Высококонцентрированная парентеральная композиция парацетамола и способ ее получения
Номер патента: 23022
Опубликовано: 29.04.2016
Авторы: Шах Пракашчандра Дж., Пател Кетан Р., Пател Милан Р.
Формула / Реферат
1. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли, предназначенная для доставки полной терапевтической дозы парацетамола 500 мг в 2-3 мл водной системы растворителей, где концентрация парацетамола или его фармацевтически приемлемой соли находится в диапазоне от 166 до 250 мг/мл, а вязкость составляет приблизительно от 7 до 28 сП при 25°C, и где система растворителей содержит гликофурол, этанол и воду, либо гликофурол, этанол, полиэтиленгликоль и воду.
2. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.1, где вязкость составляет от приблизительно 16 до приблизительно 28 сП, предпочтительно 7-22 сП.
3. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 20 до 37% об./об. и объем воды для доведения общего объема композиции до 2-3 мл.
4. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 23 до 35% об./об. и объем воды для доведения общего объема композиции до 2-3 мл.
5. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 42% об./об., этанол от 10 до 35% об./об., полиэтиленгликоль от 3 до 19% об./об. и объем воды для доведения общего объема композиции до 2-3 мл.
6. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 30 до 40% об./об., этанол от 24 до 35% об./об., полиэтиленгликоль от 3 до 6% об./об. и объем воды для доведения общего объема композиции до 2-3 мл.
7. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-6, где полиэтиленгликоль представляет собой полиэтиленгликоль 400/600.
8. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.3, где вязкость композиции находится в диапазоне от приблизительно 7 до приблизительно 16 сП.
9. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.4, где вязкость композиции находится в диапазоне от приблизительно 16 до приблизительно 28 сП.
10. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.5, где вязкость композиции находится в диапазоне от приблизительно 9 до приблизительно 14 сП.
11. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.6, где вязкость композиции находится в диапазоне от приблизительно 14 до приблизительно 28 сП.
12. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-11, где композиция дополнительно содержит антиоксиданты, хелатирующие и/или буферные средства.
13. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-12, где композиция дополнительно содержит от 2 до 6% об./об. бензилового спирта.
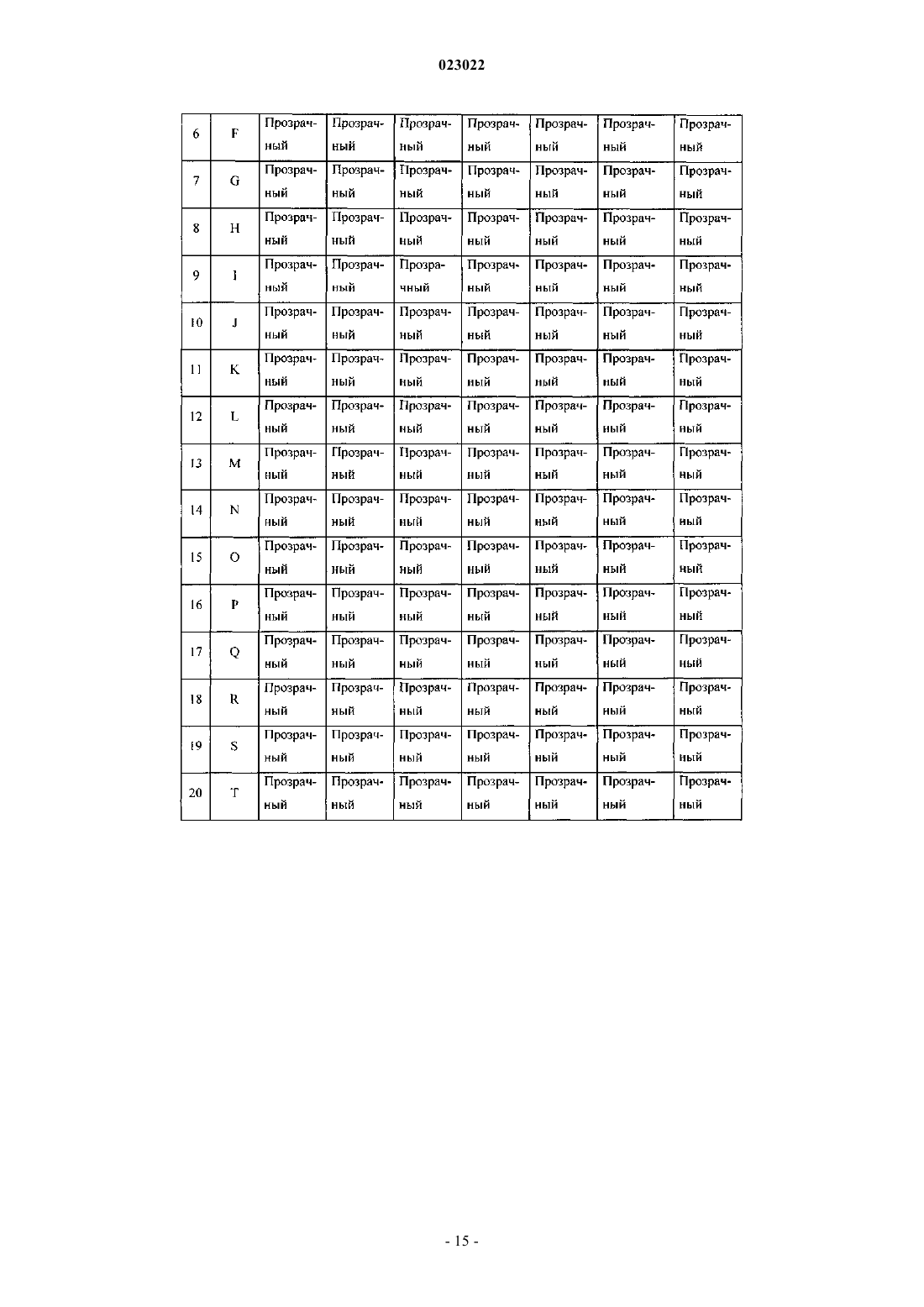
14. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-13, где композиция остается стабильной, чистой и прозрачной по меньшей мере в течение 6 ч после разведения в общепринятых внутривенных растворах, инфузионных растворах антибактериальных, противогрибковых и амебицидных лекарственных средств, и вместе с анксиолитиком - инъекционным раствором мидазолама или наркотическим анальгетиком - инъекционным раствором цитрата фентанила.
15. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-13, где композиция предназначена для введения внутримышечным способом, внутривенным способом или для внутривенного вливания.
16. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли по п.1, включающий:
a) растворение необходимого количества парацетамола или его фармацевтически приемлемой соли в системе растворителей в атмосфере инертного газа;
b) добавление антиоксиданта, хелатирующего средства, бензилового спирта;
c) доведение pH до значения от 4 до 8;
d) доведение объема раствора до заранее установленного объема;
e) фильтрование раствора через 0,22-микронный фильтрующий материал,
где стадии b и с являются необязательными, и система растворителей представляет собой гликофурол, этанол и воду либо гликофурол, этанол, полиэтиленгликоль и воду.
17. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли по п.16, где pH раствора на этапе с доводят до значения от 4 до 8 соляной кислотой, серной кислотой, уксусной кислотой, лимонной кислотой, гидроксидом натрия, гидроксидом калия, бикарбонатом натрия, бикарбонатом калия.
18. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли с концентрацией активного ингредиента в диапазоне от приблизительно 166 до приблизительно 250 мг/мл по п.16, где pH раствора на этапе с доводят до значения от 4 до 8 цитратным буфером или фосфатным буфером.
Текст
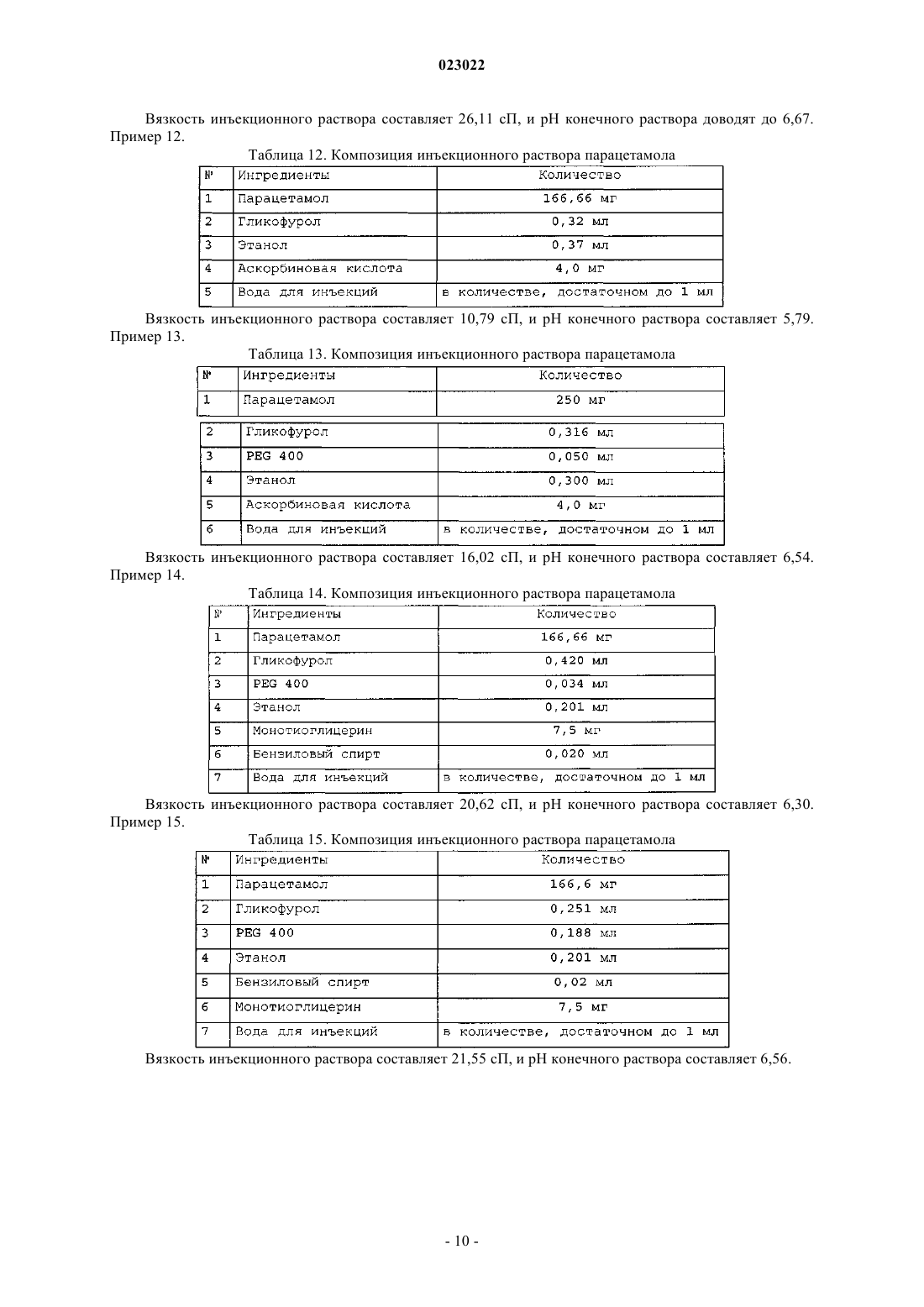
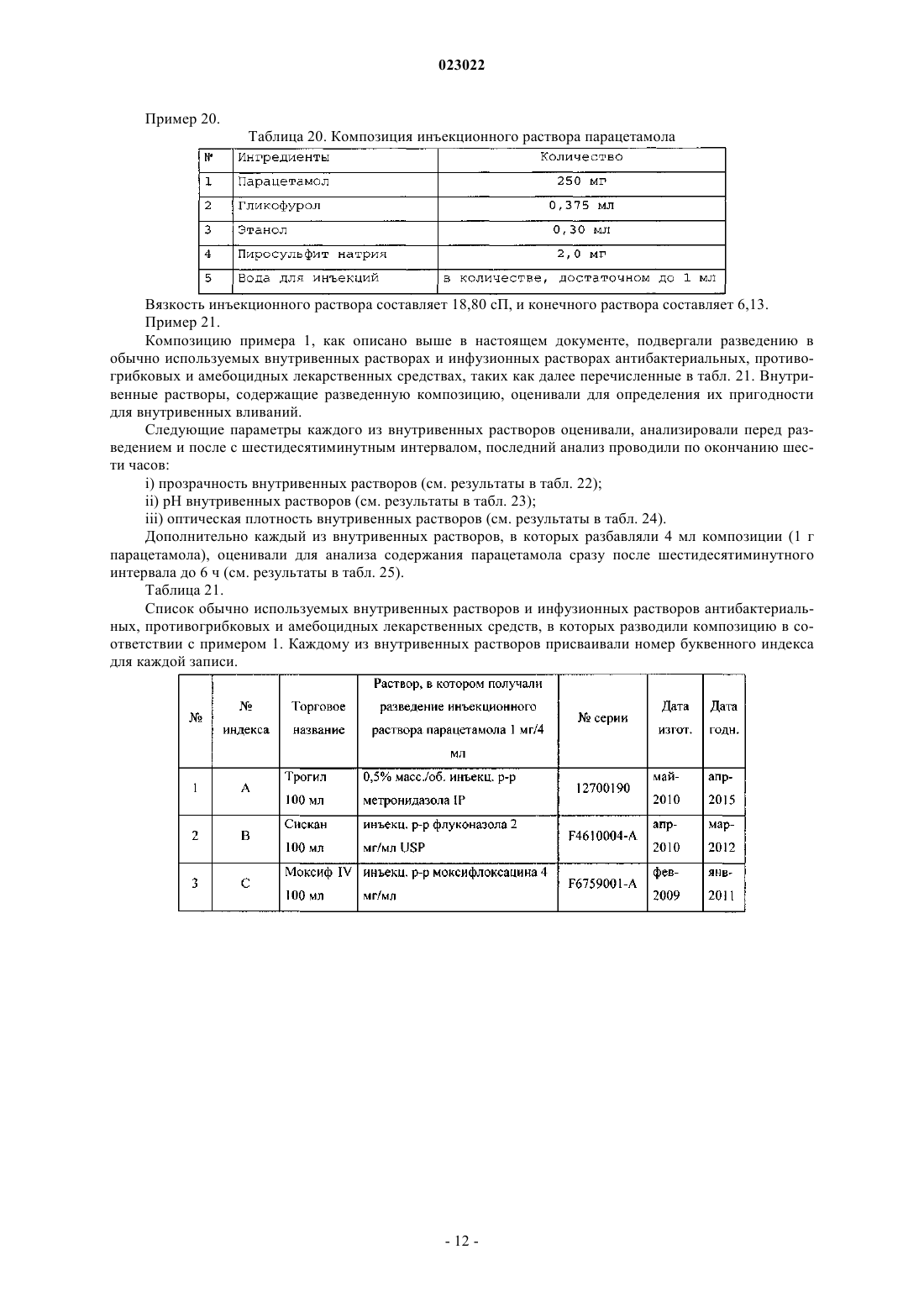
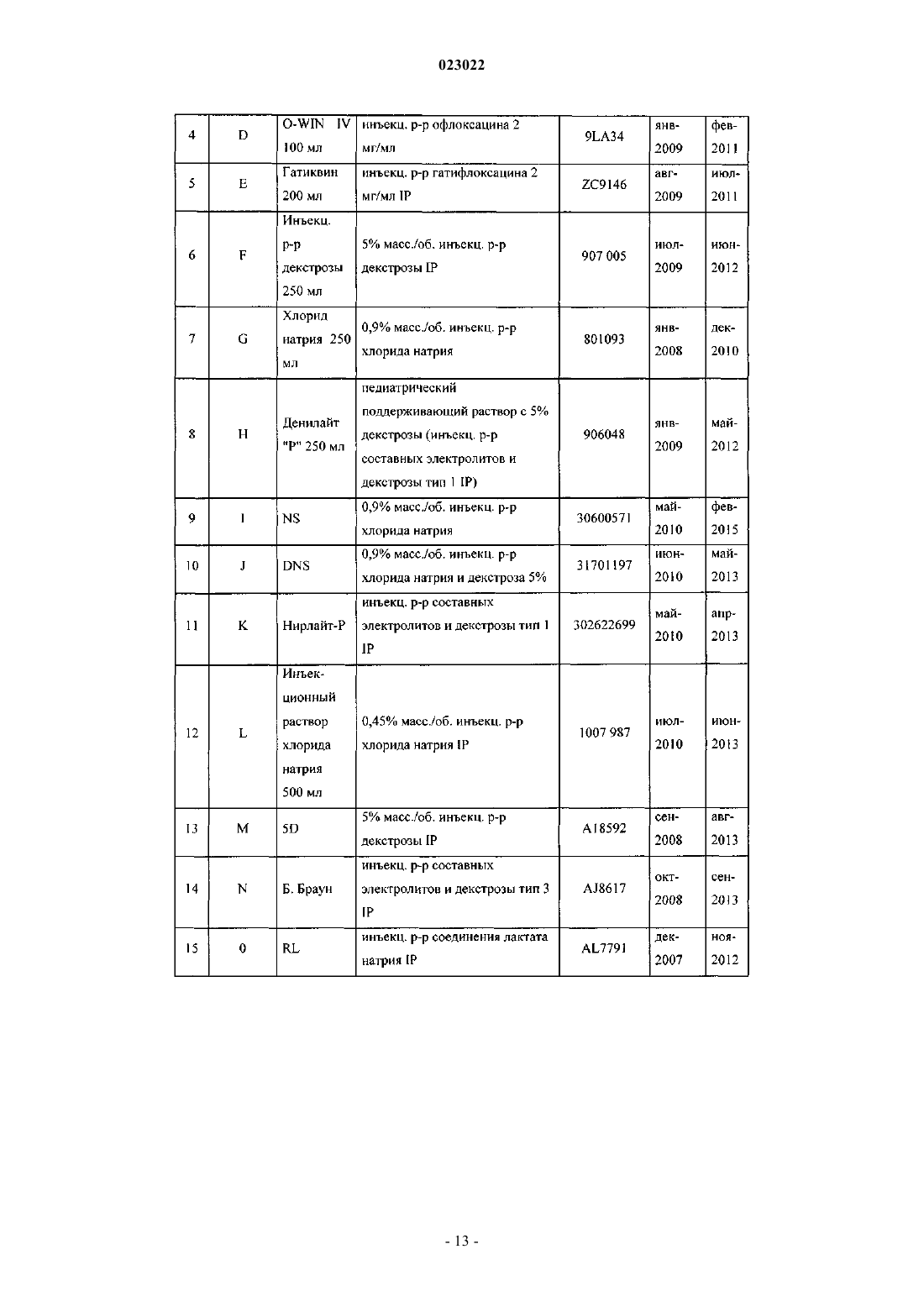
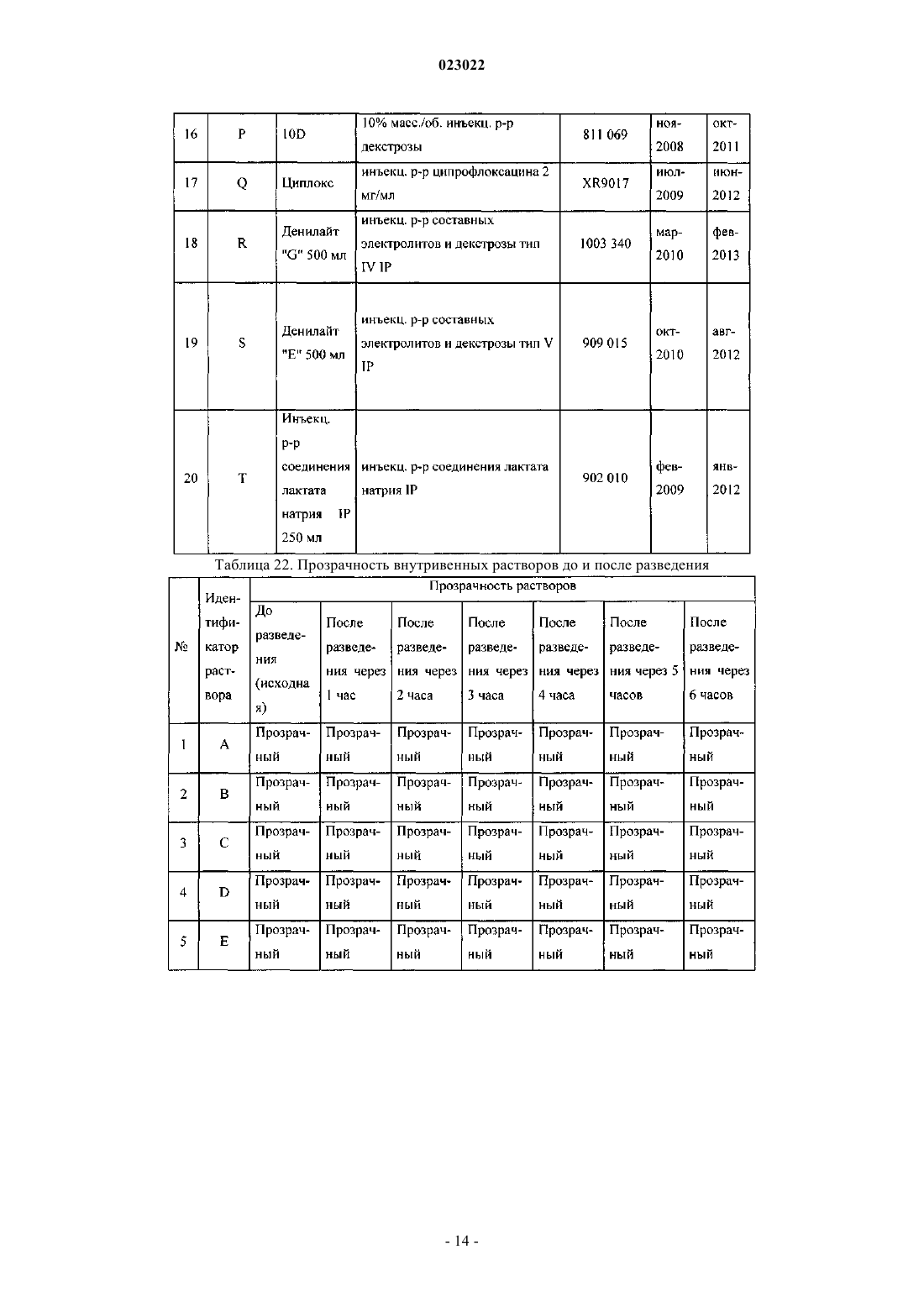
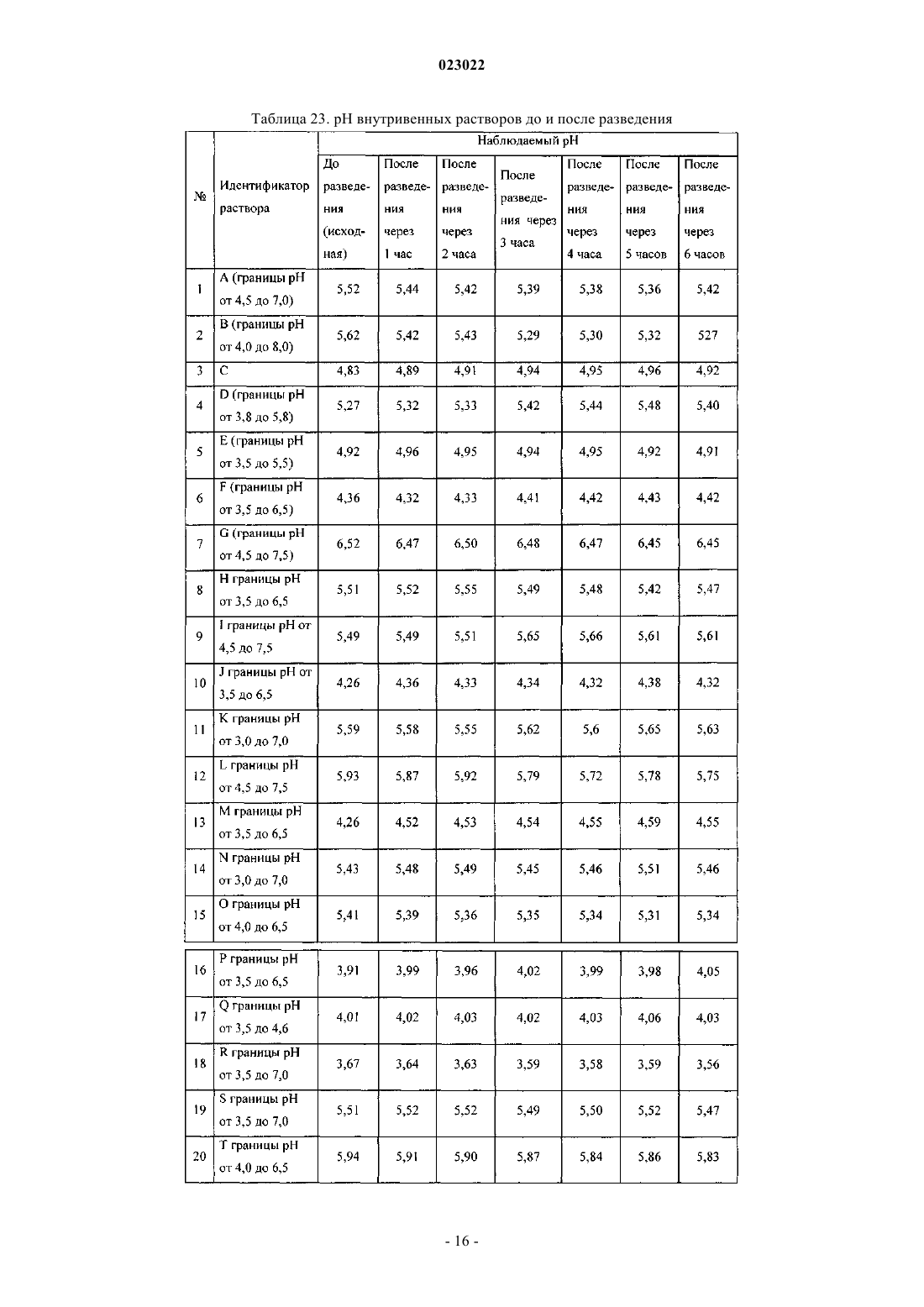
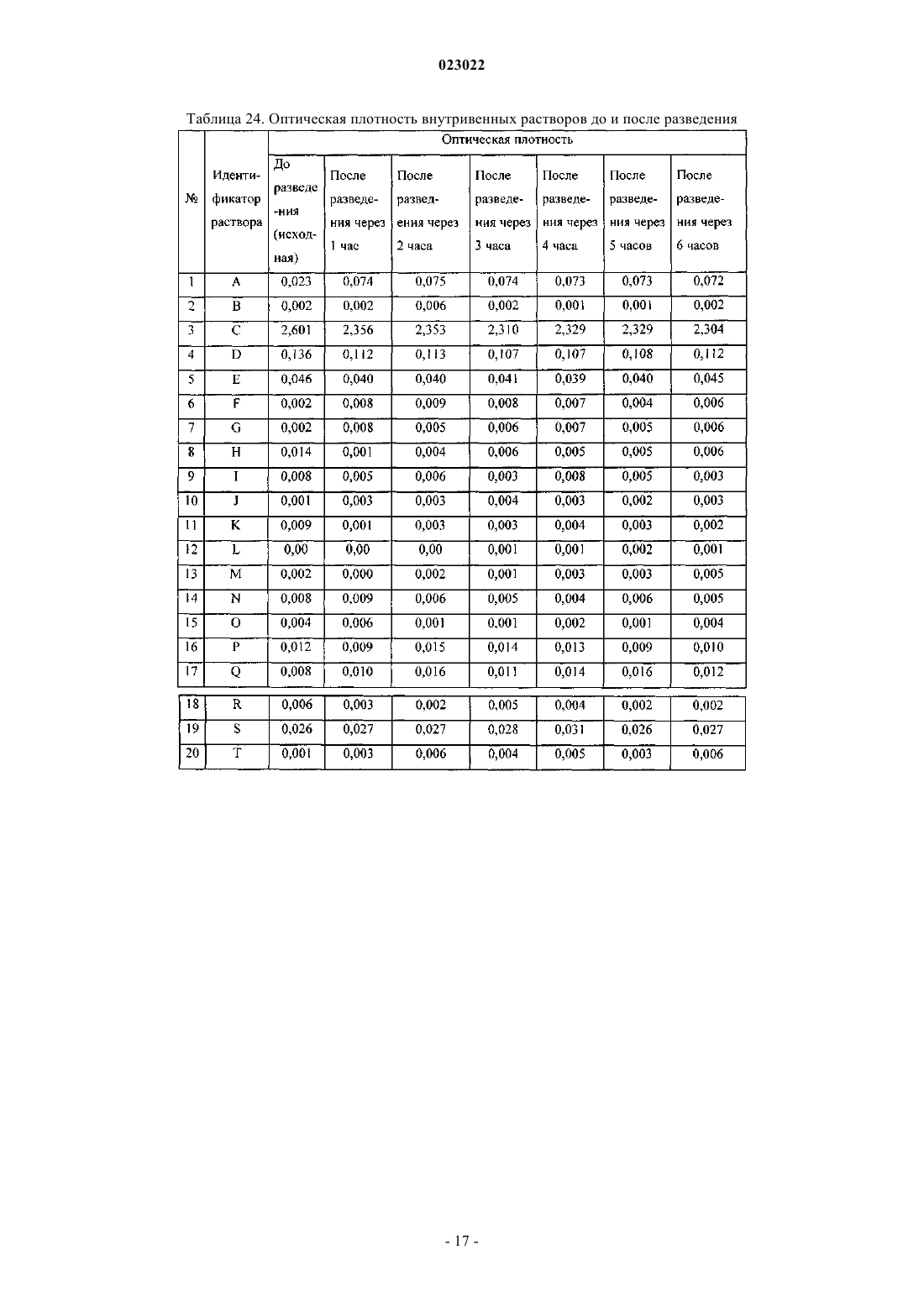
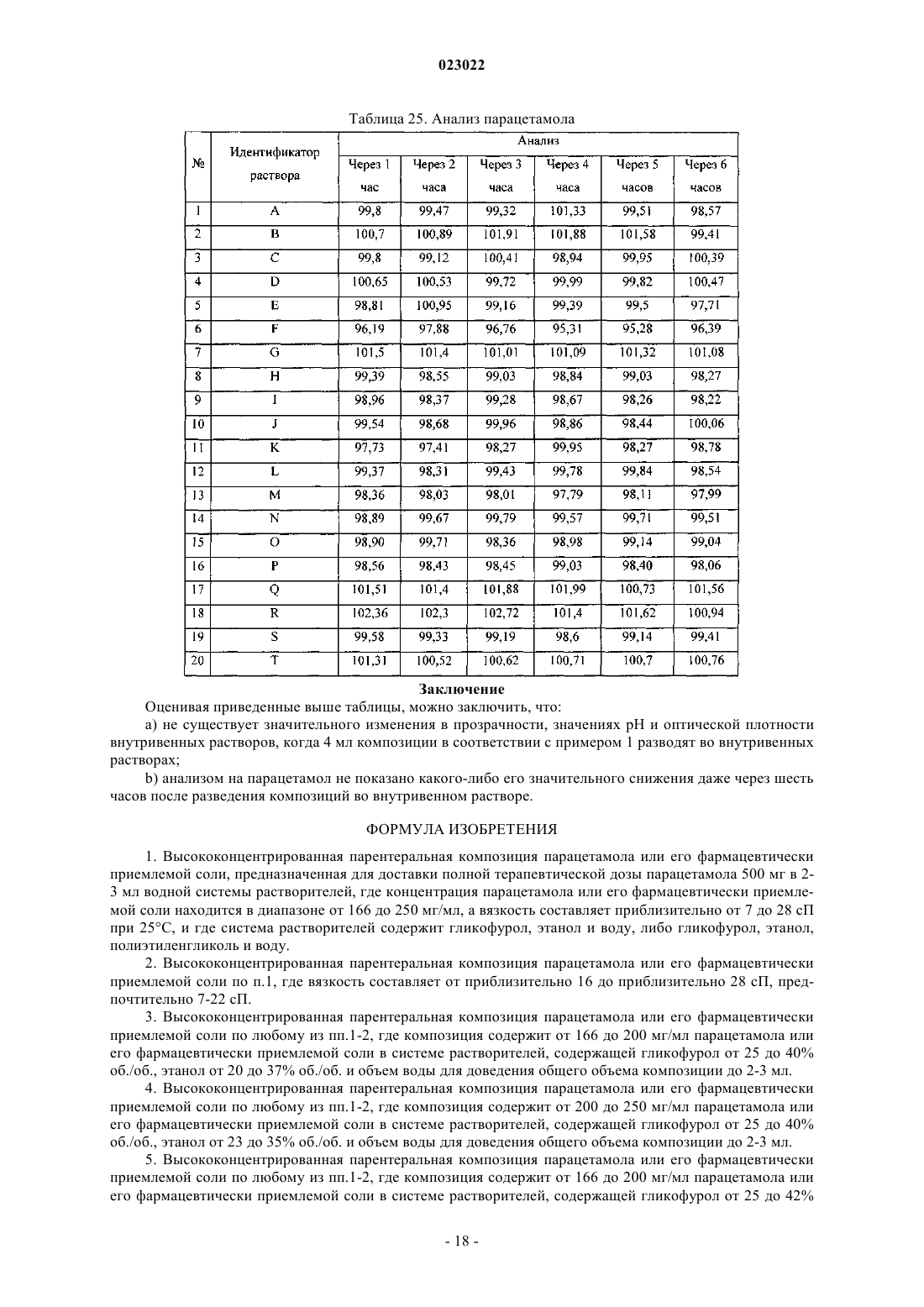
ВЫСОКОКОНЦЕНТРИРОВАННАЯ ПАРЕНТЕРАЛЬНАЯ КОМПОЗИЦИЯ ПАРАЦЕТАМОЛА И СПОСОБ Е ПОЛУЧЕНИЯ Изобретение относится к высококонцентрированной парентеральной композиции парацетамола или его фармацевтически приемлемой соли, предназначенной для доставки терапевтической дозы парацетамола 500 мг в 2-3 мл водной системы растворителей, где концентрация парацетамола или его фармацевтически приемлемой соли составляет 166-250 мг/мл, а вязкость составляет 7-28 сП при 25C, причем система растворителей содержит гликофурол, этанол и воду или гликофурол, этанол, полиэтиленгликоль и воду. Изобретение также относится к способу получения указанной композиции, включающему: а) растворение необходимого количества парацетамола или его фармацевтически приемлемой соли в системе растворителей, такой как гликофурол, этанол и вода или гликофурол, этанол, полиэтиленгликоль и вода, в атмосфере инертного газа; b) добавление антиоксиданта, хелатирующего средства, бензилового спирта; с) доведение pH до значения от 4 до 8; d) доведение объема раствора до заранее установленного объема; е) фильтрование раствора через 0,22 микронный фильтрующий материал; где стадии b и с являются необязательными. Композиции остаются стабильно чистыми и прозрачными не менее 6 ч после разведения.(71)(73) Заявитель и патентовладелец: ТРОИКАА ФАРМАСЬЮТИКАЛЗ ЛИМИТЕД (IN) Родственная заявка Изобретение, описанное в патентной заявке Индии 630/MUM/2010, поданной 9 сентября 2010 г.,является родственным изобретению, описанному в патентной заявке Индии 3023/MUM/2009, поданной 30 июня 2010 г., таким образом, что они представляют собой единственное изобретение. Область изобретения Настоящее изобретение относится к парентеральным композициям парацетамола, содержащим терапевтически эффективную дозу парацетамола, способу их получения, включая терапевтическое применение указанных композиций. Уровень техники, предшествующий изобретению Парацетамол (п-ацетиламинофенол) представляет собой общее анальгетическое и жаропонижающее лекарственное средство, которое применяют для облегчения лихорадки, головных болей и других незначительных ноющих болей и боли. Он является основным ингредиентом многочисленных медикаментов от простуды и гриппа и многих болеутоляющих средств. Лекарственное средство широко применяют как анальгетик и антипиретик и как обезболивающее при острой боли и хронической боли. Инъекции парацетамола применяют для терапии острых лихорадочных состояний, а также как анальгетик для терапии острой боли, включая послеоперационную боль. Содержащие парацетамол фармацевтические препараты для перорального введения хорошо известны. Однако хорошо известно, что концентрированные парентеральные фармацевтические композиции,содержащие в растворе парацетамол, дают несколько преимуществ относительно твердых композиций,т.к. они обеспечивают быстро начало фармакологического действия, в отличие от пероральных композиций, которые в первую очередь необходимо сначала дезинтегрировать и растворять в желудочнокишечном тракте для обеспечения всасывания. Существует два класса общепринятых парентеральных составов парацетамола, доступных на рынке. Первый состав содержит 150 мг/мл парацетамола, представленного в 2 мл раствора. Эта лекарственная форма обеспечивает 300 мг парацетамола на дозу, которая намного ниже минимальной терапевтической дозы 500 мг. Они обладают высокой вязкостью приблизительно 24,80 сП, являющейся причиной боли при внутримышечном способе введения. Кроме того, эта лекарственная форма обладает дополнительным преимуществом доставки субтерапевтических количеств. Другой парентеральный состав содержит водные растворы парацетамола в концентрации 10 мг/мл,представленные во флаконах по 50 и 100 мл, обеспечивающие 500 и 1000 мг парацетамола на флакон соответственно. Эти лекарственные формы вводят только посредством внутривенного вливания, и очевидно, что они являются неподходящими для внутримышечного способа. Такие лекарственные формы не пригодны для использования в условиях поликлинического отделения (OPD). Одновременное введение этих лекарственных форм с другими внутривенными растворами, например, в./в. вливание ципрофлоксацина, затруднено. Кроме того, при получении этих лекарственных форм необходимы дополнительная инфраструктура, обширное место для хранения и перевозка массовых грузов, увеличивающих конечную стоимость этих продуктов. Таким образом, существует неудовлетворенная потребность получения инъецируемых композиций,содержащих высокую концентрацию парацетамола, которые могут доставлять терапевтическую дозу(500 мг) в однократной дозе при внутримышечном введении, не вызывая боли у пациента. Кроме того,существует необходимость в таких высококонцентрированных лекарственных формах, которые можно адаптировать для введения с в./в. вливаниями. Заявка PCT/IN2009/000038 относится к водной стабильной фармацевтической композиции, содержащей парацетамол, для парентерального введения, где концентрация парацетамола в композиции составляет 10 мг/1 мл. Лекарственная форма является подходящей только для внутривенного вливания. В заявке PCT/IB2008/003217 описаны стабильные водные составы, содержащие 10 мг/1 мл ацетаминофена, исключительно для введения посредством внутривенного вливания, а также способы их получения. Заявка PCT/NL 2004/000819 относится к композиции в водном состоянии для введения в перфузию по меньшей мере активного компонента конкретно фармакологического, такого как парацетамол. В заявке PCT/GR 2001/000047 описаны стабильные растворы парацетамола для парентерального введения, где концентрация парацетамола составляет 150 мг/1 мл. Их необходимо вводить в многократной дозе для получения терапевтической дозировки 500 мг, и таким образом, они не являются подходящими. В заявке РСТ/ЕР 1999/005486 описана фармацевтическая композиция, характеризующуюся тем,что: а) она содержит i) парацетамол, ii) от 1 до 4 объемных частей низкомолекулярного спирта на каждую массовую часть парацетамола и iii) от 1 до 5 объемных частей полиэтиленгликоля на каждую массовую часть парацетамола; b) она является, по существу, безводной и с) ей придают форму чистого раствора для инъекций с 4-10 объемными частями воды на каждую массовую часть парацетамола. Описанные растворы являются "по существу, безводными", которые, как описано в указанной заявке, как понимают,обозначают композицию, содержащую менее 0,1 мас.% воды. Предполагается, что описанные растворы являются очень вязкими. Таким образом, эти растворы следует разводить водой для получения инъекционного раствора, где на каждую массовую часть парацетамола приходится: i) от 1 до 4 объемных частей низкомолекулярного спирта, ii) от 1 до 5 объемных частей полиэтиленгликоля и iii) от 4 до 10 объемных частей воды. В примере номер 1 указанного патент описано получение концентрированного безводного раствора, в котором титр парацетамола составляет приблизительно 210 мг на мл. В примере номер 2 описано разведение этого концентрированного безводного раствора для получения инъекционных растворов. Как вычислено, титр парацетамола в инъекционных растворах составляет приблизительно 85,60 мг на мл инъекционных растворов. Заявка PCT/IB 2008/003925 относится к стабильному водному раствору парацетамола, содержащему приблизительно 10 мг/1 мл парацетамола, для введения исключительно посредством внутривенного вливания. Заявка PCT/US 2008/083458 относится к композициям, содержащим 10 мг/мл парацетамола для введения исключительно посредством внутривенного вливания. Заявка РСТ/ЕР 2002/011498 относится к готовым к применению высокостабильным инъецируемым растворам парацетамола, полученным смешиванием парацетамола, воды, пропиленгликоля и цитратного буфера, где концентрация парацетамола составляет до 40 мг/мл для введения исключительно посредством внутривенного вливания. Заявка РСТ/ЕР 2002/002696 относится к водным парентеральным растворам парацетамола, содержащим от 1 до 17 грамм парацетамола на литр (т.е. от 1 мг на мл до 17 мг на мл) исключительно для введения посредством внутривенного вливания. Заявка РСТ/ЕР 2000/006871 относится к жидким фармацевтическим композициям, содержащим по меньшей мере 10% мас./об. парацетамола в безводном PEG 200. Вязкость 22% (мас./об.) раствора парацетамола, как описано в примере 1, составляет 168,4 сП, и, таким образом, непригодна для применения в качестве инъецируемых лекарственных средств. В патенте ЕР 2087909 описан готовый к применению инъецируемый раствор парацетамола, содержащий максимальную концентрацию парацетамила 1 мг/100 мл в дистиллированной воде и буферном средстве, исключительно для введения как внутривенное вливание. В патенте ЕР 0916347 описан инъекционный раствор парацетамола и комбинации парацетамола с другими веществами, такими как гиосцин-н-бутилбромид и фосфат кодеина. Патентная заявка Индии номер 1746/MUM/2008 относится к фармацевтическому составу парацетамола, который обеспечивает легкое введение пациентам. В указанной выше заявке описан инъекционный раствор парацетамола, содержащий максимальную концентрацию парацетамола 15% мас./об., с применением комбинаций гликофурола и воды. Однако эти растворы не доставляют необходимую терапевтическую дозу 500 мг в от 2 до 3 мл. Патентная заявка Индии номер 1532/DEL/2008 относится к введению парацетамола внутривенным способом, в котором парацетамол растворен в воде для инъекции в комбинации с неактивными ингредиентами, такими как буферы, средства придания изотоничности и т.д. Однако они также не обеспечивают необходимой терапевтической дозы 500 мг в от 2 до 3 мл. Патентная заявка Индии 1529/DEL/2008 относится к композициям парацетамола и офлоксацина для введения внутривенным способом с применением водного носителя. В патентной заявке Индии 1530/DEL/2008 описаны композиции парацетамола и ципрофлоксацина в водном носителе для введения внутривенным способом. В патентной заявке Индии 1531/DEL/2008 описана композиция парацетамола и диклофенака натрия в водном носителе для внутривенного введения. Патентная заявка Индии 2708/DEL/2006 включает водный раствор терапевтически активных веществ, предпочтительно парацетамола в комплексе с гидроксипропил-бета-циклодекстрином (HP-B-CD),инкапсулированного в физиологически и фармацевтически приемлемое масло, содержащее общепринятое липофильное поверхностно-активное вещество, которое в свою очередь диспергируют в водной среде, содержащий известное гидрофильное поверхностно-активное вещество. Патентная заявка Индии 3782/DELNP/2005 относится к новому инъецируемому составу парацетамола, содержащему водный растворитель, буферное средство с рКа между 4,5 и 6,5, средство придания изотоничности и димер парацетамола, где указанный димер применяют для стабилизации состава. Патентная заявка Индии 8070/DELNP/2008 относится к водному раствору парацетамола для применения посредством перфузии, содержащему по меньшей мере одно вещество, которое может реагировать с фенолятами. Парацетамол умеренно растворим в воде, таким образом, различные растворители, такие как пропиленгликоль, полиэтиленгликоль 400, глицерилформаль, гликофурол и этанол и т.д., применяют на известном уровне техники, так как для парацетамола показана более высокая растворимость в этих растворителях по сравнению с водой. Однако не существует известного уровня техники, для которого описаны инъецируемые лекарственные средства парацетамола с 500 мг парацетамола в однократной дозе приблизительно 2 или 3 мл. В единственном известном документе уровня техники, а именно в патенте IN1746/MUM/2008, описано применение 44% об./об. гликофурола в комбинации с 10% об./об. спирта (название спирта не описано) в комбинации с водой для растворения максимального количества 150 мг/мл парацетамола. В том же известном документе уровня техники описано применение 48% об./об. гликофурола в комбинации с водой для растворения максимального количества 150 мг/мл парацетамола. Проблема, стоящая перед фармацевтической промышленностью, представляет собой получение инъекционных растворов, содержащих более 150 мг/мл приблизительно до 250 мг/мл парацетамола, чтобы терапевтическую дозу 500 мг можно доставлять как инъекцию от 2 до 3 мл раствора. Кроме того, несмотря на такие высокие концентрации инъекционные растворы должны обладать вязкостью не более 28 сП. До настоящего времени это не получено. Сущность изобретения Основной целью настоящего изобретения является обеспечение высококонцентрированной парентеральной композиции парацетамола или его фармацевтически приемлемой соли, предназначенной для доставки полной терапевтической дозы парацетамола 500 мг в 2-3 мл водной системы растворителей, где концентрация парацетамола или его фармацевтически приемлемой соли находится в диапазоне от 166 мг/мл до 250 мг/мл, а вязкость составляет 7-28 сП при 25 C, и где система растворителей содержит гликофурол, этанол и воду, либо гликофурол, этанол, полиэтиленгликоль и воду. В одном из предпочтительных вариантов вязкость композиции составляет 16-28 сП, предпочтительно 7-22 сП. В другом предпочтительном варианте высококонцентрированная парентеральная композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 20 до 37% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. Предпочтительно вязкость такой композиции находится в диапазоне от приблизительно 7 до приблизительно 16 сП. Еще в одном из вариантов высококонцентрированная парентеральная композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 23 до 35% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. Предпочтительно вязкость такой композиции находится в диапазоне от 16 до 28 сП. Еще в одном варианте высококонцентрированная парентеральная композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 42% об./об., этанол от 10 до 35% об. /об., полиэтиленгликоль от 3 до 19% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. Предпочтительно вязкость такой композиции находится в диапазоне от 9 до 14 сП. В другом варианте высококонцентрированная парентеральная композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 30 до 40% об./об., этанол от 24 до 35% об./об., полиэтиленгликоль от 3 до 6% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. Предпочтительно вязкость такой композиции находится в диапазоне от приблизительно 14 до приблизительно 28 сП. Предпочтительно полиэтиленгликоль, входящий в состав указанных композиций, представляет собой полиэтиленгликоль 400/600. В другом предпочтительном варианте высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемая соль дополнительно содержит антиоксиданты, хелатирующие или/и буферные средства. Предпочтительно высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли дополнительно содержит от 2 до 6% об./об. бензилового спирта. Предпочтительно высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли остается стабильной, чистой и прозрачной по меньшей мере в течение 6 ч после разведения в общепринятых внутривенных растворах, инфузионных растворах антибактериальных, противогрибковых и амебицидных лекарственных средств, и вместе с анксиолитиком - инъекционным раствором мидазолама или наркотическим анальгетиком - инъекционным раствором цитрата фентанила. В предпочтительном варианте высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли предназначена для введения внутримышечным способом,внутривенным способом или как внутривенное вливание. Кроме того изобретение обеспечивает способ получения парентеральных композиций парацетамола или его фармацевтически приемлемых солей, включающий:a) растворение необходимых количеств парацетамола или его фармацевтически приемлемой соли в системе растворителей в атмосфере инертного газа;c) доведение рН от 4 до 8;d) доведение объема раствора до заданного объема;e) фильтрование раствора через 0,22 микронный фильтрующий материал, где стадии b и с являются необязательными, и система растворителей представляет собой гликофурол, этанол и воду, либо гликофурол, этанол, полиэтиленгликоль и воду. В одном из вариантов, в способе получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли рН раствора на этапе "с" доводят до значения от 4 до 8 соляной кислотой, серной кислотой, уксусной кислотой, лимонной кислотой, гидроксидом натрия, гидроксидом калия, бикарбонатом натрия, бикарбонатом калия. В другом варианте в способе получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли с концентрацией активного ингредиента в диапазоне приблизительно от 166 до 250 мг/мл по п.16, рН раствора на этапе "с" доводят до значения от 4 до 8 цитратным буфером или фосфатным буфером. Подробное описание изобретения Настоящее изобретение относится к высококонцентрированным парентеральным композициям парацетамола или его фармацевтически приемлемой соли, содержащих полную терапевтическую дозу парацетамола в небольшом объеме инъекционных растворов, которые можно вводить внутримышечным и внутривенным способами. Растворимость парацетамола в различных растворителях, таких как гликофурол, PEG, этанол и пропиленгликоль, определяли авторы изобретения. Растворимость парацетамола в гликофуроле, PEG 400, этаноле, пропиленгликоле и воде составляет приблизительно 205, 190, 160, 113 и 14 мг/мл соответственно. Кроме того, вязкость раствора парацетамола в гликофуроле при концентрации 205 мг/мл составляет приблизительно 57 сП, что является неприемлемым для применений в качестве инъецируемых лекарственных средств. Как указано в более ранних разделах, известный уровень техники не обеспечивает инъецируемые лекарственные средства с высокими концентрациями парацетамола (500 мг в 2 или 3 мл растворов) в любой системе растворителей. Проблема заключается в получении целесообразной системы растворителей для получения инъецируемых лекарственных средств, содержащих парацетамол от 166 до 250 мг/мл, чтобы терапевтическую дозу парацетамола (500 мг) можно доставлять в от 2 до 3 мл без ущерба для вязкости этих инъецируемых лекарственных средств. К удивлению авторы обнаружили, что по существу высококонцентрированные растворы парацетамола можно получать без значительного увеличения вязкости посредством целесообразной комбинации растворителей для получения систем растворителей гликофурола, этанола и воды или систем растворителей гликофурола, этанола, полиэтиленгликоля и воды. Высокая концентрация парацетамола, полученная в таких композициях, значительно выше тех, что получены на известном уровне техники или в коммерчески доступных инъецируемых лекарственных средствах с парацетамолом. Концентрация парацетамола, полученная в композиции по настоящему изобретению, находится в диапазоне приблизительно 166-250 мг/мл, таким образом, обеспечивая полную терапевтическую дозу парацетамола в качестве инъецируемого лекарственного средства, содержащего 500 мг в 2, 3 мл и 1 мг в 4 или 6 мл соответственно. Композиции по настоящему изобретению можно вводить внутримышечным способом, внутривенным способом или как внутривенное вливание после разведения в одном из обычно используемых внутривенных растворов (5% мас./об. инъекционный раствор декстрозы, 0,9% мас./об. инъекционный раствор хлорида натрия, педиатрический поддерживающий раствор с 5% мас./об. декстрозы, 0,9% мас./об. инъекционный раствор хлорида натрия и 5% мас./об. декстрозы, 0,45% мас./об. инъекционный раствор хлорида натрия, инъекц. р-р составных электролитов и декстрозы тип 3, инъекционный раствор соединения натрия лактата, 10% мас./об. инъекционный раствор декстрозы, инъекционный раствор составных электролитов и декстрозы тип IV, инъекционный раствор составных электролитов и декстрозы тип V, лактат Рингера и т.д.), а также после разведения в инфузионных растворах антибактериальных, противогрибковых и амебоцидных лекарственных средств, таких как ципрофлоксацин, офлоксацин, левофлоксацин,пазуфлоксацин, гатифлоксацин, моксифлоксацин, метронидазол, флуконазол, линезолид и т.д. Композиции по настоящему изобретению можно также совместно вводить как внутривенное вливание после разведения необходимой дозы в обычно используемых внутривенных растворах вместе с анксиолитиками (например, инъекционный раствор мидазолама) или наркотическим анальгетиком (например, инъекционный раствор цитрата фентанила). Композиции по настоящему изобретению можно представлять в ампулах/флаконах, содержащих приблизительно от 2 приблизительно до 3 мл инъекционных растворов, или в многодозовых флаконах,содержащих инъекционные растворы, которые обеспечивают многократные дозы парацетамола для доставки 500 мг парацетамола. Подходящий консервант необязательно включен в композиции. Композиции по настоящему изобретению приспособлены к тому, чтобы их доставляли в ампулах/флаконах однократной дозы, содержащих от 500 до 2 мг парацетамола для внутривенного применения. В соответствии с внутривенным введением 4 или 8 мл инъекционного раствора, содержащего 250 мг/мл парацетамола, обеспечивают дозу 1 г или дозу 2 г парацетамола соответственно. Таким же образом, 6 или 12 мл инъекционного раствора, содержащего приблизительно 166 мг/мл парацетамола, описы-4 023022 ваемого в настоящем документе, обеспечивают дозу 1 или 2 г парацетамола соответственно. Кроме того, количество парацетамола, обеспечиваемое инъекционными растворами приблизительно 166 мг/мл, составляет приблизительно 1 мг/6 мл, приблизительно 1,5 мг/9 мл, приблизительно 2 мг/12 мл. Подобное количество парацетамола, обеспечиваемое инъекционными растворами 250 мг/мл, составляет приблизительно 1 мг/4 мл, приблизительно 1,5 мг/6 мл, приблизительно 2 мг/8 мл. Выбранные фармацевтические композиции, описываемые в настоящем документе, можно вводить внутримышечно в ягодичную, дельтовидную мышцы или во внутреннюю мышцу бедра посредством игл 22 или 23 калибра. В одном из вариантов осуществления парентеральные композиции по настоящему изобретению содержат парацетамол или его фармацевтически приемлемые соли в концентрации в диапазоне приблизительно от 166 до 250 мг/мл, растворенные в гликофуроле, этаноле и воде. В другом варианте осуществления парентеральные композиции по настоящему изобретению содержат парацетамол или его фармацевтически приемлемые соли в концентрации в диапазоне приблизительно от 166 до 250 мг/мл, растворенные в гликофуроле, этаноле, полиэтиленгликоле и воде. Полиэтиленгликоль выбран из полиэтиленгликоля 400/600. В соответствии с другим вариантом осуществления настоящего изобретения подходящий антиоксидант или его смеси необязательно включены в композицию. Подходящие антиоксиданты выбраны из монотиоглицерина, аскорбиновой кислоты, аскорбата натрия, эриторбовой кислоты, метабисульфита калий, натрия метабисульфита, пропионовой кислоты, формальдегида сульфоксилата натрия, восстановленного глутатиона, тиомочевины, цистеина, Nацетилцистеина, метионина, сульфита натрия, цитрата натрия и т.д. В еще одном варианте осуществления настоящего изобретения хелатирующее средство или его смесь необязательно включено в композицию. Под подходящим хелатирующим средством в настоящем документе понимают триэдетат натрия,диэдетат натрия, эдетат натрия, эдетат динатрия кальция, фумаровую кислоту, яблочную кислоту и т.д. Инъецируемые растворы по настоящему изобретению обеспечивают стабильность парацетамола в течение всего срока хранения. Кроме того, инъецируемые лекарственные средства, полученные по настоящему изобретению,представляют собой чистые прозрачные растворы, и после разведения с одним из обычно используемых внутривенных растворов растворы остаются чистыми и прозрачными по меньшей мере в течение до шести часов после разведения, что делает их безопасными для в/в введения. Кроме того, композиции по настоящему изобретению являются совместимыми с инфузионными растворами антибактериальных, противогрибковых и амебоцидных лекарственных средств, таких как ципрофлоксацин, офлоксацин, левофлоксацин, пазуфлоксацин, гатифлоксацин, моксифлоксацин, метронидазол, флуконазол, линезолид и т.д., и такие инфузионные растворы остаются стабильно чистыми и прозрачными по меньшей мере в течение до шести часов после разведения. Кроме того, из композиций по настоящему изобретению получают чистые прозрачные растворы,при разведении в обычно используемых внутривенных растворах с анксиолитиками (инъекционный раствор мидазолама) или наркотическими анальгетиками (инъекционный раствор цитрата фентанила), и они остаются стабильно чистыми и прозрачными по меньшей мере в течение до шести часов после разведения. Как указано в разделе уровень техники, коммерчески доступные инъекционные растворы парацетамола 150 мг/мл демонстрируют вязкость приблизительно 25 сП при 25C. На единственном известном уровне техники получен раствор парацетамола в диапазоне от 60 мг/мл (6% мас./об.) до 150 мг/мл (15% мас./об.) в гликофуроле:этаноле:воде (приблизительно 44:10:46 или приблизительно 4:1:4) и гликофуроле:воде (48:52 или приблизительно 1:1). Вязкость описываемых на известном уровне техники примеров не указана в описании патента, и таким образом подобные растворы получены авторами изобретения в их лаборатории, и вязкость для примеров 1 и 2 составляла 13,5 и 14,8 сП соответственно. Следует отметить, что концентрации описанных растворы в указанном известном уровне техники составляют от 60 до 150 мг/мл. К удивлению, вязкость композиций по настоящему изобретению, в которых концентрация парацетамола составляет приблизительно от 166 до 250 мг на мл, т.е. приблизительно от 16,6 до 25% мас./об.(что значительно выше, чем любое описанное на известном уровне техники инъецируемое лекарственное средство и коммерчески доступный продукт), находится в диапазоне приблизительно от 7 до 28 сП при 25C. Дополнительно можно отметить, что целесообразно выбранная система растворителей в настоящем изобретении обеспечивает существенное снижение вязкости, несмотря на значительно более высокую концентрацию парацетамола в композиции по настоящему изобретению, по сравнению с вязкостями растворов с низкой концентрацией, описанных в известном уровне техники. В предпочтительном варианте осуществления композиции по настоящему изобретению с концентрацией парацетамола приблизительно 250 мг/мл обеспечивают введение полной терапевтической дозы парацетамола 500 мг в 2 мл инъекционного раствора более низкой вязкости (приблизительно 16 сП) по сравнению с вязкостью коммерчески доступных инъекционных растворов парацетамола 150 мг/мл, а также композиций, описанных на известном уровне техники. В другом предпочтительном варианте осуществления композиции по настоящему изобретению с концентрацией парацетамола приблизительно 166,66 мг/мл обеспечивают введение полной терапевтической дозы парацетамола 500 мг в 3 мл инъекционных растворов значительно более низкой вязкости (7,45 сП) по сравнению с коммерчески доступными инъекционными растворами парацетамола 150 мг/мл, а также композиций, описанных в известном уровне техники.pH композиций находится в диапазоне приблизительно от pH 4 приблизительно до pH 8, предпочтительно от pH 5 до pH 7 и более предпочтительно от pH 5,5 до pH 7. pH композиции по изобретению необязательно доводят до указанных выше значений подходящей кислотой/щелочью. Необязательно доводят pH, добавляя буферные средства, для получения pH от pH 4 до pH 8, предпочтительно от pH 5 доpH 7 и более предпочтительно от pH 5,5 до pH 7. Кислота/щелочь выбрана из соляной кислоты, серной кислоты, уксусной кислоты, лимонной кислоты, гидроксида натрия, гидроксида калия, бикарбоната натрия, бикарбоната калия и т.д. Подходящий для композиций буфер содержит цитратный буфер, фосфатный буфер и т.п. В одном из вариантов осуществления композиция по настоящему изобретению содержит приблизительно от 166 до 200 мг на мл в системе растворителей, содержащей гликофурол от 25 до 40% об./об.,этанол от 20 до 37% об./об. и воду (достаточное количество). В другом варианте осуществления композиция по настоящему изобретению содержит приблизительно от 200 до 250 мг на мл в системе растворителей, содержащей гликофурол от 25 до 40% об./об.,этанол от 23 до 35% об./об. и воду (достаточное количество). В еще одном варианте осуществления композиция по настоящему изобретению содержит приблизительно от 166 до 200 мг на мл в системе растворителей, содержащей гликофурол от 25 до 42% об./об.,этанол от 10 до 35% об./об., полиэтиленгликоль от 3 до 19% об./об. и воду (достаточное количество). В еще одном варианте осуществления композиция по настоящему изобретению содержит приблизительно от 200 до 250 мг на мл в системе растворителей, содержащей гликофурол от 30 до 40% об./об.,этанол от 24 до 35% об./об., полиэтиленгликоль от 3 до 6% об./об. и воду (достаточное количество). Необязательно от 2 до 6% об./об. бензилового спирта включено в композиции. Необязательно антиоксиданты и хелатирующие средства включены в композиции. Необязательно можно включать в композиции буфер, кислоту/щелочь. Система растворителей, содержащая гликофурол, этанол и воду, для композиции, содержащей приблизительно от 166 мг/мл до 250 мг/мл, содержит гликофурол:этанол:воду приблизительно от 2,8:2,0:5,1(пример 7) приблизительно до 1:1:1 (пример 12 и 19). Это находится в резком контрасте с описанным в патенте IN1746/MUM/2008 соотношением гликофурола и этанола 10:1 или системой растворителей, содержащей только гликофурол и воду. Вязкость композиций по настоящему изобретению с концентрацией парацетамола в диапазоне приблизительно от 166 до 200 мг/мл, полученных с применением системы растворителей, содержащей гликофурол, этанол и воду, находится в диапазоне приблизительно от 7 приблизительно до 16 сП. Вязкость композиций по настоящему изобретению с концентрацией парацетамола в диапазоне приблизительно от 200 до 250 мг/мл, полученных с применением системы растворителей, содержащей гликофурол, этанол и воду, находится в диапазоне приблизительно от 16 приблизительно до 28 сП. Вязкость композиций по настоящему изобретению с концентрацией парацетамола в диапазоне приблизительно от 166 до 200 мг/мл, полученных с применением системы растворителей, содержащей гликофурол, этанол, пропиленгликоль и воду, находится в диапазоне приблизительно от 9 приблизительно до 14 сП. Вязкость композиций по настоящему изобретению с концентрацией парацетамола в диапазоне приблизительно от 200 до 250 мг/мл, полученных с применением системы растворителей, содержащей гликофурол, этанол, пропиленгликоль и воду, находится в диапазоне приблизительно от 14 приблизительно до 28 сП. Способ получения парентеральных композиций парацетамола или его фармацевтически приемлемой соли с активной концентрацией в диапазоне приблизительно от 166 до 250 мг/мл включает:a) растворение необходимых количеств парацетамола или его фармацевтически приемлемой соли в системе растворителей в атмосфере инертного газа;d) доведение объема раствора до заданного объема;e) фильтрование раствора через 0,22 микронный фильтрующий материал;g) необязательно автоклавирование ампул/флаконов. Гликофурол добавляют к необходимому количеству этанола и части воды для инъекций, перемешивая при продувке инертным газом. Необходимое количество бензилового спирта и/или полиэтиленгликоля 400/600 необязательно добавляют к указанному выше раствору с последующим добавлением необходимого количества парацетамола до его полного растворения. Необходимое количество антиокси-6 023022 данта добавляют к указанному выше раствору. Дополнительно добавляют необходимое количество подходящего хелатирующего средства и буфера и добавляют воду для инъекций для получения необходимого объема. Если pH раствора не находится в желаемом диапазоне, добавляют подходящую кислоту/щелочь для доведения pH от 4 до 8. Подходящий буфер необязательно применяют для поддержанияpH 4 и 8 раствора. Раствор фильтруют через 0,2 микронный фильтр и наливают в однократной дозы/многодозовые контейнеры подходящих объемов при продувке инертным газом. Необязательно инъекционный раствор стерилизуют посредством автоклавирования и затем заполняют однократной дозы/многодозовые контейнеры подходящих объемов. В одном из вариантов осуществления антиоксидант при применении можно добавлять в начале способа в раствор гликофурола, этанола и части инъекционного раствора. В другом варианте осуществления систему растворителей гликофурола, этанола, полиэтиленгликоля и части воды для инъекций получают при непрерывном помешивании при продувке инертным газом и полиэтиленгликоль не добавляют на любой другой стадии способа. В еще одном варианте осуществления получают систему растворителей гликофурола, этанола, полиэтиленгликоля и части воды для инъекций, где антиоксидант растворяют в части воды для инъекций. Дополнительная последовательность ингредиентов не ограничивает описанные выше варианты осуществления, и специалист в данной области может получать различную комбинацию описываемых в настоящем документе композиций. Следующие неограничивающие примеры подробно иллюстрируют изобретение. Однако они не предназначены для ограничения объема настоящего изобретения тем или иным способом. Примеры Композиции по настоящему изобретению получают в соответствии со способом, приведенном выше и, таким образом, не воспроизведенным во избежание повторения. Пример 1. Таблица 1. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 18,59 сП, и pH конечного раствора доводят до 6,5. Пример 2. Таблица 2. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 23,42 сП, и pH конечного раствора доводят до 6,25. Пример 3. Таблица 3. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 14,44 сП, и pH конечного раствора доводят до 6,20. Пример 4. Таблица 4. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 18,76 сП, и pH конечного раствора доводят до 6,29. Пример 5. Таблица 5. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 9,02 сП, и pH конечного раствора доводят до 5,82. Пример 6. Таблица 6. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 10,03 сП, и pH конечного раствора доводят до 6,31. Пример 7. Таблица 7. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 7,45 сП, и pH конечного раствора доводят до 5,25. Пример 8. Таблица 8. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 12,55 сП, и pH конечного раствора доводят до 6,20. Пример 9. Таблица 9. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 13,40 сП, и pH конечного раствора составляет 5,20. Пример 10. Таблица 10. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 13,90 сП, и pH конечного раствора составляет 5,40. Пример 11. Таблица 11. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 26,11 сП, и pH конечного раствора доводят до 6,67. Пример 12. Таблица 12. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 10,79 сП, и pH конечного раствора составляет 5,79. Пример 13. Таблица 13. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 16,02 сП, и pH конечного раствора составляет 6,54. Пример 14. Таблица 14. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 20,62 сП, и pH конечного раствора составляет 6,30. Пример 15. Таблица 15. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 21,55 сП, и pH конечного раствора составляет 6,56. Пример 16. Таблица 16. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 14,34 сП, и pH конечного раствора составляет 5,84. Пример 17. Таблица 17. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 19,12 сП, и pH конечного раствора составляет 6,86. Пример 18. Таблица 18. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 20,92 сП, и pH конечного раствора составляет 6,79. Пример 19. Таблица 19. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 18,70 сП, и pH конечного раствора составляет 5,07. Пример 20. Таблица 20. Композиция инъекционного раствора парацетамола Вязкость инъекционного раствора составляет 18,80 сП, и конечного раствора составляет 6,13. Пример 21. Композицию примера 1, как описано выше в настоящем документе, подвергали разведению в обычно используемых внутривенных растворах и инфузионных растворах антибактериальных, противогрибковых и амебоцидных лекарственных средствах, таких как далее перечисленные в табл. 21. Внутривенные растворы, содержащие разведенную композицию, оценивали для определения их пригодности для внутривенных вливаний. Следующие параметры каждого из внутривенных растворов оценивали, анализировали перед разведением и после с шестидесятиминутным интервалом, последний анализ проводили по окончанию шести часов:i) прозрачность внутривенных растворов (см. результаты в табл. 22);iii) оптическая плотность внутривенных растворов (см. результаты в табл. 24). Дополнительно каждый из внутривенных растворов, в которых разбавляли 4 мл композиции (1 г парацетамола), оценивали для анализа содержания парацетамола сразу после шестидесятиминутного интервала до 6 ч (см. результаты в табл. 25). Таблица 21. Список обычно используемых внутривенных растворов и инфузионных растворов антибактериальных, противогрибковых и амебоцидных лекарственных средств, в которых разводили композицию в соответствии с примером 1. Каждому из внутривенных растворов присваивали номер буквенного индекса для каждой записи. Таблица 22. Прозрачность внутривенных растворов до и после разведения Таблица 23. pH внутривенных растворов до и после разведения Таблица 24. Оптическая плотность внутривенных растворов до и после разведения Заключение Оценивая приведенные выше таблицы, можно заключить, что:a) не существует значительного изменения в прозрачности, значениях pH и оптической плотности внутривенных растворов, когда 4 мл композиции в соответствии с примером 1 разводят во внутривенных растворах;b) анализом на парацетамол не показано какого-либо его значительного снижения даже через шесть часов после разведения композиций во внутривенном растворе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли, предназначенная для доставки полной терапевтической дозы парацетамола 500 мг в 23 мл водной системы растворителей, где концентрация парацетамола или его фармацевтически приемлемой соли находится в диапазоне от 166 до 250 мг/мл, а вязкость составляет приблизительно от 7 до 28 сП при 25C, и где система растворителей содержит гликофурол, этанол и воду, либо гликофурол, этанол,полиэтиленгликоль и воду. 2. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.1, где вязкость составляет от приблизительно 16 до приблизительно 28 сП, предпочтительно 7-22 сП. 3. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 20 до 37% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. 4. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 40% об./об., этанол от 23 до 35% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. 5. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 166 до 200 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 25 до 42% об./об., этанол от 10 до 35% об./об., полиэтиленгликоль от 3 до 19% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. 6. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-2, где композиция содержит от 200 до 250 мг/мл парацетамола или его фармацевтически приемлемой соли в системе растворителей, содержащей гликофурол от 30 до 40% об./об., этанол от 24 до 35% об./об., полиэтиленгликоль от 3 до 6% об./об. и объем воды для доведения общего объема композиции до 2-3 мл. 7. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-6, где полиэтиленгликоль представляет собой полиэтиленгликоль 400/600. 8. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.3, где вязкость композиции находится в диапазоне от приблизительно 7 до приблизительно 16 сП. 9. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.4, где вязкость композиции находится в диапазоне от приблизительно 16 до приблизительно 28 сП. 10. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.5, где вязкость композиции находится в диапазоне от приблизительно 9 до приблизительно 14 сП. 11. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по п.6, где вязкость композиции находится в диапазоне от приблизительно 14 до приблизительно 28 сП. 12. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-11, где композиция дополнительно содержит антиоксиданты, хелатирующие и/или буферные средства. 13. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-12, где композиция дополнительно содержит от 2 до 6% об./об. бензилового спирта. 14. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-13, где композиция остается стабильной, чистой и прозрачной по меньшей мере в течение 6 ч после разведения в общепринятых внутривенных растворах, инфузионных растворах антибактериальных, противогрибковых и амебицидных лекарственных средств, и вместе с анксиолитиком - инъекционным раствором мидазолама или наркотическим анальгетиком - инъекционным раствором цитрата фентанила. 15. Высококонцентрированная парентеральная композиция парацетамола или его фармацевтически приемлемой соли по любому из пп.1-13, где композиция предназначена для введения внутримышечным способом, внутривенным способом или для внутривенного вливания. 16. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли по п.1, включающий:a) растворение необходимого количества парацетамола или его фармацевтически приемлемой соли в системе растворителей в атмосфере инертного газа;c) доведение pH до значения от 4 до 8;d) доведение объема раствора до заранее установленного объема;e) фильтрование раствора через 0,22-микронный фильтрующий материал,где стадии b и с являются необязательными, и система растворителей представляет собой гликофурол, этанол и воду либо гликофурол, этанол, полиэтиленгликоль и воду. 17. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли по п.16, где pH раствора на этапе с доводят до значения от 4 до 8 соляной кислотой, серной кислотой, уксусной кислотой, лимонной кислотой, гидроксидом натрия, гидроксидом калия, бикарбонатом натрия, бикарбонатом калия. 18. Способ получения парентеральной композиции парацетамола или его фармацевтически приемлемой соли с концентрацией активного ингредиента в диапазоне от приблизительно 166 до приблизительно 250 мг/мл по п.16, где pH раствора на этапе с доводят до значения от 4 до 8 цитратным буфером или фосфатным буфером.
МПК / Метки
МПК: A61K 31/167, A61K 47/10, A61K 9/08, A61K 9/00, A61K 47/22
Метки: высококонцентрированная, парентеральная, композиция, получения, парацетамола, способ
Код ссылки
<a href="https://eas.patents.su/20-23022-vysokokoncentrirovannaya-parenteralnaya-kompoziciya-paracetamola-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Высококонцентрированная парентеральная композиция парацетамола и способ ее получения</a>
Предыдущий патент: Антитела к n3pglu бета-амилоидному пептиду и их применение
Следующий патент: Галогенированные диэтилтолуолдиамины
Случайный патент: Способ непрерывного получения поликристаллического кремния с использованием реактора с псевдоожиженным слоем