Способ лечения рака с использованием ингибитора cmet и axl и ингибитора erbb
Номер патента: 20779
Опубликовано: 30.01.2015
Авторы: Лю Ли, Греджер Джеймс Г., Джилмер Тона М., Ши Хун
Формула / Реферат
1. Способ лечения рака у пациента, включающий введение пациенту терапевтически эффективных количеств:
а) соединения формулы I
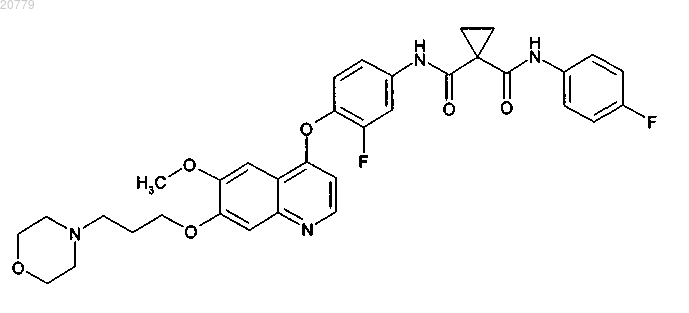
или фармацевтически приемлемой соли указанного соединения; и
(b) ингибитора ErbB, который ингибирует рецептор ErbB-1, или ErbB-2, или Erb-3, или их комбинацию;
причем опухолевая клетка указанного рака высоко экспрессирует AXL.
2. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы II
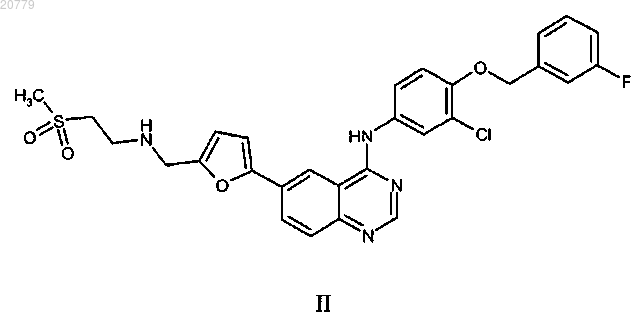
или фармацевтически приемлемую соль указанного соединения.
3. Способ по п.2, где ингибитор ErbB представляет собой дитозилатную соль или моногидрат дитозилатной соли соединения формулы II.
4. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы III
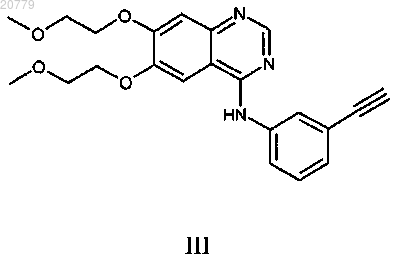
или фармацевтически приемлемую соль указанного соединения.
5. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы IV
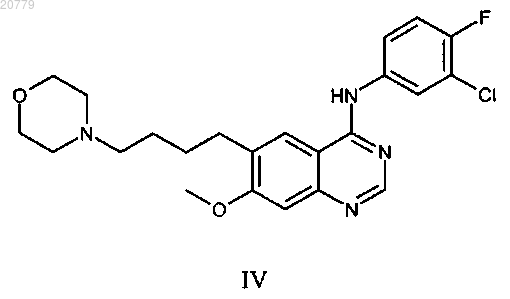
6. Способ по п.1, где ингибитор ErbB представляет собой трастузумаб.
7. Способ по п.1, где ингибитор ErbB представляет собой цетуксимаб.
8. Способ по п.1, где ингибитор ErbB представляет собой моноклональное антитело против человеческого ErbB-3.
9. Способ по любому из пп.1-8, где рак представляет собой рак желудка, легкого, пищевода, головы и шеи, кожи, эпидермиса, яичников или молочной железы.
Текст
СПОСОБ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРА cMET И AXL И ИНГИБИТОРА ErbB Изобретение относится к способу лечения рака у пациента, включающему введение пациенту терапевтически эффективных количеств а) соединения формулы I или фармацевтически приемлемой соли указанного соединения и (b) ингибитора ErbB, который ингибирует рецепторErbB-1, или ErbB-2, или Erb-3, или их комбинацию. Способ по изобретению обращен на потребности в области техники, связанной с открытием комбинированной терапии, которая, как очевидно показано, является более эффективной терапией, чем ранее описанные терапии. Данные родственной заявки По данной формуле изобретения к заявке испрашивается приоритет заявки на предварительный патент США 61/050322, поданной 5 мая 2008 г. Уровень техники изобретения Данное изобретение относится к способу лечения рака ингибитором, направленным на мультикиназы, включая сМЕТ и AXL, в комбинации с ингибитором ErbB. Как правило, рак возникает в результате дерегуляции нормальных процессов, контролирующих деление клеток, дифференциацию и апоптотическую гибель клеток. Апоптоз (программированная гибель клеток) играет основную роль в эмбриональном развитии и патогенезе различных заболеваний, таких как дегенеративные нервные заболевания, сердечно-сосудистые заболевания и рак. Одним из наиболее изученных проводящих путей, включающих киназную регуляцию апоптоза, является клеточная передача сигнала от рецепторов фактора роста на клеточной поверхности к ядрам (Crews and Erikson, Cell, 74:21517, 1993), в частности клеточная передача сигнала от рецепторов фактора роста семейства ErbB.ErbB-1 (также известный как EGFR или HER1) и ErbB-2 (также известный как HER2) являются белковыми рецепторами фактора роста трансмембранной тирозинкиназы семейства ErbB. Белковые тирозинкиназы катализируют фосфорилирование специфических тирозильных остатков в различных белках,вовлеченных в регуляцию клеточного роста и дифференциации (A.F. Wilks, Progress in Growth FactorErbB-3 (также известный как HER3) является рецептором фактора роста семейства ErbB, у которого есть домен связывания лиганда, но отсутствует внутренняя тирозинкиназная активность. HER3 активируется одним из внеклеточных лигандов (например, херегулином (HRG, затем становится субстратом для димеризации и последующего фосфорилирования посредством HER1, HER2 и HER4; образуется тот фосфорилированный HER3, который ведет к активации путей клеточной сигнализации в отношении митогенных и трансформирующих эффектов. Такие рецепторные тирозинкиназы широко экспрессируются в эпителиальных, мезенхимальных и нервных тканях, где играют роль в регуляции пролиферации клеток, выживаемости и дифференциации(Sibilia and Wagner, Science, 269: 234 (1995); Threadgill et al., Science, 269: 230 (1995. Повышенная экспрессия ErbB-2 или ErbB-1 дикого типа, или экспрессия конститутивно активированных рецепторных мутантов, трансформирует клетки in vitro (Di Fiore et al., 1987; DiMarco et al., Oncogene, 4: 831 (1989);Hudziak et al., Proc. Natl. Acad. Sci. USA., 84:7159 (1987); Qian et al., Oncogene, 10:211 (1995. Повышенная экспрессия ErbB-1 или ErbB-2 коррелирована с плохим исходом болезни при некоторых злокачественных опухолях молочной железы и ряде других злокачественных новообразований (Slamon et al., Science, 235: 177 (1987); Slamon et al., Science, 244:707 (1989); Bacus et al., Am. J. Clin. Path, 102:S13 (1994. Сообщается о сверхэкспрессии HRG и/или HER3 в многочисленных злокачественных опухолях, включая опухоли желудка, яичников, предстательной железы, мочевого пузыря и молочной железы, и связи сверхэкспрессии с неблагоприятными прогнозами (В. Tanner, J. Clin. Oncol. 2006, 24 (26):4317-23; М.Hayashi, Clin. Cancer Res. 2008, 14(23):7843-9; H. Kaya, Eur J. Gynaecol Oncol. 2008, 29(4):350-6). Способы конъюгирования лекарственного препарата с антителом, обеспечивающего направленную доставку препарата к ErbB, включают трастузумаб, моноклональное антитело против ErbB-2, цетуксимаб, антитело против ErbB-1, антитела против ErbB3, такие как mab3481, моноклональное антитело против человеческого ErbB3 (коммерчески поставляемое RD Systems, Minneapolis, MN) и низкомолекулярные ингибиторы тирозинкиназы (TKI), такие как лапатиниб, селективный ингибитор ErbB-1/ErbB-2,гефитиниб и эрлотиниб, селективные ингибиторы ErbB-1. Однако указанные агенты проявляют ограниченную активность при использовании в виде отдельных агентов (Moasser, British J. Cancer 97:453, 2007). Поэтому достижением в области онкологии было бы разработать методы терапии с повышенной эффективностью ингибирования ErbB для лечения ряда злокачественных опухолей. Краткое описание изобретения В одном из аспектов данное изобретение касается способа лечения рака у пациента, включающего введение пациенту терапевтически эффективных количеств: а) соединения формулы I или фармацевтически приемлемой соли указанного соединения; и(b) ингибитора ErbB, который ингибирует рецептор ErbB-1, или ErbB-2, или Erb-3, или их комбинацию; причем опухолевая клетка указанного рака высоко экспрессирует AXL. Способ по данному изобретению обращен на потребности в области техники, связанной с открытием комбинированной терапии, которая, как очевидно показано, является более эффективной терапией,чем ранее описанные терапии. Краткое описание чертежей Фиг. 1 представляет кривые зависимости доза-эффект для ингибирования клеточного роста посредством лапатиниба и соединения I, по отдельности и в комбинации при соотношении лапатиниб:соединение I 1:1 моль-на-моль, в клетках ОЕ-33 (сМЕТ+ и HER2+) и NCI-H1573 (сМЕТ+ и HER1+) в присутствии HGF. Фиг. 2 иллюстрирует (левое поле) влияния HGF на активность лапатиниба и комбинации лапатиниба и соединения I при соотношении лапатиниб:соединение I 1:1 моль-на-моль в опухолевых линиях со сверхэкспрессией N87 с HER2+ и СМЕТ. Фиг. 2 также иллюстрирует (правое поле) ингибирование фосфорилирования cMET, HER2, HER3, AKT и ERK посредством обработки лапатинибом и соединением I в присутствии и в отсутствие HGF, определяемое анализами вестерн-блоттинга. Фиг. 3 представляет ингибирование клеточного роста посредством лапатиниба и соединения I, по отдельности и в комбинации при соотношении лапатиниб:соединение I 1:1 моль-на-моль, в обеих клетках, ВТ 474 (чувствительных к лапатинибу и трастузумабу) и BT474-J4 (резистентных к лапатинибу и трастузумабу), в присутствии HGF. Фиг. 4 иллюстрирует индукцию апоптоза (фрагментация ДНК и активация 3/7 каспаз) посредством лапатиниба и соединения I, по отдельности и в комбинации при соотношении лапатиниб:соединение I 1:1 моль-на-моль, в обеих клетках, ВТ 474 и BT474-J4, в присутствии HGF. Фиг. 5 представляет ингибирование клеточного роста и индукцию апоптоза посредством комбинации соединения I и лапатиниба при различных концентрациях в клетках BT474-J4, в присутствии HGF. Фиг. 6 иллюстрирует 1) ингибирование фосфорилирования HER2 (pHER2) посредством одного только лапатиниба; 2) ингибирование фосфорилирования AXL (pAXL) посредством одного только соединения I и 3) ингибирование pHER2 и pAXL, равно как снижение фосфорилирования AKT (pAKT),фосфорилирования ERK1/2 (pERK1/2) и циклина D1, с использованием комбинации соединения I и лапатиниба в клетках BT474-J4. Фиг. 7 представляет ингибирование клеточного роста посредством трастузумаба и соединения I, по отдельности и в комбинации при соотношении трастузумаб:соединение I 1:15 моль-на-моль, после 5 дней обработки соединением в обеих клетках, ВТ 474 и BT474-J4, в присутствии HGF. Фиг. 8 представляет кривые зависимости доза-эффект ингибирования клеточного роста посредством эрлотиниба и соединения I, по отдельности и в комбинации при соотношении эрлотиниб:соединениеI 1:1 моль-на-моль, в клетках опухоли легкого, NCI-H1648 (сМЕТ+) и NCI-H1573 (сМЕТ+ и HER1+), в присутствии HGF. Фиг. 9 иллюстрирует (левое поле, ингибирование клеточного роста с использованием метки) кривые зависимости доза-эффект для ингибирования клеточного роста посредством лапатиниба и соединения I, по отдельности и в комбинации при соотношении лапатиниб:соединение I 1:1 моль-на-моль, в опухолевых клетках MKN45 (сверхэкспрессия СМЕТ+ и HER3) в отсутствие и присутствии HRG. Фиг. 9 также иллюстрирует (правое поле, анализ вестерн-блоттинга с использованием метки) ингибирование фосфорилирования СМЕТ, HER1, HER3, AKT и ERK путем обработки лапатинибом и соединением I в присутствии и в отсутствие HRG, определяемое анализами вестерн-блоттинга. Подробное описание изобретения В одном из аспектов настоящее изобретение касается лечения рака с использованием эффективных количеств соединения формулы I и ингибитора ErbB, где соединение формулы I представлено следующей формулой: или фармацевтически приемлемой соли указанного соединения. В другом аспекте ингибитор ErbB представляет собой соединение формулы II или фармацевтически приемлемую соль указанного соединения. В другом аспекте ингибитор ErbB представляет собой дитозилатную соль или моногидрат дитозилатной соли соединения формулы II. В другом аспекте ингибитор ErbB представляет собой соединение формулы III или фармацевтически приемлемую соль указанного соединения. В другом аспекте ингибитор ErbB представляет собой трастузумаб (реализуемый под названием герцептин). В другом аспекте ингибитор ErbB представляет собой цетуксимаб (реализуемый под названием эрбитукс). В другом аспекте ингибитор ErbB представляет собой моноклональное антитело против человеческого ErbB3. В другом аспекте рак представляет собой рак желудка, легкого, пищевода, головы и шеи, кожи,эпидермиса, яичников или молочной железы. В другом аспекте настоящее изобретение представляет способ лечения пациента, страдающего раком молочной железы или раком головы и шеи, включающий введение пациенту терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения. В другом аспекте фармацевтически приемлемый наполнитель включен в соединение или фармацевтически приемлемую соль формулы I/или ингибитор ErbB; или их комбинацию. Как использовано в описании, термин "эффективные количества" означает количества лекарственных средств или фармацевтических агентов, которые вызывают требуемый биологический или терапевтический ответ ткани, системы, животного или человека. Кроме того, термин "терапевтически эффективные количества" означает любые количества, которые при введении субъекту по сравнению с соответствующим субъектом, не получавшим таких количеств, приводят к лучшему лечению, излечиванию, предупреждению или уменьшению интенсивности заболевания, нарушения или побочного эффекта, или снижению скорости продвижения заболевания или нарушения. Термин также включает количества, эффективные для стимуляции нормальной физиологической функции. Подразумевается, что соединения могут быть введены последовательно или, по существу, одновременно. Соединение по данному изобретению может быть введено любыми подходящими способами,включая пероральный или парентеральный. Фармацевтические составы, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях или жидкие эмульсии типа масло-в-воде. Составы для перорального введения могут включать фармацевтически приемлемые наполнители, известные из уровня техники. Фармацевтические составы, адаптированные для парентерального введения, в особенности внутривенного введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, делающие состав изотоничным с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии,которые могут включать суспендирующие агенты и загустители. Составы могут быть представлены в контейнерах с однократной или многократной дозой, например в запаянных ампулах и герметично закрытых флаконах, и могут храниться в сублимированном (лиофилизованном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед употреблением. Экстемпоральные растворы и суспензии для инъекций могут быть получены из стерильных порошков, гранул и таблеток. Как использовано в описании, "ингибитор ErbB" означает соединение, моноклональное антитело,-3 020779 иммуноконъюгат или вакцину, ингибирующие ErbB-1, или ErbB-2, или ErbB-3, или их комбинацию. Данное изобретение включает соединения, равно как соответствующие фармацевтически приемлемые соли. Подразумевается, что слово "или" в контексте "соединение или фармацевтически приемлемая соль указанного соединения" означает либо соединение, либо фармацевтически приемлемую соль указанного соединения (альтернатива), или соединение и фармацевтически приемлемую соль указанного соединения(в комбинации). Как использовано в настоящем описании, "пациент" означает млекопитающее, конкретнее человека, страдающего раком. Как использован в настоящем описании, термин "фармацевтически приемлемые" означает те соединения, материалы, композиции и лекарственные формы, которые в рамках обоснованного медицинского заключения пригодны для применения в контакте с тканями людей и животных при отсутствии излишней токсичности, раздражения или иных проблем и осложнений. Квалифицированному специалисту понятно, что фармацевтически приемлемые соли соединений для способа по данному изобретению могут быть получены. Указанные фармацевтически приемлемые соли могут быть получены in situ во время окончательного выделения и очистки соединения или раздельным осуществлением взаимодействия очищенного соединения в форме свободной кислоты или в форме свободного основания с подходящим основанием или кислотой соответственно. Как правило, вводимое дозированное количество соединения формулы I и ингибитора ErbB представляет такое количество, которое является и эффективным, и толерантным. Предпочтительно количество соединения I составляет в диапазоне примерно от 1 мг до 1000 мг/день и количество ингибитораErbB предпочтительно составляет в диапазоне примерно от 1 мкг до 2000 мг/день. Соединение I (N1-3 фтор-4-[(6-(метилокси)-7-[3-(4-морфолинил)пропил]окси-4-хинолинил)окси]фенил-N1-(4-фторфенил)-1,1-циклопропандикарбоксамид) может быть получено, как описано в WO2005/030140, опубликованном 7 апреля 2005 г. Примеры 25 (с. 193), 36 (с. 202-203), 42 (с. 209), 43 (с. 209) и 44 (с. 209-210) описывают,как может быть получено соединение I. Соединение формулы I может быть получено аналогично. Общий принцип получения соединения I представлен схемой 1. Схема 1 Примеры ингибиторов ErbB включают лапатиниб, эрлотиниб и гефитиниб. Лапатиниб, N-(3-хлор-4[(3-фторфенил)метил]оксифенил)-6-[5-([2-(метилсульфонил)этил]аминометил)-2-фуранил]-4 хиназолинамин (представленный, как показано формулой II), является эффективным, пероральным, низкомолекулярным, двойным ингибитором тирозинкиназ ErbB-1 и ErbB-2 (EGFR и HER2), который разрешен в комбинации с капецитабином для лечения HER2-позитивного метастатического рака молочной железы. Свободное основание, соли HCl и дитозилатные соли соединения формулы (II) могут быть получены по методикам, описанным в WO99/35146, опубликованном 15 июля 1999 г. и WO02/02552, опубликованном 10 января 2002 г. Общая схема получения дитозилатной соли соединения II иллюстрируется схемой 2. Схема 2 Согласно схеме 2 получение дитозилатной соли соединения формулы (I) протекает в четыре стадии: стадия 1: взаимодействие указанного бициклического соединения и амина с получением указанного йодхиназолинового производного; стадия 2: получение соответствующей соли альдегида; стадия 3: получение дитозилатной соли хиназолина и стадия 4 : получение моногидрата дитозилатной соли. Эрлотиниб, N-(3-этинилфенил)-6,7-бис-[2-(метилокси)этил]окси-4-хиназолинамин (коммерчески доступный под торговой маркой Tarceva) представлен, как показано формулой III Свободное основание и HCl-соль эрлотиниба могут быть получены, например, согласно США 5747498, пример 20. Гефитиниб,N-(3-хлор-4-фторфенил)-7-метокси-6-[3-4-морфолин)пропокси]-4-хиназолинамин,представлен, как показано формулой IV Гефитиниб, коммерчески доступный под торговой маркой IRESSA (Astra-Zenenca), представляет собой ингибитор ErbB-1, показанный в качестве монотерапии для лечения пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого после безуспешной химиотерапии как на основе платины, так и на основе доцетаксела. Свободное основание и HCl-соли и ди-HCl-соли гефитиниба могут быть получены по методикам международной патентной заявкиPCT/GB96/00961, поданной 23 апреля 1996 г. и опубликованной в качестве WO96/33980 31 октября 1996 г. Методики Клеточные линии и культивирование. Клеточные линии карциномы молочной железы человека, ВТ 474, НСС 1954 и MDA-MB-468, линии плоскоклеточной карциномы головы и шеи, SCC15, Detroit 562 и SCC12, клеточные линии карциномы желудка, SNU-5, HS746T, AGS, SNU-16 и N87, клеточные линии карциномы легкого, NCI-H1993, NCIH1573, NCI-H441, NCI-H2342, NCI-H1648, НОР-92, NCI-H596, NCI-H69, NCI-H2170 и А 549, клеточная линия эпидермальной карциномы А 431 и линии карциномы толстой кишки, НТ 29, SW48 и KM12 получают из Американской коллекции типовых культур (АТСС). Клеточную линию карциномы пищевода ОЕ 33 получают из Европейской коллекции клеточных культур ЕСАСС (UK). Клеточную линию рака молочной железы JIMT-1 и клеточную линию карциномы желудка MKN-45 получают из Немецкого банка микроорганизмов и клеточных культур GmbH (Германия); KPL-4, клеточная линия рака молочной железы человека, любезно предоставлена профессором J. Kurebayashi (Kawasaki Medical School, Kurashiki, Japan). LL1-BT474-J4 (BT474-J4), клеточный клон карциномы молочной железы получен клонированием из одной клетки ВТ 474 (HER2+, молочная железа, высокочувствительный к лапатинибу), подвергнутой действию возрастающих концентраций лапатиниба, до 3 мкМ. LICR-LON-HN5 головы и шеи карциномы клеточной линии (HN5) подарена Институтом исследований злокачественных опухолей (Institute of Cancer Research, Surrey, U.K. HN5C12 получен клонированием из одной клетки HN5 с последующим воздействием возрастающих концентраций лапатиниба. Линии ВТ 474, НСС 1954, MDA-MB-468, SCC15, Detroit 562, SCC12, SNU-5, HS746T, AGS, NCI-N87,А-431, NCI-H1993, NCI-H441, НОР-92, NCI-H596, NCI-H69, NCI-H2170, А 549, JIMT-1, MKN-45, ОЕ 33,SNU-16, SW48, KM12 и НТ 29 культивируют во влажной камере при 37 С в 95% воздушной среде, 5% СО 2, в среде RPMI 1640, содержащей 10% фетальную телячью сыворотку (FBS). Как NCI-Н 1573, так иNCI-H1648 культивируют в бессывороточной среде ACL-4, содержащей в соотношении 50:50, модифицированная по способу Дульбекко среда Игла (DMEM)/F12, инсулинтрансферриновые добавки SeleniunX, 50 нМ гидрокортизона, 1 нг/мл EGF, 0,01 мМ этаноламина, 0,01 мМ фосфорилэтаноламина, 100 пМ трийодтиронина, 0,5% (мас./об.) BSA (2 мг/мл), 2 L-глутамин, 0,5 мМ пирувата натрия. NCI-H2342 культивируют в АТСС-формулированной DMEM:F12 среде ( по каталогу 30-2006) с 0,005 мг/мл инсулина,0,01 мг/мл трансферрина, 30 нМ селенита натрия (конечная концентрация), 10 нМ гидрокортизона (конечная концентрация), 10 нМ бета-эстрадиола (конечная концентрация), 10 нМ HEPES (конечная концентрация), дополнительно 2 мМ L-глутамина (для конечной концентрации 4,5 мМ) и 5% фетальной телячьей сывороткой (конечная концентрация). BT474-J4 культивируют в RPMI 1640, содержащей 10%FBS и 1 мкМ лапатиниба. KPL-4 и HN5 культивируют в DMEM, содержащей 5% FBS; HN5 С 12 культивируют в DMEM, содержащей 5% FBS и 1 мкМ лапатиниба. Испытание на ингибирование клеточного роста и данные испытания. Ингибирование клеточного роста определяют методом анализа жизнеспособности клеток CellTiterGlo. Клетки высевают на 96-луночный планшет для тканевых культур при следующих плотностях посева на соответствующую среду, содержащую 10% FBS, при 1000 или 2000 клеток/лунка в зависимости от скорости клеточного роста. BT474-J4 и FIN5C12 промывают PBS и высевают на чашку Петри в соответствующую культуральную среду, не содержащую лапатиниб. Спустя примерно 24 ч после посева клетки подвергают воздействию соединений; клетки обрабатывают десятью последовательными двукратными разведениями (конечные концентрации соединения изменяются в диапазоне от 10, 5, 2,5, 1,25, 0,63, 0,31,0,16, 0,08, 0,04 до 0,02 мкМ) соединения или комбинации из двух агентов при постоянном соотношении моль на моль 1:1 или как указано. Клетки инкубируют с соединениями в культуральной среде, содержащей либо 5%, либо 10% FBS, и в присутствии или в отсутствие 2 нг/мл HGF, лиганда для активации сМЕТ в течение 3 дней или как указано. Уровни АТФ определяют, добавляя Cell Titer Glo (Promega),инкубируя 20 мин, затем люминесцентный сигнал считывают с планшета SpectraMax M5 при времени интегрирования 0,5 с. Клеточный рост рассчитывают относительно контрольных лунок, обработанных растворителем (ДМСО). Концентрацию соединения, ингибирующую 50% контролируемого роста клеток(IC50), интерполируют, используя следующее эмпирическое уравнение четырехпараметрической кривой: где А означает минимальный отклик (ymin), В означает максимальный отклик (ymax), с означает точку перегиба кривой (ЕС 50), d означает коэффициент Хилла и х означает log10 концентрации соединения(моль/л). Эффекты комбинации оценивают, используя значения индекса комбинации (CI) и статистический анализ превышения над максимальным отдельным агентом (EOHSA). Значения CI рассчитывают с помощью интерполированных значений IC50 и уравнения взаимного неисключения, выведенного Chou и Talalay где IC50(а) означает IC50 ингибитора А; IC50(b) означает IC50 ингибитора В; Da означает концентрацию ингибитора А в комбинации с ингибитором В, ингибирующую 50% клеточного роста, и Db означает концентрацию ингибитора В в комбинации с ингибитором А, ингибирующую 50% клеточного роста. В це-6 020779 лом, значение CI в диапазоне от 0,9 до 1,10 указывает на аддитивный эффект для комбинации из двух агентов. CI0,9 указывает на синергизм (меньшее число указывает на более сильный синергетический эффект) и CI1,10 указывает на антагонизм. Превышение над максимальным отдельным агентом (EOHSA) определяется как статистически значимое улучшение в комбинации по сравнению с монотерапиями компонентами. Например, если соединения А и В комбинированы при концентрациях g и r, соответственно средний ответ в комбинацииAq+Br будет существенно выше, чем средние ответы в Aq или Br по отдельности. В статистических терминах максимум р-значений для двух сопоставлений Ag+Br против Ag и Ag+Br против Br должен быть ниже соответствующего предела или равен р 0,05. EOHSA представляет собой единый подход к оценке лекарственных комбинаций и является критерием ФДА (21 CRF 300,50) для утверждения лекарственной комбинации; см., Borisy et al. (2003) или Hung et al. (1993) в отношении примеров и пояснения. Анализ выполняют, используя двухфакторный анализ дисперсии с взаимодействием (модельными терминами являются доза лекарственного средства А, доза лекарственного средства В и взаимодействие между дозами лекарственного средства А и В), с последующими линейными контрастами между каждой группой комбинации и соответствующими монотерапиями. Анализ проводят, используя SAS (версия 9, предоставленная SAS Institute, Сагу, N.C.). EOHSA при каждой дозе рассчитывают как минимальную разность в среднем ингибировании в процентах между комбинацией и каждой из монотерапий из соответствующего контраста ANOVA. Поскольку существует множество сравнений для конечной точки ингибирования в прцентах, в р-значение вводят поправку на множественные сравнения. Метод Hommel реализуют для улучшения критерия мощности, сохраняя контроль частоты ошибки Familywise Error Rate (FWE) путем применения метода последовательного отбрасывания. р-Значения как для синергизма, так и антагонизма рассчитывают, используя введение указанной поправки. При использовании метода EOHSA синергизм означает, что эффект (или ответ) в комбинации существенно выше, чем максимальный эффект отдельного агента самого по себе с р 0,05; аддитивный означает, что эффект в комбинации несущественно отличается от максимального эффекта отдельного агента самого по себе (р 0,05), антагонист означает, что эффект в комбинации существенно ниже, чем максимальный эффект отдельного агента самого по себе с р 0,05. Испытания на апоптоз клеток методом оценки гибели клеток ELISAplus (оценка фрагментации ДНК) и испытаниями Caspase-Glo 3/7. Апоптоз клеток оценивают как методом оценки гибели клеток ELISA, который оценивает фрагментацию ДНК, признак апоптоза; и испытанием Caspase-Glo 3/7, устанавливающим активность каспазы 3/7, одного из управляющих ферментов апоптоза в клетках. Набор для оценки гибели клеток ELISAplus (Roche, Mannheim, Germany) используют согласно инструкциям изготовителя. Клетки высевают на 96-луночные планшеты при плотности 10000 на лунку. Спустя 24 ч клетки дозируют и культивируют дополнительно 48 ч на RPMI 1640 с 10% FBS в 5% СО 2 при 37 С. Цитоплазматические фракции контроля и обработанных клеток переносят на покрытые стрептавидином 96-луночные планшеты и инкубируют с биотинилированным мышиным антителом к гистону и конъюгированным с пероксидазой мышиным антителом против ДНК при комнатной температуре в течение 2 ч. Абсорбцию определяют при 405-490 нм, используя считывающее устройство для микропланшетов Spectra Max Gemini (Molecular Devices, Sunnyvale, CA). Испытание Caspase-Glo 3/7 (Promega) представляет собой гомогенный люминесцентный анализ для измерения активностей каспазы-3 и -7. Клетки высевают на 96-луночные планшеты при плотности 5000 на лунку. Спустя 24 ч клетки дозируют и культивируют дополнительно 24 ч на RPMI 1640 с 10%FBS в 5% СО 2 при 37 С. Активность каспазы 3/7 определяют добавлением люминогенного субстрата каспазы-3/7, содержащего тетрапептидную последовательность DEVD, в реагенте, оптимизированном для активности каспазы, активности люциферазы и лизиса клеток, согласно инструкциям изготовителя. Анализ вестерн-блоттинга. Клетки высевают при 250000-500000 на лунку на шестилуночные планшеты (Falcon multiwell, Becton Dickinson, Franklin Lakes, NJ). На следующий день клетки обрабатывают соединениями в среде для роста, содержащей 10% FBS. После обработки клетки промывают охлажденным PBS и лизируют в чашках для культивирования, используя буфер для лизиса клеток [40 ммоль/л Tris-HCl (pH 7,4), 10% глицерина, 50 ммоль/л -глицерофосфат, 5 ммоль/л EGTA, 2 ммоль/л EDTA, 0,35 ммоль/л ванадат, 10 ммоль/лNaF и 0,3% Triton X-100], содержащий ингибиторы протеазы (Complete Protease Inhibitor Tablets, Boehringer Mannheim, Indianapolis, IN). Образцы белка (50 мкг), детерминированные с использованием детергент-совместимых анализов на белок Bio-Rad, из контроля и обработанных клеточных лизатов загружают в гели NuPAGE с градиентом 4-12% (Novex, Inc., San Diego, CA), подвергают электрофорезу в условиях восстановления и переносят на нитроцеллюлозные мембраны (0,45 мкм; Bio-Rad Laboratories). Мембранные блоты прополаскивают PBS и блокируют в блокирующем буфере Odyssey Blocking buffer в течение 1 ч при комнатной температуре. Блоты зондируют антителами против специфических белков в блокирующем буфере плюс 0,1% Tween 20 и инкубируют 2 ч при комнатной температуре. Мембраны промывают и инкубируют с вторичными антителами IRDye 680 или IRDye 800 при комнатной темпера-7 020779 туре в течение 1 ч в блокирующем буфере плюс 0,1% Tween 20. Мембраны обнаруживают с помощью системы формирования ИК-изображений Odyssey Infrared Imaging System (LI-COR Biosciences, Lincoln,Nebraska). Условия, используемые для анализа вестерн-блоттинга (фиг. 6) следующие: клетки обрабатывают одним только лапатинибом (1 мкМ), одним только соединением I (1 мкМ) или лапатинибом (1 мкМ) в комбинации с соединением I (1 мкМ) в течение 4 ч. Клеточный лизат (50 мкг общего белка) или белки,иммунопреципитированные антителом против фосфотирозина, загружают в гель SDS-PAGE. В анализе вестерн-блоттинга используют антитело против специфического белка. Условия, используемые в анализе вестерн-блоттинга (фиг. 2, правое поле и фиг. 9, правое поле),следующие: клетки обрабатывают одним только лапатинибом (1 мкМ), одним только соединением I (1 мкМ) или лапатинибом (1 мкМ) в комбинации с соединением I (0,1 мкМ) в течение 2 ч в отсутствие или в присутствии HGF или HRG, как указано. Клеточный лизат (50 мкг общего белка) или белки, иммунопреципитированные антителом к МЕТ или к HER3, загружают в гель SDS-PAGE. В анализе вестернблоттинга используют антитело против специфического белка. Ингибирование клеточного роста соединением I. Соединение I является эффективным ингибитором мультикиназ, направленным на сМЕТ, RON,AXL, VEGFR 1/2, TIE2, PDGFRbeta, cKIT и FLT3. Ингибирование клеточного роста оценивают анализом жизнеспособности клеток CellTiter-Glo в клеточных линиях опухоли молочной железы (ВТ 474,НСС 1954, KPL-4, JIMT-1, MDA-MB-468 и BT474-J4), головы и шеи (SCC15, HN5, Detriot 562, SCC12 и(ОЕ-33), кожи (А 431) и толстой кишки (НТ 29, SW48 и KM12). Фактор роста гепатоцитов (HGF) является лигандом для активации сМЕТ. HGF является цитокином с некоторым числом биологических активностей, включающих стимуляцию пролиферации клеток, подвижности и морфогенеза. HGF секретируется как неактивный предшественник, который превращается в активную гетеродимерную форму под действием секретированной протеазы, включая активаторы плазминогена. В условиях культивирования клеток in vitro большинство клеточных линий опухолей не экспрессирует активную форму HGF. Добавление активной формы HGF человека в культуральную среду обеспечивает систему активации сМЕТ паракрином. Указывается, что уровень HGF сыворотки человека составляет для здоровых людей 0,2 нг/мл (J. Immunol. Methods 2000; 244: 163-173) и повышается до 2 нг/мл у пациентов с раком молочной железы и метастазами в печени (Tumor Biol 2007; 28:36-44). Поэтому HGF вносят при 2 нг/мл в культуральную среду, содержащую либо 5%, либо 10% FBS, для ингибирования клеточного роста и исследования апоптоза. Сокращения, принятые для таблиц Ниже приведено пояснение сокращений, используемых в таблицах.N=2 означает, что эксперименты повторяют дважды, независимо. Все анализы дублируют, за исключением случаев, указанных звездочкой;IC50 означает концентрацию соединения, которая ингибирует 50% клеточного роста контроля, интерполированную с использованием эмпирического уравнения четырехпараметрической кривой, мкМ означает микромоли на литр;HER амп.+указывает, что ген HER1 (HER1+) или HER2 (HER2+) является амплифицированным в клеточной линии; "нет" означает, что ни HER1, ни HER2 не является амплифицированным в клеточной линии; 10 означает, что IC50 не достигает наибольшей исследуемой концентрации (10 мкМ);HER3-сверх означает сверхэкспрессионные уровни РНК HER3 (интенсивность MAS 5300), как установлено аффиметрическим анализом на микрочипах;HER3-сверх означает сверхэкспрессионные уровни РНК HER3 (интенсивность MAS 5100), как установлено аффиметрическим анализом на микрочипах; сМЕТ+ означает амплификацию гена сМЕТ с 5 копиями ДНК МЕТ, как установлено SNP-CHIP; сМЕТ+ (5) означает амплификацию гена сМЕТ с 5 копиями ДНК МЕТ, как установлено SNPCHIP; сМЕТ-сверх означает сверхэкспрессию РНК сМЕТ (интенсивность MAS 5300), как установлено аффиметрическим анализом на микрочипах; сМЕТ-низкий означает низкие уровни экспрессиии РНК сМЕТ (интенсивность MAS 5300), как установлено аффиметрическим анализом на микрочипах; сМЕТ-myc означает точечную мутацию, делецию, инсерцию или миссенс-мутацию в гене сМЕТ;+HRG означает, что 10 нг/мл HRG добавляют в культуральную среду, содержащую 10% FBS; НС = нет сведений, поскольку абсолютное значение IC50 агента самого по себе не может быть определено. Влияния соединения I на ингибирование клеточного роста Влияния соединения I, самого по себе, на ингибирование клеточного роста в клеточных линиях опухолей сведены в табл. 1. Как видно из табл. 1, данное соединение очень эффективно в ингибировании клеточного роста опухолевых линий MKN-45, SNU-5, HS746T и NCI-H1993 с сМЕТ+ и HERнеамплифицированным (HER+=нет), давая значения IC50 ниже 100 нМ. NCI-H1648, сМЕТамплифицированная клеточная линия опухоли легкого более чувствительна к соединению I в присутствии HGF, что свидетельствует о зависимом от HGF-cMET - активации клеточном росте данной линии. Таблица 1 Значения IC50 (мкМ) для ингибирования клеточного роста одним только соединением I в опухолевых клеточных линиях Результаты табл. 1 свидетельствуют о том, что пролиферация опухолевых клеток с амплификацией гена сМЕТ сильно зависит от сМЕТ. Как дополнительно иллюстрируется табл. 1, соединение I дает значения IC50 в диапазоне от 0,04 до 5 мкМ в ингибировании роста клеток в клеточных линиях с амплификацией сМЕТ менее 5 копий, с мутациями сМЕТ по околомембранному домену (НОР-92: СМЕТ-Т 10101; Н 69: CMET-R988C и Н 596: сМЕТ-ехоп 14, делеция внутри рамки считывания) или сМЕТнеамплифицированных опухолевых линиях, экспрессирующих высокие или низкие количества РНК сМЕТ, обозначенные сМЕТ-сверх и сМЕТ-низкий соответственно. Такие результаты согласуются с данными о том, что соединение I ингибирует многочисленные онкогенные киназы в опухолевых клетках. Влияние соединения I в комбинации с лапатинибом на ингибирование клеточного роста на клеточных линиях с амплификацией сМЕТ и HER. Как иллюстрируется табл. 2, лапатиниб сам по себе дает средние значения IC50 0,12 и 0,11 (в присутствии и в отсутствие HGF соответственно) в клеточной линии опухоли молочной железы ВТ 474 с низким сМЕТ и HER2+, тогда как соединение I само по себе дает средние значения IC50 4,97 мкМ (сHGF) и 4,90 мкМ (без HGF). Такой результат не является неожиданным, поскольку лапатиниб, в отличие от соединения I, известен как эффективный ингибитор амплифицированного ErbB-2 (HER амп.+). В комбинации лапатиниб и соединение I проявляют либо аддитивный эффект с учетом CI 0,95 без HGF, либо синергический эффект с учетом CI 0,71 с HGF, и усиленное ингибирование клеточного роста при более высоких концентрациях (фиг. 3) в клеточной линии молочной железыВТ 474. Для сравнения, эффект ингибирования клеточного роста в клеточной линии опухоли пищевода с совместно амплифицированными сМЕТ и HER2 (пищев. ОЕ 33) комбинацией лапатиниба и соединения I является заметным и неожиданным. Как следует из табл. 2 и фиг. 1, ОЕ 33 проявляет резистентность к лапатинибу (IC50=6,5 мкМ без HGF, 10 мкМ с HGF) и умеренную чувствительность к соединению I(IC50=0,42 мкМ без HGF, 0,40 мкМ с HGF), самому по себе. Однако комбинация лапатиниба с соединением I проявляет устойчивый синергический эффект (с учетом как CI, так и EOHSA) ингибирования клеточного роста в клетках опухоли пищевода ОЕ 33 в присутствии и в отсутствие HGF. Подобным образом,как показано в табл. 2 и на фиг. 1, NCI-H1573, клеточная линия опухоли легкого с сМЕТ и EGFR совместной амплификацией резистентна к лапатинибу и умеренно чувствительна к соединению I при раздельном введении; однако комбинирование двух ингибиторов улучшает эффективность (более низкие значения IC50) и повышает активность ингибирования клеточного роста (синергизм, основано на EOHSA). Хотя и без теоретического обоснования, данные результаты означают, что сМЕТ и HER могут влиять друг на друга ("перекрестные искажения") и приводить к отклонениям от ингибирования роста, обеспеченного ингибитором HER или ингибитором сМЕТ по отдельности, и что комбинация лапатиниба с соединением I преодолевает резистентость в опухолевых клетках с сМЕТ и HER совместно амплифицированными. Таблица 2 Влияние комбинации соединения I с лапатинибом на ингибирование клеточного роста, на опухолевых клеточных линиях с совместной амплификацией генов как сМЕТ, так и HER1 или HER2 Влияние соединения I в комбинации с лапатинибом на ингибирование клеточного роста на клеточных линиях с амплификацией, мутацией или сверхэкспрессией сМЕТ. Как показано в табл. 3, комбинация лапатиниба и соединения I проявляет синергические эффекты сCI0,9 в клетках опухолей молочной железы, легкого, желудка, головы и шеи, яичников и кожи с амплифицированным, мутированным или сверхэкспрессированным сМЕТ. Анализ EOHSA подтверждает синергизм во всех случаях, за исключением N87 без HGF и Н 1993 в присутствии или в отсутствие HGF. В каждом из указанных исключений отдельный агент, лапатиниб или соединение I очень активен сам по себе и эффект комбинации является аддитивным. Неожиданно, что, как показывает табл. 3, HGF снижает эффективность ингибирования клеточного роста лапатинибом в опухолевых клетках (HER2+: N87, Н 2170 и НСС 1954; HER1+: SCC15, HN5 и А 431) с HER1/HER2 амплифицированным и сверхэкспрессированным СМЕТ. Кроме того, комбинирование лапатиниба с соединением I не только превосходит эффект HGF, но также снижает чувствительность, в особенности в клеточных линиях Н 2170, НСС 1954, SCC15, HN5 и А 431, в присутствии и в отсутствиеHGF. Напротив, HGF не снижает активность лапатиниба в ВТ 474 (табл. 2) и KPL-4 (табл. 3), двух HER2 амплифицированных клеточных линиях опухолей молочной железы с низкой экспрессией РНК сМЕТ или экспрессией белка. Эффект HGF иллюстрируется фиг. 2 для N87. Фиг. 2 (левое поле, ингибирование клеточного роста с использованием метки) показывает, что в отсутствие HGF N87 высокочувствительна к лапатинибу, взятому в отдельности (IC50=0,05 мкм) или в комбинации с соединением I при соотношении 1:1 моль-намоль. Напротив, в присутствии HGF N87 является нечувствительной к лапатинибу (IC50=4,80 мкМ), довольно чувствительной к комбинации лапатиниба и соединения I (IC50=0,05 мкМ). Фиг. 2 (правое поле,анализ вестерн-блоттинг с использованием метки) также показывает, что комбинация лапатиниба и соединения I ингибирует фосфорилирование HER2, HER3 и сМЕТ и ослабляет клеточную передачу сигнала pAKT и pERK, что соответствует ингибированию клеточного роста как в присутствии, так и в отсутствие HGF. Табл. 3 и фиг. 2 соответствуют предшествующим открытиям, основанным на утверждении, чтоHGF активирует сМЕТ. Приведенные выше результаты также указывают на то, что HGF-опосредованная активация сМЕТ может влиять на HER и снижать ингибирование роста ингибитором HER. Указанные результаты демонстрируют, что комбинирование соединения I с лапатинибом может обеспечивать более эффективную терапию опухолевых клеток со сверхэкспрессией сМЕТ и амплифицированным HER. Таблица 3 Влияние комбинации соединения I и лапатиниба на ингибирование клеточного роста, на опухолевых клеточных линиях с амплификацией, мутацией или сверхэкспрессией СМЕТ На основе экспрессии белка. Влияния комбинации соединения I и лапатиниба на клеточные линии опухолей с резистентным к лапатинибу HER+ BT474-J4, JIMT1 и HN5C12 являются клеточными линиями с резистентными к лапатинибу HER2+ или HER1+. JIMT-1, наследственную, резистентную к лапатинибу или трастузумабу линию, получают от пациента, не реагирующего на трастузумаб. Как BT474-J4, так и HN5C12 представляют собой клоны с приобретенной резистентностью к лапатинибу. Как показывает табл. 4, комбинация соединения I с лапатинибом проявляет синергизм (по анализу EOHSA) в ингибировании клеточного роста во всех трех резистентных к лапатинибу опухолевых клеточных линиях. Кроме того, как показывает фиг. 3, соединение I восстанавливает чувствительность к лапатинибу в резистентных клетках BT474-J4 и повышает активность лапатиниба как в ВТ 474 (чувствительных к лапатинибу), так и BT474-J4 (резистентных к лапатинибу и трастузумабу) клетках. Синергический эффект соединения I и лапатиниба в комбинации обнаружен не только в ингибировании клеточного роста, но также в индукции апоптоза, как иллюстрирует фиг. 4. Как показывает фиг. 4, комбинирование соединения I и лапатиниба повышает как фрагментацию ДНК, так и активацию каспаз 3/7, признаки апоптоза как в ВТ 474, так и в BT474-J4 клетках; однако введенные раздельно соединение I при высокой концентрации или лапатиниб индуцируют апоптоз только в ВТ 474, чувствительной к лапатинибу, линии. Таблица 4 Влияние соединения I в комбинации с лапатинибом на ингибирование клеточного роста на клеточных линиях опухолей с резистентным к лапатинибу HER+ Эффекты доз соединения I в клеточных линиях BT474-J4 устанавливают с использованием фиксированной концентрации лапатиниба при 1 мкМ. Как показывает фиг. 5 А, установлено, что IC50 соединения I равно 0,11 мкМ при концентрации лапатиниба 1 мкМ. Без лапатиниба IC50 соединения I равно 3 мкМ, тогда как лапатиниб сам по себе при 1,0 мкМ проявляет минимальный эффект (ингибирование 50%). Далее, как показывает фиг. 5 В, индукция апоптоза также установлена, когда соединение I и лапатиниб комбинированы в тех же условиях дозирования. Восстановление чувствительности к лапатинибу путем ингибирования соединением I AXL в клетках BT474-J4. Как неожиданно установлено, AXL высоко экспрессируется и фосфорилируется в BT474-J4, но не экспрессируется в клетках ВТ 474, как определено анализом вестерн-блоттинга (иллюстрируемым фиг. 6) и подтверждается количественным ОТ-ПЦР. Сообщается, что AXL сверхэкспрессируется в некоторых злокачественных опухолях, включая злокачественные новообразования толстой кишки (Craven et al., IntAXL в культуре тканей вызывает онкогенную трансформацию. Таким образом, комбинация по данному изобретению полезна для лечения всех AXL-сверхэкспрессирующих опухолей. Далее, как показано на фиг. 6, лапатиниб сам по себе ингибирует фосфорилирование HER2 как в ВТ 474, так и BT474-J4 клетках; однако лапатиниб ингибирует передачу в нисходящем потоке сигнала фосфорилирования AKT и ERK и снижает уровень циклина D1 только в ВТ 474, но не в BT474-J4 клетках. С другой стороны, соединение I, само по себе, ингибирует фосфорилирование AXL, но не передачу в нисходящем потоке сигнала фосфорилирования AKT в BT474-J4 клетках. На удивление, комбинация соединения I и лапатиниба существенно ингибирует фосфорилирование HER2, AXL, AKT и ERK и снижает уровень циклина D1 в BT474-J4 клетках. Эффект вышеуказанного ингибирования клеточной передачи сигнала очень хорошо коррелируется с устойчивым синергизмом, обнаруживаемым комбинацией соединения I и лапатиниба в ингибировании клеточного роста и индукции апоптоза в BT474-J4. Такие результаты, равно как результаты, приведенные в табл. 5 и на фиг. 7, убедительно доказывают, что 1) сверхэкспрессия AXL лежит в основе механизма резистентности к лапатинибу или трастузумабу и 2) комбинация соединения I и лапатиниба или трастузумаба преодолевает резистентность указанных опухолевых клеток. Влияние комбинации соединения I и трастузумаба на опухолевую клеточную линию с HER2+. Трастузумаб представляет собой гуманизированное моноклональное антитело, которое связывается с внеклеточным сегментом рецептора HER2 и ингибирует передачу сигнала от HER2. Как иллюстрируется фиг. 7, трастузумаб сам по себе обнаруживает 40% (без HGF) и 35% (с HGF) ингибирование клеточного роста в клетках ВТ 474 и незначительное ингибирование в клетках ВТ 474-J4, ОЕ-33 и N87 после 5 дней обработки. Как показано в табл. 5, комбинирование соединения I с трастузумабом повышает ингибирование клеточного роста во всех четырех линиях с амплифицированным HER2, как свидетельствует пониженное значение IC50 или синергизм, установленные с использованием EOHSA анализа. Кроме того,результаты демонстрируют преимущество комбинирования соединения I с ингибитором HER2 в опухолевой клеточной линии с амплифицированным HER2. Таблица 5 Влияние соединения I и трастузумаба на ингибирование клеточного роста на опухолевых клеточных линиях с HER2+ Трастузумаб ингибирует максимально 3540 клеточного роста в ВТ 474 после 5 дней обработки. Влияние соединения I и эрлотиниба на опухолевые клеточные линии. Эрлотиниб является ингибитором EGFR и при высоких концентрациях также ингибирует HER2 в клеточной культуре. Эрлотиниб сам по себе не очень активен в большинстве исследуемых опухолевых клеточных линиях. Комбинация соединения I и эрлотиниба проявляет синергизм в ингибировании кле- 13020779 точного роста, как свидетельствуют CI0,9 и подтверждает анализ EOHSA, в клеточных линиях опухолей легкого, головы и шеи, молочной железы, яичников, желудка и эпидермиса, перечисленных в табл. 6. Причем, как иллюстрирует фиг. 8, обнаружено, что клеточная линия опухоли легкого NCI-H1648 является резистентной к эрлотинибу (IC5010 мкМ) и умеренно чувствительной к соединению I(IC50=0,96 мкМ без HGF, 0,40 мкМ с HGF), но высокочувствительной к комбинации эрлотиниба и соединения I. Подобным образом, установлено, что NCI-H1573, клеточная линия опухоли легкого с совместной амплификацией сМЕТ и EGFR является резистентной к эрлотинибу и умеренно чувствительной к соединению I, но более чувствительной к комбинации двух соединений. Полученные результаты указывают на то, что комбинирование эрлотиниба с соединением формулы I может обеспечивать более эффективную обработку указанных опухолевых клеток. Таблица 6 Влияние комбинации соединения I и эрлотиниба на ингибирование клеточного роста на клеточных линиях опухолей молочной железы, толстой кишки, желудка, головы и шеи, легкого, яичников и кожи Влияния комбинации соединения I с лапатинибом или антителом против HER3 на опухолевые клеточные линии со сверхэкспрессией HER3. Клетки MKN45 имеют сМЕТ+ и сверхэкспрессируемый уровень HER3. Как показывают табл. 7 и фиг. 9, HRG снижает чувствительность соединения I к ингибированию клеточного роста (значение IC50 повышается от 20 нМ в отсутствие HRG до 450 нМ в присутствии HRG) и фосфорилированию HER3 в опухолевых клетках MKN45. Неожиданно, что лапатиниб восстанавливает чувствительность соединенияI и проявляет сильный синергизм в ингибировании клеточного роста, как свидетельствуют CI=0,12 и анализ EOHSA, при комбинировании с соединением I в присутствии HRG в MKN45 клетках. В качестве контроля клетки опухоли желудка HS746T с МЕТ+ и низкой экспрессией HER3 остаются чувствительными к соединению I даже в присутствии HRG. Вышеуказанные результаты демонстрируют, что комбинирование соединения I с лапатинибом полезно в случае опухолевых клеток с МЕТ+ и сверхэкспрессиейHER3. Кроме того, комбинирование соединения I с антителом против HER3 (mab3481, моноклональное антитело против человеческого ErbB-3, поставляемое RD Systems, Minneapolis, MN) повышает чувствительность соединения I и оказывает синергический эффект (EOHSA) на ингибирование клеточного роста в клетках MKN45 (табл. 8). Таблица 7 Влияние соединения I в комбинации с лапатинибом на ингибирование клеточного роста в опухолевых клеточных линиях с МЕТ+ и сверхэкспрессией HER3 Таблица 8 Влияние соединения I в комбинации с антителом против HER3 на ингибирование клеточного роста в опухолевых клеточных линиях MKN-45 со сверхэкспрессией HER3 Влияние соединения I и гефитиниба на опухолевые клеточные линии. Гефитиниб является селективным ингибитором HER1. Гефитиниб сам по себе не очень активен в двух испытываемых опухолевых клеточных линиях и проявляет умеренную активность в линии опухоли головы и шеи SCC15. Комбинация соединения I и гефитиниба проявляет синергизм в ингибировании клеточного роста, как свидетельствуют CI0,9 и/или анализ EOHSA, в клеточных линиях опухолей легкого, головы и шеи, представленных в табл. 9. Таблица 9 Влияние комбинации соединения I и гефитиниба на ингибирование клеточного роста при постоянном молярном соотношении 1:1 на клеточных линиях опухолей легкого, головы и шеи ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рака у пациента, включающий введение пациенту терапевтически эффективных количеств: а) соединения формулы I или фармацевтически приемлемой соли указанного соединения; и(b) ингибитора ErbB, который ингибирует рецептор ErbB-1, или ErbB-2, или Erb-3, или их комбинацию; причем опухолевая клетка указанного рака высоко экспрессирует AXL. 2. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы II или фармацевтически приемлемую соль указанного соединения. 3. Способ по п.2, где ингибитор ErbB представляет собой дитозилатную соль или моногидрат дитозилатной соли соединения формулы II. 4. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы III или фармацевтически приемлемую соль указанного соединения. 5. Способ по п.1, где ингибитор ErbB представляет собой соединение формулы IV 6. Способ по п.1, где ингибитор ErbB представляет собой трастузумаб. 7. Способ по п.1, где ингибитор ErbB представляет собой цетуксимаб. 8. Способ по п.1, где ингибитор ErbB представляет собой моноклональное антитело против человеческого ErbB-3. 9. Способ по любому из пп.1-8, где рак представляет собой рак желудка, легкого, пищевода, головы и шеи, кожи, эпидермиса, яичников или молочной железы.
МПК / Метки
МПК: C07D 413/00, C07D 401/00
Метки: способ, использованием, ингибитора, лечения, рака
Код ссылки
<a href="https://eas.patents.su/20-20779-sposob-lecheniya-raka-s-ispolzovaniem-ingibitora-cmet-i-axl-i-ingibitora-erbb.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения рака с использованием ингибитора cmet и axl и ингибитора erbb</a>
Предыдущий патент: Система изоляции зданий снаружи
Следующий патент: Устройство для регулирования нагнетания газа и способы его эксплуатации
Случайный патент: Способ каталитической полимеризации олефинов, реакторная система и ее применение












