Биотинилированные гексадекасахариды, их получение и применение
Номер патента: 12587
Опубликовано: 30.10.2009
Авторы: Дюшоссуа Филипп, Сави Пьер, Петиту Морис, Эрбер Жан-Марк, Эро Жан Паскаль
Формула / Реферат
1. Биотинилированные гексадекасахариды общей формулы (I)
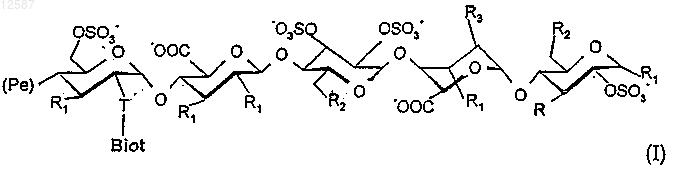
в которой Т обозначает последовательность T1 или Т2 следующих формул:
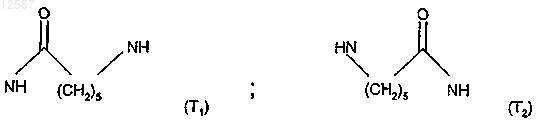
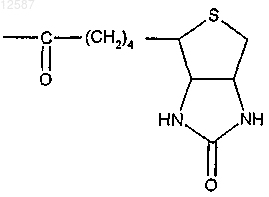
Biot обозначает группу
R обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,
R1 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,
R2 обозначает (C1-C6)алкоксирадикал или радикал -OSO3-,
R3 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-, или
R3 образует мостик -О-СН2-, в котором группа -СН2- соединена с атомом углерода, несущим карбоксильную группу на том же цикле,
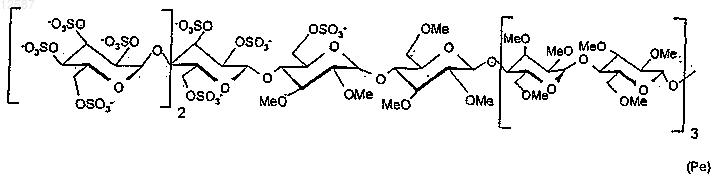
Ре обозначает сахаридную последовательность следующей формулы:
а также их фармацевтически приемлемые соли.
2. Биотинилированные гексадекасахариды по п.1 общей формулы (I), в которой
R обозначает метоксирадикал или радикал -OSO3-,
R1 обозначает метоксирадикал,
R2 обозначает радикал -OSO3-,
R3 обозначает метоксирадикал.
3. Биотинилированные гексадекасахариды по любому из пп.1 или 2, выбранные из
метил(2,3,4,6-тетра-О-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-О-сульфонато-b-D-глюкопиранозил)-(1R4)-(2,3-ди-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R4)-[(2,3,6-три-O-метил-a-D-глюкопиранозил)-(1R4)-О-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R4)]3-(2-[N-(6-биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R4)-(2,3,6-три-О-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3-ди-О-метил-a-L-идопиранозилуроновая кислота)-(1R4)-3-О-метил-2,6-ди-О-сульфонато-a-D-глюкопиранозида, соль натрия;
метил(2,3,4,6-тетра-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-О-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-О-сульфонато-b-D-глюкопиранозил)-(1R4)-(2,3-ди-О-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3,6-три-О-метил-b-D-глюкопиранозил)-(1R4)-[(2,3,6-три-O-метил-a-D-глюкопиранозил)-(1R4)-О-(2,3,6-три-O-метил-b-D-глюкопиранозил)-(1R4)]3-(2-[N-(6-биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3-ди-O-метил-b-D-глюкопиранозилуроновая кислота)-(1R4)-(2,3,6-три-О-сульфонато-a-D-глюкопиранозил)-(1R4)-(2,3-ди-О-метил-a-L-идопиранозилуроновая кислота)-(1R4)-2,3,6-три-О-сульфонато-a-D-глюкопиранозида, соль натрия.
4. Фармацевтические композиции, содержащие в качестве активного начала гексадекасахарид по любому из пп.1-3, необязательно, в сочетании с одним или несколькими соответствующими инертными эксципиентами.
5. Применение фармацевтических композиций согласно п.4 для получения лекарственного средства, пригодного для лечения различных патологий, приводящих к изменению гомеостаза в системе свертывания крови, возникающему при нарушениях сердечно-сосудистой и церебрально-сосудистой системы, таких как тромбоэмболические нарушения, ассоциированные с атеросклерозом и диабетом, такие как нестабильная стенокардия, геморрагический инсульт, рестеноз после ангиопластики, эндартериэктомия, установка сосудистых эндопротезов; или тромбоэмболические нарушения, ассоциированные с ретромбозом после тромболиза, с инфарктом, деменцией ишемического происхождения, с заболеваниями периферических артерий, с гемодиализом, с аурикулярными фибрилляциями или при использовании сосудистых протезов для аортокоронарного шунтирования; пригодного также для лечения или предотвращения тромбоэмболических патологий венозного происхождения, таких как легочная эмболия, и пригодного для лечения или профилактики тромбоэмболических осложнений, возникающих в результате хирургических операций, роста опухолей или нарушений свертывания крови, вызванных бактерийными, вирусными или ферментными активаторами.
6. Применение биотинилированных гексадекасахаридов по любому из пп.1-3 для получения лекарственного средства, пригодного для покрытия протезов.
7. Применение биотинилированных гексадекасахаридов по любому из пп.1-3 для получения лекарственного средства, пригодного в качестве адъювантов при эндартериэктомии, проводимой с использованием пористых баллончиков.
8. Способ использования авидина или стрептавидина, отличающийся тем, что он позволяет нейтрализовать антитромботическую активность биотинилированных гексадекасахаридов по любому из пп.1-3.
9. Применение авидина или стрептавидина для получения лекарственных средств, предназначенных для нейтрализации антитромботической активности биотинилированных гексадекасахаридов по любому из пп.1-3.
Текст
012587 Настоящее изобретение относится к новым синтезированным биотинилированным гексадекасахаридам, обладающим фармакологическим антикоагулирующим и антитромботическим действием гепарина. Гепарин катализирует, в частности, посредством антитромбина III (AT III) ингибирование двух ферментов, которые задействованы в каскадном процессе коагуляции крови, таких как фактор Ха и фактор IIа (или тромбин). Препараты на основе низкомолекулярного гепарина (НВРМ), содержащего звенья,образованные 4-30 моносахаридами, имеют свойство воздействовать более селективно на фактор Ха, чем на тромбин. Известно, что для ингибирования фактора Ха требуется фиксация гепарина на AT III через домен связывания антитромбина (Домен-А), а для ингибирования фактора IIa требуется фиксация с AT III через Домен-А, а также с тромбином через менее четкий домен связывания (Домен-Т). Известны синтезированные олигосахариды, соответствующие области Домен-А гепарина. Они описаны, например, в патентах ЕР 84999 и ЕР 529715, в заявке на патент, опубликованной под номером WO 99/36428 и в публикации Bioorg. Med. Chem. (1998), 6, стр. 1509-1516. Эти синтезированные олигосахариды способны селективно ингибировать через AT III фактор Ха свертывания крови, не оказывая никакого действия на тромбин. Они проявляют антитромботическую активность при венозном тромбозе. Синтезированные олигосахариды, способные ингибировать тромбин и фактор Ха путем активацииAT III, описаны в заявках на патент, опубликованных под номерами WO 98/03554 WO 99/36443. В этих заявках на патент описываются новые биологически активные сульфатированные или алкилированные производные полисахаридов. Они являются, в частности, антикоагулянтами и антитромботическими агентами. Было показано, в частности, что эти сульфатированные и алкилированные полисахариды могут являться сильными антитромботическими агентами и антикоагулянтами в зависимости от положения алкильных и сульфатных групп на углеводном скелете. В целом, было выяснено, что, создавая полисахаридную последовательность, можно с точностью модулировать активность типа GAGs с целью получения высокоактивных продуктов, обладающих фармакологическими антикоагулирующими и антитромботическими свойствами гепарина. По сравнению с гепарином преимущество синтетических олигосахаридов состоит в том, что они имеют определенную структуру и не взаимодействуют с фактором 4 тромбоцитов, который является причиной тромбоцитопении, вызываемой гепарином. Однако использование в терапии некоторых продуктов, описанных в заявках на патент, опубликованных под номерами WO 98/03554 и WO 99/36443, и в патенте ЕР 528715, должно происходить с осторожностью, особенно, если у них большой период полураспада. Если указанные продукты использовать с целью предотвращения или лечения тромбоза, то следует восстановить и поддерживать жидкое состояние крови, избегая при этом возникновения кровотечения. Так, известно, что из-за какой-либо случайной причины у пациента, находящегося на лечении, может начаться кровотечение. Может также возникнуть необходимость хирургического вмешательства у больного, проходящего антитромботическое лечение. Кроме того, в процессе некоторых хирургических действий могут быть применены высокие дозы антикоагулянтов для того, чтобы приостановить свертывание крови, и в конце операции возникает необходимость нейтрализовать их действие. Следовательно,важно располагать антитромботическими агентами, которые можно было бы нейтрализовать в любой момент для прекращения их антикоагулирующего действия. Тем не менее, известные синтезированные олигосахариды, описанные выше, не могут быстро нейтрализоваться известными антидотами гепарина или НВРМ, в том числе сульфатом протамина. Настоящее изобретение относится к новым биотинилированным синтетическим гексадекасахаридам, имеющим структуру, близкую к структуре соединений, описанных в заявке на патент, опубликованной под номером WO 02/24754. Гексадекасахариды согласно изобретению, также как и некоторые соединения, описанные в документе WO 02/24754, связываются ковалентной связью с производным биотина (гексагидро-2-оксо-1 Н-тиено[3,4-d]имидазол-4-пентановая кислота) через спейсер - последовательность формулы (T1) или (Т 2), в том виде, как она определена в настоящей заявке - и в этой связи обладают преимуществом быстро нейтрализоваться специфическим антидотом в срочных ситуациях. Этим специфическим антидотом является авидин ("The Merck index", Twelfth edition, 1996, M.N. 920, стр. 151152) или стрептавидин, два белка с тетрамерной структурой, масса которых соответственно равна 66000 и 60000 Дальтонам и которые имеют высокое сродство с биотином. Однако неожиданно оказалось, что длина спейсера, связывающего производное биотина с гексадекасахаридной цепью, а также положение биотина в сахаридном звене являются факторами, влияющими на эффективность нейтрализации специфическим антидотом, в частности, например авидином. Так,соединения гексадекасахариды согласно изобретению обладают гораздо более высокой способностью к нейтрализации под действием специфического антидота, чем сахариды, описанные в заявке на патент,опубликованной под номером WO 02/24754, и это благодаря спейсеру контролируемой длины и положению биотина на сахаридном звене. Настоящее изобретение относится к биотинилированным гексадекасахаридам общей формулы I:R обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,R1 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,- R2 обозначает (C1-C6)алкоксирадикал или радикал -OSO3-,R3 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал, или радикал -OSO3-, или же R3 образует мостик -О-СН 2-, в котором группа -СН 2- соединена с атомом углерода, несущим карбоксильную группу на том же цикле,- Ре обозначает сахаридную последовательность следующей формулы: а также к их фармацевтически приемлемым солям. Полисахаридные части состоят из алкилированных моносахаридных звеньев, не несущих заряда,и/или частично заряженных, и/или полностью заряженных. Звенья, несущие заряд, или звенья, не несущие заряда, могут распределяться по всей длине цепи или же, напротив, могут быть сгруппированы в участки сахаридной цепи, несущие заряд, или в участки, не несущие заряда. В настоящем изобретении принимается обозначение конформаций как 1 С 4 для L-идуроновой кислоты и как 4C1 для D-глюкуроновой кислоты, но следует отметить, что обычно конфорамация моносахаридных звеньев в растворе изменчива. Так, L-идуроновая кислота может иметь конформацию 4C1, 2S0 или 4C1. В объем изобретения входят также кислотные формы гексадекасахаридов или какие-либо их фармацевтически приемлемые соли. В кислотной форме группы -COO- и -SO3- находятся соответственно в виде групп -СООН и -SO3H. Под фармацевтически приемлемой солью полисахаридов согласно изобретению подразумевается полисахарид, в котором одна или несколько групп -COO- и/или -SO3- соединены ионной связью с фармацевтически приемлемым катионом. Предпочтительными солями согласно изобретению являются такие, в которых катион выбирается из катионов щелочных металлов, более предпочтительно из катиона Na+ илиK +. Соединения формулы (I), указанные выше, включают также соединения, в которых один или несколько атомов водорода или углерода заменены радиоактивным изотопом этих атомов, например тритием или углеродом С 14. Такие меченые соединения используют при исследовательских работах, при изучении метаболизма или фармакокинетики, в биохимических исследованиях в качестве лиганд. В объеме данного изобретения подразумевают под(C1-C6)алкоксирадикалом: -О-алкильный радикал, в котором алкильная группа является алифатической, насыщенной линейной или разветвленной группой, имеющий цепь из 1-6 атомов углерода. Примерами алкильных радикалов могут быть метильный, этильный, пропильный, изопропилбутильный, изобутильный, трет-бутильный радикалы. В качестве примера (C1-C6)алкоксирадикалов можно назвать метокси-, этоксирадикалы; спейсером Т: последовательность следующих формул Т 1 или Т 2: Производные биотина доступны в продаже (каталог "Pierce" 1999-2000, стр.62-81). В соответствии с одним из своих предпочтительных аспектов изобретение относится к биотинилированным гексадекасахаридам общей формулы (I), в которойR обозначает метоксирадикал или радикал -OSO3-,R1 обозначает метоксирадикал,R2 обозначает радикал-OSO3-,R3 обозначает метоксирадикал. В соответствии с другим особенно предпочтительным аспектом изобретение относится к следующим биотинилированным гексадекасахаридам: метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоDглюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метил-6-ОсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-ОметилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-(2-[N-(6 биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-ОметилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-O-метилL-идопиранозилуроновая кислота)-(14)-3-О-метил-2,6-ди-О-сульфонато-D-глюкопиранозид), соль натрия; метил(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоDглюкопиранозил)-14-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метил-6-ОсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил-(14)-[(2,3,6-три-ОметилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-(2-[N-(6 биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-ОметилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонатоDглюкопиранозид), соль натрия. Принцип способа получения соединений согласно изобретению основан на использовании исходных ди- или олигосахаридных синтонов, получаемых согласно способам, описанным в литературе. В частности, можно сослаться в этой связи на патенты или заявки на патент ЕР 300099, ЕР 529715, ЕР 621282 и ЕР 649854, а также документ С. van Boeckel, M Petitou, Angew. Chem. Int. Ed. Engl. (1993), 32,стр. 1671-1690. Эти синтоны затем сочетаются друг с другом с образованием полностью защищенного эквивалента полисахарида согласно изобретению. Этот защищенный эквивалент затем превращают в соединение согласно изобретению. Один из указанных выше исходных синтонов содержит одну особую защищенную функциональную группу, которая впоследствии дает возможность ввести биотин или его производное, например, одну аминогруппу, скрытую в форме азидогруппы или защищенную в форме Nфталимидогруппы. В упомянутых выше реакциях сочетания ди- или олигосахаридный донор, активированный по аномерному углероду, взаимодействуют с ди- или олигосахаридным акцептором, имеющим свободную гидроксильную группу. Настоящее изобретение относится к способу получения соединений формулы (I), отличающемуся тем, что на первой стадии получают полностью защищенный эквивалент желаемого гексадекасахарида формулы (I), содержащий защищенный пентасахаридный предшественник, несущий, в частности, соответственно защищенную аминогруппу для введения, в дальнейшем биотина или его производного, причем этот защищенный пентасахаридный предшественник сам удлиняется за счет защищенного предшественника полисахардного фрагмента Ре; на второй стадии вводят группы, несущие отрицательный заряд, и/или их высвобождают; на третьей стадии удаляют защиту с аминогруппы, затем вводят биотин или его производное. Синтез пентасахарида, к которому прививают биотин или его производное, осуществляют в соответствии с методами, описанными, в частности, в заявках на патент, опубликованных под номерамиWO98/03554 и WO99/36443, а также в литературе (см.выше). Синтез полисахаридной части, предшественника Ре, осуществляют в соответствии с реакциями, хорошо известными специалисту, с использованием способов синтеза олигосахаридов (G.J.Boons, Tetrahedron, (1996), 52, стр. 1095-1121, WO98/03554 и WO99/36443), или олигосахарида, если олигосахарид, являющийся донором гликозидной связи, сочетается с олигосахаридом, являющимся акцептором гликозидной связи, с получением другого олигосахарида, размер которого равен сумме размеров двух реакци-3 012587 онноспособных соединений. Эта операция повторяется до получения соединения формулы (I). Природу и профиль заряда конечного желаемого соединения определяет природа химических компонентов, участвующих на различных стадиях синтеза, в соответствии с правилами, хорошо известными специалисту. В этой связи можно назвать, например, публикацию С. van Boeckel, V. Petitou, Angew. Chem. Int. Ed.Engl. (1993), 32, стр. 1671-1690 или H.Paulsen, "Advances in selective chemical syntheses of complex oligosaccharides" Angew. Chem. Int. Ed. Engl. (1982), 21, стр.155-173. Соединения согласно изобретению получают из их полностью защищенных полисахаридных предшественников с использованием следующей последовательности реакций: спиртовые функциональные группы превращают в О-сульфогруппы и в карбоновых кислотах снимают защиту путем удаления защитных групп, которые были использованы при формировании скелета соединения, затем вводят сульфогруппы,снимают защиту с аминогрупп для введения биотина или его производного,производное биотина вводят с помощью реакции классического сочетания амина с кислотой. Соединения согласно изобретению могут быть, естественно, получены с использованием различных путей синтеза олигосахаридов, известных специалисту. Способ, описанный выше, является предпочтительным способом согласно изобретению. Однако соединения формулы (I) могут быть получены другими способами, хорошо известными в химии сахаров,описанными, например, в работе "Monosaccharides, Their chemistry and their roles in natural products",P.M.Collins и R.J.Ferrier, J.WileySons, (1995) и в G.J.Boons, Tetrahedron, (1996), 52, стр. 1095-1121. Так, пентасахариды Ре могут быть получены из дисахаридных синтонов способом, описанным в публикации С. van Boeckel, V. Petitou, Angew. Chem. Int. Ed. Engl. (1993), 32, стр. 1671-1690. Защитные группы, используемые в способе получения соединений формулы (I), являются группами, широко используемыми в химии сахаров и указанными, например, в "Protective Groups in OrganicSynthesis", (1981), TW Greene, John WileySons, New-York. Защитные группы выбирают преимущественно, например, из ацетильных групп, галогенметильных, бензоильных, левулиниловых, бензильных, замещенных бензильных, тетрагидропиранильных, аллильных, пентенильных, трет-бутилдиметилсилильных (tBDMS) или триметилсилилэтильных групп. Активирующими группами являются классические группы, используемые в химии сахаров, как указано, например, G.J.Boons, Tetrahedron, (1996), 52, стр. 1095-1121. Эти активирующие группы выбирают, например, из остатков имидатов, тиогликозидов, пентенилгликозидов, ксантатов, фосфитов или галогенидов. Что касается производного биотина и способа связывания его с олигосахаридом, а также природы производного биотина, то в химической литературе предлагаются другие пути, осуществление которых основано на выборе защитных групп, известных специалисту. Предпочтительно, используют аминогруппу, или же тиоловую группу, или же карбоксильную группу, или же альдегидную группу, которая вступает в реакцию с производным биотина, содержащим реакционноспособную группу типа активированного сложного эфира, малеимида, иодацетила или первичного амина, причем реакцию осуществляют в условиях, описанных в литературе (Savage et al., "Avidin-Biotin Chemistry: A Handbook"; (1992), PierceChemical Company). Способ, описанный выше, позволяет получить соединения согласно изобретению в виде солей. Для получения соответствующих кислот, соединения согласно изобретению в виде соли вводят в контакт с катионообменной смолой, находящейся в кислотной форме. Соединения согласно изобретению в виде кислот могут быть затем нейтрализованы основанием для получения желаемой соли. Для получения солевых форм соединений формулы (I) можно использовать любое минеральное или органическое основание, которое образует с соединениями формулы (I) фармацевтически приемлемые соли. Предпочитают использовать в качестве оснований гидроксид натрия, калия, кальция или магния. Натриевые и кальциевые соли соединений формулы (I) являются предпочтительными солями. Соединения согласно изобретению прошли биохимические и фармакологические испытания. 1. Измерение противофакторной активности в отношении фактора IIa и фактора Ха. Циркуляторная активность соединений согласно изобретению может быть измерена с помощью их противофакторной активности в отношении фактора IIа и фактора Ха по методу, описанному Herbert etal., Thromb Haemost., (2001), 85 (5), стр. 825-60. Соединения согласно изобретению вводили крысе в вену(IV) или под кожу(SC). Внутривенная (IV) инъекция авидина привела к значительному снижению циркуляторной концентрации соединения согласно изобретению (более чем на 70%). Например, циркуляторная концентрация соединения примера 1 после внутривенной инъекции с концентрацией 100 нмол/кг уменьшилась на 88% (уменьшение измеряли посредством активности против фактора Ха) и на 91% (уменьшение измеряли посредством активности против фактора IIa) спустя 2 мин после внутривенного введения авидина (10 мг/кг/625 нмол/кг). Циркуляторная концентрация соединения примера 2 после внутривенной инъекции с концентраци-4 012587 ей 100 нмол/кг уменьшилась на 76% (уменьшение измеряли посредством активности против фактора Ха) и на 89% (уменьшение измеряли посредством активности против фактора IIa) спустя 5 мин после внутривенного введения авидина (10 мг/кг/625 нмол/кг). Такой же результат ингибирования в отношении двух видов активности наблюдался и при подкожном введении (SC) соединений примеров 1 и 2. 2. Измерение общей антитромботической активности и нейтрализация авидином. Общая антитромботическая активность соединений согласно изобретению и нейтрализация их активности изучались на модели венозного тромбоза, вызванного путем вливания тканевого фактора с последующим стазированием полой вены у крысы, в соответствии с тем, как это описано Herbert et al.,Blood, (1998), 91, стр.4197-4205. а) Измерение общей антитромботической активности. Соединения согласно изобретению являются сильными ингибиторами тромбоза (значение IC50 ниже 50 нМ). Например, соединения примеров 1 и 2 показывают значение IC50 на этой модели соответственно равное 3 и 9,9 нМ после внутривенного введения этих соединений. Например, снижение массы тромба, вызванное соединением примера 1 (при концентрации 30 нмол/кг) после внутривенной инъекции 3 мг/кг/208 нмол/кг авидина снова привело массу тромба к контрольному уровню. б) Нейтрализация авидином: тест на кровотечение у крысы. Эффект соединений согласно изобретению оценивали в тесте на кровотечение у крысы (Herbert etal., Blood, (1998), 91, стр.4197-4205). Эти соединения показывали высокую антикоагулирующую активность и в этой связи увеличивали продолжительность кровотечения на моделях животных. Авидин оказывал нейтрализующий эффект на соединения согласно изобретению в отношении кровотечения. Например, продолжительность кровотечения, вызванного у крысы введением 30 нмол/кг соединения примера 1, снова установилась на контрольном уровне после внутривенного введения авидина (3 мг/кг; 208 нмол/кг). Например, продолжительность кровотечения, вызванного у крысы введением 100 нмол/кг соединения примера 2, снова установилась на контрольном уровне после внутривенного введения авидина (10 мг/кг; 625 нмол/кг). Таким образом, настоящее изобретение относится также к способу использования авидина или стрептавидина, отличающемуся тем, что он позволяет нейтрализовать полисахариды согласно изобретению. Авидин или стрептавидин могут использоваться для получения лекарственных средств, предназначенных для нейтрализации полисахаридов согласно изобретению. Благодаря своей биохимической и фармацевтической активности олигосахариды согласно изобретению представляют собой очень большой интерес как лекарственные средства. Так, токсичность олигосахаридов идеально совместима с подобным использованием. Соединения очень стабильны и, следовательно, особенно подходят для того, чтобы представлять активное начало в специфических фармацевтических препаратах. Соединения могут использоваться при различных патологиях, приводящих к изменению гомеостаза в системе свертывания крови, возникающему, в частности, при нарушениях сердечно-сосудистой и церебрально-сосудистой системы, таких как тромбоэмболические нарушения, ассоциированные с атеросклерозом и диабетом, такие как нестабильная стенокардия, геморрагический инсульт, рестеноз после ангиопластики, эндартериэктомия, установка сосудистых эндопротезов; или тромбоэмболические нарушения, ассоциированные с ретромбозом после тромболиза, с инфарктом, деменцией ишемического происхождения, с заболеваниями периферических артерий, с гемодиализом, с аурикулярной фибрилляцией или при использовании сосудистых протезов для аорто-коронарного шунтирования. Эти продукты могут быть использованы также для лечения или предотвращения тромбоэмболических патологий венозного происхождения, таких как легочная эмболия. Они могут быть использованы для профилактики или для лечения тромбоэмболических осложнений, возникающих, например, после хирургических операций, в результате роста опухолей или нарушений свертывания крови, вызванных бактерийными, вирусными или ферментными активаторами. В случае их использования при установке протезов, соединения согласно изобретению могут покрыть протезы и придать им гемосовместимость. В частности, они могут закрепляться на внутрисосудистых протезах (стенах). В этом случае соединения согласно изобретению можно, при необходимости, химически модифицировать путем прививки соответствующей боковой цепи на невосстанавливающем или восстанавливающем конце цепи как описано в документе ЕР 649854. Соединения согласно настоящему изобретению могут также использоваться в качестве адъювантов при эндартериэктомии, осуществляемой с помощью пористых баллончиков. Соединения согласно изобретению могут также использоваться для получения лекарственных средств, предназначенных для лечений вышеуказанных заболеваний. Согласно другому аспекту настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного начала синтетический полисахарид согласно изобретению или одну из его фармацевтически приемлемых солей, необязательно в сочетании с одним или несколькими соответ-5 012587 ствующими инертными эксципиентами. Указанные эксципиенты выбирают с учетом фармацевтической формы выпуска и желаемого способа введения: орального, подъязычного, подкожного, внутримышечного, внутривенного, чрезкожного,через слизистую, местным нанесением или ректальным путем. Активное начало может также представлять собой комплекс с циклодекстрином, например с ,илициклодекстрином, 2-гидроксипропилциклодекстрином или метилциклодекстрином. Активное начало может также высвобождаться из баллончика, содержащего это активное начало,или из сосудистого эндоэкстензора, вводимого в кровеносные сосуды. В этих случаях фармакологическая эффективность активного начала не нарушается. Каждая стандартная доза содержит активное начало в количестве, соответствующем ежедневной дозировке, установленной для достижения профилактического или желаемого терапевтического эффекта. Каждая стандартная доза может содержать от 0,1 до 100 мг активного начала, предпочтительно 0,5-50 мг. Эти дозы антикоагулирующих соединений могут быть нейтрализованы дозами авидина или стрептавидина, составляющими от 1 до 1000 мг, вводимыми путем быстрой внутривенной инъекции или путем перфузии. Соединения согласно изобретению могут также использоваться в сочетании с одним или несколькими другими активными началами, пригодными для данного терапевтического лечения, с такими как,например, антитромботические, антикоагулирующие, антиаггрегирующие агенты, такие как, например,дипиридамол, аспирин, тиклопидин, клопидогрел или антагонисты комплекса гликопротеин IIb/IIIa. Следующие способы, синтезы и схемы иллюстрируют получение различных промежуточных соединений, пригодных для получения полисахаридов согласно изобретению. Нижеследующие примеры получения гексадекасахаридов иллюстрируют изобретение, но не ограничивают его. Были использованы следующие сокращения:Rf = время удержания, измеренное с помощью ССМ, по отношению к объему мигрирующего растворителя; В последующем описании синтезы и примеры получения соединений согласно изобретению, подробно изложены в качестве иллюстрации. Подготовительные синтезы Схема 1 - синтез моносахарида n4n1 растворяют в 130 мл смеси N,N-диметилформамид/вода [4/1 (об./об.)], затем добавляют азид натрия(22,8 г, 350 ммол). Реакционную среду нагревают при 120 С в течение 6 ч. После фильтрации на целите фильтрат разбавляют этилацетатом, затем промывают водой. Органическую фазу сушат над сульфатом натрия, фильтруют, затем концентрируют в вакууме. Остаток перекристаллизовывают из смеси этилацетат/циклогексан (20 мл/7 мл) и получают 4,46 г соединения n2 в форме кристаллов. Т.пл.=144 С. Подготовительный синтез 2. Получение 1,6-ангидро-2-азидо-2-дезокси-4-O-п-метоксифенил-3-ОметилD-глюкопиранозы (n3). К охлажденной смеси (0 С) соединения n2 (4,08 г, 13,9 ммол) с метилиодидом (1,1 мл, 15,3 ммол) в безводном N,N-диметилформамиде (40 мл) добавляют в атмосфере аргона небольшими порциями гидрид натрия (1,04 г). Смесь перемешивают в течение 20 ч при комнатной температуре. Избыток гидрида натрия разлагают метанолом. После испарения N,N-диметилформамида остаток поглощают дихлорметаном. Органическую фазу промывают водой, сушат над сульфатом натрия, фильтруют, затем концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [толуол/этилацетат 12/1(об./об.)] и получают 3,57 г соединения n3 в виде белого твердого вещества. Т.пл.=68 С. Подготовительный синтез 3. Получение 1,6-ангидро-2-азидо-2-дезокси-3-O-метилDглюкопирамозы (n4). Раствор соединения n3 (8,0 г, 23,03 ммол) в 130 мл смеси ацетонитрил/вода [9/1 (об./об.)] вводят по каплям в раствор церийаммонийнитрата (86 г, 156,2 ммол) в 390 мл смеси ацетонитрил/вода [9/1(об./об.)]. Смесь перемешивают в течение 40 мин при комнатной температуре, затем разбавляют этилацетатом. Реакционную смесь сушат над безводным сульфатом натрия, фильтруют и концентрируют. Фильтруют через силикагель, чтобы частично удалить остатки церийаммонийнитрата. Для очистки соединения осуществляют ацетилирование с последующим дезацетилированием. Остаток поглощают дихлорметаном (90 мл), затем последовательно добавляют триэтиламин (5,3 мл), диметиламинопиридин(280 мл) и уксусный ангидрид (3,2 мл). Спустя 16 ч реакционную среду разбавляют дихлорметаном (250 мл). Органическую фазу промывают 10% раствором гидросульфата калия, водой, 10% раствором гидрокарбоната натрия, затем водой. Затем органическую фазу сушат над безводным сульфатом натрия,фильтруют, затем концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [толуол/этилацетат 10/1 (об./об.)] и получают 4,9 г продукта в виде белого твердого вещества. Этот твердый продукт растворяют в 80 мл смеси дихлорметан/метанол [1/1 (об./об.)], затем добавляют метилат натрия (544 мг). Смесь перемешивают в течение 35 мин, затем нейтрализуют на смоле Dowex 50WX4 Н+, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией в колонке с силикагелем [толуол/этилацетат 3/2 (об./об.)] и получают 3,9 г соединения n4. [D] = -27 С (С = 1,06, в дихлорметане). Схема 2. Синтез пентасахарида n11 Подготовительный синтез 4. Получение (2,3-ди-О-бензоил-4,6-О-бензилиденD-глюкопиранозил)-(14)-(2,3,6-три-О-бензоилD-глюхолиранозил)-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метил-D-глюкопиранозы (n6). Смесь тиогликозидного соединения n5 (9,00 г, 9,04 ммол), полученного аналогично приготовлению 1, описанному в заявке на патент, опубликованной под номером WO 99/36443, соединения n4,полученного в подготовительном синтезе 3 (1,65 г, 8,22 ммол) и порошкообразного молекулярного сита-7 012587 4 (9,05 г) в толуоле (180 мл) перемешивают в атмосфере аргона в течение 1 ч. Затем смесь охлаждают до -20 С. К реакционной смеси по каплям прибавляют раствор N-иодсукцинимида (2,14 г, 9,5 ммол) и трифторметансульфоновой кислоты (96 мкл, 1,09 ммол) в 47 мл смеси дихлорметан/диоксан [1/1(об./об.)]. Спустя 10 мин реакционную смесь фильтруют на целите, разбавляют дихлорметаном (1000 мл) и последовательно промывают 1 М раствором тиосульфата натрия, 10% раствором гидрокарбоната натрия и водой. Реакционную смесь сушат над безводным сульфатом натрия, затем концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [толуол/этилацетат 5/1 (об./об.)] и получают 9,20 г трисахарида n6. [D] = +44 С (С = 1,30, в дихлорметане). Подготтовительный синтез 5. Получение (4,6-О-бензилиденD-глюкопиранозил)-(14)-(-Dглюкопиранозил)-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n7). К раствору соединения n6 (9,2 г, 8,11 ммол) в диоксане (81 мл) добавляют трет-бутилат калия (1,82 г, 16,2 ммол). Смесь перемешивают 3 ч, затем нейтрализуют на смоле Dowex 50WX4 Н+, фильтруют и концентрируют в вакууме. После хроматографии на колонке с силикагелем [дихлорметан/метанол 8/1(об./об.)] выделяют 5,46 г соединения n7 в виде пенообразной массы. ССМ на силикагеле, дихлорметан/метанол [9/1 (об./об.)]: Rf=0,35; [D] = +38 С (С = 0,84, в дихлорметане). Подготовительный синтез 6. Получение (4,6-О-бензилиден-2,3-ди-О-метилD-глюкопиранозил)(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилDглюкопиранозы (n8). К охлажденной смеси (0) соединения n7 (5,05 г, 8,23 ммол) и метилиодида (3,8 мл, 61,7 ммол) в безводном N,N-диметилформамиде (150 мл) добавляют в атмосфере аргона небольшими порциями гидрид натрия (1,73 г, 72,0 ммол). Смесь перемешивают в течение 20 ч при комнатной температуре. Избыток гидрида натрия разлагают метанолом (8 мл) и реакционную смесь выливают в ледяную воду (400 мл). После экстрагирования этилацетатом органическую фазу промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия, затем концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [дихлорметан/ацетон 7/1, затем 5/1 (об./об.)] и получают 4,8 г соединения n8. [D] = +49 С (С = 1,02, в дихлорметане). ССМ на силикагеле, дихлорметан/метанол [5/1(об./об.)]: Rf=0,45. Подготовительный синтез 7. Получение (2,3-ди-О-метилD-глюкопирамозил)-(14)-(2,3,6-три-ОметилD-глюкопиранозил)-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n9). Соединение n8 (5,3 г, 7,75 ммол) растворяют в 60% уксусной кислоте (233 мл) и перемешивают в течение 1 ч 30 мин при 80 С. Смесь концентрируют и выпаривают вместе с толуолом. Остаток очищают хроматографией на колонке с силикагелем [толуол/этанол 4/1 (об./об.)] и получают 5,09 г соединения-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилDглюкопиранозы (n10). К раствору соединения n9 (5,09 г, 8,55 ммол) в дихлорметане (85 мл) прибавляют 1-бензоилокси 1 Н-бензотриазол (2,86 г, 11,97 ммол) и триэтиламин (1,80 мл). Смесь перемешивают в течение 20 ч при комнатной температуре, затем разбавляют дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия, затем водой. Затем органическую фазу сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [толуол/этанол 15/2 (об./об.)] и получают 4,85 г соединения n10. [D] = +43 С (С = 1,06, в дихлорметане). ССМ на силикагеле, толуол/этанол [15/2 (об./об.)]: Rf=0,31. Подготовительный синтез 9. Получение (2,3-ди-О-бензоил-4,6-О-бензилиденD-глюкопиранозил)-(14)-(2,3,6-три-О-бензоилD-глюкопиранозил)-(14)-(6-О-бензоил-2,3-ди-О-метилDглюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-OметилD-глюкопиранозы (n11). Осуществляют реакцию сочетания соединения n10 (4,38 г, 6,26 ммол) с соединением n5 (донором удаляемого гликозила), полученным аналогично приготовлению 1, описанному в заявке на патент, опубликованной под номером WO 99/36443 (11,85 г, 11,9 ммол), согласно принципу работы, описанному в подготовительном синтезе 4, и получают 8,39 г соединения n11. [D]= +61C (С =1,06, в дихлорметане). Подготовительный синтез 10. Получение (4,6-О-бензилиденD-глюкопиранозил)-(14)-(-Dглюкопиранозил)-(14)-(2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n12). Соединение n11 (8,36 г, 5,12 ммол), полученное в подготовительном синтезе 9, превращают в соединение 12 следуя тому же принципу работы, который описан в подготовительном синтезе 5. После хромотографии на колонке с силикагелем получают соединение n2 (4,92 г) в виде стеклообразного вещества. ССМ на силикагеле, дихлорметан/метанол [10/1 (об./об.)]: Rf=0,41. Подготовительный синтез 11. Получение (4,6-О-бензилиден-2,3-ди-О-метилD-глюкопиранозил)(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)(2,3,6-три-О-метилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы(n13). Соединение n12 (4,57 г, 4,54 ммол) превращают в соединение n13 в соответствии с тем же принципом работы, который описан в подготовительном синтезе 6. Сырой продукт очищают методом хроматографии на колонке с силикагелем и получают 4,94 г соединения n13. [D] = +68 С (С = 0,93, в дихлорметане). ССМ на силикагеле, толуол/этанол [8/1 (об./об.)]: Rf=0,39. Подготовительный синтез 12. Получение (2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-триО-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-ОметилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n14). Соединение n13 (4,89 г, 4,48 ммол) превращают в соединение n14 в соответствии с тем же принципом работы, который описан в подготовительном синтезе 7. Сырой продукт очищают методом хроматографии на колонке с силикагелем и получают 4,30 г соединения n14. [D] = +80 С (С = 1,05, в дихлорметане). ССМ на силикагеле, толуол/этанол [4/1 (об./об.)]: Rf=0,31. Подготовительный синтез 13. Получение (6-О-бензоил-2,3-ди-О-метилD-глюкопиранозил)(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)(2,3,6-три-О-метилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы(n15). Соединение n14 (4,26 г, 4,25 ммол) превращают в соединение n15 в соответствии с тем же принципом работы, который описан в подготовительном синтезе 8. Сырой продукт очищают методом хроматографии на колонке с силикагелем и получают 4,33 г соединения n15. [D] = +59C (С = 1,0, в дихлорметане). ССМ на силикагеле, толуол/ацетон [4/3 (об./об.)]: Rf=0,38.(2,3-ди-О-бензоил-4,6-О-бензилиденDглюкопиранозил)-(14)-(2,3,6-три-О-бензоилD-глюкопиранозил)-(14)-(6-О-бензоил-2,3-ди-ОметилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метил-D-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3O-метилD-глюкопиранозы (n16). Осуществляют реакцию сочетания тиогликозида n5 (4,90 г, 4,93 ммол), полученного аналогично приготовлению 1, описанному в заявке на патент, опубликованной под номером WO 99/36443, с соединением n15 (4,55 г, 4,11 ммол), описанным в подготовительном синтезе 13, согласно принципу работы, описанному в предварительном синтезе 4. Остаток, полученный после экстракции, очищают путем хроматографии на колонке с силикагелем и получают 8,07 г соединения n16. [D] = +71 С (С = 0,99, в дихлорметане). Подготовительный синтез 15. Получение (4,6-О-бензилиденD-глюкопиранозил)-(14)-(-Dглюкопиранозил)-(14)-(2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n17). Соединение n16 превращают в соединение n17 в соответствии с принципом работы, описанным в подготовительном синтезе 5. ССМ на силикагеле, дихлорметан/метанол [8/1 (об./об.)]: Rf=0,45. Подготовительный синтез 16. Получение (4,6-О-бензилиден-2,3-ди-О-метилD-глюкопиранозил)(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)(2,3-ди-О-бензоил-4,6-О-бензилиденDглюкопиранозил)-(14)-(2,3,6-три-О-бензоилD-глюкопиранозил)-(14)-(6-О-бензоил-2,3-ди-ОметилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-ОметилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)]2-(14)-1,6-ангидро-2 азидо-2-дезокси-3-О-метилD-глюкопиранозы (n21). Осуществляют реакцию сочетания тиогликозида n5 (3,91 г, 3,93 ммол), полученного аналогично приготовлению 1, описанному в заявке на патент, опубликованной под номером WO 99/36443, с соединением n20 (4,97 г, 3,27 ммол), полученным в подготовительном синтезе 18, осуществляемую согласно принципу работы, описанному в подготовительном синтезе 4. Сырой продукт очищают путем хроматографии на колонке с силикагелем и получают 8,06 г соединения n21. [D] = +77 С (С = 0,92, в дихлорметане). Подготовительный синтез 20. Получение (4,6-О-бензилиденD-глюкопиранозил)-(14)-(-Dглюкопиранозил)-(14)-(2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)]2-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n22). Соединение n21 превращают в соединение n22 в соответствии с принципом работы, описанным в подгтовительном синтезе 5. ССМ на силикагеле, дихлорметан/метанол [9/1 (об./об.)]: Rf=0,34. Подготовительный синтез 21. Получение (4,6-O-бензилиден-2,3-ди-О-метилD-глюкопиранозил)(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)(14)-(2,3,6-три-О-метилD-глюкопиранозил)]3-(14)-1,6-ангидро-2-азидо-2-дезокси-3-О-метилDглюкопиранозы (n23). Соединение n22 превращают в соединение n23 в соответствии с принципом работы, описанным в подготовительном синтезе 6. ССМ на силикагеле, циклогексан/ацетон [1/1 (об./об.)]: Rf=0,44. Подготовительный синтез 22. Получение (2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-триО-метилD-глюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-ОметилD-глюкопиранозил)]3-(14)-1,6-ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы Подготовительный синтез 24. Получение (2,3,4,6-тетра-О-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(6-Обензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-1,6 ангидро-2-азидо-2-дезокси-3-O-метилD-глюкопиранозы (n27). Смесь тиогликозидного соединения n26 (10,1 г, 10,4 ммол), полученного аналогично способу, описанному в приготовлении 36 заявки на патент, опубликованной под номером WO 99/36443, соединения-акцептора n25 (5,02 г, 2,61 ммол), полученного в подготовительном синтезе 23, и порошкообразного молекулярного сита 4 (14,5 г) в толуоле (220 мл) перемешивают в атмосфере аргона в течение 1 ч. Реакционную среду охлаждают до 0 С и в нее вводят раствор N-иодосукцинимида (2,58 г) и трифторметансульфоновой кислоты (366 мкл) в 57 мл смеси дихлорметан/диоксан [1/1 (об./об.)]. Спустя 40 мин смесь фильтруют на целите, разбавляют толуолом, последовательно промывают 1 М раствором тиосульфата натрия, 10% раствором гидрокарбоната натрия и водой. Реакционную смесь сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [дихлорметан/этилацетат/этанол 17/1/1, затем 14/1/1 (об./об./об)] и получают 5,87 г соединения n27. ССМ на силикагеле, дихлорметан/этилацетат/этанол [8/0,5/0,5 (об./об./об)]; [толуол/ацетон 1/1 (об./об.)]: Rf=0,41. Подготовительный синтез 25. Получение (2,3,4,6-тетра-О-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(6-Обензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-1,6 ди-О-ацетил-2-азидо-2-дезокси-3-O-метил-D-глюкопиранозы (n28). Раствор соединения n27 (4,06 г, 1,44 ммол) в смеси уксусного ангидрида (13,6 мл) и трифторуксусной кислоты (1,2 мл) перемешивают в течение 6 ч. После концентрирования смесь выпаривают вместе с- 12012587 толуолом (525 мл). Остаток очищают хроматографией на колонке с силикагелем [циклогексан/этилацетат/этанол 3/1/1 (об./об./об)] и получают 2,930 г соединения n28. ССМ на силикагеле, толуол/ацетон [1/1 (об./об.)]: Rf=0,44. Подготовительный синтез 26. Получение (2,3,4,6-тетра-О-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(6-Обензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-6-Oацетил-2-азидо-2-дезокси-3-O-метил-D-глюкопиранозы (n29). Раствор соединения n28 (2,72 г, 0,928 ммол) и бензиламина (3,9 мл, 35,2 ммол) в тетрагидрофуране перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разбавляют этилацетатом, промывают 1 М хлористоводородной кислотой, водой, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем [циклогексан/ацетон 4/5 (об./об.)] и получают 2,21 г соединения n29. ССМ на силикагеле, циклогексан/ацетон [4/5(об./об.)]: Rf=0,42. Подготовительный синтез 27. Получение (2,3,4,6-тетра-О-ацетилD-глюкопиранозил)-(14)(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(6-Обензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-6-Оацетил-2-азидо-2-дезокси-3-O-метил-D-глюкопиранозилтрихлорацетимидата (n30). К раствору соединения n29 (0,313 г, 108 мкмол) в дихлорметане (3 мл) добавляют трихлорацетонитрил (54,6 мкл, 541 мкмол) и карбонат цезия (56,4 мг, 173 мкмол). После перемешивания в течение 1 ч 30 мин смесь фильтруют, затем концентрируют. Остаток очищают хроматографией на колонке с силикагелем, используя для элюирования смесь циклогексан/этилацетат/этанол [2/0,5/0,5 (об./об.)], содержащую 0,1% триэтиламина, и получают 245 мг соединения n30. ССМ на силикагеле, циклогексан/этилацетат/этанол [5/1,5/1,5 (об./об./об)]: Rf=0,41. Схема 7. Синтез тетрасахарида n34 Подготовительный синтез 28. Получение метил (4-О-левулинил-2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(3,6-ди-О-ацетилD-глюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)- (14)-3-О-метилD-глюкопиранозида (n32). Раствор соединения n31 (4,50 г, 3,02 ммол), полученного аналогично приготовлению 31, описанному в заявке на патент, опубликованной под номером WO 99/36443, в 72 мл смеси этилацетат/третбутанол [1/1 (об./об.)] обрабатывают водородом под давлением 4 бар в присутствии 10% палладия на угле (9,0 г) в течение 6 ч. После фильтрации и концентрирования получают соединение n32, которое используют непосредственно на следующей стадии без очистки. Подготовительный синтез 29. Получение метил (метил-4-О-левулинил-2,3-ди-О-метилDглюкопиранозилуронат)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(метил-2,3-ди-О-метил- 13012587-L-идопиранозилуронат)-(14)-2,6-ди-О-ацетил-3-О-метилD-глюкопиранозида (n33). К раствору соединения n2 (1,09 г, 1,13 ммол) в безводном N,N-диметилформамиде (15 мл) добавляют при 0 С гидрокарбонат калия (1,13 г), затем метилиодид (1,4 мл). После 16 ч перемешивания при комнатной температуре реакционную среду охлаждают до 0 С. Затем последовательно добавляют диметиламинопиридин (44 мг), уксусный ангидрид (2,4 мл). Смесь перемешивают в течение 16 ч. После нейтрализации избытка уксусного ангидрида смесь разбавляют этилацетатом. Органическую фазу последовательно промывают 10% раствором гидросульфата натрия и водой, затем насыщенным раствором гидрокарбоната натрия и водой. Органическую фазу сушат над безводным сульфатом натрия, фильтруют,затем испаряют досуха. Полученный остаток подвергают ацетилированию в классических условиях (уксусный ангидрид, диметиламинопиридин, триэтиламин в дихлорметане). После обработки остаток очищают хроматографией на колонке с силикагелем [циклогексан/этилацетат/этанол [12/2,5/2,5 (об./об.)], и получают 0,910 г соединения n33. ССМ на силикагеле, толуол/ацетон [2/1 (об./об.)]: Rf=0,49. Подготовительный синтез 30. Получение метил(метил-2,3-ди-О-метилD-глюкопиранозилуронат)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(метил-2,3-ди-О-метилL-идопиранозилуронат)-(14)-2,6-ди-О-ацетил-3-О-метилD-глюкопиранозида (n34). Соединение n33 (0,884 г, 0,793 ммол) растворяют в 160 мл смеси толуол/этанол [1/1 (об./об.)]. Добавляют гидразинацетат (0,365 мг). После 5 ч перемешивания при комнатной температуре реакционную среду концентрируют досуха. Остаток растворяют в дихлорметане. Органическую фазу последовательно промывают 2% раствором гидрокарбоната натрия и водой, затем сушат над безводным сульфатом натрия, фильтруют и выпаривают досуха. После хроматографии на колонке с силикагелем [толуол/ацетон 5/3 (об./об.)] получают 0,696 г соединения n34. ССМ на силикагеле, толуол/ацетон [2/1 (об./об.)]:(14)-(6-О-бензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-(6-O-ацетил-2-азидо-2-дезокси-3-O-метилD-глюкопиранозил)-(14)(метил-2,3-ди-О-метилD-глюкопиранозилуронат)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)(14)-(метил-2,3-ди-О-метилL-идопиранозилуронат)-(14)-2,6-ди-О-ацетил-3-О-метилDглюкопиранозида (n36). Растворяют имидатное соединение n30 (170 мг, 56 мкмол), полученное в подготовительном синтезе 27, и соединение п 34 (114 мг, 112 мкмол), полученное в подготовительном ситнезе 30, в 2,5 мл смеси дихлорметан/диэтиловый эфир [1/2 (об./об.)]. После добавления молекулярного сита 4 в виде порошка смесь охлаждают до -20 С и добавляют 0,1 М раствор триметилсилилтрифторметансульфоната в дихлорметане (84 мкл). Спустя 40 мин смесь нейтрализуют добавлением твердого гидрокарбоната натрия. После фильтрации и концентрирования остаток очищают хроматографией на геле Sephadex LH60, затем хроматографией в колонке с силикагелем [диэтиловый эфир/этанол (17/2 об./об.)] и получают 123 мг соединения n36. Масса: метод "ESI", в режиме положительной ионизации: масса химическая: 3890,87; масса экспериментальная: 3890,460,68 u.m.a. ССМ на силикагеле, диэтиловый эфир/этанол [17/2 (об./об.)]: Rf=0,40. Подготовительный синтез 32. Получение метил(2,3,4,6-тетра-О-ацетилD-глюкопиранозил)(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)-(14)-(2,3,6-три-О-ацетилD-глюкопиранозил)(14)-(6-O-бензоил-2,3-ди-О-метилD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3-(6-О-ацетил-2-азидо-2-дезокси-3-O-метилD-глюкопиранозил)-(14)-(метил-2,3-ди-ОметилD-глюкопиранозилуронат)-(14)-(2,3,6-три-O-ацетилD-глюкопиранозил)-(14)-(метил-2,3 ди-О-метилL-идопиранозилуронат)-(14)-2,3,6-три-О-ацетилD-глюкопиранозида (n37). Растворяют имидатное соединение n30 (95 мг, 0,031 мкмол), полученное в подготовительном синтезе 27, и соединение n35 (65,4 мг, 0,062 ммол), полученное в приготовлении 42 заявки на патент,опубликованной под номером WO 02/24754, в 1,5 мл смеси дихлорметан/диэтиловый эфир [1/2 (об./об.)]. После добавления молекулярного сита 4 в виде порошка смесь охлаждают до -20 С и добавляют 0,1 М(47 мкл) раствор триметилсилилтрифторметансульфоната в дихлорметане (47 мкл). Спустя 40 мин смесь нейтрализуют добавлением твердого гидрокарбоната натрия. После фильтрации и концентрирования остаток очищают хроматографией на геле Sephadex LH60 (проводят две хроматографии) и получают 68 мг соединения n37. Масса: метод "ESI", в режиме положительной ионизации: масса химическая: 3918,88; масса экспериментальная: 3919,350,71 u.m.a. ССМ на силикагеле, циклогексан/этилацетат/этанол [3/1/1(111 мг), полученного в подготовительном синтезе 31, в тетрагидрофуране (4,6 мл). После 5 мин перемешивания прибавляют по каплям 0,7 М водный раствор гидроксида лития (1,8 мл). Реакционную смесь перемешивают при -5 С в течение 1 ч, затем при 0 С в течение 4 ч, в заключение в течение 16 ч при комнатной температуре. Переносят реакционную смесь на колонку Sephadex G-25 fine (5100 см) и элюируют водой. Фракции, содержащие целевое соединение, объединяют, концентрируют и переносят на колонку со смолой Dowex AG 50 WX4 Н+ (1,9 мл). Получают соединение при 0 С и концентрируют с получением 72,1 мг соединения n38. ССМ на силикагеле, этилацетат/пиридин/уксусная кислота/вода(60 мг) в тетрагидрофуране (5,5 мл). После 5 мин перемешивания прибавляют по каплям 0,7 М водный раствор гидроксида лития (1 мл). Реакционную смесь перемешивают при -5 С в течение 1 ч, затем при 0 С в течение 4 ч, в заключение в течение 16 ч при комнатной температуре. Нейтрализуют 1 М раствором хлористоводородной кислоты. Переносят раствор на колонку Sephadex G-25 fine (5100 см) и элюиру- 15012587 ют водой. Фракции, содержащие целевое соединение, объединяют, концентрируют и переносят на колонку со смолой Dowex AG 50 WX4 Н+. Получают соединение при 0 С и концентрируют с получением 37,5 мг соединения n39. CCM на силикагеле, этилацетат/пиридин/уксусная кислота/вода [16/12/2,6/7(об./об./об./об.)]: Rf=0,36. Подготовительный синтез 35. Получение метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-(2-азидо-2-дезокси-3-O-метил-6-О-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-3-О-метил-2,6-ди-OсульфонатоD-глюкопиранозида, соль натрия (n40). Непосредственно перед употреблением соединение n38, полученное в подготовительном синтезе 33, перегоняют вместе с N,N-диметилформамидом (32 мл). К раствору соединения n38 (70,3 мг, 22,8 мкмол) в N,N-диметилформамиде (2 мл) прибавляют комплекс триоксида серы с триэтиламином (351 мг). Смесь перемешивают в течение 16 ч при 55 С в отсутствие света. Смесь, охлажденную до 0 С, прибавляют по каплям к раствору гидрокарбоната натрия в воде. Перемешивают в течение 16 ч при комнатной температуре и концентрируют досуха. Остаток, растворенный в воде, переносят на колонкуSephadex G-25 fine и элюируют 0,2 М хлоридом натрия. Фракции, содержащие продукт, концентрируют и удаляют соль, используя ту же колонку, но элюируя водой. После лиофилизации получают 103 мг соединения n40. Масса: метод "ESI", в режиме отрицательной ионизации: масса химическая = 4864,82; масса экспериментальная = 4862,900,21 u.m.a. Подготовительный синтез 36. Получение метил(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-ОсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-диО-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3(2-азидо-2-дезокси-3-O-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метилDглюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-диО-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-O-сульфонатоD-глюкопиранозида,соль натрия (n41). Соединение n39 (33 мг, 0,017 ммол), полученное в подготовительном синтезе 34, превращают в соединение n41 в соответствии с принципом работы, описанным в подготовительном синтезе 35. После концентрирования получают 40 мг соединения n41. Масса: метод "ESI", в режиме отрицательной ионизации: масса химическая = 4952,83; масса экспериментальная = 4590,190,55 u.m.а. Подготовительный синтез 37. Получение метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-(2-амидо-2-дезокси-3-O-метил-6-О-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоDглюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-3-О-метил-2,6-диО-сульфонатоD-глюкопиранозида, соль натрия (n42). Раствор соединения n40 (93,8 мг), полученного в подготовительном синтезе 35, в смеси третбутанола (1,2 мл) и воды (1,8 мл), обрабатывают водородом под давлением 5 бар в присутствии 10% палладия на угле (28 мг) при 40 С в течение 4 ч. После фильтрации (фильтр Millipore LSWP 5 мкм) раствор концентрируют досуха с получением 93 мг соединения n42. Подготовительный синтез 38. Получение метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-0-метил-6-O-сульфонато-a-D-глюкопиранозил)-(14)-(2,3,6-три-О-метилDглюкопиранозил)-(14)-[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилDглюкопиранозил)-(14)]3-(2-амино-2-дезокси-3-O-метил-6-О-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-O-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонатоDглюкопиранозида, соль натрия (n43). Соединение n41 (40,8 мг), полученное в подготовительном синтезе 36, превращают в соединениеn43 в соответствии с принципом работы, изложенным в подготовительном синтезе 37. После концентрирования получают 42,3 мг соединения n43. Масса: метод "ESI", в режиме отрицательной ионизации: масса химическая = 4926,84; масса экспериментальная = 4924,070,36 u.m.a. Пример 1. Получение метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-ОсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-диО-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-14[(2,3,6-три-О-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3(2-[N-(6-биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-14-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-3-О-метил-2,6-ди-ОсульфонатоD-глюкопиранозида, соль натрия. Соединение n42 (20 мг, 4,13 мкмол), полученное в соответствии с подготовительным синтезом 37,растворяют в 0,5% водном растворе гидрокарбоната натрия (1,7 мл). К полученной среде добавляют по каплям раствор 6-(биотинамидо)гексаноата сульфосукцинимида (23 мг, 41,3 мкмол) в 0,5% растворе гидрокарбоната натрия (100 мкл). После 16 ч перемешивания при комнатной температуре добавляют 1 М водный раствор гидроксида натрия и перемешивают в течение 1 ч. Переносят реакционную смесь на колонку Sephadex G-25 fine (5100 см), элюируя 0,2 М водным раствором хлорида натрия. Концентрируют фракции, содержащие продукт, и удаляют соль, используя ту же колонку, но элюируя водой. После лиофилизации получают 21,2 мг целевого соединения. Масса: метод "ESI", в режиме отрицательной ионизации: масса моноизотопная = 5174,38; масса химическая = 5178,28; масса экспериментальная = 5177,690,52 u.m.а. Пример 2. Получение метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-ОсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-диО-метил-6-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)[(2,3,6-три-O-метилD-глюкопиранозил)-(14)-О-(2,3,6-три-О-метилD-глюкопиранозил)-(14)]3(2-[N-(6-биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)(2,3-ди-О-метилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонато-D-глюкопиранозида, соль натрия. Соединение n43 (19,1 мг), полученное в соответствии с подготовительным синтезом 38, превращают в соединение n45, полученное в соответствии с принципом работы, описанным в примере 1. После лиофилизации получают 18,1 мг целевого соединения. Масса: метод "ESI", в режиме отрицательной ионизации: масса моноизотопная = 5252,31; масса химическая = 5266,30; масса экспериментальная = 5263,930,38 u.m.а. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Биотинилированные гексадекасахариды общей формулы (I)R обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,R1 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-,R2 обозначает (C1-C6)алкоксирадикал или радикал -OSO3-,R3 обозначает (C1-C6)алкоксирадикал, в частности метоксирадикал или радикал -OSO3-, илиR3 образует мостик -О-СН 2-, в котором группа -СН 2- соединена с атомом углерода, несущим карбоксильную группу на том же цикле,Ре обозначает сахаридную последовательность следующей формулы: а также их фармацевтически приемлемые соли. 2. Биотинилированные гексадекасахариды по п.1 общей формулы (I), в которойR обозначает метоксирадикал или радикал -OSO3-,R1 обозначает метоксирадикал,R2 обозначает радикал -OSO3-,R3 обозначает метоксирадикал. 3. Биотинилированные гексадекасахариды по любому из пп.1 или 2, выбранные из метил(2,3,4,6-тетра-О-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-сульфонатоDглюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-O-метил-6-OсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-O-метилD-глюкопиранозил)-(14)-[(2,3,6-три-OметилD-глюкопиранозил)-(14)-О-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3-(2-[N-(6 биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-3-О-метил-2,6-ди-О-сульфонато-D-глюкопиранозида, соль натрия; метил(2,3,4,6-тетра-O-сульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоDглюкопиранозил)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-О-метил-6-OсульфонатоD-глюкопиранозил)-(14)-(2,3,6-три-О-метилD-глюкопиранозил)-(14)-[(2,3,6-три-OметилD-глюкопиранозил)-(14)-О-(2,3,6-три-O-метилD-глюкопиранозил)-(14)]3-(2-[N-(6 биотинамидогексаноил)]-2-дезокси-3-O-метил-6-O-сульфонатоD-глюкопиранозил)-(14)-(2,3-ди-OметилD-глюкопиранозилуроновая кислота)-(14)-(2,3,6-три-О-сульфонатоD-глюкопиранозил)(14)-(2,3-ди-О-метилL-идопиранозилуроновая кислота)-(14)-2,3,6-три-О-сульфонатоD-глюкопиранозида, соль натрия. 4. Фармацевтические композиции, содержащие в качестве активного начала гексадекасахарид по любому из пп.1-3, необязательно, в сочетании с одним или несколькими соответствующими инертными эксципиентами. 5. Применение фармацевтических композиций согласно п.4 для получения лекарственного средства, пригодного для лечения различных патологий, приводящих к изменению гомеостаза в системе свертывания крови, возникающему при нарушениях сердечно-сосудистой и церебрально-сосудистой системы, таких как тромбоэмболические нарушения, ассоциированные с атеросклерозом и диабетом, такие как нестабильная стенокардия, геморрагический инсульт, рестеноз после ангиопластики, эндартериэктомия, установка сосудистых эндопротезов; или тромбоэмболические нарушения, ассоциированные с ретромбозом после тромболиза, с инфарктом, деменцией ишемического происхождения, с заболеваниями периферических артерий, с гемодиализом, с аурикулярными фибрилляциями или при использовании сосудистых протезов для аортокоронарного шунтирования; пригодного также для лечения или предотвращения тромбоэмболических патологий венозного происхождения, таких как легочная эмболия, и пригодного для лечения или профилактики тромбоэмболических осложнений, возникающих в результате хирургических операций, роста опухолей или нарушений свертывания крови, вызванных бактерийными,- 18012587 вирусными или ферментными активаторами. 6. Применение биотинилированных гексадекасахаридов по любому из пп.1-3 для получения лекарственного средства, пригодного для покрытия протезов. 7. Применение биотинилированных гексадекасахаридов по любому из пп.1-3 для получения лекарственного средства, пригодного в качестве адъювантов при эндартериэктомии, проводимой с использованием пористых баллончиков. 8. Способ использования авидина или стрептавидина, отличающийся тем, что он позволяет нейтрализовать антитромботическую активность биотинилированных гексадекасахаридов по любому из пп.1-3. 9. Применение авидина или стрептавидина для получения лекарственных средств, предназначенных для нейтрализации антитромботической активности биотинилированных гексадекасахаридов по любому из пп.1-3.
МПК / Метки
МПК: A61K 31/715, C08B 37/00
Метки: биотинилированные, гексадекасахариды, получение, применение
Код ссылки
<a href="https://eas.patents.su/20-12587-biotinilirovannye-geksadekasaharidy-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Биотинилированные гексадекасахариды, их получение и применение</a>
Предыдущий патент: Rage – слитые белки и способы их применения
Следующий патент: Усовершенствованная схема синтеза лакозамида
Случайный патент: Гетероарил-циклогексил-тетраазабензо[e]азулены в качестве антагонистов рецептора v1a












