Усовершенствованная схема синтеза лакозамида
Формула / Реферат
1. Способ получения (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (лакозамид), включающий О-метилирование соединения формулы I
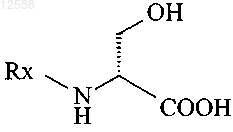
формула I
с получением соединения формулы II
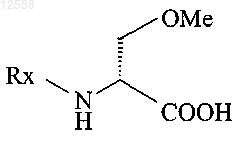
формула II
где Rx является N-защитной группой,
отличающийся тем, что
О-метилирование осуществляют одностадийной реакцией и получают соединение формулы II как R-энантиомер по меньшей мере 88% чистоты и
способ осуществляют либо (а) катализом фазового переноса, либо (б) путём добавления метилирующего агента и литийорганического соединения к соединению формулы I.
2. Способ по п.1, где способ включает добавление метилирующего агента в реакционную систему фазового переноса, включающую соединение формулы I, водную фазу, органическую фазу и катализатор фазового переноса.
3. Способ по п.2, где в качестве катализатора фазового переноса используют соль пиридиния, фосфония, аммония или сульфония.
4. Способ по любому из пп.2, 3, где катализатор фазового переноса выбирают из соединений:
(а) общей формулы IV
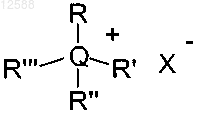
формула IV
(b) общей формулы V

формула V
или (с) общей формулы VI
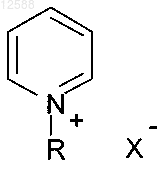
формула VI
где если присутствуют R, R', R" и R'", то они являются независимо выбранными алкильной, арильной или аралкильной группами;
Q в соединениях формулы IV представляет собой азот или фосфор и
X представляет собой галоидную, ацетатную, п-толулосульфонатную, трифторметансульфонатную, гексофторантимонатную, гидроксидную, перхлоратную, гидросульфатную, тиоцианатную или тетрафторборатную группу.
5. Способ по любому из пп.2-4, где катализатор фазового переноса представляет собой тетрабутиламмонийбромид.
6. Способ по любому из пп.2-5, где используемый в катализе фазового переноса метилирующий агент выбирают из диметилсульфата, триметилфосфата или йодистого метила.
7. Способ по любому из пп.2-6, где водная фаза представляет собой водный раствор гидроксида натрия, водный раствор гидроксида лития, водный раствор гидроксида калия, водный раствор карбоната натрия или водный раствор карбоната калия.
8. Способ по любому из пп.2-7, где органический растворитель представляет собой толуол, гексан, метиленхлорид или метил-трет-бутиловый эфир.
9. Способ по любому из пп.1-8, где катализ фазового переноса осуществляют при 0-10шС в течение по меньшей мере 30 мин.
10. Способ по п.1, где метилирующий агент, используемый вместе с литийорганическим соединением, представляет собой диметилсульфат.
11. Способ по любому из пп.1 или 10, где литийорганическое соединение представляет собой бутиллитий.
12. Способ по любому из пп.1 или 10, 11, где О-метилирование в присутствии литийорганического соединения осуществляют при температуре 0-10шС в течение по меньшей мере 5 ч.
13. Способ по любому из предшествующих пунктов, дополнительно включающий реакцию соединения II с бензиламином с получением соединения формулы III
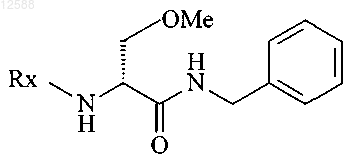
формула III
и затем заменяют защитную группу Rx на метилкарбонил с образованием (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (лакозамида).
14. Способ по п.13, где реакцию соединения формулы II с бензиламином осуществляют в присутствии активатора карбоксильной группы и основания.
15. Способ по п.14, где основание представляет собой 4-метилморфолин, триэтиламин, диизопропилэтиламин, 1.8-диазабицикло[5.4.0]ундец-7-ен или бикарбонат калия и активатор карбоксильной группы представляет собой алкилхлорформиат или карбодиимид.
16. Способ по любому из пп.13-15, где N-защитную группу Rx заменяют на метилкарбонил последовательно:
(а) отщепляя защитную группу Rx в соединении формулы III добавлением (i) минеральной кислоты или (ii) Н2/Pd-C с образованием (R)-2-амино-N-бензил-3-метоксипропионамида, а затем
b) добавляя метилкарбонильную группу к (R)-2-амино-N-бензил-3-метоксипропионамиду по реакции (R)-2-амино-N-бензил-3-метоксипропионамида с уксусным ангидридом.
17. Способ по п.16, где стадию (b) осуществляют в отсутствие пиридина.
18. Способ по любому из пп.13-15, в котором N-защитную группу Rx отщепляют с получением (R)-2-амино-N-бензил-3-метоксипропионамида.
19. Способ по любому из предшествующих пунктов, где лакозамид выделяют из конечной реакционной смеси кристаллизацией.
20. Способ по любому из предшествующих пунктов, где N-защитная группа представляет собой трет-бутоксикарбонил (Boc).
21. Способ по любому из предшествующих пунктов, включающий стадию N-ацетилирования (R)-2-амино-N-бензил-3-метоксипропионамида уксусным ангидридом в отсутствие основания, в частности в отсутствие пиридина.
22. Способ по любому из предшествующих пунктов, в котором соединение формулы II представляет собой (R)-2-N-Boc-амино-3-метоксипропановую кислоту (С-936) или ее соли.
23. (R)-N-Бензил-2-N-Boc-амино-3-метоксипропионамид (С-937) или любые его соли.
24. Применение (R)-N-бензил-2-N-Boc-амино-3-метоксипропионамида (С-937) или любых его солей в способе получения (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (лакозамида) по пп.1-22.
25. Способ получения фармацевтической композиции, содержащей лакозамид, путём последовательных стадий:
(a) получения лакозамида по любому из пп.1-22 и
(b) смешивания лакозамида с фармацевтически приемлемыми эксципиентами.
26. Способ получения N-Boc-D-серина путём взаимодействия D-серина с ди-трет-бутилдикарбонатом в реакции фазового переноса.
27. Способ получения соединения формулы VIII, включающий О-метилирование соединения формулы VII
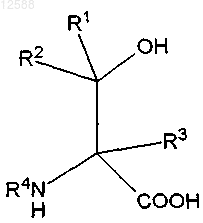
формула VII
с образованием соединения формулы VIII
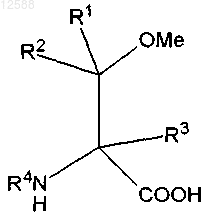
формула VIII
где R1, R2 и R3 выбраны независимо из водорода, -SH, -NH2, -NO2, -CN, -СООН, -SOH, -SO2H, -SO3H, галогена, -OR10, -SR10, -NR10R11, -SOR10, -SO2R10, -SO3R10, замещенного или незамещенного алкила, замещенного или незамещенного С2-С6-алкенила, замещенного или незамещенного С2-С6-алкинила, -(CO)-R10, -(CO)-O-R10, -O-(CO)-R10, замещенного или незамещенного арила, замещенного или незамещенного С3-С13-гетероарила, содержащего 1-3-гетероатома, независимо выбранных из N, S, О, замещенного или незамещенного аралкила, замещенного или незамещенного С7-С15-алкарила, замещенного или незамещенного С4-С14-гетероаралкила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; замещенного или незамещенного С4-С14-алкгетероарила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; или замещенного или незамещенного С3-С12-циклоалкила, содержащего 0-3 гетероатома, независимо выбранных из N, S, О;
R4 представляет собой Н, N-защитную группу и/или группу, как описано для R1; и
R10 и R11 выбраны независимо из водорода, замещенного или незамещенного алкила, замещенного или незамещенного С2-С6-алкенила, замещенного или незамещенного С2-С6-алкинила, замещенного или незамещенного арила, замещенного или незамещенного С3-С13-гетероарила, содержащего 1-3-гетероатома, независимо выбранных из N, S, О, замещенного или незамещенного аралкила, замещенного или незамещенного С7-С15-алкариыр, замещенного или незамещенного С4-С14-гетероаралкила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; замещенного или незамещенного С4-С14-алкгетероарила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; или замещенного или незамещенного С3-С12-циклоалкила, содержащего 0-3 гетероатома, независимо выбранных из N, S, О,
отличающийся тем, что
О-метилирование проводят по одностадийной реакции, где соединение формулы VIII получают в той же самой конфигурации, что и соединение VII, с чистотой по меньшей мере 88%; и
способ осуществляют либо (а) катализом фазового переноса, либо (b) добавлением метилирующего агента и литийорганического соединения к соединению формулы VII.
28. Способ по п.27, где R1 представляет собой Н, R2 представляет собой Н, R3 представляет собой Н и R4 представляет собой N-защитную группу.
29. Способ по любому из пп.27 или 28, где соединение VII находится в R-конфигурации.
Текст
(R)-2-ацетамидо-N-бензил-3-метоксипропионамид (рекомендуемый INN: лакозамид) является антисудорожным лекарственным средством для лечения эпилепсии и боли. Уровень техники В US 6048899 описаны два способа получения этого соединения. Схема 2 US 6048899 включает образование бензиламида, предшествующее О-метилированию. Однако эта реакционная схема приводит к образованию различных примесей, которые должны быть удалены с помощью хроматографии, что непрактично в промышленном масштабе. Кроме того, выход на отдельных стадиях составляет лишь 80-85%. Схема 1 US 6048899 включает О-метилирование N-защищенного D-серина, предшествующее образованию бензиламида, снятие N-защиты и N-ацетилирование. Хотя эта схема получения является более перспективной отправной точкой для масштабирования, она страдает рядом недостатков. Наиболее важно то, что О-метилирование N-защищенного D-серина с использованием оксида серебра (I) и метилиодида является непрактичным и дорогостоящим и приводит к частичной рацемизации (около 15%), что снижает выход на этой стадии до 79%. Также удаление S-энантиомера во время получения (R)-2-ацетамидоN-бензил-3-метоксипропионамида чрезвычайно сложно. Раскрытие изобретения Неожиданно в данной работе было обнаружено, что рацемизацию можно избежать, используя альтернативные способы О-метилирования, такие как, например, О-метилирование с использованием катализа фазового переноса или О-метилирование с использованием литийорганического соединения и подходящего метилирующего агента, такого как диметилсульфат. Поэтому настоящее изобретение обеспечивает усовершенствованный путь синтеза лакозамида, в котором способ О-метилирования является селективным в отношении спиртовой гидроксильной группыN-защищенного D-серина. Поэтому по сравнению с неспецифическим метилированием, предложенным в схеме 1 US 6048899, которое также приводит к эстерификации карбоксильной группы, настоящее изобретение приводит к укороченному, более эффективному способу, в котором устраняется последующая стадия гидролиза сложноэфирной метильной группы интермедиата. Таким образом, настоящее изобретение относится к усовершенствованному способу получения (R)2-ацетамидо-N-бензил-3-метоксипропионамида, включающему О-метилирование соединения формулы I до получения соединения формулы II где Rx представляет собой N-защитную группу,отличающийся тем, что О-метилирование осуществляют одностадийной реакцией, и где рацемизация устраняется таким образом, что соединение формулы (II) получают как R-энантиомер с чистотой по крайней мере 88%, предпочтительно по крайней мере 90% и ещ более предпочтительно по крайней мере 95, 96, 97, 98 или 99% энантиомерной чистоты. Выражение "одностадийная реакция", используемое в этой патентной заявке, означает, что при превращении соединения формулы I в соединение формулы II образуется незначительное количество (т.е. количество 5 мол.% или больше) сложного эфира, который необходимо гидролизовать на отдельной стадии. Обычно образуется даже меньше чем 1 мол.% сложного эфира, который затем удаляют во время дальнейшего течения процесса с образованием лакозамида, как описано ниже, без необходимости какойлибо дополнительной стадии гидролиза. Изобретенное О-метилирование может быть осуществлено добавлением к соединению формулы 1 такого соединения, как, например, N-Boc-D-серин, метилирующего агента в присутствии металлорганического соединения, предпочтительно литийорганического соединения. Подходящие метилирующие агенты, например диметилсульфат, триметилфосфат или йодистый метил с диметилсульфатом особенно предпочтительны. Предпочтительным литийорганическим соединением является соединение алкиллития, такое как бутиллитий, метиллитий или гексиллитий или соединение ариллития, такое как фениллитий. Более предпочтительным литийорганическим соединением является трет-бутиллитий или нбутиллитий и особенно предпочтителен н-бутиллитий. В качестве других металлорганических соединений, содержащих связь металл-углерод, могут быть использованы цинкорганические соединения, включая цинкорганические галогениды, алюминийорганические соединения, включающие алюминийорганические галогениды, оловоорганические соединения, в том числе включая оловоорганические галогениды и/или магнийорганические соединения, включая магнийорганические галоиды (реактивы Гриньяра), в которых галоиды включают хлор, бром и/или йод. Органическая составляющая может быть арилом или-1 012588 алкилом. Предпочтительными соединениями Гриньяра являются алкил-Mg-Y или арил-Mg-Y, где Y представляет собой Cl, Br или I. В качестве растворителя могут использоваться смеси THF/2 метоксиэтиловый эфир, диэтоксиметан или предпочтительно THF. Обычно реакция продолжается по крайней мере 5 ч при 0-10 С и предпочтительно по крайней мере 7-24 ч при 0-10 С. Наиболее предпочтительно 9-18 ч при 0-5 С. Также реакция может осуществляться при более высоких или более низких температурах, как например, в диапазоне от -10 до +25 С, если время реакции при 0-10 С, наиболее предпочтительно на протяжении 9-18 ч при 0-5 С. Кроме того, реакцию можно осуществлять при более высоких или более низких температурах, таких как в диапазоне от -10 до +25 С, если время реакции адаптировано соответствующим образом. Если N-защитная группа Rx соединения формулы I представляет собой N-Boc, типичная реакция может быть проиллюстрирована нижеследующей схемой (стадия 1-А)(R)-2-t-butoxy)carbonylamino)-3-methoxypropacic acid C936 - (R)-2-трет-бутокси)карбониламино)3-метоксипропановая кислота С 936. Неожиданно оказалось, что этот способ не приводит к образованию метилового сложного эфира или к заметной рацемизации продукта. Экспериментальный выход составляет 91% при этом основными примесями являются продукты N-метилирования (пример 1). Поэтому выход метилирования согласно способу по данному изобретению с использованием металлоорганического соединения может составлять по крайней мере 85%, предпочтительно по крайней мере 90%. Типично, количество сложноэфирной примеси после метилирования, при использовании металлорганического или предпочтительно литийорганического соединения, в частности после стадии 1 а, значительно ниже 1 мол.%, предпочтительно ниже 0,1 мол.% и, как правило, ниже предела обнаружения. В альтернативном пути селективное О-метилирование спиртовой группы N-защищенного D-серина осуществляют катализом фазового переноса ("РТС"). РТС представляет собой способ, в котором используют двухфазные гетерогенные системы при этом одна фаза представляет собой водную или твердую фазу и резервуар вступающих в реакцию анионов или основание для генерации органических анионов,тогда как органические реактанты и катализаторы локализованы во второй, органической фазе. Обычно в качестве катализатора фазового переноса используют соли четвертичного аммония, фосфония или сульфония, такую как, например, тетраалкиламмонийгалогенид. Подходящие катализаторы и реагенты РТС могут быть приобретены у многих поставщиков, например, у Sigma-Aldrich или HawksChemical. Таким образом, один вариант настоящего изобретения относится к способу получения лакозамида,отличающемуся тем, что соединение формулы I О-метилируют в соединение формулы II, проводя реакцию в присутствии катализаторов фазового переноса. Типично, что этот способ включает добавление метилирующего реагента, такого как диметилсульфат, метилиодид или триметилфосфат, в реакционную систему фазового переноса, содержащую соединение формулы I, водную фазу, органическую фазу и катализатор фазового переноса. В РТС по данному изобретению предпочтительно:(a) метилирующий агент выбирают из таких соединений, как диметилсульфат, метилиодид или триметилфосфат, где особенно предпочтительным является диметилсульфат;(b) первая (водная) фаза представляет собой водный щелочной раствор, такой как водный раствор гидроксида натрия, водный раствор гидроксида лития, водный раствор гидроксида калия, водный раствор карбоната натрия или водный раствор карбоната калия, где особенно предпочтительным является водный раствор гидроксида натрия;(c) вторую (органическую) фазу выбирают из таких соединений как толуол, гексан, метиленхлорид или метил-трет-бутиловый эфир, при этом особенно предпочтительным является толуол; и(d) катализатор фазового переноса представляет собой соль аммония или фосфония формулы IV,соль сульфония формулы V или соль пиридиния формулы VI(VI) где R, R', R" и R'" являются независимо выбраными из алкильных, арильных или аралкильных групп, Q представляет собой азот или фосфор и X представляет собой галогенид, ацетат, птолуолсульфонат, трифторметансульфонат, гексафторантимонат, гидроксид, перхлорат, гидросульфат или тетрафторборат. Примерами подходящих катализаторов фазового переноса являются тетраэтиламмоний птолуолсульфонат, тетрапропиламмоний трифторметансульфонат, тетрафенилфосфоний гексафторантимонат, цетилпиридинийбромид, трифенилметилтрифенилфосфонийхлорид, бензилтриэтиламмонийхлорид, бензилтриметиламмонийхлорид, бензилтрифенилфосфонийхлорид, бензилтрибутиламмонийхлорид,бутилтриэтиламмонийбромид, бутилтрифенилфосфонийбромид, цетилтриметиламмонийбромид, цетилтриметиламмонийхлорид, этилтрифенилфосфонийбромид, этилтрифенилфосфонийиодид, метилтриоктиламмонийбромид, метилтрифенилфосфонийбромид, метилтрифенилфосфонийиодид, фенилтриметиламмонийхлорид, тетрабутиламмонийгидроксид, тетрабутиламмонийперхлорат, тетрабутиламмонийбромид, тетрабутиламмонийгидросульфат, тетрабутиламмонийиодид, тетрабутиламмонийтетрафторборат,терабутиламмонийтиоционат, тетраэтиламмонийгидроксид, тетраэтиламмонийиодид, тетраэтиламмонийбромид, тетраметиламмонийхлорид, тетраметиламмонийиодид, тетраметиламмонийхлорид, тетраоктиламмонийбромид, тетрафенилфосфонийбромид, тетрапропиламмонийгидроксид, тетрапропиламмонийбромид и трибутилметиламмонийхлорид, где особенно предпочтительны соли тетрабутиламмония и,в частности, тетрабутиламмонийгалогениды, например бромид. В РТС настоящего изобретения подходящими концентрациями компонентов (a)-(d), определенных выше, являются следующие:(a) количество метилирующего агента составляет от 1 до 5 молярных эквивалентов относительно соединения формулы I;(b) водный раствор щелочи предусматривается в виде 5-50% мас./мас. раствора и в количестве от 1,1 до 10 молярных эквивалентов относительно соединения формулы I;(c) количество органического растворителя относительно соединения формулы I предпочтительно находится в диапазоне 3-20 объемов, в частности, 3-30 л/кг соединения формулы I:(d) количество катализатора фазового переноса находится в диапазоне от 0,01 до 0,1 молярных эквивалентов относительно соединения формулы I. В настоящем изобретении, в частности в формулах IV-VI, "арил" относится к ароматической группе, замещенной одним или несколькими заместителями или незамещенной, которая содержит от 6 до 18 кольцевых углеродных атомов и заключает в себе, суммарно, до 25 углеродных атомов и включает полиядерные ароматические циклы. Эти арильные группы могут быть моноциклическими, бициклическими,трициклическими или полициклическими и могут быть конденсированными циклическими структурами. Подразумевается, что используемое здесь полиядерное ароматическое соединение охватывает бициклические конденсированные ароматические циклические структуры, содержащие 10-18 кольцевых углеродных атомов и содержащие, суммарно, до 25 углеродных атомов. В арильной группе от 1 до 6 атомов углерода могут быть замещены гетероатомом, таким как кислород, сера и/или азот. "Арил" включает в себя незамещенный фенил, незамещенный нафтил, фенил или нафтил, замещенный одним или несколькими заместителями, выбранными, например, из гидрокси-, карбоксигруппы, галогена, нитро, C1-6 алкила, С 1-6-алкокси, амино; замещенных или незамещенных гетероарилов, таких как пирроил; тиенил; индолил и т.д. В настоящем изобретении, в частности в формуле IV, "арил" предпочтительно выбран из незамещенного фенила или замещенного фенила, например 2,6-дифторфенила, п-нитрофенила или птолуила. Особенно предпочтителен незамещенный фенил. В настоящем изобретении, в частности в формулах IV-VI, "алкил" включает разветвленные или линейные насыщенные углеводородные цепи. Предпочтительно "алкил" представляет собой разветвленный или линейный углеводород с вплоть до 20 углеродных атомов, более предпочтительно вплоть до 6 углеродных атомов; наиболее предпочтительно с вплоть до 4 атомов углерода. Углеводород может быть незамещенным или замещен одним или несколькими заместителями. Предпочтительными примерами "алкила" являются цетил, октил, гептил, пентил, бутил, пропил, этил и метил. В настоящем изобретении, в частности в формулах IV-VI, "аралкил" означает арилалкильную группу, где "арил" и "алкил" такие, как определены выше. Предпочтительным "аралкилом" является бензил. В настоящем изобретении, замещение относится к замещению атома Н, например, гидрокси, карбокси, галогеном, нитро, С 1-6-алкилом, С 1-6-алкокси, амино. Реакция РТС обычно протекает при 0-10 С в течение по крайней мере 30 мин, например на протя-3 012588 жении от 0,5 до 24 ч, предпочтительно на протяжении по крайней мере 45 мин и еще более предпочтительно в течение по крайней мере 1 ч. РТС настоящего изобретения в конкретных условиях, например условиях примера 2 (стадия 1-В),приводит к получению продукта с выходом 96%. Выход РТС по данному изобретению может, таким образом, составлять по крайней мере 85%, предпочтительно по крайней мере 90%, еще более предпочтительно по крайней мере 91, 92, 93, 94, 95 или 96%. Соединение формулы I можно получить от многих поставщиков, например от Sigma Aldrich илиLancaster. N-Boc-D-серин можно также получить взаимодействием D-серина с ди-трет-бутилкарбонатом с получением N-Boc-D-серина в каталитической реакции фазового переноса, используя, в основном, условия (например, выбор и концентрация/количество щелочи, растворителя, РТС-катализаторов, температуры, времени реакции и т.д.), как описано выше, за исключением того, что в качестве реагента вместо метилирующего агента используют ди-трет-бутилкарбонат. Если N-защитная группа соединения формулы I представляет собой Boc (трет-бутоксикарбонил), то предпочтительная реакция РТС может быть проиллюстрирована следующей схемой (стадия 1-В). где Aqueous NaOH - водный NaOH; Toluene Tetrabutyl ammonium bromide - толуол, тетрабутиламмонийбромид; N-Boc-D-serine-N-Boc-D-серин; (R)-2-t-butoxy)carbonylamino)-3-methoxypropanoic acid (R)-2-трет-бутокси)карбониламино)-3-метоксипропановая кислота. Эта реакция не приводит к какой-либо рацемизации или эстерификации продукта. Кроме того, выход дополнительно повышается за счт доведения уровня примесей до около 1%. Типично, количество сложноэфирной примеси после метилирования по РТС, в частности, после стадии 1-В, значительно ниже 1 мол.%, предпочтительно ниже 0,1 мол.%, и обычно ниже предела определения. Способ по данному изобретению может дополнительно включать стадию превращения соединения формулы II в соединение формулы III (стадия 2)(III) Получение бензиламида может быть осуществлено путем добавления к соединению формулы II необходимого количества бензиламина в присутствии(a) основания, такого как триэтиламин, диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен,бикарбонат калия или производное морфолина, предпочтительно 4-метилморфолин, и(b) активатора карбоксильной группы, такого как карбодиимид или алкилхлорформиат, предпочтительно изобутилхлорформиат. Экспериментально, выход полученного бензиламида в условиях, например, примера 3 (стадия 2) типично находился в диапазоне от 90 до 99%. Таким образом, выход полученного бензиламида по настоящему изобретению может находиться в диапазоне по крайней мере от 85 до 99,9, предпочтительно в диапазоне по крайней мере от 90 до 99%. Эта стадия 2, в основном, описана в US 6048899, содержание которого включено в настоящее описание путем отсылки. Подходящими защитными группами в способе в соответствии с настоящим изобретением являются,например, трет-бутоксикарбонил (Boc) или карбобензокси (Cbz), причем Boc-группа является особенно предпочтительной. В соединении формулы III защитная группа Rx может быть отщеплена подходящими способами,известными в данной области техники, с получением (R)-2-амино-N-бензил-3-метоксипропионамида. Например, если защитная группа Rx представляет собой карбобензоксигруппу, то е можно отщепить с помощью Н 2, Pd/C, как описано в US 6048899. Если защитная группа представляет собой Boc-группу, то е можно удобно удалить с помощью кислоты, такой как хлористоводородная кислота, например, при формула III (R)-2-амино-N-бензил-3-метоксипропионамид. Экспериментально получение амина в условиях, например, примера 3, стадия 3, обычно давало продукт с выходом в диапазоне от 95 до 100%. Так, стадия образования амина в способе по данному изобретению может давать продукт с выходом по крайней мере 85%, предпочтительно по крайней мере 90%, более предпочтительно по крайней мере 95%.(R)-2-амино-N-бензил-3-метоксипропионамид может быть затем превращен в лакозамид путем Nметилирования, используя уксусный ангидрид (стадия 4)(R)-2-амино-N-бензил-3-метоксипропионамид; 2-(R)-2-ацетамидо-N-бензил-3-метоксипропионамид (лакозамид). Экспериментально ацетилирование в условиях, например примера 3, стадия 4, дает продукт с выходом в диапазоне от 81 до 95%. Выход на стадии ацетилирования в способе по данному изобретению может, таким образом, находиться в диапазоне по крайней мере от 70 до 99%, предпочтительно в диапазоне от 80 до 95% , по крайней мере от 80 до 95%. Эта стадия была также описана в US 6048899. Однако US 6048899 предполагает использование уксусного ангидрида в присутствии основания, например, пиридина. Теперь неожиданного было обнаружено, что чистый (R)-энантиомер может быть также эффективно получен, если токсичный пиридин исключить из реакционной смеси. Таким образом, один из вариантов осуществления настоящего изобретения заключается в получении лакозамида, включающем стадии N-ацетилирования (R)-2-амино-N-бензил-3-метоксипропионамида уксусным ангидридом в отсутствии основания, в частности в отсутствии пиридина. Преимуществом реакции, свободной от основания, является то, что могут быть исключены токсичные основания, такие как пиридин. Наконец, лакозамид повышенной чистоты может быть выделен из реакционной смеси стадии 4 путем кристаллизации в подходящих растворителях, таких как этилацетат. Экспериментально, лакозамид был получен в конкретных условиях примеров 1-4, с выходом обычно 63-70% (используя бутиллитий на стадии 1 А) или с выходом в диапазоне от 66 до 75% (используя РТС на стадии 1-В). Таким образом, лакозамид может быть получен способом по данному изобретению с суммарным выходом в диапазоне, по крайней мере от 50 до 90%, предпочтительно по крайней мере 60 до 80%. Если используют металлорганическое соединение, то суммарный выход лакозамида может более предпочтительно находиться в диапазоне по крайней мере от 60 до 70%, наиболее предпочтительно в диапазоне по крайней мере от 63 до 70%. Если используют РТС, то суммарный выход лакозамида может более предпочтительно находиться в диапазоне по крайней мере от 60 до 75%, наиболее предпочтительно в диапазоне по крайней мере от 66 до 75%. Описанный выше способ синтеза лакозамида включает в себя получение соединения формулы II из соединения формулы I. Таким образом, предметом настоящего изобретения является способ получения соединения формулы (II) из соединения формулы (I) О-метилированием, как описано выше, в основном в отсутствии образования метилового сложного эфира или заметной рацемизации. Производные D-серина или производные L-лизина или смеси производных D- и L-серина в любом соотношении могут быть использованы в способе по данному изобретению. Способ получения соединения формулы II и/или лакозамида по данному изобретению приводит к повышению выхода и повышению энатиомерной чистоты продукта. Этот эффект получен благодаря тому факту, что во время О-метилирования спиртовой ОН-группы производных D- и/или L-серина в способе по данному изобретению, по существу, не образуется метиловый эфир и не наблюдается заметной рацемизации продукта. Кроме того, данное изобретение относится к важным интермедиатам настоящего способа. Наиболее важный интермедиат, (R)-2-N-Вос-амино-3-метоксипропановая кислота (С-936), является следствием усовершенствованной стадии О-метилирования согласно настоящему изобретению (см. схему в конце описания). Соединение может быть легко выделено из реакционной смеси в виде свободной кислоты или путем образования соли, такой как, например, соль циклогексиламмония. Подходящие соли С-936 также рассматриваются как часть данного изобретения. Также, (R)-N-бензил-2-N-Вос-амино-3-метоксипропионамид (С-937), который является результатом образования бензиламида (стадия 2 схемы в конце описания), является составной частью данного изобретения.-5 012588 Другой аспект данного изобретения относится к использованию С-936 или С-937 или любой их соли в качестве аддукта или интермедиата в способе получения (R)-2-ацетамидо-N-бензил-3 метоксипропионамида (лакозамида). Следующий аспект данного изобретения относится к способу получения фармацевтического препарата с помощью последующих стадий(a) получение лакозамида способом согласно данному изобретению и(b) смешение лакозамида с фармацевтически приемлемыми эксципиентами. Ещ один аспект настоящего изобретения заключается в способе получения соединения формулы(VII) с получением соединения формулы VII,(VII) где R4 представляет собой Н, N-защитную группу, и/или группу, содержащую 0-30 атомов С, и где R1, R2 и R3 выбраны независимо из Н и групп, содержащих 0-30 атомов С,отличающимся тем, что О-метилирование осуществляют одностадийной реакцией, и где соединение формулы VIII получают в той же самой конфигурации, как и соединение VII, с энантиомерной чистотой по крайней мере 88%, предпочтительно по крайней мере 90%, более предпочтительно по крайней мере 95, 96, 97, 98 или 99%. Предпочтительно, R1, R2 и R3 представляют собой независимо водород, -ОН, -SH, -NH2, -NO2, -CN,-COOH, -SOH, -SO2H, галоген, -OR10, -NR10R11, -SOR10, -SO3R10, -SO2R10 замещенный или незамещенный алкил, определенный выше, замещенный или незамещенный С 2-С 6-алкенил, замещенный или незамещенный С 2-С 6-алкинил, -(CO)-R10, -(CO)-O-R10, -O-(CO)-R10, -SR10 замещенный или незамещенный арил,определенный выше, замещенный или незамещенный С 3-С 13-гетероарил, содержащий 1-3-гетероатома,независимо выбранные из N, S, О, замещенный или незамещенный аралкил, определенный выше, замещенный или незамещенный С 7-С 15-алкарил, замещенный или незамещенный С 4-С 14-гетероаралкил, содержащий 1-3 гетероатома, независимо выбранные из N, S, О; замещенный или незамещенный С 4-С 14 алкгетероарил, содержащий 1-3 гетероатома, независимо выбранные из N, S, О; или замещенный или незамещенный С 3-С 12-циклоалкил, содержащий 0-3 гетероатома, независимо выбранные из N, S, О. Более предпочтительно, когда R1 представляет собой Н, R2 представляет собой Н и/или R3 представляет собой Н. Предпочтительно R4 выбран из R1 и N-защитных групп. Более предпочтительно, когда R4 представляет собой N-защитную группу Rx, как описано выше. Ещ более предпочтительно, когда R1 представляет собой Н, R2 представляет собой Н, R3 представляет собой Н и R4 представляет собой Rx, как описано выше. В заместителях, когда R4, R1, R2 , R3, группы R10 и R11 представляют собой независимо водород, замещенный или незамещенный алкил, определенный выше, замещенный или незамещенный С 2-С 6 алкенил, замещенный или незамещенный С 2-С 6-алкинил, замещенный или незамещенный арил, определенный выше, замещенный или незамещенный С 3-С 13-гетероарил, содержащий 1-3-гетероатома, независимо выбранные из N, S, О, замещенный или незамещенный аралкил, определенный выше, замещенный или незамещенный С 7-С 15-алкинил, замещенный или незамещенный С 4-С 14-гетероаралкил, содержащий 1-3 гетероатома, независимо выбранные из N, S, О; замещенный или незамещенный С 4-С 14-алкгетероарил, содержащий 1-3 гетероатома, независимо выбранные из N, S, О; или замещенный или незамещенный С 3-С 12-циклоалкил, содержащий 0-3 гетероатома, независимо выбранные из N, S, О. Замещение в группах R4, R1, R2, R3, R10 и R11 относится к замещению одним или несколькими заместителями, определенными выше, например гидрокси, карбокси, галогеном, нитро, C1-С 6 алкилом, C1 С 6-алкокси, амино и т.д."Та же самая конфигурация" соединения VIII относительно соединения VII означает, что, по существу, рацемизация не имеет места, или соединение VIII получают в той же самой конфигурации, что и соединение VII с энантиомерной чистотой, как определено выше. Если соединение VII находится в R конфигурации, то и соединение VIII находится также в R конфигурации. Если соединение VII находится в S конфигурации, то и соединение VIII находится также в S конфигурации.-6 012588 Предпочтительно, когда соединение VII находится в R конфигурации. Параметр энантиомерной чистоты может быть применен mutatis mutandis к энантиомерным смесям. Если соединение VII представляет собой смесь R и S конфигураций, то соединение VIII представляет собой, в основном, ту же самую смесь R и S конфигурации, т.е., отношение R и S конфигураций остается, по существу, неизменным, или получают энантиомерное отношение, как указано ниже. Полученное энантиомерное отношение соединения VIII может составлять по крайней мере 88%, предпочтительно по крайней мере 90%, более предпочтительно по крайней мере 95, 96, 97, 98 или 99% энантиомерного отношения соединения VII."Одностадийная реакция" имеет такое же значение, как обсуждалось выше. Реакционная схема превращения соединения VII в соединение VIII является обобщением Ометилирования по данному изобретению соединения формулы I с получением соединения формулы II,как описано выше. Если соединение VII находится в R конфигурации, R1 представляет собой Н, R2 представляет собой Н, R3 представляет собой Н и R представляет собой Rx, то соединение VIII соответствует соединению формулы II и может быть использовано для получения лакозамида, например, при помощи реакционных стадий, как описано выше. Исходя из соединения II или VII, лакозамид может быть получен любым подходящим способом, вводя N-бензиламидную группу и N-ацетильную группу. Поэтому, в конкретном предпочтительном варианте осуществления, соединение VII находится в R конфигурации иR4 представляет собой Rx. Наиболее предпочтительно, когда R4 представляет собой Rx, R1 представляет собой Н, R2 представляет собой Н, R3 представляет собой и соединение VII находится в R-конфигурации. О-Метилирование соединения VII настоящего изобретения может быть достигнуто путем добавления к соединению формулы VII метилирующего агента в присутствии металлорганического соединения,в частности, литийорганического соединения, как определено выше. Подходящие метилирующие агенты такие, как определены выше. В альтернативном пути, селективное О-метилирование спиртовой группы может быть осуществлено с помощью катализа фазового переноса, как определено выше. Конкретные варианты О-метилирования соединения формулы VII соответствуют конкретным вариантам способа получения лакозамида, включающего О-метилирование соединения формулы I, как описано выше, в частности конкретные варианты, относящиеся к катализу фазового переноса, катализаторам фазового переноса, в частности для соединения формул VI, V и VI, реакционной системе фазового переноса и е компонентам, металлоорганическим соединения, условиям реакции во время катализа фазового переноса или в присутствии металлоорганического соединения, дополнительным реакционным стадиям и условиям реакций, приводящих к получению лакозамида, включая образование N-бензиламида, снятие защиты с N-защиты и N-ацетилирование и т.д. Выход реакции метилирования соединения VII способом по данному изобретению может составлять по крайней мере 85%, предпочтительно по крайней мере 90% при использовании металлорганического соединения. При использовании РТС выход реакции метилирования соединения VII может составлять по крайней мере 85%, предпочтительно по крайней мере 90%, ещ более предпочтительно по крайней мере 91, 92, 93, 94, 95 или 96%. Благодаря тому факту, что во время О-метилирования производных D- и/или L-серина в способе по данному изобретению, по существу, не образуется метиловый эфир и не наблюдается заметной рацемизации продукта, способ по данному изобретению получения соединения формулы VIII путем метилирования соединения формулы VII приводит к повышению выхода и повышению энатиомерной чистоты продукта. Осуществление изобретения Далее данное изобретение иллюстрируется фиг. 1 (включая альтернативные стадии 1a или 1b) и нижеследующими примерами. Пример 1. Получение (R)-2-N-Вос-амино-3-метоксипропановой кислоты (С-936), используя бутиллитий (стадия 1 а). Раствор N-Boc-D-серина (22 г, 0,107 моль) в сухом тетрагидрофуране (352 мл) охладили до-10 С в атмосфере азота. К этому раствору добавили через воронку 15%-ный раствор мас./мас. н-бутиллития в гексане (134 мл, 0,216 моль), поддерживая температуру 10 С. Полученную суспензию перемешивали в течение одного часа при 0-5 С. Диметилсульфат (12,1 мл, 0,128 моль) перемешивали при температуре 05 С и реакционную смесь перемешивали в течение 9 ч при температуре 0-5 С. Реакцию прекратили добавлением воды (110 мл), подщелачили до рН 10-13 30%-ным раствором гидроксида натрия (3 мл) и тетрагидрофуран/гексан выпарили в вакууме. Осадок промыли толуолом (44 мл) и затем подкислили до рН 3,5 50 %-ным раствором лимонной кислоты. Подкисленную водную фазу проэкстрагировали метиленхлоридом (291 мл, 166 мл) и комбинированные экстракты С 936 высушили азеотропной перегонкой. Выход выпаренного продукта 23,7 г, чистота по ВЭЖХ 90,0%, хиральная чистота 100%. Пример 2. Получение (R)-2-N-Вос-амино-3-метоксипропановой кислоты (С-936), используя РТС(стадия 1b). Суспензию N-Boc-D-серина (22 г, 0,107 мол.) и тетрабутиламмонийбромида (1,3 г, 0,004 моль) в толуоле (110 мл) охладили до 10 С. К этой суспензии добавили гидроксида натрия (17,6 мл, 0,107 моль),-7 012588 поддерживая температуру 10 С и полученную смесь перемешивали в течении при 10 С. Диметилсульфат (40,6 мл, 0,429 моль) и 50%-ный раствор гидроксида натрия (25,4 мл, 0,485 моль) перемешивали при температуре 10 С в течение одного часа. В реакционную смесь добавили воду (66 мл) и разделили фазы. Подкислили водный раствор до рН 3,5 50% лимонной кислотой, экстрагировали метиленхлоридом (291 мл, 166 мл) и комбинированные экстракты С-936, высушили азеотропной перегонкой. (Выход после выпаривания 27 г, 100%, ВЭЖХ чистота 96,3%, хиральная чистота 98,1%) Пример 3. Стадии 2-4. Раствор (R) бензил -2-N-Boc-амино-3-метоксипропионамида (С-937) (стадия 2). Раствор С 936, приготовленный как было указано в примере 2, охладили до 10 С и добавили к смеси изобутилхлорформиата (14 мл, 0,107 моль) при -5 С и N-метилформалина (11,8 мл, 0,17 моль),охлажднной до -5 С, и смесь перемешивали в течение 30 мин при -5 С. Добавили раствор бензиламина (12,2 мл, 0,11 моль) в метиленхлориде при -5 С и смесь нагревали до комнатной температуры. После часового перемешивания смесь промывают водой (44 мл) 1N HCl (44 мл), 8%-ным раствором бикарбоната натрия (44 мл) и водой (44 мл) с образованием раствора С-937 в метиленхлориде. Раствор (R)-2-амино-N-бензил-3-метоксипропионамида (стадия 3). К вышеприготовленному раствору С-937 добавили 36%-ный раствор HCl (46,5 мл, 0,541 моль) и смесь перемешивали в течение одного часа. Добавили воду (66 мл) и разделили фазы. Органическую фазу экстрагировали водой (22 мл) и комбинировали водные слои. Подщелачивали до рН 10-12 30%-ным раствором гидроксида натрия при 35 С и добавляли хлорид натрия (8,8 г). Водные слои экстрагироваллли метиленхлоридом (2110 мл) и комбинированные органические слои промыли водой (44 мл) с получением раствора (R)-2-амино-N-бензил-3-метоксипропионамида в метиленхлориде. Лакозамид (стадия 4). Приготовленный выше раствор (R)-2-амино-N-бензил-3-метоксипропионамида охладили до температуры 5 С и добавили уксусный ангидрид (10 мл, 0,106 моль) при температуре 15 С- Реакционную смесь нагрели до комнатной температуры в течение 30 мин и перемешивали в течение 30 мин. Затем смесь промывали водой (44 мл), 8%-ным раствором бикарбоната натрия (44 мл) и водой (44) мл. Метиленхлорид был заменн на этилацетат перегонкой и раствор перегоняли до объма 115 мл. Продукт кристаллизовали при охлаждения раствора до 0-5 С и чистый лакозамид отделяли фильтрованием (18,7 г,69,8%) с чистотой по ВЭЖХ 99,98%, с хиральной чистотой 99,8% с ошибкой в пределах допустимости. Пример 4. Выделение (R)-2-амино-N-Boc-бензил-3-метоксипропановой кислоты (С-936). Раствор (R)-2-амино-N-Boc-бензил-3-метоксипропановой кислоты (С-936), приготовленный по примеру 1, выпарили в вакууме с образованием (R)-2-амино-N-Boc-бензил-3-метоксипропановой кислоты (С-936) до состояния тврдого воска (23,7 г, 100%). Чистота по ВЭЖХ 90,0%. Элементный анализC9H17NO5 вычислено 49,31% С; 7,82% Н; 6,39% N. Найдено 49,12% С; 7,72% Н; 8,97% N. Пример 5. Выделение (R) бензил-2-N-Boc-амино-3-метоксипропионамид (С-937). Раствор (R) бензил-2-N-Вос-амино-3-метоксипропионамида (С-937), приготовленный по вышеуказанному примеру 3, выпарили в вакууме с образованием неочищенного С 937 в виде маслянистого осадка. Неочищенный осадок (2 г) растворили в 10%-ном растворе хлороформа в гексане (30 мл) при 60 С,охладили до комнатной температуры и выдержали при этой температуре в течение 1 ч. Полученный осадок растворили 10%-ным раствором хлороформа в гексане, охладили до комнатной температуры и выдержали в течение 1 ч при этой температуре. Полученные тврдые вещества отделяли фильтрованием с образованием неочищенного С-937 (1,1 г). Это тврдое вещество затем перекристаллизовали дважды в 10 объмах 10%-ного раствора хлороформа в гексане с получением (R)-N-бензил-2-N-Вос-амино-3 метоксипропионамид (С-937) в виде белого кристаллического тврдого вещества (0,28 г, 14%). Чистота по ВЭЖХ 97,3%. Элементный анализ для C16H24N2O5 вычислено 62,32% С; 7,84% Н; 9,08% N. Найдено 62,19% С; 7,79% Н; 9,04% N. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (лакозамид), включающий О-метилирование соединения формулы I формула I с получением соединения формулы II формула II где Rx является N-защитной группой,-8 012588 отличающийся тем, что О-метилирование осуществляют одностадийной реакцией и получают соединение формулы II какR-энантиомер по меньшей мере 88% чистоты и способ осуществляют либо (а) катализом фазового переноса, либо (б) путм добавления метилирующего агента и литийорганического соединения к соединению формулы I. 2. Способ по п.1, где способ включает добавление метилирующего агента в реакционную систему фазового переноса, включающую соединение формулы I, водную фазу, органическую фазу и катализатор фазового переноса. 3. Способ по п.2, где в качестве катализатора фазового переноса используют соль пиридиния, фосфония, аммония или сульфония. 4. Способ по любому из пп.2, 3, где катализатор фазового переноса выбирают из соединений: формула VI где если присутствуют R, R', R" и R'", то они являются независимо выбранными алкильной, арильной или аралкильной группами;Q в соединениях формулы IV представляет собой азот или фосфор иX представляет собой галоидную, ацетатную, п-толулосульфонатную, трифторметансульфонатную,гексофторантимонатную, гидроксидную, перхлоратную, гидросульфатную, тиоцианатную или тетрафторборатную группу. 5. Способ по любому из пп.2-4, где катализатор фазового переноса представляет собой тетрабутиламмонийбромид. 6. Способ по любому из пп.2-5, где используемый в катализе фазового переноса метилирующий агент выбирают из диметилсульфата, триметилфосфата или йодистого метила. 7. Способ по любому из пп.2-6, где водная фаза представляет собой водный раствор гидроксида натрия, водный раствор гидроксида лития, водный раствор гидроксида калия, водный раствор карбоната натрия или водный раствор карбоната калия. 8. Способ по любому из пп.2-7, где органический растворитель представляет собой толуол, гексан,метиленхлорид или метил-трет-бутиловый эфир. 9. Способ по любому из пп.1-8, где катализ фазового переноса осуществляют при 0-10 С в течение по меньшей мере 30 мин. 10. Способ по п.1, где метилирующий агент, используемый вместе с литийорганическим соединением, представляет собой диметилсульфат. 11. Способ по любому из пп.1 или 10, где литийорганическое соединение представляет собой бутиллитий. 12. Способ по любому из пп.1 или 10, 11, где О-метилирование в присутствии литийорганического соединения осуществляют при температуре 0-10 С в течение по меньшей мере 5 ч. 13. Способ по любому из предшествующих пунктов, дополнительно включающий реакцию соединения II с бензиламином с получением соединения формулы III формула III и затем заменяют защитную группу Rx на метилкарбонил с образованием (R)-2-ацетамидо-Nбензил-3-метоксипропионамида (лакозамида). 14. Способ по п.13, где реакцию соединения формулы II с бензиламином осуществляют в присутствии активатора карбоксильной группы и основания.-9 012588 15. Способ по п.14, где основание представляет собой 4-метилморфолин, триэтиламин, диизопропилэтиламин, 1.8-диазабицикло[5.4.0]ундец-7-ен или бикарбонат калия и активатор карбоксильной группы представляет собой алкилхлорформиат или карбодиимид. 16. Способ по любому из пп.13-15, где N-защитную группу Rx заменяют на метилкарбонил последовательно:(а) отщепляя защитную группу Rx в соединении формулы III добавлением (i) минеральной кислоты или (ii) Н 2/Pd-C с образованием (R)-2-амино-N-бензил-3-метоксипропионамида, а затемb) добавляя метилкарбонильную группу к (R)-2-амино-N-бензил-3-метоксипропионамиду по реакции (R)-2-амино-N-бензил-3-метоксипропионамида с уксусным ангидридом. 17. Способ по п.16, где стадию (b) осуществляют в отсутствие пиридина. 18. Способ по любому из пп.13-15, в котором N-защитную группу Rx отщепляют с получением (R)2-амино-N-бензил-3-метоксипропионамида. 19. Способ по любому из предшествующих пунктов, где лакозамид выделяют из конечной реакционной смеси кристаллизацией. 20. Способ по любому из предшествующих пунктов, где N-защитная группа представляет собой трет-бутоксикарбонил (Boc). 21. Способ по любому из предшествующих пунктов, включающий стадию N-ацетилирования (R)-2 амино-N-бензил-3-метоксипропионамида уксусным ангидридом в отсутствие основания, в частности в отсутствие пиридина. 22. Способ по любому из предшествующих пунктов, в котором соединение формулы II представляет собой (R)-2-N-Boc-амино-3-метоксипропановую кислоту (С-936) или ее соли. 23. (R)-N-Бензил-2-N-Boc-амино-3-метоксипропионамид (С-937) или любые его соли. 24. Применение (R)-N-бензил-2-N-Boc-амино-3-метоксипропионамида (С-937) или любых его солей в способе получения (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (лакозамида) по пп.1-22. 25. Способ получения фармацевтической композиции, содержащей лакозамид, путм последовательных стадий:(a) получения лакозамида по любому из пп.1-22 и(b) смешивания лакозамида с фармацевтически приемлемыми эксципиентами. 26. Способ получения N-Boc-D-серина путм взаимодействия D-серина с ди-третбутилдикарбонатом в реакции фазового переноса. 27. Способ получения соединения формулы VIII, включающий О-метилирование соединения формулы VII формула VII с образованием соединения формулы VIII формула VIII где R1, R2 и R3 выбраны независимо из водорода, -SH, -NH2, -NO2, -CN, -СООН, -SOH, -SO2H,-SO3H, галогена, -OR10, -SR10, -NR10R11, -SOR10, -SO2R10, -SO3R10, замещенного или незамещенного алкила, замещенного или незамещенного С 2-С 6-алкенила, замещенного или незамещенного С 2-С 6-алкинила,-(CO)-R10, -(CO)-O-R10, -O-(CO)-R10, замещенного или незамещенного арила, замещенного или незамещенного С 3-С 13-гетероарила, содержащего 1-3-гетероатома, независимо выбранных из N, S, О, замещенного или незамещенного аралкила, замещенного или незамещенного С 7-С 15-алкарила, замещенного или незамещенного С 4-С 14-гетероаралкила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; замещенного или незамещенного С 4-С 14-алкгетероарила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; или замещенного или незамещенного С 3-С 12-циклоалкила, содержащего 0-3 гетероатома, независимо выбранных из N, S, О;R4 представляет собой Н, N-защитную группу и/или группу, как описано для R1; иR10 и R11 выбраны независимо из водорода, замещенного или незамещенного алкила, замещенного или незамещенного С 2-С 6-алкенила, замещенного или незамещенного С 2-С 6-алкинила, замещенного или- 10012588 незамещенного арила, замещенного или незамещенного С 3-С 13-гетероарила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О, замещенного или незамещенного аралкила, замещенного или незамещенного С 7-С 15-алкарила, замещенного или незамещенного С 4-С 14-гетероаралкила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; замещенного или незамещенного С 4-С 14 алкгетероарила, содержащего 1-3 гетероатома, независимо выбранных из N, S, О; или замещенного или незамещенного С 3-С 12-циклоалкила, содержащего 0-3 гетероатома, независимо выбранных из N, S, О,отличающийся тем, что О-метилирование проводят по одностадийной реакции, где соединение формулы VIII получают в той же самой конфигурации, что и соединение VII, с чистотой по меньшей мере 88%; и способ осуществляют либо (а) катализом фазового переноса, либо (b) добавлением метилирующего агента и литийорганического соединения к соединению формулы VII. 28. Способ по п.27, где R1 представляет собой Н, R2 представляет собой Н, R3 представляет собой Н 4 и R представляет собой N-защитную группу. 29. Способ по любому из пп.27 или 28, где соединение VII находится в R-конфигурации. Схема
МПК / Метки
МПК: C07C 275/10, C07C 273/18, C07C 231/02, C07C 275/16
Метки: схема, синтеза, лакозамида, усовершенствованная
Код ссылки
<a href="https://eas.patents.su/12-12588-usovershenstvovannaya-shema-sinteza-lakozamida.html" rel="bookmark" title="База патентов Евразийского Союза">Усовершенствованная схема синтеза лакозамида</a>
Предыдущий патент: Биотинилированные гексадекасахариды, их получение и применение
Случайный патент: Громкоговоритель












