Олигосахаридальгината и его производные, способ получения и применение
Номер патента: 11417
Опубликовано: 27.02.2009
Авторы: Гэнг Мэйю, Сун Гуангкианг, Ян Чжао, Гуан Хуаши, Ксин Ксианлианг
Формула / Реферат
1. Производное олигосахаридальгината или его фармацевтически приемлемая соль, характеризующееся тем, что производное олигосахаридальгината состоит из b-D-маннуроновой кислоты, соединённой a-1,4 гликозидной связью, и в нем в положении 1 восстановленного конца находится карбоксил, как показано в формуле (II)

где n представляет 0 или целое число от 1 до 19.
2. Производное по п.1, характеризующееся тем, что n=2-10.
3. Производное по п.2, характеризующееся тем, что n=4-8.
4. Способ получения производного олигосахаридальгината или его фармацевтически приемлемой соли, описанных в п.1, включающий следующие стадии:
кислотный гидролиз, при котором полиманнуронатный водный раствор помещают в автоклав на 2-6 ч при рН 2-6 и температуре 100-120шС;
доведение рН после окончания реакции гидролиза до величины рН 7;
окислительная деструкция, при которой добавляют окислитель и реакция продолжается от 15 мин до 2 ч при температуре 100-120шС;
повторное доведение рН после окислительной деструкции до величины рН 7.
5. Способ по п.4, характеризующийся тем, что названный полиманнуронат представляет собой полиманнуронат натрия и названный кислотный гидролиз проводят 4 ч при рН 4 и температуре 110шС.
6. Способ по п.4, характеризующийся тем, что после доведения рН до 7 проводят осаждение спиртом, а осадок отфильтровывают, обезвоживают, высушивают и обессоливают.
7. Способ по п.4, характеризующийся тем, что окислитель представляет собой гидрат окиси меди, а окислительную деструкцию проводят 30 мин при температуре 100шС.
8. Применение олигосахарида маннуроновой кислоты формулы (I) для изготовления лекарства для лечения и профилактики AD, являющегося ингибитором образования b-амилоида, и лекарства для лечения и профилактики диабета, являющегося ингибитором образования островков волокон амилоида и промотором деструкции волокна
где n представляет 0 или целое число от 1 до 19.
9. Фармацевтическая композиция, содержащая эффективное количество производного олигосахарида маннуроновой кислоты, охарактеризованного в пп.1-3, и фармацевтически приемлемый носитель или его фармацевтически приемлемые соли.
10. Композиция по п.9, характеризующаяся тем, что представляет собой средство для профилактики или лечения AD, является ингибитором образования волокон белка b-амилоида, а также представляет собой средство для профилактики и лечения диабета, является ингибитором образования островков волокон амилоида, промотором деструкции волокна.
Текст
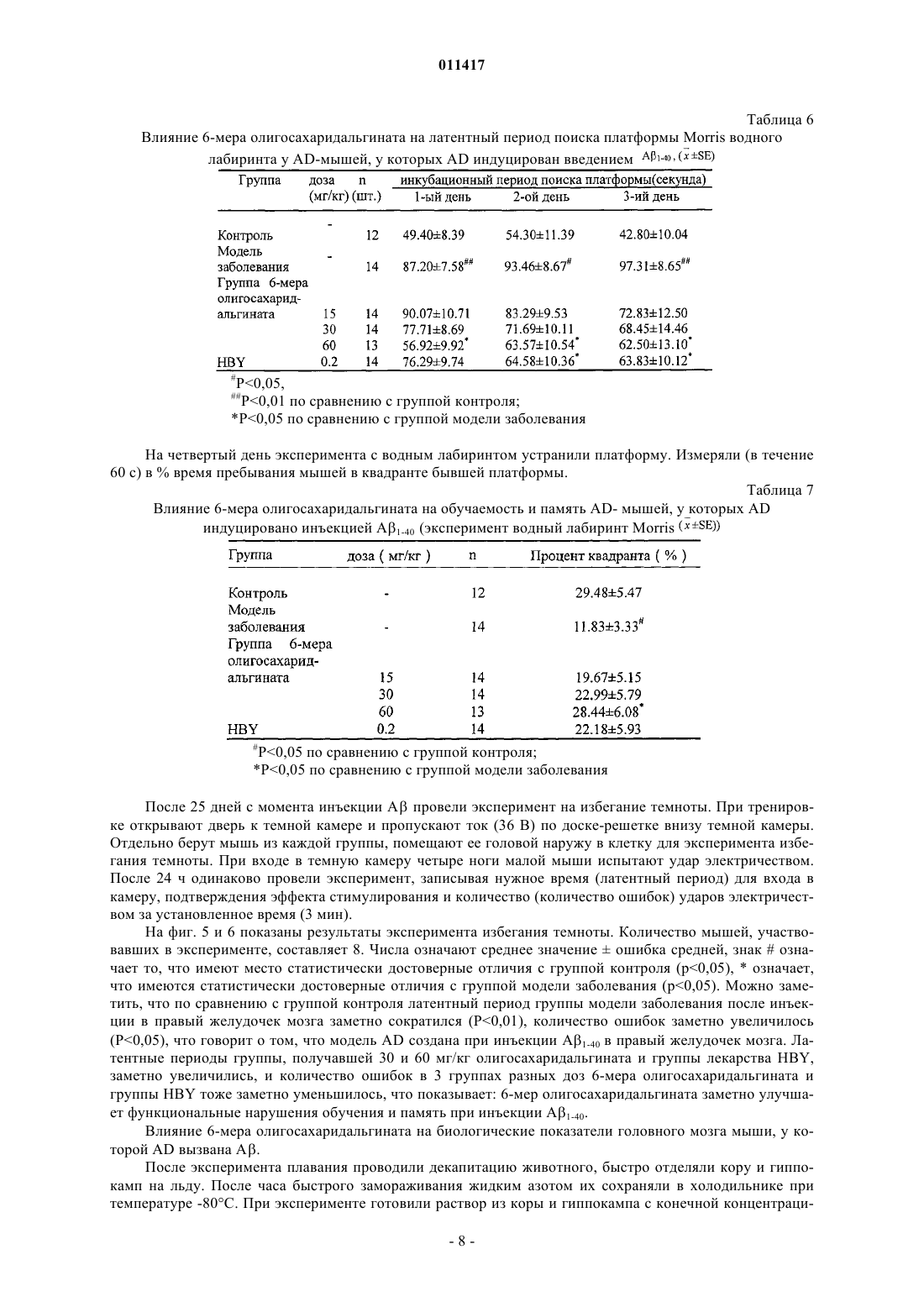
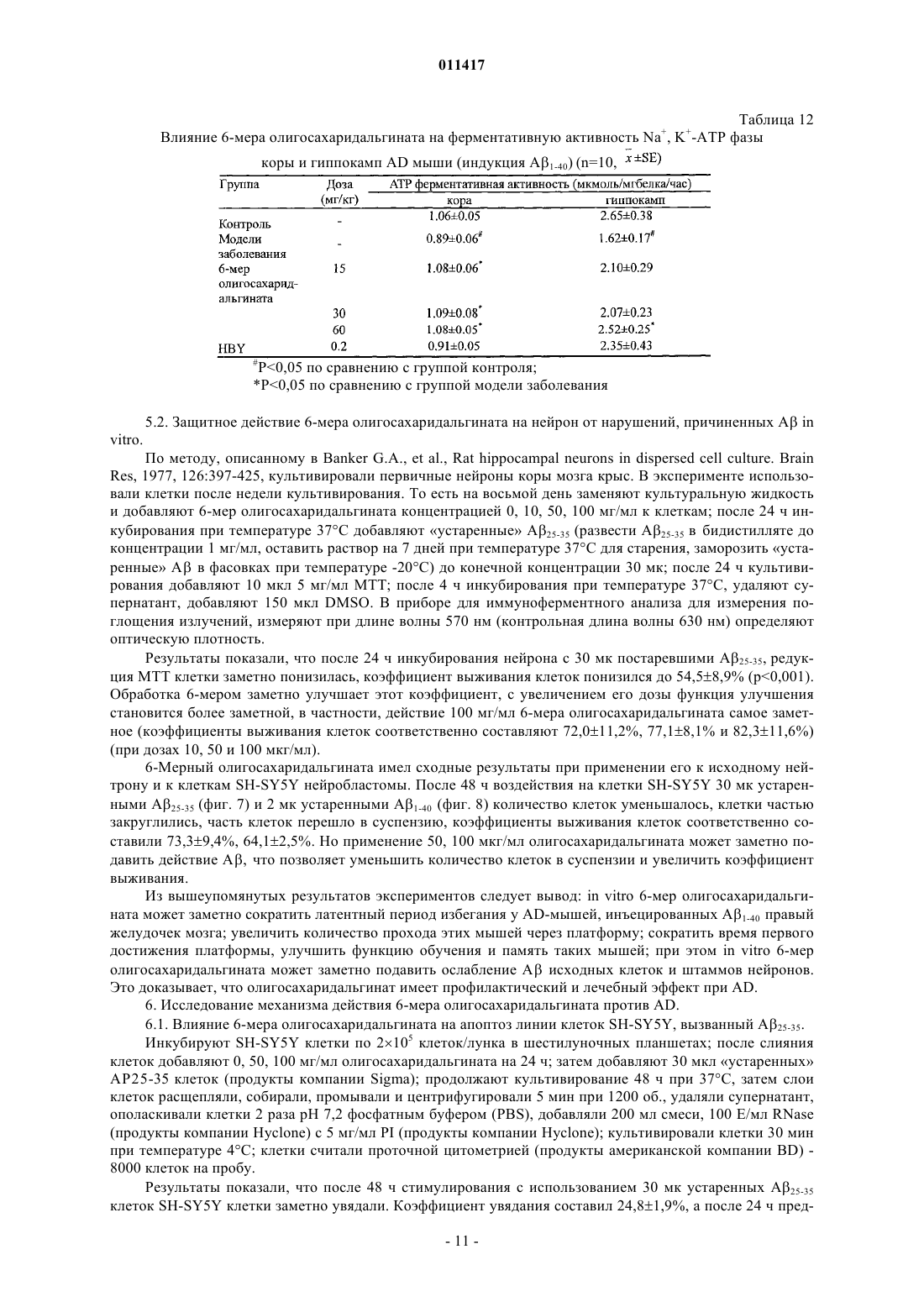
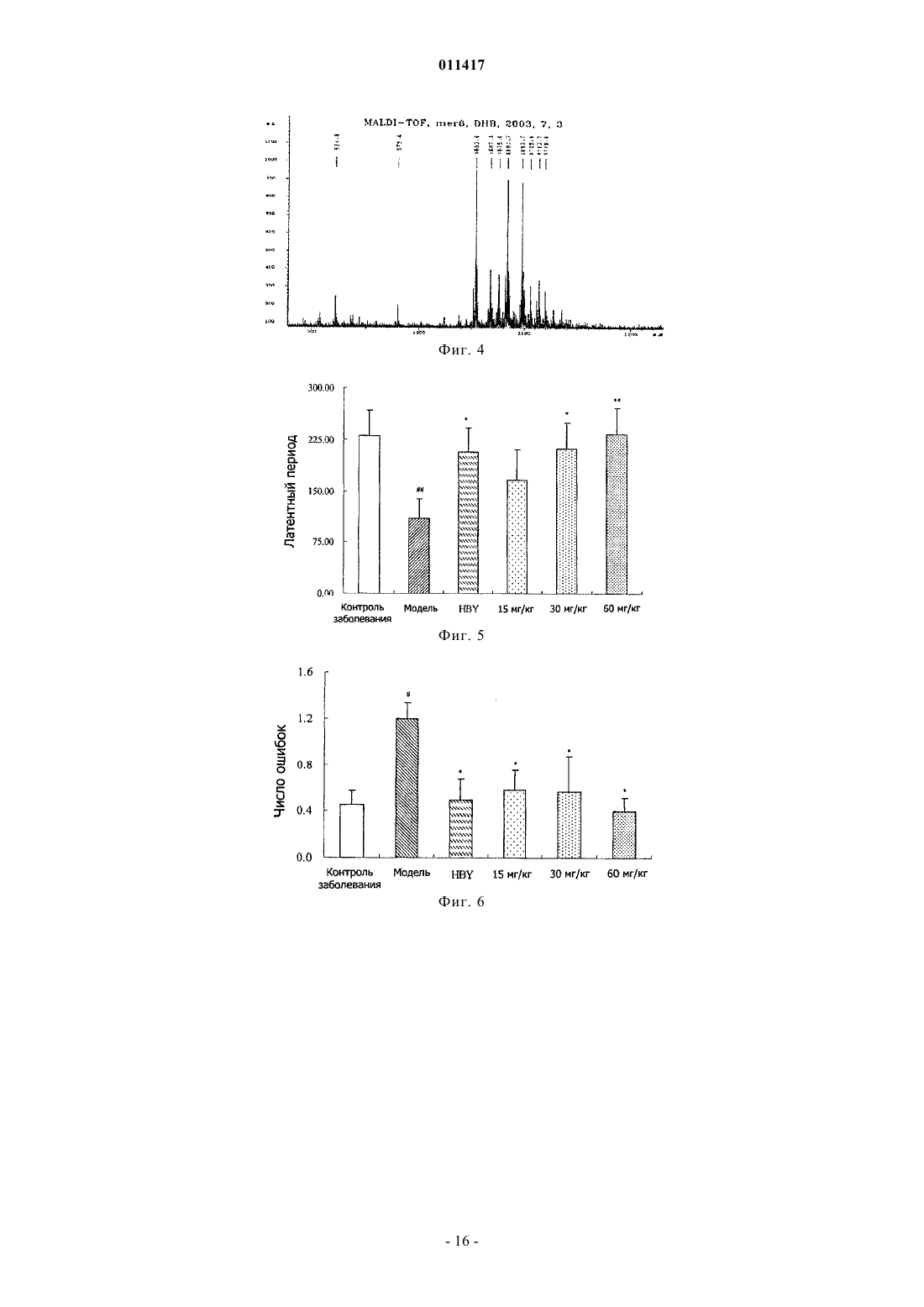
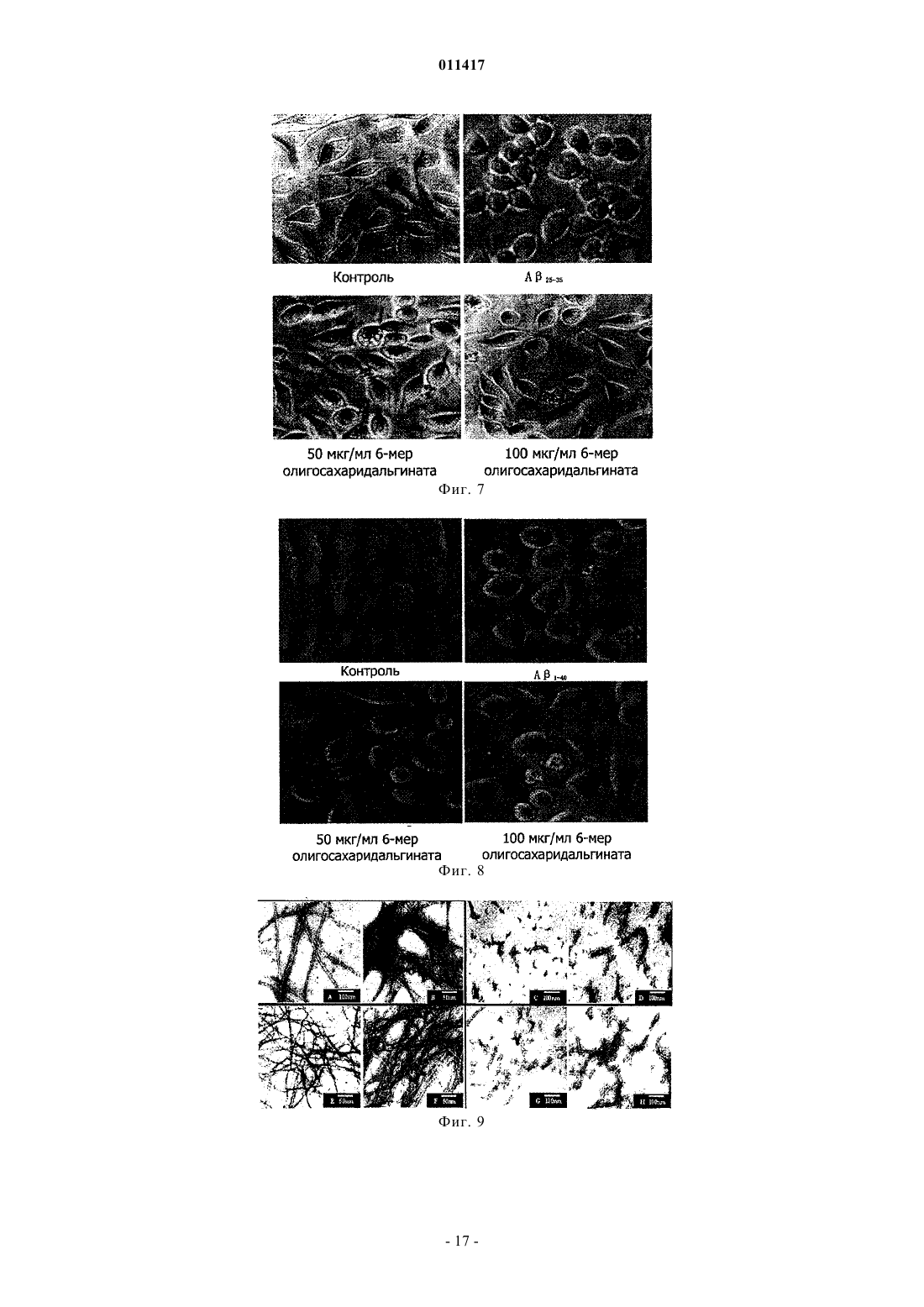
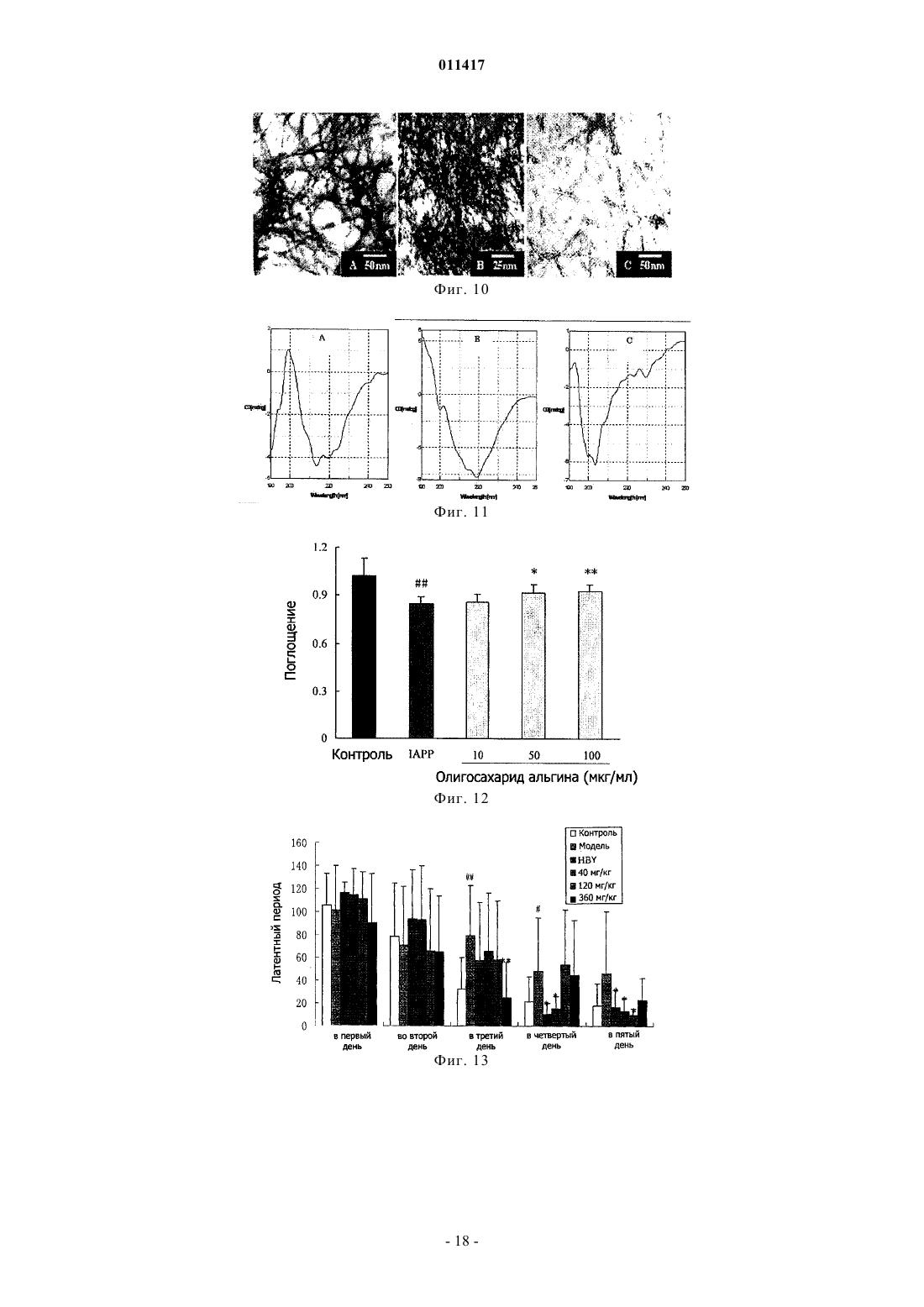
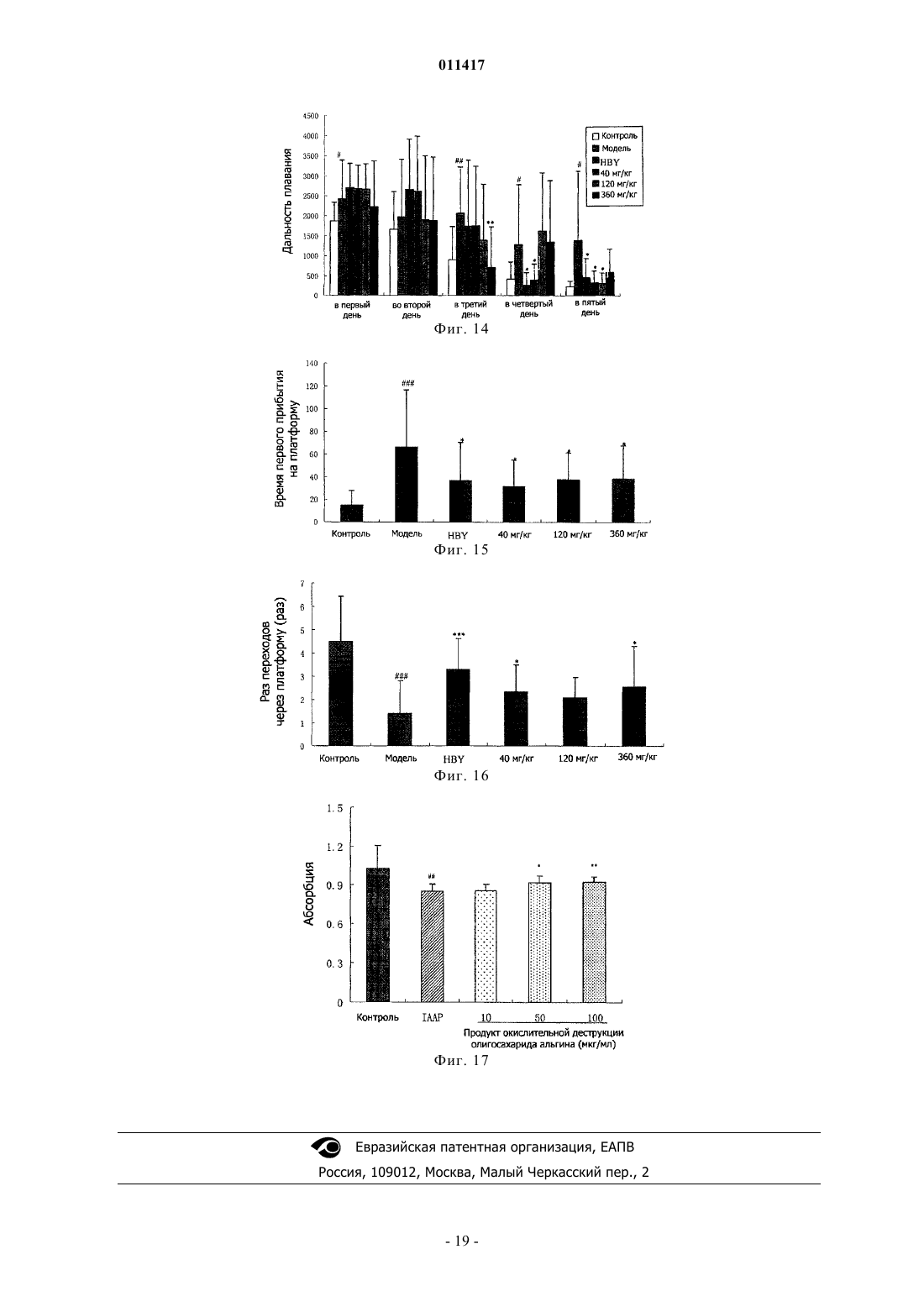
011417 Область техники, к которой относится изобретение Настоящее изобретение касается олигосахаридальгината и его производных, способа их получения и применения при лечении болезни Альцгеймера (AD) (старческого слабоумия) и диабета. Уровень техники В настоящее время AD и диабет являются широко распространнными и обычными болезнями,серьзно опасными для здоровья человека. В мире с увеличением количества стариков заболеваемость повышается год от года. Поэтому борьба с AD и диабетом становится все более важной. В настоящее время средства для борьбы с AD в большинстве случаев имеют недостатки, а именно ненаджный лечебный эффект, большое вредное побочное действие, лекарства для борьбы с диабетом включают в себя, главным образом, инсулин и гипогликемические лекарства, принимаемые внутрь, которые имеют недостатки: неудобное применение, большое вредное побочное действие. Кроме того, отсутствует эффективное лекарство для борьбы с диабетом 2 типа. Исследование показывает, что процессы заболеваний AD и диабета 2 типа связаны с депонированием амилоида- (А), и амилина (IAAP), образованием волокна и усилением свободно-радикального окисления. Поэтому ингибирование образования волокна амилоида- и амилона может оказаться эффективным путем для профилактики и лечения этих заболеваний. Альгинаты являются главным компонентом клеточной стенки бурых водорослей и представляют собой линейный анионный полисахарид, состоящий из соединнных 1-4 гликозидной связью из -Dманнуроновой кислоты и -L-гулуроновой кислоты. Альгинаты относятся к высокомолекулярным соединениям, молекулярный вес которых составляет обычно от 104 до 106 Да. Альгинаты широко применяются в пищевой, химической и медицинской промышленности. Недавние исследования показали, что альгинат имеет много активностей. Однако его лекарственное применение в определнной степени ограниченно из-за большого молекулярного веса. Поэтому олигосахаридальгинат, отщепленный от альгината путем деструкции последнего, имеет важное исследовательное значение в областях сахарной химии, сахарной биологии, сахарной инженерии и исследованиях сахаридного лекарства. Деструкция альгината может быть осуществлена равными способами, включая энзимную деструкцию (ферментативный гидролиз), химическую деструкцию и физическую деструкцию. Однако поскольку для энзимной деструкции нужен конкретный, специфический энзим, эта методика имеет ограничение. Физическая деструкция применяется обычно вместе с другой методикой,но может обеспечить предельный молекулярной вес продукта деструкции только около 50000 Да. Химическая деструкция сахарида обычно включает кислотной гидролиз и окислительную деструкцию, но в связи с тем, что обычный ацидолиз проводится при нормальной температуре и давлении, трудно получить олигосахарид с молекулярным весом ниже 4000 Да, применение данного метода также ограниченно. Раскрытие изобретения Учитывая вышеуказанные обстоятельства, заявитель провел глубокое исследование и обнаружил,что кислотной гидролиз при высокой температуре и высоком давлении позволяет получить олигосахаридальгинат бурых водорослей с молекулярным весом ниже 4000 Да, а также его производные в присутствии окислителя, чей восстановленный в позиции 1 конец представляет собой карбоксил. Изобретение основано на этом открытии. Таким образом, настоящее изобретение касается олигосахаридальгината бурых водорослей с низким молекулярным весом, его производных и фармацевтически приемлемых солей, а также способа получения этих соединений. Настоящее изобретение также касается лекарственного средства для лечения и профилактики AD и диабета, содержащего указанный выше низкомолекулярный олигосахаридальгинат,его производное или фармацевтически приемлемую соль. Настоящее изобретение касается олигосахаридальгината формулы I, его производных и их фармацевтически приемлемых солей. Данный олигосахарид состоит из частей -D-маннуроновой кислоты,соединнных -1,4 гликозидной связью. где n представляет 0 или целое число от 1 до 19. Соединение формулы (II) является примером производного олигосахаридальгината, в котором восстановленный конец в положении 1 представляет собой карбоксил. где n представляет 0 или целое число от 1 до 19.-1 011417 В вышеуказанных формулах (I) и (II) n предпочтительно равен 2-10, более предпочтительно n = 4-8. Пока неизвестно, почему биологический эффект тетрасахарида-додесахарида (гексасахаридадекасахарида лучше) хороший, может быть потому, что клетка организма их легко опознает и принимает. Описанное производное олигосахаридальгината включает также производное, в котором часть гидроксильных групп в маннуроновой кислоте сульфатирована. Фармацевтически приемлемая соль олигосахаридальгината или производного олигосахаридальгината представляет собой, например, натриевую, калиевую, кальциевую и магниевую соль, среди них натриевая соль предпочтительна. Эта соль может быть получена обычным способом. Способ получения олигосахаридальгината или его производного в настоящем изобретении характеризуется тем, что альгинатный раствор помещают в автоклав высокого давления, реакция продолжается 2-6 ч при рН 2-6 и температуре 100-120 С; после окончания реакции величину рН доводят до 7; продукт окислительной деструкции получают добавлением окислителя в раствор олигосахаридальгината. В соответствии с предпочтительным воплощением способа по настоящему изобретению 0,5-5%ный альгинатный раствор помещают в автоклав высокого давления, нагревают и поддерживают реакцию 4 ч при рН 4 и температуре 110 С. После окончания реакции реакционную смесь откачивают, охлаждают, устанавливают рН 7 раствором NaOH. При перемешивании медленно вливают фильтрат в промышленный спирт объмом в 4 раза выше, чем фильтрат, и оставляют на ночь для осаждения. На другой день фильтруют нерастворнное вещество досуха, затем обезвоживают его абсолютным этанолом, помещают полученную белую фильтрованную лепешку в сушильный шкаф при температуре 60 С и сушат, получая неочищенный олигосахаридальгинат. Готовят 10%-ный раствор этого неочищенного олигосахаридальгината, проводят осаждение 95%-ным раствором этанола, осадок промывают безводным этанолом, высушивают и готовят 5%-ный раствор. Этот раствор фильтруют через плнку 3 мкм для удаления включений, затем обессоливают на колонке Bio-Gel-P6 (1,6180 см), подвижная фаза 0,2 мольл-1 NH4HCO3. Продукт последовательно собирают, элюат проверяют с помощью сернокисло-карбазольного метода,объединяют фракции, содержащие сахариды, концентрируют при пониженном давлении и обессоливают, лиофилизируют, получая олигосахаридальгинат. Получение производного формулы (II). После реакции 0,5-5%-ного альгинатного раствора в течение 2-6 ч в автоклаве высокого давления при рН 2-6 и температуре 100-120 С добавляют окислитель. Реакция продолжается от 15 мин до 2 ч при температуре реакции 100-120 С. В соответствии с лучшим воплощением добавляют 25 мл 5%-ного раствора сульфата меди к 50 мл 10%-ного водного NaOH, сразу перемешивают и добавляют 40 мл 5%-ного раствора олигосахаридальгината; полученную смесь нагревают на водяной бане до прекращения образования кирпичного осадка. Смесь центрифугируют для удаления этого осадка, супернатант добавляют к смеси 5%-ного сульфата меди с 10% NaOH в соотношении, указанном выше. Проверяют наличие кирпичного осадка. При его отсутствии надосадочную жидкость добавляют в промышленный спирт объмом в 4 раза большим, чем у надосадочной жидкости и оставляют на ночь для осаждения. На другой день отфильтровывают осадок досуха, затем промывают его безводным этанолом повторно для обезвоживания, помещают осадок в сушильный шкаф при температуре 60 С и высушивают и отделение проводят так же, как олигосахаридальгината формулы (I). Настоящее изобретение также касается фармацевтической композиции, содержащей эффективное количество вышеуказанных олигосахаридальгинатов, или их производных, или их фармацевтически приемлемых солей. Данная фармацевтическая композиция может быть полезна в качестве средства для профилактики и лечения AD. Кроме того, данная фармацевтическая композиция также может быть использована в качестве ингибитора образования волокна -амилоида и промотора деструкции волокна. Данная фармацевтическая композиция может быть полезна в качестве средства для профилактики и лечения диабета. Более того, данная фармацевтическая композиция может быть использована в качестве ингибитора образования волокна белкового амилоида в островковых клетках панкреатической железы и ингибитора образования полипептида амилоида в островковых клетках. Олигосахаридальгинат бурых водорослей по настоящему изобретению применяется в изготовлении средств для борьбы со старческим слабоумием и диабетом, что имеет очень важное значение для решения вопроса, касающегося отсутствия лечебного лекарства от старческого слабоумия и диабета. Краткое описание фигур Фиг. 1 представляет собой кривую элюции олигосахаридальгината при разделении на колонке Biogel-Р 6 после кислотной деструкции по настоящему изобретению,фиг. 2 - спектр MALDI-TOF олигосахаридальгината по настоящему изобретению,фиг. 3 - кривую элюции продукта окислительной деструкции олигосахаридальгината при разделении на колонке Bio-gel-P6,-2 011417 фиг. 4 - спектр MALDI-TOF (Positive mode) продукта окислительной деструкции олигосахаридальгината,фиг. 5 - влияние олигосахаридальгината по настоящему изобретению на латентный период у AD мыши, у которой AD вызван А 1-40 (тест на нарушение обучения и памяти, в эксперименте избегания темноты),фиг. 6 - влияние олигосахаридальгината настоящего изобретения на количество ошибок у мыши,под воздействием А 1-40, который ведет к нарушению обучения и памяти, в эксперименте избегания темноты,фиг. 7 - защитное действие олигосахаридальгината по настоящему изобретению на клетки SHSY5Y нейробластомы поврежденные (ослабленные) А 25-35,фиг. 8 - защитное действие олигосахаридальгината по настоящему изобретению на клетки SHSY5Y нейробластомы ослабленные А 1-40,фиг. 9 - ингибирующее действие олигосахаридальгината по настоящему изобретению на процесс образования волокна А 1-40, которое образуется естественным путем или является гепарининдуцированным,фиг. 10 - влияние олигосахаридальгината по настоящему изобретению на деструкцию волокна А 1-40,фиг. 11 - влияние олигосахаридальгината по настоящему изобретению на конформацию растворенного А 1-40 (250 мг/мл),фиг. 12 - защитное действие олигосахаридальгината по настоящему изобретению на клетки NIT,ослабленные IAAP,фиг. 13 - влияние смеси продуктов окислительной деструкции олигосахаридальгината по настоящему изобретению на латентный период поиска AD-мышью платформы в водном лабиринте Morris (AD вызвано инъекцией в мозг А 1-40),фиг. 14 - влияние смеси продуктов окислительной деструкции олигосахаридальгината по настоящему изобретению на дальность плавания AD-мыши в водном лабиринте Morris (AD вызвано инъекцией в мозг А 1-40),фиг. 15 - влияние смеси продуктов окислительной деструкции олигосахаридальгината по настоящему изобретению на время первого прибытия на платформу AD-мыши в водном лабиринте Morris (AD вызвано инъекцией в мозг А 1-40),фиг. 16 - влияние смеси продуктов окислительной деструкции олигосахаридальгината по настоящему изобретению на число переходов через платформу AD-мыши в водном лабиринте Morris (AD вызвано инъекцией в мозг А 1-40),фиг. 17 - защитное действие смеси продуктов окислительной деструкции олигосахаридальгината по настоящему изобретению на клетки NIT, ослабленные IAAP. Осуществление изобретения Предпочтительные варианты воплощения изобретения 1. Получение олигосахаридальгината (бурых водорослей). Добавляют дистиллированную воду к 1 г полиманнуроната натриевой соли (молекулярный вес среднего веса 8,235 Да, поставлен фирмой Lantai Pharm. LTD., Ocean University of China), устанавливают соляной кислотой pH до 4; помещают альгинатный раствор в автоклав высокого давления; нагревают 4 ч при температуре 110 С. После охлаждения доводят рН до 7 водным раствором NaOH. При перемешивании медленно вливают фильтрат в промышленный спирт объмом в 4 раза выше, чем фильтрат; оставляют на ночь для осаждения; на другой день отфильтровывают нерастворнное вещество досуха и затем его обезвоживают, промывая абсолютным этанолом; полученную белую фильтрованную лепешку помещают в сушильный шкаф при температуре 60 С и сушат до получения заготовки олигосахаридальгината(неочищенный продукт). Готовят 10%-ный раствор из заготовки олигосахаридальгината и проводят осаждение 95% раствором этанола; осадок промывают абсолютным этанолом, высушивают и готовят 5%-ный раствор; этот раствор фильтруют через плнку 3 мкм для удаления включений; на колонке Bio-Gel-P6 (1,6180 см) проводят обессоливание и разделение (подвижная фаза представляет собой 0,2 мольл-1 NH4HCO3); последовательно собирают элюат, который проверяют по сернокисло-карбазольному методу; объединяют фракции, содержащие сахарные компоненты, концентрируют при пониженном давлении и обессоливают их на колонке G-10; далее дополнительно разделяют внешний объмный компонент на колонке Bio-GelP10 (1,6180 см); затем проводят лиофилизацию и получают олигосахаридальгинат (фиг. 1). 2. Получение продукта окислительной деструкции олигосахаридальгината. Готовят 5%-ный раствор из 5 г полученного выше олигосахаридальгината. Добавляют 25 мл 5%ного раствора сульфата меди к 50 мл 10%-ного NaOH (водный), немедленно перемешивают и добавляют в 5%-ный раствор олигосахаридальгината (40 мл); нагревают полученную смесь на водяной бане до прекращения возникновения кирпичного осадка. Центрифугируют для удаления осадка; супернатант добавляют при ранее указанном соотношении в смесь 5%-ного раствора сульфата меди с 10%-ным воднымNaOH до прекращения образования кирпичного осадка. Добавляют надосадочную жидкость в промыш-3 011417 ленный спирт объмом в 4 раза выше, чем объем надосадочной жидкости, и оставляют на ночь для осаждения; на другой день отфильтровывают осадок досуха и затем обезвоживают его, повторно промывая безводным абсолютным этанолом; осадок помещают в сушильный шкаф при температуре 60 С и сушат до получения заготовки продукта окислительной деструкции олигосахаридальгината (неочищенный продукт). Готовят 10%-ный раствор из заготовки продукта окислительной деструкции и осаждают в 95%-ным раствором этанола; осадок промывают абсолютным этанолом и после высушивания готовят 5%-ный раствор; этот раствор фильтруют через плнку 3 мкм для удаления включений, на колонке Bio-Gel-P6(1,6180 см) проводят обессоливание и разделение (подвижная фаза представляет собой 0,2 мольл-1NH4HCO3); последовательно собирают элюат, который проверяют по сернокисло-карбазольному методу; объединяют фракции, содержащие сахарные компоненты, концентрируют при пониженном давлении и обессоливают их на колонке с G-10; дополнительно разделяют компоненты внешнего объма на колонкеBio-Gel-P10 (1,6180 см); затем лиофилизируют, получая продукт окислительной деструкции олигосахаридальгината (фиг. 2). 3. Идентификация структуры олигосахаридальгината. Была идентифицирована структура олигосахаридов, содержащихся во фракциях, полученных при получении олигосахаридальгината по изобретению. Было подтверждено, что олигосахариды представляют собой олигосахаридальгинаты, состоящие из частей -D-маннуроновой кислоты, соединенных 1,4 гликозидной связью. Структурная формула где n представляет 0 или целое число от 1 до 19. Далее по тексту фракция элюата около 292 мл (обозначена как компонент 6 на фиг. 1, в последующем называется компонентом 6). 3.1. Ультрафиолетовая спектрограмма абсорбции. Разбавляют олигосахарид во фракции элюата около 292 мл до приемлемой концентрации и сканируют при 190-400 нм на спектрофотометре UV-2102 VV-VIS. Было найдено, что у данного компонента в ультрафиолетовой области отсутствует специфический пик абсорбции, что означает, что в структуре нет сопряжнного двойных связей. Однако в области на 190-200 нм была замечена неспецифическая абсорбция, поэтому при обессоливании данного олигосахарида можно проводить онлайновую проверку этой области. 3.2. Инфракрасная спектрометрия. Взвешивают 0,5 мг указанной выше фракции олигосахаридов. Их спектр изучили с помощью инфракрасного стилоскопа NEXUS-470 (KBr). Отмечено, что в положениях 3420,79; 3214,64; 2924,61 см-1 спектра имеется симметричное телескопическое колебание гидроксила, 1600,25 см-1 - симметричное телескопическое колебание карбонила карбоксилата, в 1406,54 см-1 - симметричное ножничное колебание гидроксила, в 1146,42 см-11 - симметричное телескопическое колебание карбонила, в 1045,77 см-1 - асимметричное телескопическое колебание циклического внутреннего эфира, в 804,02 см-11 - асимметричное телескопическое колебание циклического скелета маннуроновой кислоты. Это означает, что данное соединение содержит гидроксил, карбонил и структуру скелета цикла маннуроновой кислоты. 3.3. Анализ масс-спектров. В анализе масс-спектров применяется масс-спектрометр MALDI-TOF типа BIFLEX II от компанииBruker Daltonics. Как видно из масс-спектров (фиг. 2, табл. 1) пик 1073.9 (m/z) представляет собой пик молекулярного иона [М-Н]-1, пик 1096.6 (m/z) представляет [M+Na-2H]-1 пик 1028.0 (m/z) представляет[M-H2O-CO-H]-1, пик 821.2 (m/z) [М-ManA-CH2O-2H2O-H]-1, пик 704.3 (m/z) - [M-2ManA-H2O-H]-1, пик 634.4 (m/z) - [М-2 МапА-2(CH2O)-СО-Н]-1, пик 536.5 - [М-2 Н]2-, пик 357.4 - [М-3H]3-. В спектре ESI-MS олигосахарида указанной выше фракции пик молекулярного иона представляет m/z, составляет 1073.9,значит его молекулярный вес составляет 1074. Согласно вышеуказанным результатам измерений определено, что олигосахаридальгинат, который содержится в исследованной фракции элюатов, является гексасахаридом маннуроновой кислоты, имеющим следующую структуру (Ia) 3.5. Измерение содержания маннуроновой кислоты в образце олигосахаридальгината (1 Н-ЯМРспектроскопия). С помощью 1 Н-ЯМР с высоким коэффициентом различения исследовали состав олигосахаридальгината. По интенсивности сигнала протонаномерного углерода провели количественный анализ отношения маннуроновой кислоты и гулуроновой кислоты (M/G) в образце олигосахаридальгината. Взвешивают 3-5 мг сухого образца, растворяют в D2O при нейтральном pD, добавляют 0,3 мг EDTA, измеряют спектрометром ЯМР типа Bruker DPX-300, при температуре 70 С, записывают спектрограмму так, чтобы пик D2O отошл далеко от резонансной зоны аполярного протона; выражают относительную интенсивность сигнала в интегральных величинах площади пика. Результаты показывают: сигнал Н-1 радикала М представляет 4,64 и 4,66 млн ч. (соответственно предстает ММ и MG последовательности). Все сигналы Н-1 радикала G на 5,05 млн ч. (двойной пик). Относительное содержание М и G в образце может быть рассчитано по интенсивности их Н-1 пиков по формуле где I представляет интенсивность пика, представленную через величины площади пика. По данному методу измерено то, что относительное содержание D-маннуроновой кислоты в олигосахаридальгинате составляет 98,07%, значит образец олигосахаридальгината в основном состоит из маннуроновой кислоты.-5 011417 4. Идентификация структуры продукта окислительной деструкции олигосахаридальгината. Идентификация структуры продукта окислительной деструкции олигосахаридальгината во фракции, указанной выше, показала, что продукт окислительной деструкции данной серии олигосахаридальгината является фракцией производного олигосахаридальгината, состоящего из -D маннуроновой кислоты, соединнной -1,4 гликозидной связью, в позиции 1 восстановительного конца находится карбоксил, имеющего следующую структуру: где n представляет 0 или целое число от 1 до 19. Компонент 6 взят в качестве примера для иллюстрации анализа структуры продукта окислительной деструкции олигосахарида. 4.1. Анализ ультрафиолетовых спектров. Разбавляют необходимое количество продукта окислительной деструкции дистиллированной водой до некоторой концентрации и проводят сканирование на ультрафиолетовом спектрофотометре UV-260(190700 нм). Найдено, что у продукта окислительной деструкции олигосахаридальгината в областях ультрафиолетового и видимого света нет никакого специфического пика абсорбции. 4.2. Анализ инфракрасных спектров. На инфракрасном спектрометре NICOLE NEXUS-470 измерили инфракрасные спектры продукта окислительной деструкции олигосахаридальгината; результаты анализа приведены в табл. 4. Таблица 4 Результаты анализа спектрограммы IR продукта окислительной деструкции олигосахаридальгината 4.3. 1 Н-ЯМР-анализ. ЯМР-спектрометром Bruker Auance DPX-300 измерили спектры 1 Н NMR и 13 С NMR продукта окислительной деструкции олигосахаридальгината. По водородному спектру ЯМР видно, что спектрограмма в основном состоит из сигналов шести атомов водорода -D-маннуроновой кислоты. Отмечено, что молекула продукта окислительной деструкции олигосахаридальгината в основном состоит из маннуроновой кислоты. Если в позиции 1 восстановленного конца находится альдегидная группа, то химическое смещение Н-1 исоответственно должно быть 5,11 млн ч. и 4,81 млн ч. Но в позиции 1 восстановленного конца олигосахарида альгина находится карбоксил после окисления альдегидной группы, поэтому отсутствует Н-1, и на 5,11 млн ч. и 4,81 млн ч. нет сигнала. Результаты анализа ЯМР спектров C-NMR показывают, что спектрограмма образца в основном состоит из сигналов шести атомов углерода -Dманнуроновой кислоты. После того как возвратились расщепленные сигналы к исходному положению,узнали, что интермедиатная молекула состоит в основном из маннуроновой кислоты. Сравнение спектра интермедиата показало, что собственный сигнал С-1 восстановленного конца (94 млн ч.) исчез. Сигнал С-1 восстановленного конца сместился на 175,81 млн ч., поскольку в позиции 1 восстановленного конца олигосахаридальгината находится карбоксил как результат окисления альдегидной группы. 4.4. Анализ масс-спектров. В анализе масс-спектров применяли масс-спектрометр MALDI-TOF типа BIFLEX II от компанииBruker Daltonics. Результаты показаны на фиг. 4. Как видно, пик 1113.7 (m/z) представляет собой[M+Na]+1, пик 1113.7 (m/z) представляет [M-O+Na]+1, пик 1083.7 (m/z) представляет [M-CH2O+Na]+1, пик 1067.6 (m/z) - [М-CH2O-O+Na]+1, пик 1053.6 (m/z) - [M-2(CH2O)+Na]+1, пик 979.6 (m/z) - [M-3(CH2O)CO2+Na]+1, пик 921.6 - [M-4(CH2O)-CO2-CO+Na]+1. Анализ масс-спектров продукта окислительной дест-6 011417 рукции олигосахаридальгината показан в табл. 5. Таблица 5 Анализ масс-спектров продукта окислительной деструкции олигосахаридальгината На спектре MALDI-TOF продукта окислительной деструкции олигосахаридальгината m/z является пиком 1113.7, представляет [M+Na]+1, значит молекулярный вес продукта окислительной деструкции олигосахаридальгината составляет 1090.7. По сравнению с олигосахаридальгинатом (молекулярный вес 1075) после кислотного гидролиза он стал выше на 16, то есть в молекуле добавился один кислород, то есть можно считать, что в процессе изготовления олигосахаридальгинат был окислен. Согласно вышеуказанным результатам измерений химическая структурная формула продукта окислительной деструкции олигосахаридальгината (IIa) 5. Оценка лечебного эффекта олигосахаридальгината при болезни Альцгеймера (AD). В нижеприведенных испытаниях олигосахаридальгинат представляет собой гексасахарид (гексамер 6-мер), выделенный с помощью колонки Bio-Gel-P6. 5.1. Влияние 6-мерного олигосахаридальгината на мышиную модель (AD), индуцированную A1-40. Самцов мышей весом 18-22 г (поставленных Центром животных для эксперимента Шаньдунского университета), после их взвешивания случайным образом разделяют на 6 групп: контрольную группу,группу модели заболевания, 3 группы по назначениям доз олигосахаридальгината (15, 30, 60 мг/кг),группу 0,2 мг/кг лекарства сравнения Агиперцин-А (HBY, произведенный фармзаводом "Юйчжун" при компании "Чжулинь Чжуншэн" в провинции Хэнань). После разделения на 3-й день мышей стали кормить соответствующими лекарствами, количеством 0,5 мл/20 г. Группу контроля и группу модели заболевания кормят эквивалентным количеством физиологического раствора раз в день до конца эксперимента. На восьмой день введения лекарства по методу, описанному Jhoo J.H. et al., P-amyloid (1-42)-inducedBehavioural Brain Research (2004) 155: 185-196, индуцировали AD: инъецировали A1-40 правый желудочек мозга всех мышей, кроме группы контроля, для создания модели функционального нарушения обучения и памяти. С помощью водного лабиринта и эксперимента избегания темноты по биохимическим данным оценили влияние лекарства на обучение и память мыши. Результаты (фиг. 6) показали, что при сравнении с группой контроля группа модели заболевания показала явную или очень явную разницу(Р 0,05, Р 0,01) по латентному периоду поиска платформы, что говорит об успешном создании моделиAD с помощью инъекции A1-40 в правый желудочек мозга. В первый день, за исключением группы, получившей 15 мг/кг 6-мера олигосахаридальгината, по сравнению с группой модели заболевания латентные периоды у других групп показали тенденцию к сокращению, в частности латентный период у групп по сравнению с группой модели заболевания статически значимо сократился (Р 0,05). На второй, третий день латентные периоды у всех групп, которым давали лекарства, сократились по сравнению с группой модели заболевания, в частности, период группы 60 мг/кг 6-мера олигосахаридальгината и группы HBY достигли статистически значимого значения (Р 0,05).-7 011417 Таблица 6 Влияние 6-мера олигосахаридальгината на латентный период поиска платформы Morris водного лабиринта у AD-мышей, у которых AD индуцирован введением На четвертый день эксперимента с водным лабиринтом устранили платформу. Измеряли (в течение 60 с) в % время пребывания мышей в квадранте бывшей платформы. Таблица 7 Влияние 6-мера олигосахаридальгината на обучаемость и память AD- мышей, у которых AD индуцировано инъекцией A1-40 (эксперимент водный лабиринт Morris После 25 дней с момента инъекции А провели эксперимент на избегание темноты. При тренировке открывают дверь к темной камере и пропускают ток (36 В) по доске-решетке внизу темной камеры. Отдельно берут мышь из каждой группы, помещают ее головой наружу в клетку для эксперимента избегания темноты. При входе в темную камеру четыре ноги малой мыши испытают удар электричеством. После 24 ч одинаково провели эксперимент, записывая нужное время (латентный период) для входа в камеру, подтверждения эффекта стимулирования и количество (количество ошибок) ударов электричеством за установленное время (3 мин). На фиг. 5 и 6 показаны результаты эксперимента избегания темноты. Количество мышей, участвовавших в эксперименте, составляет 8. Числа означают среднее значениеошибка средней, знакозначает то, что имеют место статистически достоверные отличия с группой контроля (р 0,05),означает,что имеются статистически достоверные отличия с группой модели заболевания (р 0,05). Можно заметить, что по сравнению с группой контроля латентный период группы модели заболевания после инъекции в правый желудочек мозга заметно сократился (Р 0,01), количество ошибок заметно увеличилось(Р 0,05), что говорит о том, что модель AD создана при инъекции A1-40 в правый желудочек мозга. Латентные периоды группы, получавшей 30 и 60 мг/кг олигосахаридальгината и группы лекарства HBY,заметно увеличились, и количество ошибок в 3 группах разных доз 6-мера олигосахаридальгината и группы HBY тоже заметно уменьшилось, что показывает: 6-мер олигосахаридальгината заметно улучшает функциональные нарушения обучения и память при инъекции A1-40. Влияние 6-мера олигосахаридальгината на биологические показатели головного мозга мыши, у которой AD вызвана А. После эксперимента плавания проводили декапитацию животного, быстро отделяли кору и гиппокамп на льду. После часа быстрого замораживания жидким азотом их сохраняли в холодильнике при температуре -80 С. При эксперименте готовили раствор из коры и гиппокампа с конечной концентраци-8 011417 ей 10 и 5% в физиологическом растворе. Проводили центрифугирование при 3600 об./мин. Измеряли активности MDA, CuZn-SOD, GSH-PX, Na+K+-ATPase, AchE и CHAT в супернатанте. CHAT измеряли способом с использованием метода. Другие показатели считали на общий белок, применяя соответствующие наборы, произведенные "Цзяньчэн" биотехнологическим институтом в городе Нанкине.(1) Влияние 6-мера на активность холинацетилтрансферазы (ChAT) у мышей. Активность ChAT коры мозга группы модели А заметно ниже, чем группы контроля (Р 0,05). Кормление мыши 6-мером олигосахаридальгината и HBY 30, 60 мг/кг соответственно до или после медицинской операции статистически значимо увеличивает эту активность ChAT (табл. 8). Таблица 8 Влияние олигосахарида альгина на активность ChAT коры малой мыши модели А (n=10,(2) Активность супероксиддисмутазы (SOD) у AD-мышей. Активность SOD мозга мыши из группы модели заболевания ниже, чем у контрольной группы, но статистически не значимо. После лечения мышей в группе с использованием 60 мг/кг 6-мера олигосахаридальгината активность SOD в коре мозга и гиппокампе статистически значимо увеличивается, что указывает на то, что механизм влияния 6-мера олигосахаридальгината на AD связан с повышением антиокислительной активности (табл. 9). Таблица 9 Влияние 6-мера олигосахаридальгината на активность SOD коры мозга и гиппокампа(3) Влияние 6-мера на содержание малонового диальдегида(MDA) у мышей. Содержание MDA в коре и гиппкампе мыши в группе модели заболевания не отличается от группы контроля. Содержание MDA в мозге мышей, которых заранее кормили 6-мером олигосахаридальгината и которые продолжительно лечились, понизилось, в частности, содержание MDA в мозге мышей из группы дозы 30, 60 мг/кг и из группы HBY заметно понизилось, что показывает, что эти 2 лекарства могут улучшить окислительную реакцию в мозге, снизить вред от свободных радикалов, защищать мозговую структуру от окислительного ущерба (табл. 10).-9 011417 Таблица 10 Влияние 6-мера олигосахаридальгината на содержание MDA в коре и гиппкампе(4) Влияние 6-мера на активность глютатиона-пероксидазы (GSH-PX) у мышей. Активность GSH-PX в коре и гиппокампе мыши из группы модели заболевания ниже, чем в группе контроля, а в гиппокампе достоверно ниже (Р 0,05). После введения 6-мера олигосахаридальгината активность GSH-PX увеличивается, в частности, ферментативная активность в коре мозга группы, получавшей 60 мг/кг 6-мер олигосахаридальгината и в гиппокампе группы, получавшей HBY, достоверно выше по сравнению с группой модели заболевания (р 0,05) (табл. 11). Таблица 11 Влияние 6-мера олигосахаридальгината на активность GSH-PX в коре и гиппкампе(5) Влияние 6-мера на активность Na+, K+-АТР фазу в AD-мыши. Ферментативная активность Na+, K+-АТР фазы коры мозга и гиппокампа мыши из группы модели заболевания заметно ниже, чем в группе контроля, что свидетельствует о явном влиянии А на энергетический обмен нейрона мозга. Однако эта ферментативная активность в мозге мышей, которых заранее кормили 6-мером олигосахараридальгината, еще более повысилась при продолжительном лечении. Ферментативная активность Na+, K+-АТР фазы во всех 3 группах, получавших разные дозы препарата, заметно повысилась. Ферментативная активность Na+, K+-АТР фазы в группе высокой дозы заметно повысилась в гиппокампе, при этом лечебный эффект высокой дозы 6-мера олигосахаридальгината был лучше, чем HBY. Это свидетельствует о том, что повышение уровня энергетического обмена в мозге может быть одним из механизмов защиты олигосахаридальгинатом мозговой функции, в том числе при AD- 10011417 Таблица 12 Влияние 6-мера олигосахаридальгината на ферментативную активность Na+, K+-АТР фазы коры и гиппокамп AD мыши (индукция A1-40) (n=10,5.2. Защитное действие 6-мера олигосахаридальгината на нейрон от нарушений, причиненных А inRes, 1977, 126:397-425, культивировали первичные нейроны коры мозга крыс. В эксперименте использовали клетки после недели культивирования. То есть на восьмой день заменяют культуральную жидкость и добавляют 6-мер олигосахаридальгината концентрацией 0, 10, 50, 100 мг/мл к клеткам; после 24 ч инкубирования при температуре 37 С добавляют устаренные A25-35 (развести A25-35 в бидистилляте до концентрации 1 мг/мл, оставить раствор на 7 дней при температуре 37 С для старения, заморозить устаренные А в фасовках при температуре -20 С) до конечной концентрации 30 мк; после 24 ч культивирования добавляют 10 мкл 5 мг/мл МТТ; после 4 ч инкубирования при температуре 37 С, удаляют супернатант, добавляют 150 мкл DMSO. В приборе для иммуноферментного анализа для измерения поглощения излучений, измеряют при длине волны 570 нм (контрольная длина волны 630 нм) определяют оптическую плотность. Результаты показали, что после 24 ч инкубирования нейрона с 30 мк постаревшими A25-35, редукция МТТ клетки заметно понизилась, коэффициент выживания клеток понизился до 54,58,9% (р 0,001). Обработка 6-мером заметно улучшает этот коэффициент, с увеличением его дозы функция улучшения становится более заметной, в частности, действие 100 мг/мл 6-мера олигосахаридальгината самое заметное (коэффициенты выживания клеток соответственно составляют 72,011,2%, 77,18,1% и 82,311,6%)(при дозах 10, 50 и 100 мкг/мл). 6-Мерный олигосахаридальгината имел сходные результаты при применении его к исходному нейтрону и к клеткам SH-SY5Y нейробластомы. После 48 ч воздействия на клетки SH-SY5Y 30 мк устаренными A25-35 (фиг. 7) и 2 мк устаренными A1-40 (фиг. 8) количество клеток уменьшалось, клетки частью закруглились, часть клеток перешло в суспензию, коэффициенты выживания клеток соответственно составили 73,39,4%, 64,12,5%. Но применение 50, 100 мкг/мл олигосахаридальгината может заметно подавить действие А, что позволяет уменьшить количество клеток в суспензии и увеличить коэффициент выживания. Из вышеупомянутых результатов экспериментов следует вывод: in vitro 6-мер олигосахаридальгината может заметно сократить латентный период избегания у AD-мышей, инъецированных A1-40 правый желудочек мозга; увеличить количество прохода этих мышей через платформу; сократить время первого достижения платформы, улучшить функцию обучения и память таких мышей; при этом in vitro 6-мер олигосахаридальгината может заметно подавить ослабление А исходных клеток и штаммов нейронов. Это доказывает, что олигосахаридальгинат имеет профилактический и лечебный эффект при AD. 6. Исследование механизма действия 6-мера олигосахаридальгината против AD. 6.1. Влияние 6-мера олигосахаридальгината на апоптоз линии клеток SH-SY5Y, вызванный A25-35. Инкубируют SH-SY5Y клетки по 2105 клеток/лунка в шестилуночных планшетах; после слияния клеток добавляют 0, 50, 100 мг/мл олигосахаридальгината на 24 ч; затем добавляют 30 мкл устаренных АР 25-35 клеток (продукты компании Sigma); продолжают культивирование 48 ч при 37 С, затем слои клеток расщепляли, собирали, промывали и центрифугировали 5 мин при 1200 об., удаляли супернатант,ополаскивали клетки 2 раза рН 7,2 фосфатным буфером (PBS), добавляли 200 мл смеси, 100 Е/мл RNase(продукты компании Hyclone) с 5 мг/мл PI (продукты компании Hyclone); культивировали клетки 30 мин при температуре 4 С; клетки считали проточной цитометрией (продукты американской компании BD) 8000 клеток на пробу. Результаты показали, что после 48 ч стимулирования с использованием 30 мк устаренных A25-35 клеток SH-SY5Y клетки заметно увядали. Коэффициент увядания составил 24,81,9%, а после 24 ч пред- 11011417 варительной обработки с использованием 50, 100 мкг/мл олигосахаридальгината увядание, индуцированное A25-35, было заметно подавлено, и коэффициенты увядания соответственно составляют 10,21,3% и 5,10,7%. Углубленное исследование механизма действия олигосахаридальгината против увядания клеток,индуцированного А, показало, что олигосахаридальгинат может заметно подавить индуцированное А повышение концентрации свободных ионов кальция в нейроне, индуцированное А образование свободных радикалов, повышение содержания перекисей липидов в клетках, понижение потенциала митохондриальной мембраны, повышение экспрессии белков Р 53 и белков Caspase-3, индуцированных A,стимулировать повышение экспрессии белков Всl-2. Все эти факторы подтверждают терапевтический потенциал 6-мера в лечении AD. 6.2. Исследование молекулярного механизма действия 6-мера олигосахаридальгината против нейротоксичности, вызванной А.(1) Влияние 6-мера олигосахаридальгината на образование волокон A1-40. Свежие A1-40 инкубируют отдельно или с 6-мером (конечные концентрации 10, 50 и 100 мкг/мл) при 37 С в течение 24 ч. После инкубации добавляют Th-T и изучают интенсивность флуоресценции при 450 и 480 нм. Результаты показали, что 10, 50, 100 мкг/мл олигосахаридальгината могут подавить накоплениеA1-40, а 100 мкг/мл 6-мера олигосахаридальгината имеет самый сильный эффект подавления; интенсивность флуоресценции соответственно составляют 10,460,94, 9,181,32 и 7,811,38 (р 0,05, р 0,05,р 0,001). Обнаруженное с помощью электронного микроскопа влияние 6-мера олигосахаридальгината на образование волокон A1-40 (фиг. 9) также показало, что олигосахаридальгинат может заметно подавить образование волокон A1-40. То же техническое исследование показало, что олигосахаридальгинат имеет заметное подавляющее действие на образование волокон, стимулированное гепарином. На фиг. 9 А показан результат инкубации в течение 24 ч только с A1-40; 9 В - показан результат инкубации в течение 24 ч со смесью A1-40 и гепарина; 9 С - показан результат 24-часовой инкубации со смесью A1-40 и 6-мера олигосахаридальгината; 9D - результат 24-часовой инкубации со смесью A1-40 и гепарина, 6-мера олигосахаридальгината; 9 Е - результат 48-часовой инкубации с одним A1-40; 9F - результат 48-часового инкубирования со смесью A1-40 и гепарина; 9G - результат 48-часового инкубирования со смесью A1-40 и 6 мера олигосахаридальгината; 9 Н - результат 48-часового инкубирования со смесью A1-40 и гепарина, 6 мера олигосахаридальгината.(2) Влияние 6-мера олигосахаридальгината на деструкцию волокон A1-40. Растворяют A1-40 в бесбактериальном неионизированном бидистилляте до 1 мг/мл, фасуют раствор в пробирки Eppendorf, выдерживают раствор 7 дней при температуре 37 С. Смешивают устарелые A1-40(1 мг/мл) с олигосахаридальгинатом, инкубируют 3 дня при температуре 37 С, негативно окрашивают пробы уксуснокислым ураном, через JEM-1200EX электронный микроскоп обнаруживают формацию волокон. Результаты показали: после 7 дней старения образовались взаимоперекрестные и взаимособирающиеся волокна: к волокнам A1-40 добавляют олигосахаридальгинат; после 3 дней инкубирования количество волокон А заметно снизилось, волокна разрывались и укоротились. На фиг. 10 А показана инкубация А; 10 В - инкубация совместно олигосахаридальгината и А.(3) Влияние 6-мера олигосахаридальгината на конформацию A1-40. Растворяют A1-40 в бесбактериальном TBS (рН 7,4, 100 мМ Tris, 50 мМ NaCl) до концентрации 250 мкг/мл, фасовать раствор в Eppendorf пробирки по 350 мкл/пробирка, отдельно добавить в эти пробирки 6-мер олигосахаридальгината конечной концентрацией 100 мкг/мл; после равномерного перемешивания оставляют раствор при температуре 37 С на 12 ч; определение изменения конформации А проводят с помощью CD прибора типа J-500A (продукты японской компании JASCO). На фиг. 11 А показано влияние A1-40; 10 В - влияние смеси устаренных A1-40 и гепарина; 10 С влияние смеси A1-40 и гепарина. Результаты показали, что после 12 ч инкубации при температуре 37 СA1-40 в основном приобрели совершено -складчатую конформацию, а олигисахаридальгината заметно подавляет переход A1-40 в -складчатой конформации.(4) Исследование взаимодействия 6-мера олигосахаридальгината с А. Для этого применяют SPR технику (BIAcore X, шведский Uppsala ) при температуре 25 С, скорости потока HBS-EP фосфатного буфера 5 мкл/мин (0,01 М HEPES, 150 ммоль/л NaCl, 3,4 ммоль/л EDTA-Na2,0,005% (об./об.) твин-20, рН 7,4). Растворяют A1-40 в HBS-EP фосфатном буфере до 1 мг/мл и оставляют на хранение в фасовках при температуре 37 С, извлекают A1-40 раствор в точках времени (дней) 0, 0,5, 1,2, 4, 6; разбавляют раствор на 5 концентраций в кратной пропорции, при температуре 25 С; позволяют раствору со скоростью потока 5 мкл/мин протекать через чипы (объем инъекции - 10 мкл) олигосахаридальгината; записывают кривую связывания А с олигосахаридальгинатом. С помощью 2 М NaCl чипы восстанавливают. Результаты показали, что 6-мер олигосахаридальгината может связываться с A1-40 с разной степе- 12011417 нью связывания, особенно хорошо связывается со свежим A1-40 (величина KD составляет 6,85 Е-07 М). С увеличением времени старения А степень связывания олигосахаридальгината повышается (величина KD соответственно составляет 1.07 Е-07, 9.06 Е-08, 5.43 Е-08, 2.15 Е-08, 1.45 Е-08 М), но когда время старения становится более 2 дней, величина повышения уменьшается и стабилизируется. Дальнейшие исследования показали, что 6-мер олигосахаридальгината связывается черезHisl3Lys16 с полноразмерной молекулой А и через Ser26Lys28 с молекулой A25-35. Связывание олигосахаридальгината со свежим А является важной причиной для подавления изменения конформации для подавления образования волокон. Связывание олигосахаридальгината с постаревшими новыми А является важной причиной для стимулирования деструкции волокнистого А. Благодаря вышесказанному исследованию механизма действия было установлено, что олигосахаридальгинат через связывание с молекулой А подавляет образование А-волокон и стимулирует деструкцию А-волокон, таким образом, он может подавить перегрузку каналов ионов кальция нейрона, удалить свободные радикалы, подавить старение нейрона, защитить нейрон от вреда и тем самым играет важную роль в новой стратегии лечения AD. 7. Исследование действия 6-мера олигосахаридальгината на модели диабета. 7.1. Защитное действие олигосахаридальгината на панкреатическую -клетку, ослабленную амилином в условиях in vitro. В культуральной среде DMEM с содержанием 10% FBS культивируют NIT штаммы инсулиновых-клеток человека, по 1104 клетка/лунка, иммобилизуют клетки штамма на лунки 96-луночного планшета; после слияния клеток добавляют 0, 10, 50, 100 мкг/мл 6-мера олигосахаридальгината на 24 ч; затем добавляют для старения амилин с конечной концентрацией 30 мкМ (amylin - островковый амилоидный полипептид, сокращенное название IAPP); после 48 ч культивирования МТТ-методом измеряют количество живых клеток. Результаты показали, что 24 ч предварительной обработки может заметно уменьшить вредное действие IAPP на клетки, повысить количество живых клеток, и такое действие становится заметнее с увеличением доз 6-мерного олигосахаридальгината. Результаты представлены на фиг. 12; количество измерений в каждой группе составляет 6; числа означают среднее значениеошибка средней; знакиобозначают статистически значимое отличие от контрольной группы (р 0,01); знаки знакиобозначает наличие статистически значимых отличий от группы IAPP (р 0,05 и р 0,01). Исследование показало, что 6-мер олигосахаридальгината оказывает защитное действие по отношению к инсулиновым р-клеткам от IAPP. 7.2. Влияние in vivo 6-мера олигосахаридальгината на диабет мыши, индуцированный стрептозотоцином (STZ). Разделяют случайным образом 60 самцов мышей NIH весом 18-22 г на нормальную группу, группу модель заболевания, группу, в которой мышей обрабатывают 50, 150, 450 мг/кг олигосахаридальгината,и группу, которую обрабатывают 5 мг/кг глибенкламидом. Кроме контрольной группы, мышей других групп обрабатывают: в первый день испытания в брюшную полость вводят 150 мг/кг стрептозотоцина (STZ). Затем подряд 10 дней кормят соответствующим лекарством, на 11-тый день изымают глазное яблоко и берут кровь для измерения концентрации глюкозы в крови. Результаты показывают, что концентрация глюкозы в крови мышей, которым давали лекарства, явно ниже, чем в группе модели заболевания, это значит, 6-мер олигосахаридальгината имеет лечебное значение для мыши, инъецированной стрептозотоцином (STZ), вызывающим диабет (табл. 13). Таблица 13 Влияние 6-мера олигосахаридальгината на диабетических мышей, у которых заболевание вызвано введением стрептозотоцина (STZ)- 13011417 Ряд экспериментов был выполнен с олигосахаридальгинатом (его степень полимеризации составляет 2-22) или продуктами окислительной деструкции или их смесью. Были получены сходные экспериментальные результаты как в случае AD, так и с диабетом. Фиг. 13-16 демонстрируют результаты влияния смеси продуктов окислительной деструкции олигосахаридальгината на мышиной модели AD, полученной инъекцией в мозг А 1-40. В каждой экспериментальной группе 8 животных. Цифрами обозначены значение среднейошибка средней. Знакииозначают, что имеется статистически достоверное отличие с группой контроля (р 0,05, р 0,01). Знакииозначают то, что имеется статистически значимое отличие с группой модели заболевания (р 0,05, р 0,01). Видно, что смесь продуктов окислительной деструкции 6-мера олигосахаридальгината может явно повысить способность к обучению и память животных с AD. Фиг. 17 демонстрирует результаты защитного действия смеси продуктов окислительной деструкции олигосахаридальгината на NIT штамм инсулиновых -клеток от амилина (IAAP), в каждой экспериментальной группе 8 животных. Числовые значения означают величину среднейошибка средней. Знакозначает то, что имеется статистически значимое отличие от группы контроля (р 0,01), знакииозначают, что имеется статистически значимое отличие с группой IAPP (р 0,05, р 0,01). Видно, что смесь продукта окислительной деструкции 6-мера олигосахаридальгината имеет явный лечебный эффект в борьбе с диабетом. 8. Статистический анализ. Статистический анализ был выполнен с использованием программы статистической обработкиStatview. Результат анализа выражали значения среднейошибки средней. (Mean valuesSE. Сравнение проводили с помощью дисперсионного анализа (ANOVA). Основываясь на приведенных выше результатах могут быть приготовлены фармацевтические композиции, содержащие терапевтически эффективное количество олигосахаридальгината по изобретению и фармацевтически приемлемый носитель. Названные фармацевтические композиции включают ингибитор образования волокна -амилоида. Олигосахаридальгинат по изобретению имеет важное значение для получения лекарственного средства для профилактики и лечения AD и диабета. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное олигосахаридальгината или его фармацевтически приемлемая соль, характеризующееся тем, что производное олигосахаридальгината состоит из -D-маннуроновой кислоты, соединнной-1,4 гликозидной связью, и в нем в положении 1 восстановленного конца находится карбоксил, как показано в формуле (II) где n представляет 0 или целое число от 1 до 19. 2. Производное по п.1, характеризующееся тем, что n=2-10. 3. Производное по п.2, характеризующееся тем, что n=4-8. 4. Способ получения производного олигосахаридальгината или его фармацевтически приемлемой соли, описанных в п.1, включающий следующие стадии: кислотный гидролиз, при котором полиманнуронатный водный раствор помещают в автоклав на 26 ч при рН 2-6 и температуре 100-120 С; доведение рН после окончания реакции гидролиза до величины рН 7; окислительная деструкция, при которой добавляют окислитель и реакция продолжается от 15 мин до 2 ч при температуре 100-120 С; повторное доведение рН после окислительной деструкции до величины рН 7. 5. Способ по п.4, характеризующийся тем, что названный полиманнуронат представляет собой полиманнуронат натрия и названный кислотный гидролиз проводят 4 ч при рН 4 и температуре 110 С. 6. Способ по п.4, характеризующийся тем, что после доведения рН до 7 проводят осаждение спиртом, а осадок отфильтровывают, обезвоживают, высушивают и обессоливают. 7. Способ по п.4, характеризующийся тем, что окислитель представляет собой гидрат окиси меди, а окислительную деструкцию проводят 30 мин при температуре 100 С. 8. Применение олигосахарида маннуроновой кислоты формулы (I) для изготовления лекарства для лечения и профилактики AD, являющегося ингибитором образования -амилоида, и лекарства для лечения и профилактики диабета, являющегося ингибитором образования островков волокон амилоида и промотором деструкции волокна где n представляет 0 или целое число от 1 до 19. 9. Фармацевтическая композиция, содержащая эффективное количество производного олигосаха- 14011417 рида маннуроновой кислоты, охарактеризованного в пп.1-3, и фармацевтически приемлемый носитель или его фармацевтически приемлемые соли. 10. Композиция по п.9, характеризующаяся тем, что представляет собой средство для профилактики или лечения AD, является ингибитором образования волокон белка -амилоида, а также представляет собой средство для профилактики и лечения диабета, является ингибитором образования островков волокон амилоида, промотором деструкции волокна.
МПК / Метки
МПК: A61P 3/10, A61P 25/28, A61K 31/702, C08B 37/00, C07H 3/06
Метки: способ, олигосахаридальгината, получения, производные, применение
Код ссылки
<a href="https://eas.patents.su/20-11417-oligosaharidalginata-i-ego-proizvodnye-sposob-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Олигосахаридальгината и его производные, способ получения и применение</a>
Следующий патент: Производные 2-(1h-индолилсульфанил)ариламина для применения при лечении аффективных расстройств, боли, нгдв и стрессового недержания мочи
Случайный патент: Увеличение электрической проводимости и сокращаемости с помощью двухфазного кардиостимулятора, введенного в сердечное кровяное депо