Сложные эфиры апорфина и их применение в терапии
Номер патента: 6388
Опубликовано: 29.12.2005
Авторы: Андрен Пер Эрик, Юрва Ульрик, Викстрем Хокан, Кремерс Томас, Дейкстра Дюрк, Марше Сандрин
Формула / Реферат
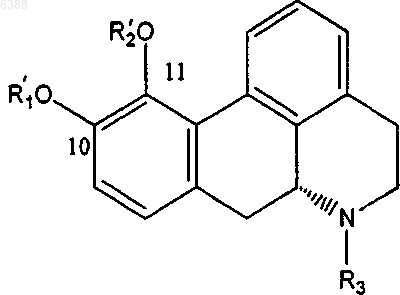
1. Производное апорфина, имеющее общую формулу (I)
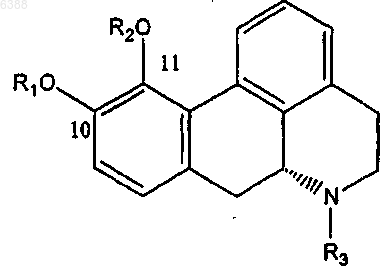
где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (C3-C20)алканоила; галоген-(C3-C20)алканоила; (C3-C20)алкеноила; (C4-C7)циклоалканоила; (C3-C6)циклоалкил (C2-C16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил(C2-C16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из O, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, и его физиологически приемлемые соли.
2. Производное апорфина по п.1, где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (C3-C20)алканоила; (C4-C7)циклоалканоила; бензоила, который является незамещенным или замещенным атомом хлора или 1-3 метоксигруппами; фенилацетила, который может быть замещенным атомом хлора, и гетероарилацетила, и R3 означает (C1-C3)алкил или циклопропил.
3. Производное апорфина по п.2, где один из R1 и R2 означает водород и другой из них выбирают из группы, состоящей из пропаноила, пропеноила, бутаноила, изобутаноила, пивалоила, деканоила, гексадеканоила, циклопропаноила и бензоила, и R3 означает метил или пропил.
4. Производное апорфина по п.2, где один из R1 и R2 означает ацетил и другой из них выбирают из группы, состоящей из бутаноила, изобутаноила, циклопропаноила, циклогексаноила, пивалоила, деканоила и гексадеканоила, и R3 означает метил.
5. Способ получения моноэфирного производного апорфина, имеющего общую формулу (I')
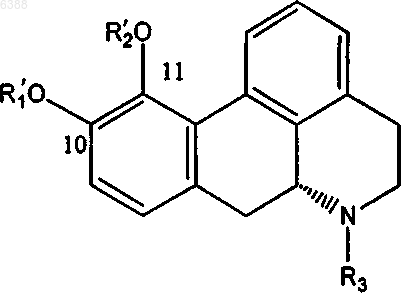
где один из R'1 и R'2 означает водород и другой из них выбирают из группы, состоящей из ацетила, (C3-C20)алканоила; галоген-(C3-C20)алканоила; (C3-C20)алкеноила; (C4-C7)циклоалканоила; (C3-C6)циклоалкил(C2-C16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3) алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил(C2-C16) алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из O, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3) алкила и (C1-C3) алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, включающий
a) взаимодействие апорфина общей формулы (II)
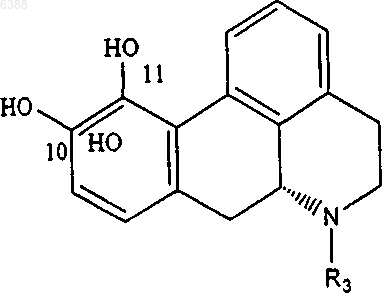
где R3 определяют, как описано выше, с хлорангидридом общей формулы (III)
R4-Cl,
где R4 является таким, как определено выше для одного из R'1 и R'2, при молярном отношении апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);
b) после завершения взаимодействия выпаривание растворителей или лиофилизацию реакционной смеси;
c) растворение остатка сырой смеси продукта в CH2Cl2 и очистку хроматографией на Al2O3 с элюированием CH2Cl2 и затем смесями трет-BuOH:CH2Cl2 и EtOH:CH2Cl2 с использованием ступенчатого градиента при увеличивающейся концентрации трет-BuOH и EtOH соответственно от 1 до 15 об.%, предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные моноэфирные производные формулы (I); и
d) разделение вышеуказанных изомерных моноэфирных производных формулы (I') известными способами с целью выделения одного моноэфира формулы (I').
6. Способ получения диэфирного производного апорфина, имеющего общую формулу (I")
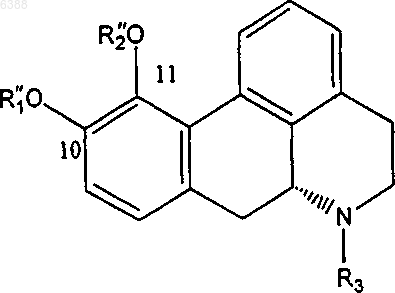
где один из R"1 и R"2 означает ацетил и другой из них выбирают из группы, состоящей из (C3-C20)алканоила; галоген-(C3-C20)алканоила; (C3-C20)алкеноила; (C4-C7)циклоалканоила; (C3-C6) циклоалкил (C2-C16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил (C2-C16)алканоила, который замещен или незамещен в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена, и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из O, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила; способ, включающий в себя
a) взаимодействие моноэфира апорфина общей формулы (I')
где один из R'1 и R'2 означает водород и другой из них означрхт ацетил, и R3 определяют, как описано выше, с хлорангидридом общей формулы (IV)
R5-Cl,
где R5 является таким, как определено выше для одного из R"1 и R"2, при молярном отношении моноэфира апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);
b) после завершения взаимодействия выпаривание растворителей или лиофилизацию реакционной смеси;
c) растворение остатка сырой смеси продукта в CH2Cl2 и очистку хроматографией на Al2O3 с элюированием CH2Cl2 и затем смесями трет-BuOH:CH2Cl2 и EtOH:CH2Cl2 с использованием ступенчатого градиента при увеличивающейся концентрации трет-BuOH и EtOH соответственно от 1 до 15 об.%, предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные диэфирные производные формулы (I"); и
d) разделение вышеуказанных изомерных диэфирных производных формулы (I") известными способами с целью выделения одного диэфира формулы (I").
7. Фармацевтическая композиция, содержащая в качестве активной основы по крайней мере одно производное апорфина формулы I, как указано в любом из пп.1-4, или его физиологически приемлемую соль вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
8. Фармацевтическая композиция по п.7, которая представлена в виде пластыря или мази для чрескожного введения.
9. Фармацевтическая композиция по п.8, которая, кроме того, содержит стабилизаторы, солюбилизирующие реагенты и реагенты, способствующие проницаемости, с целью облегчения проникновения активной основы через кожу.
10. Фармацевтическая композиция по п.7, которая представлена в виде препарата-депо для подкожного или внутримышечного введения, содержащая вышеуказанное производное апорфина формулы I или его физиологически приемлемую соль, растворенные или суспендированные в масле.
11. Фармацевтическая композиция по п.10, которая, кроме производного апорфина формулы I или его физиологически приемлемой соли, содержит местное анестезирующее средство.
12. Фармацевтическая композиция по п.7, которая представлена в форме, подходящей для перорального, подъязычного, легочного, ректального, вагинального или интрадуоденального введения.
13. Фармацевтическая композиция по любому из пп.7-12, которая, кроме производного апорфина формулы I или его физиологически приемлемой соли, содержит эффективное количество противорвотного реагента.
14. Применение производного апорфина формулы I, как указано в п.1, или его физиологически приемлемого производного для производства лекарственного средства с целью лечения болезни Паркинсона, мигрени, синдрома усталых ног, полового нарушения у мужчин и женщин, гиперпролактинемии и психотических расстройств и/или оценки болезни Паркинсона.
15. Способ лечения болезни Паркинсона, мигрени, синдрома усталых ног, полового нарушения, гиперпролактинемии и психотических расстройств, включающий в себя введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества производного апорфина формулы I, как определено в п.1, или его физиологически приемлемой соли.
Текст
006388 Настоящее изобретение относится к новым сложным эфирам апорфина, способу их получения,фармацевтическим композициям, содержащим указанные эфиры, и к их применению в терапии. Более детально, настоящее изобретение относится к новым 10- и 11-моно-(сложным)эфирам и 10,11 асимметричным ди-(сложным)эфирам апорфина, их получению и применению и к фармацевтическим композициям, содержащим указанные соединения. Болезнь Паркинсона представляет собой прогрессирующее, нейродегенеративное расстройство, вызванное повреждением клеточных тел допаминергических (DA-ергических) нейронов в черном веществе и дегенерацией нервных окончаний в полосатом теле, приводящих к низким уровням DA в черном веществе и полосатом теле. Болезнь Паркинсона является хроническим заболеванием, характеризующимся прогрессирующим нарушением двигательной функции, и ее основными симптомами являются тремор,наблюдающийся преимущественно в состоянии покоя, ригидность мышц и снижение частоты произвольных движений (гипокинезия), которые становятся трудно выполнимыми, если нужно остановиться при ходьбе, начать двигаться или повернуть во время ходьбы. Постоянный тремор накладывается на повышенный тонус противоположной группы мышц, и в начале ходьбы движения становятся в значительной степени затрудненными и замедленными. На поздней стадии движения больных становятся практически замороженными, и больные не способны заботиться о себе. Исследования показали, что симптомы болезни Паркинсона проявляются, когда уровни DA в полосатом теле снижаются до 20-40% от нормы. Поскольку болезнь Паркинсона обусловлена потерей DA из полосатого тела, то обычно лечение заключается в приеме лекарственных средств, которые заменяют DA, причем наиболее применяемым из них является леводопа. Леводопа превращается в DA в мозге посредством допа-декарбоксилазы, и образующийся DA оказывает терапевтический эффект. Однако леводопа хорошо всасывается из тонкого кишечника, большая часть препарата инактивируется моноаминоксидазой в стенке кишечника. Кроме того,период полувыведения леводопы из плазмы является коротким, и приблизительно 95% лекарственного средства превращается в DA в периферических тканях, где допа-декарбоксилаза является преобладающей, в результате чего менее 1% проникает в мозг. Следовательно, леводопу следует вводить в виде больших и частых доз. Кроме того, образование DA в периферических тканях приводит к нежелательным побочным эффектам. Таким образом, леводопу обычно дают в комбинации с другими лекарственными средствами для усиления действия леводопы в мозге и снижения до минимума действия препарата на периферические ткани. В частности, леводопу обычно применяют в комбинации с периферическим ингибитором допадекарбоксилазы, который не пересекает гематоэнцефалический барьер, таким как карбидопа, который ингибирует расщепление леводопы до DA вне мозга, тем самым снижает нежелательные эффекты в периферических тканях. Кроме того, ингибитор способствует тому, что относительно большое количество пероральной дозы леводопы достигает мозга и, таким образом, доза леводопы может быть снижена, что также уменьшает побочные эффекты в периферических тканях. Кроме того, периферический антагонистDA, который не проникает через гематоэнцефалический барьер, такой как домперидон, также можно вводить для уменьшения тошноты и рвоты, как побочных эффектов леводопы. Кроме упомянутых выше побочных эффектов другие нежелательные побочные эффекты связаны с применением леводопы в течение продолжительного времени. В частности, у многих больных наблюдаются непроизвольные хорееподобные движения, которые являются результатом чрезмерной активации рецепторов DA. Обычно указанные движения затрагивают лицо и конечности и могут стать очень серьезными. Такие движения исчезают при снижении дозы леводопы, но это приводит к возобновлению мышечной ригидности. Кроме того, разница между благоприятным и нежелательным эффектом, повидимому, постепенно сужается по мере того, как увеличивается период лечения леводопой. Традиционный способ устранения указанного эффекта заключается в увеличении частоты введения леводопы, при этом общая доза леводопы остается постоянной. Указанный подход снижает эффект истощения конечной концентрации и уменьшает вероятность развития у больного дискинезии, которая появляется при приеме больших доз препарата. Дальнейшее осложнение, возникающее при длительном лечении леводопой, заключается в развитии быстрых колебаний в клиническом состоянии, когда больной внезапно переходит из подвижного состояния в состояние неподвижности в течение периода времени, изменяющегося от нескольких минут до нескольких часов. Это явление названо как "эффект включениявыключения", причем состояние "включения" является предпочтительным, в течение которого может быть достигнуто почти нормальное функционирование двигательного аппарата, а состояние "выключения" характеризуется нарушением тонуса в течение периодов сниженной подвижности. Действительно, в таком состоянии происходит неожиданная потеря подвижности, так что больной может вдруг остановиться при ходьбе или не сможет подняться со стула, на который он нормально сел несколькими минутами раньше. Обычно этот эффект не изменяется при манипулировании дозой леводопы и больному может потребоваться лечение альтернативными лекарственными средствами. Кроме вышеперечисленных побочных эффектов, возникающих при длительном лечении леводопой, было обнаружено, что эффективность леводопы в значительной степени снижается со временем и с некоторых пор препарат уже не оказывает воздействие. Кроме того, наблюдали повышенную частоту случаев злокачественной мелано-1 006388 мы у больных, которых лечили леводопой, и поэтому было сделано предположение, что лечение леводопой может быть связано с развитием злокачественной меланомы. Таким образом, применение леводопы в лечении болезни Паркинсона далеко от идеала. Альтернативный способ лечения болезни Паркинсона заключается в применении лекарственных препаратов, которые имитируют действие DA. Такие лекарственные препараты обобщенно названы агонистами DA, поскольку они непосредственно стимулируют рецепторы DA в тракте с недостаточностьюDA, имеющем отношение к эфферентной связи черного вещества с полосатым телом. В отличие от леводопы, агонисты DA не нуждаются в превращении в активные соединения в мозге. Кроме того, агонистыDA являются эффективными для больных, находящихся на поздних стадиях болезни Паркинсона, когда леводопа больше не оказывает благоприятного воздействия, так как они прямо действуют на рецепторыDA, и поэтому на них не влияет недостаток DA-образующих нервных клеток у таких больных. Однако воздействие таких агонистов DA на рецепторы DA также вызывает нежелательные DA-ергические эффекты, такие как тошнота, рвота и экстрапирамидальные эффекты, которые ослабляют здоровье больных, и некоторые агонисты DA, такие как апоморфин, также оказывают нежелательные побочные эффекты, особенно в случаях, когда применяют высокие дозы препарата, такие эффекты, как седативный,угнетение дыхания, гипотензия, брадикардия, потение и зевота. На степень тяжести и природу таких побочных эффектов можно воздействовать способом введения лекарственного препарата. Например, исследования, связанные с приемом апоморфина, проводили с использованием ряда способов введения данного лекарственного препарата. Однако пероральное введение таблеток апоморфина требует высоких доз для достижения необходимого терапевтического эффекта, так как введенный таким способом апоморфин подвергается интенсивному пресистемному метаболизму в тонком кишечнике и/или печени(первый эффект проникновения). Кроме того, продолжительные исследования по таким пероральным формам были остановлены после 7-10 дней приема вследствие необъяснимого увеличения в крови азота мочевины. Подъязычное введение таблеток апоморфина в течение длительного применения вызывает тяжелый стоматит с язвой на слизистой оболочке щеки у половины подвергаемых лечению больных. Введение в нос, вызывающее временное нарушение назальной проходимости, ощущение жжения и опухание носа и губ, должно быть отменено для некоторых из испытуемых больных из-за того, что такое введение, как полагают, вызывает химическое воспаление слизистой носа.1 Таким образом, единственно удовлетворительным путем введения апоморфина, который позволяет избежать метаболизма при первом проникновении, как было найдено, является подкожное введение и,следовательно, единственной коммерчески доступной композицией апоморфина является жидкость для подкожной инъекции или подкожной инфузии. Даже в этом случае подкожное введение стандартного агониста DA не может избежать побочных эффектов, таких как тошнота и рвота, и подкожное введение,будь то инъекция или инфузия, нелегко осуществить, особенно для больных, у которых двигательные функции уже снижены, и поэтому требует подготовки больных и лиц, присматривающих за ними. Кроме того, место введения должно меняться каждые 12 ч, чтобы снизить риск изменения цвета кожи и образования узелков. Принимая во внимание указанные проблемы, неудивительно, что применение агонистовDA, таких как апоморфин, в лечении болезни Паркинсона в значительной степени ограничено до лечения в периоды выключения, вызванного терапией леводопой, несмотря на явное благоприятное воздействие таких лекарственных средств по сравнению с леводопой. Из описанного выше очевидно, что с клинической точки зрения желательно найти способ введения агонистов DA, таких как апоморфин, который является легко выполнимым для больных и поэтому снижает необходимость контроля введения и который позволяет избежать обмена агонистов в печени при их первом проникновении. Кроме того, такая композиция апоморфина или пролекарств апоморфина должна обладать более благоприятным фармакокинетическим профилем, чем сам апоморфин 2-5. Ранее пролекарства апоморфина описаны и тестированы на моделях животных 6-21. Такие пролекарства по большей части представляют собой сложные эфиры и дисимметричные, т.е. 10,11-диэфиры. Таким образом, например, следующие диэфиры апорфинов описаны: диацетил, дипропионил, дибутироил,диизобутироил, дипивалоил, дипентаноил, дигексаноил, дигексадеканоил, дифенилацетил, диметоксиацетил, дитрифторацетил и дигептафторбутаноил эфиры. Некоторые сообщения по поводу улучшенной биодоступности таких эфиров были представлены, но общий результат оказался неутешительным. В качестве примера, дипивалоилэфирное пролекарство оказалось намного менее активным, чем родительское соединение сам апоморфин. Полагают, что благодаря стерическому характеру пивалоильной группы гидролиз такой объемной группы может быть замедленным по сравнению с гидролизом, например, ацетильной группы. 10,11-Диацетилапоморфин является почти таким же сильнодействующим, как сам апоморфин 6. Возможность получения асимметричных диэфиров описана в публикации США US-A-408045611. Однако такие асимметричные диэфиры не были описаны с помощью экспериментальных примеров, иллюстрирующих их получение и характеристики, и было предположено авторами этой публикации, что такие асимметричные диэфиры трудно получить и что фармакологию таких диэфиров трудно прогнозировать. Таким образом, все известные диацилапорфины, в действительности, полученные на практике,являются симметрично замещенными, т.е. одинаковое замещение обнаружено как у 10-, так и 11-2 006388 положения апорфинового скелета. Конечно, это является ограничением в отношении оптимизации физико-химических свойств, которые, вероятно, представляют важность как для чрескожного, так и для подкожного или внутримышечного введения. Задачей настоящего изобретения является получение новых сложных эфиров апорфина, обладающих улучшенной биодоступностью по сравнению с известными ранее эфирами апорфина. Другой задачей настоящего изобретения является получение новых сложных эфиров апорфина, которые обладают свойствами, подходящими для композиций, предназначенных для введения чрескожным, подкожным и внутримышечным способами, чтобы достичь продолжительного действия препарата против болезни Паркинсона и других заболеваний. Кроме того, другой задачей изобретения является получение чрескожных и/или инъецируемых композиций пролекарств апорфина, благодаря которым интервал между введениями может быть значительно увеличен. Согласно настоящему изобретению неожиданно было обнаружено, что моно- и асимметричные диэфиры апорфина обладают свойствами, подходящими для композиций, предназначенных для введения чрескожным, подкожным и внутримышечным способами, чтобы достичь продолжительного терапевтического эффекта препарата. Таким образом, согласно вышеуказанным данным в одном аспекте настоящее изобретение относится к новому производному апорфина, имеющему общую формулу (I) где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (С 3 С 20)алканоила; галоген-(С 3-С 20) алканоила; (С 3-С 20) алкеноила; (С 4-С 7) циклоалканоила; (С 3-С 6) циклоалкил (C2-C16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями,выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и(C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил(С 2 С 16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний в свою очередь может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из О, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, и к его физиологически приемлемым солям. Согласно предпочтительному аспекту настоящего изобретения заявители получили производное апорфина общей формулы I, представленной выше, где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (С 3-С 20)алканоила; (С 4-С 7)циклоалканоила; бензоила,который является незамещенным или замещенным атомом хлора или 1-3 метоксигруппами; фенилацетила, который может быть замещен атомом хлора, и гетероарилацетила, и R3 означает (С 1-С 3)алкил или циклопропил. Согласно более предпочтительному аспекту настоящего изобретения заявители получили производное апорфина общей формулы I, представленной выше, где один из R1 и R2 означает водород и другой из них выбирают из группы, состоящей из пропаноила, пропеноила, бутаноила, изобутаноила, пивалоила, деканоила, гексадеканоила, циклопропаноила и бензоила, и R3 означает метил или пропил. Согласно другому более предпочтительному аспекту настоящего изобретения заявители получили производное апорфина общей формулы I, представленной выше, где один из R1 и R2 означает ацетил и другой из них выбирают из группы, состоящей из бутаноила, изобутаноила, циклопропаноила, циклогексаноила, пивалоила, деканоила и гексадеканоила, и R3 означает метил. Относительно определения каждого символа R1, R2 и R3 в формуле I следует применять следующие значения. Термины "гало" и "галоген" применяют для обозначения фтора, хлора, брома и йода, предпочтительно фтора и хлора. Термин "(С 3-С 20)алканоил" применяют для обозначения остатка насыщенной алифатической карбоновой кислоты, состоящей из 3-20 атомов углерода, углеродная цепь которой может быть прямой или разветвленной. Примерами таких алканоильных групп являются, например, пропаноил, изопропаноил,-3 006388 бутаноил, 2-метилпропаноил, пентаноил, 3-метилбутаноил, пивалоил, н-гексаноил, н-гептаноил, ноктаноил, н-нонаноил, п-деканоил, пальмитоил, стеароил и эйкозаноил. Термин "гало-(С 3-С 20)алканоил" применяют для обозначения (С 3-С 20)алканоильной группы, как определено выше, которая замещена по крайней мере одним атомом галогена, предпочтительно 1-3 атомами галогена. Термин "(С 3-С 20)алкеноил" применяют для обозначения остатка алифатической карбоновой кислоты, состоящей из 3-20 атомов углерода, углеродная цепь которой может быть прямой или разветвленной,и которая содержит от 1 до 3 сопряженных или несопряженных двойных связей. Примерами таких алкеноильных групп являются, например, акрилоил, метакрилоил, линолеоил и линоленоил. Термин "(С 4-С 7)циклоалканоил" применяют для обозначения группы, имеющей формулу где n равно целому числу от 1 до 4. Такие группы включают в себя циклопропаноил, циклобутаноил, циклопентаноил и циклогексаноил. Термин "(С 3-С 6)циклоалкил-(С 2-С 16)алканоил" применяют для обозначения группы, имеющей формулу где n определено, как описано выше, n равно целому числу от 1 до 15, и алкиленовая цепь (Cn1H2n1) может быть прямой или разветвленной. Примерами таких групп являются, например, циклопропилацетил,циклогексилацетил, циклопропилгексаноил и циклопропилпальмитоил. Термин "ароил" применяют для обозначения бензоила, 1-нафтоила и 2-нафтоила. Указанная ароильная группа является незамещенной или замещенной 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3) алкила и (C1-С 3) алкокси, причем алкил- и алкоксигруппы в свою очередь могут быть замещены 1-3 атомами галогена. Примерами таких замещенных ароильных групп являются м-метоксибензоил, п-трифторметоксибензоил, п-хлорбензоил,3,4,5-триметоксибензоил, п-цианобензоил и 3-хлор-1-нафтоил. Термин " (C1-С 3)алкил" применяют для обозначения метила, этила, пропила и изопропила и термин"(C1-С 3)алкокси" применяют для обозначения метокси, этокси, пропокси и изопропокси. Термин "арил-(С 2-С 16)алканоил" применяют для обозначения группы формулы где арил и n1 являются такими, как ранее определено, и цепь алкилена (Cn1H2n1) может быть прямой или разветвленной. Арильный фрагмент указанной группы может быть замещенным заместителями, которые указаны выше в связи с ароильной группой. Примерами арил-(C2-C16)алканоильными группами являются фенацетил, п-хлорфенилацетил, п-трифторметоксифенилацетил и фенилгексаноил. Примерами гетероарилалканоильных групп, имеющих от одного до трех гетероатомов, выбранных из О, S и N, в гетероарильном фрагменте и от 2 до 10 атомов углерода в алканоильном фрагменте и которые являются незамещенными или замещенными в гетероарильном фрагменте, как указано выше, являются тиофен-2-ил-ацетил и пирид-4-ил-гексаноил. Термин " (C1-C4) алкил" в значении R3 применяют для обозначения прямой или разветвленной алкильной группы, состоящей из 1-4 атомов углерода, включающей метил, этил, пропил, изопропил, бутил,1-метилпропил, 2-метилпропил и трет-бутил. Согласно другому аспекту изобретения заявителями представлены способы получения соединений общей формулы (I), изображенной выше. Соответственно, представлен способ получения моноэфирного производного апорфина, имеющего общую формулу (I) где один из R1 и R2 означает водород и другой из них выбирают из группы, состоящей из ацетила, (С 3 С 20)алканоила; галоген-(С 3-С 20)алканоила; (С 3-С 20)алкеноила; (С 4-С 7)циклоалканоила; (С 3-С 6)циклоалкил(С 2-С 16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1 С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил (С 2 С 16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из О, S и N, в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила; способ, включающий в себя а) взаимодействие апорфина общей формулы (II) где R3 определяют, как описано выше, с хлорангидридом общей формулы (III)R4-Cl,где R4 является таким, как определено выше для одного из R'1 и R'2, при молярном отношении апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);b) после завершения взаимодействия выпаривание растворителей или лиофилизация реакционной смеси;c) растворение остатка сырой смеси продукта в СН 2 Сl2 и очистку хроматографией на Al2O3 с элюированием СН 2 Сl2 и затем смесями трет-BuOH: CH2Cl2 и EtOH:CH2Cl2 с использованием ступенчатого градиента при увеличивающейся концентрации трет-BuОН и EtOH, соответственно, от 1 до 15 об.%,предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные моноэфирные производные формулы (I); иd) разделение вышеуказанных изомерных моноэфирных производных формулы (I) известными способами с целью выделения одного моноэфира формулы (I). Согласно настоящему изобретению заявители представили способ получения диэфирного производного апорфина, имеющего общую формулу (I) где один из R"1 и R"2 означает ацетил и другой из них выбирают из группы, состоящей из (С 3 С 20)алканоила; галоген- (С 3-С 20)алканоила; (С 3-С 20)алкеноила; (С 4-С 7)циклоалканоила; (С 3-С 6)циклоалкил(С 2-С 16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1 С 3)алкокси, причем последний в свою очередь может быть замещен 1-3 атомами галогена; арил(С 2 С 16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний в свою очередь может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного-5 006388 до трех гетероатомов, выбранных из О, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (С 1-С 4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, включающий в себя а) взаимодействие моноэфира апорфина общей формулы (I) где один из R1 и R2 означает водород и другой из них означает ацетил и R3 определяют, как описано выше, с хлорангидридом общей формулы (IV)R5-Cl,где R5 является таким, как определено выше для одного из R1 и R2, при молярном отношении моноэфира апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);b) после завершения взаимодействия выпаривание растворителей или лиофилизацию реакционной смеси;c) растворение остатка сырой смеси продукта в CH2CI2 и очистку хроматографией на Al2O3 с элюированием посредством CH2Cl2 и затем смесями трет-ВuОН:СН 2 Сl2 и EtOH:CH2Cl2 с использованием ступенчатого градиента при увеличивающейся концентрации трет-ВuОН и EtOH, соответственно от 1 до 15 об.%, предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные диэфирные производные формулы (I); иd) разделение вышеуказанных изомерных диэфирных производных формулы (I) известными способами с целью выделения одного диэфира формулы (I). В первой модификации способа получения диэфирного производного апорфина общей формулы (I),как определено выше, моноэфир общей формулы (I), где R1 и R2 являются такими, как определено в связи с вышеуказанной формулой, за исключением того, что ни один из них не является ацетилом, взаимодействует с ацетилхлоридом на стадии а) при молярном отношении моноэфира апорфина к ацетилхлориду от 1:1 до 1:5 в трифторуксусной кислоте и метиленхлориде (CH2Cl2), после чего следуют стадии от b) до d), как указано выше. В другой модификации способа получения диэфирного производного апорфина общей формулы (I),как определено выше, моноэфир общей формулы (I), где R1 и R2 являются такими, как определено в связи с вышеуказанной формулой, за исключением того, что ни один из них не является ацетилом, взаимодействует на стадии а) с ангидридом уксусной кислоты в CH2Cl2 в присутствии основного катализатора,такого как триэтиламин или пиридин, после чего следуют стадии от b) до d), как указано выше. В качестве альтернативы, моноацетиловый сложный эфир апорфина взаимодействует с ангидридом кислоты формулы (V)R5-OH где R5 является таким, как определено выше, на стадии а) в CH2Cl2 в присутствии основного катализатора, такого как триэтиламин или пиридин, после чего следуют стадии от b) до d), как указано выше. Апорфины, будучи катехинами, являются очень чувствительными к окислению (например, в условиях атмосферного воздуха). Это особенно верно при основных условиях (основной раствор апоморфина изменяет цвет от зеленого до синего, до фиолетового, до черного на воздухе). Таким образом, в действительности, не представляется возможным иметь дело с такими апорфинами в свободной основной форме без добавления антиоксидантов. Кроме того, пролекарства согласно настоящему изобретению разработаны так, что они легко гидролизуются, при этом осложняется применение SiO2 и нуклеофильных спиртов для очистки колоночной хроматографией эфиров апорфина согласно изобретению. На стадии а) способа согласно настоящему изобретению этерификацию апорфинов и моноацетиловый эфира апорфинов, соответственно, осуществляют в кислых условиях в трифторуксусной кислоте(CF3COOH), разбавленной метиленхлоридом (СН 2 Сl2), причем подходящее разбавление производят приблизительно в 3-10 раз. Хлорангидрид, возможно растворенный в CH2Cl2, добавляют к апорфину или моноацетиловый эфир апорфина, соответственно, при молярном отношении апорфина или моноэфира апорфина к хлорангидриду от 1:1 до 1:5. Оптимальное отношение будет изменяться в зависимости от стерических свойств хлорангидрида, но, в целом, будет находиться в области от 1:1 до 1:2.-6 006388 Реакцию можно контролировать с помощью ТСХ (Аl2 О 3 и элюция посредством CH2Cl2, или смесей СН 2 Сl2:трет-ВuОН, или смесей CH2Cl2:EtOH). После окончания реакции (обычно в пределах 1-24 ч в зависимости от хлорангидрида и используемого молярного отношения) растворители выпаривают из реакционной смеси или реакционную смесь лиофилизируют на стадии b) способа согласно изобретению. Выпаривание растворителей обычно выполняют при пониженном давлении. Для очистки соответственно стадии с) способов согласно настоящему изобретению остаток смеси продукта со стадии b) на стадии с) растворяют в CH2Cl2 и очищают хроматографией на Аl2 О 3, элюцию выполняют путем использования вначале CH2Cl2 и затем смесей трет-BuOH и CH2Cl2 посредством ступенчатого градиента с увеличивающейся концентрацией трет-BuOH от 1 до 15 об.% трет-ВuОН в расчете на смесь, предпочтительно от 2 до 10 об.%, например ступенями в 1,0, 2,0, 5,0 и 10%. В процессе элюции собирали фракции, содержащие желательные изомерные эфирные производные. В случае получения моноэфиров, начиная от апорфина, потенциально образованные дисимметричные эфиры будут элюироваться первыми, а изомеры моноэфира (10-эфир, 11-ОН и 10-ОН, 11-эфир) будут элюироваться после них. Непрореагировавший апорфин (который представляет собой катехин) будет удерживаться в колонке. Изомерные моноэфиры затем могут быть разделены известными способами, такими как флешхроматография, препаративная ВЭЖХ (высокоэффективная жидкостная хроматография), кристаллизация и другие известные сами по себе способы. Однако может оказаться, что некоторые из изомерных моноэфиров трудно разделить, и в таком случае смесь двух изомеров можно использовать в качестве исходного материала для получения асимметричных диэфиров или в качестве активного начала при изготовлении фармацевтического препарата. В случае получения асимметричных диэфиров, начиная от индивидуального изомера моноэфира,асимметричные диэфиры будут элюироваться первыми, а непрореагировавшие моноэфиры - после них. Кроме того, в данном случае, когда исходным материалом является смесь двух возможных изомеров моноэфира, получаемых в результате реакции этерификации согласно настоящему изобретению, может оказаться, что два изомера диэфира трудно разделить и поэтому целесообразно, по-видимому, смесь изомеров использовать в качестве активного начала при изготовлении фармацевтического препарата, а не тратить средства на разделение изомеров. Согласно следующему аспекту настоящего изобретения заявителями предложена фармацевтическая композиция, содержащая в качестве активной основы по крайней мере одно производное апорфина формулы I, как определено выше, или его физиологически приемлемую соль вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Термин "по крайней мере одно", применяемый в описанном выше абзаце, главным образом, подразумевает обращение к случаю, когда смесь двух изомеров, являющуюся результатом реакции этерификации согласно настоящему изобретению, трудно разделить и отсюда целесообразно, по-видимому, использовать вышеуказанную смесь, а не один изомер. По-видимому, целесообразно использовать смесь двух изомеров или комбинацию двух соединений согласно изобретению, имеющих различные комбинации значений символов R1 и R2 в формуле I друг с другом. Эфирные пролекарства апорфина формулы I согласно изобретению могут быть включены в фармацевтическую композицию согласно изобретению в качестве основания или в качестве аддитивной соли кислоты, особенно хлористоводородной соли. Другими подходящими солями являются такие соли, которые образованы с помощью кислот НВr и сульфокислоты, подобной метансульфокислоте, октансульфокислоте и гексадекансульфокислоте. Как уже указывалось, существует потребность в улучшенных способах введения апоморфина и/или пролекарств апоморфина, которые недостаточно всасываются при пероральном применении и/или являются мишенями для исчерпывающей элиминации при первом проникновении. Согласно настоящему изобретению неожиданно было обнаружено, что дозированная форма с пролонгированным действием может быть получена путем использования пролекарств апорфина формулы I согласно изобретению,суспендированных (в виде чистого масла или в виде кристаллов, или растворенных в подходящем и фармацевтически приемлемом растворителе (например, воде, этаноле, ДМСО, изо-PrOH или бензилбензоате в фармацевтически приемлемом масле-депо (например, viscoleo, кунжутном масле или оливковом масле) и инъецируемых подкожно или внутримышечно шприцом или "карандашом-инжектором". В качестве альтернативы, указанные лекарственные средства могут быть в подходящей композиции и с подходящим связующим веществом (усиливающим проникновение) нанесены на пластырь для чрескожного введения. Композиция также может включать местное анестезирующее средство (например, лидокаин),чтобы избежать боли при инъецировании, в частности при внутримышечных инъекциях. Таким образом, согласно предпочтительному аспекту, касающемуся фармацевтической композиции согласно настоящему изобретению, вышеуказанную композицию применяют в виде пластыря или мази для чрескожного введения. Вышеуказанные пластырь или мазь предпочтительно также содержат стабилизаторы, солюбилизаторы и агенты, активирующие проницаемость, для облегчения проникновения активной основы через кожу.-7 006388 Согласно другому предпочтительному аспекту, касающемуся композиции согласно настоящему изобретению, вышеуказанную композицию применяют в виде препарата-депо для подкожного или внутримышечного введения, содержащую вышеуказанное производное апорфина формулы I или его физиологически приемлемую соль, растворенные или суспендированные в масле. Как указано выше, такая композиция предпочтительно содержит местное анестезирующее средство кроме производного апорфина формулы I или его физиологически приемлемой соли. Инъецируемая композиция-депо представляет собой дозированную форму, которая, главным образом, предназначена оказывать терапевтический эффект в течение 2-4 недель после введения (например,нейролептики, подобные деканоату флуфеназина в кунжутном масле). Для того, чтобы поддержать эффективные уровни лекарственного средства в плазме, дозированная форма должна высвобождать лекарственное средство с более или менее постоянной скоростью в течение желательного интервала между дозами. Действующее правило приготовления данного лекарственного средства с пролонгированным высвобождением является довольно простым. Поскольку лекарственное вещество должно достичь большого круга кровообращения для проявления его действия, большинство инъекционных систем-депо снижает скорость транспортировки лекарственного средства от участка инъекции до большого круга кровообращения. Подкожный путь введения позволяет избежать проблемы эффекта первого проникновения, что является очень важным в случае апоморфина, представляющего собой катехин и поэтому являющегося чувствительным к окислению, конъюгации и инактивации посредством СОМТ (катехол-Ометил трансфераза). Апоморфин нельзя принимать перорально вследствие его значительного метаболизма при первом проникновении. Подходящей формой введения препарата-депо является подкожное или внутримышечное введение масляного раствора и/или масляной суспензии липофильного лекарственного средства. Такое введение приводит к медленной транспортировке через раздел масло-биологическая жидкость и медленному растворению в биофазе. Таким образом, когда лекарственное средство растворяется в аполярном растворителе (например, масле), который не смешивается с водными биологическими жидкостями, лекарственное средство должно проходить через раздел фаз масло/вода. Когда коэффициент распределения в фазах масло/вода является высоким, то транспортировка лекарственного средства будет медленной. Что касается очень липофильных лекарственных средств, то высвобождение из масляной фазы продолжается в течение вплоть до нескольких недель. Максимальный объем масляного раствора/суспензии, который вводят внутримышечно или подкожно, составляет 2-4 мл. Это выполнимо для препаратов производных апорфина согласно настоящему изобретению. Накопленная суточная доза, используемая в терапии болезни Паркинсона посредством подкожного введения апоморфина, составляет в 4-10 раз больше относительно 1-4 мг (4-40 мг/день). Что касается проведенного на животных фармакологического исследования, которое привело к настоящему изобретению, приблизительно 2 мг апоморфина х НСl (или эквивалентное молярное количество соединений согласно формуле I выше в качестве основания или в качестве подходящей соли или ионной пары) растворяют в 1 мл масла (кунжутное масло, Viscoleo или другое проверенное масло), и смесь осторожно нагревают (максимально до 50 С), встряхивают в аппарате для встряхивания и подвергают действию ультразвука в течение короткого периода времени (минуты) до тех пор, пока смесь не станет гомогенным раствором или суспензией. Если необходимо, испытуемое соединение вначале растворяют в 50-300 мкл ДМСО, воде, трет-BuOH, PEG, бензилбензоате или другом подходящем и проверенном растворителе или в их смесях, затем добавляют масло (см. выше) до общего объема 1 мл. Другие подходящие формы введения производных апорфина формулы I согласно изобретению включают в себя формы, подходящие для перорального, подъязычного, легочного, ректального, вагинального или интрадуоденального введения. Предпочтительной формой фармацевтической композиции, предназначенной для перорального введения, является форма, покрытая энтеросолюбильной оболочкой, которая быстро растворяется в двенадцатиперстной кишке/тонком кишечнике. Такая форма может включать в себя основу таблетки, полученную компрессией смеси активного ингредиента (ингредиентов), наполнителей, адъювантов и возможных других добавок, которую затем покрываютэнтеросолюбильной оболочкой. В качестве альтернативы, такая форма может включать в себя смесь активного ингредиента (ингредиентов) и соответствующих наполнителей и адъювантов, заключенную в капсулу, которая растворяется в двенадцатиперстной кишке/тонком кишечнике и, таким образом, функционирует в качестве энтеросолюбильной оболочки для вышеуказанной смеси. Предпочтительно вышеуказанная смесь находится в виде раствора активного ингредиента (ингредиентов) в растворителе. Предпочтительно, что новые эфирные пролекарства апорфина формулы I согласно настоящему изобретению содержатся в композиции в количестве от 0,05 до 100 мг, предпочтительно от 0,05 до 20 мг в каждой стандартной лекарственной форме. В тех случаях, когда больному требуется высокая суточная доза, то ее можно вводить в виде нескольких (более низких доз) инъекций в течение дня. Однако число указанных инъекций в день все же ниже, чем число инъекций с ранее используемой композицией, содержащей апоморфин х НСl в воде (может достигать 10-12 инъекций в день).-8 006388 Как упомянуто выше, агонисты DA, подобные апоморфину, оказывают побочный эффект, такой как тошнота и рвота. Поэтому предпочтительно, когда композицию согласно изобретению вводят после противорвотного средства или в сочетании с ним, по крайней мере, в начале терапии. Противорвотное средство может быть подходящим образом введено в такой же композиции, что и новые эфирные пролекарства апорфина согласно настоящему изобретению. В качестве альтернативы, противорвотное средство может быть введено отдельно от агониста DA любым из обычных пероральных или парентеральных способов введения, например с помощью таблеток, капсул, суспензий, суппозиториев, инфузий, инъекций и т.д., в подходящее время, такое как до, после или одновременно с введением агониста DA. Вероятно, что после адаптационного периода противорвотное средство можно убрать из терапевтической схемы. Таким образом, согласно следующему предпочтительному аспекту, касающемуся фармацевтической композиции согласно настоящему изобретению, вышеуказанная композиция, кроме производного апорфина формулы I или его физиологически приемлемой соли, содержит эффективное количество противорвотного агента. Предпочтительно, когда противорвотное средство содержится в композиции в количестве от 1 до 120 мг, более предпочтительно 1-60 мг. Однако определенное количество противорвотного средства,которое должно быть введено больному, будет зависеть от выбранного противорвотного средства. Хорошо известными и часто используемыми противорвотными средствами являются периферические антагонистыDA 5-хлор-1-[1-[3-(2,3-дигидро-2-оксо-1 Н-бензимидазол-1-ил)пропил-4-пиперидинил-1,3 дигидро-2 Н-бензимидазол-2-он (домперидон) и его соли. Диапазон предпочтительной суточной дозы противорвотного домперидона составляет 20-120 мг, более предпочтительно 30-60 мг. В тех случаях,когда требуется высокая суточная доза, она может быть введена в виде нескольких приемов небольших доз. Другим противорвотным средством является налоксон, противоядие апоморфина, снижающее рвотный эффект апоморфина. Для парентерального введения приготовляют жидкие стандартные лекарственные формы, используя соединение формулы I согласно изобретению или его фармацевтически приемлемую соль и стерильное связующее вещество. Соединение, в зависимости от связующего вещества и используемой концентрации, может быть либо суспендировано, либо растворено в связующем веществе. При приготовлении растворов соединение можно растворить для инъекции и стерилизовать с помощью фильтрации до заполнения флакона или ампулы и герметично закрыть. Целесообразно, когда адъюванты, такие как местноанестезирующие консерванты и буферные реагенты, растворяют в связующем веществе. Для повышения стабильности композицию можно заморозить после помещения ее во флакон, и воду удаляют в вакууме. Парентеральные суспензии готовят, в основном, таким же способом, за исключением того, что соединение суспендируют в связующем веществе, а не растворяют его, и стерилизация не может быть осуществлена фильтрацией. Возможно, поверхностно-активное вещество или смачивающий реагент включают в композицию, чтобы облегчить однородное распределение соединения. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного материала, в зависимости от способа введения. Доза соединения, применяемая в лечении вышеупомянутых нарушений, будет варьировать обычным образом в зависимости от серьезности заболеваний, веса больного и других подобных факторов. Однако в качестве обычно рекомендуемых подходящих стандартных доз могут применяться дозы от 0,05 до 100 мг, более предпочтительно от 0,05 до 20,0 мг, например от 0,2 до 5 мг, и подобные стандартные дозы могут быть введены более одного раза в сутки, например два или три раза в сутки, так что общая суточная дозировка находится в области приблизительно от 0,5 до 100 мг, и подобная терапия может продолжаться в течение ряда недель, месяцев, лет, включая состояния покоя больного. Другими заболеваниями/состояниями, кроме болезни Паркинсона, которые можно лечить с помощью пролекарств апорфина согласно настоящему изобретению, являются синдром усталых ног (RLS),мигрень, нарушение эрекции (импотенция у мужчин) и также повышенная половая возбудимость, например, у женщин в периоде менопаузы (стимуляция смазывания влагалища и эрекция клитора), гиперпролактинемия и психозы (например, шизофрения). Таким образом, упомянутые заболевания не ограничивают область настоящего изобретения, поэтому другие болезненные состояния, вовлекающие DAергическую систему, являются также вполне подходящими для лечения соединениями согласно настоящему изобретению. При введении соединений согласно изобретению в соответствии с изобретением неприемлемых токсикологических эффектов не ожидают. Агонисты DA, особенно апоморфин, можно применять для прогнозирования вероятного ответа на прием леводопы у больных болезнью Паркинсона. Соответственно, настоящее изобретение в следующем аспекте касается применения фармацевтической композиции, как определено выше, с целью оценки болезни Паркинсона. В другом аспекте настоящего изобретения заявители предлагают использовать производное апорфина формулы I, как определено выше, для производства лекарственного средства для лечения болезни Паркинсона, мигрени, синдрома усталых ног (RLS), половых нарушений у мужчин и женщин, гиперпролактинемии и психотических расстройств и/или оценки болезни Паркинсона.-9 006388 Согласно одному аспекту предпочтительна фармацевтическая композиция в форме, подходящей для перорального введения, покрытой энтеросолюбильной оболочкой, которая быстро растворяется в двенадцатиперсной кишке/тонком кишечнике. Согласно другому аспекту предпочтительным производным апорфина является монобутироилапоморфин. Изобретение далее будет описано посредством ряда примеров, которые не рассматривают как ограничивающие объем настоящего изобретения. Примеры Приборы и способы исследования Точки плавления определяли в открытых стеклянных капиллярах на электротермическом цифровом приборе для определения точки плавления, и они не являются истинными. Масс-спектры были получены на приборе Unicam 610-Automass 150 GC-MS system или на PE-Sciex API 3000 трехкратном четырехполюсном масс-спектрометре (Sciex, Concord, Ont., Canada), снабженном Turbo Ionspray interface. Ход реакции контролировали с помощью газового хроматографа Perkin-Elmer 8410, снабженного колонкой СрSil 5. Производные свободных гидроксигрупп были получены с помощью уксусного ангидрида или бутироилхлорида. Колоночную хроматографию выполняли с помощью окиси алюминия 90, активной, нейтральной, начиная с CH2Cl2 в качестве элюента и постепенно повышая полярность элюента путем добавления трет-бутанола вплоть до 10% (об./об.). Тонкослойную хроматографию выполняли на пластинах сAl2O3 60 F254, нейтральной. Пример 1. Моноацетил-апоморфин Апоморфин НСl (0,25 г, 0,83 ммоль) растворяли в CH2Cl2 (25 мл) и трифторуксусной кислоте (2 мл). Смесь перемешивали на льду. Затем добавляли ацетилхлорид (0,13 г, 1,65 ммоль). Температуру медленно повышали до комнатной температуры. Реакционную смесь оставляли на ночь и затем выпаривали при пониженном давлении, при этом получали маслянистый продукт желтого цвета. В результате очистки колоночной хроматографией получают 17,4 мг (0,056 ммоль, 6,8%) кристаллов серого цвета. API-MS:m/z 310 (М+Н)+. Пример 2. Монобутироилапоморфин Апоморфин НСl (0,25 г, 0,83 ммоль) растворяли в CH2Cl2 (25 мл) и трифторуксусной кислоте (2 мл). Смесь перемешивали на льду. Затем добавляли бутироилхлорид (0,09 г, 0,83 ммоль). Температуру медленно повышали до комнатной температуры. После 3,5 ч добавляли 0,5 эквивалентов бутироилхлорида. Дополнительные 0,5 эквиваленты добавляли после 5,5 ч. Реакционную смесь оставляли на ночь и затем выпаривали при пониженном давлении, при этом получали маслянистый продукт желтого цвета. В результате очистки колоночной хроматографией получают продукт в виде бесцветного масла. Кристаллизацией из гексана получали 14 мг (0,042 ммоль, 5,1%) кристаллов серого цвета: т.пл. 99-102 С; API-MS:m/z 338 (М+Н)+. Пример 3. Монопивалоилапоморфин Апоморфин НСl (0,45 г, 1,49 ммоль) растворяли в CH2Cl2 (25 мл) и трифторуксусной кислоте (2 мл). Смесь перемешивали на льду. Затем добавляли пивалоилхлорид (0,54 г, 4,46 ммоль). Температуру медленно повышали до комнатной температуры. Реакционную смесь оставляли на ночь и затем выпаривали при пониженном давлении, при этом получали маслянистый продукт желтого цвета. В результате очистки колоночной хроматографией получают продукт в виде бесцветного масла. Кристаллизацией из гексана получали 114 мг (0,32 ммоль, 21,8%) кристаллов серого цвета: т.пл. 128-130 С; API-MS: m/z 393(М+Н)+. Пример 4. Моногексадеканоилапоморфин Теоретический выход: 98 мг (основание) Синтез 1: Апоморфин х НСl (50,0 мг; 0,164 ммоль) растворяли в CF3COOH (0,3 мл) и добавляли один эквивалент (0,164 ммоль; 45,1 мг=49,7 мкл) гексадеканоилхлорида в виде одной навески при комнатной температуре. ТСХ (Al2O3; CH2Cl2:EtOH, 9:1 или 5:1) выполняли в разные интервалы времени. Добавили первые 2 эквивалента и после выстаивания в течение ночи при комнатной температуре растворитель выпаривали и остаток растворяли вновь в CH2Cl2, и образец отбирали пипеткой и подвергали хроматографии на пипетке, наполненной Al2O3. Элюцию осуществляли сначала посредством СН 2 Сl2 и затем смесью СН 2 Сl2:ЕtОН (9:1). Выделенный продукт (фракция 17,5 мг) растворяли в Viscoleo и вводили в шею одной нормальной крысы подкожно дозу из 10 мг/кг (соответствует приблизительно 5 мг/кг апоморфина х НСl). Четкие сигналы допаминергической активности выявляли в течение весьма длительного времени (приблизительно 24 ч). Заявители полагают, что первоначально реакция не была окончена, и поэтому добавляли еще 3 эквивалента. Полагали, что указанное добавление способствует завершению реакции. После хроматографии (см. выше) выделенный продукт (15 мг) растворяли в Viscoleo и инъецировали подкожно двум крысам (приблизительно 3,7 мг/кг, соответствует 2 мг/кг апоморфина х НСl) в концентрации 3,7 мг/мл. Никакого эффекта не было получено. Объяснение: Первая небольшая порция содержала как моно-, так и ди-С 16-апоморфин и заметно проявляла активность при инъецировании в Viscoleo как в носителе. Вторая порция содержала только- 10006388 ди-С 16-апоморфин, который in vivo заметно не гидролизовался (или очень медленно) до самого апоморфина. Поэтому новую порцию брали в качестве исходного материала и реакцию контролировали посредством масс-спектрометрии API MS. Синтез 2: Такую же реакцию осуществляли с порцией, включающей 50 мг. В это время добавляли 1 эквивалент и реакцию контролировали и обнаружили, что она не окончилась. Однако ди-С 16 не образовывался. Таким образом, другой эквивалент добавляли, и масс-спектрометрия позволила выявить приблизительно 60, 100 и 10% апоморфина, моно-С 16-апоморфина и ди-С 16-апоморфина, соответственно. Было решено остановить реакцию на этой стадии и растворитель (CF3COOH) выпарить. Остаток растворяли приблизительно в 1 мл CH2Cl2 и помещали в колонку в виде пипетки с Al2O3 и элюировали посредством CH2Cl2 и затем смеси CH2Cl2:EtOH (9:1). Фракции 28-31 анализировали посредством массспектрометрии и показали, что они содержали приблизительно 50/50 апоморфина и моно-С 16 апоморфина, несмотря на тот факт, что находящийся в колонке апоморфин должен прочно удерживаться на Al2O3. Поэтому к фракциям 28-31 добавляли одну каплю пиридина и после этого одну каплю Ас 20 для ацетилирования любой свободной ОН группы во фракциях. Весьма неожиданно, что ди-Ас-Аро в образцах не был обнаружен посредством масс-спектрометрии. Таким образом, никакого Аро не было в указанных образцах после хроматографии. Аро должен быть образован в образцах, разбавленных МеОН при приготовлении препаратов для масс-спектрометрических опытов. Таким образом, моно-С 16-Аро является очень чувствительным к метанолизу (и, вероятно, к гидролизу) и не должен контактировать с нуклеофильными спиртами, подобными МеОН и EtOH. Однако подходящим должен быть ненуклеофильный спирт, подобный трет-ВиОН. Остаток порции помещали в колонку с Al2O3 (приблизительно 5 г) и элюировали посредствомCH2Cl2 и затем смесью CH2Cl2:EtOAc с увеличивающимися концентрациями EtOAc. Однако отдельные фракции, содержащие продукт, не были обнаружены. Таким образом, применяли смесь СН 2 Сl2: третВuОН (9:1) и местонахождение наблюдали во фракциях 53 и 54, которые объединяли, оставляя только 4,5 мг флуоресцентного продукта, который оказался моно-гексадеканоилапоморфином, что было подтверждено масс-спектрометрией. Примеры с 5 по 18 По аналогии со способом из примеров 1-4 следующие моноэфиры апоморфина были получены, используя соответствующие хлорангидриды. Моноэфиры, полученные в примерах 1-18, и данные исследования суммированы в следующей табл. 1. Таблица 1- 11006388 Примеры с 19 по 23 Асимметричные диэфиры апоморфина получали двухстадийным способом, используя на каждой стадии методику, аналогичную той, которая описана в примерах 1-18. На первой стадии 15 мМ апоморфина подвергали взаимодействию с ацетилхлоридом в TFA с получением смеси 10,11-изомерных моноацетил-апоморфинов. На второй стадии, в каждый образец добавляли хлорангидрид, как изложено в табл. 2 ниже. В табл. 2 также представлены данные анализа полученных продуктов. Пример 24. Апоморфин х НСl (50 мг, 165 мкмоль) растворяли приблизительно в 0,5 мл CF3COOH и добавляли пивалоилхлорид (4 эквивалента, 660 мкмоль, 4x19,8 мг или мкл=79,2 мкл) при 0 С. После приблизительно 5 мин баню со льдом удаляли и смесь оставляли для достижения комнатной температуры и перемешивали в течение ночи. Летучие компоненты удаляли на роторном испарителе при пониженном давлении и остаточный продукт в виде масла растворяли в смеси CH2Cl2:EtOH (20:1) и наносили на колонку(10-15 г) с Al2O3 (нейтральная), элюировали смесью CH2Cl2:EtOH (20:1), и чистые фракции, содержащие монопивалоилированный АРО, собирали (35 мг после выпаривания растворителей), и моно-Piv-Apo (10Piv-Apo или 11-Piv-Аро) был подтвержден посредством ЯМР (300 Мгц) и масс-спектрометрии (API, см. табл. 1). Собранный продукт (35 мг) растворяли приблизительно в 0,5 мл CF3COOH и добавляли ацетилхлорид (приблизительно 2 эквивалента от исходного количества ApoxHCl (т.е. 165x2=330 мкмоль=2 х 12,9=25,8 мкл при комнатной температуре. Летучие компоненты выпаривали, и остаточный продукт в виде масла растворяли в CH2Cl2 и наносили на колонку с Al2O3 (нейтральная) , и продукты элюировали сначала посредством CH2Cl2 и затем смесью CH2Cl2:EtOH (20:1). Фракции, содержащие два изомера piv, Ac-Apo, подвергали ЯМР (фракция 45) и биологическому тестированию (фракция 46; 6,5 мг и фракция 47; 1,5 мг). Фракции 45-47 подвергали ГХ/масс-спектрометрии и получали следующие соотношения между изомерами: фракция 45, первый пик/второй пик=75/25; фракция 46, 67/33 и фракция 47,83/17, соответственно. Пример 25. Апоморфин х НСl (50 мг, 165 мкмоль) растворяли приблизительно в 0,5 мл CF3COOH и добавляли пропионилхлорид (4 эквивалента, 660 мкмоль, 3x15,2 мг или мкл=45,6/1,4 мкл= 32,6 мкл) при комнатной температуре. ТСХ смеси на Al2O3 в CH2Cl2 и смеси CH2Cl2/EtOH (20:1) показала, что в ней присутствовало много добавленного пропионилхлорида (основным продуктом был дипропионил). Несмотря на этот факт добавляли 2 эквивалента ацетилхлорида без первого разделения, чтобы превратить непрореагировавший пропионил-Аро в ацетил, пропионил-Аро. После ночи при комнатной температуре летучие компоненты выпаривали и остаточный продукт в виде масла растворяли в CH2Cl2 и наносили на колонку с Al2O3 (нейтральная), и продукты элюировали сначала посредством CH2Cl2 и затем смесью СН 2 Сl2:ЕtОН (20:1). Фракции, содержащие два изомера пропионил-Ас-Аро и дипропионил-Аро, подвергали ЯМР и биологическому тестированию. Указанные фракции содержали приблизительно 95% дипропионил-Аро и приблизительно 5% смешанных изомеров пропионил-Ас-Аро. Проведенные исследования с помощью ГХ/масс-спектрометрии показали два небольших пика,принадлежащих дисимметричным изомерам, и большой пик, принадлежащий ди-пропионил-Аро. Примеры 26-29. Способом, аналогичным способу, описанному в примере 24, получали асимметричные диэфиры апоморфина, используя на первой стадии хлорангидрид, как указано в табл. 3 ниже. На второй стадии осуществляли взаимодействие с ацетилхлоридом. В табл. 3 также представлены данные анализа полученных продуктов. Примеры 28-35. Способами, аналогичными способам, описанным в примерах 1-18, но с использованием R(-)пропилнорапоморфин вместо апоморфина в качестве исходного материала, получали следующую серию моноэфиров. Таким образом, 5 мМ R(-)-пропилнорапоморфина в дихлорметане, содержащем 3% TFA, подвергали взаимодействию с соответствующими хлорангидридами, приведенными в табл. 4 ниже, с получением соответствующих изомеров моноэфира как смеси. В табл. 4 также представлены данные анализа полученных продуктов. Таблица 4 Примеры 36-43. Используя реакционные смеси, полученные согласно примерам 28-35, в качестве исходных материалов для взаимодействия с ацетилхлоридом по аналогии со способами, описанными в примерах 19-28,получали следующую серию асимметричных диэфиров. В табл. 5 ниже представлены различные исходные материалы и данные анализа полученных продуктов. Таблица 5 Пример композиции Приготовление дозированной формы эфиров апорфина согласно настоящему изобретению в виде депонированного материала в масле. Эфир апорфина согласно настоящему изобретению в виде свободного основания или соли непосредственно растворяли в фармацевтически приемлемом масле (см. ниже) или сначала растворяли или суспендировали в подходящем растворителе, подобном спирту (например, трет-BuOH) или ДМСО, PEG и т.д., и затем этот раствор растворяли или суспендировали в подходящем масле (например, кунжутном масле, Viscoleo, оливковом масле, ореховом масле). Антиоксидант также может быть включен для защиты композиции от окислительной деградации. Раствор (смесь, суспензия) после соответствующей стерилизации (автоклав, гамма-излучение, окись этилена, стерилизация фильтрацией и т.д.) хранили в замороженном состоянии до использования. Перед использованием температуру раствора доводили до комнатной температуры и затем раствор тщательно встряхивали до получения раствора для инъецирования или суспензии для подкожного (s.c.) введения или внутримышечно (i.m.).- 13006388 Вследствие возможной тошноты и рвоты, вызываемой приемом апоморфина, субъекты могут предварительно принимать противорвотное средство, подобное домперидону. После предварительного приема такого средства терапию домперидоном, вероятно, можно отменить благодаря адаптации больного к апоморфину. Предпочтительно, каждая порция или полученная стандартная лекарственная форма содержит от 0,5 до 20 мг эфиров апорфина согласно настоящему изобретению (или эквивалентное количество соли/ионной пары), более предпочтительно от 0,5 до 15 мг и особенно 1 мг. Фармакокинетические исследования Протокол определения апоморфина в плазме Приборы Образцы анализировали независимо с помощью ОФ-ВЭЖХ, используя электрохимический детектор. Система включала в себя электрохимический детектор ANTEC, колонку С-18, инжектор для образцаGILSON 231 и разбавитель GILSON 401, насос для ВЭЖХ PHARMACIA 2150 и самописец планшетного типа Kipp en Zonen. Скорость потока составляла 0,25 мл/мин. Подвижная фаза включала 2000 мл UP 860 мл метанола 34 г моногидрата лимонной кислоты 13,5 г NaHPO32H2O 1,4 3 г EDTA 25 мг/л OSA 1 мМ ТМА Растворитель подвергали ультрафильтрации (UP). Животные Тестируемыми животными были самцы белых крыс Wistar, весящие между 200 и 370 г. Пищу и воду давали крысам в течение всего времени. Их содержали в нормальном 12-часовом ритме день-ночь. До операции животные находились в большой клетке, где содержали группу крыс. В течение экспериментов крыс содержали по одной в клетке размерами 252535 см. Образцы крови отбирали у свободно передвигающихся животных, которые все находились в сознании. Таким способом можно регистрировать потенциальные поведенческие изменения в процессе лечения. Операция заключалась во введении канюли в яремную вену. После эксперимента крысам давали по крайней мере 12 ч для выздоровления. Отбор образцов и экстракция крови Через канюлю, введенную в яремную вену, отбирали кровь у свободно передвигающихся крыс. Указанный отбор крови осуществляли с помощью инжекторного шприца и ПЭ-пробирки диаметром 0,75 мм. 1. Время отбора образцов крови было: t=0, 15, 30, 60, 120, 240, 480, 720 и 1440 мин. 2. В опытные пробирки Eppendorf помещали 10 мкл 0,35% меркаптоэтанола и 10 мкл 10% EDTA(конечная концентрация меркаптоэтанола была 0,01%). 3. В опытные пробирки Eppendorf собирали 0,35 мл крови (см. пункт 2 выше). 4. Собранную кровь центрифугировали в течение пяти минут при 22 С и 3500 оборотов в минуту. 5. Плазму в количестве 200 мкл пипеткой отбирали и переносили в чистые опытные пробирки. 6. Указанные тестируемые пробирки хранили при минус 18 С до анализирования. Экстракция плазмы К плазме добавляли раствор, содержащий 500 нг/мл NPA (N-пропил-норапоморфин). NPA является внутренним стандартом с конечной концентрацией 50 нг/мл. Кроме того, добавляли по 100 мкл 1% раствора бикарбоната натрия (NaHCO3). 1. Добавляли 3 мл диэтилового эфира (Р.А. качества) стеклянной пипеткой. 2. Все опытные пробирки встряхивали в течение трех минут на аппарате для встряхивания Multivortex. 3. Опытные пробирки центрифугировали в течение 15 мин при 4 С и 1000 оборотов в минуту. 4. Эфирный слой отбирали пипеткой и переносили в другую опытную пробирку. 5. Экстракцию эфиром осуществляли три раза. 6. Эфирные слои (в целом, 9 мл) выпаривали с помощью теплой воды и в токе газа азота, струящегося над поверхностью. 7. Остатки в опытных пробирках после выпаривания эфира растворяли в 100 мкл подвижной фазы. 8. Образцы перемешивали и затем помещали в центрифугу. 9. Полученные образцы подвергали исследованию с помощью системы ВЭЖХ. Чрескожный опыт на одной единственной крысе Приблизительно 5 мг моно-Вu-эфира аломорфина, полученного согласно примеру 2, растворяли приблизительно в 120 мг крема для рук Fenuril (PNU). Указанное количество крема накладывали шпателем на бритую шею крыс, весивших приблизительно 350 г. Заявители наблюдали допаминергические эффекты, но они были слабыми в своем проявлении.- 14006388 Указанные эффекты контролировали в течение приблизительно одного часа, и они проявлялись в исследовательском поведении и "охорашивании" и жевании в начальной фазе. После приблизительно получаса крысы успокаивались и стояли, в основном, неподвижно, периодически фыркали и жевали и некоторые из них зевали. После 1 ч и 10 мин приблизительно пять капелек ДМСО наносили на шею крысы. После приблизительно 10 мин регистрировали сильную зевоту, фырканье, вылизывание полового члена и жевание. Приблизительно через 30 мин после нанесения ДМСО крыса становилась очень активной с признаками фырканья, жевания и облизывания и обнаруживала типичный допаминергический синдром, включая локомоторную активность. Стереотипия продолжалась в течение по крайней мере двух часов. После дополнительных двух часов (в целом, 4 ч) крыса стояла неподвижно в неудобном положении, достаточно высоко на своих четырех лапах. Таким образом, крыса не находилась в нормальном лежачем положении и легко активизировалась при верчении клетки. В это время (t=приблизительно 6 ч) все еще наблюдали жевание,фырканье и зевоту. На следующий день в 10:00 утра крыса была еще активной, проявляя признаки жевания. Это было ненормальное поведение и являлось, должно быть, эффектом небольшого количества апоморфина, все еще циркулирующего в крови крысы. В сравнительном эксперименте 7 мг твердого хлоргидрата апоморфина растворяли в ДМСО (70 мкл). Твердый материал сразу растворялся, и 20 мкл, соответствующих 2 мг хлоргидратной соли апоморфина, наносили на бритую шею крысы. После приблизительно 10-15 мин наблюдали признаки жевания и фырканья. Крыса становилась немного спокойнее (благодаря пресинаптическому действию лекарственного средства), но продолжала фыркать и жевать. После приблизительно 30 мин крыса обнаруживала стереотипию. После приблизительно двух часов значительной стереотипии, включающей фырканье,локальную моторную активность, приподнятое положение и жевание, довольно внезапно крыса останавливалась. После этого времени крыса лежала, в основном, спокойно. Никаких других признаков допаминергической активности не регистрировали после этого времени. Цитируемая литература(21) Zijlstra, S.; De Groot, T.J., Kok, L.P.; Visser, G.M.; Vaalburg, W.J. J. Org. Chem. 1993, 58, 16431645. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное апорфина, имеющее общую формулу (I) где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (С 3 С 20)алканоила; галоген-(С 3-С 20)алканоила; (С 3-С 20)алкеноила; (С 4-С 7)циклоалканоила; (С 3-С 6)циклоалкил(С 2-С 16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1 С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил(С 2 С 16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из О, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (С 1-С 4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, и его физиологически приемлемые соли. 2. Производное апорфина по п.1, где один из R1 и R2 означает водород или ацетил и другой из них выбирают из группы, состоящей из (С 3-С 20)алканоила; (С 4-С 7)циклоалканоила; бензоила, который является незамещенным или замещенным атомом хлора или 1-3 метоксигруппами; фенилацетила, который может быть замещенным атомом хлора, и гетероарилацетила, и R3 означает (С 1-С 3)алкил или циклопропил. 3. Производное апорфина по п.2, где один из R1 и R2 означает водород и другой из них выбирают из группы, состоящей из пропаноила, пропеноила, бутаноила, изобутаноила, пивалоила, деканоила, гексадеканоила, циклопропаноила и бензоила, и R3 означает метил или пропил. 4. Производное апорфина по п.2, где один из R1 и R2 означает ацетил и другой из них выбирают из группы, состоящей из бутаноила, изобутаноила, циклопропаноила, циклогексаноила, пивалоила, деканоила и гексадеканоила, и R3 означает метил. 5. Способ получения моноэфирного производного апорфина, имеющего общую формулу (I) где один из R1 и R2 означает водород и другой из них выбирают из группы, состоящей из ацетила, (С 3 С 20)алканоила; галоген-(С 3-С 20)алканоила; (С 3-С 20)алкеноила; (С 4-С 7)циклоалканоила; (С 3-С 6)циклоалкил(С 2-С 16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями,выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3) алкила и(C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил(С 2 С 16)алканоила, который является незамещенным или замещенным в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (С 1-С 3)алкила и (C1-C3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из О, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3) алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (С 1-С 4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила, включающий а) взаимодействие апорфина общей формулы (II) где R3 определяют, как описано выше, с хлорангидридом общей формулы (III)R4-Cl где R4 является таким, как определено выше для одного из R1 и R2, при молярном отношении апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);b) после завершения взаимодействия выпаривание растворителей или лиофилизацию реакционной смеси;c) растворение остатка сырой смеси продукта в CH2Cl2 и очистку хроматографией на Аl2 О 3 с элюированием СН 2 Сl2 и затем смесями трет-ВuОН:СН 2 Сl2 и EtOH:CH2Cl2 с использованием ступенчатого градиента при увеличивающейся концентрации трет-ВuОН и EtOH, соответственно от 1 до 15 об.%, предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные моноэфирные производные формулы (I) иd) разделение вышеуказанных изомерных моноэфирных производных формулы (I) известными способами с целью выделения одного моноэфира формулы (I). 6. Способ получения диэфирного производного апорфина, имеющего общую формулу (I) где один из R"1 и R"2 означает ацетил и другой из них выбирают из группы, состоящей из (С 3 С 20)алканоила; галоген-(С 3-С 20)алканоила; (С 3-С 20)алкеноила; (С 4-С 7)циклоалканоила; (С 3-С 6) циклоалкил(С 2-С 16)алканоила; ароила, который является незамещенным или замещенным 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-С 3)алкила и (C1 С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; арил (С 2 С 16)алканоила, который замещен или незамещен в арильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, (C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь,может быть замещен 1-3 атомами галогена, и гетероарилалканоила, имеющего от одного до трех гетероатомов, выбранных из О, S и N в гетероарильном фрагменте, и от 2 до 10 атомов углерода в алканоильном фрагменте, и который является незамещенным или замещенным в гетероарильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, трифторметансульфонилокси,(C1-С 3)алкила и (C1-С 3)алкокси, причем последний, в свою очередь, может быть замещен 1-3 атомами галогена; и R3 выбирают из группы, состоящей из водорода; (C1-C4)алкила, который является незамещенным или замещенным 1-3 атомами галогена; циклопропила и циклопропилметила; способ, включающий в себя а) взаимодействие моноэфира апорфина общей формулы (I) где один из R1 и R2 означает водород и другой из них означает ацетил, и R3 определяют, как описано выше, с хлорангидридом общей формулы (IV)R5-Cl где R5 является таким, как определено выше для одного из R1 и R2, при молярном отношении моноэфира апорфина к хлорангидриду от 1:1 до 1:5 и в трифторуксусной кислоте и метиленхлориде (CH2Cl2);b) после завершения взаимодействия выпаривание растворителей или лиофилизацию реакционной смеси;c) растворение остатка сырой смеси продукта в CH2Cl2 и очистку хроматографией на Al2O3 с элюированием CH2Cl2 и затем смесями трет-ВuОН:СН 2 Сl2 и EtOH:CH2Cl2 с использованием ступенчатого- 17006388 градиента при увеличивающейся концентрации трет-ВuОН и EtOH, соответственно, от 1 до 15 об.% предпочтительно от 2 до 10 об.% смеси, и выделение фракций, содержащих изомерные диэфирные производные формулы (I") иd) разделение вышеуказанных изомерных диэфирных производных формулы (I") известными способами с целью выделения одного диэфира формулы (I"). 7. Фармацевтическая композиция, содержащая в качестве активной основы по крайней мере одно производное апорфина формулы I, как указано в любом из пп.1-4, или его физиологически приемлемую соль вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. 8. Фармацевтическая композиция по п.7, которая представлена в виде пластыря или мази для чрескожного введения. 9. Фармацевтическая композиция по п.8, которая, кроме того, содержит стабилизаторы, солюбилизирующие реагенты и реагенты, способствующие проницаемости, с целью облегчения проникновения активной основы через кожу. 10. Фармацевтическая композиция по п.7, которая представлена в виде препарата-депо для подкожного или внутримышечного введения, содержащая вышеуказанное производное апорфина формулы I или его физиологически приемлемую соль, растворенные или суспендированные в масле. 11. Фармацевтическая композиция по п.10, которая, кроме производного апорфина формулы I или его физиологически приемлемой соли, содержит местное анестезирующее средство. 12. Фармацевтическая композиция по п.7, которая представлена в форме, подходящей для перорального, подъязычного, легочного, ректального, вагинального или интрадуоденального введения. 13. Фармацевтическая композиция по любому из пп.7-12, которая, кроме производного апорфина формулы I или его физиологически приемлемой соли, содержит эффективное количество противорвотного реагента. 14. Применение производного апорфина формулы I, как указано в п.1, или его физиологически приемлемого производного для производства лекарственного средства с целью лечения болезни Паркинсона, мигрени, синдрома усталых ног, полового нарушения у мужчин и женщин, гиперпролактинемии и психотических расстройств и/или оценки болезни Паркинсона. 15. Способ лечения болезни Паркинсона, мигрени, синдрома усталых ног, полового нарушения, гиперпролактинемии и психотических расстройств, включающий в себя введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества производного апорфина формулы I, как определено в п.1, или его физиологически приемлемой соли.
МПК / Метки
МПК: A61K 31/473, A61P 25/00, C07D 211/18
Метки: терапии, применение, эфиры, апорфина, сложные
Код ссылки
<a href="https://eas.patents.su/19-6388-slozhnye-efiry-aporfina-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Сложные эфиры апорфина и их применение в терапии</a>
Предыдущий патент: 4-галогенированные 17-метиленстероиды, способ их получения и содержащие эти соединения фармацевтические композиции
Следующий патент: Новые соединения аминокислоты, способ их получения и фармацевтические композиции, содержащие их
Случайный патент: Внутриклеточный полипептид (cari) и способы его применения












