4-галогенированные 17-метиленстероиды, способ их получения и содержащие эти соединения фармацевтические композиции
Номер патента: 6387
Опубликовано: 29.12.2005
Авторы: Кауфманн Гюнтер, Мюллер Герд, Хиллиш Александр, Менценбах Бернд, Дрёшер Петер, Элгер Вальтер, Швайкерт Ханс-Удо
Формула / Реферат
1. 17-Метиленстероиды общей формулы I

в которой R4 представляет собой атом галогена или псевдогалоген,
R10 представляет собой атом водорода или прямоцепочечную либо разветвленную C1-C4алкильную группу,
R20 и R20a, каждый независимо друг от друга, представляет собой атом водорода, прямоцепочечную либо разветвленную C1-C4алкильную или гидрокси-C1-C4алкильную группу или один из радикалов R20 и R20a обозначает атом водорода, прямоцепочечную либо разветвленную C1-C4алкильную или гидрокси-C1-C4алкильную группу, а другой радикал обозначает атом галогена или псевдогалоген, за исключением 4-хлор-4-адростен-3,17-диона.
2. 17-Метиленстероиды по п.1, отличающиеся тем, что R4 представляет собой атом хлора либо брома или цианогруппу.
3. 17-Метиленстероиды по п.1 или 2, отличающиеся тем, что один из радикалов R20 и R20a представляет собой атом водорода или метильную группу, другой радикал обозначает атом фтора, хлора либо брома, азидо-, циано- либо роданогруппу или гидроксиметил.
4. 17-Метиленстероиды по пп.1, 2 или 3, отличающиеся тем, что R10 представляет собой атом водорода или метильную группу.
5. 17-Метиленстероиды по п.1 из группы, включающей
1) E-17-хлорметилен-4-хлорэстр-4-ен-3 -он,
2) E-17-цианометилен-4-хлорэстр-4-ен-3-он,
3) 2-17-цианометилен-4-хлорэстр-4-ен-3-он,
4) Z-17-(1')-цианоэтилиден-4-хлорэстр-4-ен-3 -он,
5) Z-17-этилиден-4-хлорэстр-4-ен-3-он,
6) E-17-этилиден-4-хлорэстр-4-ен-3-он,
7) E-17-бромметилен-4-хлорэстр-4-ен-3-он,
8) Z-17-хлорэтилиден-4-хлорэстр-4-ен-3-он,
9) Z-17-бромэтилиден-4-хлорэстр-4-ен-3-он,
10) E-17-хлорметилен-4-цианоандрост-4-ен-3-он,
11) E-17-хлорметилен-4-хлорандрост-4-ен-3-он,
12) E-17-(2')-гидроксиэтилиден-4-хлорэстр-4-ен-3-он и
13) Z-17-(2')-гидроксиэтилиден-4-хлорэстр-4-ен-3-он.
6. Способ получения 17-метиленстероидов по п.1, где R20a обозначает атом водорода, отличающийся тем, что соединение общей формулы II
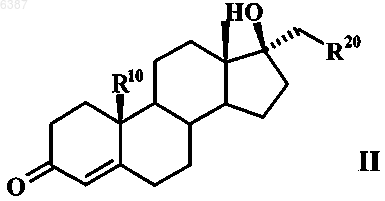
в апротонном растворителе подвергают взаимодействию с хлорангидридом кислоты с образованием 17-метиленстероида общей формулы III
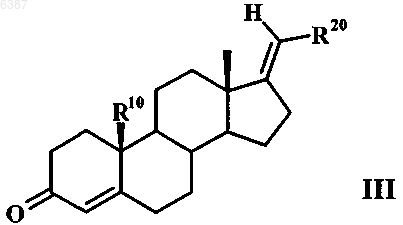
далее с помощью H2O2/NaOH образуют 4,5-эпоксид, из которого затем за счет размыкания кольца нуклеофильным реагентом - производным атома галогена, соответственно псевдогалогена - в диполярном апротонном растворителе образуют галоген-, соответственно псевдогалогенгидрин и этот гидрин при определенных условиях взаимодействием с минеральной кислотой, карбоновой кислотой или сульфоновой кислотой в протонном либо апротонном растворителе, путем дегидратации превращают в соединение общей формулы IV

в которой R4 представляет собой атом галогена или псевдогалоген, при этом R10 имеет значения, указанные в п.1, а R20 обозначает C1-C4алкильную или гидрокси-C1-C4алкильную группу, атом галогена или псевдогалоген.
7. Способ получения 17-метиленстероидов по п.1, отличающийся тем, что соединение общей формулы V
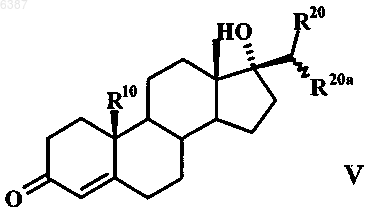
подвергают взаимодействию с хлорангидридом кислоты в апротонном растворителе с образованием в результате метиленстероида общей формулы VI
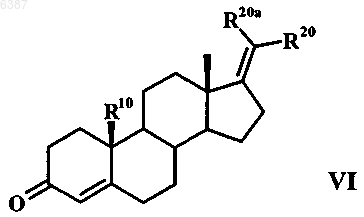
далее с помощью H2O2/NaOH образуют 4,5-эпоксид, из которого затем за счет размыкания кольца нуклеофильным реагентом - производным атома галогена, соответственно псевдогалогена - в диполярном апротонном растворителе образуют галоген-, соответственно псевдогалогенгидрин и этот гидрин при определенных условиях взаимодействием с минеральной кислотой, карбоновой кислотой или сульфоновой кислотой в протонном либо апротонном растворителе, путем дегидратации превращают в соединение общей формулы VII
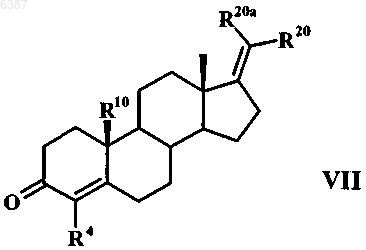
в которой R4 представляет собой атом галогена или псевдогалоген, при этом R10 имеет значения, указанные в п.1, а R20 обозначает C1-C4алкильную или гидрокси-C1-C4алкильную группу и R20a обозначает атом водорода, атом галогена или псевдогалоген.
8. Фармацевтические композиции, содержащие в своем составе по меньшей мере один 17-метиленстероид по пп.1, 2, 3, 4 или 5, при необходимости вместе с фармацевтически приемлемыми вспомогательными веществами и носителями.
9. 17-Метиленстероиды по любому из пп.1-5 для применения в качестве терапевтических активных веществ.
10. Применение соединений по любому из пп.1-5 для лечения заболеваний предстательной железы, алопеции мужского типа, угрей и гирсутизма, а также для мужской и женской контрацепции и/или для ингибирования 5a -редуктазы.
Текст
006387 Настоящее изобретение относится к 17-метиленстероидам, к способу их получения и к содержащим эти соединения фармацевтическим композициям. Предлагаемые в изобретении соединения обладают профилем действия смешанного характера, проявляющегося в том, что, с одной стороны, они действуют как ингибиторы 5-редуктазы, а с другой стороны, как гестагены. Поэтому они пригодны для лечения заболеваний определенных органов и тканей у мужчин и женщин, обусловленных повышенным уровнем андрогенов. В сочетании с другими гормональными веществами, такими как эстроген, тестостерон, соответственно высокоактивный андроген,соединения по изобретению могут применяться в качестве противозачаточных средств как для женщин,так и для мужчин. У женщин повышенный уровень 5-дигидропрогестерона может способствовать возникновению серьезных расстройств здоровья при предменструальном синдроме. На такие расстройства можно также положительно воздействовать за счет подавления 5-редуктазы. Одновременное наличие гестагенного действия позволяет подавлять у представителей обоих полов функции гонад. Данный эффект желателен в тех случаях, когда целью лечения является антирепродуктивное действие или же подавление гормональной секреции гонад. Поскольку у беременных женщин, вынашивающих плод мужского пола, подавление 5-редуктазы может привести к необратимым нарушениям развития и формирования половых признаков плода, сохранение фертильности при одновременной антиандрогенной терапии является целью, к которой следует стремиться. Возможными показаниями для применения могут быть заболевания предстательной железы, алопеция мужского типа, угри и гирсутизм. У соответственно предрасположенных к этому женщин удается улучшить состояние при предменструальном синдроме. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача получить соединения, обладающие действием ингибиторов 5-редуктазы и одновременно действием гестагенов. Указанная задача решается благодаря 17-метиленстероидам общей формулы IR4 представляет собой атом водорода, атом галогена или псевдогалоген,R10 представляет собой атом водорода или прямоцепочечную либо разветвленную С 1-С 4 алкильную группу,R20 и R20a, каждый независимо друг от друга, представляет собой атом водорода, прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу или один из радикалов R20 иR20a обозначает атом водорода, прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1 С 4 алкильную группу, а другой радикал обозначает атом галогена или псевдогалоген,R4 помимо атома водорода может обозначать атом галогена, такой как атом фтора, хлора, брома либо иода, или псевдогалоген, такой как цианатная, роданидная, циано- или азидогруппа, предпочтительны при этом атом брома или цианогруппа и особенно предпочтителен атом хлора,R10 может представлять собой атом водорода или прямоцепочечную либо разветвленную С 1 С 4 алкильную группу, в качестве примеров прямоцепочечных, соответственно разветвленных С 1 С 4 алкильных групп можно назвать при этом метил, этил, пропил, изопропил, бутил, изобутил и третбутил. Предпочтительными значениями R10 являются атом водорода и метильная группа.R20 и R20 могут, во-первых, каждый независимо друг от друга, представлять собой атом водорода,прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу. Предпочтительно в этом случае R20 и R20a обозначают, каждый независимо друг от друга, атом водорода, метильную группу или группу -СН 2 ОН. Кроме того, один из радикалов R20 и R20a может обозначать атом водорода, прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу, а другой радикал может обозначать атом галогена, такой как атом фтора, хлора, брома либо иода, или псевдогалоген, такой как цианатная, роданидная, циано- или азидогруппа. В качестве примеров прямоцепочечных, соответственно разветвленных С 1-С 4 алкильных групп можно назвать группы, указанные для R10. Прямоцепочечные, соответственно разветвленные гидрокси-С 1-С 4 алкильные группы представляют собой производные вышеназванных прямоцепочечных, соответственно разветвленных С 1-С 4 алкильных групп, где один или несколько атомов водорода заменены на гидроксильные группы. Предпочтительно в этом случае один из радикалов R20 и R20a обозначает атом водорода или метиль-1 006387 ную группу, а другой радикал обозначает атом галогена, предпочтительно атом фтора, особенно предпочтительно атом хлора либо брома, или псевдогалоген, предпочтительно азидо- либо роданогруппу,особенно предпочтительно цианогруппу. В качестве примеров прямоцепочечных, соответственно разветвленных С 1-С 4 алкильных групп, являющихся значениями R20 и R20a, можно назвать таковые, которые указаны для R10. Прямоцепочечные,соответственно разветвленные гидрокси-С 1-С 4 алкильные группы представляют собой производные этих С 1-С 4 алкильных групп, где один или несколько атомов водорода заменены на гидроксильные группы,прежде всего на группу -(СН 2)n-ОН, где n равно 1-4. К наиболее предпочтительным относятся следующие соединения: 1) Е-17-хлорметилен-4-хлорэстр-4-ен-3-он,2) Е-17-цианометилен-4-хлорэстр-4-ен-3-он,3) Z-17-цианометилен-4-хлорэстр-4-ен-3-он,4) Z-20-циано-4-хлор-19-норпрегна-4,17(20)-диен-3-он,5) Z-4-хлор-19-норпрегна-4,17(20)-диен-3-он,6) Е-4-хлор-19-норпрегна-4,17(20)-диен-3-он,7) Е-17-бромметилен-4-хлорэстр-4-ен-3-он,8) Z-20-хлор-19-норпрегна-4,17(20)-диен-3-он,9) Z-4,20-дихлор-19-норпрегна-4,17(20)-диен-3-он,10) Z-20-бром-4-хлор-19-норпрегна-4,17(20)-диен-3-он,11) Е-17-хлорметилен-4-цианоандрост-4-ен-3-он,12) Е-17-хлорметилен-4-хлорандрост-4-ен-3-он,13) Е-21-гидрокси-4-хлор-19-норпрегна-4,17(20)-диен-3-он и 14) Z-21 -гидрокси-4-хлор-19-норпрегна-4,17(20)-диен-3-он. Объектом настоящего изобретения являются далее фармацевтические композиции, содержащие в качестве активных веществ по меньшей мере один 17-метиленстероид общей формулы I, при этом в состав названных композиций включены при необходимости соответствующие вспомогательные вещества и носители, а также применение предлагаемых соединений для получения лекарственных средств, прежде всего при указанных ниже показаниях. Вводимое количество соединения общей формулы I может варьироваться в широких пределах, при условии, что такое активное количество обеспечивает достижение требуемого эффекта. В зависимости от состояния, для которого предназначается соответствующее лечение, и от методики введения суточная доза вводимого соединения может составлять от 0,01 мкг/кг до 10 мг/кг веса тела, предпочтительно от 0,04 мкг/кг до 1 мг/кг веса тела. Для человека это соответствует суточной дозе от 0,8 мкг до 800 мг,предпочтительно от 3,2 мкг до 80 мг. Унифицированная доза содержит согласно изобретению от 1,6 мкг до 200 мг одного или нескольких соединений общей формулы I. Предлагаемые в изобретении соединения пригодны для получения фармацевтических композиций и составов. Фармацевтические композиции, соответственно лекарственные средства, содержат в качестве активного вещества одно или несколько соединений по изобретению, при необходимости, в смеси с другими фармакологически, соответственно фармацевтически активными веществами. Лекарственные средства изготавливают по обычной технологии, при этом могут использоваться известные и общепринятые в таких случаях фармацевтические вспомогательные вещества, а также иные обычные носители и разбавители. В качестве таких носителей и вспомогательных веществ могут рассматриваться таковые, которые рекомендуются для использования в качестве вспомогательных веществ в фармацевтике, косметике и других смежных областях или указываются в следующих публикациях: Ullman's Encyklopadie der technischen Chemie, т. 4 (1953), cc. 1-39; Journal of Pharmaceutical Sciences, т. 52 (1963), cc. 918 и далее; H. v.Cantor KG, Aulendorf in Wurttemberg (1971). Соединения могут применяться для перорального или парентерального введения, например интраперитонеального, внутримышечного, подкожного или чрескожного введения. Соединения можно также имплантировать в ткань. Для перорального введения могут назначаться капсулы, пилюли, таблетки, драже и т.д. Унифицированные дозы могут при этом наряду с активным веществом содержать также фармацевтически приемлемый носитель, такой, например, как крахмал, сахар, сорбит, желатин, антиадгезивы, кремниевую кислоту, тальк и т.п. Для парентерального введения активные вещества можно растворять или суспендировать в физиологически приемлемом разбавителе. В качестве разбавителей целесообразно использовать в большинстве случаев масла с добавлением или без добавления средства, способствующего растворимости, поверхностно-активного вещества, суспендирующего или эмульгирующего агента. В качестве примеров используемых масел можно назвать оливковое масло, арахисовое масло, хлопковое масло, соевое масло, касторовое масло и кунжутное масло. Соединения могут применяться также в виде инъекции в форме депо или имплантируемого препа-2 006387 рата, которые приготавливают таким образом, чтобы обеспечить высвобождение активного вещества постепенно, с замедлением, т.е. с приданием пролонгированного действия. Имплантаты могут содержать в качестве инертных материалов, например, биологически разлагаемые полимеры или синтетические силиконы, такие, например, как силиконовый каучук. Активные вещества можно, кроме того, при чрескожном применении заделывать в пластырь. Для изготовления снабженных активными соединениями общей формулы I внутривлагалищных систем (например, влагалищных колец) или внутриматочных систем (например, пессариев, спиралей,ВМС, Mirena), предназначенных, как очевидно, для местного применения, пригодны различные полимеры, такие, например, как кремнийорганические (силиконовые) полимеры, этиленвинилацетат, полиэтилен или полипропилен. Для обеспечения лучшей биодоступности активного вещества предлагаемые соединения можно использовать также для получения циклодекстринклатратов. С этой целью соединения подвергают взаимодействию с -, - или -циклодекстрином либо с его производными (см. заявку РСТ/ЕР 95/02656). Согласно изобретению соединения общей формулы I можно также инкапсулировать с липосомами. Соединения могут применяться как для перорального, так и парентерального введения при следующих показаниях. Как указывалось выше, предлагаемые в изобретении соединения обладают "гибридным" (смешанным) профилем действия. Они представляют собой ингибиторы 5-редуктазы и вместе с тем действуют как гестагены. Благодаря этому их можно применять для лечения заболеваний определенных органов и тканей у мужчин и женщин, обусловленных повышенным уровнем андрогенов. У женщин повышенный уровень 5-дигидропрогестерона может привести к серьезным нарушениям их здоровья при предменструальном синдроме. Эффективно препятствовать этому можно за счет подавления 5-редуктазы. Одновременное наличие у предлагаемых в изобретении соединений гестагенного действия позволяет подавлять у представителей обоих полов функции гонад. Данный эффект желателен в тех случаях, когда целью лечения является антирепродуктивное действие или же подавление гормональной секреции гонад. Такой подход часто реализуется при заболеваниях предстательной железы (доброкачественная гиперплазия простаты). Возможными показаниями для применения наряду с заболеваниями предстательной железы являются контрацепция у обоих полов, алопеция мужского типа, угри и гирсутизм. В сочетании с другими гормональными веществами, такими как эстроген, тестостерон, соответственно высокоактивный андроген, соединения по изобретению могут применяться в качестве противозачаточных средств как для женщин, так и для мужчин. В последнем случае действие тестостерона в простате удается ослабить за счет подавления 5-редуктазы, тогда как благодаря гестагенной активности действие в мужской гонаде, т.е. подавление сперматогенеза, удается повысить. Если соединения по изобретению предназначены для женской контрацепции, то их можно применять индивидуально или же в сочетании с соответствующим эстрогеном. В качестве эстрогенов приемлемы в принципе все соединения, обладающие эстрогенным действием. К таким эстрогенам относятся среди прочих этинилэстрадиол, 17-эстрадиол и его эфиры, такие как эстрадиол-3-бензоат, эстрадиол-17 валерат, -ципионат, -ундецилат, -энантат и/или другие эстрадиоловые эфиры (см. US 2611773, US 2990414, US 2054271, US 2225419 и US 2156599) и конъюгированные эстрогены. Согласно изобретению могут применяться также эстрадиол-, этинилэстрадиол- и эстрон-3 сульфаматы, например эстрон-N,N-диметилсульфамат, эстрон-N,N-диэтилсульфамат, этинилэстрадиол-3-N,N-диметилсульфамат, этинилэстрадиол-3-N,N-диэтилсульфамат, этинилэстрадиол-3-N,N-тетраметиленсульфамат, эстронсульфамат, эстрадиол-3-сульфамат, эстрадиол-3-N,N-диметилсульфамат, эстрадиол-3-N,N-диэтилсульфамат, этинилэстрадиол-3 -сульфамат, все представляющие собой пролекарственные остатки соответствующих 3-гидроксисоединений (см. W. Elger и др., в Journ. Steroid Biochem. Molec.Biol., т. 55,3/4 (1995), сс. 395-403; DE 4429398 A1 и DE 4429397 A1). Если соединения по изобретению предназначены для мужской контрацепции, то их можно применять индивидуально или же в сочетании с тестостероном, соответственно с высокоактивным андрогеном,примерами такого высокоактивного андрогена являются указанные в примерах соединения. В нижеследующих табл. 1 и 2 приведены данные касательно активности 5-редуктазы типа 2, полученные с использованием гомогенатов кожи половых органов, и данные касательно гестагенной активности in vivo. Таблица 1 Активность 5-редуктазы типа 2, определенная с использованием гомогенатов кожи половых органов в оптимизированных условиях при рН 5,5 (IC50(нM, связывание прогестеронового рецептора с цитозолом матки, подопытные животные - кролики, с затравкой, изотопный индикатор: 3H-ORG 2058/условия инкубации 0-4 С, 18 ч, контрольная субстанция: прогестерон=100% Таблица 2 Данные касательно гестагенной активности in vivo Тест на сохранение беременности, подопытные животные - мыши, после подкожного введения Приведенные в табл. 1 и 2 данные подтверждают смешанный характер механизма действия соединений по изобретению, которые действуют и как ингибиторы 5-редуктазы, и как гестагены. Предлагаемые соединения представляют собой, кроме того, промежуточные продукты для синтеза других фармакологически высокоэффективных стероидных продуктов. 17-Метиленстероиды общей формулы I по изобретению можно получать из соединений общей формулы II и общей формулы V Их получают взаимодействием соединения общей формулы II в апротонном растворителе, предпочтительно в пиридине или триэтиламине, с хлорангидридом кислоты, предпочтительно тионилхлоридом или оксихлоридом фосфора, с образованием соединения общей формулы III которое по известному методу подвергают эпоксидированию с помощью Н 2 О 2/NаОН в спирте, предпочтительно в метаноле или этаноле, образовавшийся 4,5-эпоксид размыканием кольца с помощью нуклеофилов, таких как галогенид (галогеноводород) или псевдогалогенид, в диполярном апротонном растворителе, предпочтительно в ДМСО или ДМП, диоксане или ацетоне, превращают в галоген-, соответственно псевдогалогенгидрины, и затем эти гидрины при катализе минеральной кислотой, карбоновой кислотой или сульфоновой кислотой, такой как хлористо-водородная кислота, щавелевая кислота или nтолуолсульфоновая кислота, в протонном либо апротонном растворителе, таком как метанол или ацетон,дегидратируют с образованием в результате соединения общей формулы IV в которой R4 представляет собой атом галогена или псевдогалоген, при этом R10 имеет указанные выше значения, a R20 обозначает С 1-С 4 алкильную либо гидрокси-С 1-С 4 алкильную группу, атом галогена или псевдогалоген. Согласно другому варианту 17-метиленстероиды общей формулы I получают взаимодействием соединения общей формулы V в апротонном растворителе, предпочтительно в пиридине или триэтиламине, с хлорангидридом кислоты, предпочтительно тионилхлоридом или оксихлоридом фосфора, с образованием соединения общей формулы VI которое по известному методу подвергают эпоксидированию с помощью Н 2 О 2/NаОН в спирте, предпочтительно в метаноле или этаноле, образовавшийся 4,5-эпоксид размыканием кольца с помощью нуклеофила, такого как галогенид (галогеноводород) или псевдогалогенид, в диполярном апротонном растворителе, предпочтительно в ДМСО или ДМП, диоксане или ацетоне, превращают в галоген-, соответственно псевдогалогенгидрин, и затем этот гидрин при катализе минеральной кислотой, карбоновой кислотой или сульфоновой кислотой, такой как хлористо-водородная кислота, щавелевая кислота или nтолуолсульфоновая кислота, в протонном либо апротонном растворителе, таком как метанол или ацетон,дегидратируют с образованием в результате соединения общей формулы VII Согласно еще одному варианту 17-метиленстероиды общей формулы I можно получать взаимодействием соединений общих формул III и VI осуществляемым по известной технологии (см. М. Haase-Held, M. Mattis и J. Mann, Journ. Chem. Soc, издво Perkin Trans. 1, стр. 2999 (1992 с NaIO4/KMnO4 в спиртах, предпочтительно в трет-ВuОН, с образованием 3,5-секокетокислот, эти последние с помощью Ас 2 О/АсСl переводят в ненасыщенные лактоны,которые затем взаимодействием с н-ВuLi/СН 3 СN в диполярном апротонном растворителе, таком как ТГФ, превращают в соединения общих формул VIII и IX Соединения формул III и IV могут быть получены также путем олефинирования действием карбо-5 006387 нильных соединений по реакции Виттига, Хорнера или Петерсона. Ниже изобретение более подробно поясняется на примерах. Пример 1. Z-4,20-дихлор-19-норпрегна-4,17(20)-диен-3-он. А). Z-20-хлор-19-норпрегна-4,17(20)-диен-3-он. 9,74 ммоль (3,28 г) (20)R-хлор-19-норпрегн-4-ен-3-он-17-ола растворяют в 34 мл пиридина. При небольшом охлаждении добавляют по каплям при перемешивании 12,66 ммоль (0,92 мл) тионилхлорида. Затем в атмосфере защитного газа (аргона) перемешивают приблизительно в течение 1 ч, после чего реакционный раствор сливают на охлажденную льдом воду с рН, установленным соляной кислотой на значение 3-4. Клейкий осадок экстрагируют метиленхлоридом, объединенные, промытые до нейтральной реакции экстракты сушат над сульфатом натрия и концентрируют. Образующийся твердый продукт очищают экспресс-хроматографией на силикагеле (элюент: толуен/этиловый эфир уксусной кислоты в соотношении 95:5) и при необходимости перекристаллизацией из метанола. Таким путем получают 0,6 г твердого продукта.tпл=138-141C; []D20=+104 (CHCl3). Б). Z-20-хлор-4,5-эпокси-19-норпрегн-17(20)-ен-3-он. 2,80 ммоль (894 мг) Z-20-хлор-19-норпрегна-4,17(20)-диен-3-она растворяют в смеси из 9 мл метанола и 7,3 мл метиленхлорида и охлаждают до 0 С. Затем к охлажденному раствору последовательно при перемешивании и в атмосфере защитного газа (аргона) добавляют по каплям 6,31 ммоль (0,63 мл) пероксида водорода (30%-ного) и 1,26 ммоль (0,3 мл) едкого натра (с=4 моль/л). По завершении процесса добавления температуру медленно повышают до комнатной. По истечении примерно 1,5 ч, в течение которых продолжается реакция, смесь сливают на ледяную воду, после чего экстрагируют метиленхлоридом. Объединенные экстракты сушат над сульфатом натрия и концентрируют. В результате получают 926 мг твердого продукта светложелтого цвета. В). Z-4,20-дихлор-19-норпрегна-4,17(20)-диен-3-он. 2,71 ммоль (896 мг) Z-20-хлор-4,5-эпокси-19-норпрегн-17(20)-ен-3-она растворяют в 25 мл 1,3 диметилтетрагидро-2(1H)-пиримидинона (ДМП) и медленно добавляют по каплям 26,54 ммоль (2,2 мл) соляной кислоты (37%-ной). После 1-часового перемешивания в атмосфере защитного газа (аргона) реакционный раствор сливают на охлажденный льдом водный раствор гидрокарбоната натрия, выпавший осадок отделяют вакуум-фильтрацией и в завершение сушат в эксикаторе с помощью гидроксида калия. В результате экспресс-хроматографии на силикагеле (элюент: толуен/этиловый эфир уксусной кислоты в соотношении 99:1) и последующей перекристаллизации из смеси метанол/ацетон получают 353 мг твердого продукта.A). Z-20-бpoм-19-нopпpeгнa-4,17(20)-диен-3-он. 9,7 ммоль (3,7 г) (20)R-бром-19-норпрегн-4-ен-3-он-17-ола растворяют в 39 мл пиридина. При небольшом охлаждении добавляют по каплям при перемешивании 12,61 ммоль (0,91 мл) тионилхлорида. Затем в атмосфере защитного газа (аргона) перемешивают приблизительно в течение 1 ч, после чего реакционный раствор сливают на охлажденную льдом воду с рН, установленным соляной кислотой на значение 3-4. Клейкий осадок экстрагируют метиленхлоридом, объединенные, промытые до нейтральной реакции экстракты сушат над сульфатом натрия и концентрируют. Образующееся пенистое вещество желтого цвета очищают экспресс-хроматографией на силикагеле (элюент: н-гексан/этиловый эфир уксусной кислоты в соотношении 95:5) и при необходимости последующей кристаллизацией из метанола/ацетона. Таким путем получают 536 мг твердого продукта светложелтого цвета.tпл=153-158C; []D20=+109 (CHCl3). Б). Z-20-бром-4,5-эпокси-19-норпрегн-17(20)-ен-3-он. 2,09 ммоль (760 мг) Z-20-бром-19-норпрегна-4,17(20)-диен-3-она растворяют в смеси из 7,8 мл метанола и 6,3 мл метиленхлорида и охлаждают до 0 С. Затем к охлажденному раствору последовательно при перемешивании и в атмосфере защитного газа (аргона) добавляют по каплям 4,7 ммоль (0,48 мл) пероксида водорода (30%-ного) и 0,94 ммоль (0,24 мл) едкого натра (с=4 моль/л). По завершении процесса добавления температуру медленно повышают до комнатной. По истечении примерно 1,5 ч, в течение которых продолжается реакция, к смеси добавляют 50 мл воды. При этом образуется 2-фазная система,которую экстрагируют метиленхлоридом. Объединенные, промытые до нейтральной реакции экстракты сушат над сульфатом натрия и концентрируют. Образующийся твердый продукт желтого цвета очищают экспресс-хроматографией на силикагеле (элюент: н-гексан/этиловый эфир уксусной кислоты в соотношении 95:5). В результате получают 680 мг твердого продукта белого цвета. В). Z-20-бpoм-4-xлop-19-норпрегна-4,17(20)-диен-3-он. 2,57 ммоль (975 мг) Z-20-бром-4,5-эпокси-19-норпрегн-17(20)-ен-3-она растворяют в 25 мл ДМП и медленно добавляют по каплям 25,2 ммоль (2,09 мл) соляной кислоты (37%-ной). После 1-часового перемешивания в атмосфере защитного газа (аргона) реакционный раствор сливают на охлажденный льдом водный раствор гидрокарбоната натрия, выпавший осадок отделяют вакуум-фильтрацией и в за-6 006387 вершение сушат в эксикаторе с помощью гидроксида калия. В результате экспресс-хроматографии на силикагеле (элюент: толуен) и последующей перекристаллизации из смеси метанол/ацетон получают 600 мг белых кристаллов.tпл=164-173C; []D20=+138 (CHCl3). Пример 3. Е-17-хлорметилен-4-хлорэстр-4-ен-3-он. А). Е-17-хлорметиленэстр-4-ен-3-он. 18,27 ммоль (5,9 г) 17-хлорметил-17-гидроксиэстр-4-ен-3-она растворяют в 60 мл пиридина. При небольшом охлаждении добавляют по каплям при перемешивании 21,9 ммоль (1,56 мл) тионилхлорида. Затем в атмосфере защитного газа (аргона) перемешивают приблизительно в течение 1 ч, после чего реакционный раствор сливают на охлажденную льдом воду с рН, установленным соляной кислотой на значение 3-4. Клейкий осадок экстрагируют метиленхлоридом, объединенные, промытые до нейтральной реакции экстракты сушат над сульфатом натрия и концентрируют. Образующийся твердый продукт очищают экспресс-хроматографией на силикагеле (элюент: н-гексан/этиловый эфир уксусной кислоты в соотношении 85:15). После перекристаллизации из ацетона получают 1,6 г требуемого продукта.tпл=143-146C; []D20=+20 (CHCl3). Б). Е-17-хлорметилен-4,5-эпоксиэстран-3-он. 3,93 ммоль (1,2 г) Е-17-хлорметиленэстр-4-ен-3-она растворяют в смеси из 12 мл метанола и 10 мл метиленхлорида в атмосфере защитного газа (аргона) и охлаждают до 0 С. К охлажденному раствору при перемешивании последовательно добавляют по каплям 9,2 ммоль (0,94 мл) пероксида водорода(30%-ного) и 1,65 ммоль (0,4 мл) едкого натра (с=4 моль/л). По завершении процесса добавления температуру медленно повышают до комнатной. По истечении примерно 1,5 ч, в течение которых продолжается реакция, смесь сливают на ледяную воду и экстрагируют метиленхлоридом. Объединенные экстракты сушат над сульфатом натрия и концентрируют. Таким путем получают 1,1 г клейкого пенистого вещества белого цвета. В). Е-17-хлорметилен-4-хлорэстр-4-ен-3-он. 3,42 ммоль (1,1 г) Е-17-хлорметилен-4,5-эпоксиэстран-3-она растворяют в 26 мл ДМП и затем медленно добавляют по каплям 33 ммоль (2,74 мл) соляной кислоты (37%-ной). По истечении 1 ч реакционный раствор сливают на охлажденный льдом водный раствор гидрокарбоната натрия, выпавший осадок отделяют вакуум-фильтрацией и сушат в эксикаторе с помощью гидроксида калия. После перекристаллизации из ацетона получают 760 мг белых кристаллов.tпл=182-194C; []D20=+63 (CHCl3). Пример 4. Е-17-бромметилен-4-хлорэстр-4-ен-3-он. А). Е-17-бромметиленэстр-4-ен-3-он. 28,58 ммоль (10,5 г) 17-бромметил-17-гидроксиэстр-4-ен-3-она растворяют в 90 мл пиридина. При небольшом охлаждении по каплям добавляют при перемешивании 37,16 ммоль (2,7 мл) тионилхлорида. Далее приблизительно в течение 1 ч перемешивают в атмосфере защитного газа (аргона), после чего реакционный раствор сливают в охлажденную льдом воду с рН, установленным соляной кислотой на значение 3-4. Выпавший желтый осадок отделяют вакуум-фильтрацией и очищают экспрессхроматографией на силикагеле (элюент: н-гексан/этиловый эфир уксусной кислоты в соотношении 85:15). Таким путем получают 4,85 г твердого вещества желтоватого цвета. После перекристаллизации из ацетона получают 3,1 г белых кристаллов.tпл=153-164C; []D20=+15 (CHCl3). Б). Е-17-бромметилен-4,5-эпоксиэстран-3-он. 2,86 ммоль (1 г) Е-17-бромметиленэстр-4-ен-3-она растворяют в смеси из 10,5 мл метанола и 8,5 мл метиленхлорида в атмосфере защитного газа (аргона) и охлаждают до 0 С. К охлажденному раствору при перемешивании последовательно добавляют по каплям 6,44 ммоль (0,66 мл) пероксида водорода(30%-ного) и 1,26 ммоль (0,32 мл) едкого натра (с=4 моль/л). По завершении процесса добавления температуру медленно понижают до комнатной. По истечении примерно 1,5 ч, в течение которых продолжается реакция, смесь сливают на ледяную воду. При этом образуется двухфазная система, которую экстрагируют метиленхлоридом. Объединенные, промытые до нейтральной реакции экстракты сушат над сульфатом натрия и концентрируют. Таким путем получают 891 мг клейкого пенистого вещества белого цвета. В). Е-17-бромметилен-4-хлорэстр-4-ен-3-он. 2,38 ммоль (приблизительно 870 мг) Е-17-бромметилен-4,5-эпоксиэстран-3-она растворяют в 23 мл ДМП в атмосфере защитного газа (аргона) и медленно добавляют по каплям 23,33 ммоль (1,93 мл) соляной кислоты (37%-ной). По истечении 1 ч реакционный раствор сливают на охлажденный льдом водный раствор гидрокарбоната натрия, выпавший осадок отделяют вакуум-фильтрацией и сушат в эксикаторе с помощью гидроксида калия. В результате экспресс-хроматографии на силикагеле (элюент: толуен/этиловый эфир уксусной кислоты в соотношении 98:2) и последующей перекристаллизации из ацетона получают 552 мг белых кристаллов. в которой R4 представляет собой атом галогена или псевдогалоген,R10 представляет собой атом водорода или прямоцепочечную либо разветвленную С 1-С 4 алкильную группу,R20 и R20a, каждый независимо друг от друга, представляет собой атом водорода, прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу или один из радикалов R20 иR20a обозначает атом водорода, прямоцепочечную либо разветвленную С 1-С 4 алкильную или гидрокси-С 1 С 4 алкильную группу, а другой радикал обозначает атом галогена или псевдогалоген, за исключением 4 хлор-4-адростен-3,17-диона. 2. 17-Метиленстероиды по п.1, отличающиеся тем, что R4 представляет собой атом хлора либо брома или цианогруппу. 3. 17-Метиленстероиды по п.1 или 2, отличающиеся тем, что один из радикалов R20 и R20a представляет собой атом водорода или метильную группу, другой радикал обозначает атом фтора, хлора либо брома, азидо-, циано- либо роданогруппу или гидроксиметил. 4. 17-Метиленстероиды по пп.1, 2 или 3, отличающиеся тем, что R10 представляет собой атом водорода или метильную группу. 5. 17-Метиленстероиды по п.1 из группы, включающей 1) Е-17-хлорметилен-4-хлорэстр-4-ен-3-он,2) Е-17-цианометилен-4-хлорэстр-4-ен-3-он,3) 2-17-цианометилен-4-хлорэстр-4-ен-3-он,4) Z-17-(1')-цианоэтилиден-4-хлорэстр-4-ен-3-он,5) Z-17-этилиден-4-хлорэстр-4-ен-3-он,6) Е-17-этилиден-4-хлорэстр-4-ен-3-он,7) Е-17-бромметилен-4-хлорэстр-4-ен-3-он,8) Z-17-хлорэтилиден-4-хлорэстр-4-ен-3-он,9) Z-17-бромэтилиден-4-хлорэстр-4-ен-3-он,10) Е-17-хлорметилен-4-цианоандрост-4-ен-3-он,11) Е-17-хлорметилен-4-хлорандрост-4-ен-3-он,12) Е-17-(2')-гидроксиэтилиден-4-хлорэстр-4-ен-3-он и 13) Z-17-(2')-гидроксиэтилиден-4-хлорэстр-4-ен-3-он. 6. Способ получения 17-метиленстероидов по п.1, где R20 а обозначает атом водорода, отличающийся тем, что соединение общей формулы II в апротонном растворителе подвергают взаимодействию с хлорангидридом кислоты с образованием 17 метиленстероида общей формулы III далее с помощью H2O2/NaOH образуют 4,5-эпоксид, из которого затем за счет размыкания кольца нуклеофильным реагентом - производным атома галогена, соответственно псевдогалогена - в диполярном апротонном растворителе образуют галоген-, соответственно псевдогалогенгидрин и этот гидрин при определенных условиях взаимодействием с минеральной кислотой, карбоновой кислотой или сульфоновой кислотой в протонном либо апротонном растворителе, путем дегидратации превращают в соедине-8 006387 ние общей формулы IV в которой R4 представляет собой атом галогена или псевдогалоген, при этом R10 имеет значения,указанные в п.1, a R20 обозначает С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу, атом галогена или псевдогалоген. 7. Способ получения 17-метиленстероидов по п.1, отличающийся тем, что соединение общей формулы V подвергают взаимодействию с хлорангидридом кислоты в апротонном растворителе с образованием в результате метиленстероида общей формулы VI далее с помощью Н 2 О 2/NаОН образуют 4,5-эпоксид, из которого затем за счет размыкания кольца нуклеофильным реагентом - производным атома галогена, соответственно псевдогалогена - в диполярном апротонном растворителе образуют галоген-, соответственно псевдогалогенгидрин, и этот гидрин при определенных условиях взаимодействием с минеральной кислотой, карбоновой кислотой или сульфоновой кислотой в протонном либо апротонном растворителе, путем дегидратации превращают в соединение общей формулы VII в которой R4 представляет собой атом галогена или псевдогалоген, при этом R10 имеет значения,указанные в п.1, a R20 обозначает С 1-С 4 алкильную или гидрокси-С 1-С 4 алкильную группу и R20a обозначает атом водорода, атом галогена или псевдогалоген. 8. Фармацевтические композиции, содержащие в своем составе по меньшей мере один 17 метиленстероид по пп.1, 2, 3, 4 или 5, при необходимости вместе с фармацевтически приемлемыми вспомогательными веществами и носителями. 9. 17-Метиленстероиды по любому из пп.1-5 для применения в качестве терапевтических активных веществ. 10. Применение соединений по любому из пп.1-5 для лечения заболеваний предстательной железы,алопеции мужского типа, угрей и гирсутизма, а также для мужской и женской контрацепции и/или для ингибирования 5-редуктазы.
МПК / Метки
МПК: A61K 31/56, A61P 5/28, C07J 13/00
Метки: получения, 4-галогенированные, соединения, композиции, фармацевтические, способ, эти, содержащие, 17-метиленстероиды
Код ссылки
<a href="https://eas.patents.su/10-6387-4-galogenirovannye-17-metilensteroidy-sposob-ih-polucheniya-i-soderzhashhie-eti-soedineniya-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">4-галогенированные 17-метиленстероиды, способ их получения и содержащие эти соединения фармацевтические композиции</a>
Предыдущий патент: Фармацевтические композиции эстрогенных агентов
Следующий патент: Сложные эфиры апорфина и их применение в терапии
Случайный патент: Способ и устройство для цифровой обработки текстильного материала












