Новые производные дифенилмочевины, способ их получения и содержащие их фармацевтические композиции
Номер патента: 5128
Опубликовано: 30.12.2004
Авторы: Миллан Марк, Лавилль Жильбер, Брокко Морисетт, Декен Анн, Мюллер Оливье
Формула / Реферат
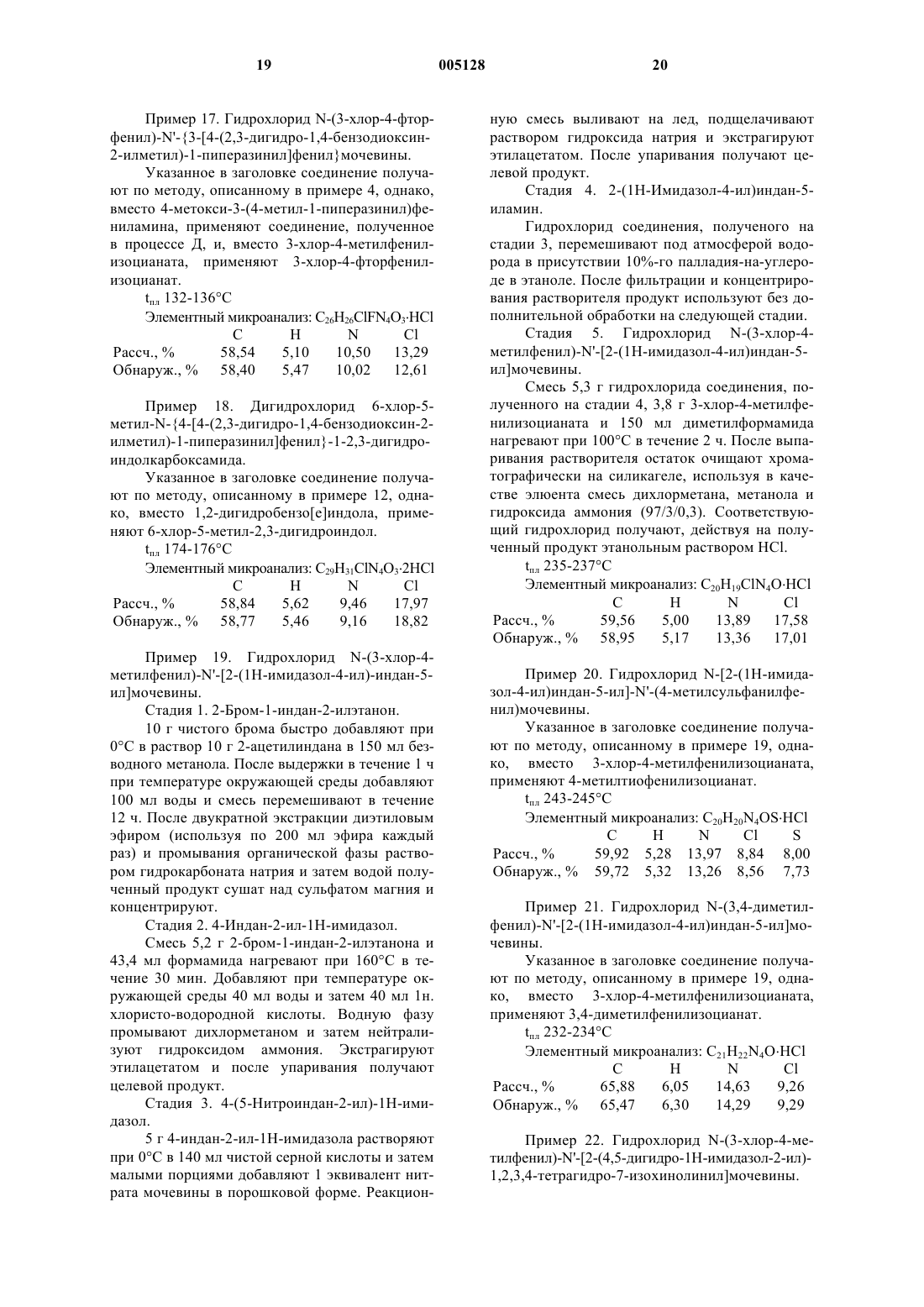
1. Соединения формулы (I)
где R1, R2, R3 и R4 независимо друг от друга обозначают атом водорода, атом галогена или алкил, алкокси-, гидрокси-, алкилтио-, меркапто-, циано-, аминогруппу (необязательно замещенную одной или двумя алкильными группами), нитро-, карбоксигруппу, алкоксикарбонил, аминокарбонил (необязательно замещенный одной или двумя алкильными группами) или карбамоил,
или два из этих радикалов вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо или ароматический гетероцикл, имеющий 5-7 кольцевых членов и содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
L1 и L2, каждый обозначает атом водорода, или указанные радикалы вместе образуют группу -CH2-CH2-,
X1, присоединенный в положении 2 или 3 ароматического кольца, обозначает связь, в этом случае X2 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами), или
X1 и X2, вместе с двумя соседними атомами углерода, к которым они присоединены в положении 2, 3 или 4 ароматического кольца, образуют C4-C7циклоалкильную группу, где одна или две группы -CH2-циклоалкильного кольца необязательно замещены атомом кислорода или группой NH (необязательно замещенной алкильной группой) и где один из атомов углерода циклоалкильного кольца замещен группой G,
X3 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами),
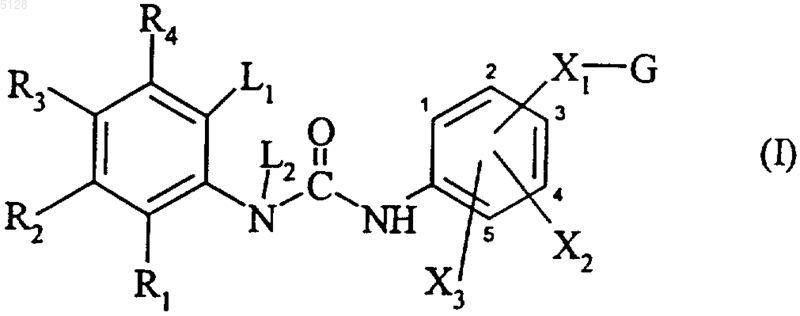
G обозначает группу, выбранную из
где штриховые линии обозначают необязательно присутствующую двойную связь,
Alk обозначает линейную или разветвленную C1-C6алкиленовую группу, если G1 или G2 содержит имидазолиновую группу, при этом группа Alk присоединена в положении 2 кольца,
n равно 0 или 1,
T3 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,
T4 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,
при этом
понятие "алкил" обозначает линейную или разветвленную группу, содержащую от 1 до 6 атомов углерода,
понятие "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода,
понятие "арил" обозначает фенил, нафтил или бифенил,
понятие "гетероарил" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, при этом каждая группа содержит от 5 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,
выражение "необязательно замещенный" применительно к арилу, арилалкилу, гетероарилу и гетероарилалкилу обозначает, что эти группы являются незамещенными или замещены в циклическом фрагменте одним или несколькими атомами галогена и/или алкилом, алкокси-, гидрокси-, меркапто-, алкилтио-, циано-, аминогруппой (необязательно замещенной одной или двумя алкильными группами), нитро-, карбоксигруппой, алкоксикарбонилом, аминокарбонилом (необязательно замещенным одной или двумя алкильными группами) или карбамоилом, при этом гетероарил и гетероарилалкил могут быть дополнительно замещены оксогруппой,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
2. Соединения формулы (I) по п.1, где L1 и L2, каждый обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
3. Соединения формулы (I) по п.1, где L1 и L2 вместе образуют группу -CH2-CH2-, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
4. Соединения формулы (I) по п.1, где R1 и R4, каждый обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
5. Соединения формулы (I) по п.1, где R2 и R3 выбирают из атома галогена и алкила, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
6. Соединения формулы (I) по п.1, где X1 присоединен в положении 2 фенильного кольца, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
7. Соединения формулы (I) по п.1, где X1 обозначает связь и X2 обозначает атом галогена, или алкил, или алкоксигруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
8. Соединения формулы (I) по п.1, где X3 обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
9. Соединения формулы (I) по п.1, где R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо и L1 и L2 вместе образуют группу -CH2-CH2-, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
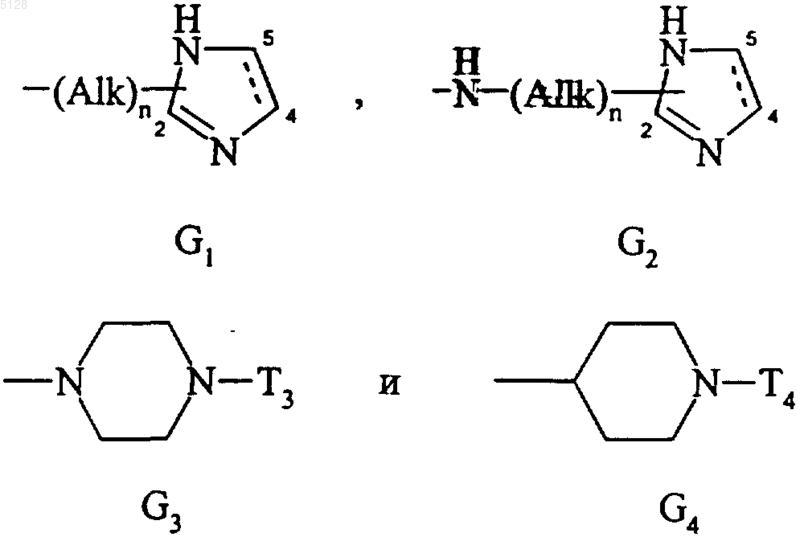
10. Соединения формулы (I) по п.1, где G выбирают из ряда, включающего группы
где T'3 более предпочтительно обозначает необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
11. Соединения формулы (I) по п.1, где X1 и X2 вместе с двумя атомами углерода в положениях 2 и 3 ароматического кольца, к которым они присоединены, образуют C4-C7циклоалкильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
12. Соединение формулы (I), представляющее собой N-(3-хлор-4-метилфенил)-N'-{3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил}мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
13. Соединение формулы (I), представляющее собой N-[4-хлор-3-(4,5-дигидро-1H-имидазол-2-иламино)фенил]-N'-(3-хлор-4-метилфенил)мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
14. Соединение формулы (I), представляющее собой N-(3-хлор-4-метилфенил)-N'-[2-(1H-имидазол-4-ил)индан-5-ил]мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
15. Соединение формулы (I), представляющее собой N-{3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил}-N'-(3,4-диметилфенил)мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используется ароматический амин формулы (II)
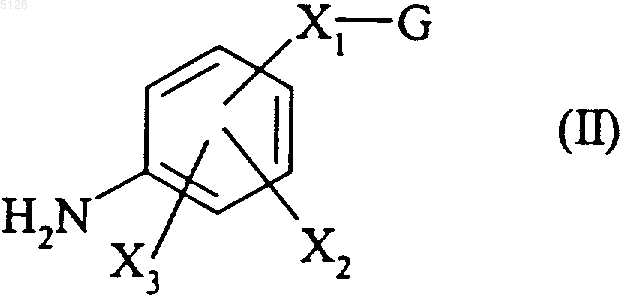
где X1, X2, X3 ш G имеют значения, указанные для формулы (I),
который конденсируют путем нагревания в щелочной среде с соединением формулы (III)
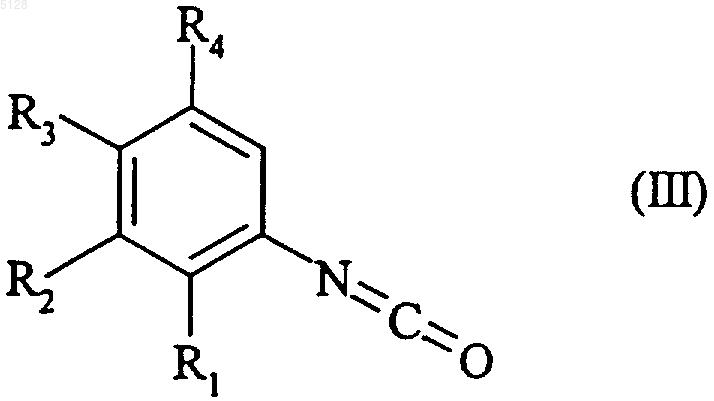
где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),
с получением соединения формулы (I/a)
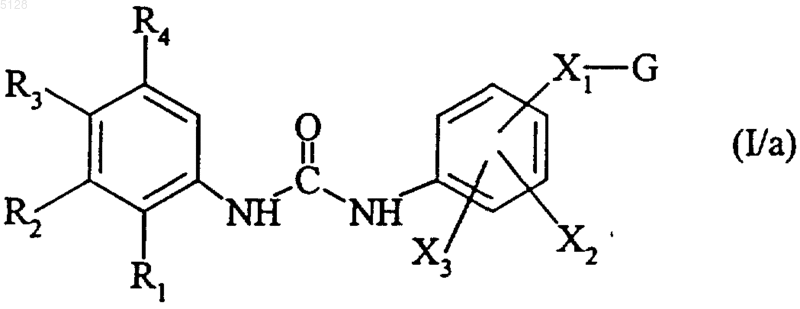
представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, X1, X2, X3 и G имеют указанные выше значения,
причем изоцианат формулы (III) либо имеется в продаже, либо может быть получен согласно известным методам,
при этом соединения формулы (I/a) при необходимости могут быть очищены с использованием общепринятых методов очистки, необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения, при необходимости могут быть превращены в аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используется амин формулы (IV)

где L1, L2, R1, R2, R3 и R4 имеют значения, указанные для формулы (I),
который конденсируют путем нагреванияв щелочной среде с соединением формулы (V)
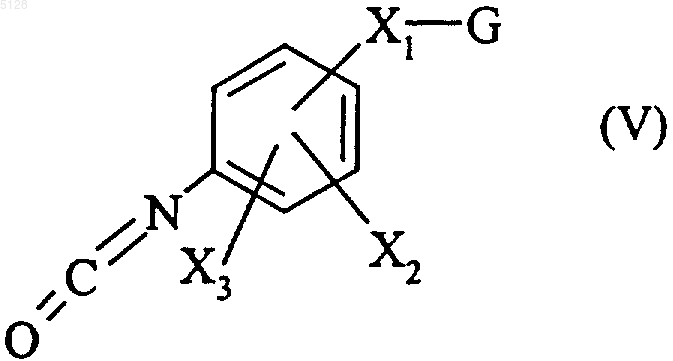
где X1, X2, X3 и G имеют значения, указанные для формулы (I),
с получением соединения формулы (I/b)
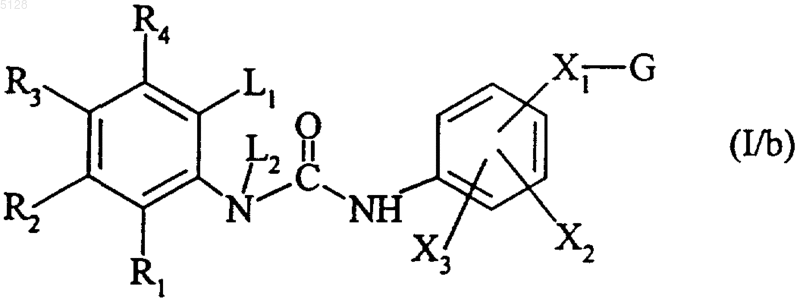
представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, L1, L2, X1, X2, X3 и G имеют указанные выше значения,
причем изоцианат формулы (V) либо имеется в продаже, либо может быть получен согласно известным методам,
при этом соединения формулы (I/b) при необходимости могут быть очищены с использованием общепринятых методов очистки, необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения, при необходимости могут быть превращены в аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используют амин формулы (VI)
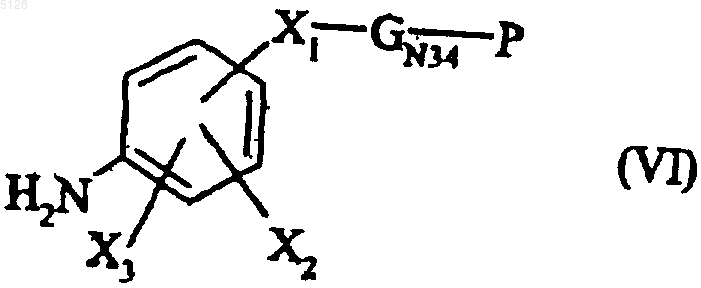
где X1, X2 и X3 имеют значения, указанные для формулы (I), GN34 обозначает группу NH и P обозначает атом водорода или группу, защищающую аминную функцию,
который конденсируют путем нагревания в щелочной среде с соединением формулы (III)
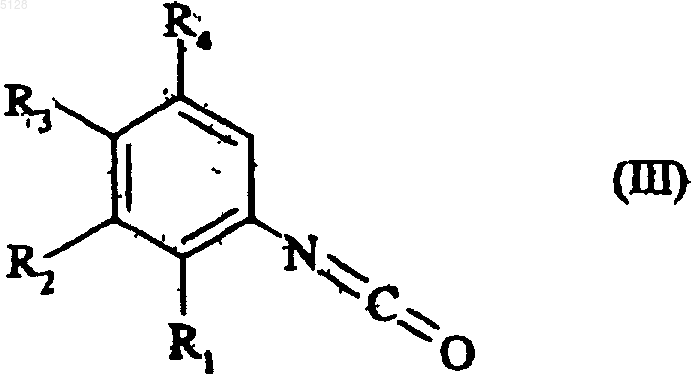
где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),
с получением соединения формулы (VII)
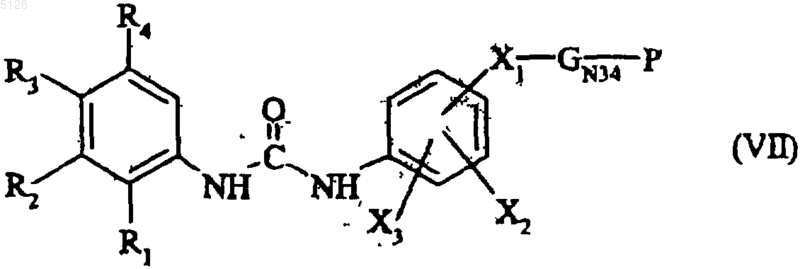
где R1, R2, R3, R4, X1, X2, X3, GN34 и P имеют указанные выше значения,
полученное соединение формулы (VII), после удаления в случае необходимости защитной группы, конденсируют с тиофосгеном с получением соединения формулы (VIII)
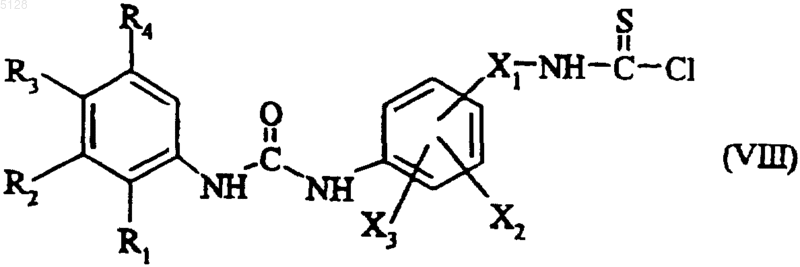
где R1, R2, R3, R4, X1, X2 и X3 имеют указанные выше значения,
которое подвергают взаимодействию с этилендиамином, получая соединение формулы (IX)
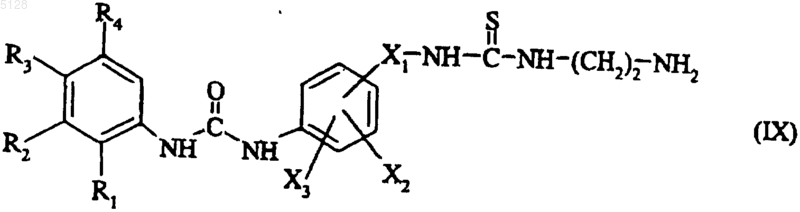
где R1, R2, R3, R4, X1, X2 и X3 имеют указанные выше значения,
указанное соединение формулы (IX) подвергают реакции внутримолекулярной циклизации, катализируемой палладиевым соединением, с получением соединения формулы (I/d)
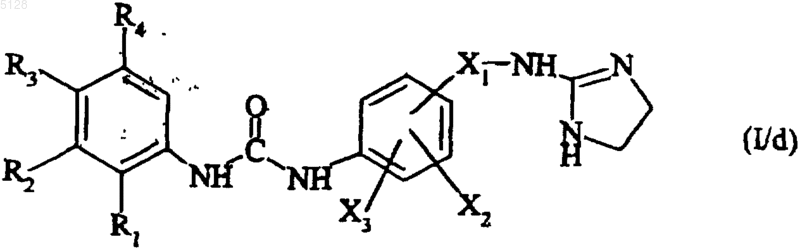
представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, X1, X2 и X3 имеют указанные выше значения,
при этом указанное соединение формулы (I/d) при необходимости очищают с использованием общепринятых методов очистки, необязательно разделяют на изомеры с использованием общепринятых методов разделения, при необходимости превращают в аддитивные соли с фармацевтически приемлемыми кислотой или основанием.
19. Фармацевтические композиции, содержащие в качестве действующего вещества по крайней мере одно соединение по любому из пп.1-15, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями.
20. Фармацевтические композиции по п.19, содержащие по крайней мере одно действующее вещество по любому из пп.1-15, предназначенные для приготовления лекарственных средств, применяемых в качестве двойных антагонистов a2/5-HT2c-рецепторов для лечения депрессии, состояния страха, шизофрении, болезни Паркинсона, когнитивных болезней, расстройств либидо, сексуальных дисфункций, нарушений сна, злоупотребления лекарствами и нарушений импульсивного поведения.
Текст
1 Настоящее изобретение относится к новым производным дифенилмочевины, способу их получения и к содержащим их фармацевтическим композициям. Изобретение также относится к их применению в качестве смешанных (двойных) лигандов 2/5-НТ 2c-рецепторов. Соединения, включающие структуру дифенилмочевины, были описаны в заявке JP11130750 в качестве серотонинергических антагонистов, а в заявке WO 99/32436 описано их применение в качестве ингибиторов raf-киназы. Лобная доля полушария головного мозга играет важную роль в процессах, контролирующих функции, нарушаемые при психических заболеваниях. В частности, в настоящее время установлено, что нарушение моноаминергической передачи существенно влияет на этиологию различных болезней этого типа. Например, в случае депрессии моноаминергическая активность уменьшается в кортиколимбических областях. Установлено, что среди различных моноаминных ауто- и гетерорецепторов, участвующих в регуляторных механизмах, наиболее важными являются 2-А.Р. (ауторецепторы)- и 5 НТ 2c-рецепторы. Эти два подтипа рецепторов действуют одинаковым образом, ингибируя допаминергическую и адренергическую передачу. С одной стороны, 2-А.Р.-рецепторы оказывают обратное действие на норадренергические нейроны (J. Pharmacol. Exp. Ther., 270, 958, 1994), а с другой стороны, 5-НТ 2c-рецепторы оказывают ингибирующее воздействие на допаминергическую и норадренергическую передачу (Neuropharmacology, 36, 609, 1997). Ранее было установлено, что соединения,связывающие первый или второй из этих подтипов рецепторов, могут применяться для лечения различных патологий. Например, положительное воздействие соединений, являющихся антагонистами 2-рецепторов, было изучено при лечении когнитивных болезней (J. Pharmacol., 6, 376, 1992), болезни Паркинсона (CBS Drugs, 10, 189, 1998), расстройств либидо и сексуальных дисфункций (J.Pharmacol., 11, 72, 1997). Аналогично этому, было установлено, что антагонисты 5-НТ 2c-рецепторов могут применяться при лечении сексуальных дисфункций (см. J. Pharmacol., там же), болезни Паркинсона (Drug News Perspect., 12, 477,1999), а также состояния страха (Br. J. Pharmacol.,117. 427, 1996) и шизофрении (Neurosci. Lett.,181, 65, 1996). Соединения, обладающие двойной антагонистической активностью как в отношении 2 А.Р.-, так и 5-НТ 2c-рецепторов, могут иметь большое значение для клиницистов, поскольку позволяют достичь при введении одного соединения существенно более высокой активности в отношении восстановления нейротрансмиссии 2 благодаря синергетическому действию. Кроме того, такое соединение обладает значительным преимуществом при введении по сравнению с введением двух различных продуктов. Соединения по изобретению имеют новую структуру, придающую им двойную 2/5-НТ 2cантагонистическую активность, и вследствие этого они могут применяться при лечении депрессии, состояния страха, шизофрении, болезни Паркинсона, когнитивных болезней, расстройств либидо и сексуальных дисфункций,нарушений сна, злоупотребления лекарствами и нарушений импульсивного поведения. Настоящее изобретение относится к соединениям формулы (I) где R1, R2, R3 и R4 независимо друг от друга обозначают атом водорода, атом галогена или алкил, алкокси-, гидрокси-, алкилтио-, меркапто-, циано-, аминогруппу (необязательно замещенную одной или двумя алкильными группами), нитро-, карбоксигруппу, алкоксикарбонил,аминокарбонил (необязательно замещенный одной или двумя алкильными группами) или карбамоил,или два из этих радикалов вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо или ароматический гетероцикл, имеющий 5-7 кольцевых членов и содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,L1 и L2, каждый обозначает атом водорода,или указанные радикалы вместе образуют группу -СН 2-СН 2-,Х 1, присоединенный в положении 2 или 3 ароматического кольца, обозначает связь, в этом случае Х 2 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами), или Х 1 и Х 2, вместе с двумя соседними атомами углерода, к которым они присоединены в положении 2, 3 или 4 ароматического кольца,образуют С 4-С 7 циклоалкильную группу, где одна или две группы -СН 2-циклоалкильного кольца необязательно замещены атомом кислорода или группой NH (необязательно замещенной алкильной группой) и где один из атомов углерода циклоалкильного кольца замещен группой G,Х 3 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами), 3 где штриховые линии обозначают необязательно присутствующую двойную связь,Alk обозначает линейную или разветвленную С 1-С 6 алкиленовую группу, если G1 или G2 содержит имидазолиновую группу, при этом группа Alk присоединена в положении 2 кольца,n равно 0 или 1,Т 3 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,Т 4 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,при этом понятие "алкил" обозначает линейную или разветвленную группу, содержащую от 1 до 6 атомов углерода,понятие "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода,понятие "арил" обозначает фенил, нафтил или бифенил,понятие "гетероарил" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, при этом каждая группа содержит от 5 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,выражение "необязательно замещенный" применительно к арилу, арилалкилу, гетероарилу и гетероарилалкилу обозначает, что эти группы являются незамещенными или замещены в циклическом фрагменте одним или несколькими атомами галогена и/или алкилом,алкокси-, гидрокси-, меркапто-, алкилтио-, циано-, аминогруппой (необязательно замещенной одной или двумя алкильными группами), нитро-,карбоксигруппой, алкоксикарбонилом, аминокарбонилом (необязательно замещенным одной или двумя алкильными группами) или карбамоилом, при этом гетероарил и гетероарилалкил могут быть дополнительно замещены оксогруппой, 005128 4 к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемыми кислотой или основанием. Среди фармацевтически приемлемых кислот следует отметить соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту,лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований следует отметить гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. В предпочтительных соединениях формулы(I) R1 и R4, каждый обозначает атом водорода. В соединениях формулы (I) R2 и R3 предпочтительно выбирают из атома галогена и алкила. В предпочтительном варианте осуществления изобретение относится к соединениям формулы (I), где Х 1 присоединен в положении 2 фенильного кольца. В другом предпочтительном варианте осуществления изобретение относится к соединениям формулы (I), где L1 и L2 вместе образуют группу -СН 2-СН 2-, R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо. Предпочтительными соединениями по изобретению являются соединения, в которых Х 1 обозначает связь и Х 2 обозначает атом галогена, или алкил, или алкоксигруппу. В другом предпочтительном варианте осуществления изобретение относится к соединениям формулы (I), где X3 обозначает атом водорода. В предпочтительных соединениях формулы (I) G предпочтительно выбирают из ряда,включающего группы где Т'3 более предпочтительно обозначает необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил. Другая предпочтительная группа соединений формулы (I) включает соединения, где Х 1 и Х 2 вместе с 2 атомами углерода в положениях 2 и 3 ароматического кольца, к которым они присоединены, образуют C4-С 7 циклоалкильную группу, например циклопентильную группу. Предпочтительной арильной группой по изобретению является фенильная группа. Среди предпочтительных соединений по изобретению следует особо отметить следующие соединения:N-[4-хлор-3-(4,5-дигидро-1 Н-имидазол-2-иламино)фенил]-N'-(3-xлop-4-метилфенил)мочевину,N-(3-хлор-4-метилфенил)-N'-[2-(1 Н-имидазол-4-ил)индан-5-ил]мочевину,N-3-[4-(2,3-дигидро-1,4-бензодиоксин-2 илметил)-1-пиперазинил]фенил-N'-(3,4-диметилфенил)мочевину. Под объем изобретения также подпадает способ получения соединений формулы (I). Один из вариантов способа получения соединений формулы (I) отличается тем, что в нем в качестве исходного продукта используется ароматический амин формулы (II) где X1, Х 2, Х 3 и G имеют значения, указанные для формулы (I),который конденсируют путем нагревания в щелочной среде с соединением формулы (III) где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (I/a) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, Х 1,Х 2, Х 3 и G имеют указанные выше значения,причем изоцианат формулы (III) либо имеется в продаже, либо может быть получен согласно известным методам, например из соответствующей карбоновой кислоты путем взаимодействия с азидом натрия и перегруппировки полученного ацилазида,при этом соединения формулы (I/a) при необходимости, могут быть очищены с использованием общепринятых методов очистки,необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения,при необходимости, могут быть превращены в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Другой вариант способа получения соединений формулы (I) отличается тем, что в нем в качестве исходного продукта используется амин формулы (IV) где L1, L2, R1, R2, R3 и R4 имеют значения, указанные для формулы (I),который конденсируют путем нагревания в щелочной среде с соединением формулы (V) где Х 1, Х 2, Х 3 и G имеют значения, указанные для формулы (I),с получением соединения формулы (I/b) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, L1,L2, X1, X2, X3 и G имеют указанные выше значения,причем изоцианат формулы (V) либо имеется в продаже, либо может быть получен согласно известным методам, например из соответствующей карбоновой кислоты путем взаимодействия с азидом натрия и перегруппировки полученного ацилазида,при этом соединения формулы (I/b) при необходимости, могут быть очищены с использованием общепринятых методов очистки,необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения,при необходимости, могут быть превращены в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Еще один вариант способа получения соединений формулы (I) отличается тем, что в нем в качестве исходного продукта используется амин формулы (VI) где Х 1, Х 2 и X3 имеют значения, указанные для формулы (I), GN34 обозначает группу NH или 1 пиперазинил или 4-пиперидинил и Р обозначает атом водорода или группу, защищающую аминофункцию,который конденсируют путем нагревания в щелочной среде с соединением формулы (III) где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (VII) где R1, R2, R3, R4, X1, Х 2, Х 3, GN34 и Р имеют указанные выше значения,с соединением формулы (VII),указанное соединение формулы (VII),если GN34 обозначает 1-пиперазинил или 4 пиперидинил, при необходимости, после удаления защитной группы аминной функции подвергают реакции замещения в щелочной среде с получением соединения формулы (I/с) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, Х 1,Х 2 и Х 3 имеют указанные выше значения и G34 обозначает группу G3 или G4, как они определены для соединений формулы (I), или если GN34 обозначает группу NH, при необходимости, после удаления защитной группы конденсируют с тиофосгеном с получением соединения формулы (VIII) где R1, R2, R3, R4, X1, X2 и Х 3 имеют указанные выше значения,которое подвергают взаимодействию с этилендиамином, получая соединение формулы где R1, R2, R3, R4, Х 1, Х 2 и X3 имеют указанные выше значения,указанное соединение формулы (IX) подвергают реакции внутримолекулярной циклизации, катализируемой палладиевым соединением, с получением соединения формулы (I/d) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, X1,X2 и X3 имеют указанные выше значения,при этом указанные соединения формул(I/с) и (I/d) при необходимости, могут быть очищены с использованием общепринятых методов очистки,необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения,при необходимости, могут быть превращены в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве действующего вещества по крайней мере одно соединение формулы (I) индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями. Среди фармацевтических композиций по изобретению следует особо отметить композиции, которые пригодны для перорального, парентерального, назального или трансдермального введения, такие как таблетки или драже, сублингвальные таблетки, желатиновые капсулы,пастилки, суппозитории, кремы, мази, кожные гели и т.д. Пригодная доза варьируется в зависимости от возраста и веса пациента, природы и серьезности заболевания и пути введения, который может представлять собой пероральный, назальный, ректальный или парентеральный путь введения. В норме стандартная доза варьируется от 0,05 до 500 мг на одну обработку при 1-3 кратном введении в течение 24 ч. Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Структуры описанных соединений были определены с помощью обычных спектроскопических методов. Исходные продукты представляют собой известные продукты или они могут быть получены согласно известным методам. Процесс получения А. 3-(4,5-Дигидро-1 Нимидазол-2-илметил)анилин. Стадия 1. Гидрохлорид 2-(3-нитробензил)4,5-дигидро-1 Н-имидазола. Смесь 30,7 ммоля (5 г) 3-нитрофенилацетонитрила и 30 ммолей (7,2 г) этилендиаминпаратолуолсульфоната нагревают при 100 С в течение 1 ч. После охлаждения до 20 С смесь гидролизуют с помощью 100 мл 5 М водного раствора гидроксида натрия и затем экстрагируют дихлорметаном. Органические фазы сушат над сульфатом магния и концентрируют. Полу 9 ченный остаток превращают в гидрохлорид,действуя на него этанольным раствором НСl, с получением целевого продукта. Стадия 2. 3-(4,5-Дигидро-1 Н-имидазол-2 илметил)анилин. Раствор 22,7 ммоля (5,5 г) продукта, полученного на предыдущей стадии, в смеси 100 мл этанола и 10 мл воды перемешивают под атмосферой водорода в присутствии 0,5 г 10%-ного палладия-на-углероде. После прекращения поглощения водорода реакционную смесь фильтруют и концентрируют с получением целевого продукта. Процесс получения Б. 3-[1-(4,5-Дигидро 1 Н-имидазол-2-ил)этил]анилин. Стадия 1. 2-(3-Нитрофенил)пропаннитрил. Смесь 62 ммолей (10 г) 3-нитрофенилацетонитрила, 1,11 моля (100 г) диметилкарбоната и 3,1 ммоля (0,43 г) карбоната калия нагревают в течение 6 ч при 170 С в автоклаве. После охлаждения добавляют 200 мл дихлорметана и промывают органическую фазу с помощью 100 мл воды, а затем с помощью 100 мл насыщенного водного раствора хлорида натрия. Органическую фазу сушат над сульфатом магния и концентрируют. Полученный остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь циклогексана и этилацетата (90/10), с получением целевого продукта. Стадия 2. 2-[1-(3-Нитрофенил)этил]-4,5 дигидро-1H-имидазол. Указанное в заголовке соединение получают аналогично процессу А, стадия 1, используя в качестве исходного соединение, полученное на предыдущей стадии. Стадия 3. 3-[1-(4,5-Дигидро-1 Н-имидазол 2-ил)этил]анилин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения В. 3-[1-(4,5-Дигидро 1 Н-имидазол-2-ил)-1-метилэтил]анилин. Стадия 1. 2-Метил-2-(3-нитрофенил)пропаннитрил. В энергично перемешиваемый раствор 123 ммоля (20 г) 3-нитрофенилацетонитрила и 369 ммолей (46,5 г) диметилсульфата в 200 мл диметилсульфоксида добавляют 40 мл 50%-ного раствора гидроксида натрия. После перемешивания в течение 1 ч реакционную смесь разбавляют 2 л воды и дважды экстрагируют 1 л диэтилового эфира. Органические фазы сушат над сульфатом натрия и концентрируют с получением целевого продукта. Стадия 2. 2-[1-Метил-1-(3-нитрофенил) этил]-4,5-дигидро-1 Н-имидазол. Указанное в заголовке соединение получают аналогично процессу А, стадия 1, используя в качестве исходного соединение, полученное на предыдущей стадии. 10 Стадия 3. 3-[1-(4,5-Дигидро-1 Н-имидазол 2-ил)-1-метилэтил]-анилин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения Г. 4-Метил-3-(4-метил 1-пиперазинил)анилин. Стадия 1. 4-(2-Метилфенил)-1-пиперазинкарбальдегид. В раствор 415 ммолей (61,3 г) трихлорацетальдегида в 400 мл дибутилового эфира добавляют при энергичном перемешивании 437 ммолей (77 г) 2-метилфенилпиперазина. Реакционную смесь нагревают при 80 С в течение 1 ч и после охлаждения концентрируют с получением целевого продукта. Стадия 2. 1-Метил-4-(2-метилфенил)пиперазин. В суспензию 568 ммолей (21,6 г) тетрагидроалюмината лития в 300 мл тетрагидрофурана добавляют раствор 437 ммолей (90 г) соединения, полученного на предыдущей стадии, в 400 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 12 ч при 50 С. После охлаждения реакционную смесь гидролизуют с помощью 52,5 мл воды, затем с помощью 48 мл 10%-ного водного раствора гидрокcида натрия и, наконец, с помощью 88,5 мл воды. Образовавшийся осадок отфильтровывают через целит и фильтрат концентрируют. Полученный остаток растворяют в 200 мл воды и экстрагируют 3 раза с помощью 250 мл дихлорметана. Органическую фазу сушат над сульфатом магния и концентрируют с получением целевого продукта. Стадия 3. Гидрохлорид 1-метил-4-(2-метил-5-нитрофенил)пиперазина. В раствор 347 ммолей (100 г) гидросульфата соединения, полученного на предыдущей стадии, в 500 мл концентрированной серной кислоты добавляют 416 ммолей (64 г) нитрата калия в порошковой форме. Перемешивают в течение 5 ч и реакционную смесь выливают на 1200 г льда и затем нейтрализуют твердым карбонатом калия и экстрагируют 3 раза с помощью 500 мл этилацетата. Органические фазы сушат и концентрируют с получением целевого продукта. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl. Стадия 4. 4-Метил-3-(4-метил-1-пиперазинил)анилин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения Д. 3-[4-(2,3-Дигидро 1,4-бензодиоксин-2-илметил)-1-пиперазинил] анилин. Стадия 1. 1-(2,3-Дигидро-1,4-бензодиоксин-2-илметил)-4-(3-нитрофенил)пиперазин. 11 Смесь 54,2 ммоля (10 г) 2-хлорметил-2,3 дигидро-1,4-бензодиоксина, 54,2 ммоля (9,2 г) 3-нитрофенилпиперазина и 6 г гидрокарбоната калия в 100 мл метил-4-пентанона нагревают с обратным холодильником в течение 72 ч. После охлаждения реакционную смесь концентрируют. Остаток растворяют в 200 мл воды и экстрагируют с помощью 200 мл дихлорметана. Органическую фазу сушат над сульфатом магния,концентрируют и очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония (90/1/0,1), с получением целевого продукта. Стадия 2. 3-[4-(2,3-Дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]анилин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения Е. N3-(4,5-Дигидро-1 Нимидазол-2-ил)-4-метил-1,3-бензолдиамин. Стадия 1. Хлорангидрид 2-метил-5-нитрофенилкарбамотиовой кислоты. В раствор 130 ммолей (20 г) 2-метил-5 нитроанилина в 375 мл концентрированной хлористо-водородной кислоты добавляют 2,25 л воды. Затем при температуре 0 С добавляют одной порцией 162 ммоля (19 г) тиофосгена. Реакционную смесь энергично перемешивают в течение 24 ч при температуре окружающей среды. Образовавшийся осадок отфильтровывают и затем растворяют в диэтиловом эфире. Органическую фазу промывают водой, сушат над сульфатом магния и концентрируют с получением целевого продукта. Стадия 2. N-(2-Аминоэтил)-N'-(2-метил-5 нитрофенил)тиомочевина. Раствор 123 ммолей (24 г) соединения, полученного на предыдущей стадии, в 1000 мл толуола нагревают до 60 С. Быстро добавляют 246 ммолей (8,27 мл) этилендиамина и смесь нагревают при 100 С в течение 3 ч. После охлаждения органическую фазу промывают 1 М раствором хлористо-водородной кислоты. Водную фазу подщелачивают концентрированным раствором гидроксида натрия и затем экстрагируют дихлорметаном. Органическую фазу промывают водой, сушат над сульфатом магния, концентрируют и очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония(90/10/1), с получением целевого продукта. Стадия 3. N-(2-Метил-5-нитрофенил)-4,5 дигидро-1 Н-имидазол-2-амин. В раствор 63 ммолей (16,0 г) соединения,полученного на предыдущей стадии, добавляют горячий раствор 38,8 г гидроксида калия в 135 мл воды. Затем, при энергичном перемешивании, при температуре 80 С добавляют горячий раствор 72,5 ммоля (27,2 г) ацетата свинца в 135 мл воды. Через 30 мин реакционную смесь фильтруют через целит и концентрируют. Оста 005128 12 ток растворяют в 100 мл воды и рН доводят до 10. После экстракции дихлорметаном органическую фазу сушат над сульфатом магния и концентрируют с получением целевого продукта. Стадия 4. N3-(4,5-Дигидро-1 Н-имидазол-2 ил)-4-метил-1,3-бензолдиамин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения Ж. N1-(4,5-Дигидро 1 Н-имидазол-2-ил)-1,3-бензолдиамин. Стадия 1. N-(3-Нитрофенил)-4,5-дигидро 1 Н-имидазол-2-амин. Указанное в заголовке соединение получают аналогично процессу E, стадия 2, используя в качестве исходного соединения 3-нитрофенилизоцианат. Стадия 2. N1-(4,5-Дигидро-1H-имидазол-2 ил)-1,3-бензолдиамин. Указанное в заголовке соединение получают аналогично процессу А, стадия 2, используя в качестве исходного соединение, полученное на предыдущей стадии. Процесс получения З. 2-Метокси-5-(4-метил-1-пиперазинил)бензоилазид. В раствор 20 ммолей (5 г) 4-метокси-3-(4 метил-1-пиперазинил)бензойной кислоты (описанной в J. Med. Chem., 1994, 37, стр. 2255) и 50 ммолей (3,25 г) азида натрия в 4,05 мл пиридина добавляют раствор 25 ммолей (5,3 г) фенилдихлорфосфата в 100 мл дихлорметана. После перемешивания в течение 12 ч при температуре окружающей среды органическую фазу промывают в 100 мл воды, сушат над сульфатом магния и концентрируют с получением целевого продукта. Пример 1. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-[3-(4,5-дигидро-1 Н-имидазол-2 илметил)фенил]мочевины. Раствор 4,7 ммоля (1 г) соединения, полученного в процессе А, и 4,7 ммоля (0,79 г) 3 хлор-4-метилфенилизоцианата в 50 мл диметилформамида нагревают в течение 2 ч при 100 С. После охлаждения реакционную смесь концентрируют. Полученный остаток растворяют в 200 мл дихлорметана и полученный осадок отфильтровывают и очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и аммиака (90/10/1), с получением целевого продукта. Соответствующий гидрохлорид получают,действуя на полученный продукт этанольным раствором НСl. 13 Пример 2. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[1-(4,5-дигидро-1 Н-имидазол 2-ил)этил]фенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 1, однако,вместо соединения, полученного в процессе А,применяют соединение, полученное в процессе Б.N Сl Рассч., % 58,02 5,64 14,24 9,01 Обнаруж., % 58,07 5,95 13,55 8,91 Пример 3. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[1-(4,5-дигидро-1 Н-имидазол 2-ил)-1-метилэтил]фенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 1, однако,вместо соединения, полученного в процессе А,применяют соединение, полученное в процессе В.(2,26 г) 3-хлор-4-метилфенилизоцианата в 100 мл толуола нагревают с обратным холодильником в течение 2 ч. После охлаждения полученный осадок отфильтровывают и промывают дважды диэтиловым эфиром. Полученное твердое вещество очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония(96/4/0,4), с получением целевого продукта. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 55,29 6,10 12,90 18,36 Обнаруж., % 55,59 6,14 12,70 18,31 Пример 5. Гидрохлорид N-(3-хлор-4-метилфенил)-N'-[4-метил-3-(4-метил-1-пиперазинил)фенил]мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 4, однако,вместо 4-метокси-3-(4-метил-1-пиперазинил)фениламина, применяют соединение, полученное в процессе Г. 14 Пример 6. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 4, однако,вместо 4-метокси-3-(4-метил-1-пиперазинил)фениламина, применяют соединение, полученное в процессе Д.N Сl Рассч., % 57,30 5,53 9,90 18,79 Обнаруж., % 57,36 5,55 9,63 18,85 Пример 7. Гидрохлорид N-(3-хлор-4-метилфенил)-N'-[3-(4,5-дигидро-1 Н-имидазол-2 иламино)-4-метилфенил]мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 1, однако,вместо соединения, полученного в процессе А,применяют соединение, полученное в процессе Е.N Сl Рассч., % 54,83 5,37 17,76 8,99 Обнаруж., % 54,91 5,25 17,78 9,12 Пример 8. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-[3-(4,5-дигидро-1 Н-имидазол-2 иламино)фенил]мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 1, однако,вместо соединения, полученного в процессе А,применяют соединение, полученное в процессе Ж.N Сl Рассч., % 53,01 5,10 18,14 10,38 Обнаруж., % 53,18 5,02 18,25 10,16 Пример 9. Гидрохлорид N-[4-хлор-3-(4,5 дигидро-1 Н-имидазол-2-иламино)фенил]-N'-(3 хлор-4-метилфенил)мочевины. Стадия а. N-(3-Хлор-4-метилфенил)-N'-(4 хлор-3-нитрофенил]мочевина. Раствор 29,8 ммоля (5 г) 3-хлор-4-метилфенилизоцианата в 90 мл толуола нагревают до 70 С и прибавляют к нему 29,8 ммоля (5,15 г) 4 хлор-3-нитроанилина. Полученный раствор нагревают с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают льдом и образовавшийся осадок отфильтровывают и затем промывают диэтиловым эфиром с получением целевого продукта. Стадия б. N-(3-Амино-4-хлорфенил)-N'-(3 хлор-4-метилфенил)мочевина. Раствор 22,2 ммоля (7,5 г) соединения, полученного на предыдущей стадии, в 80 мл смеси метанола и тетрагидрофурана нагревают до 45 С в присутствии никеля Ренея. Регулируя температуру, добавляют 33,3 ммоля (1,61 мл) гидразин 15 гидрата. Температуру поддерживают при 45 С в течение 30 мин и затем добавляют еще 33,3 ммоля (1,61 мл) гидразингидрата. Смесь перемешивают при температуре дефлегмации в течение 30 мин. После охлаждения катализатор отфильтровывают и фильтрат концентрируют. Полученный остаток растворяют в диэтиловом эфире и промывают с получением целевого продукта. Стадия в. Хлорангидрид 2-хлор-5-[(3 хлор-4-метиланилин)карбонил]аминофенилкарбамотиовой кислоты. В суспензию 3,2 ммоля (0,32 г) карбоната кальция в смеси 15 мл дихлорметана и 2,2 мл воды прибавляют при 5 С 3,2 ммоля (0,25 мл) тиофосгена. Затем при указанной температуре добавляют 3,2 ммоля (1 г) растворенного в дихлорметане соединения, полученного на предыдущей стадии. После добавления 4,25 ммоля(0,36 г) гидрокарбоната натрия реакционную смесь перемешивают в течение 15 мин при температуре окружающей среды. После фильтрации через целит фильтрат декантируют и органическую фазу промывают водой и затем насыщенным водным раствором хлорида натрия. После сушки над сульфатом магния и фильтрации фильтрат концентрируют. Полученный остаток растворяют в диэтиловом эфире и промывают с получением целевого продукта. Стадия г. N-[3-([(2-Аминоэтил)амино] карботиоиламино)-4-хлорфенил]-N'-(3-хлор-4 метилфенил)мочевина. 4,4 ммоля (0,27 мл) этилендиамина быстро добавляют в нагретый до 60 С раствор 2,2 ммоля (0,78 г) соединения, полученного на предыдущей стадии, в 35 мл толуола. Реакционную смесь нагревают при 100 С в течение 3 ч. После охлаждения органическую фазу промывают 1 н. раствором хлористо-водородной кислоты (10 мл). Водную фазу подщелачивают концентрированным раствором гидроксида натрия и затем экстрагируют дихлорметаном. Органическую фазу промывают водой, сушат над сульфатом магния,фильтруют и концентрируют. Полученный остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония(90/10/1), с получением целевого продукта. Стадия д. N-[4-Xлор-3-(4,5-дигидро-1 Нимидазол-2-иламино)фенил]-N'-(3-хлор-4-метилфенил)мочевина. В раствор 1,5 ммоля (0,63 г) соединения,полученного на предыдущей стадии, в 10 мл этанола при 50 С добавляют горячий раствор 16,5 ммоля (1,5 г) гидроксида калия в 5,5 мл воды. При энергичном перемешивании при 80 С добавляют горячий раствор 1,72 ммоля(1,1 г) ацетата свинца в 5,5 мл воды. Через 30 мин смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в 5 мл воды, доводят рН до 10 и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, концентрируют и очищают хрома 005128 16 тографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония (90/10/1), с получением целевого продукта. Соответствющий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 49,23 4,37 16,89 25,65 Обнаруж., % 48,82 4,47 16,62 25,44 Пример 10. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]-4-метоксифенил мочевины. Стадия а. трет-Бутанолат 4-(5-[(3-хлор-4 метиланилин)карбонил]амино-2-метоксифенил)-1-пиперазинкарбоновой кислоты. Раствор 34,4 ммоля (10 г) трет-бутанолата 4-(5-амино-2-метоксифенил)пиперазин-1-карбоновой кислоты (описан в J. Med. Chem., 1999,стр. 202) и 37,8 ммоля (5,9 г) 3-хлор-4-метилфенилизоцианата в 150 мл толуола нагревают с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют и остаток растворяют в 200 мл 4 н. хлористо-водородной кислоты и затем нагревают с обратным холодильником в течение 4 ч. После охлаждения образовавшийся осадок отфильтровывают и обрабатывают 2 н. раствором гидроксида натрия для регенерации соответствующего основания. Стадия б. N-(3-Хлор-4-метилфенил)-N'-3[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1 пиперазинил]-4-метоксифенилмочевина. Раствор 12,3 ммоля (5 г) соединения, полученного на предыдущей стадии, в смеси 100 мл ацетонитрила и 100 мл диэтилкетона нагревают с обратным холодильником в течение 48 ч в присутствии 12,3 ммоля (2,3 г) 2-хлорметил-2,3 дигидро-1,4-бензодиоксина, 1,3 г гидрокарбоната калия и 100 мг иодида калия. После охлаждения смесь концентрируют и полученный остаток экстрагируют дихлорметаном. Органическую фазу сушат, концентрируют и очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония (97/3/0,3), с получением целевого продукта. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl. 17 Раствор 10,9 ммоля (3 г) соединения, полученного в процессе З, в 100 мл толуола нагревают с обратным холодильником в течение 1 ч. После охлаждения до 20 С добавляют раствор 10,9 ммоля (1,9 г) 6-хлор-5-фториндолина в 200 мл дихлорметана и реакционную смесь нагревают с обратным холодильником в течение 1 ночи. После охлаждения до температуры окружающей среды реакционную смесь концентрируют и очищают хроматографически на силикагеле,используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония (95/5/0,5),с получением целевого продукта.N Сl Рассч., % 60,21 5,77 13,37 8,46 Обнаруж., % 59,15 6,05 12,82 8,85 Пример 12. Дигидрохлорид N-3-[4-(2,3 дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил-1,2-дигидро-3 Н-бензо[е]индол 3-карбоксамида. В раствор 3,12 г 1,2-дигидро-3 Н-бензо[е]индола в 300 мл толуола добавляют при 20 С 20 мл 20%-ного (мас.) раствора фосгена в толуоле. После выдержки в течение 1 ч при 50 С смесь нагревают до 100 С, барботируя через нее азот. Затем добавляют при 20 С раствор в толуоле 6 г соединения, полученного в процессе Д, после чего смесь нагревают при 80 С в течение 12 ч. Затем остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония(99/1/0,1). Соответствующий дигидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 64,75 5,79 9,44 11,95 Обнаруж., % 65,17 5,75 9,46 10,88 Пример 13. Дигидрохлорид 6-xлор-5-фторN-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил-1-2,3-дигидроиндолкарбоксамида. Указанное в заголовке соединение получают по методу, описанному в примере 12, однако, вместо 1,2-дигидробензо[е]индола, применяют 6-хлор-5-фтор-2,3-дигидроиндол. 18 Стадия 1. 1-(2,3-Дигидробензо[1,4]диоксин 2-илметил)-4-(2-метокси-5-нитрофенил)пиперазин. Указанное в заголовке соединение получают по методу, описанному в процессе Д, однако, вместо 3-нитрофенилпиперазина, применяют 2-метокси-5-нитрофенилпиперазин. Стадия 2. 3-[4-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперазин-1-ил]-4-метоксифениламин. Указанное в заголовке соединение получают по методу, описанному в процессе А, стадия 2, используя в качестве исходного соединение,полученное на предыдущей стадии. Стадия 3. Дигидрохлорид N-3-[4-(2,3 дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]-4-метоксифенил-N'-(3,4-диметилфенил)мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 4, однако,вместо 4-метокси-3-(4-метил-1-пиперазинил)фениламина, применяют соединение, полученное на стадии 2 упомянутого примера, и, вместо 3 хлор-4-метилфенилизоцианата, применяют 3,4 диметилфенилизоцианат.N Сl Рассч., % 60,52 6,30 9,73 12,32 Обнаруж., % 60,50 6,23 9,79 12,12 Пример 15. Гидрохлорид N-(3-xлор-4 фторфенил)-N'-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]-4-метоксифенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 14, однако, вместо 3,4-диметилфенилизоцианата, применяют 3-хлор-4-фторфенилизоцианат.N Сl Рассч., % 57,56 5,19 9,94 12,58 Обнаруж., % 57,62 5,39 9,59 11,72 Пример 16. Гидрохлорид N-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил-N'-(3,4-диметилфенил)мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 4, однако,вместо 4-метокси-3-(4-метил-1-пиперазинил)фениламина, применяют соединение, полученное в процессе Д, и, вместо 3-хлор-4-метилфенилизоцианата, применяют 3,4-диметилфенилизоцианат. 19 Пример 17. Гидрохлорид N-(3-xлор-4-фторфенил)-N'-3-[4-(2,3-дигидpo-1,4-бeнзoдиоксин 2-илметил)-1-пиперазинил]фенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 4, однако,вместо 4-метокси-3-(4-метил-1-пиперазинил)фениламина, применяют соединение, полученное в процессе Д, и, вместо 3-хлор-4-метилфенилизоцианата, применяют 3-хлор-4-фторфенилизоцианат.N Сl Рассч., % 58,54 5,10 10,50 13,29 Обнаруж., % 58,40 5,47 10,02 12,61 Пример 18. Дигидрохлорид 6-xлор-5 метил-N-4-[4-(2,3-дигидро-1,4-бензодиоксин-2 илметил)-1-пиперазинил]фенил-1-2,3-дигидроиндолкарбоксамида. Указанное в заголовке соединение получают по методу, описанному в примере 12, однако, вместо 1,2-дигидробензо[е]индола, применяют 6-хлор-5-метил-2,3-дигидроиндол.N Сl Рассч., % 58,84 5,62 9,46 17,97 Обнаруж., % 58,77 5,46 9,16 18,82 Пример 19. Гидрохлорид N-(3-xлор-4 метилфенил)-N'-[2-(1 Н-имидазол-4-ил)-индан-5 ил]мочевины. Стадия 1. 2-Бром-1-индан-2-илэтанон. 10 г чистого брома быстро добавляют при 0 С в раствор 10 г 2-ацетилиндана в 150 мл безводного метанола. После выдержки в течение 1 ч при температуре окружающей среды добавляют 100 мл воды и смесь перемешивают в течение 12 ч. После двукратной экстракции диэтиловым эфиром (используя по 200 мл эфира каждый раз) и промывания органической фазы раствором гидрокарбоната натрия и затем водой полученный продукт сушат над сульфатом магния и концентрируют. Стадия 2. 4-Индан-2-ил-1 Н-имидазол. Смесь 5,2 г 2-бром-1-индан-2-илэтанона и 43,4 мл формамида нагревают при 160 С в течение 30 мин. Добавляют при температуре окружающей среды 40 мл воды и затем 40 мл 1 н. хлористо-водородной кислоты. Водную фазу промывают дихлорметаном и затем нейтрализуют гидроксидом аммония. Экстрагируют этилацетатом и после упаривания получают целевой продукт. Стадия 3. 4-(5-Нитроиндан-2-ил)-1 Н-имидазол. 5 г 4-индан-2-ил-1 Н-имидазола растворяют при 0 С в 140 мл чистой серной кислоты и затем малыми порциями добавляют 1 эквивалент нитрата мочевины в порошковой форме. Реакцион 005128 20 ную смесь выливают на лед, подщелачивают раствором гидроксида натрия и экстрагируют этилацетатом. После упаривания получают целевой продукт. Стадия 4. 2-(1 Н-Имидазол-4-ил)индан-5 иламин. Гидрохлорид соединения, полученого на стадии 3, перемешивают под атмосферой водорода в присутствии 10%-го палладия-на-углероде в этаноле. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 5. Гидрохлорид N-(3-xлор-4 метилфенил)-N'-[2-(1 Н-имидазол-4-ил)индан-5 ил]мочевины. Смесь 5,3 г гидрохлорида соединения, полученного на стадии 4, 3,8 г 3-хлор-4-метилфенилизоцианата и 150 мл диметилформамида нагревают при 100 С в течение 2 ч. После выпаривания растворителя остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и гидроксида аммония (97/3/0,3). Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 59,56 5,00 13,89 17,58 Обнаруж., % 58,95 5,17 13,36 17,01 Пример 20. Гидрохлорид N-[2-(1 Н-имидазол-4-ил)индан-5-ил]-N'-(4-метилсульфанилфенил)мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 19, однако, вместо 3-хлор-4-метилфенилизоцианата,применяют 4-метилтиофенилизоцианат.S Рассч., % 59,92 5,28 13,97 8,84 8,00 Обнаруж., % 59,72 5,32 13,26 8,56 7,73 Пример 21. Гидрохлорид N-(3,4-диметилфенил)-N'-[2-(1 Н-имидазол-4-ил)индан-5-ил]мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 19, однако, вместо 3-хлор-4-метилфенилизоцианата,применяют 3,4-диметилфенилизоцианат. 21 Стадия 1. 2-(4,5-Дигидро-1 Н-имидазол-2 ил)-7-нитро-1,2,3,4-тетрагидроизохинолин. Смесь 10 г 7-нитро-1,2,3,4-тетрагидроизохинолина, 13,7 г 2-метилсульфанил-4,5-дигидро-1 Н-имидазолгидрохлорида и 100 мл метанола нагревают с обратным холодильником в течение 12 ч. Добавляют диэтиловый эфир, выпавший при этом осадок отделяют, растворяют в воде, нейтрализуют гидроксидом натрия и экстрагируют дихлорметаном. Стадия 2. 2-(4,5-Дигидро-1 Н-имидазол-2 ил)-1,2,3,4-тетрагидроизохинолин-7-иламин. В суспензию 2 г гидрохлорида продукта,полученного на стадии 1, добавляют при 40 С 2 мл гидразингидрата и 2 г никеля Ренея в 50 мл этанола. После выдержки в течение 2 ч при 50 С катализатор отфильтровывают и растворитель выпаривают. Стадия 3. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-[2-(4,5-дигидро-1 Н-имидазол-2-ил)1,2,3,4-тетрагидро-7-изохинолинил]мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 19, стадия 5.N Сl Рассч., % 57,09 5,47 16,65 16,89 Обнаруж., % 57,41 5,51 16,32 16,74 Пример 23. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[2-(1 Н-имидазол-4-ил)этил]фенилмочевины. Стадия 1. (3-Нитрофенил)ацетальдегид. Смесь 10 г 2-(3-нитрофенил)этанола, 25,1 г 1-оксида 1-гидрокси-1,2-бензиодоксол-3(1 Н)-она и 300 мл тетрагидрофурана нагревают с обратным холодильником в течение 6 ч. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 2. 2-(3-Нитрофенил)-1-(1-тритил 1 Н-имидазол-4-ил)этанол. 4,2 мл 3 М этилмагнийбромида выливают при температуре окружающей следы в 5,48 г 4-иод 1-тритил-1 Н-имидазола, растворенного в 30 мл дихлорметана. Через 1 ч 1 г продукта, полученного на стадии 1, растворяют в 20 мл дихлорметана. После гидролиза насыщенным раствором гидроксида аммония, экстракции дихлорметаном и затем промывки органической фазы водой растворитель выпаривают и остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (98/2). Стадия 3. 4-[2-(3-Нитрофенил)винил]-1 тритил-1 Н-имидазол. Смесь 12,25 г продукта, полученного на стадии 2, 1 г паратолуолсульфоновой кислоты и 200 мл толуола нагревают с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры толуоловый раствор промывают 0,1 н. раствором гидроксида натрия 22 и затем водой, сушат над сульфатом магния и концентрируют с получением целевого продукта. Стадия 4. 4-[2-(3-Нитрофенил)винил]-1Hимидазол. Смесь 11 г продукта, полученного на стадии 3, 6 мл концентрированной хлористо-водородной кислоты и 150 мл метанола нагревают с обратным холодильником в течение 2 ч. Растворитель концентрируют и остатoк растворяют в смеси изопропанола и диэтилового эфира. Целевой продукт получают, отфильтровывая образовавшийся осадок. Стадия 5. 3-[2-(1 Н-Имидазол-4-ил)этил] фениламин. Гидрохлорид соединения, полученого на стадии 4, перемешивают под атмосферой водорода в присутствии 90%-ного раствора 10%-го палладия-на-углероде в этаноле. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 6. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[2-(1 Н-имидазол-4-ил)этил]фенил мочевины. Указанное в заголовке соединение получают по методу, описанному в примере 19, стадия 5.N Сl Рассч., % 58,32 5,15 14,32 18,12 Обнаруж., % 58,40 5,13 13,97 18,35 Пример 24. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[2-(4,5-дигидро-1 Н-имидазол 2-ил)этил]фенилмочевины. Стадия 1. 3-(3-Нитрофенил)акрилонитрил. 75,5 г диэтилового эфира цианометилфосфиновой кислоты, растворенные в тетрагидрофуране, выливают при 0 С в суспензию гидрида натрия в тетрагидрофуране. После 30-минутного контакта при температуре окружающей среды добавляют 56 г 3-нитробензальдегида, растворенные в тетрагидрофуране. Через 1 ч проводят гидролиз с помощью 300 мл воды и затем растворитель концентрируют. После экстракции дихлорметаном, промывки органической фазы водой, сушки над сульфатом магния и концентрирования осадок растворяют в диэтиловом эфире и отфильтровывают. Стадия 2. 3-(3-Нитрофенил)пропионитрил. В цилиндр помещают 3 г продукта, полученого на стадии 1, 1,59 г хлорида трис(трифенилфосфин)родия(I) и 90 мл бензола. Смесь нагревают в течение 5 ч при 40 С под атмосферой водорода при давлении 5 бар. Растворитель выпаривают и остаток очищают хроматографически на силикагеле, используя в качестве элюента дихлорметан. Стадия 3. 2-[2-(3-Нитрофенил)этил]-4,5 дигидро-1 Н-имидазол. 1 г продукта, полученного на стадии 2, нагревают в течение 2 ч при 160 С с 1,32 г этилен 23 диаминпаратолуолсульфоната. Затем прибавляют 0,1 н. раствор гидроксида натрия и экстрагируют дихлорметаном. Органическую фазу промывают водой, сушат над сульфатом магния и концентрируют. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl. Стадия 4. 3-[2-(4,5-Дигидро-1 Н-имидазол 2-ил)этил]фениламин. Гидрохлорид соединения, полученого на стадии 3, перемешивают под атмосферой водорода в присутствии 90%-ного раствора 10%-го палладия-на-углероде в этаноле. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 5. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-3-[2-(4,5-дигидро-1 Н-имидазол-2 ил)этил]фенилмочевины. Указанное в заголовке соединение получают по методу, описанному в примере 19, стадия 5.N Сl Рассч., % 58,02 5,64 14,24 18,03 Обнаруж., % 57,88 5,69 13,98 17,93 Пример 25. Гидрохлорид N-(3-xлор-4 метилфенил)-N'-[8-(1 Н-имидазол-4-ил)-5,6,7,8 тетрагидро-2-нафталинил]мочевины. Стадия 1. 7-Нитро-3,4,4 а,8 а-тетрагидронафталин-1-иловый эфир трифторметансульфокислоты. В раствор 10 г 7-нитротетралона и 11,8 г 2,6-ди-трет-бутил-4-метилпиридина в 365 мл дихлорметана при 0 С выливают 9,8 мл ангидрида трифторметансульфокислоты. После выдержки в течение 24 ч при температуре окружающей среды, концентрирования досуха и растворения остатка в 200 мл пентана при температуре дефлегмации в течение 30 мин образовавшийся осадок отфильтровывают. Органическую фазу промывают 1 н. раствором хлористоводородной кислоты и затем водой, сушат над сульфатом магния и концентрируют. Стадия 2. 4-(7-Нитро-3,4,4 а,8 а-тетрагидронафталин-1-ил)-1-тритил-1 Н-имидазол. 15,34 мл 3 М этилмагнийбромида при температуре окружающей среды выливают в раствор, содержащий 16,74 г 4-иод-1-тритил-1 Нимидазола в 250 мл тетрагидрофурана. Через 1 ч добавляют 76,6 мл 1 н. раствора хлорида цинка в диэтиловом эфире. После контакта в течение 1 ч добавляют 12,4 г полученного на стадии 1 продукта, растворенного в 100 мл тетрагидрофурана,и 2,22 г тетракис(трифенилфосфин)палладия(0) и полученную смесь нагревают с обратным холодильником. После гидролиза насыщенным раствором гидроксида аммония и экстракции дихлорметаном органическую фазу промывают водой. Затем растворитель выпаривают и остаток очищают хроматографически на силикагеле, 005128 24 используя в качестве элюента смесь циклогексана и этилацетата (80/20). Стадия 3. 8-(1-Тритил-1 Н-имидазол-4-ил)4 а,5,6,7,8,8 а-гексагидронафталин-2-иламин. 7,7 г продукта, полученного на стадии 2,перемешивают под атмосферой водорода в присутствии 10%-го палладия-на-углероде в смеси метанола и тетрагидрофурана. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 4. 8-(1 Н-Имидазол-4-ил)-4 а,5,6,7,8,8 а-гексагидронафталин-2-иламин. Смесь 7,7 г продукта, полученного на стадии 3, 4,2 мл концентрированной хлористоводородной кислоты и 100 мл метанола нагревают с обратным холодильником в течение 2 ч. После концентрирования растворителя остаток растворяют в смеси изопропанола и диэтилового эфира. Осадок отфильтровывают с получением целевого продукта. Стадия 5. Гидрохлорид N-(3-Хлор-4 метилфенил)-N'-[8-(1 Н-имидазол-4-ил)-5,6,7,8 тетрагидро-2-нафталинил]мочевины. Смесь 0,7 г продукта, полученного на стадии 4, 0,55 г 3-хлор-4-метилфенилизоцианата и 50 мл толуола нагревают с обратным холодильником в течение 3 ч. Затем остаток отфильтровывают. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 60,44 5,31 13,42 16,99 Обнаруж., % 60,28 5,41 13,02 17,20 Пример 26. Гидрохлорид N-(3-xлор-4 метилфенил)-N'-[7-(1 Н-имидазол-4-ил)-5,6,7,8 тетрагидро-2-нафталинил]мочевины. Стадия 1. 7-Нитро-3,4-дигидро-1 Н-нафталин-2-он. 100 г 2-тетралона растворяют при 0 С в 460 мл чистой серной кислоты и малыми порциями добавляют 84,6 г нитрата калия в порошковой форме. Затем смесь выливают на лед и экстрагируют дихлорметаном. После выпаривания растворителя остаток очищают хроматографически на силикагеле, используя в качестве элюента смесь циклогексана и тетрагдрофурана(90/10). Стадия 2. 7-Нитро-3,4-дигидронафталин-2 иловый эфир трифторметансульфокислоты. Указанное в заголовке соединение получают по методу, описанному в примере 25, стадия 1, однако, вместо 7-нитротетралона, применяют 14,3 г продукта, полученного на стадии 1. Стадия 3. 4-(7-Нитро-3,4-дигидронафталин-2-ил)-1-тритил-1 Н-имидазол. Указанное в заголовке соединение получают по методу, описанному в примере 25, стадия 2, однако, вместо 7-нитро-3,4,4 а,8 а-тетрагидро 25 нафталин-1-илового эфира трифторметансульфокислоты, применяют 11,2 г продукта, полученного на стадии 2. Стадия 4. 7-(1-Тритил-1 Н-имидазол-4-ил)5,6,7,8-тетрагидронафталин-2-иламин. 5,5 г продукта, полученного на стадии 3,перемешивают под атмосферой водорода в смеси метанола и тетрагидрофурана в присутствии 10%-го палладия-на-углероде. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 5. 7-(1 Н-Имидазол-4-ил)-5,6,7,8 тетрагидронафталин-2-иламин. Смесь 5,5 г продукта, полученного на стадии 4, 3,8 мл концентрированной хлористоводородной кислоты и 100 мл метанола нагревают с обратным холодильником в течение 2 ч. После концентрирования растворителя остаток растворяют в смеси ацетона и диэтилового эфира. Осадок отфильтровывают с получением целевого продукта. Стадия 6. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-[7-(1 Н-имидазол-4-ил)-5,6,7,8-тетрагидро-2-нафталинил]мочевины. Смесь 0,9 г продукта, полученного на стадии 4, 0,71 г 3-хлор-4-метилфенилизоцианата и 70 мл толуола нагревают с обратным холодильником в течение 3 ч. Осадок отфильтровывают и затем перекристаллизовывают из смеси этанола и метанола. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 60,44 5,31 13,42 16,99 Обнаруж., % 59,84 5,17 13,06 16,88 Пример 27. Гидрохлорид N-(3-xлор-4 метилфенил)-N'-[4-(1 Н-имидазол-4-ил)хроман 6-ил]мочевины. Стадия 1. 6-Нитрохроман-4-он. 60 г 4-хроманона при -35 С добавляют малыми порциями в 385 мл 90%-ной азотной кислоты. Полученную смесь выливают на лед и затем экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом магния и затем выпаривают растворитель. Стадия 2. 6-Нитро-2 Н-хромен-4-иловый эфир трифторметансульфокислоты. Указанное в заголовке соединение получают по методу, описанному в примере 25, стадия 1, однако, вместо 7-нитротетралона, применяют 20 г продукта, полученного на стадии 1. Стадия 3. 4-(6-Нитро-2 Н-хромен-4-ил)-1 тритил-1 Н-имидазол. Указанное в заголовке соединение получают по методу, описанному в примере 25, стадия 2, однако, вместо 7-нитро-3,4,4 а,8 а-тетрагидронафталин-1-илового эфира трифторметансуль 005128 26 фокислоты, применяют 11,1 г продукта, полученного на стадии 2. Стадия 4. 4- (1 Н-Имидазол-4-ил)хроман-6 иламин. Гидрохлорид соединения, полученного на стадии 3, перемешивают под атмосферой водорода в этаноле в присутствии 10%-го палладияна-углероде. После фильтрации и концентрирования растворителя продукт используют без дополнительной обработки на следующей стадии. Стадия 5. Гидрохлорид N-(3-xлор-4-метилфенил)-N'-[4-(1 Н-имидазол-4-ил)хроман-6-ил] мочевины. Смесь 0,76 г продукта, полученного на стадии 4, 0,59 г 3-хлор-4-метилфенилизоцианата и 70 мл толуола нагревают с обратным холодильником в течение 2 ч. Осадок отфильтровывают и затем перекристаллизовывают из смеси этанола и метанола. Соответствующий гидрохлорид получают, действуя на полученный продукт этанольным раствором НСl.N Сl Рассч., % 57,29 4,81 13,36 16,91 Обнаруж., % 56,83 4,98 12,96 16,63 Соединения из примеров 28-30 получают по методам, описанным выше. Пример 28. N-[3-(1 Н-Имидазол-4-ил)хроман-6-ил]-1,2-дигидро-3 Н-бензо[е]индол-3-карбоксамид. Пример 29. N-(3-Хлор-4-метилфенил)-N'[3-(1 Н-имидазол-4-ил)-хроман-6-ил]мочевина. Пример 30. N-(3-Хлор-4-метилфенил)-N'[2-(1 Н-имидазол-4-ил)-1,2,3,4-тетрагидро-7-изохинолинил]мочевина. Фармакологическое исследование Пример А. Тест для исследования воздействия соединений на эрекцию полового члена у крыс. Тест позволяет оценить способность фармакологических агентов ингибировать эрекции полового члена, вызываемые введением избирательного агониста 5-НТ 2c-рецептора, RO 60-0175. Самцов крыс линии Wistar весом от 120 до 140 г в день эксперимента после введения тестируемого соединения или носителя помещают по отдельности в плексигласовые ящики для наблюдения. Через 30 мин животным вводят RO 60-0175 (1,25 мг/кг, путем подкожного введения) и подсчитывают количество эрекций, которые происходят в течение следующих 30 мин. Результаты. Соединения по настоящему изобретению обладают способностью ингибировать эрекции полового члена, вызываемые введением избирательного агониста 5-НТ 2c-рецептора. Следовательно, они являются антагонистами в отношении 5-НТ 2c-рецепторов. Например, концентрация соединения из примера 6, вызывающая 50%-ное ингибирование (IC50), составляет 0,7 мг/кг. 27 Пример Б. Тест для исследования воздействия соединений на агрессивность, вызванную изоляцией, на мышах. В качестве подопытных животных используют самцов мышей линии CD-1. После доставки мышей изолируют в отдельных клетках со свободным доступом к пище и питью. После периода изоляции, составляющего 1 месяц, отбирают пары мышей, обладающих постоянной агрессивностью, на основе оценки латентного периода, количества и продолжительности атак,когда животных помещают вместе. Тест проводят 1 раз в неделю. В день опыта каждой мыши из пары мышей (мышь-хозяин и мышь-гость) вводят путем подкожной инъекции носитель (контрольные животные) или тестируемый продукт (обработанные животные) в объеме 10 мл/кг. Через 30 мин мышь-гость вносят в клетку мыши-хозяина. Затем в течение 3 мин оценивают латентный период, количество и продолжительность атак. Считается, что продукт обладает специфическими антиагрессивными свойствами, если он вызывает уменьшение количества и продолжительности атак при введении в неседативных дозах. Результаты. Соединения по изобретению вызывают существенное уменьшение количества и продолжительности атак. Например, доза соединения из примера 6, вызывающая 50%-ное ингибирование (ID50), составляет 2,5 мг/кг (подкожное введение). Пример В. Тест на мышах по закапыванию шариков. Этот тест позволяет оценить способность фармакологических агентов ингибировать спонтанное поведение мышей, заключающееся в закапывании шариков, при этом степень ингибирования может служить основой для оценки антидепрессантного и/или антиимпульсивного действия. Самцов мышей линии NMRI весом 20-25 г в день эксперимента помещают по отдельности в садки из макролона, содержащие подстилку из опилок толщиной 5 см и покрытые перфорированной пластиной из плексигласа. 24 стеклянных шарика, раскрашенных под "тигровый глаз", равномерно распределяют на опилках по периферии садка. После 30-минутного свободного эксперимента животных удаляют из садка и подсчитывают количество закопанных шариков. Результаты. Соединения по изобретению обладают способностью ингибировать спонтанное поведение мышей, заключающееся в закапывании шариков. Например, эффективная доза соединения из примера 6, вызывающая 50%-ное ингибирование (ED50), составляет 0,4 мг/кг. Пример Г. Определение аффинности в отношении 2-адренергических рецепторов в опытах на крысах. 28 Аффинность определяют в конкурентных опытах с использованием [3 Н]-RX 821,002. Выделяют мембраны из коры головного мозга крыс и инкубируют в трех повторностях в течение 60 мин при 22 С в присутствии 0,4 нМ [3 Н]-RX 821,002 и тестируемого соединения в конечном объеме 1,0 мл. Буфер для инкубации содержит 50 нМ трис-НСl (рН 7,5), 1 мМ ЭДТК и 100 мкМGppNHp. Неспецифическое связывание определяют с использованием 10 мкМ фентоламина. Анализ данных. После завершения инкубации среду для инкубации фильтруют через фильтры типаWHATMAN GF/B, пропитанные 0,1%-ным полиэтиленимином, и трижды промывают 5 мл охлажденного буфера. Радиоактивность, сохранившуюся на фильтрах, определяют с помощью жидкостного сцинтилляционного счетчика. Изотермы связывания анализируют с использованием метода нелинейной регрессии. Результаты. Соединения по изобретению обладают антагонистической активностью, специфической в отношении 2-адренергических рецепторов,например значение pKi соединения из примера 6 составляет 6,7. Пример Д. Фармацевтическая композиция. Состав для приготовления 1000 таблеток,каждая из которых содержит 10 мг действующего вещества: Соединение из примера 6 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) где R1, R2, R3 и R4 независимо друг от друга обозначают атом водорода, атом галогена или алкил, алкокси-, гидрокси-, алкилтио-, меркапто-, циано-, аминогруппу (необязательно замещенную одной или двумя алкильными группами), нитро-, карбоксигруппу, алкоксикарбонил,аминокарбонил (необязательно замещенный одной или двумя алкильными группами) или карбамоил,или два из этих радикалов вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо или ароматический гетероцикл, имеющий 5-7 кольцевых членов и содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, 29L1 и L2, каждый обозначает атом водорода,или указанные радикалы вместе образуют группу -СН 2-СН 2-,Х 1, присоединенный в положении 2 или 3 ароматического кольца, обозначает связь, в этом случае Х 2 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами), илиX1 и Х 2, вместе с двумя соседними атомами углерода, к которым они присоединены в положении 2, 3 или 4 ароматического кольца,образуют С 4-С 7 циклоалкильную группу, где одна или две группы -СН 2-циклоалкильного кольца необязательно замещены атомом кислорода или группой NH (необязательно замещенной алкильной группой) и где один из атомов углерода циклоалкильного кольца замещен группой G,X3 обозначает атом водорода, атом галогена, алкил, алкокси-, гидрокси-, нитро- или цианогруппу или аминогруппу (необязательно замещенную одной или двумя алкильными группами),G обозначает группу, выбранную из где штриховые линии обозначают необязательно присутствующую двойную связь,Alk обозначает линейную или разветвленную С 1-С 6 алкиленовую группу, если G1 или G2 содержит имидазолиновую группу, при этом группа Alk присоединена в положении 2 кольца,n равно 0 или 1,Т 3 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,Т 4 обозначает алкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил,при этом понятие "алкил" обозначает линейную или разветвленную группу, содержащую от 1 до 6 атомов углерода,понятие "алкокси" обозначает линейную или разветвленную алкилоксигруппу, содержащую от 1 до 6 атомов углерода, 005128 30 понятие "арил" обозначает фенил, нафтил или бифенил,понятие "гетероарил" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, при этом каждая группа содержит от 5 до 11 кольцевых членов и от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы,выражение "необязательно замещенный" применительно к арилу, арилалкилу, гетероарилу и гетероарилалкилу обозначает, что эти группы являются незамещенными или замещены в циклическом фрагменте одним или несколькими атомами галогена и/или алкилом,алкокси-, гидрокси-, меркапто-, алкилтио-, циано-, аминогруппой (необязательно замещенной одной или двумя алкильными группами), нитро-,карбоксигруппой, алкоксикарбонилом, аминокарбонилом (необязательно замещенным одной или двумя алкильными группами) или карбамоилом, при этом гетероарил и гетероарилалкил могут быть дополнительно замещены оксогруппой,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 2. Соединения формулы (I) по п.1, где L1 иL2, каждый обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 3. Соединения формулы (I) по п.1, где L1 иL2 вместе образуют группу -СН 2-СН 2-, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 4. Соединения формулы (I) по п.1, где R1 иR4, каждый обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 5. Соединения формулы (I) по п.1, где R2 иR3 выбирают из атома галогена и алкила, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 6. Соединения формулы (I) по п.1, где Х 1 присоединен в положении 2 фенильного кольца,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 7. Соединения формулы (I) по п.1, где Х 1 обозначает связь и Х 2 обозначает атом галогена,или алкил, или алкоксигруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 8. Соединения формулы (I) по п.1, где Х 3 обозначает атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием.R4 вместе с атомами углерода, к которым они присоединены, образуют фенильное кольцо и L1 и L2 вместе образуют группу -СН 2-СН 2-, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 10. Соединения формулы (I) по п.1, где G выбирают из ряда, включающего группы где Т'3 более предпочтительно обозначает необязательно замещенный гетероарил или необязательно замещенный гетероарилалкил, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 11. Соединения формулы (I) по п.1, где Х 1 и Х 2 вместе с двумя атомами углерода в положениях 2 и 3 ароматического кольца, к которым они присоединены, образуют С 4-С 7 циклоалкильную группу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 12. Соединение формулы (I), представляющее собой N-(3-хлор-4-метилфенил)-N'-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенилмочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 13. Соединение формулы (I), представляющее собой N-[4-хлор-3-(4,5-дигидро-1 Н-имидазол-2-иламино)фенил]-N'-(3-хлор-4-метилфенил) мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 14. Соединение формулы (I), представляющее собой N-(3-хлор-4-метилфенил)-N'-[2-(1 Нимидазол-4-ил)индан-5-ил]мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 15. Соединение формулы (I), представляющее собой N-3-[4-(2,3-дигидро-1,4-бензодиоксин-2-илметил)-1-пиперазинил]фенил-N'-(3,4-диметилфенил)мочевину, его энантиомеры и диастереоизомеры, а также его аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используется ароматический амин формулы (II) где X1, Х 2, Х 3 и G имеют значения, указанные для формулы (I), 005128 32 который конденсируют путем нагревания в щелочной среде с соединением формулы (III) где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (I/a) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, Х 1,Х 2, X3 и G имеют указанные выше значения,причем изоцианат формулы (III) либо имеется в продаже, либо может быть получен согласно известным методам,при этом соединения формулы (I/a) при необходимости могут быть очищены с использованием общепринятых методов очистки,необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения,при необходимости могут быть превращены в аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используется амин формулы (IV) где L1, L2, R1, R2, R3 и R4 имеют значения, указанные для формулы (I),который конденсируют путем нагревания в щелочной среде с соединением формулы (V) где Х 1, Х 2, X3 и G имеют значения, указанные для формулы (I),с получением соединения формулы (I/b) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, L1, L2,Х 1, Х 2, Х 3 и G имеют указанные выше значения,причем изоцианат формулы (V) либо имеется в продаже, либо может быть получен согласно известным методам,при этом соединения формулы (I/b) при необходимости могут быть очищены с использованием общепринятых методов очистки,необязательно могут быть разделены на изомеры с использованием общепринятых методов разделения,при необходимости могут быть превращены в аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в нем в качестве исходного продукта используют амин формулы (VI) где Х 1, Х 2 и Х 3 имеют значения, указанные для формулы (I), GN34 обозначает группу NH и Р обозначает атом водорода или группу, защищающую аминную функцию,который конденсируют путем нагревания в щелочной среде с соединением формулы (III) где R1, R2, R3 и R4 имеют значения, указанные для формулы (I),с получением соединения формулы (VII) где R1, R2, R3, R4, X1, Х 2, Х 3, GN34 и Р имеют указанные выше значения,полученное соединение формулы (VII),после удаления в случае необходимости защитной группы, конденсируют с тиофосгеном с получением соединения формулы (VIII) где R1, R2, R3, R4, X1, X2 и X3 имеют указанные выше значения,которое подвергают взаимодействию с этилендиамином, получая соединение формулы (IX) где R1, R2, R3, R4, Х 1, Х 2 и Х 3 имеют указанные выше значения,указанное соединение формулы (IX) подвергают реакции внутримолекулярной циклизации, катализируемой палладиевым соединением, с получением соединения формулы (I/d) представляющего собой частный случай соединений формулы (I), где R1, R2, R3, R4, Х 1,Х 2 и X3 имеют указанные выше значения,при этом указанное соединение формулы (I/d) при необходимости очищают с использованием общепринятых методов очистки,необязательно разделяют на изомеры с использованием общепринятых методов разделения,при необходимости превращают в аддитивные соли с фармацевтически приемлемыми кислотой или основанием. 19. Фармацевтические композиции, содержащие в качестве действующего вещества по крайней мере одно соединение по любому из пп.1-15, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями. 20. Фармацевтические композиции по п.19,содержащие по крайней мере одно действующее вещество по любому из пп.1-15, предназначенные для приготовления лекарственных средств,применяемых в качестве двойных антагонистов 2/5-НТ 2c-рецепторов для лечения депрессии,состояния страха, шизофрении, болезни Паркинсона, когнитивных болезней, расстройств либидо, сексуальных дисфункций, нарушений сна, злоупотребления лекарствами и нарушений импульсивного поведения.
МПК / Метки
МПК: C07D 405/04, C07D 233/24, C07C 275/28, C07D 233/50, C07D 405/12, A61K 31/4174, C07D 295/135, C07D 319/20, A61K 31/4164, C07D 405/14, C07D 401/04
Метки: фармацевтические, содержащие, получения, дифенилмочевины, новые, способ, производные, композиции
Код ссылки
<a href="https://eas.patents.su/19-5128-novye-proizvodnye-difenilmocheviny-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные дифенилмочевины, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Метод стимулирования полового цикла у свиноматок
Следующий патент: Способ получения меламина из мочевины
Случайный патент: Антагонисты рецептора il - 8