Гетероциклоалкилбензоциклобутановые и гетероарилбензоциклобутановые производные и содержащие их фармацевтические композиции
Номер патента: 4473
Опубликовано: 29.04.2004
Авторы: Пеглион Жан-Луи, Гумен Бертран, Лежён Франсуа, Брокко Морисетт, Мийан Марк, Дессинге Эмея
Формула / Реферат
1. Гетероциклоалкилбензоциклобутановые и гетероарилциклобутановые производные формулы (I)
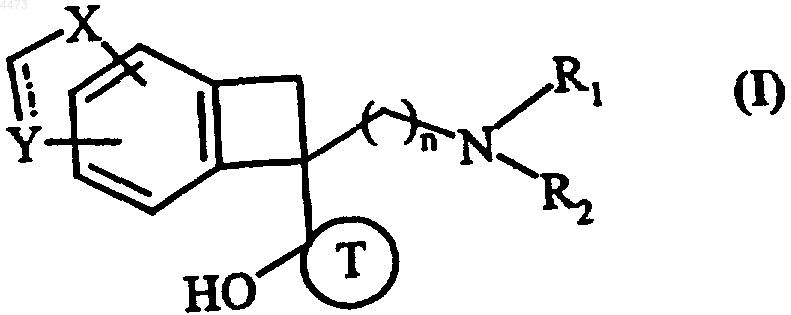
где ----- обозначает простую или двойную связь,
n обозначает целое число от 1 до 6 включительно,
R1 и R2 могут быть одинаковыми или различными и каждый независимо друг от друга обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную C1-C6алкильную группу, арильную группу, арилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную C2-C6алкенильную группу, линейную или разветвленную C2-C6алкинильную группу, гетероциклоалкильную группу, гетероциклоалкилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, гетероарильную группу и гетероарилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным,
X обозначает группу, выбранную из ряда, включающего -CH=CH-, атом кислорода, группу S(O)m, где m обозначает целое число от 0 до 2 включительно, и NR3, где R3 обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную C1-C6алкильную группу, арильную группу, арилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилC1-C6алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную C2-C6алкенильную группу и линейную или разветвленную C2-C6алкинильную группу,
Y обозначает CH- или CH2-группу, в зависимости от того, обозначает ли ----- простую связь или двойную связь, или может также обозначать атом кислорода, когда X обозначает атом кислорода,
T обозначает циклопентильную или циклогексильную группу,
их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием, где
"арильная группа" обозначает группу, выбранную из ряда, включающего фенил, бифенил, нафтил, дигидронафтил, тетрагидронафтил, инданил, инденил и бензоциклобутил, каждая из этих групп необязательно замещена одним или несколькими одинаковыми или различными группами, выбранными из ряда, включающего атомы галогена, линейные или разветвленные C1-C6алкильные группы, гидроксигруппы, линейные или разветвленные C1-C6алкоксигруппы, нитрогруппы, цианогруппы, линейные или разветвленные тригалоC1-C6алкильные группы, аминогруппы, моноалкиламиногруппы, в которых алкильный фрагмент имеет от 1 до 6 атомов углерода и является линейным или разветвленным, диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 6 атомов углерода и является линейным или разветвленным,
"гетероарильная группа" обозначает арильную группу, как она определена выше, содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы, эта гетероарильная группа необязательно может быть замещена одной или несколькими одинаковыми или различными группами, выбранными из заместителей, указанных выше для арильной группы,
"циклоалкильная группа" обозначает моно- или полициклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем эти ненасыщенные группы не оказывают влияния на ароматический характер указанной кольцевой системы,
"гетероциклоалкильная группа" обозначает циклоалкильную группу, как она определена выше, содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы.
2. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 1, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что R1 и R2, которые могут быть одинаковыми или различными, обозначают атом водорода, линейную или разветвленную C1-C6алкильную группу или 2,3-дигидро-1,4-бензодиоксин-2-илметильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/A)
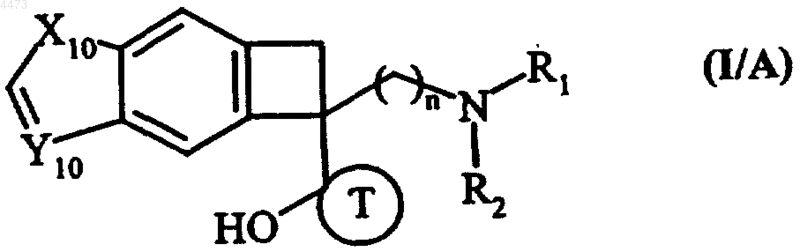
в которых n, R1, R2 и T имеют значения, указанные для формулы (I), X10 обозначает атом кислорода или атом серы и Y10 обозначает группу CH, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/B)
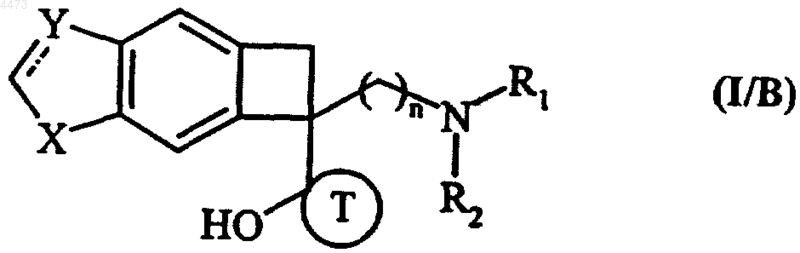
в которых X, Y, n, R1, R2, R3 и T имеют значения, указанные для формулы (I), их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I/B) по п.5, отличающиеся тем, что n равно 1 и X обозначает группу NR3, где R3 обозначает атом водорода или линейную или разветвленную C1-C6алкильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/C)
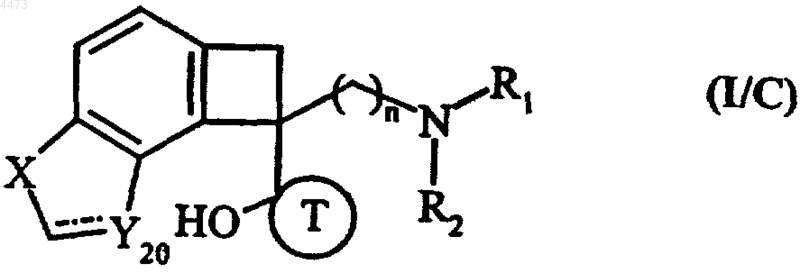
в которых n, R1, R2, X и T имеют значения, указанные для формулы (I), и Y20 обозначает группу CH или CH2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/D)

в которых n, R1, R2, X и T имеют значения, указанные для формулы (I), и Y20 обозначает группу CH или CH2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/E)
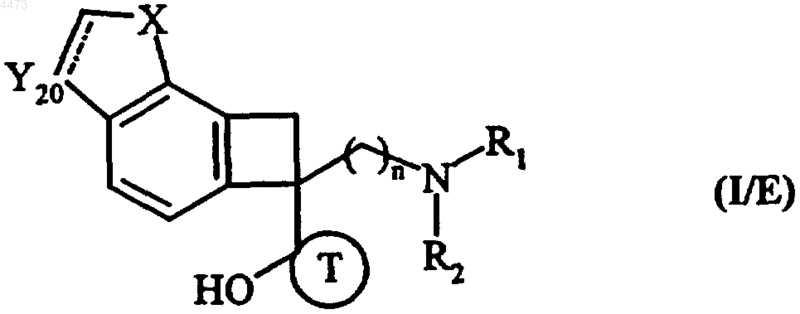
в которых n, R1, R2, X и T имеют значения, указанные для формулы (I), и Y20 обозначает группу CH или CH2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/F)
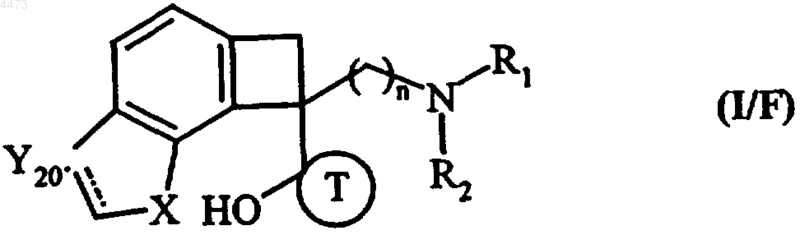
в которых n, R1, R2, X и T имеют значения, указанные для формулы (I), и Y20 обозначает группу CH или CH2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по любому из пп.1-3, представляющие собой
1-{6-[(диметиламино)метил]-1-метил-2,3,5,6-тетрагидро-1H-циклобута[f]индол-6-ил}циклогексанол,
1-{6-[(диметиламино)метил]-2,3,5,6-тетрагидро-1H-циклобута[f]индол-6-ил}циклогексанол,
1-{5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензофуран-5-ил}циклогексанол,
1-{5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил}циклогексанол,
1-{6-[(диметиламино)метил]-1-метил-5,6-дигидро-1H-циклобута[f]индол-6-ил}циклогексанол,
1-{7-[(диметиламино)метил]-2,3,6,7-тетрагидро-1H-циклобута[e]индол-7-ил}циклогексанол,
1-{5-[(метиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил}циклопентанол,
1-{5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил}циклопентанол,
(+)-1-{5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил}циклопентанол,
(-)-1-{5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил}циклопентанол,
1-{6-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-6-ил}циклопентанол,
1-{5-[(диметиламино)метил]-1-метил-5,6-дигидро-1H-циклобута[f]индол-5-ил}циклопентанол,
1-{7-[(диметиламино)метил]-6,7-дигидроциклобута[g][1]бензофуран-7-ил}циклопентанол,
1-{1-[(диметиламино)метил]-1,2-дигидроциклобута[b]нафталин-1-ил}циклопентанол,
1-{7-[(диметиламино)метил]-6,7-дигидро-3H-циклобута[e]индол-7-ил}циклопентанол,
1-{1-[(диметиламино)метил]-1,2-дигидроциклобута[a]нафталин-1-ил}циклопентанол,
их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Фармацевтическая композиция, включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-11, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями.
13. Фармацевтическая композиция по п.12, включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-11, предназначенные для лечения депрессии, приступов паники, обсессивно-компульсивных состояний, фобий, нарушений импульсивного контроля, злоупотребления лекарственными средствами, состояния тревоги, ожирения и булимии.
Текст
1 Настоящее изобретение относится к новым гетероциклоалкилбензоциклобутановым и гетероарилбензоциклобутановым производным,способу их получения и содержащим их фармацевтическим композициям. Соединения по настоящему изобретению действуют в качестве эффективных ингибиторов повторного проникновения серотонина и норадреналина. Вследствие этого они могут применяться в качестве лекарственных средств при лечении депрессии, приступов паники, обсессивно-компульсивных состояний, фобий,нарушений импульсивного контроля, злоупотребления лекарственными средствами, состояния тревоги, ожирения и булимии. Так, соединения по настоящему изобретения проявили активность, с одной стороны, invitro в специфическом тесте в отношении ингибирования повторного проникновения серотонина и норадреналина, а с другой стороны, в опытах in vivo. Так, в экспериментах по микродиализу, проведенных с использованием лобной коры (кора лобной доли полушария большого мозга) крыс, соединения по изобретению при введении в эту область повышают высвобождение серотонина, норадреналина и дофамина. Таким образом, заявляемые соединения в целом пригодны для применения при патологиях, которые связаны с нарушением переноса этих двух нейромедиаторов. Это особенно ценное действие соединений по изобретению также продемонстрировано в тесте по закапыванию шариков мышами. Более конкретно изобретение относится к соединениям формулы (I) гдеобозначает простую или двойную связь,n обозначает целое число от 1 до 6 включительно,R1 и R2 могут быть одинаковыми или различными и каждый независимо друг от друга обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную С 1-С 6 алкильную группу, арильную группу, арилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную С 2-С 6 алкенильную группу, линейную или разветвленную С 2-С 6 алкинильную группу, гетероциклоалкильную группу, гетероциклоалкилС 1 С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, гетероарильную группу и гетероарилС 1-С 6 алкильную группу, в которой алкиль 004473 2 ный фрагмент может быть линейным или разветвленным,Х обозначает группу, выбранную из ряда,включающего -СН=СН-, атом кислорода, группу S(O)m, где m обозначает целое число от 0 до 2 включительно, и NR3, где R3 обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную С 1 С 6 алкильную группу, арильную группу, арилС 1 С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную С 2 С 6 алкенильную группу и линейную или разветвленную С 2-С 6 алкинильную группу,Y обозначает СН- или СН 2-группу, в зависимости от того, обозначает илипростую связь или двойную связь, или может также обозначать атом кислорода, когда Х обозначает атом кислорода,Т обозначает моноциклическую или полициклическую С 3-С 12 циклоалкильную группу,причем один из атомов углерода циклоалкила необязательно может быть замещен группой,выбранной из ряда, включающего атом кислорода, атом селена, группу формулы S(О)p, где р обозначает целое число от 0 до 2 включительно,NR3, где R3 имеет указанные выше значения,группу формулы SiR4R5, где R4 и R5, которые могут быть одинаковыми или различными, обозначают линейную или разветвленную С 1 С 6 алкильную группу,их изомерам, а также к аддитивным солям с фармацевтически приемлемой кислотой или основанием. Под понятием "арильная группа" подразумевают группу, выбранную из ряда, включающего фенил, бифенил, нафтил, дигидронафтил,тетрагидронафтил, инданил, инденил и бензоциклобутил, каждая из этих групп необязательно замещена одним или несколькими одинаковыми или различными группами, выбранными из ряда, включающего атомы галогена, линейные или разветвленные С 1-С 6 алкильные группы,гидроксигруппы, линейные или разветвленные С 1-С 6 алкоксигруппы, нитрогруппы, цианогруппы, линейные или разветвленные тригалоС 1 С 6 алкильные группы, аминогруппы, моноалкиламиногруппы, в которых алкильный фрагмент имеет от 1 до 6 атомов углерода и является линейным или разветвленным, диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 6 атомов углерода и является линейным или разветвленным. Под понятием "гетероарильная группа" подразумевают арильную группу, как она определена выше, содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы, эта гетероарильная группа необязательно может 3 быть замещена одной или несколькими одинаковыми или различными группами, выбранными из заместителей, указанных выше для арильной группы. Из гетероарильных групп в качестве примеров, не ограничивающих объем изобретения, можно упомянуть, например, такие группы, как пиридил, пиримидинил, индолил, бензофуранил, бензотиенил, хинолил, изохинолил,бензо[1,4]диоксинил, 2,3-дигидробензо[1,4]диоксинил и т.д. Под понятием "циклоалкильная группа" подразумевают моно- или полициклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем, эти ненасыщенные группы не оказывают влияние на ароматический характер указанной кольцевой системы. Под понятием "гетероциклоалкильная группа" подразумевают циклоалкильную группу, как она определена выше, содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы. Предпочтительными соединениями по изобретению являются соединения формулы (I),в которых n равно 1. Согласно изобретению предпочтительными заместителями R1 и R2 являются атом водорода, линейная или разветвленная С 1-С 6 алкильная группа и 2,3-дигидро-1,4-бензодиоксин-2 илметильная группа. Согласно изобретению предпочтительным заместителем Т является насыщенная моноциклическая С 3-С 8 циклоалкильная группа. Согласно изобретению особенно предпочтительными заместителями Т являются циклопентильная и циклогексильная группы. Согласно предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/A) в которых n, R1, R2 и Т имеют значения, указанные для формулы (I), Х 10 обозначает атом кислорода или атом серы и Y10 обозначает группу СН. Согласно другому предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/B) в которых X, Y, n, R1, R2, R3 и Т имеют значения, указанные для формулы (I). 4 В предпочтительном варианте осуществления предпочтительными соединениями по изобретению являются соединения формулы(I/B), в которых n равно 1 и Х обозначает группу NR3, где R3 обозначает атом водорода или линейную или разветвленную С 1-С 6 алкильную группу. Согласно третьему предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/C) в которых n, R1, R2, X и Т имеют значения, указанные для формулы (I), и Y20 обозначает группу СН или СН 2. Согласно четвертому предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/D) в которых n, R1, R2, X и Т имеют значения, указанные для формулы (I), и Y20 обозначает группу СН или СН 2. Согласно еще одному предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/E) в которых n, R1, R2, X и Т имеют значения, указанные для формулы (I), и Y20 обозначает группу СН или СН 2. И наконец, согласно последнему, предпочтительному варианту осуществления предпочтительными соединениями по изобретению являются соединения формулы (I/F) в которых n, R1, R2, X и Т имеют значения, указанные для формулы (I), и Y20 обозначает группу СН или СН 2. Предпочтительными соединениями по изобретению являются 1-6-[(диметиламино)метил]-1-метил-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-илциклогексанол,1-6-[(диметиламино)метил]-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-илциклогексанол, 5 1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензофуран-5-илциклогексанол,1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклогексанол,1-6-[(диметиламино)метил]-1-метил-5,6 дигидро-1 Н-циклобута[f]индол-6-илциклогексанол,1-7-[(диметиламино)метил]-2,3,6,7-тетрагидро-1 Н-циклобута[е]индол-7-илциклогексанол,1-5-[(метиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,(+)-1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,(-)-1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,1-6-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-6-илциклопентанол,1-5-[(диметиламино)метил]-1-метил-5,6 дигидро-1 Н-циклобута[f]индол-5-илциклопентанол,1-7-[(диметиламино)метил]-6,7-дигидроциклобута[g][1]бензофуран-7-илциклопентанол,1-1-[(диметиламино)метил]-1,2-дигидроциклобута[b]нафталин-1-илциклопентанол,1-7-[(диметиламино)метил]-6,7-дигидро 3 Н-циклобута[е]индол-7-илциклопентанол,1-1-[(диметиламино)метил]-1,2-дигидроциклобута[а]нафталин-1-илциклопентанол. Изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием предпочтительных соединений являются составной частью изобретения. Под изомерами подразумевают оптические изомеры, такие как диастереоизомеры и энантиомеры. Из фармацевтически приемлемых кислот следует упомянуть (не ограничиваясь ими) соляную кислоту, бромисто-водородную кислоту,серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту,малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту и т.д. Из фармацевтически приемлемых оснований следует упомянуть (не ограничиваясь ими) гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Настоящее изобретение также относится к способу получения соединений формулы (I),отличающемуся тем, что в нем в качестве исходного продукта применяют а) либо соединение формулы (II) где Хa обозначает атом серы, атом кислорода или NH-группу,это соединение формулы (II) подвергают взаимодействию с соединением формулы (III)(III) где А обозначает линейную или разветвленную С 1-С 4 алкильную группу и Z обозначает формильную группу (когда Хa обозначает NHгруппу) или группу -CH2Hal, где Hal обозначает атом хлора, брома или йода, с получением соединений формулы (IV) где Хa и А имеют указанные выше значения, эти соединения формулы (IV) подвергают либо, когда Хa имеет значение X1 и обозначает атом кислорода или атом серы, циклизации с помощью кислоты, такой как полифосфорная кислота или кислота Льюиса, с получением соединений формулы (V/a) где Х 1 обозначает атом кислорода или атом серы, эти соединения формулы (V/a) обрабатывают либо в присутствии сильного основания циклическим кетоном формулы (VI) где Т имеет значения, указанные для формулы(I), с получением соединений формулы (VII/a) где X1 и Т имеют указанные выше значения, эти соединения формулы (VII/a) подвергают воздействию восстановителя согласно обычным условиям органического синтеза с получением соединений формулы (I/a), которые являются частным случаем соединений формулы (I) где Х 1 и Т имеют указанные выше значения,в этих соединениях формулы (I/a): либо первичную аминную функцию замещают согласно общепринятым методам органического синтеза, таким как восстановительное аминирование или нуклеофильное замещение,соединением формулы (VIIIa):R'1-Z1 (VIIIa) где R'1 имеет такие же значения, что и R1 в формуле (I) кроме атома водорода и Z1 обозначает обычную в области органической химии уходящую группу, такую как атом галогена или мезилатную или тозилатную группу, с получением соединений формулы (I/b1), которые являются частным случаем соединений формулы (I) где R1 и R2 имеют значения, указанные для формулы (I), n1 обозначает целое число от 2 до 6 включительно и L обозначает уходящую группу, такую как атом галогена, мезилат, тозилат или трифтометансульфонатную группу, с получением соединений формулы (X) где X1, Т и R'1 имеют указанные выше значения,либо согласно предпочтительному варианту осуществления способа обработку осуществляют с использованием соединения формулы(VIIIb) где R"1 обозначает гетероциклоалкилС 1 С 5 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, и Z2 обозначает атом хлора или имидазолильную группу, с получением соединений формулы (I/b2) где Х 1, n1, R1 и R2 имеют указанные выше значения,эти соединения формулы (X) обрабатывают перекисью водорода в присутствии карбоната натрия с получением соединений формулы где X1, Т и R"1 имеют указанные выше значения, эти соединения формулы (I/b2) восстанавливают с помощью восстановителя, обычно применяемого в органической химии, с получением соединений формулы (I/b3) где Х 1, R"1 и Т имеют указанные выше значения,соединения формул (I/b1) и (I/b3) представляют собой всю совокупность соединений формулы (I/b),эти соединения формулы (I/b) обрабатывают в таких же условиях, которые описаны выше, соединением формулы (VIIIc)(VIIIc) где Z1 имеет указанные выше значения и R'2 имеет такие же значения, что и R2 в формуле (I) кроме атома водорода,с получением соединений формулы (I/с),которые являются частным случаем соединений формулы (I) где X1, Т, R'1 и R'2 имеют указанные выше значения, либо в присутствии сильного основания амином формулы (IX) где Х 1, n1, R1 и R2 имеют указанные выше значения,эти соединения формулы (XI) восстанавливают с помощью формиата аммония в присутствии 10%-ного Pd/C с получением соединений формулы (XII) где Х 1, n1, R1 и R2 имеют указанные выше значения,эти соединения формулы (XII) подвергают воздействию соединения формулы (XIII)(XIII) где G обозначает линейную или разветвленную С 1-С 6 алкильную группу, бензильную группу или циклогексильную группу, с получением соединений формулы (XIV) где Х 1, n1, R1 и R2 имеют указанные выше значения,эти соединения формулы (XIV) обрабатывают димагниевым соединениeм формулы (XV) где Hal обозначает атом галогена и Т имеет значения, указанные для формулы (I),с получением соединений формулы (I/d),которые являются частным случаем соединений формулы (I) 9 где Х 1, n1, R1, R2 и Т имеют указанные выше значения,соединения формул (I/a), (I/b), (I/c) и (I/d),в случае, когда Х 1 обозначает атом серы, представляют собой всю совокупность соединений формулы (I/е) где n, R1, R2 и Т имеют значения, указанные для формулы (I), эти соединения формулы (I/е) подвергают воздействию окислителя согласно общепринятым условиям органического синтеза с получением соединений формулы (I/f), которые являются частным случаем соединений формулы (I) где p1 обозначает целое число, выбранное из 1 и 2, a n, R1, R2 и Т имеют указанные выше значения,соединения формул (I/a), (I/b), (I/c), (I/d)(где Х 1 обозначает атом кислорода или атом серы) и (I/f) представляют собой всю совокупность соединений формулы (I/g) где Х 1a обозначает атом кислорода или группу формулы S(O)p, где р имеет значения, указанные для формулы (I), и n, R1, R2 и Т имеют значения,указанные для формулы (I),эти соединения формулы (I/g) подвергают воздействию восстановителя согласно общепринятым условиям органического синтеза с получением соединений формулы (I/h), которые являются частным случаем соединений формулы (I) где Х 1a, n, R1, R2 и Т имеют указанные выше значения,либо, когда Хa имеет значения Х'2 и обозначает NH-группу, воздействию хлорангидрида сульфоновой кислоты формулы (XVI)(XVI) где Е обозначает линейную или разветвленную С 1-С 4 алкильную группу, фенильную группу или паратолуильную группу, с получением соединений формулы (XVII) где Х 2 обозначает атом азота и Е и А имеют указанные выше значения, эти соединения формулы (XVII) циклизуют под воздействием кислоты с получением соединений формулы (V/b) где Х 2 и Е имеют указанные выше значения,у циклического амина этих соединений формулы (V/b) удаляют защитную группу с помощью щелочного агента, а затем их подвергают воздействию восстановителя согласно общепринятым условиям органического синтеза с получением соединений формулы (V/c) где Х 2 имеет указанные выше значения,эти соединения формулы (V/c) подвергают воздействию соединения формулы (VI) согласно описанному выше процессу с получением соединений формулы (VII/b) где Х 2 имеет указанные выше значения и Т имеет значения, указанные для формулы (I),эти соединения формулы (VII/b) либо обрабатывают в таких же условиях,которые описаны для соединений формулы(VII/a), с получением соединений формулы (I/i),которые являются частным случаем соединений формулы (I) где Х 2 и Т имеют указанные выше значения,эти соединения формулы (I/i) могут обрабатываться последовательно соединением формулы (VIIIa) или (VIIIb), а затем (VIIIc) согласно описанному выше процессу с получением соединений формул (I/j) и (I/k) соответственно,которые являются частным случаем соединений формулы (I) 12 где Т, Х 2, Е и R'1 имеют указанные выше значения, эти соединения формулы (XX) могут быть превращены в третичные амины под воздействием соединения формулы (VIIIb) согласно описанному выше процессу с получением соединений формулы (XXI) где Х 2, Т, R'1 и R'2 имеют указанные выше значения, а R'3 имеет такие же значения, что и R'1,соединения формул (I/i), (I/j) и (I/k) представляют собой всю совокупность соединений формулы (I/1) где Х 2, R1, R2, R3 и Т имеют значения, указанные для формулы (I), эти соединения формулы (I/1) подвергают воздействию окислителя, такого как диоксид марганца, с получением соединений формулы (I/m), которые являются частным случаем соединений формулы (I) где Т, Х 2, Е, R'1 и R'2 имеют указанные выше значения,у этих соединений формул (XX) и (XXI) затем удаляют защитные группы обработкой натрием в жидком аммиаке с получением соединений формул (I/n) и (I/о) соответственно,которые являются частным случаем соединений формулы (I) где Т, Х 2, R'1 и R'2 имеют указанные выше значения,б) либо соединение формулы (II/1) где Х 2, R1, R2, R3 и Т имеют указанные выше значения,либо обрабатывают соединением формулы(XVI) согласно описанному выше процессу с получением соединений формулы (XVIII) где Т, Х 2 и Е имеют указанные выше значения,эти соединения формулы (XVIII) восстанавливают согласно общепринятым условиям органического синтеза с получением соединений формулы (XIX) где Т, Х 2 и Е имеют указанные выше значения,первичная аминная функция этих соединений формулы (XIX) может быть замещена под воздействием соединения формулы (VIIIa) согласно описанному выше процессу с получением соединений формулы (XX) где Hal обозначает атом галогена и Хb обозначает атом кислорода, когда Yb обозначает атом кислорода иобозначает простую связь,или Хb обозначает группу -СН=СН-, где Yb обозначает СН-группу иобозначает двойную связь,эти соединения формулы (II/1) подвергают взаимодействию с (EtO)2POCH2CN с получением соединений формулы (II/2) где Hal, Xb и Yb имеют указанные выше значения, эти соединения формулы (II/2) сначала подвергают воздействию восстановителя, обычного в области органической химии, а затем восстанавливают с помощью NaNH2 с получением соединений формулы (II/3) где Хb и Yb имеют указанные выше значения,эти соединения формулы (II/3) могут быть обработаны в таких же условиях, которые описаны для соединений формулы (Va),либо соединением формулы (VI), затем(VIIIa) или (VIIIb), а затем (VIIIc) с получением последовательно соединений формул (I/3a),(I/3b) или (I/3c) где Xb, Yb, T, R'1 и R'2 имеют указанные выше значения,либо соединением формулы (IX), затем образовавшийся продукт обрабатывают аналогично тому, как описано для соединений формул (X) и (XI), далее подвергают последовательному воздействию соединения формулы(XIII), а затем (XV) согласно описанному выше процессу с получением соединений формулы где Хb, Yb, n1, R1 и R2 имеют указанные выше значения, эти соединения формул (I/a)-(I/o) и(I/3a)-(I/3d) представляют собой всю совокупность соединений по изобретению, и они могут быть очищены при необходимости с помощью общепринятого метода очистки, могут быть разделены на их различные изомеры при необходимости с помощью общепринятого метода разделения и при необходимости превращены в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (II/1), (III), (VI),(VIIIa), (VIIIb), (VIIIc) (IX), (XIII), (XV) и (XVI) либо являются известными продуктами, либо представляют собой продукты, которые могут быть получены из известных соединений с помощью обычных методов органической химии. Соединения по настоящему изобретению являются ингибиторами повторного проникновения серотонина, норадреналина и дофамина. Они могут применяться в качестве лекарственных средств при лечении депрессии, приступов паники, обсессивно-компульсивных состояний,фобий, нарушений импульсивного контроля,злоупотребления лекарственными средствами,состояния тревоги, ожирения и булимии. Настоящее изобретение относится также к фармацевтическим композициям, включающим в качестве действующего вещества по меньшей мере одно соединение формулы (I), его оптический изомер или его аддитивную соль с фармацевтически приемлемой кислотой или основанием индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными, нетоксичными эксципиентами или носителями. Из фармацевтических композиций по изобретению, которые следует упомянуть, прежде всего следует отметить композиции, пригодные 14 для перорального, парентерального (внутривенного, внутримышечного или подкожного), перили транскожного, назального, ректального,внутриязычного, глазного или респираторного введения, и прежде всего таблетки или драже,таблетки для сублингвального применения, желатиновые капсулы с мягким покрытием, желатиновые капсулы с твердым покрытием, суппозитории, кремы, мази, кожные гели, композиции для инъекций или для питья, аэрозоли, капли глазные или для носа и т.д. Приемлемая доза варьируется в зависимости от возраста и веса пациента, пути введения,природы и серьезности нарушения и применения возможных сопутствующих лечений и находится в диапазоне от 0,5 до 25 мг, и она может вводиться в виде одной или нескольких доз в день. Приведенные ниже примеры служат для иллюстрации изобретения и никоим образом не направлены на ограничение его объема. Применяемые исходные продукты являются известными или могут быть получены с использованием известных методов. Синтез промежуточных продуктов, предназначенных для получения соединений по изобретению, может быть осуществлен с помощью различных примеров получения. Строение описанных в примерах соединений определяли с помощью обычных спектрофотометрических методов (инфракрасная спектроскопия, ядерный магнитный резонанс, массспектрометрия и т.д.). Температуры плавления определяли с помощью нагревательной плиты Кофлера (К.) или с помощью нагревательной плиты, которую обследовали под микроскопом (М.K.). Когда соединение существует в форме соли, температура плавления соответствует температуре плавления соли. Только с информационной целью ниже приведена нумерация для различных трициклических систем. Пример получения 1. 6-Циан-1-метилсульфонил-5,6-дигидроциклобута[f]индол. Стадия 1. 1-Циан-5-[(2,2-диметоксиэтил) амино]бензоциклобутан. К суспензии, содержащей 13,5 г 1-циан-5 аминобензоциклобутана в 400 мл 1,2-дихлорэтана, добавляют быстро по каплям 26,5 мл 45%ного раствора 2,2-диметоксиацетальдегида в метил-трет-бутиловом эфире, затем 16 мл уксусной кислоты и, наконец, порциями 39,7 г 15 триацетоксиборогидрида натрия. После повышения температуры до 29 С смесь снова охлаждают до комнатной температуры и затем перемешивают в течение 1 ч 15 мин и подвергают гидролизу, сливая на 500 мл водного насыщенного раствора бикарбоната натрия. Органическую фазу отделяют, промывают водой и концентрируют при пониженном давлении, получая требуемый продукт с количественным выходом. Стадия 2. 1-Циан-5-[(N-(2,2-диметоксиэтил)-N-метилсульфониламино]бензоциклобутан. Раствор, приготовленный с использованием 21,6 г продукта, полученного на предыдущей стадии 1, 58 мл пиридина и 225 мл дихлорметана, охлаждают до 0 С. В течение 20 мин по каплям добавляют 10,8 мл мезилхлорида и продолжают перемешивание еще в течение 40 мин при 0 С, а затем в течение 20 ч при комнатной температуре. После этого реакционную смесь сливают на 40 мл водного насыщенного раствора бикарбоната натрия. После сливания водную фазу экстрагируют дважды, используя каждый раз по 150 мл метиленхлорида. Объединенные органические фазы промывают 1 н. соляной кислотой, сушат и концентрируют, получая ожидаемый продукт с количественным выходом. Стадия 3. 6-Циан-1-метилсульфонил-5,6 дигидроциклобута[f]индол. Раствор, содержащий 10,9 мл хлорида титана в 450 мл толуола, и раствор 27,9 г полученного на стадии 2 продукта в 450 мл толуола,одновременно сливают при температуре дефлегмации в течение 1 ч 15 мин на 2,1 л толуола. После завершения добавления температуре дают опуститься до 40 С и смесь сливают на 1,8 л водного насыщенного раствора бикарбоната натрия. После сливания водную фазу экстрагируют толуолом, органические фазы объединяют,сушат и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (дихлорметан/циклогексан: 75/25), получая ожидаемый продукт и его региоизомер.tпл: 142-144C (M.K.). Пример получения 2. 6-Циано-5,6-дигидроциклобута[f]индол. 2,6 г продукта, полученного согласно процессу, описанному в примере получения 1, вносят в раствор, содержащий 7,7 г гидроксида калия в 190 мл метанола. После выдерживания в течение 12 ч при температуре дефлегмации метанол удаляют путем выпаривания и остаток растворяют в простом эфире. После промывки органическую фазу сушат и концентрируют,получая ожидаемый продукт. 16 ют порциями в течение 5 мин 3,84 г цианборогидрида натрия. После нагрева до комнатной температуры продолжают перемешивание в течение 2 ч, после чего реакционную смесь охлаждают до 0 С и доводят значение рН до 11 путем добавления раствора гидроксида натрия (45 г в 250 мл воды). Полученный мутный раствор экстрагируют простым эфиром. Органические фазы промывают, сушат и концентрируют, получая ожидаемый продукт в виде твердого вещества белого цвета.tпл: 85-87 С (М.K.). Пример получения 4. 4-Циан-1-метилсульфонил-4,5-дигидроциклобута[е]индол. Региоизомер, полученный на стадии 3 примера получения 1, соответствует ожидаемому продукту.tпл: 118-120C (М.K.). Пример получения 5. 4-Циан-4,5-дигидроциклобута[е]индол. Продукт получают согласно процессу,описанному в примере получения 2, используя в качестве субстрата продукт, полученный в примере получения 4.tпл: 132-134C (М.K.). Пример получения 6. 4-Циан-2,3,4,5-тетрагидроциклобута[е]индол. Продукт получают согласно процессу,описанному в примере получения 3, используя в качестве субстрата продукт, полученный в примере получения 5. Пример получения 7. 5-Циан-5,6-дигидроциклобута[f]бензотиофен. Стадия 1. 1-Циан-4-тиометилбензоциклобутан. В 3,5 л жидкого аммиака, содержащего каталитические количества ферроцианида калия и моногидрата тринитрата железа, вносят при температуре дефлегмации в течение 2 ч 50,8 г натрия, а затем в течение 5 мин 153 г 3-(2-хлор 5-тиометилфенил)пропионитрила. Смеси дают взаимодействовать в течение 1 ч при -33 С и затем вносят 118,2 г твердого хлорида аммония. После удаления аммиака путем выпаривания остаток растворяют в простом эфире, отфильтровывают соли и фильтрат упаривают досуха,получая ожидаемый продукт. Стадия 2. 1-Циан-4-метилсульфинилбензоциклобутан. 11 г полученного на стадии 1 продукта растворяют в 70 мл дихлорметана. На охлажденный до -5 С раствор сливают раствор, содержащий 15,8 г метахлорпербензойной кислоты в 80 мл дихлорметана. После перемешивания в течение 10 мин реакционную смесь сливают на 100 мл воды и 100 мл 1 н. раствора гидроксида натрия. Осуществляют сливание и водную фазу экстрагируют еще 1 раз дихлорметаном. Объединенные органические фазы промывают бисульфатом натрия, а затем 1 н. раствором гидроксида натрия, бикарбонатом натрия и, в завершение, водой до получения нейтрального 17 нейтрального значения рН. Органическую фазу сушат и концентрируют, получая ожидаемый продукт. Стадия 3. 1-Циан-4-меркаптобензоциклобутан. К раствору, содержащему 11 г полученного на предыдущей стадии продукта в 100 мл дихлорметана, добавляют 9,76 мл трифторуксусной кислоты, растворенной в 20 мл дихлорметана. Добавление осуществляют в течение 45 мин, в течение этого периода времени температуру поддерживают на уровне 25 С. Реакционную смесь перемешивают еще в течение 1 ч 30 мин при этой температуре и затем упаривают досуха. Остаток растворяют при перемешивании в течение 10 мин в смеси триэтиламина и метанола (50/50). После упаривания остаток разбавляют дихлорметаном, промывают насыщенным раствором хлорида аммония и затем водой, сушат и концентрируют, получая ожидаемый продукт в виде масла. Стадия 4. 1-Циан-4-(2,2-диэтоксиэтилсульфанил)бензоциклобутан. К раствору, содержащему 9,1 г полученного на предыдущей стадии 3 продукта в 20 мл тетрагидрофурана и 140 мл этанола, добавляют по порциям при 20 С 3,65 г борогидрида натрия. После выдерживания в течение 1 ч при 50 С добавляют еще 2,14 г борогидрида натрия. Затем реакционную смесь нагревают до 80 С и при этой температуре сливают на нее в течение 1 ч 39 мл диэтилацеталя бромацетальдегида. Смесь выдерживают при этой температуре еще в течение 12 ч, после чего охлажденную реакционную смесь сливают на 1 л ледяной воды. Образовавшуюся смесь экстрагируют простым эфиром и органическую фазу промывают 10%-ным раствором бикарбоната натрия, а затем водой. Эфирную фазу сушат и концентрируют в вакууме, получая ожидаемый продукт в виде масла. Стадия 5. 5-Циан-5,6-дигидроциклобута[f] бензотиофен. 10 г полифосфорной кислоты и 8,5 г полученного на предыдущей стадии 4 продукта в 500 мл хлорбензола выдерживают при 130 С в течение 4 ч. После охлаждения удаляют супернатант и остаток промывают дихлорметаном. Супернатант и дихлорметановую фазу объединяют и нейтрализуют путем добавления порошкообразного бикарбоната натрия. После перемешивания в течение 15 мин осуществляют фильтрацию,после чего раствор упаривают досуха. Остаток очищают с помощью хроматографии на силикагеле (циклогексан/дихлорметан: 50/50), получая ожидаемый продукт и побочный продукт.tпл: 102-103 С (М.K.). Пример получения 8. 6-Циан-5,6-дигидроциклобута[f]бензотиофен. Продукт получают согласно процессу,описанному в примере получения 7, стадии 1-5,но используя на стадии 1 3-(3-бром-4-тиоме 004473 18 тилфенил)пропионитрил вместо 3-(2-хлор-5 тиометилфенил)пропионитрила. Пример получения 9. 5-Циан-5,6-дигидроциклобута[f]бензофуран. Стадия 1. 1-Циан-4-(2,2-диэтоксиэтокси) бензоциклобутан. Раствор, содержащий 16,5 г 1-циан-4 гидроксибензоциклобутана в 205 мл диметилформамида, сливают на суспензию, содержащую 67,8 ммоля гидрида натрия в 160 мл диметилформамида. Реакционную смесь перемешивают в течение 30 мин и затем в течение 15 мин добавляют раствор, содержащий 10,2 мл 1 бром-2,2-диэтоксиэтана в 40 мл, и температуру поддерживают на уровне 60 С в течение 6 ч. Смесь перемешивают еще в течение 12 ч, после чего диметилформамид удаляют выпариванием и остаток растворяют в воде, экстрагируют дихлорметаном, сушат и концентрируют в вакууме. Остаток хроматографируют на силикагеле(CH2Cl2/AcOEt: 95/5), выделяя ожидаемый продукт. Стадия 2. 5-Циан-5,6-дигидроциклобута[f] бензофуран. Продукт получают согласно процессу, описанному для стадии 3 в примере получения 1, но используя продукт, полученный на стадии 1. С помощью хроматографии на силикагеле(СН 2 Сl2/циклогексан: 80/20) выделяют ожидаемый продукт и побочный продукт. Пример получения 10. 6-Циано-5,6-дигидроциклобута[f]бензофуран. Продукт получают согласно процессу,описанному в примере получения 9, но используя на стадии 1 1-циан-5-гидроксибензоциклобутан, а на стадии 2 используя в качестве элюента смесь СН 2 Сl2/циклогексан: 75/25 для разделения региоизомеров. Ожидаемый продукт выделяют в виде масла. Пример получения 11. 5-Циан-4,5-дигидроциклобута[е]бензотиофен. Побочный продукт, полученный на стадии 5 примера получения 7, соответствует ожидаемому продукту. Пример получения 12. 4-Циан-4,5-дигидроциклобута[е]бензотиофен. Продукт получают на стадии 5 примера получения 8. Пример получения 13. 5-Циан-4,5-дигидроциклобута[е]бензотиофен. Побочный продукт, полученный на стадии 2 примера получения 9, соответствует ожидаемому продукту. Пример получения 14. 4-Циан-4,5-дигидроциклобута[е][1,3]бензофуран. Побочный продукт, выделенный с помощью хроматографии согласно методу, описанному в примере получения 10, соответствует ожидаемому продукту. Пример получения 15. 5,6-Дигидроциклобута[f]бензодиоксол-5-карбонитрил. 19 46 г 3-(6-бром-1,3-бензодиоксол-5-ил)пропаннитрила вносят по порциям в 1,4 л жидкого аммиака, в котором растворяют азид натрия,который предварительно получают путем внесения 16,7 г натрия в жидкий аммиак. После взаимодействия в течение 30 мин реакционную смесь обрабатывают 38,7 г хлорида аммония,после чего аммиак отгоняют при комнатной температуре. Остаток растворяют в простом эфире и фильтруют; осадок промывают простым эфиром. Объединенные эфирные фазы упаривают и образовавшийся остаток перекристаллизовывают из изопропилового спирта, выделяя ожидаемый продукт.tпл: 91C (M.K.) Пример получения 16. 6,7-Дигидроциклобута[g][1]бензофуран-7-карбонитрил. Стадия 1. 1-Циан-6-(2,2-диэтоксиэтокси) бензоциклобутан. Продукт получают согласно методу, описанному для стадии 1 примера получения 9, используя в качестве субстрата 1-циан-6 гидроксибензоциклобутан. Стадия 2. 6,7-дигидроциклобута[g][1]бензофуран-7-карбонитрил. Продукт получают согласно методу, описанному для стадии 3 примера получения 9, используя в качестве субстрата продукт, полученный на предыдущей стадии 1. Пример получения 17. 1,2-Дигидроциклобута[b]нафталин-1-карбонитрил. Продукт получают согласно методу, описанному для примера получения 15, используя в качестве субстрата 3-(3-йод-2-нафтил)пропионнитрил.tпл: 98-102 С (M.K.) Пример получения 18. 1,2-Дигидроциклобута[а]нафталин-1-карбонитрил. Стадия 1. 1,1-Диэтокси-1,2-дигидроциклобута[а]нафталин. 9,4 г амида натрия вносят в 350 мл тетрагидрофурана. На эту смесь сливают последовательно 25,9 г 1-бромнафталина и 28 г свежеприготовленного 161-диэтоксиэтилена. Реакционную смесь выдерживают при температуре дефлегмации в течение 16 ч и затем растворяют в воде и простом эфире. После промывки органической фазы до достижения нейтрального значения рН и сушки выделяют ожидаемый продукт и хроматографируют на силикагеле (дихлорметан/циклогексан: 1/1). Стадия 2. Циклобута[а]нафталин-1-(2 Н)он. 10 г продукта, полученного на стадии 1,обрабатывают при комнатной температуре 42 мл 1 н. соляной кислотой, растворенной в 170 мл тетрагидрофурана. После взаимодействия в течение 1 ч 30 мин растворитель концентрируют и остаток сливают на 170 мл воды. После этого выделяют 6,9 г твердого вещества, соответствующего ожидаемому продукту. 20 Стадия 3. 1,2-Дигидроциклобута[a]нафталин-1-ол. К суспензии, содержащей 5,2 г продукта,полученного на стадии 2, в 150 мл метанола,добавляют при 0-5 С 1,4 г борогидрида натрия. После выдерживания при этой температуре в течение 15 мин и затем в течение 1 ч при комнатной температуре реакционную смесь сливают на 300 г льда и экстрагируют дихлорметаном. Путем стандартной обработки выделяют 5,2 г ожидаемого продукта.tпл: 96-100 С (М.K.) Стадия 4. 1,2-Дигидроциклобута[а]нафталин-1-карбонитрил. 5,1 г продукта, полученного на стадии 3,14,2 г трифенилфосфина и 12 г четырехбромистого углерода в 150 мл простого эфира кипятят с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь фильтруют,концентрируют, растворяют в простом эфире,фильтруют и упаривают. 7,85 г образовавшегося остатка обрабатывают 10,5 г цианида тетрабутиламмония в 150 мл тетрагидрофурана. После взаимодействия в течение 64 ч при комнатной температуре реакционную смесь концентрируют и растворяют в смеси лед-простой эфир. После декантирования выделяют продукт в виде масла, который очищают с помощью хроматографии на силикагеле (дихлорметан), выделяя ожидаемый продукт.tпл: 78-84C. Пример получения 19. 1-(Метилсульфонил)-5,6-дигидро-1 Н-циклобута[f]индол-5-карбонитрил. Продукт получают согласно процессу,описанному для стадий 1-3 в примере получения 1, используя на стадии 1 4-амино-1-цианбензоциклобутан.tпл: 164-168 С (М.K.). Пример получения 20. 5,6-Дигидро-1 Нциклобута[f]индол-5-карбонитрил. Продукт получают согласно процессу,описанному в примере получения 2, используя в качестве субстрата продукт, полученный в примере получения 19.tпл: 109-113 С (М.K.). Пример получения 21. 2,3,5,6-Тетрагидро 1 Н-циклобута[f]индол-5-карбонитрил. Продукт получают согласно процессу,описанному в примере получения 3, используя в качестве субстрата продукт, полученный в примере получения 20.tпл: 100-105C (М.K.). Пример 1. 1-[6-(Аминометил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил]циклогексанол. Стадия А. 6-(1-Гидроксициклогексил)2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-карбонитрил. 4,1 г продукта, полученного в примере получения 3, растворяют в 215 мл тетрагидрофурана. Реакционную смесь охлаждают до -80 С и 21 добавляют 19,25 мл 2,5 М раствора нбутиллития в гексане. После завершения добавления перемешивание продолжают еще в течение 20 мин и затем на смесь сливают в течение 3 мин 6,2 мл циклогексанона. После взаимодействия в течение 2 ч при 80 С реакционной смеси дают нагреться до комнатной температуры и вносят 23 мл водного насыщенного раствора хлорида аммония, а затем 135 мл воды. После сливания органическую фазу промывают насыщенным раствором хлорида натрия, сушат и концентрируют. Образовавшийся остаток отверждают простым изопропиловым эфиром и фильтруют, получая требуемый продукт, а фильтрат очищают с помощью хроматографии на силикагеле (CH2Cl2/AcOEt: 90/10), выделяя дополнительное количество ожидаемого продукта.tпл: 168-170 С. Стадия Б. 1-[6-(Аминометил)-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил]циклогексанол. 4 г полученного на предыдущей стадии А продукта растворяют в 200 мл 3,6 н. раствора аммиака в метаноле, содержащем 2 мл никеля Ренея. Реакционную смесь гидрируют в течение 24 ч при 60 С при давлении 30 бар. После фильтрации и удаления растворителя выпариванием остаток растворяют в дихлорметане, промывают водой до получения нейтрального значения рН, сушат и концентрируют, выделяя ожидаемый продукт в виде масла. Пример 2. 1-6-[(Диметиламино)метил]-1 метил-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-илциклогексанол. 659 мг продукта, полученного в примере 1,растворяют в 20 мл ацетонитрила. В этот охлажденный до 0 С раствор вносят 608 мг цианборогидрида натрия и 1,5 мл 37%-ного раствора формальдегида в воде, поддерживая температуру на уровне 0 С. После выдерживания реакционной смеси в течение 20 ч при комнатной температуре смесь гидролизуют с помощью 33 мл 1 н. соляной кислоты и затем перемешивают в течение 3 ч. Реакционную смесь промывают 30 мл простого эфира и затем подщелачивают, используя 20%-ный раствор гидроксида натрия. Водную фазу экстрагируют дихлорметаном. После сушки и упаривания остаток очищают хроматографией на силикагеле (CH2Cl2/EtOH: 95/5), получая ожидаемый продукт.tпл: 121-124C (M.K.) Пример 3. 1-6-[(Диметиламино)метил]2,3,5,6-тетрагидро-1H-циклобута[f]индол-6-ил циклогексанол. Стадия А. 6-(1-Гидроксициклогексил)-1(метилсульфонил)-2,3,5,6-тетрагидро-1H-циклобута[f]индол-6-карбонитрил. Продукт получают согласно процессу,описанному для стадии 2 примера получения 1,используя продукт, полученный на стадии А примера 1. Ожидаемый продукт выделяют пу 004473 22 тем отверждения из простого эфира в виде твердого вещества фиолетового цвета.tпл: 174-176C. Стадия Б. 1-[6-(Аминометил)-1-(метилсульфонил)-2,3,5,6-тетрагидро-1 Н-циклобута[f] индол-6-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадии Б примера 1, но используя продукт, полученный выше на стадии А. Ожидаемый продукт получают в виде пенообразной застывшей массы желтого цвета. Стадия В. 1-[6-(Диметиламино)метил]-1(метилсульфонил)-2,3,5,6-тетрагидро-1 Нциклобута[f]индол-6-ил]циклогексанол. Продукт получают согласно процессу,описанному в примере 2, но используя продукт,полученный выше на стадии Б. Ожидаемый продукт получают в виде твердого вещества желтого цвета.tпл: 156-158 С (М.K.). Стадия Г. 1-6-[(Диметиламино)метил]2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил циклогексанол. В трехгорлую колбу вносят 40 мл жидкого аммиака, а затем 380 мг полученного на стадии В продукта, растворенного в 10 мл тетрагидрофурана. Смесь охлаждают до -50 С и в реакционную смесь вносят в виде нескольких порций 100 мг натрия. После взаимодействия в течение 15 мин по порциям добавляют 430 мг порошкообразного хлорида аммония. Реакционной смеси дают нагреться до комнатной температуры. После удаления всего аммиака путем выпаривания остаток растворяют в воде, экстрагируют простым эфиром, сушат и концентрируют, получая ожидаемый продукт.tпл: 159-161 С (М.K.). Пример 4. 1-[5-(Аминометил)-5,6-дигидроциклобута[f][1]бензофуран-5-ил]циклогексанол. Стадия А. 5-(1-Гидроксициклогексил)-5,6 дигидроциклобута[f][1]бензофуран-5-карбонитрил. Продукт получают согласно процессу,описанному для стадии А примера 1, но используя продукт, полученный в примере получения 9, и осуществляя гидролиз реакционной смеси при -75 С. Ожидаемый продукт получают в виде твердого вещества.tпл: 154-158C (М.K.). Стадия Б. 1-[5-(Аминометил)-5,6-дигидроциклобута[f][1]бензофуран-5-ил]циклогексанол. Раствор, содержащий 520 мг полученного на стадии А продукта в 10 мл тетрагидрофурана, добавляют по каплям при 0 С при продувании азотом к суспензии, содержащей 177 мг алюмогидрида натрия в 10 мл простого эфира. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем подвергают гидролизу, добавляя 0,26 мл воды, 0,79 мл 20%-ного раствора гидроксида натрия и 1,05 мл воды. После перемешивания в течение 15 мин 23 при комнатной температуре осуществляют фильтрацию, а затем выпаривание досуха. Ожидаемый продукт получают в виде клейкой пенообразной застывшей массы. Пример 5. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензофуран-5-ил циклогексанол. 400 мг полученного в примере 4 продукта растворяют в 12 мл ацетонитрила. После охлаждения до 0 С последовательно добавляют 0,55 мл 37%-ного раствора формальдегида в воде и 185 мг цианборогидрида натрия. После выдерживания в течение 1 ч при 0 С и с течение 2 ч при комнатной температуре снова добавляют 0,55 мл 37%-ного раствора формальдегида в воде и 185 мг цианборогидрида натрия и продолжают перемешивание еще в течение 12 ч при 20 С. Осуществляют гидролиз при комнатной температуре с использованием 22,3 мл соляной кислоты (1 н.) и смесь перемешивают в течение 1 ч, подщелачивают при 0 С с помощью 20%ного раствора гидроксида натрия, экстрагируют дихлорметаном, промывают водой и концентрируют. С помощью хроматографии на силикагеле (CH2Cl2/EtOH: 90/10) выделяют ожидаемый продукт в виде кристаллов белого цвета.tпл: 127-136 С (М.K.). Пример 6. 1-[5-(Аминометил)-5,6-дигидроциклобута[f][1]бензотиен-5-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, но используя продукт, полученный на стадии А примера получения 7. Пример 7. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензотиен-5-илциклогексанол. Продукт получают согласно процессу,описанному в примере 5, используя в качестве субстрата продукт, полученный в примере 6.tпл: 151-155C (М.K.). Пример 8. 1-6-[(Диметиламино)метил]-1 метил-5,6-дигидро-1 Н-циклобута[f]индол-6-ил циклогексанол. В 15 мл толуола вносят 0,44 г продукта,полученного в примере 1, и 1,23 г диоксида марганца. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и затем снова добавляют 0,6 г диоксида марганца и продолжают перемешивание еще в течение 24 ч. После фильтрации через целит и удаления выпариванием растворителя остаток очищают экспресс-хроматографией на силикагеле 24 Продукт получают согласно процессу,описанному для стадии А примера 1, но используя вместо продукта, полученного в примере получения 6, продукт, полученный в примере получения 3. Стадия Б. 1-7-[(Диметиламино)метил]2,3,6,7-тетрагидро-1 Н-циклобута[е]индол-7-ил циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Г примера 3, но используя на стадии А указанного примера продукт, полученный выше на стадии А. Пример 10. 1-[6-(Аминометил)-5,6-дигидроциклобута[f][1]бензотиен-6-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 8. Пример 11. 1-[6-(Аминометил)-5,6-дигидроциклобута[f][1]бензофуран-6-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 10. Пример 12. 1-6-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензофуран-6-ил циклогексанол. Продукт получают согласно процессу,описанному в примере 4, используя в качестве субстрата соединение из примера 11. Пример 13. 1-[6-(Аминометил)-6,7-дигидроциклобута[е][1]бензотиен-6-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 11. Пример 14. 1-[7-(Аминометил)-6,7-дигидроциклобута[е][1]бензотиен-7-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 12. Пример 15. 1-[6-(Аминометил)-6,7-дигидроциклобута[е][1]бензофуран-6-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 13. Пример 16. 1-[7-(Аминометил)-6,7-дигидроциклобута[е][1]бензофуран-7-ил]циклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата соединение из примера получения 14. 25 Пример 17. 1-6-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензотиен-6-илциклогексанол. Продукт получают согласно процессу,описанному в примере 2, используя в качестве субстрата соединение из примера 10.tпл: 161-166 С (М.K.). Пример 18. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1,3]бензодиоксол-5 илциклогексанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 1 и согласно процессу, описанному в примере 2, используя на стадии А примера 1 в качестве субстрата продукт из примера получения 15 вместо продукта из примера получения 3.tпл: 94-96C (М.K.). Пример 19. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензофуран-5-ил циклопентанол и его гидрохлорид. Продукт получают согласно процессу,описанному для стадий А-Б примера 4 и затем согласно процессу, описанному в примере 5,используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона. Свободное основание превращают в гидрохлорид путем обработки эфирным раствором хлористого водорода.tпл: 258-262 С (М.K.). Пример 20. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1,3]бензодиоксол-5 илциклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4 и затем согласно процессу, описанному в примере 5,используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 15 вместо продукта из примера получения 9.tпл: 71-74 С (М.K.). Пример 21. 1-[5-(Аминометил)-5,6-дигидроциклобута[f][1]бензотиен-5-ил]циклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 7 вместо продукта из примера получения 9.tпл: 149-153C (М.K.). Пример 22. 1-5-[(Метиламино)метил]-5,6 дигидроциклобута[f][1]бензотиен-5-илциклопентанол. Раствор, содержащий 0,29 мл этилхлорформиата в 40 мл дихлорметана, вносят при 0 С в смесь, содержащую 1 г продукта из примера 21, 1,2 мл триэтиламина и 60 мл дихлорметана. После нагрева снова до комнатной температуры реакционную смесь промывают 0,1 н. соляной кислотой, а затем насыщенным раствором бикарбоната натрия, сушат и выпаривают. Образовавшийся остаток растворяют в 20 мл тетрагид 004473 26 рофурана. Раствор добавляют к смеси, содержащей 1,3 г AlLiH4 в 60 мл тетрагидрофурана. Реакционную смесь кипятят с обратным холодильником в течение 3 ч и затем подвергают гидролизу, используя 0,65 мл воды, 0,45 мл 20%-ного раствора гидроксида натрия и 2,1 мл воды. После фильтрации и концентрирования остаток очищают с помощью хроматографии на силикагеле (дихлорметан/этанол/NН 4OН: 95/5/0,5) и перекристаллизовывают из изопропилового эфира, получая ожидаемый продукт.tпл: 166-169 С (М.K.). Пример 23. 1-5-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол. Продукт получают согласно процессу,описанному в примере 5, но используя продукт из примера 21 вместо продукта из примера 4.tпл: 93-98 С (М.K.). Пример 24. (+)-1-5-[(Диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил циклопентанол. Продукт, полученный в примере 23, вносят в хиральную колонку, используя в качестве подвижной фазы метанол/диэтиламин (1000/1). Первый из элюированных продуктов соответствует (+)-изомеру.tпл: 122-126C (М.K.). Пример 25. (-)-1-5-[(Диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-ил циклопентанол. Продукт, полученный в примере 23, вносят в хиральную колонку, используя в качестве подвижной фазы метанол/диэтиламин (1000/1). Второй из элюированных продуктов соответствует (-)-изомеру.tпл: 123-127C (М.K.). Пример 26. 1-[6-(Аминометил)-5,6-дигидроциклобута[f][1]бензотиен-6-ил]циклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 8 вместо продукта из примера получения 9.tпл: 71-74C (М.K.). Пример 27. 1-6-[(Метиламино)метил]-5,6 дигидроциклобута[f][1]бензотиен-6-илциклопентанол. Продукт получают согласно процессу,описанному в примере 22, используя продукт из примера 26 вместо продукта из примера 21.tпл: 117-120 С (М.K.). Пример 28. 1-6-[(Диметиламино)метил]5,6-дигидpоциклобута[f][1]бензотиен-6-илциклопентанол. Продукт получают согласно процессу,описанному в примере 5, используя продукт из примера 26 вместо продукта из примера 4. 27 Пример 29. 1-6-[(Диметиламино)метил]1-метил-5,6-дигидро-1 Н-циклобута[f]индол-6 илциклопентанол. Продукт получают, осуществляя последовательно процессы, описанные в примерах 1, 2 и 8, и используя на стадии А примера 1 циклопентанон вместо циклогексанона.tпл: 108-111C (М.K.). Пример 30. 1-5-[(Диметиламино)метил]1-метил-5,6-дигидро-1 Н-циклобута[f]индол-5 илциклопентанол. Продукт получают, осуществляя последовательно процессы, описанные в примерах 1, 2 и 8, и используя на стадии А примера 1 циклопентанон вместо циклогексанона и используя продукт из примера получения 21 вместо продукта из примера получения 3.tпл: 100-104 С (М.K.). Пример 31. 1-7-[(Диметиламино)метил]6,7-дигидроциклобута[g][1]бензофуран-7-ил циклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4 и затем согласно процессу, описанному в примере 5,используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 16 вместо продукта из примера получения 9.tпл: 135-137C (М.K.). Пример 32. 1-6-[(Диметиламино)метил]5,6-дигидроциклобута[f][1]бензофуран-6-ил циклопентанол и его гидрохлорид. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, и затем согласно процессу, описанному в примере 5,используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 10 вместо продукта из примера получения 9. Гидрохлорид получают путем обработки эфирным раствором хлористого водорода.tпл (гидрохлорид): 225-235 С (М.K.). Пример 33. 1-6-[(Диметиламино)метил]2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-ил циклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 3, используя на стадии А примера 1 в качестве исходного продукта циклопентанон вместо циклогексанона.tпл: 105-108 С (М.K.). Пример 34. 1-6-[(Диметиламино)метил]5,6-дигидро-1 Н-циклобута[f]индол-6-илциклопентанол. Продукт получают согласно процессу,описанному в примере 8, используя продукт из примера 33 в качестве субстрата. 28 Продукт получают согласно процессу,описанному для стадий А-Б примера 4 и затем согласно процессу, описанному в примере 5,используя на стадии А в качестве субстрата циклопентанон вместо циклогексанона и используя продукт из примера получения 17 вместо продукта из примера получения 9.tпл: 133-135C (М.K.). Пример 36. 1-7-[(Диметиламино)метил]6,7-дигидро-3 Н-циклобута[е]индол-7-илциклопентанол. Продукт получают согласно процессу,описанному для стадий А-Г примера 3, и затем согласно процессу, описанному в примере 8,используя на стадии А примера 3 продукт, полученный на стадии А примера 1, и, с одной стороны, используя продукт из примера получения 9, а, с другой стороны, используя циклопентанон.tпл: 200-204 С (М.K.). Пример 37. 1-1-[(Диметиламино)метил]1,2-дигидроциклобута[а]нафталин-1-илциклопентанол и его гидрохлорид. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, и затем согласно процессу, описанному в примере 5,используя в качестве субстрата на стадии А циклопентанон вместо циклогексанона и используя продукт из примера получения 18 вместо продукта из примера получения 9. Гидрохлорид получают обработкой эфирным раствором хлористого водорода.tпл (гидрохлорид): 258-262 С (М.K.). Пример 38. 1-(7-[2S)-2,3-Дигидро-1,4 бензодиоксин-2-илметил)амино]метил-6,7-дигидроциклобута[g][1]бензофуран-7-ил)циклопентанол и его гидрохлорид. Стадия А. 1-[7-(Аминометил)-6,7-дигидроциклобута[g][1]бензофуран-7-илциклопентанол. Продукт получают согласно процессу,описанному для стадий А-Б примера 4, используя в качестве субстрата на стадии А циклопентанон вместо циклогексанона и используя продукт из примера получения 16 вместо продукта из примера получения 9. Стадия Б. (2R)-N-[7-(1-Гидроксициклопентил)-6,7-дигидроциклобутa[g][1]-бензофуран-7-ил]метил-2,3-дигидро-1,4-бензодиоксин 2-карбоксамид. К раствору, содержащему 900 мг полученного на стадии А соединения в 30 мл дихлорметана и 1,2 мл диизопропилэтиламина, добавляют при 0 С раствор, содержащий 762 мг хлорангидрида (2R)-2,3-дигидробензо[1,4]диок-син 2-илкарбоновой кислоты. После выдерживания в течение 48 ч при комнатной температуре реакционную смесь разбавляют водой и экстрагируют дихлорметаном. После упаривания при пониженном давлении и последующей стандартной обработки выделяют ожидаемый продукт в виде пенообразной застывшей массы. 29 Стадия В. 1-(7-[2S)-2,3-Дигидро-1,4 бензодиоксин-2-илметил)амино]метил-6,7 дигидроциклобута[g][1]бензофуран-7-ил)циклопентанол и его гидрохлорид. 500 мг алюмогидрида лития в 20 мл тетрагидрофурана кипятят с обратным холодильником и затем добавляют 1,1 г полученного на стадии Б продукта, растворенного в 20 мл тетрагидрофурана. После выдерживания в течение 3 ч 30 мин при температуре дефлегмации реакционную смесь гидролизуют путем добавления 0,45 мл воды, 0,31 мл 20%-ного раствора гидроксида натрия и 1,67 мл воды. После фильтрации и упаривания с помощью хроматографии на силикагеле (дихлорметан/этанол: 98/2) выделяют ожидаемый продукт, который превращают в гидрохлорид путем обработки эфирным раствором хлористого водорода.tпл (гидрохлорид): 213-235 С (М.K.). Пример 39. 1-(5-[2R)-2,3-Дигидро-1,4 бензодиоксин-2-илметил)амино]метил-5,6-дигидроциклобута[f][1,3]бензодиоксол-5-ил)циклопентанол и его гидрохлорид. Продукт получают согласно процессу,описанному для стадий А-В примера 38, используя на стадии А продукт из примера получения 15 и используя на стадии Б хлорангидридtпл (гидрохлорид): 109-119 С (М.K.). Пример 40. 1-(1-2-(5-Фтор-1 Н-индол-3 ил)этил](метил)амино]метил-1,2-дигидроциклобута[b]нафталин-1-ил)циклопентанол. Стадия А. 1-[(Метил)амино]метил-1,2 дигидроциклобута[b]нафталин-1-ил)циклопентанол. Продукт получают согласно процессу,описанному в примере 22, используя в качестве субстрата 1-[1-(аминометил)-1,2-дигидроциклобута[b]нафталин-1-ил)циклопентанол, который получают согласно процессу, описанному в примере получения 17. Стадия Б. 2-(5-Фтор-1 Н-индол-3-ил)-N-1(1-гидроксициклопентил)-1,2-дигидроциклобута[b]нафталин-1-ил]метил]-N-метилацетамид. 0,652 г (5-фториндол-3-ил)уксусной кислоты, растворенной в 30 мл дихлорметана, обрабатывают в течение 30 мин при комнатной температуре 0,61 г карбонилдиимидазола. На раствор сливают 0,95 г полученного на стадии А продукта, растворенного в 5 мл дихлорметана. После завершения реакции реакционную смесь растворяют в воде, декантируют, сушат и упаривают, получая ожидаемый продукт. Стадия В. 1-(1-2-(5-Фтор-1 Н-индол-3 ил)этил](метил)амино]метил-1,2-дигидроциклобута[b]нафталин-1-ил)циклопентанол. Продукт получают согласно процессу,описанному в примере 39, используя в качестве субстрата продукт, полученный на предыдущей стадии Б. 30 Фармакологическое изучение соединений по изобретению А. Опыты in vitro. Пример 41. Определение аффинности в отношении сайтов повторного проникновения серотонина. Аффинность определяют с помощью экспериментов по конкурентному связыванию с использованием [3 Н]-пароксетина (фирма NEN,Les Ulis, Франция). Мембраны получают из лобной коры крыс и инкубируют в трех повторностях в течение 2 ч при 25 С с 1,0 нМ [3H]пароксетином и холодным лигандом в конечном объеме 0,4 мл. Буфер для инкубации содержит 50 нМ Трис-НСl (рН 7,4), 120 мМ NaCl и 5 мМ КСl. Неспецифическое связывание определяют с использованием 10 мкМ циталопрама. В конце периода инкубации среду для инкубации фильтруют и трижды промывают 5 мл охлажденного буфера. Радиоактивность, сохранившуюся на фильтрах, определяют с помощью жидкостного сцинтилляционного счетчика. Изотермы связывания анализируют с использованием метода нелинейной регрессии, определяя значения IC50. Эти значения используют для определения константы диссоциации (Ki), используя уравнениеKi=IC50/(1+L/Kd) где L обозначает концентрацию [3 Н]пароксетина и Kd обозначает константу диссоциации [3 Н]-пароксетина для сайта повторного проникновения серотонина (0,13 нМ). Результаты выражают в виде рKi (-log Ki). Для соединений по изобретению обнаружена очень высокая аффинность в отношении сайта повторного проникновения серотонина,их значение рKi 7. Пример 42. Определение аффинности в отношении сайтов повторного проникновения норадреналина. Аффинность определяют с помощью экспериментов по конкурентному связыванию с использованием [3 Н]-низоксетина (фирма Amersham, les Ulis, Франция). Мембраны получают из лобной коры крыс и инкубируют в трех повторностях в течение 4 ч при 4 С с 2,0 нМ [3 Н]низоксетином и холодным лигандом в конечном объеме 0,5 мл. Буфер для инкубации содержит 50 мМ Трис-НСl (рН 7,4), 300 мМ NaCl и 5 мМ КСl. Неспецифическое связывание определяют с использованием 10 мкМ дезипрамина. В конце периода инкубации среду для инубации фильтруют и трижды промывают 5 мл охлажденного буфера для фильтрации (50 мМ Трис-HCl, рН 7,4, 300 мМ NaCl и 5 мМ KСl). Радиоактивность, сохранившуюся на фильтрах, определяют с помощью жидкостного сцинтилляционного счетчика. Изотермы связывания анализируют с использованием метода нелинейной регрессии,определяя значения IC50. Эти значения используют для определения константы диссоциацииKi=IC50/(1+L/Kd) где L обозначает концентрацию [3 Н]низоксетина и Kd обозначает константу диссоциации [3 Н]-низоксетина для сайта повторного проникновения норадреналина (1,23 нМ). Результаты выражают в виде рKi (-log Ki). Для соединений по изобретению значение рKi 6. Б. Опыты in vivo. Пример 43. Эксперимент по микродиализу,проведенный с использованием крыс. Крыс анестезируют пентобарбиталом (60 мг/кг i.p.). Их помещают в стереотаксическое устройство Копфа и проводник катетера имплантируют в поясной отдел лобной коры согласно следующим координатам, указанным в атласе Paxinos и Watson (1982): АР=+2,2;L=0,6; DV=-0,2. Крыс помещают в отдельные клетки и в течение 5 дней после этого не используют в опытах по диализу. В день проведения диализа зонд медленно опускают и закрепляют в определенном положении. Через зонд пропускают со скоростью потока 1 мкл/мин раствор, содержащий 147,2 мМ NaCl, 4 мМ KСl и 2,3 мМ СаСl2, значение рН которого доведено до 7,3 с помощью фосфатного буфера (0,1 М). Через 2 ч после имплантации начинают собирать образцы каждые 20 мин в течение 4 ч. До начала введения подлежащих тестированию продуктов получают три образца, которые служат для оценки фонового уровня. Крыс держат в отдельных клетках в течение всего времени эксперимента. После окончания эксперимента крыс обезглавливают и головной мозг выделяют и замораживают в изопентане. Делают срезы толщиной 100 мкм и окрашивают крезилом фиолетовым, который позволяет выявить положение зондов. Одновременно проводят количественное определение дофамина, норэпинефрина и серотонина следующим образом: каждый из полученных в результате диализа образцов объемом по 20 мкл разбавляют 20 мкл подвижной фазы (NаН 2 РO4, 75 мМ, ЭДТК, 20 мкМ, 1 декансульфонат, 1 мМ, метанол, 17,5%, триэтиламин, 0,01%, рН 5,70) и образцы объемом 33 мкл анализируют с помощью ЖХВР, используя колонку с обращенной фазой, температура термостата которой поддерживается на уровне 45,снабженную кулонометрическим детектором для количественного определения. Потенциал первого электрода детектора поддерживают на уровне -90 мВ (восстановление), а второго детектора на уровне +280 мВ (окисление). Подвижную фазу инъецируют со скоростью потока 2 мл/мин с помощью насоса. Пределы чувствительности метода для дофамина, норэпинефрина и серотонина составляют 0,55 фмолей/образец. Все продукты по изобретению инъецируют подкожно в объеме 1,0 мл/кг. Продукты растворяют в дистиллированной воде, к которой при необходимости добавляют несколько капель молочной кислоты. 32 Результаты В качестве примера и с целью иллюстрации активности продуктов по изобретению можно отметить, что соединение из примера 5 при введении подкожно в дозе 10 мг/кг повышает уровень серотонина на 25015%, норадреналина на 50013% и дофамина на 40050% (максимальное значение в % по сравнению с фоновым уровнем, который принят за 0%). Пример 44. Тест по закапыванию шариков мышами. Этот тест позволяет оценить способность фармакологических агентов ингибировать спонтанное поведение мышей по закапыванию шариков, ингибирование может быть предсказано,исходя из антидепрессантного и/или антиимпульсивного действия. Самцов мышей линииNMRI (фирма Iffa-Credo, l'Arbresle, Франция) весом 20-25 г в день эксперимента помещают по отдельности в садки из Макролона (30 х 18 х 19 см),содержащие подстилку из опилок толщиной 5 см и покрытые перфорированной пластиной из плексигласа. Двадцать четыре стеклянных шарика, раскрашенных под "тигровый глаз", равномерно распределяют на опилках в периферической части садка. После 30-минутного свободного эксперимента животных удаляют из садка и подсчитывают количество закопанных шариков. В качестве примера в таблице приведены данные о воздействии продукта по изобретению в сравнении с флуоксетином, который используют в качестве эталонного антидепрессанта. Пример Закапывание шариков мышами, ID50 Флуоксетин 8,03 5 0,6ID50 - доза, вызывающая 50%-ное ингибирование. Дозы выражают в виде мг/кг s.c. Пример 45. Фармацевтическая композиция: таблетки. Состав для приготовления 1000 таблеток,каждая из которых содержит по 5 мг в качестве действующего вещества: Соединение из примера 5 5 г Гидроксипропилметилцеллюлоза 5 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гетероциклоалкилбензоциклобутановые и гетероарилциклобутановые производные формулы (I) гдеобозначает простую или двойную связь, 33n обозначает целое число от 1 до 6 включительно,R1 и R2 могут быть одинаковыми или различными и каждый независимо друг от друга обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную С 1-С 6 алкильную группу, арильную группу, арилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную С 2-С 6 алкенильную группу, линейную или разветвленную С 2-С 6 алкинильную группу, гетероциклоалкильную группу, гетероциклоалкилС 1 С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, гетероарильную группу и гетероарилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным,Х обозначает группу, выбранную из ряда,включающего -СН=СН-, атом кислорода, группу S(O)m, где m обозначает целое число от 0 до 2 включительно, и NR3, где R3 обозначает группу, выбранную из ряда, включающего атом водорода, линейную или разветвленную С 1 С 6 алкильную группу, арильную группу, арилС 1 С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, циклоалкильную группу, циклоалкилС 1-С 6 алкильную группу, в которой алкильный фрагмент может быть линейным или разветвленным, линейную или разветвленную С 2 С 6 алкенильную группу и линейную или разветвленную С 2-С 6 алкинильную группу,Y обозначает СН- или СН 2-группу, в зависимости от того, обозначает липростую связь или двойную связь, или может также обозначать атом кислорода, когда Х обозначает атом кислорода,Т обозначает циклопентильную или циклогексильную группу,их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием, где"арильная группа" обозначает группу, выбранную из ряда, включающего фенил, бифенил, нафтил, дигидронафтил, тетрагидронафтил,инданил, инденил и бензоциклобутил, каждая из этих групп необязательно замещена одним или несколькими одинаковыми или различными группами, выбранными из ряда, включающего атомы галогена, линейные или разветвленные С 1-С 6 алкильные группы, гидроксигруппы, линейные или разветвленные С 1-С 6 алкоксигруппы,нитрогруппы, цианогруппы, линейные или разветвленные тригалоС 1-С 6 алкильные группы,аминогруппы, моноалкиламиногруппы, в которых алкильный фрагмент имеет от 1 до 6 атомов углерода и является линейным или разветвленным, диалкиламиногруппы, в которых каждый 34 алкильный фрагмент имеет от 1 до б атомов углерода и является линейным или разветвленным,"гетероарильная группа" обозначает арильную группу, как она определена выше,содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы, эта гетероарильная группа необязательно может быть замещена одной или несколькими одинаковыми или различными группами, выбранными из заместителей, указанных выше для арильной группы,"циклоалкильная группа" обозначает моноили полициклическую систему, содержащую от 3 до 12 кольцевых членов и необязательно включающую одну или несколько ненасыщенных групп, причем эти ненасыщенные группы не оказывают влияния на ароматический характер указанной кольцевой системы,"гетероциклоалкильная группа" обозначает циклоалкильную группу, как она определена выше, содержащую в кольцевой системе от 1 до 3 одинаковых или различных гетероатомов, выбранных из кислорода, азота и серы. 2. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 1, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, отличающиеся тем, что R1 и R2, которые могут быть одинаковыми или различными, обозначают атом водорода, линейную или разветвленную С 1-С 6 алкильную группу или 2,3-дигидро-1,4 бензодиоксин-2-илметильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/A) в которых n, R1, R2 и Т имеют значения, указанные для формулы (I), Х 10 обозначает атом кислорода или атом серы и Y10 обозначает группу СН, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/B) в которых X, Y, n, R1, R2, R3 и Т имеют значения, указанные для формулы (I), их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I/B) по п.5, отличающиеся тем, что n равно 1 и Х обозначает группу NR3, где R3 обозначает атом водорода или линейную или разветвленную С 1 С 6 алкильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/C) в которых n, R1, R2, X и Т имеют значения,указанные для формулы (I), и Y20 обозначает группу СН или СН 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по любому из пп.1-3 , отличающиеся тем, что они представляют собой соединения формулы (I/D) в которых n, R1, R2, X и Т имеют значения, указанные для формулы (I), и Y20 обозначает группу СН или СН 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/E) в которых n, R1, R2, X и Т имеют значения,указанные для формулы (I), и Y20 обозначает группу СН или СН 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (I/F) в которых n, R1, R2, X и Т имеют значения,указанные для формулы (I), и Y20 обозначает группу СН или СН 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по любому из пп.1-3, представляющие собой 36 1-6-[(диметиламино)метил]-1-метил-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-илциклогексанол,1-6-[(диметиламино)метил]-2,3,5,6-тетрагидро-1 Н-циклобута[f]индол-6-илциклогексанол,1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензофуран-5-илциклогексанол,1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклогексанол,1-6-[(диметиламино)метил]-1-метил-5,6 дигидро-1 Н-циклобута[f]индол-6-илциклогексанол,1-7-[(диметиламино)метил]-2,3,6,7-тетрагидро-1 Н-циклобута[е]индол-7-илциклогексанол,1-5-[(метиламинo)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,(+)-1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,(-)-1-5-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-5-илциклопентанол,1-6-[(диметиламино)метил]-5,6-дигидроциклобута[f][1]бензотиен-6-илциклопентанол,1-5-[(диметиламино)метил]-1-метил-5,6 дигидро-1 Н-циклобута[f]индол-5-илциклопентанол,1-7-[(диметиламино)метил]-6,7-дигидроциклобута[g][1]бензофуран-7-илциклопентанол,1-1-[(диметиламино)метил]-1,2-дигидроциклобута[b]нафталин-1-илциклопентанол,1-7-[(диметиламино)метил]-6,7-дигидро 3 Н-циклобута[е]индол-7-илциклопентанол,1-1-[(диметиламино)метил]-1,2-дигидроциклобута[а]нафталин-1-илциклопентанол,их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Фармацевтическая композиция, включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-11, индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми инертными нетоксичными эксципиентами или носителями. 13. Фармацевтическая композиция по п.11,включающая в качестве действующего вещества по меньшей мере одно соединение формулы (I) по любому из пп.1-13, предназначенные для лечения депрессии, приступов паники, обсессивно-компульсивных состояний, фобий, нарушений импульсивного контроля, злоупотребления лекарственными средствами, состояния тревоги, ожирения и булимии.
МПК / Метки
МПК: A61K 31/343, A61P 25/00, C07C 215/42, C07D 209/70
Метки: гетероарилбензоциклобутановые, гетероциклоалкилбензоциклобутановые, содержащие, фармацевтические, композиции, производные
Код ссылки
<a href="https://eas.patents.su/19-4473-geterocikloalkilbenzociklobutanovye-i-geteroarilbenzociklobutanovye-proizvodnye-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклоалкилбензоциклобутановые и гетероарилбензоциклобутановые производные и содержащие их фармацевтические композиции</a>












