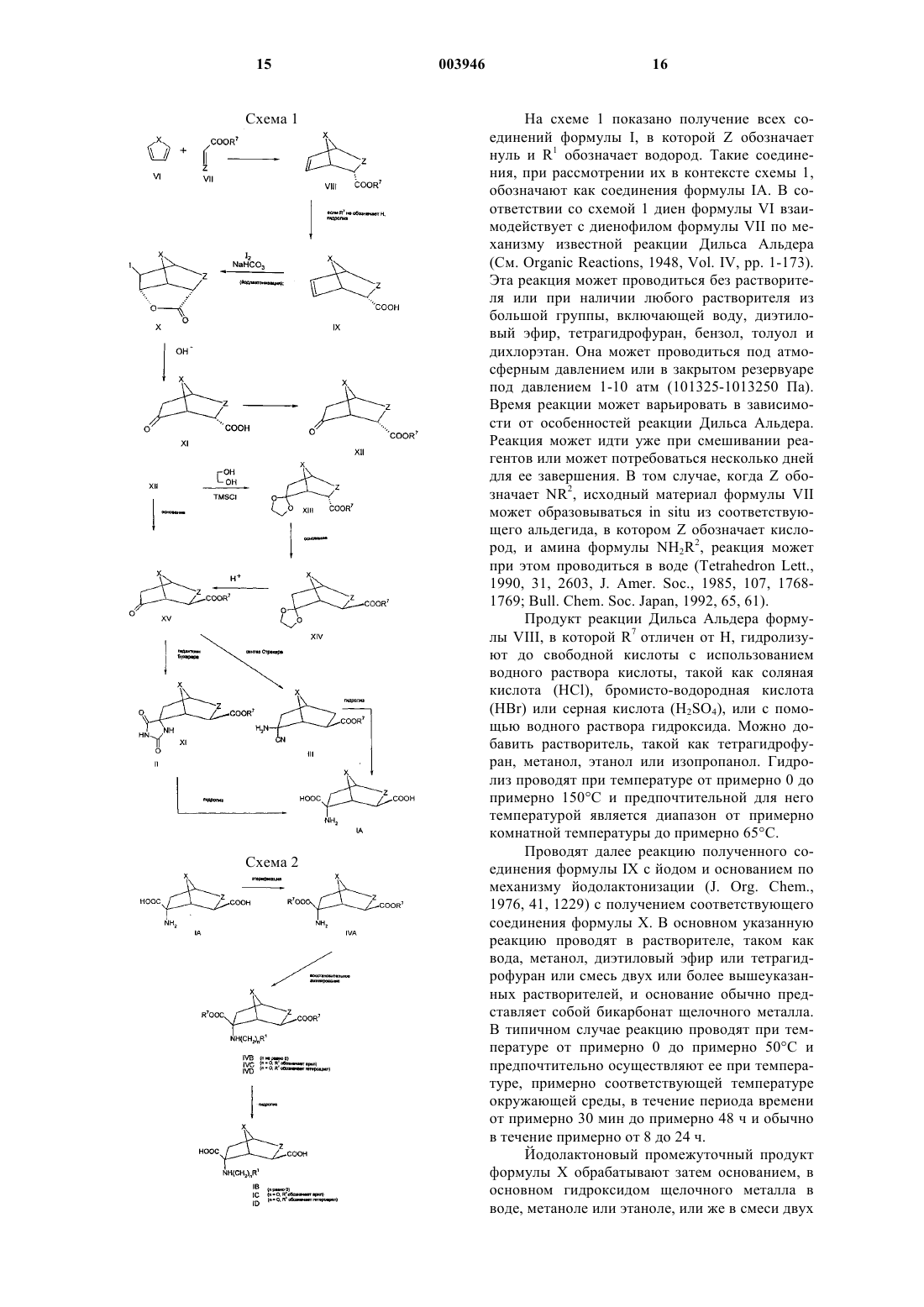
Бицикло [2.2.1] гептаны и родственные соединения
Формула / Реферат
1. Соединение формулы
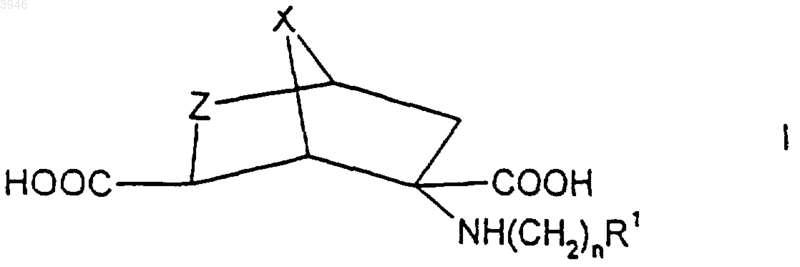
где n принимает значения от 0 до 6,
X обозначает CH2, CH2CH2 или кислород,
Z обозначает CHR2 или NR2 и
R1 и R2 выбирают независимо из водорода, (C1-C6)алкила, арила и гетероарила, при этом указанный арил выбирают из фенила и нафтила и указанный гетероарил выбирают из 5- и 6-членных ароматических гетероциклических колец, которые содержат от одного до четырех гетероатомов, выбранных независимо из азота, кислорода и серы, и при этом указанные арильная и гетероарильная группировки могут быть необязательно замещены одним или большим числом заместителей, которые выбирают независимо из галогена, -S(C1-C6)алкила, -S(O)(C1-C6)алкила, -S(O)2(C1-C6)алкила, (C1-C6)алкила, необязательно замещенного от одного до семи атомами фтора, (C1-C6)алкокси, необязательно замещенного от одного до семи атомами фтора, амино, нитро, циано, карбокси, -CO2(C1-C6)алкила, (C1-C6)алкиламино, ди-[(C1-C6)алкил]аминофенокси, анилино и фенилтио,
при условии, что ни одна из вышеуказанных гетероарильных группировок не содержит в кольце более одного атома кислорода или также в кольце более одного атома серы,
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где Z обозначает CH2.
3. Соединение по п.1, в котором R1 выбирают из группы, состоящей из водорода, фенила и фенила, замещенного одним или двумя заместителями.
4. Соединение по п.1, в котором n обозначает 0, 1 или 2.
5. Соединение по п.1, в котором X обозначает CH2.
6. Соединение по п.1, выбранное из группы, состоящей из
2-(эндо)аминобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота;
(+)-2-(эндо)аминобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота;
(-)-2-(эндо)аминобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота;
2-(эндо)бензиламинобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота и
2-(эндо)фенилэтиламинобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота.
7. Фармацевтическая композиция, предназначенная для лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, химическую зависимость и привыкание, повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, осуществляемое или облегчаемое за счет модуляции нейротрансмиссии глютамата у млекопитающего, включающая эффективное для лечения такого заболевания или состояния количество соединения по п.1 и фармацевтически приемлемый носитель.
8. Способ лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, которое осуществляется или облегчается за счет модуляции нейротрансмиссии глютамата у млекопитающего, отличающийся тем, что он включает введение млекопитающему, нуждающемуся в такой терапии, эффективного для лечения указанного заболевания или состояния количества соединения по п.1 и фармацевтически приемлемого носителя.
9. Фармацевтическая композиция, предназначенная для лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, химическую зависимость и привыкание, повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, причем лечение осуществляется или состояние облегчается за счет модуляции нейротрансмиссии глютамата у млекопитающего, включающая
(а) соединение по п.1 или его фармацевтически приемлемую соль,
(б) ингибитор повторного захвата серотонина или лиганд рецептора серотонина-1A (5HT1A) или фармацевтически приемлемую соль такого ингибитора или лиганда и
(в) фармацевтически приемлемый носитель,
причем количества соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, содержащиеся в данной композиции, таковы, что сочетание двух активных ингредиентов оказывается эффективным для лечения указанного заболевания или состояния.
10. Способ лечения заболевания или состояния, выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, осуществляемое или облегчаемое за счет модуляции нейротрансмиссии глютамата у млекопитающего, отличающийся тем, что он включает введение млекопитающему, нуждающемуся в таком лечении,
(а) соединения по п.1 или его фармацевтически приемлемой соли и
(б) ингибитора повторного захвата серотонина или лиганда рецептора серотонина-1A (5HT1A) или фармацевтически приемлемой соли такого ингибитора или лиганда,
причем количества соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в рамърх данного способа, таковы, что сочетание двух активных ингредиентов оказывается эффективным для лечения указанного заболевания или состояния.
11. Фармацевтическая композиция по п.9, отличающаяся тем, что (б) представляет собой ингибитор повторного захвата серотонина, выбранный из сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фенфлурамина и фемоксетина.
12. Способ по п.10, отличающийся тем, что (б) представляет собой ингибитор повторного захвата серотонина, выбранный из сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фенфлурамина и фемоксетина.
13. Соединение формулы
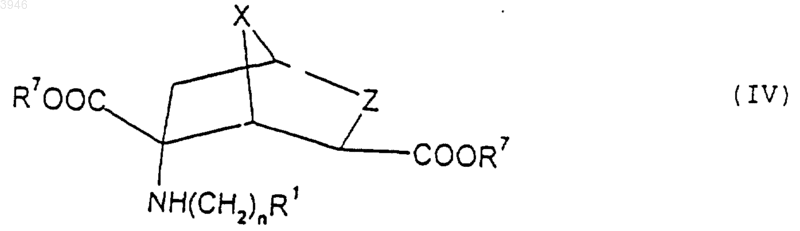
где n принимает значения от 0 до 6,
X обозначает CH2, CH2CH2 или кислород,
Z обозначает CHR2 или NR2 и
R1 и R2 выбирают независимо из водорода, (C1-C6)алкила, арила и гетероарила, при этом указанный арил выбирают из фенила и нафтила и указанный гетероарил выбирают из 5- и 6-членных ароматических гетероциклических колец, которые содержат от одного до четырех гетероатомов, выбранных независимо из азота, кислорода и серы, и при этом указанные арильная и гетероарильная группировки могут быть необязательно замещены одним или большим количеством заместителей, выбранных независимо из галогена, -S(C1-C6)алкила, -S(O)(C1-C6)алкила, -S(O)2(C1-C6)алкила, (C1-C6)алкила, необязательно замещенного от одного до семи атомами фтора, (C1-C6)алкокси, необязательно замещенного от одного до семи атомами фтора, амино, нитро, циано, карбокси, -CO2(C1-C6)алкила, (C1-C6)алкиламино, ди-[(C1-C6)алкил]аминофенокси, анилино и фенилтио, и
R7 обозначает водород, (C1-C6)алкил или бензил,
при условии, что ни одна из вышеуказанных гетероарильных группировок не содержит в кольце более одного атома кислорода или более одного атома серы.
Текст
1 Настоящая заявка относится к использованию временной заявки на патент США 60/078346, зарегистрированной 17 марта 1998 г. Настоящее изобретение относится к описанным ниже соединениям формулы I, их фармацевтически приемлемым солям, фармацевтическим композициям, содержащим их, и к их использованию при лечении нервных и психических заболеваний. Роль возбудительных аминокислот, таких как глютаминовая кислота и аспарагиновая кислота, в качестве основных медиаторов синаптической передачи, обуславливающей возбуждение в настоящее время хорошо установлена.(1989); Watkins, Krogsgaard-Larsen and Honore,Trans. Pharm. Sci., 11, 25 (1990. Функция указанных аминокислот состоит в синаптической передаче, в первую очередь, через рецепторы возбудительных аминокислот. Такие аминокислоты задействованы также в ряде других физиологических процессов, таких как регуляция моторики,дыхание,регуляция сердечнососудистой системы, чувствительная перцепция и распознавание. Рецепторы возбудительных аминокислот подразделяют на два основных типа. Рецепторы,которые непосредственно связаны с входом катионных каналов в клеточной мембране нейронов, носят название ионотропные. Этот тип рецепторов подразделяется, в свою очередь, по меньшей мере, на три подтипа, которые определяются по деполяризующему воздействию селективных агонистов N-метил-D-аспартата(NMDA), -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМПА) и каиновой кислоты (КК). Второй основной тип рецепторов представляет собой G-белок или метаботропный рецептор, связанный со вторым переносчиком. Указанный второй тип рецепторов при активации агонистами хисквалатом, иботенатом или транс-1-аминоциклопентан-1,3 дикарбоновой кислотой или 2-амино-4 фосфономасляной кислотой активирует вторую систему переноса. Подмножество рецепторов,связанных со вторым переносчиком, характеризуется отрицательной реакцией на связывание с аденилатциклазой. Оба типа рецепторов, по всей видимости, не только являются посредниками в нормальном процессе синаптической передачи возбудительного проводящего пути,но также принимают участие в модификации синаптической связи при развитии и способны менять эффективность передачи в синапсах в течение жизни. (См. Schoepp, Bockaert andReviews, 15, 41 (1990). Избыточная или несоответствующая стимуляция рецепторов возбудительных аминокис 003946 2 лот ведет к повреждению нейрональных клеток или к их потере по механизму процесса, известного как нервная токсичность (эксцитотоксичность). Предполагается, что этот процесс при многих состояниях опосредует нейрональное повреждение. Медицинские последствия нейрональной дегенерации делают борьбу с такими дегенеративными неврологическими процессами важной задачей практической терапии. Нервная токсичность возбудительных аминокислот вносит вклад в патофизиологию многих неврологических заболеваний. Нервная токсичность участвует в патофизиологии острых и хронических нейродегенеративных состояний, таких как мозговой удар, церебральная ишемия, травма спинного мозга, травма головы,болезнь Альцгеймера, хорея Хантингтона, боковой амиотрофический склероз, эпилепсия, деменция, вызванная СПИДом, перинатальная гипоксия, гипоксия (например, состояния, вызванные сдавлением, хирургическим вмешательством, вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя), остановка сердца,повреждение нейронов при гипогликемии, повреждения глаз и ретинопатия, идиопатическая и вызванная лекарствами болезнь Паркинсона и сердечная недостаточность, вызванная шунтированием сердца и трансплантацией. Другие неврологические состояния, которые определяются нарушением функции глютамата, требуют нейромодуляции. Такие другие неврологические состояния включают мышечные спазмы, головную боль по типу мигрени, недержание мочи,психоз, синдром абстиненции (такой как в случае зависимости от алкоголя и лекарственных препаратов, включая опиат, кокаин и никотин),толерантность к опиату, тревогу, рвоту, отек мозга, хроническую и острую боль, судороги,шум в ушах и позднюю дискинезию. Считается,что применение нейропротекторных средств,таких как антагонист рецептора АМПА, может быть полезно для лечения таких болезней и/или с целью снижения выраженности неврологических нарушений, связанных с этими заболеваниями. Предполагается также, что антагонисты рецептора аминокислот, участвующих в проведении нервного импульса (ЕАА, ВАК), могут использоваться в качестве анальгетических средств. Метаботропные рецепторы глютамата представляют собой чрезвычайно гетерогенное семейство рецепторов глютамата, которые связаны с множественными метаболическими путями второго переносчика. В основном, функция этих рецепторов заключается в модуляции пресинаптического высвобождения глютамата и послесинаптической чувствительности нейрональной клетки к возбуждению глютаматом. Метаботропные рецепторы глютамата (mGluR,мГлюР) на основе фармакологических критери 3 ев подразделяются на три подтипа. Одна группа рецепторов (рецепторы класса I) положительно связывается с фосфолипазой С, которая вызывает гидролиз клеточных фосфоинозитидов(PI, ФИ). Первая группа называется ФИсвязанные метаботропные рецепторы глютамата. Вторая группа рецепторов (рецепторы класса II и класса III) отрицательно связывается с аденилатциклазой, которая препятствует стимулированному форсколином накоплению циклических аденозинмонофосфатов (цАМФ). (См.(1993. Рецепторы класса II и класса III различаются по селективной активации транс-1 аминоциклопентан-1,3-дикарбоновой кислотой и 2-амино-4-фосфономасляной кислотой соответственно. Рецепторы, образующие указанную вторую группу, называются цАМФ-связанные метаботропные рецепторы глютамата. Агонисты цАМФ-связанных метаботропных рецепторов глютамата могут быть полезными при лечении острых и хронических нервных и психических состояний. Недавно были обнаружены соединения,которые воздействуют на метаботропные рецепторы глютамата, но не оказывают влияния на ионотропные рецепторы глютамата. (1S,3R)-1 аминоциклопентан-1,3-дикарбоновая кислота(1S,3R-ACPD) представляет собой агонист ФИсвязанных и цАМФ-связанных рецепторов глютамата. (См. Schoepp, Johnson, True and Monn,Eur. J. Pharmacol., 207, 351 (1991); Schoepp,Johnson and Monn, J. Neurochem., 58, 1184(1992. Недавно (2S,3S,4S)-2-(карбоксициклопропил)глицин (L-CCG-1, L-КЦГ-1) был описан как селективный агонист цАМФ-связанного метаботропного рецептора глютамата, однако,при более высоких концентрациях это соединение проявляет активность ФИ-связанных метаботропных рецепторов. (См. Nakagawa, et al.,Eur. J. Phannacol., 184, 205 (1990); Hayashi, et al.,Br. J. Pharmacol., 197, 539 (1992); Schoepp et al.,J. Neurochem., 63, 769-772 (1994. Заявка на европейский патент ЕР 696577A1, опубликованная 14 февраля 1996 г., относится к ряду синтетических аминокислот, обладающих селективностью в реакции отрицательного связывания с цАМФ-связанными метаботропными рецепторами глютамата (например,метаботропными рецепторами глютамата классаII). Соединения формулы I и их фармацевтически приемлемые соли являются лигандами метаботропных рецепторов глютамата, которые обладают селективностью в отношении метаботропных рецепторов глютамата класса II. Краткое описание сущности изобретения Настоящее изобретение относится к соединениям формулы где n принимает значения от 0 до 6; Х обозначает CH2, CH2CH2 или кислород;R1 и R2 выбирают независимо из водорода,(C1-С 6)алкила, арила и гетероарила, где указанный арил выбирают из фенила и нафтила и указанный гетероарил выбирают из 5- и 6-членных ароматических гетероциклических колец, которые содержат от одного до четырех гетероатомов, выбранных независимо из азота, кислорода и серы и при этом указанные арильная и гетероарильная группировки могут быть необязательно замещены одним или большим числом заместителей, предпочтительно одним или двумя заместителями, которые выбирают независимо из галогена (например, фтора, хлора, брома или йода), -S(C1-C6)алкила, -S(O)(C1C6)алкила, -S(O)2(C1-C6)алкила, (C1-C6)алкила,необязательно замещенного от одного до семи атомами фтора, (C1-C6)алкокси, необязательно замещенного в количестве от одного до семи атомами фтора, амино, нитро, циано, карбокси,-СO2(C1-C6)алкила, (C1-C6)алкиламино, ди-[(C1C6)алкил]аминофенокси, анилино и фенилтио; при условии, что ни одна из вышеуказанных гетероарильных группировок не содержит в кольце более одного атома кислорода или также в кольце более одного атома серы; и к фармацевтически приемлемым солям таких соединений. Примеры гетероарильных группировок в указанном гетероарил-(С 0-С 6)алкиле включают следующие: оксазолил, изоксазолил, тиазолил,изотиазолил, фуранил, пиразолил, пирролил,тетразолил, триазолил, тиенил, имидазолил, пиридинил и пиримидинил. Настоящее изобретение также относится к соединениям формул 5 где X и Z определены выше в описании формулы I и R7 обозначает водород, (С 1-С 6)алкил или бензил. Соединения формул II, III или IV являются промежуточными соединениями в синтезе соединений формулы I. Предпочтительные соединения формулы I включают те из них, в которых R1 обозначает пирид-3-ильную или пирид-4-ильную группу. Другие предпочтительные соединения формулы I включают те из них, в которых R1 обозначает водород, незамещенный фенил или фенил, замещенный одним или двумя заместителями. В том случае, когда R1 обозначает замещенный фенил, предпочтительные заместители на указанном фениле выбирают независимо из (C1-С 6)алкила, нитро, циано, галогена,СF3, (С 1-С 5)алкила, замещенного СF3, (С 1 С 5)алкокси, замещенного СF3, и О-СF3. Другие предпочтительные соединения формулы I включают те из них, в которых n принимает значения от 1 до 6. При этом более предпочтительными являются соединения, в которых n обозначает 1 или 2. Другие предпочтительные соединения формулы I включают те из них, в которых Z обозначает CH2. Другие предпочтительные соединения формулы I включают те из них, в которых Х обозначает CH2. Другие предпочтительные соединения формулы I включают те из них, в которых Х и Z обозначают СН 2, R1 обозначает водород и n обозначает нуль. Другие варианты реализации настоящего изобретения включают соединения формулы I, в которых:R обозначает фенил или замещенный фенил;(д) один из R1 и R2 представляет собой арил или гетероарил или(е) оба R1 и R2 выбирают из арила, замещенного арила, гетероарила и замещенного гетероарила. Предпочтительные соединения формулы I включают следующие соединения, не ограничиваясь ими: 2-(эндо)аминобицикло[2.2.1]гептан-2(экзо)-6-(экзо)дикарбоновая кислота; 6 Предпочтительные соединения формул II,III и IV включают те из них, в которых R7 обозначает водород, (С 1-С 6)алкил или бензил. В одном варианте реализации изобретения соединения формул II, III и IV включают R7, где указанный R7 обозначает (C1-C6)трет-алкил, например трет-бутил. Соединения формулы I и их фармацевтически приемлемые соли представляют собой лиганды метаботропного рецептора глютамата и используются при лечении множества нервных и психических заболеваний. Примеры нервных заболеваний, которые можно лечить с использованием соединений формулы I и их фармацевтически приемлемых солей, включают сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации, церебральную ишемию (например, при мозговом ударе и остановке сердца), травму спинного мозга,травму головы, болезнь Альцгеймера, болезнь Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, судороги, перинатальную гипоксию, повреждение нейронов при гипогликемии, химическую зависимость и привыкание(например, зависимость от опиатов, бензодиазепинов, кокаина, никотина или этанола или привыкание к ним), симптомы абстиненции при зависимости от лекарственных средств или алкоголя, повреждения глаз и ретинопатию, расстройства познавательной способности, идиопатическую и вызванную лекарствами болезнь Паркинсона, рвоту, отек мозга, острую или хроническую боль, расстройства сна, болезнь Туретта, дефицит внимания и позднюю дискинезию. Примеры психических заболеваний, которые можно лечить соединениями формулы I и их фармацевтически приемлемыми солями,включают шизофрению, тревогу и родственные заболевания (например, состояние общего беспокойства, паническую атаку и связанные со стрессом заболевания, такие как посттравматаческий стресс-синдром), депрессию, биполярное расстройство, психоз и навязчивое состояние. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения кислоты соединений формулы I. Кислоты,которые используются для приготовления фармацевтически приемлемых солей вышеуказанных соединений по настоящему изобретению,включают такие, которые образуют нетоксичные соли присоединения кислоты, например соли, содержащие фармакологически приемлемые анионы, такие соли, как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат,цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [на 7 пример, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения основания соединений формулы I. Все указанные соли получают на основе традиционной методики. Химические соединения, которые используются в качестве реагентов для получения фармацевтически приемлемых солей присоединения основания по настоящему изобретению, включают такие, которые образуют нетоксичные соли присоединения основания при взаимодействии с кислыми соединениями формулы I. Указанные нетоксичные соли присоединения основания включают те из них, которые получают на основе таких фармакологически приемлемых катионов, как натрий, калий,кальций, магний и др. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения у млекопитающих такого заболевания или состояния, в отношении которого известно, что лечение или профилактика могут быть проведены или облегчены за счет модуляции (например, повышения или снижения) нейротрансмиссии глютамата, и которая включает определенное количество соединения формулыI или его фармацевтически приемлемой соли,которое эффективно для лечения такого заболевания или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения заболевания или состояния, в отношении которого известно, что лечение или профилактика могут быть проведены или облегчены за счет модуляции нейротрансмиссии глютамата у млекопитающих, и который включает введение указанному млекопитающему, при наличии в этом необходимости, эффективного для лечения такого заболевания или состояния количества соединения формулы I или его фармацевтически эффективной соли. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения состояния, выбранного из группы,включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона,боковой амиотрофический склероз, эпилепсию,деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию (такую как состояния,вызванные сдавлением, хирургическим вмешательством, вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя), остановку сердца,повреждение нейронов при гипогликемии, химическую зависимость и привыкание (например, зависимость от алкоголя, опиатов, бензодиазепинов, никотина, героина или кокаина или 8 привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки, шум в ушах,идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, посттравматический стресс-синдром, паническая атака, общее состояние беспокойства, обычные фобии и социальные фобии), шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга,хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, которая включает эффективное для модуляции нейротрансмиссии глютамата количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения состояния, выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз,эпилепсию, деменцию, вызванную СПИДом,мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию (такую как состояния, вызванные сдавлением, хирургическим вмешательством, вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении,электротравме или передозировке лекарственных препаратов или алкоголя), остановку сердца, повреждение нейронов при гипогликемии,химическую зависимость и привыкание (например, зависимость от алкоголя, опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки, шум в ушах,идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, паническую атаку расстройство, посттравматический стресс-синдром, общее состояние беспокойства,обычные фобии и социальные фобии), шизофрению, депрессию, биполярное расстройство,навязчивое состояние, болезнь Туретта, рвоту,отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность,развивающуюся после шунтирования сердца и трансплантации у млекопитающих, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективное для модуляции нейротрансмиссии глютамата количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения заболевания или состояния, в отношении которого известно, что лечение или профилактика могут быть проведены или облегчены за счет модуляции (например, повышения или снижения) нейротрансмиссии глютамата, и которая включает определенное количество со 9 единения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения такого заболевания или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения заболевания или состояния,заключающегося в том, что лечение может быть проведено или облегчено путем модуляции нейротрансмиссии глютамата у млекопитающего, и который включает введение указанному млекопитающему, при необходимости такого лечения,эффективного для модуляции нейротрансмиссии количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения состояния, выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, эпилепсию, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи,психоз, судороги, перинатальную гипоксию,гипоксию (такую как состояния, вызванные сдавлением, хирургическим вмешательством,вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя), остановку сердца, повреждение нейронов при гипогликемии, химическую зависимость и привыкание (например,зависимость от алкоголя, опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки, шум в ушах, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, паническую атаку, посттравматический стресс-синдром, общее состояние беспокойства, обычные фобии и социальные фобии), шизофрению, депрессию,биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, который включает введение млекопитающему, при наличии необходимости в таком лечении, эффективного для лечения указанного состояния количества соединения формулы I. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения состояния, выбранного из группы,включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона,боковой амиотрофический склероз, эпилепсию,деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию (такую как состояния,вызванные сдавлением, хирургическим вмеша 003946 10 тельством, вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя), остановку сердца,повреждение нейронов при гипогликемии, химическую зависимость и привыкание (например, зависимость от алкоголя, опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки, шум в ушах,идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, паническую атаку, посттравматический стресссиндром, общее состояние беспокойства, обычные фобии и социальные фобии), шизофрению,депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, которая включает количество соединения формулы I, эффективное для лечения указанного состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения заболевания или состояния,заключающегося в том, что лечение может быть проведено или облегчено путем модуляции нейротрансмиссии глютамата у млекопитающего,который включает введение млекопитающему,нуждающемуся в таком лечении:(а) соединения формулы I или его фармацевтически приемлемой соли и(б) ингибитора повторного захвата серотонина (например, сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фенфлурамина, фемоксетина и др.) или лиганда рецептора серотонина-1A (5HT1A) (например, буспирона, флезиноксана и др.) или фармацевтически приемлемой соли такого ингибитора или лиганда; при том, что количество соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в рамках этого метода, таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения заболевания или состояния, заключающегося в том, что лечение может быть проведено или облегчено путем модуляции нейротрансмиссии глютамата у млекопитающего,которая включает:(а) соединение формулы I или его фармацевтически приемлемую соль и(б) ингибитор повторного захвата серотонина (например, сертралин, флуоксетин, флувоксамин, пароксетин, циталопрам, фенфлурамин, фемоксетин и др.) или лиганд рецептора серотонина-1 А (5 НТ 1A) (например, буспирон, 11 флезиноксан и др.) или фармацевтически приемлемую соль такого ингибитора или лиганда;(в) фармацевтически приемлемый носитель; при том, что количество соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в композиции, таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. Настоящее изобретение также относится к способу лечения заболевания или состояния,заключающегося в том, что лечение его может быть проведено или облегчено путем модуляции нейротрансмиссии глютамата у млекопитающего, который включает введение млекопитающему, нуждающемуся в таком лечении:(а) соединения, модулирующего нейротрансмиссию глютамата, или его фармацевтически приемлемой соли и(б) ингибитора повторного захвата серотонина (например, сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фемоксетина, фенфлурамина и др.) или лиганда рецептора серотонина-1A (5HT1A) (например, буспирона, флезиноксана и др.) или фармацевтически приемлемой соли такого ингибитора или лиганда; при том, что количество соединения, модулирующего нейротрансмиссию, и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в рамках этого метода, таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. Настоящее изобретение также относится к фармацевтической композиции, применяемой для лечения заболевания или состояния, заключающегося в том, что лечение может быть проведено или облегчено путем модуляции нейротрансмиссии глютамата у млекопитающего,которая включает:(а) соединение, модулирующее нейротрансмиссию глютамата, или его фармацевтически приемлемую соль и(б) ингибитор повторного захвата серотонина (например, сертралин, флуоксетин, флувоксамин, пароксетин, циталопрам, фенфлурамин, фемоксетин и др.) или лиганд рецептора серотонина-1 А (5HT1A) (например, буспирон,флезиноксан и др.) или фармацевтически приемлемую соль такого ингибитора или лиганда;(в) фармацевтически приемлемый носитель; при том, что количество соединения, модулирующего нейротрансмиссию, и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в композиции,таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. 12 Настоящее изобретение также относится к способу лечения заболевания или состояния,выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера,хорею Хантингтона, боковой амиотрофический склероз, эпилепсию, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию (такую как состояния, вызванные сдавлением, хирургическим вмешательством, вдыханием дыма,асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя),остановку сердца, повреждение нейронов при гипогликемии, химическую зависимость и привыкание (например, зависимость от алкоголя,опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки,шум в ушах, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, паническую атаку, посттравматический стресс-синдром, общее состояние беспокойства,обычные фобии и социальные фобии), шизофрению, депрессию, биполярное расстройство,навязчивое состояние, болезнь Туретта, рвоту,отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность,развивающуюся после шунтирования сердца и трансплантации у млекопитающих, который включает введение млекопитающему, при наличии необходимости в таком лечении:(а) соединения формулы I или его фармацевтически приемлемой соли и(б) ингибитора повторного захвата серотонина (например, сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фенфлурамина, фемоксетина и др.) или лиганда рецептора серотонина-1A (5HT1A) (например, буспирона, флезиноксана и др.) или фармацевтически приемлемой соли такого ингибитора или лиганда; при том, что количество соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в рамках этого метода, таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. Настоящее изобретение относится также к фармацевтической композиции, применяемой для лечения заболевания или состояния, выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера,хорею Хантингтона, боковой амиотрофический склероз, эпилепсию, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию (та 13 кую как состояния, вызванные сдавлением, хирургическим вмешательством, вдыханием дыма,асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя),остановку сердца, повреждение нейронов при гипогликемии, химическую зависимость и привыкание (например, зависимость от алкоголя,опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатию, невропатию сетчатки,шум в ушах, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу (например, паническую атаку, посттравматический стресс-синдром, общее состояние беспокойства,обычные фобии и социальные фобии), шизофрению, депрессию, биполярное расстройство,навязчивое состояние, болезнь Туретта, рвоту,отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность,развивающуюся после шунтирования сердца и трансплантации у млекопитающих, которая включает:(а) соединения формулы I или его фармацевтически приемлемую соль,(б) ингибитор повторного захвата серотонина (например, сертралин, флуоксетин, флувоксамин, циталопрам, пароксетин, фенфлурамин, фемоксетин и др.) или лиганд рецептора серотонина-1 А (5HT1A) (например, буспирон,флезиноксан и др.), или фармацевтически приемлемую соль такого ингибитора или лиганда и в) фармацевтически приемлемый носитель; при том, что количество соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, содержащиеся в этой композиции, таково, что сочетание двух активных ингредиентов оказывается эффективным для лечения такого заболевания или состояния. Если особо не оговорено иное, алкильные группы, так же как и алкильные группировки, в других рассматриваемых группах (например, в алкокси) могут быть линейными или разветвленными (например, представляют собой третбутил) и могут также быть циклическими (например, представляют собой циклопропил, циклобутил, циклопентил или циклогексил) или это может быть линейная или разветвленная группа,содержащая циклические части. Термин лечение в контексте настоящего описания относится к реверсии, ослаблению,подавлению развития, а также к предупреждению заболевания или состояния, к которым этот термин применяется, или же одного или более симптомов такого заболевания или состояния. Термин лечение в контексте настоящего описания относится к акту лечения, определенному в этом абзаце. Если особо не оговорено иное, термин галоген в контексте настоящего описания относится к фтору, брому, хлору или йоду. 14 Соединения формулы I могут содержать хиральные центры и в этой связи существовать в виде различных энантиомерных и диастереомерных форм. Настоящее изобретение относится ко всем оптическим изомерам и всем другим стереоизомерам соединений формулы I, ко всем рацемическим и иным смесям указанных соединений, а также ко всем фармацевтическим композициям и способам лечения, определенным выше, которые содержат или используют такие изомеры или их смеси. Настоящее изобретение в качестве своего объекта охватывает также меченые изотопами соединения, которые идентичны тем, что описываются формулой I, но отличаются от обычных природных соединений тем, что один или более атомов в них заменены атомом с другой атомной массой или другим массовым числом. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению,включают изотопы водорода, углерода, азота,кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13 С, 14 С, 15N, 18 О, 17 О, 31P, 32P, 18F и 36Cl соответственно. Соединения по настоящему изобретению и фармацевтически приемлемые соли рассматриваемых соединений, которые содержат указанные изотопы и/или другие изотопы других атомов, также входят в объем настоящего изобретения. Некоторые меченые изотопами соединения по настоящему изобретению, например, те, которые содержат радиоактивные изотопы, такие как 3H и 14 С, используют для изучения распределения лекарства и/или субстрата по тканям организма. Особенно предпочтительны изотопы тритий, т.е. 3H, и углерод 14, т.е. 14 С, в связи с легкостью их получения и простотой обнаружения. Кроме того, введение тяжелых изотопов, таких как дейтерий или 2H,может создать некоторые преимущества при лечении, определяемые большей метаболической стабильностью, например, увеличить период полужизни или позволить снижение дозировки, и в связи с этим в ряде случаев может стать предпочтительным. Меченые изотопами соединения формулы I по настоящему изобретению в основном можно получать, следуя процедурам, приведенным дальше в схемах и способах получения в настоящем описании, путем замены немеченого соединения доступным реагентом, содержащим изотопную метку. Подробное описание изобретения Соединения формулы I могут быть получены согласно методам, указанным в схеме 1. На реакционной схеме и в объяснениях к ней,если особо не оговорено иное, n, X, Z, R1, R2 иR7, а также структурные формулы I, II, III и IV определены выше. 16 На схеме 1 показано получение всех соединений формулы I, в которой Z обозначает нуль и R1 обозначает водород. Такие соединения, при рассмотрении их в контексте схемы 1,обозначают как соединения формулы IA. В соответствии со схемой 1 диен формулы VI взаимодействует с диенофилом формулы VII по механизму известной реакции Дильса Альдера(См. Organic Reactions, 1948, Vol. IV, pp. 1-173). Эта реакция может проводиться без растворителя или при наличии любого растворителя из большой группы, включающей воду, диэтиловый эфир, тетрагидрофуран, бензол, толуол и дихлорэтан. Она может проводиться под атмосферным давлением или в закрытом резервуаре под давлением 1-10 атм (101325-1013250 Па). Время реакции может варьировать в зависимости от особенностей реакции Дильса Альдера. Реакция может идти уже при смешивании реагентов или может потребоваться несколько дней для ее завершения. В том случае, когда Z обозначает NR2, исходный материал формулы VII может образовываться in situ из соответствующего альдегида, в котором Z обозначает кислород, и амина формулы NH2R2, реакция может при этом проводиться в воде (Tetrahedron Lett.,1990, 31, 2603, J. Amer. Soc., 1985, 107, 17681769; Bull. Chem. Soc. Japan, 1992, 65, 61). Продукт реакции Дильса Альдера формулы VIII, в которой R7 отличен от Н, гидролизуют до свободной кислоты с использованием водного раствора кислоты, такой как соляная кислота (НСl), бромисто-водородная кислота(НВr) или серная кислота (Н 2SO4), или с помощью водного раствора гидроксида. Можно добавить растворитель, такой как тетрагидрофуран, метанол, этанол или изопропанол. Гидролиз проводят при температуре от примерно 0 до примерно 150 С и предпочтительной для него температурой является диапазон от примерно комнатной температуры до примерно 65 С. Проводят далее реакцию полученного соединения формулы IX с йодом и основанием по механизму йодолактонизации (J. Org. Chem.,1976, 41, 1229) с получением соответствующего соединения формулы X. В основном указанную реакцию проводят в растворителе, таком как вода, метанол, диэтиловый эфир или тетрагидрофуран или смесь двух или более вышеуказанных растворителей, и основание обычно представляет собой бикарбонат щелочного металла. В типичном случае реакцию проводят при температуре от примерно 0 до примерно 50 С и предпочтительно осуществляют ее при температуре, примерно соответствующей температуре окружающей среды, в течение периода времени от примерно 30 мин до примерно 48 ч и обычно в течение примерно от 8 до 24 ч. Йодолактоновый промежуточный продукт формулы Х обрабатывают затем основанием, в основном гидроксидом щелочного металла в воде, метаноле или этаноле, или же в смеси двух 17 или более указанных растворителей в соответствии с процедурой Бастиаансена (Bastiaansen, J.Org. Chem., 1995, 60, 4240) с получением соответствующего промежуточного продукта формулы XI. Затем проводят этерификацию соединения формулы XI в стандартных условиях, известных в технике (например, при реакции с диазометаном или триметилсилилдиазометаном, или с использованием триметилсилилхлорида и спирта, или же с помощью кислоты, такой как соляная или серная кислота, и спирта, или с использованием хлорформиата, такого как метил-,этил- или бензилформиат. Кетоновая группировка в полученном кетоэфире может быть защищена в виде кеталя при обработке этиленгликолем или ортоформиатом, таким как триметилортоформиат, в условиях дегидратации, таких как добавление молекулярных сит или азеотропное удаление воды,с получением защищенного промежуточного продукта формулы XIII. Для ускорения указанной реакции можно использовать катализатор,такой как триметилсилилхлорид, или кислоту,такую как паратолуолсульфоновая кислота, серная кислота или бензолсульфоновая кислота, а также пиридиния тозилат. Температура реакции может варьировать от примерно температуры окружающей среды до температуры, примерно соответствующей точке кипения с обратным холодильником растворителя. Подходящие растворители включают апротонные растворители,такие как толуол, бензол, тетрагидрофуран, диметоксиэтан, метиленхлорид и дихлорэтан. Обработка кетоэфира (XII) или кеталевого эфира(XIII) основанием, таким как метоксид натрия или этоксид натрия, в спиртовом растворителе при температуре от примерно температуры окружающей среды до примерно температуры кипения с обратным холодильником растворителя в течение от примерно 6 ч до примерно 5 дней, уравновешивает эфир преимущественно в экзо-положении. Декетализация с использованием кислоты, такой как соляная, серная, щавелевая или уксусная кислота, в воде, одной или в смеси с метанолом, тетрагидрофураном или диэтиловым эфиром, дает промежуточный продукт формулы XV. Затем проводят реакцию соединения формулы XV в условиях образования гидантоина Бухерера (См. J. Org. Chem., 1982, 47, 4081 и приведенные в работе ссылки; Vogel's Textbookof Practical Organic Chemistry, 4th Ed., 1978, p. 876) с получением промежуточного продукта синтеза гидантоина формулы XI. Такие условия включают, например, реакцию с цианидом щелочного металла и карбонатом аммония в воде,метаноле или этаноле при температуре от примерно температуры окружающей среды до примерно 150 С и под давлением от примерно давления окружающей среды до примерно 150 фунт/дюйм 2 (850338 Па), в течение времени от 18 примерно 30 мин до примерно 48 ч. Гидролиз полученного гидантоина с использованием минеральной кислоты или водного раствора гидроксида щелочного металла или водного раствора гидроксида бария, в основном при температуре от примерно 50 до примерно 150 С, дает желаемый конечный продукт формулы IA. В альтернативном случае соединение формулы XV может взаимодействовать в условиях проведения синтеза Стрекера (См. Jerry March,Advanced Organic Chemistry, 4th Ed., 1992, p. 965;Vogel, Textbook of Practical Organic Chemistry,4th Ed., 1978, p. 546) с образованием аминонитрильного промежуточного продукта формулы III. Такие условия включают, например, использование либо (а) аммиака и цианисто-водородной кислоты, (б) цианида аммония,(в) цианида щелочного металла и хлорида аммония, либо (г) триметилсилилцианида в спиртовом растворе, таком как метанол или этанол,необязательно при добавлении кислоты, такой как уксусная кислота, при температуре от примерно 20 до примерно 100 С в течение от примерно 0,5 до примерно 24 ч, в основном при температуре от примерно 40 до 80 С в течение примерно 1-8 ч. Гидролиз указанного промежуточного продукта по процедуре, описанной выше для гидантоина, дает целевой конечный продукт формулы IA. Как видно из схемы 2, соединения формулы IA можно в описанных выше стандартных условиях этерифицировать с получением соответствующих диэфиров формулы IVA. В полученных диэфирах содержащаяся в них свободная аминогруппа может быть далее подвергнута преобразованиям в ходе стандартной процедуры восстановительного аминирования с получением соответствующих соединений формул IVB (n не равно нулю), IVC (n равно нулю и R1 обозначает арил) и IVD (n равно нулю и R1 обозначает гетероарил). В том случае, когда имеется алкильная связка R1 с азотом аминогруппы в формуле I, т.е. n не равно нулю, соединение формулы IVA взаимодействует с соответствующим альдегидом формулы R1(CH2)mCHO, где m равно n-1 (т.е. m на единицу меньше, чем n), с образованием соединения формулы IVB. Указанное выше восстановительное аминирование может быть проведено с использованием стандартных методов, известных специалистам со средним уровнем знаний в данной области. В типичном случае реакцию проводят в присутствии восстановителя, такого как цианборгидрид натрия, триацетоксиборгидрид натрия, боргидрид натрия, водород (или химический источник водорода, такой как муравьиная кислота или формиат аммония) и металлического катализатора, такого как платина, палладий или родий,цинк и соляная кислота, диметилсульфид борана или муравьиная кислота, при температуре от примерно -60 до примерно 50 С. Подходящие для использования в данной реакции инертные 19 растворители включают низшие спирты (например, метанол, этанол и изопропанол), диоксан, метиленхлорид, дихлорэтан, уксусную кислоту и тетрагидрофуран (ТГФ. Предпочтительно в качестве растворителя используют метиленхлорид или дихлорэтан, в качестве восстановителя триацетоксиборгидрид натрия и температура составляет примерно 25 С. Соединения формул IVC и IVD представляют собой соединения, идентичные соединениям формулы IVB, с той разницей, что в них n равно нулю и R обозначает арил или гетероарил соответственно. Такие соединения также могут быть получены из соответствующих соединений формулы IVA. В этом случае происходит взаимодействие соответствующих соединений формулы IVA с соединением формулы R1X, где Х обозначает уходящую группу, такую как галоген, трифлат, мезилат или тозилат. Реакцию обычно проводят в растворителе, таком как этанол, N,N-диметилформамид (ДМФ), N,N-диметилацетамид, ацетонитрил, нитрометен, диоксан или дихлорэтан, предпочтительно в ДМФ, при температуре от примерно 0 до примерно 160 С,предпочтительно от примерно 80 до примерно 150 С. Аналогично могут быть получены соединения формулы IVD при взаимодействии соответствующего соединения формулы IVA с гетероароматическим соединением формулы АХ,где А обозначает азотсодержащий гетероцикл и Х обозначает уходящую группу, определенную выше, которая находится в орто-положении по отношению к азоту кольца. Ниже приведены примеры соединений формулы АХ. Присутствие на указанных гетероарильных группах электрон-акцепторных группировок,например, эфирных, нитрильных, сульфоновых и нитрогрупп, еще сильнее активирует их. Соединения формул IVB, IVC и IVD, образуемые в указанной выше реакции, можно превратить в соответствующие желательные соединения формул IB, IC и ID путем их гидролиза по известным в технике методам. Кислоты, пригодные для проведения кислотного гидролиза соединений формулы IVB, включают минеральные кислоты, такие как фтористо-водородная кислота, серная кислота, соляная кислота и бромисто-водородная кислота. Основания, подходящие для проведения щелочного гидролиза соединений формулы IVB, включают гидрокси 003946 20 ды щелочных металлов и гидроксид бария. Температура для проведения кислотного и щелочного гидролиза может варьировать от примерно 0 до примерно 100 С. Предпочтительно указанные реакции проводят примерно при температуре кипения реакционной смеси с обратным холодильником. Другие соединения формул 1 С и ID, в которых R1 обозначает замещенный арил или гетероарил соответственно, могут быть получены из соединений формул 1 С и ID, в которых R1 обозначает нитроарильную или нитрогетероарильную группу соответственно, при использовании известных в химии методов синтеза. Так,например, при использовании процедур, описанных Джерри Марчем (Jerry March, AdvancedOrganic Chemistry, 4th, edition, pp. 721-725 и 1216-1217), нитрогруппа может быть восстановлена до амина. Вновь образованный амин может быть замещен другими заместителями в ходе диазотирования и других реакций, описанных в указанной работе. Например, эти способы позволяют получить соединения формулы I, в которой R1 обозначает арильную или гетероарильную группу, замещенную амино-, меркаптогруппами, галогеном, цианогруппой или фенилом. Исходные материалы формул VI и VII, а также формул R1X и AX - это либо известные из уровня техники и коммерчески доступные соединения, либо могут быть легко получены из коммерчески доступных или известных соединений с использованием известных в технике методов. Если особо не оговорено иное, давление,используемое для проведения реакций, не является важным фактором. В основном, указанные реакции проводят под давлением от примерно 1(101325 Па) до примерно 3 атм (303975 Па),предпочтительно под давлением окружающей среды (примерно 1 атм) (101325 Па). Для получения других соединений формулы I, специально не описанных в экспериментальном разделе, могут быть использованы очевидные для специалистов со средним уровнем знаний в данной области сочетания приведенных выше реакций. Те соединения формулы I, которые являются основными по своей природе, способны образовывать множество различных солей с неорганическими и органическими кислотами. Кислота, используемая для приготовления фармацевтически приемлемых солей добавления кислоты основных по природе соединений по настоящему изобретению, должна давать нетоксичные соли добавления кислоты, например,соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат,цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, са 21 харат, бензоат, метансульфонат и памоат [например, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Хотя такие соли должны быть фармацевтически приемлемыми для возможности введения животным, зачастую на практике желательно выделять соединение формулы I из реакционной смеси в виде фармацевтически приемлемой соли и затем просто превращать ее в свободное основание при обработке щелочным реагентом,после чего преобразовывать свободное основание в фармацевтически приемлемую соль добавления кислоты. Кислотно-аддитивные соли основных соединений по настоящему изобретению легко получают при обработке основных соединений по настоящему изобретению, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя получают желательную твердую соль. Те соединения формулы I, которые являются кислыми по своей природе, способны образовывать соли присоединения основания с различными фармакологически приемлемыми катионами. Эти соли получают с использованием традиционных методик. Основания, которые используют в качестве реагентов для приготовления фармацевтически приемлемых основноаддитивных солей по настоящему изобретению,должны давать нетоксичные основноаддитивные соли с кислыми соединениями формулы I. Такие нетоксичные соли добавления основания включают соли, полученные с использованием таких фармацевтически приемлемых катионов, как натрий, калий, кальций, магний и др. Указанные соли могут быть легко получены при обработке соответствующих кислых соединений водным раствором, содержащим фармакологически приемлемые катионы, с последующим выпариванием досуха полученного раствора, предпочтительно под пониженным давлением. Альтернативно, они также могут быть получены при смешивании растворов кислых соединений в низших спиртах и алкоксида желательного щелочного металла, с последующим выпариванием досуха полученного раствора тем же способом, что и ранее. В любом случае, для гарантии завершения реакции и с целью повышения выхода желательного конечного продукта используют стехиометрические количества реагентов. Соединения формулы I и их фармацевтически приемлемые соли (которые в общем далее будем называть как активные соединения по настоящему изобретению), представляя собой мощные антагонисты лигандов метаботропных рецепторов глютамата, могут быть пригодны при лечении нейродегенеративных, психотропных и состояний, вызванных приемом лекарств или алкоголя. В этой связи активные соедине 003946 22 ния по настоящему изобретению могут применяться для лечения или профилактики мозгового удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Хантингтона, бокового амиотрофического склероза, эпилепсии, деменции, вызванной СПИДом, мышечных спазмов, головной боли по типу мигрени, недержания мочи, психоза, судорог, перинатальной гипоксии, гипоксии(такой как состояния, вызванные сдавлением,хирургическим вмешательством, вдыханием дыма, асфиксией, а также возникающие при утоплении, удушении, электротравме или передозировке лекарственных препаратов или алкоголя), остановки сердца, повреждения нейронов при гипогликемии, химической зависимости и привыкание (например, зависимости от алкоголя, опиатов, бензодиазепинов, никотина, героина или кокаина или привыкание к ним), повреждения глаз, ретинопатии, невропатии сетчатки,шума в ушах, идиопатической и вызванной лекарствами болезни Паркинсона, беспокойства,рвоты, отека мозга, хронической и острой боли,поздней дискинезии и сердечной недостаточности, развивающейся после шунтирования сердца и трансплантации. Для определения активности терапевтических средств по настоящему изобретению в качестве агонистов и антагонистов метаботропных рецепторов глютамата используют следующую процедуру. Клетки яичника китайского хомячка(mGluR2 и пкДНК 3) по кальций-фосфатному методу. Отбирают позитивные на генетицин клоны (G418, Gibco, 500-700 мкг/мл) и анализируют их в полимеразно-цепьевой реакции с обратной транскриптазой ОТ-ПЦР на наличиеmGluR2 мРНК (с использованием праймеров для mGluR2: 5'-AAG TGC CCG GAG AAC TTCTTG AGT CCA-3'). Позитивные клоны выращивают до слияния и определяют реакцию на цАМФ в присутствии 10 мкМ форсколина. Слившиеся клоны замораживают и хранят в жидком азоте. Клетки яичника китайского хомячка(СНО), стабильно трансфицированные метаботропным рецептором глютамата крысы mGluR2,растят до слияния на среде Игла в модификации Дульбекко (ДМЕМ) (номер 11960-044 в каталоге Гибко (Gibco, содержащей 10% диализованной околоплодной сыворотки теленка, 1% пролина, 0,11 мг/мл пирувата натрия, 0,5 мг/мл генетицина, 2 мМ L-глютамина и пенициллин/стрептомицин. Клетки собирают с использованием 5 мМ раствора этилендиаминтетрауксусной кислоты (ЭДТА) и затем центрифугируют их со скоростью 800 об./мин при 4 С (в центрифуге с охлаждением). Оставшийся осадок ресуспендируют в фосфатно-буферном растворе, содержащем 30 мМ HEPES (Gibco, catino, 23 15630-080), 5 мМ хлорида магния (MgCl2), 300 мкМ 3-изобутил-1-метилксантина (ИБМК) и 0,1% декстрозы. Клеточную суспензию вносят по 200 мкл в полипропиленовые плоскодонные пробирки, которые затем помещают на 22 мин в нагретую до 37 С водяную баню. Если соединение исследуют на антагонистическую активность, его помещают в баню с клетками для предварительной инкубации в течение первых 11 мин. По окончании 11 мин добавляют 5 мкМ форсколина и исследуемое соединение в известной концентрации и продолжают инкубацию еще в течение 11 мин. Если соединение исследуют на агонистскую активность, клетки встряхивают в бане в течение первых 11 мин и затем на оставшиеся 11 мин инкубации добавляют 5 мкМ форсколина и агонист в известной концентрации. В любом случае реакцию останавливают добавлением 25 мкл 6N перхлорной кислоты (ПХК) и сразу переносят пробирки в водяную баню со льдом. Доводят рН каждого образца примерно до 8,0 путем добавления гидроксида калия (КОН) и стабилизируют его добавлением Триса, рН 7,4. Аликвоты по 25 мкл анализируют с помощью коммерческого набора для оценки уровня конкурентного связывания(Amersham TRK 432). Затем образцы осаждают на GF/B фильтры, смоченные в 0,5% ПЭИ, с помощью 96-гнездного устройства для сбора клеток Скатрон (Skatron). На жидкостном сцинтилляционном счетчике 1205 Betaplate проводят количественную оценку образцов. Полученные на счетчике Betaplate значения в имп/мин переводят в пмоль цАМФ/мг белка/минуту инкубации с форсколином с использованием программы Excel. Из данных концентрационной кривой вычисляют значения ЭК 50 и ИК 50. Ниже приведена методика определения агонистской активности терапевтических средств по настоящему изобретению в качестве агонистов метаботропных рецепторов глютамата. Клетки яичника китайского хомячка(СНО), стабильно трансфицированные метаботропным рецептором глютамата крысы mGluR2,растят до слияния на среде ДМЕМ (номер 11960-044 в каталоге Гибко (Gibco, содержащей 10% диализованной околоплодной сыворотки теленка, 1% пролина, 0,11 мг/мл пирувата натрия, 0,5 мг/мл генетицина, 2 мМ Lглютамина и пенициллин/стрептомицин. Клетки собирают с использованием 5 мМ раствора ЭДТА и гомогенизируют в ручном стекляннотефлоновом гомогенизаторе (10 ударов), после чего добавляют 50 объемов фосфатнобуферного раствора (ФБР), и раствор центрифугируют со скоростью 18000 об./мин в течение 10 мин при 4 С. Осадок гомогенизируют и ресуспендируют в буфере для анализа (100 мМ 24 Перед самым началом эксперимента готовят реакционную смесь, содержащую 6 мМ MgCl2,0,5 мМ аденозинтрифосфата (АТФ), 0,5 мМ 3 изобутил-1-метилксантана (ИБМК), 0,1 мМ гуанозинтрифосфата (ГТФ), 10 мМ фосфокреатина,0,31 мг/мл креатинфосфокиназы (указаны конечные концентрации в тесте). Последовательно на 96-гнездное полипропиленовое плато вносят 20 мкл исследуемого соединения, 20 мкл форсколина (конечная концентрация 5 мкМ), 20 мкл реакционной смеси и 40 мкл тканевого экстракта. Плато инкубируют в нагретой до 37 С водяной бане в течение 15 мин. Реакцию останавливают добавлением 50 мкл 40 мМ ЭДТА. Затем плато переносят в лед и встряхивают в течение 10-15 мин, после чего отбирают аликвоту 25 мкл для анализа в коммерческом устройстве для оценки уровня конкурентного связывания (Amersham TRK 342). После выдерживания в холодильнике в течение 2-18 ч образцы осаждают наGF/B фильтры, смоченные в 0,5% полиэтиленимине (ПЭИ), с помощью 96-гнездного устройства для сбора клеток Скатрон (Skatron). На жидкостном сцинтилляционном счетчике 1205 Betaplate проводят количественную оценку образцов. Полученные на счетчике Betaplate значения в имп/мин переводят в пмоль цАМФ/ячейку с использованием программы Excel. Активность агонистов определяют по проценту снижения сигнала форсколина также в программе Excel. По графику линейной регрессии концентрацияответ вычисляют значения ЭК 50. Композиции по настоящему изобретению могут быть приготовлены традиционным способом с использованием одного или более фармацевтически приемлемых носителей. Так, активные соединения по настоящему изобретению могут быть введены в композицию для перорального, трансбуккального, трансдермального(например, в виде пластырей), интраназального,парентерального (например, внутривенного,внутримышечного или подкожного) или ректального применения или с получением формы,пригодной для введения ингаляцией или инсуффляцией. Фармацевтические композиции, пригодные для перорального применения, могут иметь вид, например, таблеток или капсул, полученных традиционными способами с использованием фармацевтически приемлемых наполнителей, таких как связующие вещества (например,желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); замасливатели (например, стеарат магния, тальк или кремнезем); средства, способствующие разложению (например, картофельный крахмал или натрий-гликоллят крахмала); или увлажнители (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболоч 25 кой с помощью известных в технике методов. Жидкие препараты для перорального введения могут, например, иметь вид растворов, сиропов или суспензий, а также могут представлять собой сухой продукт, который перед употреблением разводят водой или другим подходящим носителем. Указанные жидкие препараты могут быть приготовлены традиционными методами с использованием фармацевтически приемлемых добавок, таких как средства, способствующие суспендированию (например, сироп сорбита,метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители(например, миндальное масло, сложные эфиры жирных кислот или этиловый спирт); и консерванты (например, метил- или пропил-пгидроксибензоаты или сорбиновая кислота). Композиция для трансбуккального введения может иметь вид таблеток или леденцов,приготовленных традиционным способом. Активные соединения по настоящему изобретению могут быть включены в состав композиции, пригодной для парентерального введения инъекцией, включая обычную методику катетеризации и инфузию. Композиции для инъекций могут быть приготовлены в стандартной дозированной форме, например, в ампулах или в контейнерах для многоразового использования с добавлением консерванта. Указанные композиции могут представлять собой суспензии, растворы или эмульсии в масляном или водном носителе, которые могут содержать средства,облегчающие приготовление композиций, например, агенты, способствующие суспендированию, стабилизирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может представлять собой порошкообразный препарат, который разводится перед употреблением подходящим носителем, например, стерильной водой без пирогенов. Активные соединения по настоящему изобретению могут быть также приготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например,содержащих обычную для суппозиторий основу, такую как масло какао или другие глицериды. Для интраназального введения или введения ингаляцией активные соединения по настоящему изобретению готовятся для доставки в виде раствора или суспензии из поршневого контейнера, высвобождаемых пациентом при надавливании на контейнер или на поршень,или в виде аэрозольного распыления из контейнера или ингалятора, в которых используется подходящий сжатый пропеллент, например,дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, двуокись углерода или другой приемлемый газ. В случае аэрозольного баллончика стандартная доза может отмеряться 26 клапаном, высвобождающим нужное количество. Контейнер или распылитель, находящиеся под давлением, могут включать раствор или суспензию активного соединения. Применяемые в ингаляторе или инсуффляторе капсулы и картриджи (выполненные, например, из желатина) могут содержать порошкообразную смесь соединения по настоящему изобретению и подходящий порошок основы, такой как лактоза или крахмал. Доза активного соединения по настоящему изобретению, предлагаемая для перорального,парентерального или трансбуккального введения среднестатистическому взрослому человеку в указанных выше условиях (например, при мозговом ударе), составляет от 0,01 до 50 мг/кг активного ингредиента на единицу дозы, которая может вводиться от 1 до 4 раз в день. Аэрозольные формы, предназначенные для лечения указанных выше состояний (например,мозгового удара) у среднестатистического взрослого человека, предпочтительно готовят так, чтобы каждая отмеряемая доза или впрыск аэрозоля содержал от 20 до 1000 мг соединения по настоящему изобретению. Общая дневная доза аэрозольной формы составляет от 100 до 10 мг. Эта доза может быть разбита на несколько приемов, например, 2, 3, 4 или 8 раз в день, содержащих, например, по 1, 2 или 3 дозы каждая. Приведенные ниже примеры поясняют получение соединений по настоящему изобретению. В них используют коммерческие реагенты без дополнительной очистки. Точки плавления не корректируют. Если особо не оговорено иное, все данные ЯМР определяют при 250, 300 или 400 МГц в дейтерохлороформе, указывают в виде частей на миллиони относят к синхронизирующему сигналу дейтерия растворителя в образце. Все неводные реакции проводят в сухой стеклянной посуде с применением сухих растворителей в инертной среде для удобства и увеличения выхода. Если особо не оговорено иное, все реакционные смеси перемешивают с использованием магнитной мешалки. И также,если не оговорено иное, все данные по массспектру получают с использованием условий,способствующих проявлению химических взаимодействий. Температура окружающей среды или комнатная температура соответствует 20-25 С. Точки плавления не корректируют. В приведенных ниже примерах 1-14 описаны некоторые соединения формулы I. Эти примеры даны только для иллюстрации различных аспектов настоящего изобретения. Их ни в коей мере не следует рассматривать как ограничивающие настоящее изобретение, которое более полно раскрывается далее в описании и определяется прилагаемой формулой изобретения. Пример 1. 2-(Эндо)аминобицикло[2.2.1] гептан-2-(экзо),6-(экзо)дикарбоновая кислота.(9 мл) добавляют цианид калия (0,456 г, 7 ммоль). Смесь нагревают до 41,5 С и перемешивают в течение ночи. Затем смесь разбавляют водой и проводят повторную экстракцию этилацетатом. Объединенную органическую фазу промывают водой, высушивают над сульфатом магния и концентрируют с получением белого твердого вещества. Указанное твердое вещество очищают флэш-хроматографией на силикагеле(40 х 80 мм) при проведении элюции в следующем режиме: 50% этилацетат/гексан - 112 мл пусто; 42 мл - неидентифицированные примеси; 332 мл - пусто; 332 мл - 0,299 г целевого продукта в виде белого твердого вещества, которое характеризуется следующими параметрами: 1H ЯМР (CDCl3) (основной диастереомер с азотом эндогидантоина)10,60 (с, 1 Н), 8,23 (с, 1 Н),3,55 (с, 3H), 2,81 (к, J=4,5 Гц, 1 Н), 2,42 (с, 1 Н),2,26 (с, 1 Н), 2,04 (д, J=10,1 Гц, 1 Н), 1,92 (дт,J=3,5, 12,25 Гц, 1 Н), 1,84-1,76 (м, 1 Н), 1,60-1,52(м, 1 Н), 1,30 (д, J=10,1 Гц, 1 Н), 1,20 (д, J=12,7 Гц, 1 Н). Б. 2-(Эндо)аминобицикло[2.2.1]гептан-2,6 ди(экзо)карбоновая кислота. Смесь метилбицикло[2.2.1)гептан-2-он-6 экзокарбоксилата гидантоина (0,10 г, 0,41 ммоль) в 6N соляной кислоте (10 мл) нагревают при температуре кипения с обратным холодильником в течение 24 ч, затем охлаждают и выдерживают при температуре окружающей среды в течение 72 ч. Далее реакционную смесь концентрируют под вакуумом с получением белого твердого вещества. Указанное твердое вещество растворяют в воде с помощью 2 капель 6N соляной кислоты и наносят на ионообменную колонку Дауэкс (Dowex) 50 х 8100 (7 мл смолы,полученной при элюции водой до достижения в элюенте рН 4). Колонку элюируют водой до достижения рН 4,5. Элюцию продолжают с использованием 1N гидроксида аммония. Положительные по нингидрину фракции собирают и лиофилизируют с получением 0,032 г белого твердого продукта, которое характеризуется следующими параметрами: 1H ЯМР (D2O)2,53 28 А. Гидантоин бицикло[2.2.1]гептан-2-он-6 карбоновой кислоты. Раствор метил гидантоин бицикло[2.2.1] гептан-2-он-6-экзо-карбоксилата (1,02 г, 4,28 ммоль) в 6N соляной кислоте (20 мл) нагревают при температуре кипения с обратным холодильником в течение 1 ч. При охлаждении до температуры окружающей среды осаждается белый твердый материал. Указанное твердое вещество собирают и высушивают на воздухе с получением 0,776 г целевого продукта, который характеризуется следующими параметрами: 1H ЯМР(искаженный т, 1 Н), 1,34-1,19 (искаженный т,2 Н). Б. Разделение гидантоин бицикло[2.2.1] гептан-2-он-6-экзокарбоновой кислоты на энантиомеры. Гидантоин бицикло[2.2.1]гептан-2-он-6 карбоновую кислоту (0,776 г) объединяют с метанолом (20 мл) и добавляют (s)-(-)-метилбензиламин (0,470 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. В течение этого периода раствор становится гомогенным и затем из него выпадает белый осадок. Осадок собирают (0,50 г) и дважды кристаллизуют из метанола. Повторно кристаллизованную соль обрабатывают 1N соляной кислотой и несколько раз экстрагируют этилацетатом. Объединенный органический слой высушивают над сульфатом магния и концентрируют с получением 0,120 г (-)энантиомера гидантоин бицикло[2.2.1]гептан-2-он-6-карбоновой кислоты, который характеризуется спектром ЯМР, идентичным таковому у рацемического материала и имеет []D = -36,11 (с = 0,925, метанол). Результаты хиральной ВЭЖХ (колонка сchiralcel OG, смесь 95/5 гексана/этанола с 0,1% трифторуксусной кислотой (растворителем),скорость течения = 1 мл/мин, обнаружение в УФ при 214 нм) показывают, что соединение характеризуется 100% энантиомерной чистотой со временем удерживания 14,5 мин. Объединяют маточную жидкость, оставшуюся от разделения указанной выше соли, и обрабатывают ее 1N соляной кислотой. Повторная экстракция этилацетатом позволяет получить гидантоин бицикло[2.2.1]гептан-2-он-6 карбоновую кислоту, обогащенную (+)энантиомером. Указанный материал обрабатывают (R)(+)метилбензиламином, как указано выше, с получением 0,066 г (+)-гидантоин бицикло[2.2.1]гептан-2-он-6-карбоновой кислоты в виде белого твердого вещества, которое имеет []D =+32,77 (с = 0,900, метанол). Хиральная ВЭЖХ,проведенная по указанному выше методу, показала, что в образце на 98,1% преобладает указанный энантиомер и время его удерживания составляет 17,56 мин. 29 В. (+)-2-(Эндо)аминобицикло[2.2.1]гептан 2-(экзо),6-(экзо)дикарбоновой кислоты гидрохлорид. Гидантоин (+)-бицикло[2.2.1]гептан-2-он 6-карбоновая кислота (0,098 г, 0,4 ммоль) объединяют с 6N соляной кислотой (20 мл) и нагревают при температуре кипения с обратным холодильником в течение 48 ч. Смесь концентрируют под вакуумом с получением 0,095 г целевого продукта, который имеет []D = +20,31 (с = 1,07, метанол). Г. (-)-2-(Эндо)аминобицикло[2.2.1]гептан 2-(экзо),6-(экзо)дикарбоновой кислоты гидрохлорид. С использованием описанной выше процедуры гидролиза гидантоин (-)-бицикло[2.2.1] гептан-2-он-6-карбоновую кислоту превращают в (-)целевой продукт, который имеет []D =(0,25 г, 1,1 ммоль) (см. ниже способ получения 1), метиленхлорида (10 мл), бензальдегида(0,134 мл) и триацетоксиборгидрида натрия (1,2 г, 5,5 ммоль) перемешивают в течение 16 ч. Реакцию останавливают добавлением 0,5N HCl(20 мл) и перемешивают в течение 30 мин. Разделяют фазы и органический слой промывают насыщенным водным раствором бикарбоната,водой и солевым раствором. Органический слой высушивают над сульфатом магния и концентрируют с получением 0,225 г бесцветного масла. Указанное масло хроматографируют на силикагеле (с использованием картриджа Flash 40s от компании Biotage (Charlcottesville, Virginia,США); картридж Flash 40s содержит sil KP) со следующим режимом элюции: 10% этилацетат/гексан, 100 мл - пусто; 100 мл - 0,043 г диметил-2-(эндо)бензиламинобицикло[2.2.1] гептан-2-(экзо)-6-(экзо)дикарбоксилата в виде бесцветного масла, которое характеризуется следующими параметрами: ЯМР (СDCl3)7,317,29 (м, 5 Н), 3,73 (с, 3H), 3,66 (с, 3H), 3,51 (Абк,1-3=40 Гц, J=13 Гц, 2 Н), 3,32 (дд, J=5,9 Гц,1 Н), 2,95 (с, 1 Н), 2,28 (шс, 1 Н), 2,21-2,15 (м, 1 Н),1,97-1,90 (м, 1 Н), 1,88 (с, 1 Н), 1,59-1,54 (м, 1 Н),1,45 (Абк, 1-3=24 Гц, J=11 Гц, 2 Н), 1,10 (дц,J=3,13 Гц, 1 Н). Б. Гидролиз эфирных групп. Смесь диметил 2-(эндо)бензиламинобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоксилата (0,04 г, 0,126 ммоль), полученного в соответствии с процедурой предыдущего раздела (А), и 6N НСl (5 мл) нагревают при 80 С в течение ночи. Затем добавляют еще 6N НСl (5 мл) и реакционную смесь нагревают при 103 С 30 в течение 24 ч. Смесь охлаждают и концентрируют. Данные ЯМР показывают, что гидролизуется одна сложно-эфирная группа. Остаток объединяют с водой (5 мл) и этанолом (5 мл) и добавляют LiOH (0,15 г, 6,2 ммоль). Смесь нагревают при температуре 65 С в течение 16 ч. Далее, реакционную смесь концентрируют и большую часть оставшегося твердого вещества отбирают этанолом. Затем указанный твердый материал отделяют от этанольного раствора фильтрованием через целит. Этанольный фильтрат концентрируют с получением 0,242 г белого твердого вещества. Указанный твердый материал смывают 1N HCl (1 мл) и наносят на колонку с ионообменной смолой AG50w-x8(0,15 г, которая была предварительно промыта водой до тех пор, пока рН повысился до 4,5). Указанную смесь перемешивают в течение недели. Подготавливают колонку SCX (0,5 г сильного катионообменника, полученного от компании Burdick and Jackson (Muskegon, Мичиган,США) (номер по каталогу 9094), пропуская через нее воду до достижения в элюенте рН 4,5. Ионообменную смолу и ее раствор наносят на колонку SCX и проводят элюцию в следующем режиме: вода, 3 мл - неизвестный материал; вода, 30 мл - пусто; 1N гидроксид аммония, 28 мл- 0,02 г целевого продукта данного примера,который характеризуется следующими параметрами: ЯМР (D2O)7,23-7,15 (м, 5 Н), 3,32(дд, J=5, 9,5 Гц, 1 Н), 2,03 (с, 1 Н), 1,87-1,81 (шд,1 Н), 1,58-1,51 (м, 1 Н), 1,41 (т, J=10,5 Гц, 1 Н),1,26 (м, 2 Н), 0,88 (д, J=11,5 Гц, 1 Н), APCI MS,р+1=290,2. Пример 4. 2-(Эндо)фенилэтиламинобицикло[2.2.1]гептан-2-(экзо)-6-(экзо)дикарбоновая кислота. Следуя по существу указанной выше процедуре примера 3, но при проведении непосредственного гидролиза LiOH (без стадии частичного кислотного гидролиза) из диметил 2(эндо)аминобицикло[2.2.1]гептан-2-(экзо)-6(экзо)дикарбоксилата (0,015 г, 0,066 ммоль),метиленхлорида (2 мл), фенилацетальдегида(0,01 мл, 0,08 ммоль) и триацетоксиборгидрида натрия (0,07 г, 0,33 ммоль) получают целевое соединение настоящего примера. Указанное целевое соединение настоящего примера характеризуется следующими параметрами: ЯМР(дд, J=5, 9 Гц, 1 Н), 2,05-2,01 (м, 1 Н), 1,82 (ддд,J=3, 5, 13 Гц, 1 Н), 1,58-1,51 (м, 1H), 1,41 (т,J=10,5 Гц, 1H), 1,24-1,16 (м, 2H), 0,85 (дд, J=2,11,5 Гц, 1H); APCI MS, p+1=304,1. Способ получения 1. Гидрохлорид диметил 2-(эндо)аминобицикло[2.2.1]гептан-2-(экзо)6-(экзо)дикарбоксилата. 2-(Эндо)аминобицикло[2.2.1]гептан-2(экзо)-6-(экзо)дикарбоновая кислота (0,010 г,0,05 ммоль) растворяют в метаноле (5 мл) и рас 31 твор насыщают газообразным НСl. Смесь нагревают в течение ночи при температуре кипения с обратным холодильником. Далее реакционную смесь охлаждают и концентрируют с получением целевого соединения указанного способа в виде белого твердого вещества, которое характеризуется следующими параметрами: ЯМР (СD3 ОD)3,84 (с, 3H), 3,68 (с, 3H), 2,90 (с,1 Н), 2,74-2,62 (м, 1 Н), 2,54-2,40 (м, 2 Н), 2,061,96 (м, 1 Н), 1,88 (д, J=11 Гц, 1 Н), 1,84-1,74 (м,1 Н), 1,52 (дд, J=4,5, 11 Гц, 1 Н), 1,34 (дд, J=1,9,13,5 Гц, 1 Н). Способ получения 2. Диэтил 2-(эндо) аминобицикло[2.2.1]гептан-2-(экзо)дикарбоксилат. Соединение настоящего способа получения также применяется для получения соединений формулы I. 2-(Эндо)аминобицикло[2.2.1] гептан-2-(экзо)-6-(экзо)дикарбоновую кислоту(0,392 г, 1,96 ммоль) растворяют в этаноле (15 мл) и раствор насыщают газообразным НСl. Смесь нагревают в течение ночи при температуре кипения с обратным холодильником. Далее раствор концентрируют и остаток обрабатывают насыщенным водным раствором бикарбоната натрия. Указанную водную смесь затем обрабатывают карбонатом натрия для доведения рН до 10. Водный слой повторно экстрагируют этилацетатом. Объединенный органический слой высушивают над сульфатом магния и концентрируют с получением целевого соединения настоящего способа в виде бледно-желтого масла, которое характеризуется следующими параметрами: ЯМР (CDCl3)4,20-4,05 (м, 4 Н), 3,30 где n принимает значения от 0 до 6,Х обозначает CH2, CH2CH2 или кислород,Z обозначает CHR2 или NR2 иR1 и R2 выбирают независимо из водорода,(C1-C6)алкила, арила и гетероарила, при этом указанный арил выбирают из фенила и нафтила и указанный гетероарил выбирают из 5- и 6 членных ароматических гетероциклических колец, которые содержат от одного до четырех гетероатомов, выбранных независимо из азота,кислорода и серы, и при этом указанные арильная и гетероарильная группировки могут быть необязательно замещены одним или большим числом заместителей, которые выбирают независимо из галогена, -S(C1-C6)алкила, -S(О)(C1 003946C6)алкила, -S(О)2(C1-C6)алкила, (C1-С 6)алкила,необязательно замещенного от одного до семи атомами фтора, (C1-C6)алкокси, необязательно замещенного от одного до семи атомами фтора,амино, нитро, циано, карбокси, -CO2(C1-С 6) алкила, (C1-C6)алкиламино, ди-[(C1-C6)алкил] аминофенокси, анилино и фенилтио,при условии, что ни одна из вышеуказанных гетероарильных группировок не содержит в кольце более одного атома кислорода или также в кольце более одного атома серы,или их фармацевтически приемлемые соли. 2. Соединение по п.1, где Z обозначает СН 2. 3. Соединение по п.1, в котором R1 выбирают из группы, состоящей из водорода, фенила и фенила, замещенного одним или двумя заместителями. 4. Соединение по п.1, в котором n обозначает 0, 1 или 2. 5. Соединение по п.1, в котором Х обозначает CH2. 6. Соединение по п.1, выбранное из группы, состоящей из 2-(эндо)аминобицикло[2.2.1]гептан-2(экзо)-6-(экзо)дикарбоновая кислота;(-)-2-(эндо)аминобицикло[2.2.1]гептан-2(экзо)-6-(экзо)дикарбоновая кислота; 2-(эндо)бензиламинобицикло[2.2.1]гептан 2-(экзо)-6-(экзо)дикарбоновая кислота и 2-(эндо)фенилэтиламинобицикло[2.2.1] гептан-2-(экзо)-6-(экзо)дикарбоновая кислота. 7. Фармацевтическая композиция, предназначенная для лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом,мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, химическую зависимость и привыкание, повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию,биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, осуществляемое или облегчаемое за счет модуляции нейротрансмиссии глютамата у млекопитающего, включающая эффективное для лечения такого заболевания 33 или состояния количество соединения по п.1 и фармацевтически приемлемый носитель. 8. Способ лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, повреждение глаз и ретинопатию,идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства,посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга,хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, которое осуществляется или облегчается за счет модуляции нейротрансмиссии глютамата у млекопитающего,отличающийся тем, что он включает введение млекопитающему, нуждающемуся в такой терапии, эффективного для лечения указанного заболевания или состояния количества соединения по п.1 и фармацевтически приемлемого носителя. 9. Фармацевтическая композиция, предназначенная для лечения заболевания или состояния, выбранных из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом,мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, химическую зависимость и привыкание,повреждение глаз и ретинопатию, идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку,общее состояние беспокойства, посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние,болезнь Туретта, рвоту, отек мозга, хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, причем лечение осуществляется или состояние облегчается за счет модуляции нейротрансмиссии глютамата у млекопитающего, включающая(а) соединение по п.1 или его фармацевтически приемлемую соль, 003946(б) ингибитор повторного захвата серотонина или лиганд рецептора серотонина-1A(5HT1A), или фармацевтически приемлемую соль такого ингибитора или лиганда и(в) фармацевтически приемлемый носитель,причем количества соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, содержащиеся в данной композиции, таковы, что сочетание двух активных ингредиентов оказывается эффективным для лечения указанного заболевания или состояния. 10. Способ лечения заболевания или состояния, выбранного из группы, включающей мозговой удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера, хорею Хантингтона, боковой амиотрофический склероз, деменцию, вызванную СПИДом, мышечные спазмы, головную боль по типу мигрени, недержание мочи, психоз, судороги, перинатальную гипоксию, гипоксию, остановку сердца, повреждение нейронов при гипогликемии, толерантность к опиату и синдром абстиненции, повреждение глаз и ретинопатию,идиопатическую и вызванную лекарствами болезнь Паркинсона, тревогу, включая паническую атаку, общее состояние беспокойства,посттравматический стресс-синдром, обычные фобии и социальные фобии, шизофрению, депрессию, биполярное расстройство, навязчивое состояние, болезнь Туретта, рвоту, отек мозга,хроническую и острую боль, позднюю дискинезию и сердечную недостаточность, развивающуюся после шунтирования сердца и трансплантации у млекопитающих, осуществляемое или облегчаемое за счет модуляции нейротрансмиссии глютамата у млекопитающего,отличающийся тем, что он включает введение млекопитающему, нуждающемуся в таком лечении,(а) соединения по п.1 или его фармацевтически приемлемой соли и(б) ингибитора повторного захвата серотонина или лиганда рецептора серотонина-1A(5HT1A), или фармацевтически приемлемой соли такого ингибитора или лиганда,причем количества соединения формулы I и ингибитора повторного захвата серотонина или лиганда рецептора 5HT1A, используемые в рамках данного способа, таковы, что сочетание двух активных ингредиентов оказывается эффективным для лечения указанного заболевания или состояния. 11. Фармацевтическая композиция по п.9,отличающаяся тем, что (б) представляет собой ингибитор повторного захвата серотонина, выбранный из сертралина, флуоксетина, флувоксамина, пароксетина, циталопрама, фенфлурамина и фемоксетина. 12. Способ по п.10, отличающийся тем, что(б) представляет собой ингибитор повторного где n принимает значения от 0 до 6,Х обозначает CH2, СН 2 СН 2 или кислород,Z обозначает CHR2 или NR2 иR1 и R2 выбирают независимо из водорода,(C1-С 6)алкила, арила и гетероарила, при этом указанный арил выбирают из фенила и нафтила и указанный гетероарил выбирают из 5- и 6 членных ароматических гетероциклических колец, которые содержат от одного до четырех гетероатомов, выбранных независимо из азота,кислорода и серы, и при этом указанные ариль 36 ная и гетероарильная группировки могут быть необязательно замещены одним или большим количеством заместителей, выбранных независимо из галогена, -S(C1-С 6)алкила, -S(О)(C1C6)алкила, -S(O)2(C1-С 6)алкила, (C1-С 6)алкила,необязательно замещенного от одного до семи атомами фтора, (C1-С 6)алкокси, необязательно замещенного от одного до семи атомами фтора,амино, нитро, циано, карбокси, -CO2(C1-С 6) алкила, (C1-С 6)алкиламино, ди-[(C1-C6)алкил] аминофенокси, анилино и фенилтио, иR7 обозначает водород, (C1-C6)алкил или бензил,при условии, что ни одна из вышеуказанных гетероарильных группировок не содержит в кольце более одного атома кислорода или более одного атома серы.
МПК / Метки
МПК: A61K 31/198, A61P 25/00, C07C 229/50
Метки: бицикло, соединения, родственные, 2.2.1, гептаны
Код ссылки
<a href="https://eas.patents.su/19-3946-biciklo-221-geptany-i-rodstvennye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Бицикло [2.2.1] гептаны и родственные соединения</a>
Предыдущий патент: Хинолинкарбоксамиды в качестве противовирусных агентов
Следующий патент: Бензимидазолы, их получение и их применение в качестве лекарственных средств
Случайный патент: Способ модификации поверхности стекла