Применение рацематов пиноцембрина для получения лекарственных средств для лечения инсульта
Номер патента: 22275
Опубликовано: 30.12.2015
Авторы: Лю Жуй, Гао Мэй, Лю Хайли, Ли Иньгуй, Гуан Хунмей, У Сун, Фэн Сяолун, Ци Янь, Ши Ин, Ду Гуаньхуа, Шэнь Дунминь, Ван Цзиньсюй
Формула / Реферат
1. Применение рацемата пиноцембрина, рацемата соли пиноцембрина или рацемата гидрата пиноцембрина для получения лекарственного средства для профилактики и лечения инсульта, вызванного гипертензией.
2. Фармацевтическая композиция для профилактики и лечения вызванного гипертензией инсульта, содержащая рацемат пиноцембрина, рацемат соли пиноцембрина или рацемат гидрата пиноцембрина и фармацевтически приемлемый наполнитель.
3. Применение (R)-пиноцембрина или его соли или гидрата для получения лекарственного средства для профилактики и лечения инсульта, вызванного гипертензией.
4. Применение (R)-пиноцембрина или его соли или гидрата для получения лекарственного средства для профилактики и лечения острого ишемического инсульта.
5. Фармацевтическая композиция для профилактики и лечения инсульта, вызванного гипертензией, содержащая (R)-пиноцембрин или его соль или гидрат и фармацевтически приемлемый наполнитель.
Текст
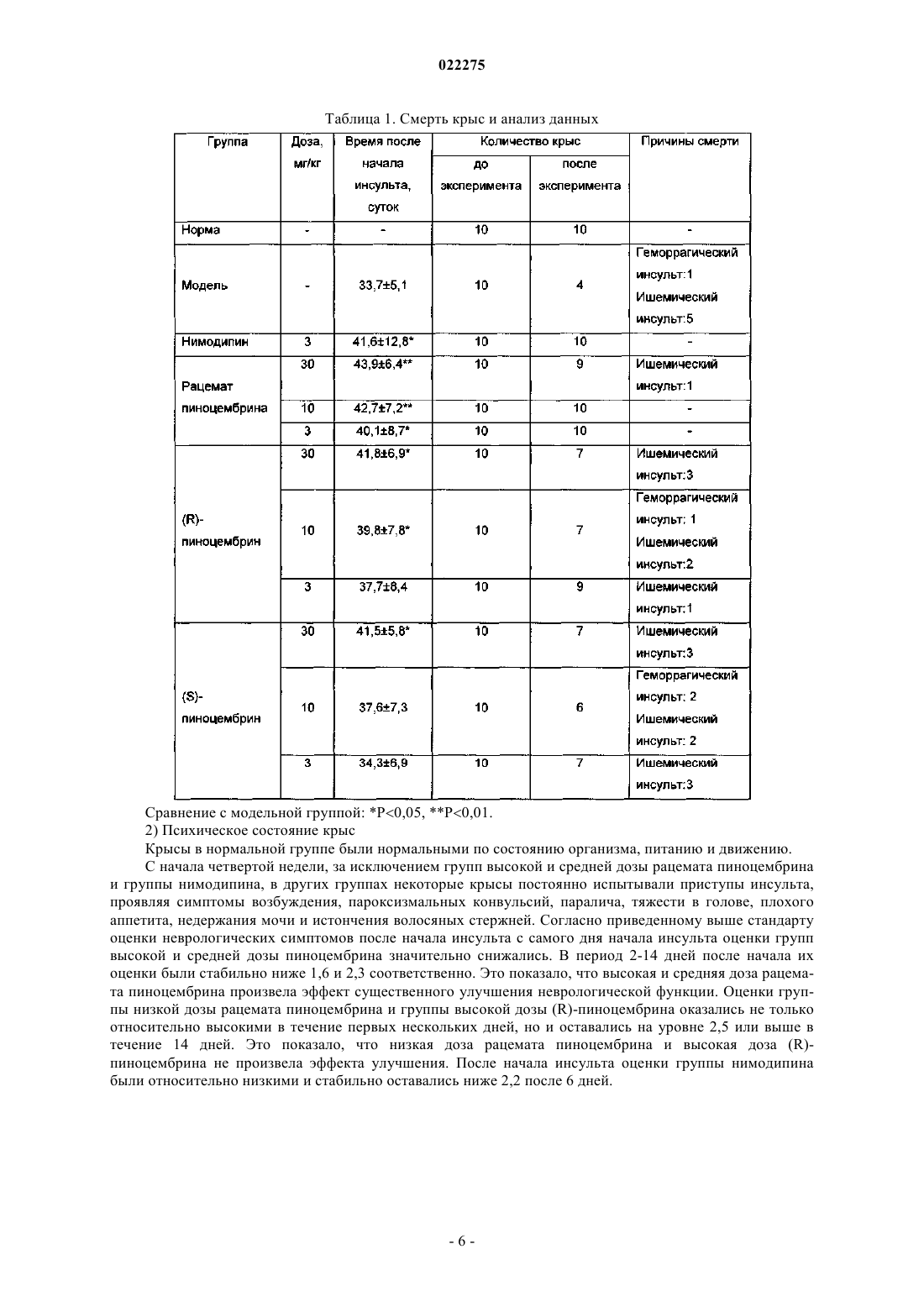
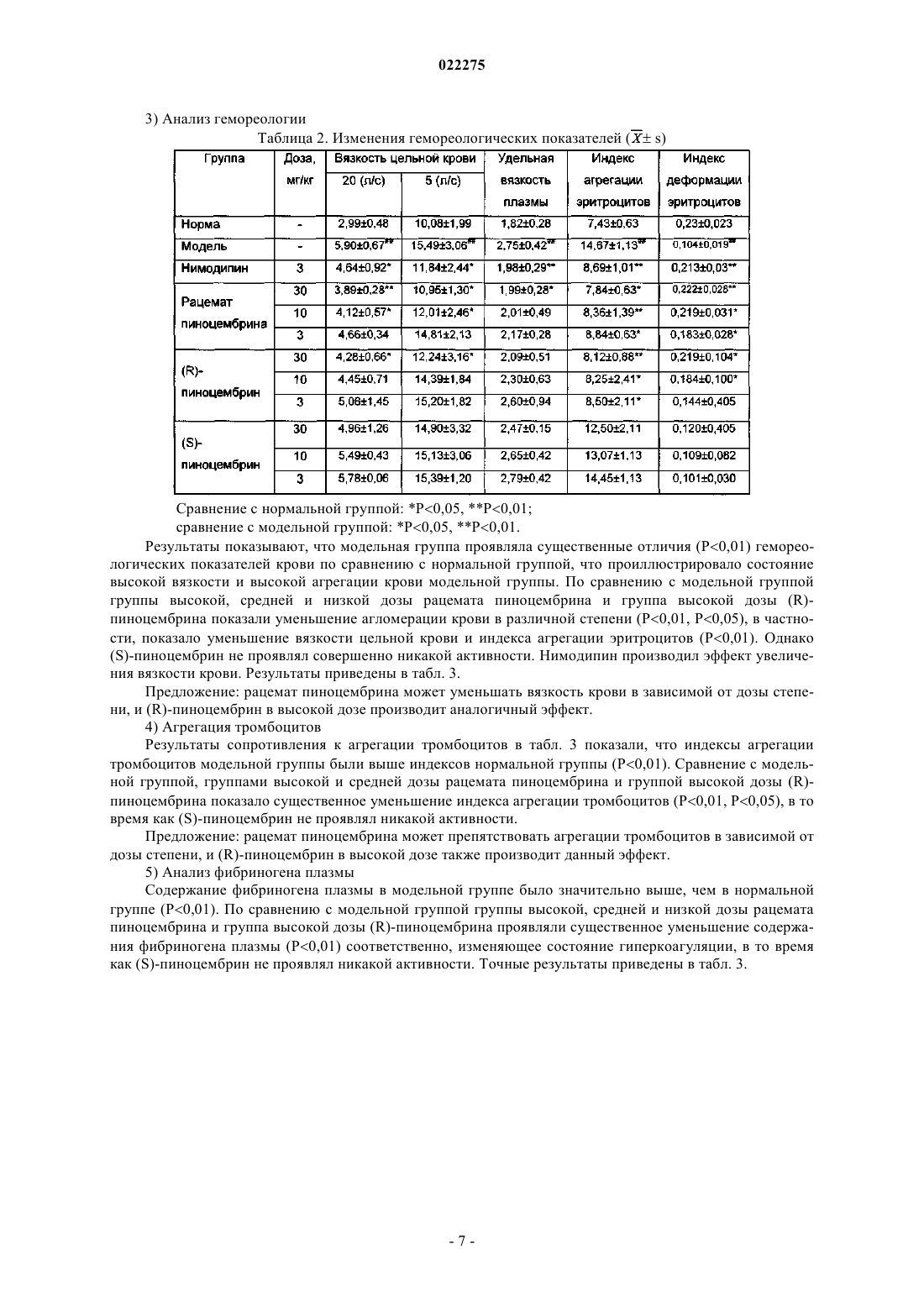
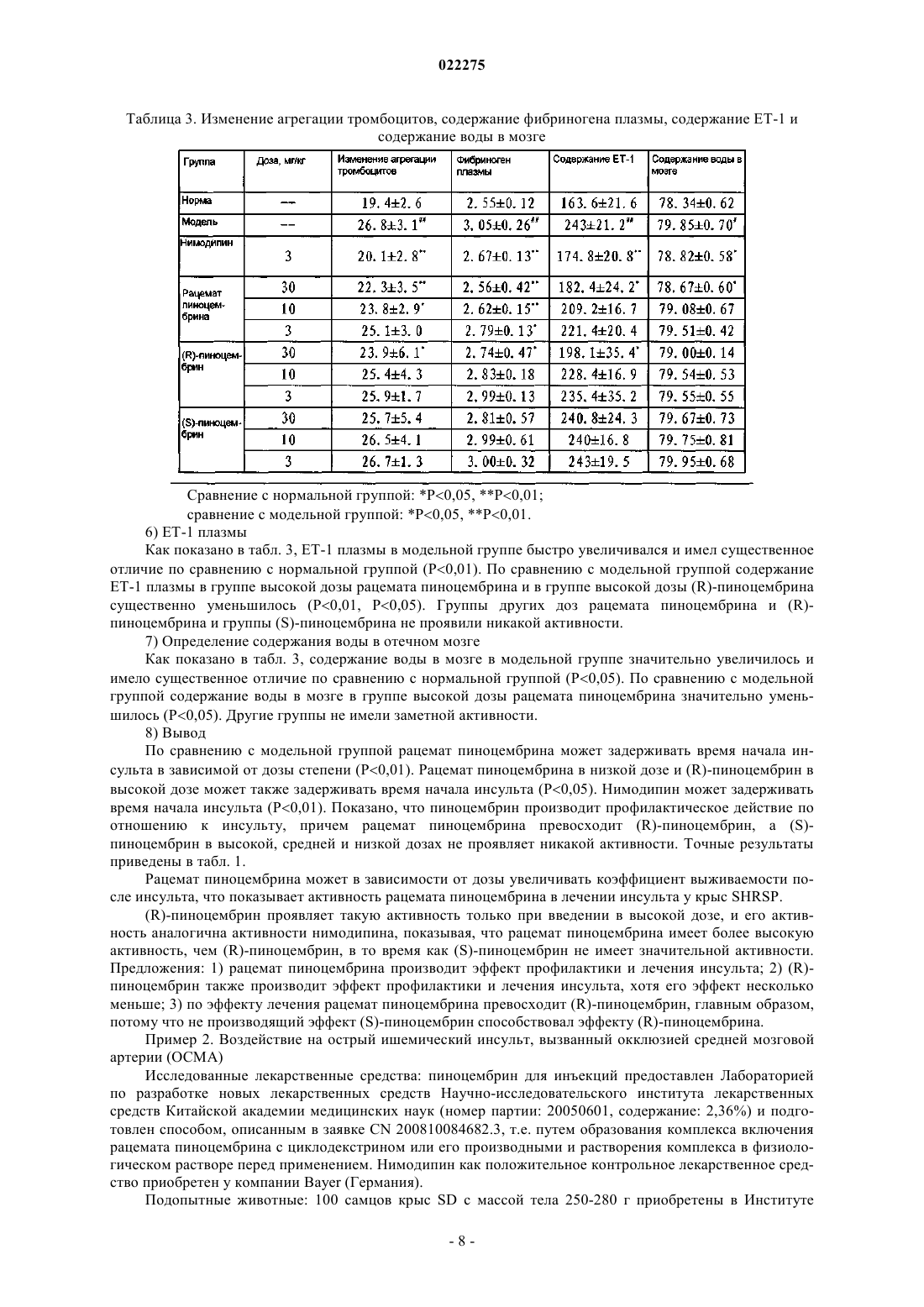
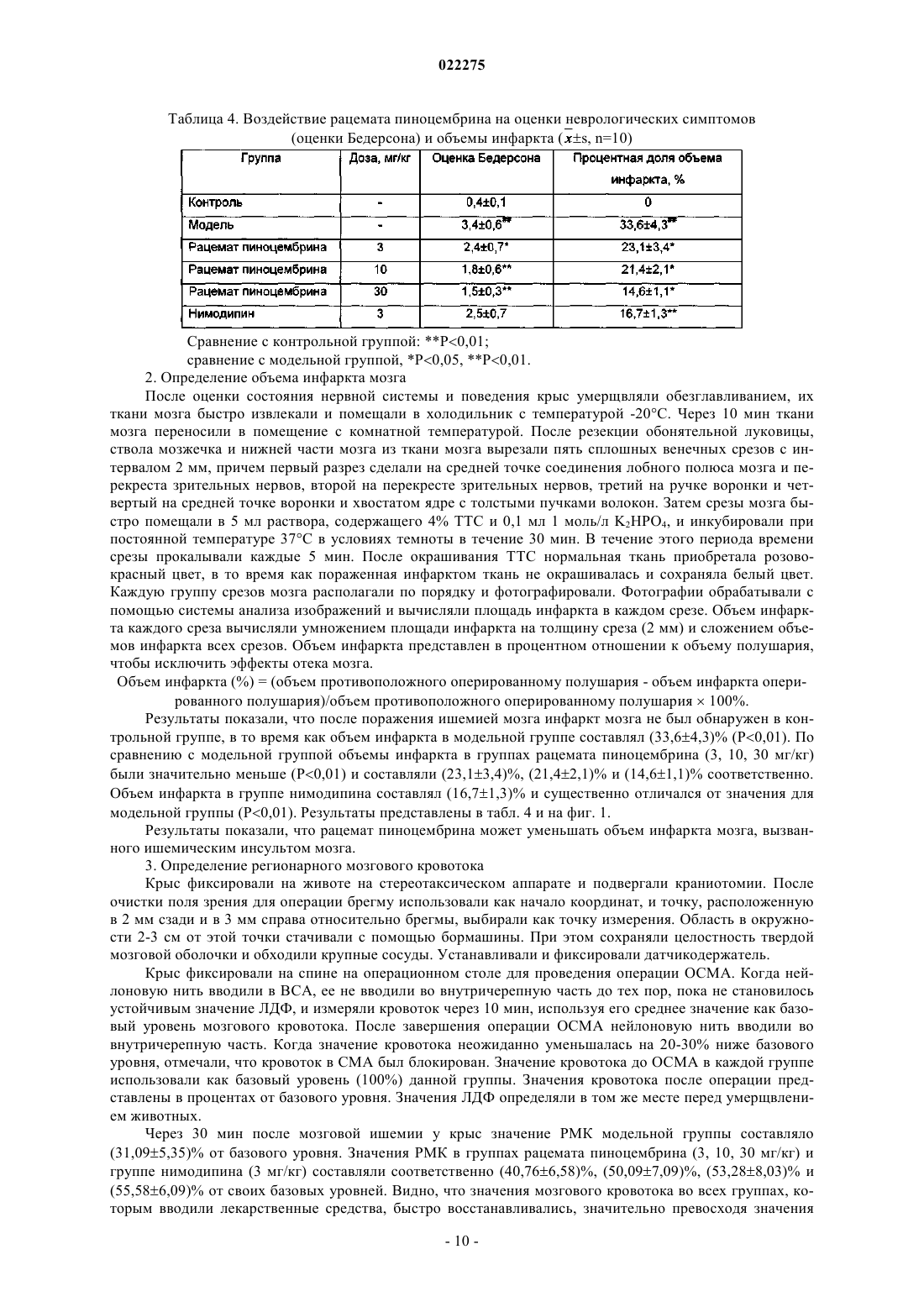
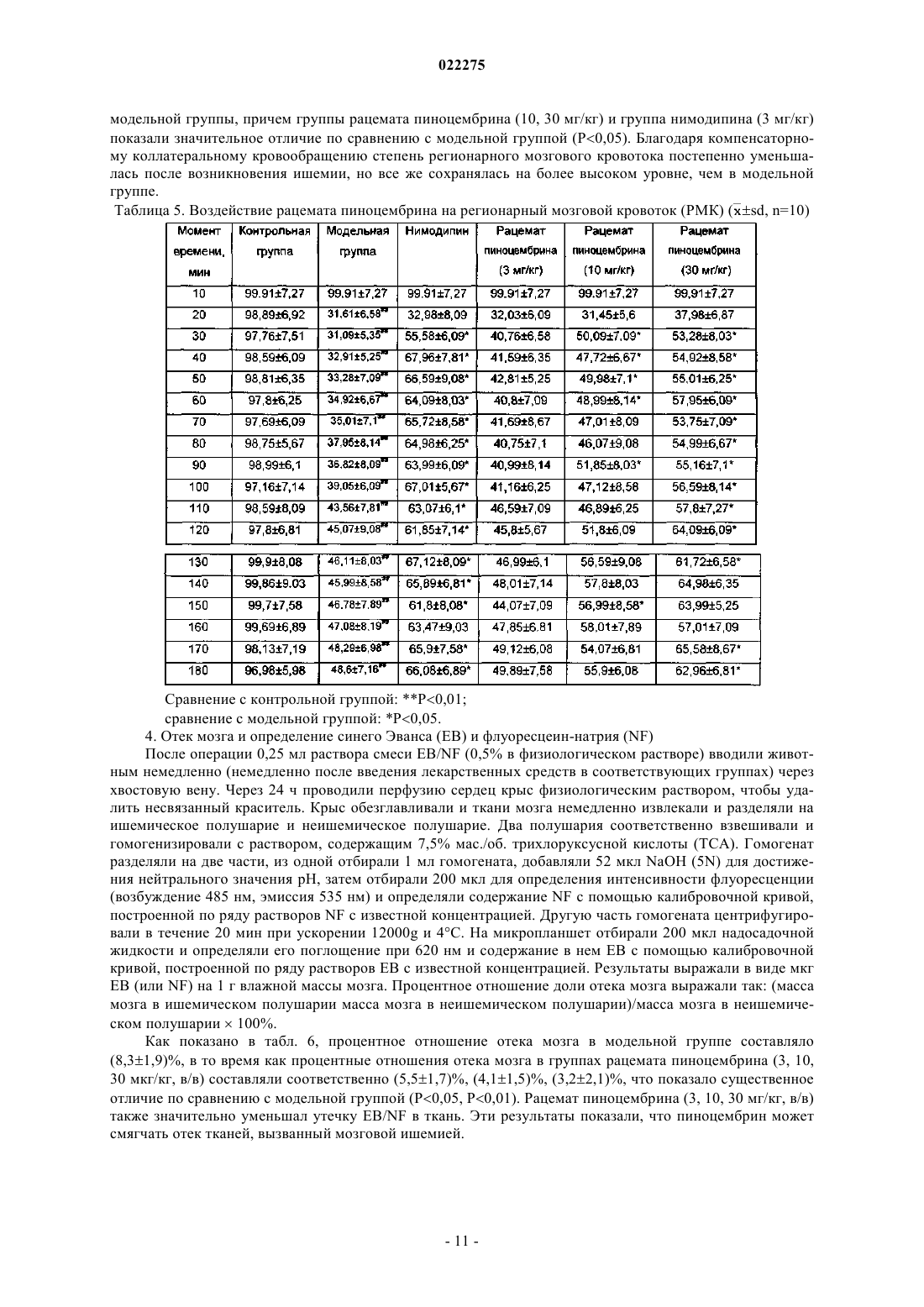
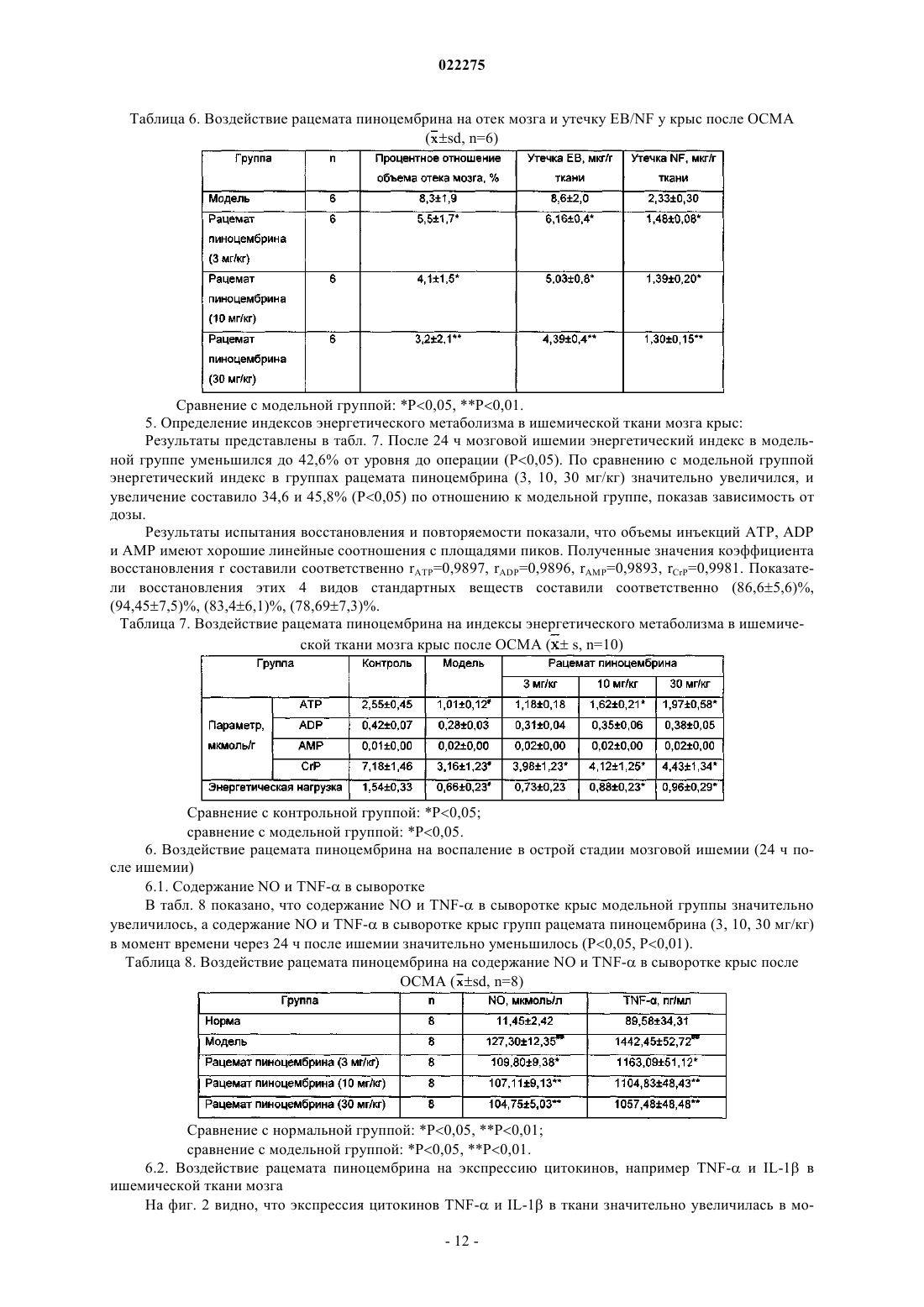
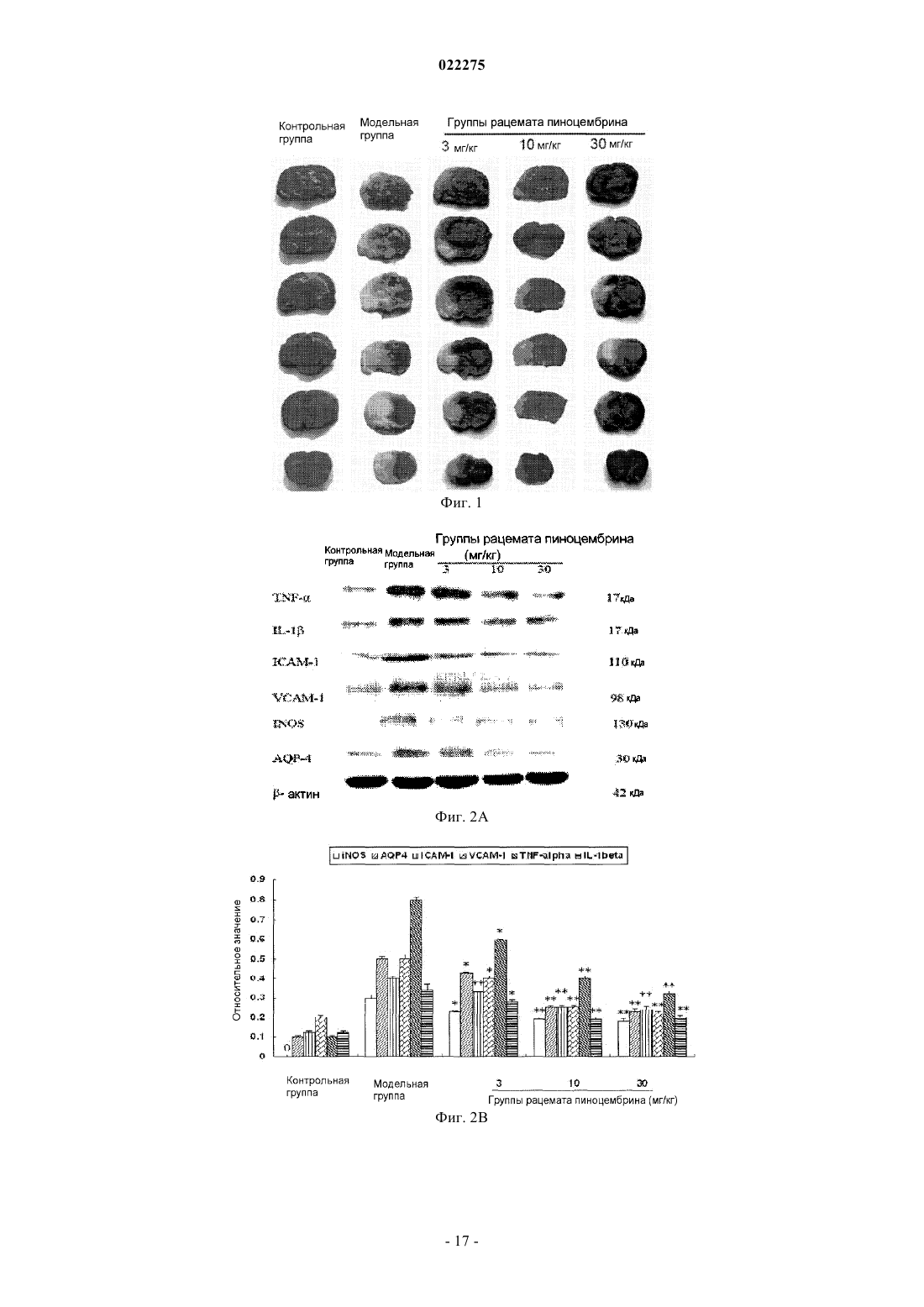
ПРИМЕНЕНИЕ РАЦЕМАТОВ ПИНОЦЕМБРИНА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ИНСУЛЬТА Применение рацемата пиноцембрина, рацемата соли пиноцембрина, рацемата предшественника пиноцембрина или рацемата гидрата пиноцембрина для получения лекарственного средства для профилактики и лечения инсульта. В частности, применение рацемата пиноцембрина для получения средства для лечения острого ишемического инсульта.(71)(73) Заявитель и патентовладелец: СиЭсПиСи ЧЖУНЦИ ФАРМАСЬЮТИКАЛ ТЕКНОЛОДЖИ (ШИЦЗЯЧЖУАН) КО., ЛТД.; ИНСТИТЬЮТ ОФ МАТЕРИЯ МЕДИКА, ЧАЙНИЗ ЭКЕДЕМИ ОФ МЕДИКАЛ САЙЕНСЕЗ (CN) По настоящей заявке испрашивается приоритет на основании китайской патентной заявки 200810185559.0, поданной 11 декабря 2008 г. и озаглавленной "Применение пиноцембрина для получения лекарственного средства для лечения инсульта", описание которой включено в настоящий документ посредством ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к применению рацемата пиноцембрина для получения лекарственного средства для профилактики и лечения инсульта. Уровень техники(S)-пиноцембрин формулы II, имеющий химическое наименование (S)-2,3-дигидро-5,7-дигидрокси 2-фенил-4 Н-1-бензопиран-4-кетон, представляет собой соединение водонерастворимого флавонона и природное соединение, извлекаемое из прополиса. Кроме того, это соединение также находится в экстрактах множества растений, например швейцарской пятиигольной сосны, листа эвкалипта и аравийской камеди. С 1980-х гг. исследователи всего мира открыли множество фармакологических свойств (S)пиноцембрина, включая антибиотические, антивирусные, антиоксидантные и противовоспалительные свойства. Китайская академия медицинских наук впервые сообщила, что (S)-пиноцембрин обладает функцией ингибирования сужения сосудов, вызванного множеством факторов, и защиты от повреждений многих видов нервных клеток. Подробное описание можно найти в китайской заявке CN 200410037860.9, где описано применение (S)-пиноцембрина в лечении мозговой ишемии, последствий мозговой ишемии и заболеваний, связанных с повреждением и функциональными изменениями нервных клеток, и соответствующий механизм защиты мозговой ткани от ишемического поражения, главным образом, путем ингибирования калпаина, NO и С-реактивного белка (CRP) и активирования экспрессии белка теплового шока мозга. Следовательно, (S)-пиноцембрин можно применять для лечения инфаркта мозга. Кроме того, Rui Liu и др. сотрудники Китайской академии медицинских наук установили, что (S)пиноцембрин обладает функцией защиты поврежденного нерва за счет ишемической реперфузии мозга или аналогичных ситуаций, в результате модельного исследования ишемии, гипоксии и апоптоза ткани мозга, вызванных ишемической реперфузией мозга (Pinocembrin protects rat brain against oxidation andYonghao Cheng и др. сообщили о синтезе рацемата пиноцембрина (формула I) (Yonghao Cheng,Yabo Duan, Yan Qi и др., "Syntesis 5,7-dihydroxy-flavanone", Chemical Reagents, 2006, 28 (7): 437). Из предшествущего уровня техники известно, что рацемат не имеет прямого или определенного отношения к эффективности. В общем, это отношение можно ограничить следующим рядом ситуаций: рацемат оказывает лучший эффект по сравнению с энантиомерами; энантиомеры обладают одинаковыми или близкими свойствами; энантиомеры имеют свойства различной силы; энантиомеры имеют противоположные свойства; энантиомеры имеют свойства различных типов. Далее перечисленные выше ситуации иллюстрируются следующими примерами. 1. Энантиомеры являются взаимно синергетическими, тогда рацемат оказывает лучший эффект по сравнению с энантиомерами. Как агонист -рецептора L-изомер добутамина слабо действует на -рецептор. Аналогичным образом, как агонист -рецептора, D-изомер добутамина слабо действует на -рецептор. Введение рацемата произведет эффект увеличения сократительной способности миокарда, но не увеличит частоту сердечных сокращений и не повысит кровяное давление. Антигистаминная эффективность рацемата изотипендила при пероральном введении в 1,4 раза выше, чем у (-)-изомера, и в 2,5 раза выше, чем у (+)-изомера при пероральном введении. Причина, по которой рацемат обладает лучшей эффективностью, возможно, состоит в том, что один изомер изменяет абсорбцию другого таким образом, что повышается биодоступность последнего, или что один изомер снижает скорость метаболизма второго таким образом, что увеличивается время действия последнего. 2. Энантиомеры имеют одинаковые свойства. Прометазин в составе антигистаминного средства содержит хиральные молекулы только одного энантиомера. Так как его рецепторы не обладают селективностью к энантиомерам лекарственного средства, оба его энантиомера оказывают одинаковое фармакологическое действие и проявляют лечебные свойства одинаковой силы. 3. Энантиомеры имеют свойства различной силы. Как антагонист -рецептора, пропранолол зависит, главным образом, от своего L-изомера в проявлении своей антагонистической активности, потому что его L-изомер имеет одинаковую конфигурацию с агонистом -рецептора и может селективно связывать -рецептор, а его D-изомер не может. В другом предельном примере L-метилдопа как гипотензивное лекарственное средство обладает фармакологическими свойствами, в то время как D-метилдопа не проявляет никакой активности. 4. Энантиомеры имеют противоположные свойства. В случае Bay k8644, структурного аналога нифедипина, его D-энантиомер является антагонистом кальция, в то время как его L-энантиомер является агонистом кальция. Эти два энантиомера имеют полностью противоположные свойства. 5. Энантиомеры имеют фармакологические свойства различных типов.D-энантиомер пропоксифена обладает сильным анальгетическим действием, которое в 6 раз превышает действие L-энантиомера, но не обладает противокашлевым действием. Напротив, L-энантиомер пропоксифена имеет сильное противокашлевое действие (Medicinal Chemistry, edited by Wensheng Ji, Anliang Li, Higher Education Press: 25-26). Из приведенных выше примеров известно также, что, согласно известной фармакологической активности (S)-пиноцембрина невозможно определить без экспериментов, обладает ли рацемат пиноцембрина или (R)-пиноцембрин такими же фармакологическими свойствами и действием, как (S)пиноцембрин. При изучении существующего уровня техники обнаружены следующие документы.Xiaoming Zhu и др. сообщили, что пиноцембрин может расширять сосуд грудной аорты по зависимому от эндотелия механизму и независимому от эндотелия механизму (Zhu X.M., Fang L.H., Li Y.J., DuMei Gao и др. сообщили, что пиноцембрин может устранять индуцированные глутаматом повреждения клеток и апоптоз, а также уменьшать вероятность апоптоза, что является доказательством нейропротективного свойства пиноцембрина в отношении его действия против мозговой ишемии (Mei Gao,Wen-cui Zhang, Qing-shan Liu, Juan-juan Hu, Geng-tao Liu, Guan-hua Du. Pinocembrin prevents glutamateinduced apoptosis in SH-S Y5Y neuronal cells via bax/bcl-2 ratio decrease. Eur. J. Pharmacol., 2008, 591(13):73-9).Mei Gao и др. сообщили, что пиноцембрин может защищать нервно-сосудистую систему мозга при постоянной мозговой ишемии у крыс (Acute neurovascular unit protective action of pinocembrin against permanent cerebral ischemia in rats. J. Asian Nat. Prod. Res., May-Jun 2008 г.; 10(5-6): 551-8). Так впервые было доказано защитное действие пиноцембрина против постоянной фокальной мозговой ишемии. Его механизм все еще исследуют.Hongmei Guang и др. получили модель недостаточного кровоснабжения мозга путем двусторонней перевязки сонной артерии и определяли познавательную способность путем испытания в водном лабиринте Морриса. Они сообщили, что пиноцембрин может приводить к улучшению состояния познавательной дисфункции у крыс, вызванной недостаточным кровоснабжением мозга, и механизм улучшения состоял в том, что пиноцембрин способен защищать структуру и функцию митохондрий (Protections ofEur. J. Pharmacol., 7 Aug. 2006 г.; 542 (1-3): 77-83). Приведенные выше документы в некоторой степени описывают фармакологические свойства пиноцембрина, но ограничены его сосудорасширяющим действием и нейрососудистой защитой. Из предшествущего уровня техники известно, что острый ишемический инсульт мозга (ишемическую апоплексию мозга) характеризует высокая распространенность, высокая смертность и высокий риск инвалидности. В настоящее время наиболее эффективным лечением является тромболиз. Чем раньше осуществляют тромболиз, тем лучше эффект лечения. Прошлые многолетние клинические опыты показали, что спасение пациентов с инсультом должно быть максимально скорым. Как только мозговая артерия блокирована, клетки мозга в ишемической области быстро начинают каскад электрохимических цепных реакций и производят большое количество свободных радикалов, вызывая приток ионов кальция и перегрузку внутриклеточными ионами кальция, что в итоге приводит к необратимому поражению ткани мозга. Следовательно, время спасения после начала инсульта должно быть минимизировано, насколько это возможно. В клинической практике ишемический инсульт мозга можно разделить на следующие типы: сверхранняя стадия в течение 6 ч после начала; ранняя стадия в течение 6-72 ч после начала; последующая острая стадия в течение 72 ч - 1 недели после начала; стадия восстановления через 1 неделю после начала. В течение сверхранней стадии ишемического инсульта инфаркт мозга еще не возникает. Если возможно своевременно восстановить нормальное кровоснабжение и вывести вредные метаболиты из ишемических тканей, у пациентов будет высокий шанс полного выздоровления. Поэтому лечение на сверхранней стадии будет представлять собой наилучшую возможность и обеспечит хороший результат. Вплоть до ранней стадии ишемического инсульта постоянная ишемия, гипоксия и особенно повреждение гемоэнцефалического барьера приводит к тенденции образования областей центрального инфаркта. По сравнению с лечением на сверхранней стадии лечение на этой стадии теряет большую часть терапевтического значения. В 1996 г. рекомбинантный тканевый активатор плазминогена (tPA) прошел клиническую аттеста-2 022275 цию Управления по контролю за качеством пищевых продуктов и лекарственных препаратов США и был утвержден для использования в течение 3 ч после начала острого ишемического инсульта. Это единственное лекарственное средство с доказанной эффективностью в лечении ишемического инсульта. Из-за ограниченного терапевтического временного окна 95% пациентов с острым инсультом не могут получить своевременное лечение путем тромболиза, и в Китае количество пациентов, получающих лечение путем тромболиза, составляет менее 1%. В течение последнего десятилетия исследование нейропротективных средств становится горячей точкой в лечении инсульта. Но из 114 исследований инсульта (с применением до 49 нейропротективных средств) во всем мире лишь несколько оказались успешными. Это означает, что в настоящее время все еще не доказана эффективность и безопасность ни одного нейропротективного средства в лечении острого ишемического инсульта. Из приведенного выше анализа видно, что, помимо tPA, средства эффективного лечения инсульта все еще требуются в клинической практике, и даже tPA ограничен терапевтическим временным окном,составляющим всего 3 ч. Содержание изобретения В соответствии с настоящим изобретением неожиданно экспериментально обнаружено, что рацемат пиноцембрина можно применять для лечения инсульта. По сравнению с (S)-пиноцембрином рацемат пиноцембрина имеет более продолжительное терапевтическое временное окно (около 6 ч), и его лечебное действие продолжается в течение большего периода времени после начала инсульта. Продление терапевтического временного окна дает больше шансов пациентам с ишемическим инсультом. Эксперименты на животных показывают, что рацемат пиноцембрина имеет значительные лечебные свойства. Одна задача настоящего изобретения состоит в том, чтобы обеспечить применение рацемата пиноцембрина, рацемата соли пиноцембрина, рацемата предшественника пиноцембрина или рацемата гидрата пиноцембрина для получения средства для лечения инсульта. Термин "рацемат" означает эквимолярную смесь, содержащую оптически активные хиральные молекулы вещества и его энантиомера, которая образуется путем смешивания эквивалентных количеств двух веществ, вращающих плоскость поляризации света в противоположных направлениях и с равной силой, так что вызванные ими вращения нейтрализуются вследствие их межмолекулярного взаимодействия. Соль пиноцембрина представляет собой фармацевтически приемлемую соль пиноцембрина, например гидрохлорид, сульфат, цитрат и т.д. Предшественник пиноцембрина представляет собой пролекарство пиноцембрина, т.е. соединение,которое может проявлять фармакологические свойства только после превращения в пиноцембрин посредством конверсии в организме. Предпочтительно инсульт представляет собой острый ишемический инсульт. Экспериментальным путем обнаружено, что: 1) рацемат пиноцембрина можно применять для лечения инсульта; 2) рацемат пиноцембрина может исправлять изменения поведения, вызванные острым ишемическим инсультом; 3) рацемат пиноцембрина может исправлять уменьшение мозгового кровотока, вызванное острым ишемическим инсультом; 4) рацемат пиноцембрина может уменьшать объем инфаркта мозга, вызванного острым ишемическим инсультом; 5) рацемат пиноцембрина может уменьшать отек мозга, вызванный острым ишемическим инсультом; 6) рацемат пиноцембрина может исправлять энергетический метаболизм, вызванный острым ишемическим инсультом; 7) рацемат пиноцембрина может уменьшать острое воспаление, вызванное острым ишемическим инсультом; 8) рацемат пиноцембрина может защищать нервные клетки от повреждения, вызванного острым ишемическим инсультом. Следовательно, настоящее изобретение также относится к лекарственному средству на основе рацемата пиноцембрина, который состоит из рацемата пиноцембрина, рацемата соли пиноцембрина, рацемата предшественника пиноцембрина или рацемата гидрата пиноцембрина и фармацевтически приемлемого наполнителя. Лекарственное средство согласно настоящему изобретению может быть пригодно для перорального, трансдермального, внутримышечного, внутривенного или мукозального введения. Лекарственное средство согласно настоящему изобретению может быть получено в твердом или жидком виде традиционным способом. Лекарственное средство согласно настоящему изобретению может быть жидким, предпочтительно в виде раствора для инъекций. Раствор для инъекций получают инкапсулированием рацемата пиноцембрина с циклодекстрином или его производными с последующим добавлением подходящего наполните-3 022275 ля. Настоящее изобретение также предлагает применение (R)-пиноцембрина, его солей, его предшественников или его гидратов для получения средства для лечения и профилактики инсульта, в котором инсульт представляет собой ишемический инсульт или геморрагический инсульт. Достоинством рацемата пиноцембрина, применяемого согласно настоящему изобретению, является низкая токсичность, и его можно применять для лечения острого ишемического инсульта. Краткое описание чертежей На фиг. 1 показано воздействие рацемата пиноцембрина на объем инфаркта. На фиг. 2 показано воздействие рацемата пиноцембрина на экспрессию белков TNF-, IL-1,ICAM-1, VCAM-1, iNOS и AQP-4 в ишемических тканях мозга после окклюзии средней мозговой артерии (ОСМА) в течение 24 ч, где А показывает воздействие DL0108 на экспрессию белков TNF-, IL-1, ICAM-1, VCAM-1, iNOS иAQP-4; В представляет собой статистическую таблицу, которая количественно показывает экспрессию белков TNF-, IL-1, ICAM-1, VCAM-1, iNOS и AQP-4 с применением -актина как внутреннего стандарта. На фиг. 3 представлено увеличенное в 200 раз изображение окрашенной по Нисслю области СА 1 коры головного мозга и гиппокампа, где А - контрольная группа; В - модельная группа; С - группа нимодипина (3 мг/кг);F - группа DL0108 (рацемат пиноцембрина, 10 мг/кг). Частные способы осуществления изобретения Настоящее изобретение иллюстрируется следующими конкретными примерами. Пример 1. Влияние на профилактику и лечение инсульта у предрасположенных к развитию инсульта спонтанно гипертензивных крыс (SHRSP) 1. Исследованные лекарственные средства: рацемат пиноцембрина для инъекций, (R)-пиноцембрин для инъекций и (S)-пиноцембрин для инъекций, которые предоставлены Лабораторией по разработке новых лекарственных средств Научно-исследовательского института лекарственных средств Китайской академии медицинских наук (номер партии: 20050601, содержание: 2,36%) и подготовлены способом,описанным в заявке CN 200810084682.3, т.е. путем образования комплекса включения рацемата пиноцембрина или энантиомеров пиноцембрина с циклодекстрином или его производными и растворения комплекса в физиологическом растворе перед применением. Нимодипин как положительное контрольное лекарственное средство приобретен у компании Bayer (Германия). 2. Подопытные животные и группы Подопытные животные: 110 крыс SHRSP и 10 нормальных крыс Wistar в возрасте 6 недель. Экспериментальные группы: крысы Wistar составляли нормальную группу; крысы SHRSP составляли модельную группу, группу нимодипина (3 мг/кг), группы низкой, средней и высокой дозы рацемата пиноцембрина (3, 10 и 30 мг/кг/сутки соответственно), группы низкой, средней и высокой дозы (R)пиноцембрина (эти дозы были идентичны дозам в соответствующих группах рацемата пиноцембрина) и группы низкой, средней и высокой доз (S)-пиноцембрина (эти дозы были идентичны дозам в соответствующих группах рацемата пиноцембрина). 3. Способ проведения экспериментов За исключением крыс нормальной группы, все крысы SHRSP пили ежедневно 1% раствор хлорида натрия. Лекарственные средства вводили в предписанных дозах соответственно, крысам группы нимодипина (3 мг/кг), групп низкой, средней и высокой дозы рацемата пиноцембрина (3, 10 и 30 мг/кг/сутки соответственно), групп низкой, средней и высокой дозы (R)-пиноцембрина (эти дозы были идентичны дозам в соответствующих группах рацемата пиноцембрина) и групп низкой, средней и высокой дозы (S)пиноцембрина (эти дозы были идентичны дозам в соответствующих группах рацемата пиноцембрина). Физиологический раствор в том же объеме вводили крысам модельной группы. Введение продолжали в течение 14 дней после начала инсульта. 4. Стандарт начала инсульта проявление судорог одной конечности, двух передних конечностей или всего тела; проявление гемиплегии или полного паралича, прижатие живота к полу и невозможность встать; в более серьезных случаях проявление общего мелкого дрожания, ползание, периферический паралич, даже смерть. Помимо перечисленных выше симптомов, у некоторых животных можно наблюдать возбудимость (прыжки или подскоки). Как только наблюдался какой-либо из перечисленных выше симптомов, определяли начало инсульта и записывали время после его начала у каждого животного. 5. Сбор образцов: 1) После последней дозы крыс содержали без пищи в течение 6 ч и отбирали пробы крови с глазно-4 022275 го дна. После обезглавливания целый мозг крысы отделяли на лотке со льдом для исследования. 2) Кровь (3 мл) быстро выпускали в кювету с 1 мл 0,074% гепарина и смешивали. Вязкость цельной крови, вязкость плазмы, индекс агрегации эритроцитов и индекс деформации эритроцитов определяли гемореологическим детектором согласно его техническим условиям. 3) Кровь (2 мл) быстро выпускали в кювету с 0,2 мл 0,13 моль/л цитрата натрия и смешивали. Смесь центрифугировали в течение 10 мин со скоростью 1000 об./мин и степень агрегации тромбоцитов определяли анализатором агрегации тромбоцитов согласно его техническим условиям. 4) Кровь (1 мл) быстро выпускали в кювету с 0,1 мл 0,109 моль/л цитрата натрия и смешивали. Смесь центрифугировали в течение 15 мин со скоростью 3000 об./мин и фибриноген плазмы в надосадочной жидкости определяли твердофазным иммуноферментным анализом (ELISA). 5) Кровь (2 мл) быстро выпускали в кювету с 30 мкл 7,5% EDTA-2Na и 40 мкл апротинина и смешивали. После центрифугирования в течение 5 мин со скоростью 3000 об./мин эндотелин 1 (ЕТ-1) плазмы в надосадочной жидкости определяли радиоизотопным иммуноанализом. 6) Ткани цельного мозга взвешивали по очереди, сушили в вакууме при 1105 С в течение 48 ч и затем снова взвешивали. 6. Наблюдаемые показатели 1) Наблюдение состояния организма животных каждой группы после моделирования, включая внешний вид организма, психическое состояние, чувствительность, положение тела в движении, самопроизвольную активность, количество воды и пищи, массу тела и т.п. Оценки неврологических симптомов после начала инсульта После начала инсульта в течение 14 дней записывали оценки для каждого животного и сравнивали оценки получающих лекарственные средства групп с оценками контрольной группы. 2) Гемореология, включая вязкость цельной крови, вязкость плазмы, индекс агрегации эритроцитов,индекс деформации эритроцитов и индекс агрегации тромбоцитов. 3) Фибриноген плазмы. 4) ЕТ-1 плазмы. 5) Содержание воды в мозге вычисляли по массам тканей цельного мозга до и после сушки в вакуумной печи, которые подставляли в следующую формулу: Содержание воды в мозге = (влажная масса - сухая масса)/влажная масса 100%. 6. Статистические методы Результаты представлены в форматеSD (среднее значениестандартное отклонение) и сравнение данных проведено методом однофакторного дисперсионного анализа (ОДА). 7. Экспериментальные результаты 1) Смерть крыс Всего в течение эксперимента умерли 24 крысы. После паталогоанатомического анализа обнаружено, что 4 из них умерли от геморрагического инсульта и остальные 20 крыс умерли от ишемического инсульта. Подробные данные приведены в табл. 1. Сравнение с модельной группой: Р 0,05, Р 0,01. 2) Психическое состояние крыс Крысы в нормальной группе были нормальными по состоянию организма, питанию и движению. С начала четвертой недели, за исключением групп высокой и средней дозы рацемата пиноцембрина и группы нимодипина, в других группах некоторые крысы постоянно испытывали приступы инсульта,проявляя симптомы возбуждения, пароксизмальных конвульсий, паралича, тяжести в голове, плохого аппетита, недержания мочи и истончения волосяных стержней. Согласно приведенному выше стандарту оценки неврологических симптомов после начала инсульта с самого дня начала инсульта оценки групп высокой и средней дозы пиноцембрина значительно снижались. В период 2-14 дней после начала их оценки были стабильно ниже 1,6 и 2,3 соответственно. Это показало, что высокая и средняя доза рацемата пиноцембрина произвела эффект существенного улучшения неврологической функции. Оценки группы низкой дозы рацемата пиноцембрина и группы высокой дозы (R)-пиноцембрина оказались не только относительно высокими в течение первых нескольких дней, но и оставались на уровне 2,5 или выше в течение 14 дней. Это показало, что низкая доза рацемата пиноцембрина и высокая доза (R)пиноцембрина не произвела эффекта улучшения. После начала инсульта оценки группы нимодипина были относительно низкими и стабильно оставались ниже 2,2 после 6 дней. 3) Анализ гемореологии Таблица 2. Изменения гемореологических показателей (s) Сравнение с нормальной группой: Р 0,05, Р 0,01; сравнение с модельной группой: Р 0,05, Р 0,01. Результаты показывают, что модельная группа проявляла существенные отличия (Р 0,01) гемореологических показателей крови по сравнению с нормальной группой, что проиллюстрировало состояние высокой вязкости и высокой агрегации крови модельной группы. По сравнению с модельной группой группы высокой, средней и низкой дозы рацемата пиноцембрина и группа высокой дозы (R)пиноцембрина показали уменьшение агломерации крови в различной степени (Р 0,01, Р 0,05), в частности, показало уменьшение вязкости цельной крови и индекса агрегации эритроцитов (Р 0,01). Однако(S)-пиноцембрин не проявлял совершенно никакой активности. Нимодипин производил эффект увеличения вязкости крови. Результаты приведены в табл. 3. Предложение: рацемат пиноцембрина может уменьшать вязкость крови в зависимой от дозы степени, и (R)-пиноцембрин в высокой дозе производит аналогичный эффект. 4) Агрегация тромбоцитов Результаты сопротивления к агрегации тромбоцитов в табл. 3 показали, что индексы агрегации тромбоцитов модельной группы были выше индексов нормальной группы (Р 0,01). Сравнение с модельной группой, группами высокой и средней дозы рацемата пиноцембрина и группой высокой дозы (R)пиноцембрина показало существенное уменьшение индекса агрегации тромбоцитов (Р 0,01, Р 0,05), в то время как (S)-пиноцембрин не проявлял никакой активности. Предложение: рацемат пиноцембрина может препятствовать агрегации тромбоцитов в зависимой от дозы степени, и (R)-пиноцембрин в высокой дозе также производит данный эффект. 5) Анализ фибриногена плазмы Содержание фибриногена плазмы в модельной группе было значительно выше, чем в нормальной группе (Р 0,01). По сравнению с модельной группой группы высокой, средней и низкой дозы рацемата пиноцембрина и группа высокой дозы (R)-пиноцембрина проявляли существенное уменьшение содержания фибриногена плазмы (Р 0,01) соответственно, изменяющее состояние гиперкоагуляции, в то время как (S)-пиноцембрин не проявлял никакой активности. Точные результаты приведены в табл. 3. Сравнение с нормальной группой: Р 0,05, Р 0,01; сравнение с модельной группой: Р 0,05, Р 0,01. 6) ЕТ-1 плазмы Как показано в табл. 3, ЕТ-1 плазмы в модельной группе быстро увеличивался и имел существенное отличие по сравнению с нормальной группой (Р 0,01). По сравнению с модельной группой содержание ЕТ-1 плазмы в группе высокой дозы рацемата пиноцембрина и в группе высокой дозы (R)-пиноцембрина существенно уменьшилось (Р 0,01, Р 0,05). Группы других доз рацемата пиноцембрина и (R)пиноцембрина и группы (S)-пиноцембрина не проявили никакой активности. 7) Определение содержания воды в отечном мозге Как показано в табл. 3, содержание воды в мозге в модельной группе значительно увеличилось и имело существенное отличие по сравнению с нормальной группой (Р 0,05). По сравнению с модельной группой содержание воды в мозге в группе высокой дозы рацемата пиноцембрина значительно уменьшилось (Р 0,05). Другие группы не имели заметной активности. 8) Вывод По сравнению с модельной группой рацемат пиноцембрина может задерживать время начала инсульта в зависимой от дозы степени (Р 0,01). Рацемат пиноцембрина в низкой дозе и (R)-пиноцембрин в высокой дозе может также задерживать время начала инсульта (Р 0,05). Нимодипин может задерживать время начала инсульта (Р 0,01). Показано, что пиноцембрин производит профилактическое действие по отношению к инсульту, причем рацемат пиноцембрина превосходит (R)-пиноцембрин, a (S)пиноцембрин в высокой, средней и низкой дозах не проявляет никакой активности. Точные результаты приведены в табл. 1. Рацемат пиноцембрина может в зависимости от дозы увеличивать коэффициент выживаемости после инсульта, что показывает активность рацемата пиноцембрина в лечении инсульта у крыс SHRSP.(R)-пиноцембрин проявляет такую активность только при введении в высокой дозе, и его активность аналогична активности нимодипина, показывая, что рацемат пиноцембрина имеет более высокую активность, чем (R)-пиноцембрин, в то время как (S)-пиноцембрин не имеет значительной активности. Предложения: 1) рацемат пиноцембрина производит эффект профилактики и лечения инсульта; 2) (R)пиноцембрин также производит эффект профилактики и лечения инсульта, хотя его эффект несколько меньше; 3) по эффекту лечения рацемат пиноцембрина превосходит (R)-пиноцембрин, главным образом,потому что не производящий эффект (S)-пиноцембрин способствовал эффекту (R)-пиноцембрина. Пример 2. Воздействие на острый ишемический инсульт, вызванный окклюзией средней мозговой артерии (ОСМА) Исследованные лекарственные средства: пиноцембрин для инъекций предоставлен Лабораторией по разработке новых лекарственных средств Научно-исследовательского института лекарственных средств Китайской академии медицинских наук (номер партии: 20050601, содержание: 2,36%) и подготовлен способом, описанным в заявке CN 200810084682.3, т.е. путем образования комплекса включения рацемата пиноцембрина с циклодекстрином или его производными и растворения комплекса в физиологическом растворе перед применением. Нимодипин как положительное контрольное лекарственное средство приобретен у компании Bayer (Германия). Подопытные животные: 100 самцов крыс SD с массой тела 250-280 г приобретены в Институте подопытных животных Китайской академии медицинских наук. Крыс случайным образом распределяли по группам, включая контрольную группу, модельную группу, группы пиноцембрина и группу нимодипина (3 мг/кг). Экспериментальная модель: модель острого ишемического инсульта, вызванного окклюзией средней мозговой артерии (ОСМА). Способ окклюзии средней мозговой артерии путем перевязки, который создал Zea Longa, был принят с соответствующими усовершенствованиями. Крысам вводили интраперитонеально 400 мг/кг 10% хлоральгидрата. Наружную сонную артерию (НСА) отделяли и перевязывали приблизительно в 0,8 см от места ее выхода. Ближний к сердцу конец НСА зажимали зажимом для артерий. Клиновидный разрез длиной 2 мм делали от места перевязки НСА до места ее бифуркации. Нейлоновую нить мягко вводили в общую сонную артерию (ОСА) и затем во внутреннюю сонную артерию (ВСА) через бифуркацию НСА и ВСА после ослабления зажима артерии. Нейлоновую нить проталкивали в мозг через ВСА и вводили на глубину 18,50,5 мм, когда ощущалось легкое сопротивление. Нейлоновая нить должна была попасть в малую переднюю мозговую артерию через начало средней мозговой артерии (СМА), чтобы можно было перевязывать и сшивать ВСА. Конец нейлоновой нити длиной 1 см должен был оставаться над кожей. Крыс в контрольной группе оперировали только с предоперационной анестезией и рассечением сосудов без перевязки и введения нити. Статистические методы: результаты представлены в формате SD (среднее значениестандартное отклонение) и сравнение данных проведено методом однофакторного дисперсионного анализа (ОДА,ANOVA). Наблюдаемые показатели и результаты 1. Исследование состояния нервной системы и поведения (оценка Бедерсона) : Исследование состояния нервной системы и поведения проводили перед тем, как животных умерщвляли. Крыс поднимали над полом на высоту около 1 чи (1 чи = 1/3 метра) для наблюдения состояния двух передних конечностей. Крыс ставили на пол и толкали их в плечо с наблюдением различия их сопротивления. Крыс ставили на пол и наблюдали за манерой их движения. Был принят способ оценки по пятибалльной шкале (0-4 балла). Чем выше была оценка, тем более серьезное поражение существовало в их нервной системе и поведении. Стандарт оценки Бедерсона:(1) Если крысы вели себя полностью нормально, ставили оценку 0.(2) Если при вставании с пола крысы подворачивали или втягивали переднюю конечность со стороны, противоположной оперированной, ставили оценку 1.(3) Если при помещении крыс на пол и сжимании рукой для проверки сопротивления обеих сторон уменьшалось сопротивление со стороны, противоположной оперированной, ставили оценку 2.(4) Если при помещении на пол для наблюдения манеры передвижения крысы ходили вокруг стороны, противоположной оперированной, ставили оценку 3.(5) Если крысы были поражены так серьезно, что не могли двигаться самостоятельно, ставили оценку 4. Результаты приведены в табл. 4. Оценка состояния нервной системы и поведения крыс контрольной группы была равна 0. Средняя оценка состояния нервной системы и поведения крыс модельной группы составляла 3,40,6, причем большинство животных проявляли подворачивание или втягивание своих передних конечностей со стороны, противоположной оперированной, сокращение силы растяжения мышц со стороны, противоположной оперированной, кружение или временное кружение и получили оценку 3; меньшинство животных проявляли только подворачивание своих передних конечностей и уменьшение сопротивления и получили оценку 2; некоторые животные проявляли серьезные симптомы,не двигались самостоятельно и получили оценку 4. В группах рацемата пиноцембрина (3, 10, 30 мг/кг) симптомы поражения нервной системы, вызванные ишемией у животных, значительно улучшились (Р 0,05, Р 0,01), показывая эффект зависимости от дозы. Таблица 4. Воздействие рацемата пиноцембрина на оценки неврологических симптомов Сравнение с контрольной группой: Р 0,01; сравнение с модельной группой, Р 0,05, Р 0,01. 2. Определение объема инфаркта мозга После оценки состояния нервной системы и поведения крыс умерщвляли обезглавливанием, их ткани мозга быстро извлекали и помещали в холодильник с температурой -20 С. Через 10 мин ткани мозга переносили в помещение с комнатной температурой. После резекции обонятельной луковицы,ствола мозжечка и нижней части мозга из ткани мозга вырезали пять сплошных венечных срезов с интервалом 2 мм, причем первый разрез сделали на средней точке соединения лобного полюса мозга и перекреста зрительных нервов, второй на перекресте зрительных нервов, третий на ручке воронки и четвертый на средней точке воронки и хвостатом ядре с толстыми пучками волокон. Затем срезы мозга быстро помещали в 5 мл раствора, содержащего 4% ТТС и 0,1 мл 1 моль/л K2HPO4, и инкубировали при постоянной температуре 37 С в условиях темноты в течение 30 мин. В течение этого периода времени срезы прокалывали каждые 5 мин. После окрашивания ТТС нормальная ткань приобретала розовокрасный цвет, в то время как пораженная инфарктом ткань не окрашивалась и сохраняла белый цвет. Каждую группу срезов мозга располагали по порядку и фотографировали. Фотографии обрабатывали с помощью системы анализа изображений и вычисляли площадь инфаркта в каждом срезе. Объем инфаркта каждого среза вычисляли умножением площади инфаркта на толщину среза (2 мм) и сложением объемов инфаркта всех срезов. Объем инфаркта представлен в процентном отношении к объему полушария,чтобы исключить эффекты отека мозга. Объем инфаркта (%) = (объем противоположного оперированному полушария - объем инфаркта оперированного полушария)/объем противоположного оперированному полушария 100%. Результаты показали, что после поражения ишемией мозга инфаркт мозга не был обнаружен в контрольной группе, в то время как объем инфаркта в модельной группе составлял (33,64,3)% (Р 0,01). По сравнению с модельной группой объемы инфаркта в группах рацемата пиноцембрина (3, 10, 30 мг/кг) были значительно меньше (Р 0,01) и составляли (23,13,4)%, (21,42,1)% и (14,61,1)% соответственно. Объем инфаркта в группе нимодипина составлял (16,71,3)% и существенно отличался от значения для модельной группы (Р 0,01). Результаты представлены в табл. 4 и на фиг. 1. Результаты показали, что рацемат пиноцембрина может уменьшать объем инфаркта мозга, вызванного ишемическим инсультом мозга. 3. Определение регионарного мозгового кровотока Крыс фиксировали на животе на стереотаксическом аппарате и подвергали краниотомии. После очистки поля зрения для операции брегму использовали как начало координат, и точку, расположенную в 2 мм сзади и в 3 мм справа относительно брегмы, выбирали как точку измерения. Область в окружности 2-3 см от этой точки стачивали с помощью бормашины. При этом сохраняли целостность твердой мозговой оболочки и обходили крупные сосуды. Устанавливали и фиксировали датчикодержатель. Крыс фиксировали на спине на операционном столе для проведения операции ОСМА. Когда нейлоновую нить вводили в ВСА, ее не вводили во внутричерепную часть до тех пор, пока не становилось устойчивым значение ЛДФ, и измеряли кровоток через 10 мин, используя его среднее значение как базовый уровень мозгового кровотока. После завершения операции ОСМА нейлоновую нить вводили во внутричерепную часть. Когда значение кровотока неожиданно уменьшалась на 20-30% ниже базового уровня, отмечали, что кровоток в СМА был блокирован. Значение кровотока до ОСМА в каждой группе использовали как базовый уровень (100%) данной группы. Значения кровотока после операции представлены в процентах от базового уровня. Значения ЛДФ определяли в том же месте перед умерщвлением животных. Через 30 мин после мозговой ишемии у крыс значение РМК модельной группы составляло(31,095,35)% от базового уровня. Значения РМК в группах рацемата пиноцембрина (3, 10, 30 мг/кг) и группе нимодипина (3 мг/кг) составляли соответственно (40,766,58)%, (50,097,09)%, (53,288,03)% и(55,586,09)% от своих базовых уровней. Видно, что значения мозгового кровотока во всех группах, которым вводили лекарственные средства, быстро восстанавливались, значительно превосходя значения модельной группы, причем группы рацемата пиноцембрина (10, 30 мг/кг) и группа нимодипина (3 мг/кг) показали значительное отличие по сравнению с модельной группой (Р 0,05). Благодаря компенсаторному коллатеральному кровообращению степень регионарного мозгового кровотока постепенно уменьшалась после возникновения ишемии, но все же сохранялась на более высоком уровне, чем в модельной группе. Таблица 5. Воздействие рацемата пиноцембрина на регионарный мозговой кровоток (РМК) ( sd, n=10) Сравнение с контрольной группой: Р 0,01; сравнение с модельной группой: Р 0,05. 4. Отек мозга и определение синего Эванса (ЕВ) и флуоресцеин-натрия (NF) После операции 0,25 мл раствора смеси EB/NF (0,5% в физиологическом растворе) вводили животным немедленно (немедленно после введения лекарственных средств в соответствующих группах) через хвостовую вену. Через 24 ч проводили перфузию сердец крыс физиологическим раствором, чтобы удалить несвязанный краситель. Крыс обезглавливали и ткани мозга немедленно извлекали и разделяли на ишемическое полушарие и неишемическое полушарие. Два полушария соответственно взвешивали и гомогенизировали с раствором, содержащим 7,5% мас./об. трихлоруксусной кислоты (ТСА). Гомогенат разделяли на две части, из одной отбирали 1 мл гомогената, добавляли 52 мкл NaOH (5N) для достижения нейтрального значения рН, затем отбирали 200 мкл для определения интенсивности флуоресценции(возбуждение 485 нм, эмиссия 535 нм) и определяли содержание NF с помощью калибровочной кривой,построенной по ряду растворов NF с известной концентрацией. Другую часть гомогената центрифугировали в течение 20 мин при ускорении 12000g и 4 С. На микропланшет отбирали 200 мкл надосадочной жидкости и определяли его поглощение при 620 нм и содержание в нем ЕВ с помощью калибровочной кривой, построенной по ряду растворов ЕВ с известной концентрацией. Результаты выражали в виде мкг ЕВ (или NF) на 1 г влажной массы мозга. Процентное отношение доли отека мозга выражали так: (масса мозга в ишемическом полушарии масса мозга в неишемическом полушарии)/масса мозга в неишемическом полушарии 100%. Как показано в табл. 6, процентное отношение отека мозга в модельной группе составляло(8,31,9)%, в то время как процентные отношения отека мозга в группах рацемата пиноцембрина (3, 10,30 мкг/кг, в/в) составляли соответственно (5,51,7)%, (4,11,5)%, (3,22,1)%, что показало существенное отличие по сравнению с модельной группой (Р 0,05, Р 0,01). Рацемат пиноцембрина (3, 10, 30 мг/кг, в/в) также значительно уменьшал утечку EB/NF в ткань. Эти результаты показали, что пиноцембрин может смягчать отек тканей, вызванный мозговой ишемией. Таблица 6. Воздействие рацемата пиноцембрина на отек мозга и утечку EB/NF у крыс после ОСМА Сравнение с модельной группой: Р 0,05, Р 0,01. 5. Определение индексов энергетического метаболизма в ишемической ткани мозга крыс: Результаты представлены в табл. 7. После 24 ч мозговой ишемии энергетический индекс в модельной группе уменьшился до 42,6% от уровня до операции (Р 0,05). По сравнению с модельной группой энергетический индекс в группах рацемата пиноцембрина (3, 10, 30 мг/кг) значительно увеличился, и увеличение составило 34,6 и 45,8% (Р 0,05) по отношению к модельной группе, показав зависимость от дозы. Результаты испытания восстановления и повторяемости показали, что объемы инъекций ATP, ADP и AMP имеют хорошие линейные соотношения с площадями пиков. Полученные значения коэффициента восстановления r составили соответственно rATP=0,9897, rADP=0,9896, rAMP=0,9893, rCrP=0,9981. Показатели восстановления этих 4 видов стандартных веществ составили соответственно (86,65,6)%,(94,457,5)%, (83,46,1)%, (78,697,3)%. Таблица 7. Воздействие рацемата пиноцембрина на индексы энергетического метаболизма в ишемической ткани мозга крыс после ОСМА (s, n=10) Сравнение с контрольной группой: Р 0,05; сравнение с модельной группой: Р 0,05. 6. Воздействие рацемата пиноцембрина на воспаление в острой стадии мозговой ишемии (24 ч после ишемии) 6.1. Содержание NO и TNF- в сыворотке В табл. 8 показано, что содержание NO и TNF- в сыворотке крыс модельной группы значительно увеличилось, а содержание NO и TNF- в сыворотке крыс групп рацемата пиноцембрина (3, 10, 30 мг/кг) в момент времени через 24 ч после ишемии значительно уменьшилось (Р 0,05, Р 0,01). Таблица 8. Воздействие рацемата пиноцембрина на содержание NO и TNF- в сыворотке крыс после ОСМА ( sd, n=8) Сравнение с нормальной группой: Р 0,05, Р 0,01; сравнение с модельной группой: Р 0,05, Р 0,01. 6.2. Воздействие рацемата пиноцембрина на экспрессию цитокинов, например TNF- и IL-1 в ишемической ткани мозга На фиг. 2 видно, что экспрессия цитокинов TNF- и IL-1 в ткани значительно увеличилась в мо- 12022275 мент времени через 24 ч после ишемии, и введение рацемата пиноцембрина (3, 10, 30 мг/кг) на ранней стадии ишемии в некоторой степени ингибировало экспрессию TNF- и IL-1. 6.3. Воздействие рацемата пиноцембрина на экспрессию адгезионных молекул, например ICAM-1 иVCAM-1 в ишемической ткани мозга На фиг. 2 видно, что экспрессия адгезионных молекул ICAM-1 и VCAM-1 в ткани значительно увеличилась в момент времени через 24 ч после ишемии, и введение рацемата пиноцембрина (3, 10, 30 мг/кг) на ранней стадии ишемии в некоторой степени ингибировало экспрессию TNF- и IL-1. 6.4. Воздействия рацемата пиноцембрина на экспрессию белка iNOS и AQP-4 На фиг. 2 видно, что экспрессия белка iNOS и AQP-4 в ткани значительно увеличилась в момент времени через 24 ч после ишемии, и введение рацемата пиноцембрина (3, 10, 30 мг/кг) на ранней стадии ишемии в некоторой степени ингибировало экспрессию белка iNOS и AQP-4. С помощью -актина как внутреннего стандарта количественно определяли экспрессию TNF-, IL1, ICAM-1, VCAM-1, iNOS, AQP-4 и интуитивно замечали ингибирующее воздействие рацемата пиноцембрина на перечисленные выше белки. Рацемат пиноцембрина в дозах 10 и 30 мг/кг показал более высокие результаты. Приведенные выше результаты показали, что рацемат пиноцембрина может уменьшать острое воспаление, вызванное острым ишемическим инсультом. 7. Наблюдения морфологии нейронов в ишемической ткани мозга крыс: Через 24 ч после мозговой ишемии крысы получали анестезию в виде внутриперитонеальной инъекции 10% хлоральгидрата. После перфузии через сердце содержащим гепарин физиологическим раствором в течение 10 мин и 4% параформальдегидом в течение 30 мин ткани мозга извлекали и помещали для фиксации в 4% параформальдегид, затем нарезали на венечные срезы толщиной 6 мкм с помощью микротома с замораживанием и для окрашивания отбирали каждый двадцатый срез. Окрашенные срезы помещали на стеклянные пластинки, обработанные полилизином, и затем хранили в холодильнике при -40 С. Окрашивание по Нисслю: (1) замороженный срез извлекали из холодильника и сушили при комнатной температуре; (2) помещали в ацетон для фиксации в течение 30 мин и три раза промывали PBS по 3 мин каждый раз; (3) погружали на 20-30 мин в толуидиновый синий краситель (краситель Ниссля) и затем промывали водой в течение 15 мин; (4) дегидратировали этанолом в градиентном режиме, стекловали ксилолом и помещали на нейтральную смолу; (5) наблюдали под световым микроскопом и фотографировали для анализа; (6) отбирали по 4 замороженных среза приблизительно в том же положении для каждой крысы и наблюдали каждый срез по 5 полям зрения в гиппокампе под световым микроскопом с 200-кратным увеличением (всего по 20 изображений для каждой крысы). Считали клетки в полях зрения. Средние отношения количества клеток в группах, которым вводили лекарственные средства, к количеству в модельной группе вычисляли для статистического анализа. Результаты приведены на фиг. 3. Гиппокамп представляет собой область, чувствительную к мозговой ишемии. Результаты окрашивания по Нисслю показали, что после ишемического поражения мозговой ткани наблюдали серьезное поражение нейронов гиппокампа, очевидное отсутствие клеток и неупорядоченное расположение нервных клеток. Количественные результаты показали, что количество нервных клеток уменьшилось на 79,59,7% по сравнению с контрольной группой, и различие было значительным (Р 0,01). Пиноцембрин (3, 10, 30 мг/кг) может улучшать форму ишемических нервных клеток и уменьшать потерю нервных клеток, при этом количество нервных клеток увеличилось на 11,58,9%,36,84,9% и 51,76,6% по сравнению с модельной группой, показывая значительные отличия (Р 0,05) по сравнению с модельной группой и зависимость от дозы, что свидетельствует о нейропротективном действии после острой мозговой ишемии. Сущность изобретения 1) рацемат пиноцембрина может исправлять изменения поведения, вызванные ишемическим инсультом; 2) рацемат пиноцембрина может восстанавливать уменьшение мозгового кровотока, вызванное ишемическим инсультом; 3) рацемат пиноцембрина может уменьшать объем инфаркта мозга, вызванного ишемическим инсультом; 4) рацемат пиноцембрина может уменьшать отек мозга, вызванный ишемическим инсультом; 5) рацемат пиноцембрина может восстанавливать нарушение энергетического метаболизма, вызванное ишемическим инсультом; 6) рацемат пиноцембрина может уменьшать воспаление, вызванное ишемическим инсультом; 7) рацемат пиноцембрина может восстанавливать повреждение нервных клеток, вызванное ишемическим инсультом. Пример 3. Исследование и оценка острой токсичности Экспериментальные результаты показали, что при однократной внутривенной инъекции крысам СД значение полулетальной дозы LD50 рацемата пиноцембрина составляет 490,9 (367,6-746,7) мг/кг, значение LD50 (S)-пиноцембрина составляет 375,3 (271,2-538,5) мг/кг и значение LD50 (R)-пиноцембрина составляет 347,8 (257,4-466,3) мг/кг. Приведенные выше результаты показали, что рацемат пиноцембрина имеет более широкий интервал безопасного использования. Все данные лекарственные средства не оказывали воздействия на массу животных, и основные признаки их токсичности представляли собой тетраплегию и умеренный гемостаз печени и легких. Пример 4. Исследования терапевтического временного окна пиноцембрина у крыс, пораженных фокальной мозговой ишемией-реперфузией 1. В данном исследовании была принята модель крыс с временной окклюзией средней мозговой артерии (ВОСМА, tMCAO). Реперфузию проводили после фокальной мозговой ишемии в течение 2 ч, чтобы проверить терапевтическое временное окно пиноцембрина после фокальной мозговой ишемии. Крысам вводили рацемат пиноцембрина (1, 5 мг/кг, внутривенная инъекция) через 1, 4 и 6 ч (т.е. после 3, 6 и 8 ч ишемии). (R)-пиноцембрин и (S)-пиноцембрин (1, 5 мг/кг, внутривенная инъекция) вводили через 1 и 4 ч после реперфузии (т.е. после 3 и 6 ч ишемии). Терапевтические временные окна данных лекарственных средств при фокальной мозговой ишемии определяли путем исследования их воздействия на оценки неврологических симптомов, размеры инфаркта и содержание воды в мозге в течение 24 ч после ВОСМА. 2. Материалы и способы исследования 2.1. Подопытные животные: 100 самцов крыс SD массой 240-280 г приобретали у компании Beijing Weitong Lihua ExperimentalAnimal Technology Co., Ltd. Сертификат соответствия: SCXK (JING) 2007-0001. До и после операции животных содержали в стандартных условиях при 23-25 С с неограниченным снабжением пищей и водой. 2.2. Лекарственные средства и реагенты Рацемат пиноцембрина для инъекций, (R)-пиноцембрин для инъекций и (S)-пиноцембрин для инъекций предоставлены Лабораторией по разработке новых лекарственных средств Научноисследовательского института лекарственных средств Китайской академии медицинских наук (номер партии: 20050601, содержание: 2,36%) и подготовлены способом, описанном в заявке CN 200810084682.3, т.е. путем образования комплекса включения рацемата пиноцембрина или энантиомеров пиноцембрина с циклодекстрином или его производными и растворения комплекса в физиологическом растворе перед применением. Нимодипин как положительное контрольное лекарственное средство приобретен у компании Bayer (Германия). Гидроксипропилциклодекстрин предоставлен Лабораторией по разработке новых лекарственных средств Научно-исследовательского института лекарственных средств Китайской академии медицинских наук. ТТС приобретен у компании Sigma. Другие реагенты представляют собой имеющиеся в продаже реагенты категории "чистый для анализа". 2.3. Получение модели ВОСМА Анестезия крыс: 400 мг/кг 10% хлоральгидрата вводили крысам внутриперитонеально, после чего исчезал выпрямительный рефлекс. Крыс фиксировали на спине на операционном столе, перерезали шею спереди и тупым инструментом отделяли ткани тела, чтобы открыть правую общую сонную артерию (ОСА). ОСА отделяли до сегмента после бифуркации внутренней сонной артерии (ВСА) и наружной сонной артерии (НСА). Избегали повреждения блуждающего нерва и трахеи. Под ОСА и НСА помещали нити в качестве поддержки. ОСА и ВСА зажимали зажимом для артерий. Двумя хирургическими нитями 0 перевязывали дистальный конец НСА с интервалом 2-3 мм и затем перерезали сосуд между двумя перетяжками. Дистальный конец НСА вытягивали, пока он не образовывал прямую линию с ВСА. Делали надрез на НСА и вводили нейлоновую нить через НСА в ВСА. После ослабления зажима на артерии нейлоновую нить проталкивали в мозг через ВСА и вставляли на глубину 18,50,5 мм, на которой слегка ощущалось сопротивление. Нейлоновую нить вводили до малой передней мозговой артерии через начало СМА и затем проводили обструкцию правой СМА, в течение обструкции животные находились под анестезией. После 2 ч обструкции нейлоновую нить мягко вытягивали из корня НСА, чтобы создать реперфузию. В течение операции животных облучали настольной лампой мощностью 100 Вт для поддержания температуры тела. Комнатную температуру поддерживали в интервале 23-25 С. Крыс в контрольной группе подвергали только предоперационной анестезии и рассечению сосудов без перевязки и введения нити. 2.4. Экспериментальные группы и введение лекарственных средств контрольная группа (внутривенная инъекция физиологического раствора после 3 ч ишемии); модельная группа (внутривенная инъекция 50 мг/кг гидроксипропилциклодекстрина после 3 ч ишемии); группа нимодипина (1 мг/кг, введение после 3 ч ишемии); группа рацемата пиноцембрина (1, 5 мг/кг, введение после 3, 6 и 8 ч ишемии); группа (R)-пиноцембрина (1, 5 мг/кг, введение после 3 и 6 ч ишемии); группа (S)-пиноцембрин (1, 5 мг/кг, введение после 3 и 6 ч ишемии). Первое введение осуществляли путем внутривенной инъекции, через 12 ч проводили внутриперитонеальную инъекцию дозы, превышавшей в 1,5 раза дозу внутривенной инъекции. 2.5. Исследование состояния нервной системы и поведения Исследование состояния нервной системы и поведения проводили соответственно, когда животных пробуждали после операции и перед умерщвлением животных. Была принята оценка Бедерсона (см. подробное описание в п.1 примера 2 "Исследование состояния нервной системы и поведения"). 2.6. Определение объема инфаркта После оценки состояния нервной системы и поведения крыс умерщвляли обезглавливанием, их ткани мозга быстро извлекали и помещали в холодильник при -20 С. Через 10 мин ткани мозга переносили в помещение с комнатной температурой. После резекции обонятельной луковицы, ствола мозжечка и нижней части мозга из ткани мозга вырезали шесть сплошных венечных срезов с интервалом 2 мм. Затем среды мозга быстро переносили в раствор, содержащий 2% ТТС, и инкубировали при постоянной температуре 37 С в условиях темноты в течение 30 мин. В течение этого периода времени срезы прокалывали каждые 5 мин. После окрашивания ТТС нормальная ткань приобретала розово-красный цвет, в то время как пораженная инфарктом ткань не окрашивалась и сохраняла белый цвет. Каждую группу срезов мозга располагали по порядку и фотографировали. Фотографии обрабатывали с помощью системы анализа изображений и вычисляли площадь инфаркта в каждом срезе. Объем инфаркта каждого среза вычисляли умножением площади инфаркта на толщину среза (2 мм) и сложением объемов инфаркта всех срезов. Процентное отношение объема инфаркта выражали как отношение объема инфаркта в пораженном полушарии мозга к полному объему пораженного полушария. 2.7. Определение содержания воды в мозге: Влажную массу мозга каждого животного определяли взвешиванием перед получением срезов. После окрашивания срезы мозга сушили при 105 С в течение 24 ч и определяли взвешиванием сухую массу мозга каждого животного. Сравнивали содержание воды в мозге животных различных групп. Содержание воды в мозге = (влажная масса мозга - сухая масса мозга)/влажная масса мозга 100%. 2.8. Обработка данных Данные количественных измерений выражали как среднее значениестандартное отклонение для проверки по t-критерию Стьюдента. Вычисленные значения выражали в виде процентного отношения для проверки по Х 2-критерию Пирсона. 3. Экспериментальные результаты 3.1. Воздействие пиноцембрина на оценку Бедерсона крыс после ВОСМА Оценка состояния нервной системы и поведения крыс контрольной группы составляла 0. Средняя оценка модельной группы оперированных крыс, которым вводили растворитель, составляла 3,40,6,причем большинство животных проявляли подворачивание или втягивание передней конечности со стороны, противоположной оперированной, уменьшение силы растяжения мышц или кружение и получали оценку 3; меньшинство животных проявляли только подворачивание конечностей и уменьшение сопротивления и получали оценку 2 и несколько животных проявляли более серьезные симптомы и получали оценку 4. В группах рацемата пиноцембрина (1, 5 мг/кг) симптомы нервного расстройства после 3 ч и 6 ч ишемии у животных значительно улучшились (Р 0,05, Р 0,01), хотя улучшение симптомов после 8 ч ишемии было незначительным и проявляло зависимость от дозы в некоторой степени. В группах (R)пиноцембрина и группах (S)-пиноцембрина (1, 5 мг/кг) симптомы нервного расстройства после 3 ч ишемии значительно улучшились (Р 0,05), хотя улучшение симптомов после 6 часов ишемии было незначительным. Кроме того, нимодипин (1 мг/кг) не показал никакого улучшения симптомов после 3 ч ишемии. 3.2. Воздействие пиноцембрина на объем инфаркта крыс после ВОСМА Через 24 ч после ВОСМА последовательные венечные срезы мозга крыс окрашивали ТТС. Обнаружены области инфаркта (белые), которые не окрашивались у определенной процентной доли животных в каждой группе, показывая, что животные самостоятельно восстановились в большей или меньшей степени в течение 24 ч реперфузии. В статистической обработке данных из каждой группы удаляли образцы, в которых объем инфаркта составлял менее 5%. Рацемат пиноцембрина (5 мг/кг) уменьшал объем инфаркта при первоначальном введении после 3 ч мозговой ишемии, и его воздействие не было значительным при первоначальном введении после 6 ч мозговой ишемии. Рацемат пиноцембрина (5 мг/кг) уменьшал объем инфаркта при первоначальном введении после 3 и 6 ч мозговой ишемии (Р 0,05, Р 0,01), и его воздействие не было значительным при первоначальном введении после 8 ч мозговой ишемии. Эти эффекты оказались зависимыми от дозы в некоторой степени. (R)-пиноцембрин и (S)-пиноцембрин (1, 5 мг/кг) уменьшали объем инфаркта после 3 ч мозговой ишемии (Р 0,05), и их воздействие не было значительным при первоначальном введении после 6 ч мозговой ишемии. Кроме того, нимодипин (1 мг/кг) не приводил к улучшению при его первоначальном введении после 3 ч мозговой ишемии. 3.3. Воздействие пиноцембрина на отек мозга крыс после ВОСМА В модельной группе содержание воды в мозге крыс значительно уменьшилось. Рацемат пиноцембрина (1, 5 мг/кг) значительно уменьшал содержание воды в мозге после 3 и 6 ч мозговой ишемии(Р 0,05, Р 0,01), и его воздействие не было значительным при первоначальном введении после 8 ч мозговой ишемии. Это воздействие было зависимым от дозы в некоторой степени. (R)-пиноцембрин и (S)пиноцембрин (1, 5 мг/кг) уменьшали содержание воды в мозге после 3 ч мозговой ишемии (Р 0,05), и их воздействие не было значительным при первоначальном введении после 6 ч мозговой ишемии. Кроме того, нимодипин (1 мг/кг) не приводил к улучшению при его первоначальном введении после 3 ч мозговой ишемии. Результаты приведены в табл. 9. Таблица 9. Воздействие пиноцембрина на оценку состояния нервной системы и поведения, объем инфаркта и содержание воды в мозге крыс после 2 ч ишемии и 24 ч реперфузии ( s) Сравнение с контрольной группой: Р 0,01; сравнение с модельной группой: Р 0,05, Р 0,01. 4. Вывод Результаты показали, что инъекция рацемата пиноцембрина (1, 5 мг/кг) после 3 и 6 ч ишемии уменьшала расстройство нервной системы и поведения, сокращала объем инфаркта и смягчала отек мозга. Эти эффекты были значительными и проявляли положительную зависимость от дозы. (R)пиноцембрин и (S)-пиноцембрин проявляли значительное воздействие на крыс при первоначальной инъекции после 3 ч ишемии, но оказывались неэффективными при первоначальной инъекции после 6 ч ишемии. Нимодипин не проявлял значительной эффективности в условиях эксперимента. Рацемат пиноцембрина (1, 5 мг/кг, в/в) оказывал хорошее терапевтическое воздействие на острый ишемический инсульт у крыс, и его терапевтическое временное окно составляло около 6 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение рацемата пиноцембрина, рацемата соли пиноцембрина или рацемата гидрата пиноцембрина для получения лекарственного средства для профилактики и лечения инсульта, вызванного гипертензией. 2. Фармацевтическая композиция для профилактики и лечения вызванного гипертензией инсульта,содержащая рацемат пиноцембрина, рацемат соли пиноцембрина или рацемат гидрата пиноцембрина и фармацевтически приемлемый наполнитель. 3. Применение (R)-пиноцембрина или его соли или гидрата для получения лекарственного средства для профилактики и лечения инсульта, вызванного гипертензией. 4. Применение (R)-пиноцембрина или его соли или гидрата для получения лекарственного средства для профилактики и лечения острого ишемического инсульта. 5. Фармацевтическая композиция для профилактики и лечения инсульта, вызванного гипертензией,содержащая (R)-пиноцембрин или его соль или гидрат и фармацевтически приемлемый наполнитель.
МПК / Метки
МПК: A61P 9/10, A61K 31/352, A61K 9/00, A61K 9/08
Метки: средств, пиноцембрина, лечения, инсульта, получения, применение, рацематов, лекарственных
Код ссылки
<a href="https://eas.patents.su/19-22275-primenenie-racematov-pinocembrina-dlya-polucheniya-lekarstvennyh-sredstv-dlya-lecheniya-insulta.html" rel="bookmark" title="База патентов Евразийского Союза">Применение рацематов пиноцембрина для получения лекарственных средств для лечения инсульта</a>
Предыдущий патент: Переработка материалов
Следующий патент: Устройство и способ объединения компонентов для курительных изделий
Случайный патент: Способ получения массы, содержащей твердый карбид алюминия, и способ извлечения металлического алюминия из этой массы