Соединения бензотиадиазепина, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 20259
Опубликовано: 30.09.2014
Авторы: Лестаж Пьерр, Дезо Патрис, Данобе Лоранс, Корди Алексис
Формула / Реферат
1. Соединения формулы (I)
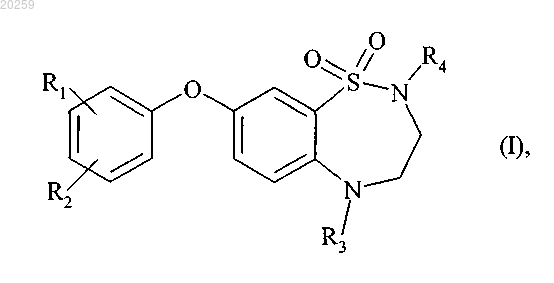
где R1 и R2, которые могут быть одинаковыми или разными, каждый, представляют собой атом водорода; атом галогена; прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена; прямую или разветвленную (C1-C6)алкоксильную группу; прямую или разветвленную (C1-C6)алкилтиогруппу; прямую или разветвленную (C1-C6)алкоксикарбонильную группу; карбоксильную группу; прямую или разветвленную (C1-C6)ацильную группу; гидроксильную группу; прямую или разветвленную (C1-C6)гидроксиалкильную группу; цианогруппу; нитрогруппу; аминогруппу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; аминогруппу, которая является замещенной прямой или разветвленной (C1-C6)ацильной группой; аминокарбонильную группу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; аминосульфонильную группу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; (C1-C6)алкилсульфониламино(C1-C6)алкильную группу, в которой алкильные фрагменты являются прямыми или разветвленными; N-гидроксикарбоксимидамидную группу или бензилоксигруппу;
R3 представляет собой атом водорода или прямую или разветвленную (C1-C6)алкильную группу, (C3-C8)циклоалкильную группу или (C3-С8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным;
R4 представляет собой атом водорода или прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена,
их оптические и позиционные изомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что группа R1 представляет собой атом водорода или гидроксильную группу, гидроксиметильную группу, этоксикарбонильную группу, аминогруппу или N-метиламинокарбонильную группу.
3. Соединения формулы (I) в соответствии с п.1 или 2, отличающиеся тем, что группа R1 находится в положении мета или пара.
4. Соединения формулы (I) в соответствии с любым из пп.1-3, отличающиеся тем, что группы R2 и R4 представляют собой атомы водорода.
5. Соединения формулы (I) в соответствии с любым из пп.1-4, отличающиеся тем, что группа R3 представляет собой атом водорода или метильную группу.
6. Соединения формулы (I) в соответствии с п.1, которые представляют собой
8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид;
этил 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]бензоат;
3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]-N-метилбензамид;
{3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенил}метанол;
4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол;
4-[(5-метил-1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол;
4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]анилин,
а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
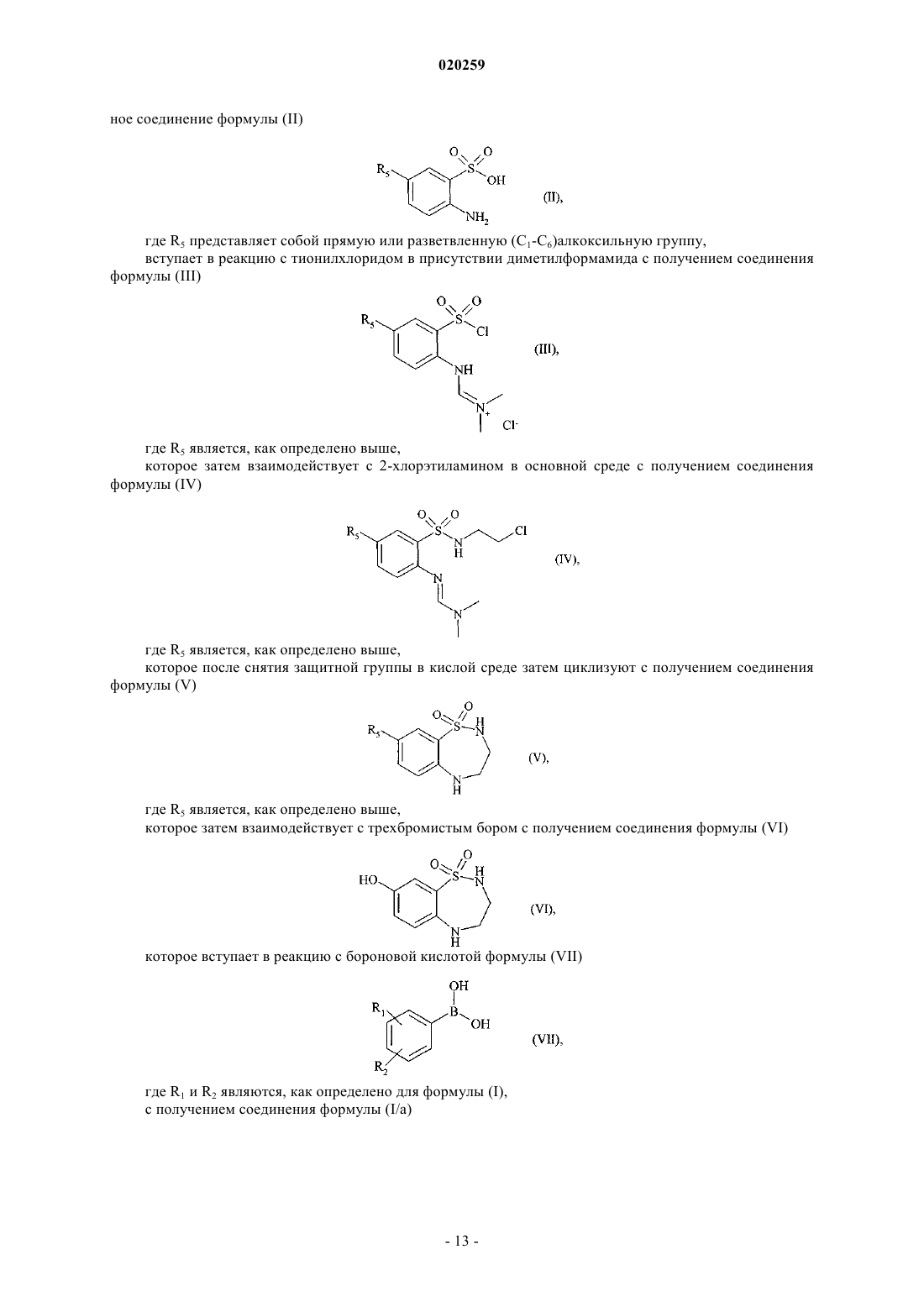
7. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исходное соединение формулы (II)

где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,
вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III)
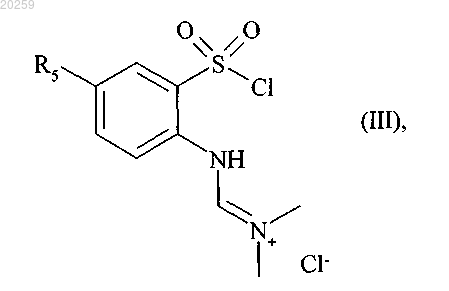
где R5 является, как определено выше,
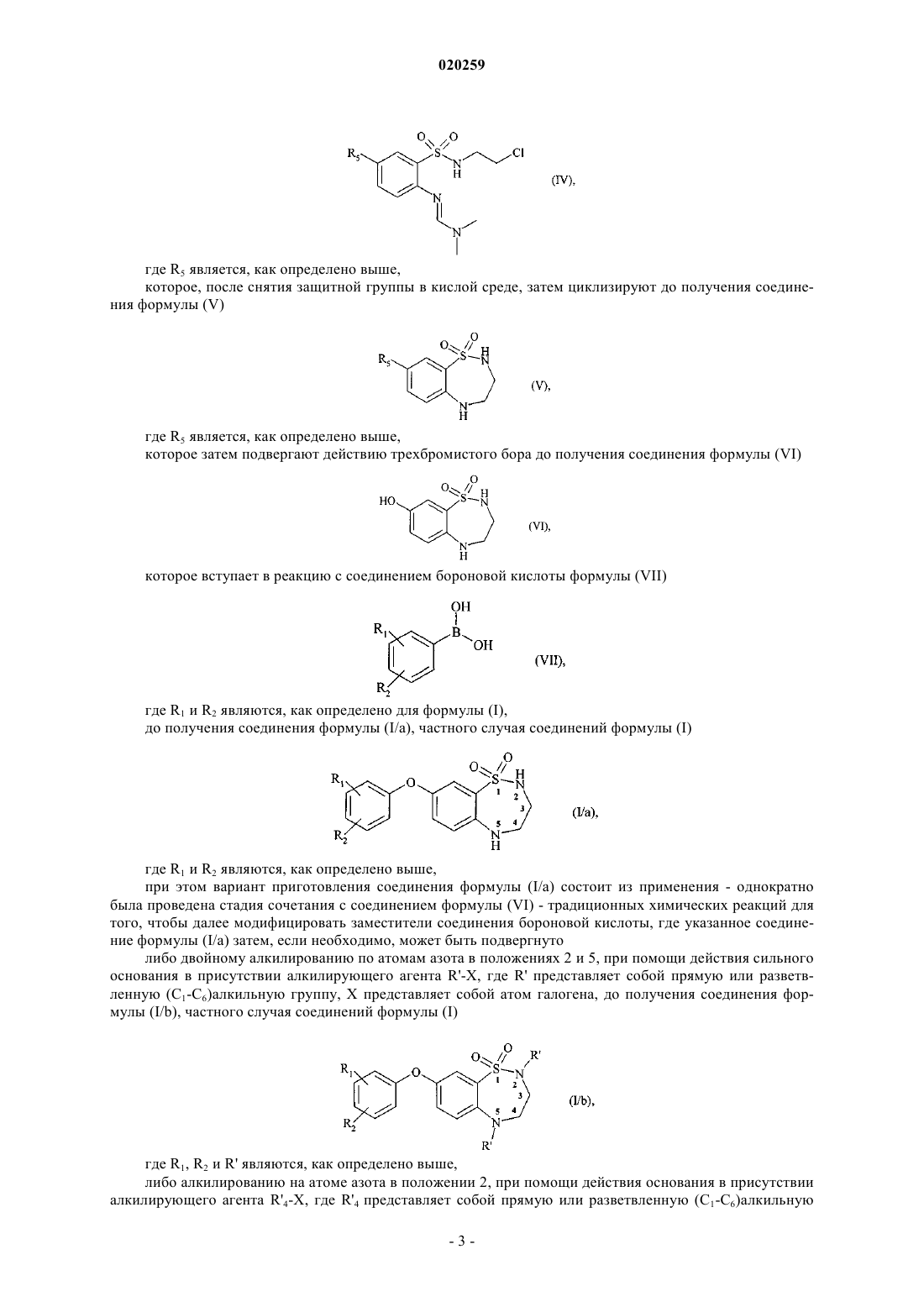
которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV)
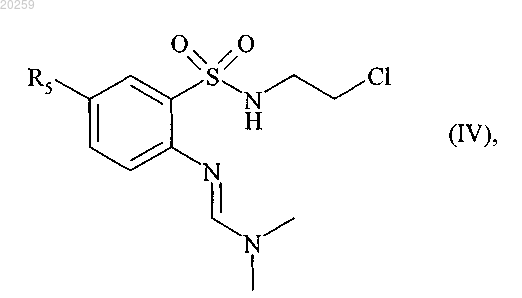
где R5 является, как определено выше,
которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V)
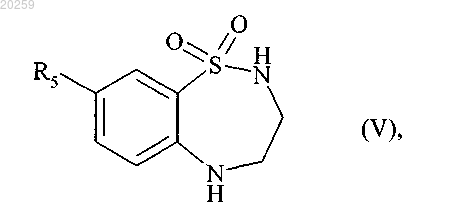
где R5 является, как определено выше,
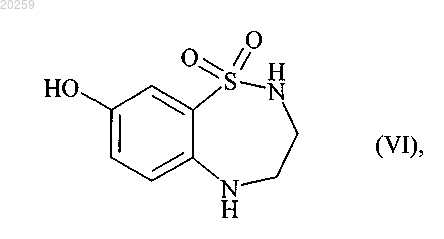
которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI)
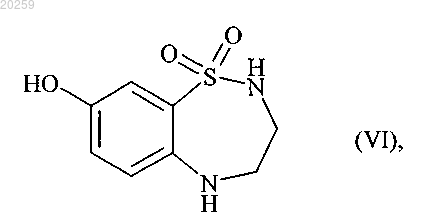
которое вступает в реакцию с бороновой кислотой формулы (VII)
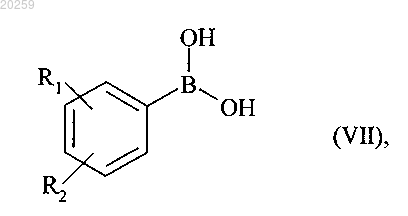
где R1 и R2 являются, как определено для формулы (I),
с получением соединения формулы (I/а)
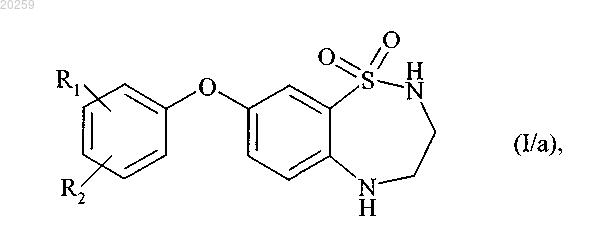
где R1 и R2 являются, как определено выше,
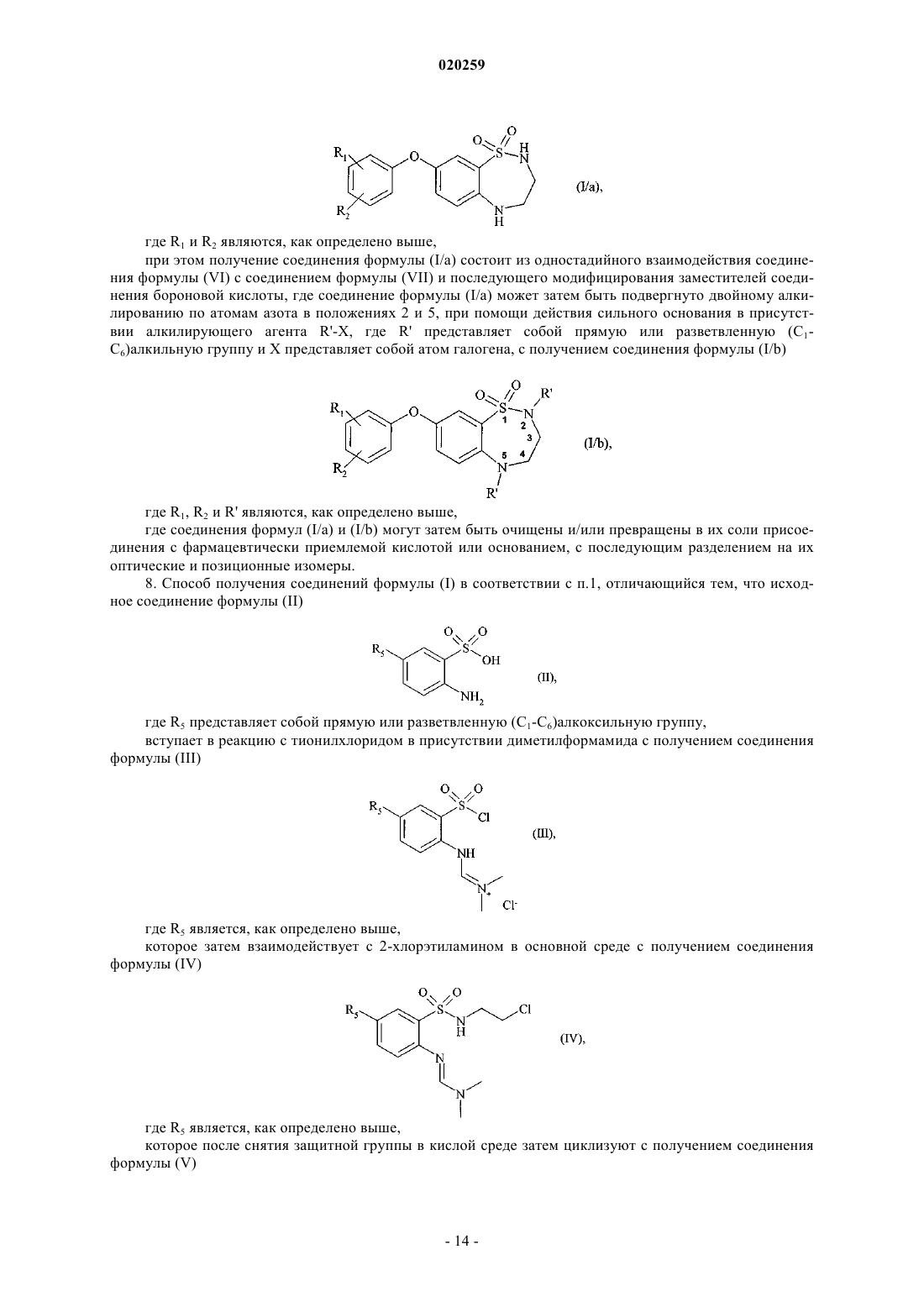
при этом получение соединения формулы (I/а) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто двойному алкилированию по атомам азота в положениях 2 и 5, при помощи действия сильного основания в присутствии алкилирующего агента R'-X, где R' представляет собой прямую или разветвленную (C1-C6)алкильную группу и X представляет собой атом галогена, с получением соединения формулы (I/b)
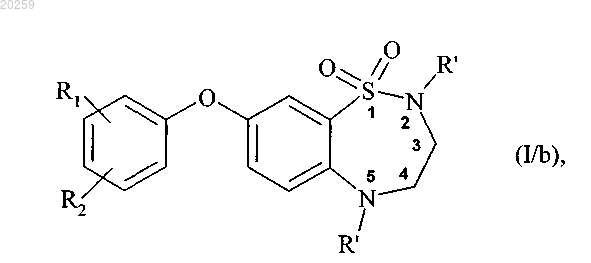
где R1, R2 и R' являются, как определено выше,
где соединения формул (I/a) и (I/b) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием, с последующим разделением на их оптические и позиционные изомеры.
8. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исходное соединение формулы (II)
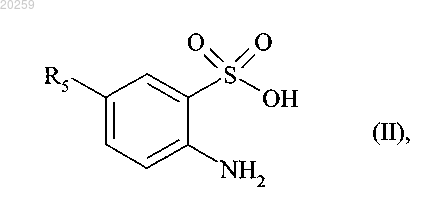
где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,
вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III)
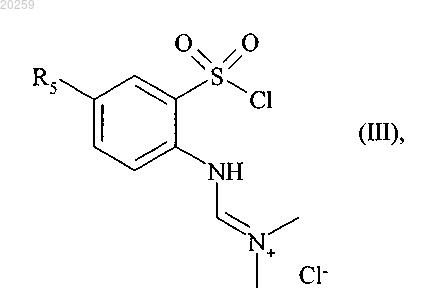
где R5 является, как определено выше,
которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV)
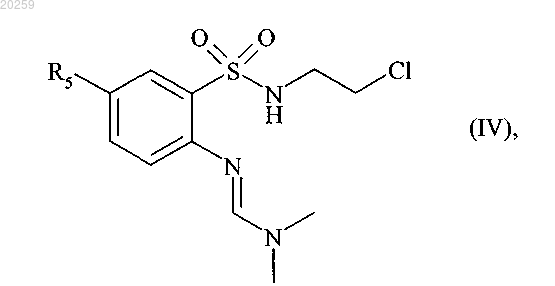
где R5 является, как определено выше,
которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V)
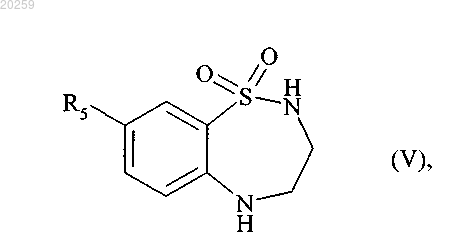
где R5 является, как определено выше,
которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI)
которое вступает в реакцию с бороновой кислотой формулы (VII)
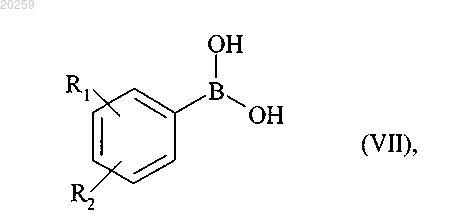
где R1 и R2 являются, как определено для формулы (I),
с получением соединения формулы (I/а)
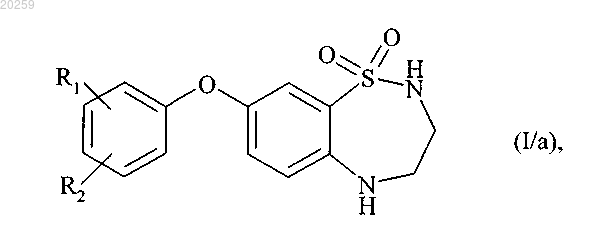
где R1 и R2 являются, как определено выше,
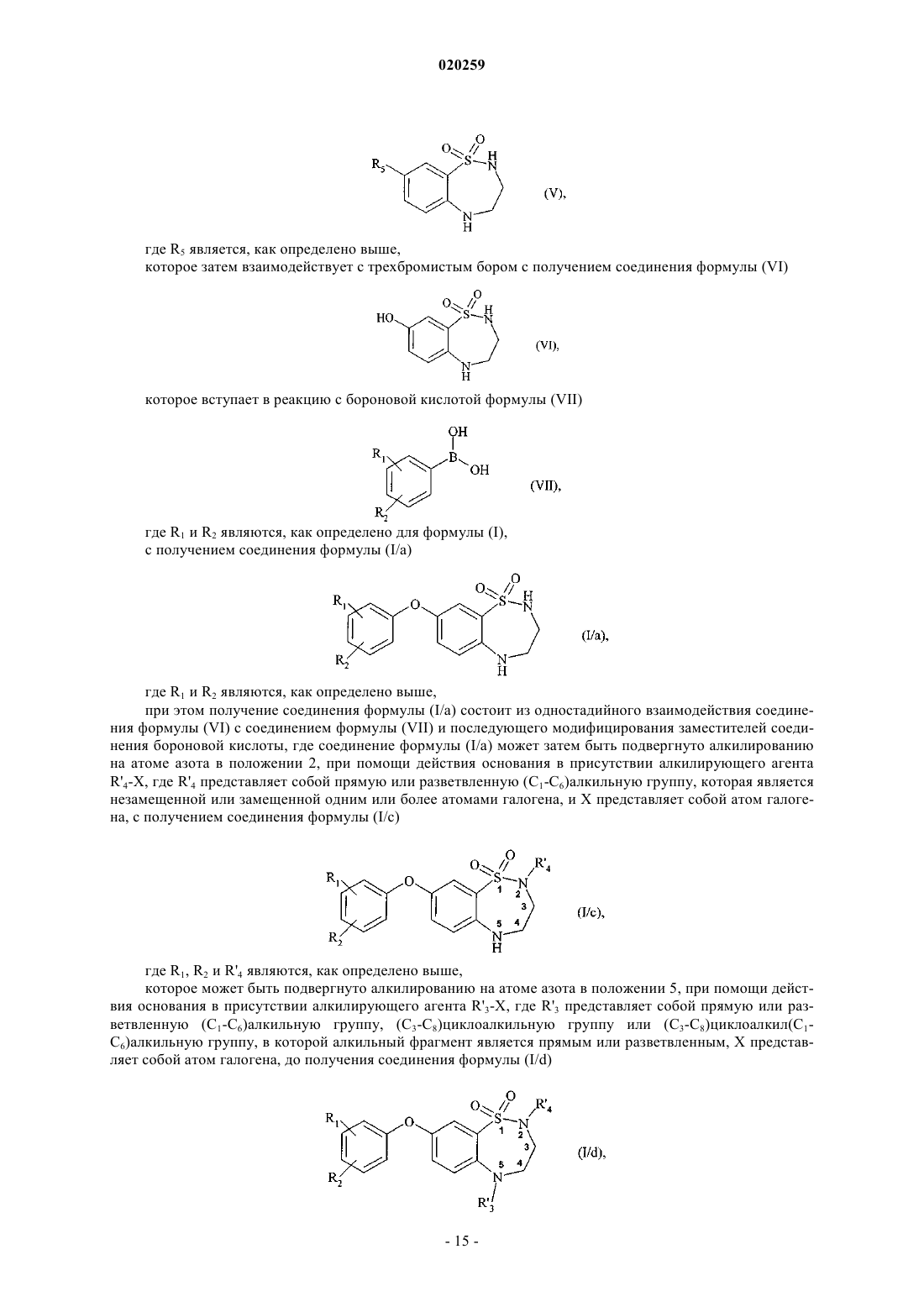
при этом получение соединения формулы (I/a) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агента R'4-X, где R'4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, и X представляет собой атом галогена, с получением соединения формулы (I/с)
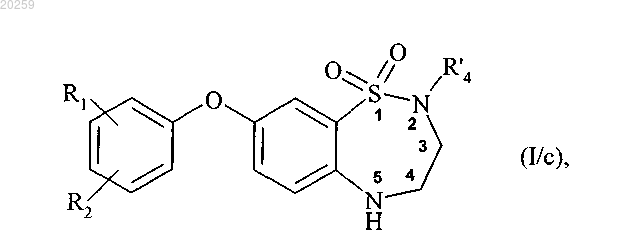
где R1, R2 и R'4 являются, как определено выше,
которое может быть подвергнуто алкилированию на атоме азота в положении 5, при помощи действия основания в присутствии алкилирующего агента R'3-X, где R'3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3-C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным, X представляет собой атом галогена, до получения соединения формулы (I/d)
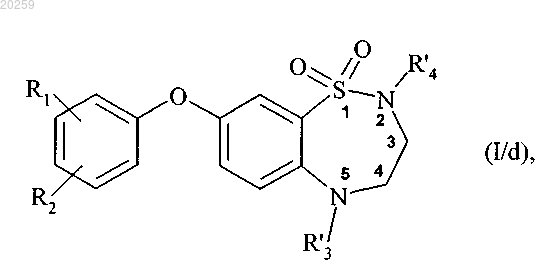
где R1, R2, R'3 и R'4 являются, как определено выше,
где соединения формул (I/a), (I/с) и (I/d) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием с последующим разделением на их оптические и позиционные изомеры.
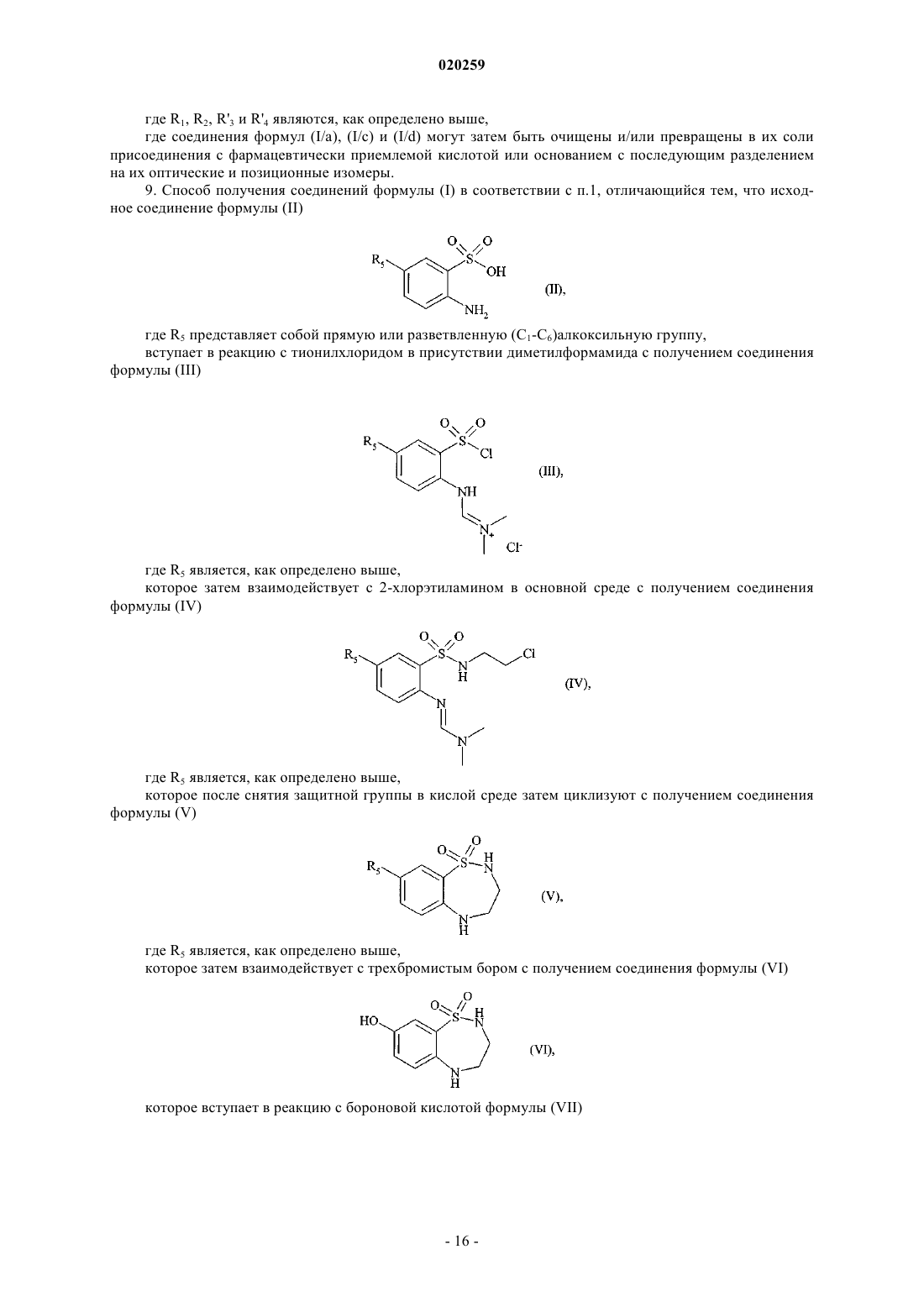
9. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исходное соединение формулы (II)
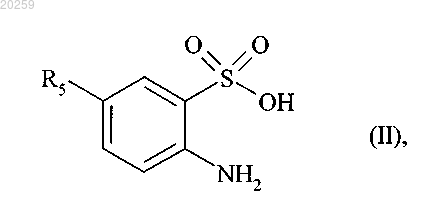
где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,
вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III)
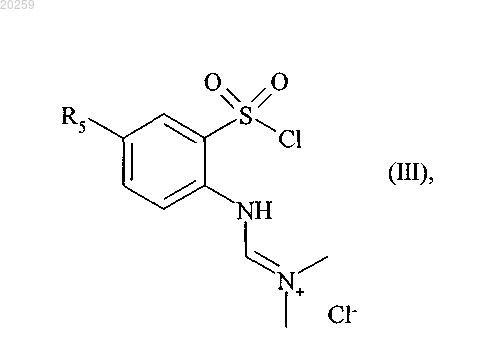
где R5 является, как определено выше,
которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV)
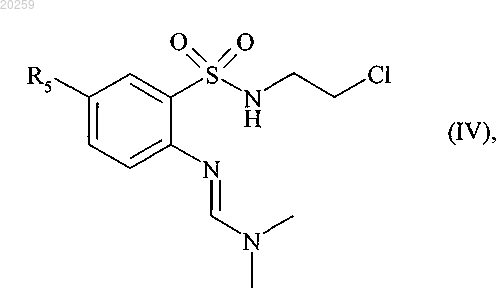
где R5 является, как определено выше,
которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V)
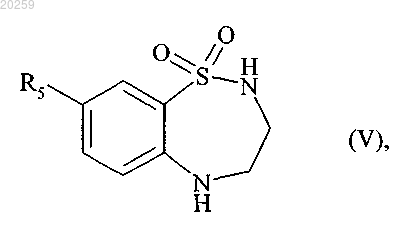
где R5 является, как определено выше,
которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI)
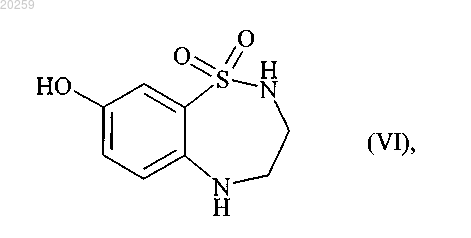
которое вступает в реакцию с бороновой кислотой формулы (VII)
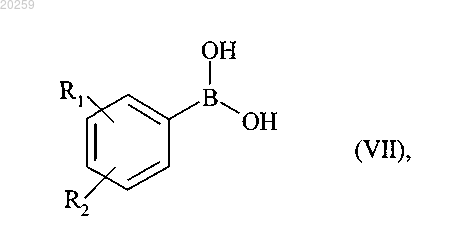
где R1 и R2 являются, как определено для формулы (I),
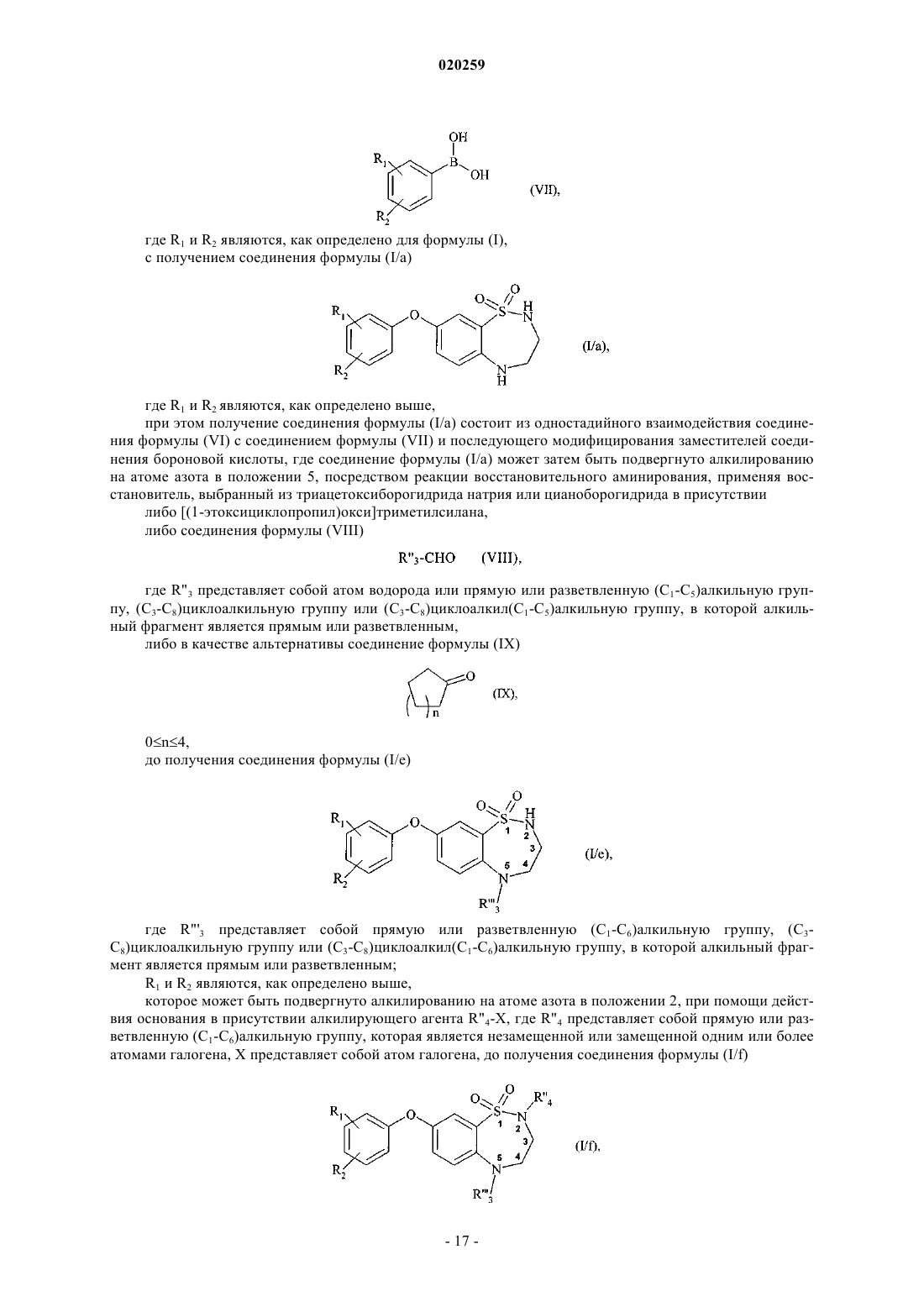
с получением соединения формулы (I/а)
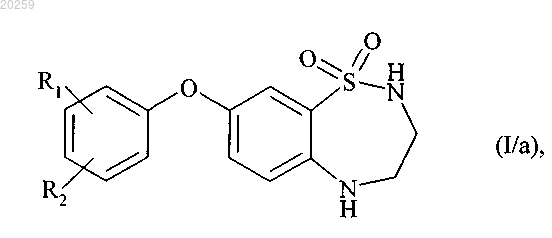
где R1 и R2 являются, как определено выше,
при этом получение соединения формулы (I/а) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто алкилированию на атоме азота в положении 5, посредством реакции восстановительного аминирования, применяя восстановитель, выбранный из триацетоксиборогидрида натрия или цианоборогидрида в присутствии
либо [(1-этоксициклопропил)окси]триметилсилана,
либо соединения формулы (VIII)
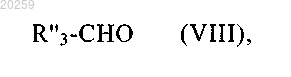
где R"3 представляет собой атом водорода или прямую или разветвленную (C1-C5)алкильную группу, (C3-C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C5)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным,
либо в качестве альтернативы соединение формулы (IX)
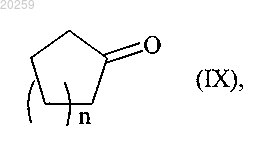
0≤n≤4,
до получения соединения формулы (I/е)
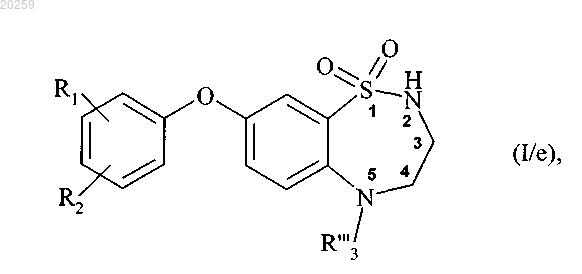
где R"'3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3-C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным;
R1 и R2 являются, как определено выше,
которое может быть подвергнуто алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агента R"4-X, где R"4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, X представляет собой атом галогена, до получения соединения формулы (I/f)
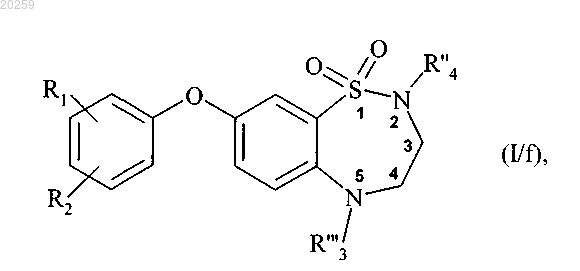
где R1, R2, R"'3 и R"4 являются, как определено выше,
где соединения формул (I/a), (I/е) и (I/f) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием, с последующим разделением на их оптические и позиционные изомеры.
10. Соединение формулы (VI)
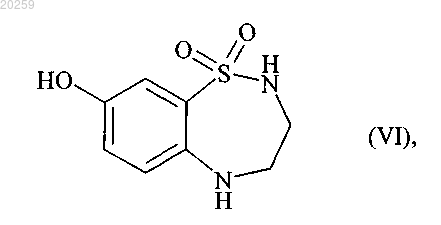
отличающееся тем, что оно применяется в качестве интермедиата в синтезе соединений формулы (I).
11. Фармацевтическая композиция, содержащая в качестве действующего вещества соединение в соответствии с любым из пп.1-6, в комбинации с одним или более фармацевтически приемлемыми, нетоксичными, инертными носителями.
12. Фармацевтическая композиция в соответствии с п.11 для изготовления лекарственных средств в качестве модуляторов АМРА(α-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота)-рецепторов и антагонистов NMDA(N-метил-D-аспарат)-рецепторов.
13. Фармацевтическая композиция в соответствии с п.11 для изготовления лекарственных средств для лечения или профилактики прогрессирующих и острых нейродегенеративных заболеваний.
14. Фармацевтическая композиция в соответствии с п.13, где нейродегенеративные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, хорею Хантингтона, корсаковский психоз, шизофрению, деменцию лобной доли, подкорковую деменцию, сосудистую деменцию, эпилепсию, острые церебральные сосудистые расстройства, депрессивные и тревожные состояния.
Текст
СОЕДИНЕНИЯ БЕНЗОТИАДИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ где R1 и R2, которые могут быть одинаковыми или разными, каждый, представляют собой водород или атом галогена либо алкильную, алкоксильную группы, алкилтиогруппу,ацильную, алкоксикарбонильную, карбоксильную, гидроксильную, гидроксиалкильную группы, цианогруппу, нитрогруппу, аминогруппу, замещенную или незамещенную аминокарбонильную группу, аминосульфонильную, алкилсульфониламиноалкильную, Nгидроксикарбоксимидамидную группы или бензилоксигруппу; R3 представляет собой атом водорода или алкильную, циклоалкильную или циклоалкилалкильную группы; R4 представляет собой атом водорода или замещенную или незамещенную алкильную группу.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Настоящее изобретение относится к новым соединениям бензотиадиазепина, к способу их приготовления, к фармацевтическим композициям, содержащим их, а также к их применению в качестве положительных аллостерических модуляторов АМРА-рецепторов и антагонистов NMDA-рецепторов. На сегодня является известным, что возбуждающие аминокислоты, особенно, в частности, глутамат, играют решающую роль в физиологических процессах нейронной пластичности и в механизмах,лежащих в основе обучаемости и памяти. Патофизиологические исследования ясно показали, что дефицит глутаматергической нейтротрансмиссии тесно связан с развитием болезни Альцгеймера (Neuroscience and Biobehavioral Reviews, 1992, 16, 13-24; Progress in Neurobiology, 1992, 39, 517-545). Кроме того,многочисленные работы продемонстрировали существование подвидов рецепторов возбуждающих аминокислот и их функциональных взаимодействий (Molecular Neuropharmacology, 1992, 2, 15-31). Среди указанных рецепторов рецептор АМРА (-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота) представляет собой рецептор-канал для глутамата, который является проницаемым для Na+ и K+ и обладает низкой проницаемостью для Са 2+. АМРА-рецептор, по-видимому, в наибольшей степени задействован в быстрой физиологической возбуждающей синаптической передаче и,особенно, в процессах запоминания. Например, было показано, что обучаемость связана с увеличением числа АМРА-рецепторов в синаптических связях внутри гиппокампа, одной из областей головного мозга, отвечающей за процессы памяти и познания. Подобным образом, ноотропные вещества, такие как анирацетам, были описаны как вещества, положительным образом модулирующие АМРА-рецепторов нервных клеток (J. Neurochemistry, 1992, 58, 1199-1204). Второй рецептор, рецептор NMDA (N-метил-D-аспарат), также принадлежит к одному из трех классов глутаматных рецепторов-каналов. Связывание глутамата и его коагониста, глицина, является необходимым, чтобы открыть канал и позволить вхождение Са 2+ в клетку (Progress in Neurobiology, 1998,54, 581-618; Handb. Exp. Pharmacol., 2005, 169, 249-303). NMDA-рецепторы, подобным образом, играют важную физиологическую роль в процессах обучения и памяти. Однако чрезмерная активация этих рецепторов, что может происходить во время ишемии головного мозга и аноксии головного мозга, эпилептических припадков, травмы или нейродегенеративных болезней, приводит к чрезмерному вхождению Са 2+ в клетку, что может иметь достаточный потенциал, чтобы вызвать гибель клетки по причине явления эксайтотоксичности (Progress in Neurobiology, 1998, 54, 369-415; J. Pharmacol. Exp. Ther., 2002, 300,717-723). Фактически было продемонстрировано, что определенные формы нейротоксичности, вызванной глутаматом, зависят от накопления Са 2+ в клетке, что приводит к повышению метаболической нагрузки на митохондрию и повышенной выработке свободных радикалов. По этим причинам антагонисты рецепторов NMDA были разработаны в отношении их нейропротекторных свойств, включая мемантин,который в настоящее время применяется в лечении от умеренно серьезных до серьезных форм болезни Альцгеймера (Neuropharmacology, 1999, 38, 735-767; Dement. Geriatr. Cogn. Disord., 2005, 19, 229- 245). В литературе было описано лишь несколько соединений, имеющих бензотиадиазиновую структуру,которые являются положительными модуляторами АМРА-рецепторов, которые также обладают действием антагонистов рецепторов NMDA (Neuropharmacology, 2004, 46, 1105-1113). Соединение IDRA-21, в частности, обладает способностью улучшать характеристики памяти. Патент WO 99/42456 описывает, среди прочего, бензотиадиазин и соединения бензотиадиазепина в качестве модуляторов АМРА-рецепторов. Соединения бензотиадиазепина, к которым относится настоящее изобретение, кроме того, что являются новыми, демонстрируют фармакологическое действие в отношении как рецептора АМРА, так и в отношении рецептора NMDA, которое превосходит фармакологическое действие соединений, которые имеют подобные структуры, описанные в предшествующем уровне техники. Конкретнее, настоящее изобретение относится к соединениям формулы (I) где R1 и R2, которые могут быть одинаковыми или разными, каждый, представляют собой атом водорода; атом галогена или прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена; прямую или разветвленную (C1C6)алкоксильную группу; прямую или разветвленную (C1-C6)алкилтиогруппу; прямую или разветвленную (C1-C6)алкоксикарбонильную группу; карбоксильную группу; прямую или разветвленную (C1C6)ацильную группу; гидроксильную группу; прямую или разветвленную (C1-C6)гидроксиалкильную группу; цианогруппу; нитрогруппу; аминогруппу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; аминогруппу, которая является замещенной прямой или разветвленной (C1-C6)ацильной группой; аминокарбонильную группу, ко-1 020259 торая является незамещенной или замещенной одной или более прямыми или разветвленными (C1C6)алкильными группами; аминосульфонильную группу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; (C1C6)алкилсульфониламино(С 1-C6)алкильную группу, в которой алкильные фрагменты являются прямыми или разветвленными; N-гидроксикарбоксимидамидную группу или бензилоксигруппу;R3 представляет собой атом водорода, прямую или разветвленную (C1-C6)алкильную группу, (C3C8)циклоалкильную группу или (C3-С 8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным;R4 представляет собой атом водорода или прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена,к их оптическим и позиционным изомерам, когда они существуют, и также к их солям присоединения с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот могут быть упомянуты, без основания полагать какиелибо ограничения, соляная, бромисто-водородная, серная, фосфорная, уксусная, трифторуксусная, молочная, пировиноградная, малоновая, янтарная, глутаровая, флумаровая, винная, малеиновая, лимонная,аскорбиновая, щавелевая, метансульфоновая, бензилсульфоновая и камфарная кислоты. Среди фармацевтически приемлемых оснований могут быть упомянуты, без основания полагать какие-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин и трет-бутиламин. Группа R1 предпочтительно представляет собой атом водорода или гидроксильную группу; прямую или разветвленную (C1-C6)гидроксиалкильную группу и, в частности, гидроксиметильную группу; прямую или разветвленную (C1-C6)алкоксикарбонильную группу и преимущественно этоксикарбонильную группу; аминогруппу или аминокарбонильную группу, которая является замещенной прямой или разветвленной (C1-C6)алкильной группой и, в частности, N-метиламинокарбонильную группу. Предпочтение отдают группе R1, которая находится в положении мета или пара. R1 особенно предпочтительно представляет собой атом водорода. Группы R2 и R4, каждая, предпочтительно представляют собой атом водорода.R3 предпочтительно представляет собой атом водорода или метильную группу. Предпочтительные соединения изобретения представляют собой 8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид; этил 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]бензоат; 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]-N-метил бензамид; 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенилметанол; 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол; 4-[(5-метил-1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол; 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]анилин. Соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений изобретения составляют неотъемлемую часть изобретения. Изобретение относится также к способу приготовления соединений формулы (I), где указанный способ отличается тем, что в качестве исходного материала применяют соединение формулы (II) где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,которое вступает в реакцию с тионилхлоридом в присутствии диметилформамида до получения соединения формулы (III) где R5 является, как определено выше,которое затем подвергают действию 2-хлорэтиламина в основной среде до получения соединения формулы (IV) где R5 является, как определено выше,которое, после снятия защитной группы в кислой среде, затем циклизируют до получения соединения формулы (V) где R5 является, как определено выше,которое затем подвергают действию трехбромистого бора до получения соединения формулы (VI) которое вступает в реакцию с соединением бороновой кислоты формулы (VII) где R1 и R2 являются, как определено для формулы (I),до получения соединения формулы (I/a), частного случая соединений формулы (I) где R1 и R2 являются, как определено выше,при этом вариант приготовления соединения формулы (I/a) состоит из применения - однократно была проведена стадия сочетания с соединением формулы (VI) - традиционных химических реакций для того, чтобы далее модифицировать заместители соединения бороновой кислоты, где указанное соединение формулы (I/a) затем, если необходимо, может быть подвергнуто либо двойному алкилированию по атомам азота в положениях 2 и 5, при помощи действия сильного основания в присутствии алкилирующего агента R'-X, где R' представляет собой прямую или разветвленную (C1-C6)алкильную группу, X представляет собой атом галогена, до получения соединения формулы (I/b), частного случая соединений формулы (I) где R1, R2 и R' являются, как определено выше,либо алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агента R'4-X, где R'4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, X представляет собой атом галогена, до получения соединения формулы (I/с), частного случая соединений формулы (I) где R1, R2 и R'4 являются, как определено выше,которые необязательно могут быть подвергнуты алкилированию на атоме азота в положении 5, при помощи действия основания в присутствии алкилирующего агента R'3-X, где R'3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3-C8)циклоалкильную группу или (C3C8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным, X представляет собой атом галогена, до получения соединения формулы (I/d) где R1, R2, R'3 и R'4 являются, как определено выше,либо в качестве альтернативы алкилированию на атоме азота в положении 5, посредством реакции восстановительного аминирования, при помощи применения восстановителя, такого как натрия триацетоксиборогидрида или цианоборогидрида в присутствии либо [(1-этоксициклопропил)окси]триметилсилана,либо соединения формулы (VIII) где R"3 представляет собой атом водорода или прямую или разветвленную (C1-C5)алкильную группу, (C3-C8)циклоалкильную группу или (С 3-С 8)циклоалкил(С 1-С 5)группу, в которой алкильный фрагмент является прямым или разветвленным,либо в качестве альтернативы соединения формулы (IX) где 0n4,до получения соединения формулы (I/е), частного случая соединений формулы (I) где R3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C6)группу, в которой алкильный фрагмент является прямым или разветвленным, R1 и R2 являются, как определено выше,которые необязательно могут быть подвергнуты алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агента R"4-X, где R"4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, и X представляет собой атом галогена, до получения соединения формулы (I/f) где R1, R2, R'"3 и R"4 являются, как определено выше,где указанные соединения формул (I/a)-(I/f), которые составляют совокупность соединений формулы (I), могут затем быть очищены в соответствии с традиционным методом разделения, и преобразуют,если желательно, на их соли присоединения с фармацевтически приемлемой кислотой или основанием и разделяют, в соответствующих случаях, на их оптические и позиционные изомеры, если они существуют, в соответствии с традиционным методом разделения. Соединения формул (II) и (VII) являются коммерчески доступными или являются легко доступными для специалиста в данной области техники посредством применения традиционных химических реакций или химических реакций, которые описаны в литературе. Соединение формулы (VI) является новым и, в качестве интермедиата в синтезе соединений формулы (I), также является частью изобретения. Соединения формулы (I) в соответствии с изобретением обладают свойствами активации АМРАрецепторов и свойствами антагониста NMDA-рецепторов, что позволяет применять их для лечения или для профилактики прогрессирующих нейродегенеративных заболеваний, болезни Альцгеймера, болезни Паркинсона, болезни Пика, хореи Хантингтона, корсаковского психоза, шизофрении, острых нейродегенеративных заболеваний, деменции лобной доли и подкорковой деменции, сосудистой деменции, эпилепсии, острых церебральных сосудистых расстройств, а также депрессивных и тревожных состояний. Изобретение относится также к фармацевтическим композициям, содержащим в качестве действующего вещества по крайней мере одно соединение формулы (I) с одним или более соответствующими,инертными, нетоксичными вспомогательными веществами. Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты, в частности, те, которые являются подходящими для перорального, парентерального (внутривенного или подкожного), назального, перкутанного, чрескожного, ректального, чрезъязычного, глазного и респираторного введения и, в частности, таблетки или драже,подъязыковые таблетки, саше, пеллеты, капсулы, пастилки, глоссеты, суппозитории, кремы, мази, кожные гели, препараты для инъекций и суспензии для питья. Применяемая дозировка может варьироваться в зависимости от природы и серьезности нарушения,способа введения, а также от возраста и веса пациента, и она находится в пределах от 0,01 мг до 1 г в день в один или более приемов. Примеры, которые следуют, иллюстрируют изобретение, но не ограничивают его ни в коем случае. Применяемые исходные материалы являются продуктами, которые известны, или которые могут быть приготовлены в соответствии с известными методами. Структуры соединений, описанных в примерах, были определены в соответствии с обычным спектрофотометрическим методом (инфракрасная, ЯМР, масс-спектрометрия). Пример 1: 8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин, 1,1-диоксид. Стадия A: N-2-(хлоросульфонил)-4-метоксифенил]амино]метилен]-N-метилметанаминиум хлорид. Диметилформамид (0,152 моль) добавляют капля по капле к суспензии 2-амино-5 метоксибензилсульфоновой кислоты (0,152 моль) в тионилхлориде (0,763 моль). Реакционную смесь нагревают очень медленно до температуры 70C и поддерживают при этой температуре на протяжении 1,5 ч. После охлаждения перемешанный реакционный раствор обрабатывают при помощи добавления 20 мл толуола. Образуется осадок, который тут же фильтруют, споласкивают толуолом и затем сушат при температуре 40C в вакууме в присутствии гранул KOH, что дает указанный продукт. Стадия В: N-(2-хлорэтил)-2-[(1E)-(диметиламино)метилен]амино-5-метоксибензилсульфонамид. Триэтиламин (0,517 моль) добавляют капля по капле к суспензии смеси продукта стадии, описанной выше (0,152 моль), и 2-хлорэтиламин гидрохлорида (0,182 моль) в 470 мл дихлорметана, поддерживая температуру реакционной смеси ниже 30C. После перемешивания на протяжении 2 ч реакционную смесь разбавляют дихлорметаном, органическую фазу дважды промывают водой, а затем насыщенным раствором NaCl. Органическую фазу сушат над MgSO4 и упаривают при сниженном давлении. Остаток затвердевает в этиловом эфире, что дает после фильтрации указанный продукт. Температура плавления: 89C. Стадия С: 2-амино-N-(2-хлорэтил)-5-метоксибензилсульфонамид. Весь продукт стадии, описанной выше, суспендируют в смеси 130 мл диоксана и 110 мл 5 М HCl. Реакционную смесь перемешивают при температуре 110C на протяжении 16 ч. После выпаривания диоксана реакционную смесь разбавляют водой, затем ее нейтрализуют при помощи добавления 10% раствора NaHCO3. При нейтральном значении pH водную фазу 3 раза экстрагируют этилацетатом. Органические фазы собирают, промывают насыщенным раствором NaCl и затем сушат над MgSO4, что дает после упаривания при сниженном давлении указанный продукт в виде масла. Стадия D: 8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. В 1-литровом автоклавном реакторе PAAR со стеклянным корпусом весь продукт стадии, описанной выше, суспендируют в 300 мл этанола. Реакционную смесь нагревают при температуре 150C на протяжении 8 ч. После того как охлаждение завершено, осадок фильтруют, что дает указанный продукт. Температура плавления: 126C. Стадия Е: 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ол 1,1-диоксид. К суспензии продукта стадии, описанной выше, (12,3 ммоль) в 30 мл дихлорметана добавляют капля по капле 1 М раствора трехбромистого бора в дихлорметане (37 мл), поддерживая температуру реакционной смеси ниже 30C. Гетерогенную смесь перемешивают на протяжении 20 ч при температуре окружающей среды и выливают на приблизительно 100 г льда. Раствор затем нейтрализуют при помощи добавления 10% раствора Na2CO3. После упаривания водной фазы до сухого состояния остаток растирают в порошок в ацетоне. Соли фильтруют несколько раз и различные фильтраты (содержащие ожидаемый продукт и также исходный материал) собирают. Их абсорбируют через кварц, что дает после хроматографирования посредством элюирования с градиентом дихлорметана/ацетона от 96/4 до 90/10 и твердения в этиловом эфире указанный продукт в виде белого порошка. Температура плавления: 183-188C. Стадия F: 8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Суспензию фенилбороновой кислоты (8,36 ммоль), продукта стадии, описанной выше (5,60 ммоль),Cu(OAc)2 (8,42 ммоль), пиридина (16,8 ммоль) и 12 г молекулярного сита в 200 мл дихлорметана перемешивают всю ночь на воздухе при температуре окружающей среды. Затем добавляют ацетон и затем реакционную смесь фильтруют через фритт. Фильтрат упаривают, поглощают в дихлорметане и хроматографируют на кварцевой колонке, элюируя со смесью дихлорметана/ацетона 96/4, что дает после твердения в этиловом эфире указанный продукт в виде белого порошка. Температура плавления: 146-149C. Элементный микроанализ: Продукты примеров 2-9, которые следуют далее, были получены в соответствии с процедурой стадии F примера 1, начиная от интермедиата 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ол 1,1-диоксид Пример 8: 8-[4-(бензилокси)фенокси]-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Реакция с [4-(бензилокси)фенил]бороновой кислотой. Температура плавления: 134C. Пример 9: 8-(4-нитрофенокси)-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Реакция с (4-нитрофенил)бороновой кислотой. Температура плавления: 162C. Пример 10: 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]-Nгидроксибензилкарбоксимидамид. К 750 мкл ДМСО добавляют гидроксиламина гидрохлорид (1,90 ммоль) и затем триэтиламин (1,90 ммоль). Образуется обильный белый осадок, который разбавляют при помощи добавления 3 мл ТГФ, и производят перемешивание на протяжении 25 мин при температуре окружающей среды. ТГФ упаривают при сниженном давлении и суспензию фильтруют. Продукт примера 6 (0,317 ммоль) добавляют к фильтрату и раствор перемешивают всю ночь при температуре окружающей среды. После добавления к реакционной смеси воды образуется клейкое вещество, которое затвердевает при помощи добавления дихлорметана и этилового эфира. Осадок фильтруют и ополаскивают водой и этиловым эфиром, что дает указанный продукт. Температура плавления: 197C. Элементный микроанализ: Пример 11: 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]бензойная кислота. Суспензию сложного эфира примера 7 (0,55 ммоль) в 5 мл 1N раствора гидроксида натрия перемешивают на протяжении 30 мин при температуре 80C. Реакционную смесь затем нейтрализуют при помощи применения 1N раствора HCl, экстрагируют этилацетатом, промывают (насыщенным растворомNaCl), сушат (MgSO4), фильтруют и затем упаривают при сниженном давлении, что дает после растирания остатка в порошок в этиловом эфире и последующего фильтрования указанный продукт. Температура плавления: 212-217C. Элементный микроанализ: Пример 12: 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]-Nметилбензамид. Кислоту примера 11 (0,66 ммоль) перемешивают всю ночь при температуре окружающей среды в 50 мл дихлорметана в присутствии 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурониум тетрафторобората (0,80 ммоль), диизопропилэтиламина (0,80 ммоль) и 2 М раствора метиламина в ТГФ (1,32 ммоль). Реакционную смесь затем нейтрализуют 1N раствора HCl, экстрагируют этилацетатом, промывают (насыщенным раствором NaCl), сушат (MgSO4), фильтруют и затем упаривают при сниженном давлении,что дает после растирания остатка в порошок в смеси дихлорметана/метанола и фильтрования указанный продукт. Температура плавления: 205C. Элементный микроанализ: Пример 13: 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенилметанол. Сложный эфир примера 7 (0,805 ммоль) растворяют в 10 мл ТГФ и добавляют LiAlH4 (2,43 ммоль) небольшими порциями. После перемешивания на протяжении 30 мин к реакционной смеси по очереди добавляют 1 мл изопропилового спирта и 1 мл соляного раствора. Суспензию фильтруют и фильтрат после упаривания при сниженном давлении хроматографируют на кварцевой колонке (98/2 дихлорметан/метанол), что дает указанный продукт. Температура плавления: 146C. Пример 14: 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол. Продукт примера 8 (0,76 ммоль) гидрогенизируют на протяжении 1 ч при атмосферном давлении в 60 мл этанола в присутствии 30 мг 10% палладиевого катализатора на углеродном носителе и 2 капель 4N раствора HCl в диоксане. Катализатор удаляют при помощи фильтрации и фильтрат упаривают досуха. Остаток поглощают в горячем состоянии в этилацетате. Органическую фазу промывают 1% раствором NaHCO3 и затем насыщенным раствором NaCl, сушат (MgSO4), фильтруют и упаривают. Остаток растирают в порошок в смеси этилацетата/этилового эфира, что дает после фильтрации указанный продукт. Температура плавления: 175C. Элементный микроанализ: Пример 15: 8-[4-(бензилокси)фенокси]-5-метил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1 диоксид. Водный формальдегид 37% (12,6 ммоль) добавляют к суспензии продукта примера 8 (2,52 ммоль) в 10 мл ацетонитрила. Суспензию перемешивают на протяжении 1 ч при температуре окружающей среды. Добавляют по очереди на конце шпателя бромкрезолового зеленого и цианоборогидрида натрия (7,56 ммоль). Реакционную смесь доводят до кислого значения pH при помощи добавления 4N раствора HCl в диоксане. Реакционную смесь перемешивают всю ночь при температуре окружающей среды и затем нейтрализуют при помощи добавления 10% раствора NaHCO3. После разбавления реакционной смеси водой образуется осадок, который фильтруют. Очищение указанного продукта выполняют хроматографией на кварце, элюируя со смесью дихлорметана/этилацетата 96/4. Температура плавления: 168-172C. Пример 16: 4-[(5-метил-1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол. Соединение получают при помощи каталитического гидрирования продукта примера 15 в соответствии с процедурой примера 14. Очищение выполняют хроматографией на кварце, элюируя со смесью дихлорметана/ацетона 95/5. Температура плавления: 128-130C. Элементный микроанализ: Пример 17: 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]анилин дигидрохлорид. Продукт примера 9 (0,51 ммоль) гидрогенизируют на протяжении 2 ч при атмосферном давлении в 30 мл метанола в присутствии 20 мг 10% палладиевого катализатора на углеродном носителе. Катализатор удаляют при помощи фильтрации и фильтрат упаривают до сухого состояния. Остаток поглощают в горячем состоянии в метаноле и смесь окисляют с помощью 4N раствора HCl в диоксане. После упаривания до сухого состояния остаток растирают в порошок в ацетонитриле, что дает после фильтрации указанный продукт. Температура плавления: 128-134C Продукты примеров 18-21, которые следуют далее, получают при помощи восстановительного алкилирования соединения примера 1. Пример 18: 5-(циклопропилметил)-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1 диоксид гидрохлорид. К раствору продукта примера 1 (1,38 ммоль) в 50 мл CH2Cl2 добавляют циклопропанкарбальдегид(4,17 ммоль), уксусную кислоту (4,17 ммоль) и триацетоксиборогидрид натрия (4,17 ммоль). Реакционную смесь перемешивают всю ночь при температуре окружающей среды и затем нейтрализуют при помощи добавления 10% раствора NaHCO3. После экстрагирования с дихлорметаном органические фазы собирают, промывают (насыщенным раствором NaCl), сушат (MgSO4) и затем упаривают. Сырой продукт очищают хроматографией на кварце (дихлорметан/метанол 98/2) и продукт преобразуют в соль в этаноле при помощи добавления 4N раствора HCl в диоксане, что дает указанный продукт. Температура плавления: 62C (меренговая структура). Пример 19: 5-циклобутил-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Процедура является такой же, что и в примере 18, только реакционную смесь перемешивают при температуре 70C в дихлорэтане, применяя циклобутанон вместо циклопропанкарбальдегида. Сырой продукт очищают хроматографией на кварце, элюируя со смесью этилацетата/циклогексана 2/8, что дает после упаривания указанный продукт. Температура плавления: 55C (меренговая структура). Элементный микроанализ: Пример 20: 5-метил-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Процедура является такой же, как и в примере 18, где вместо циклопропанкарбальдегида применяют водный формальдегид 37%. Сырой продукт очищают хроматографией на кварце, элюируя со смесью дихлорметана/метанола 98/2, что дает указанный продукт. Температура плавления: 128-131C. Элементный микроанализ: Пример 21: 5-этил-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Процедура является такой же, как и в примере 18, где вместо циклопропанкарбальдегида применяют ацетальдегид. Сырой продукт очищают хроматографией на кварце, элюируя со смесью дихлорметана/метанола 98/2, что дает указанный продукт. Температура плавления: 138C. Элементный микроанализ: Пример 22: 5-циклопропил-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Процедура является такой же, как и в примере 18, только реакционную смесь перемешивают при температуре 70C в дихлорэтане, применяя [(1-этоксициклопропил)окси]триметилсилан вместо циклопропанкарбальдегида. Сырой продукт очищают хроматографией на кварце, элюируя со смесью циклогексана/этилацетата 70/30, что дает указанный продукт. Температура плавления: 119C. Элементный микроанализ: Пример 23: 2,5-диметил-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Гидрид натрия 60% в минеральном масле (3,05 ммоль) добавляют к суспензии продукта примера 1(1,016 ммоль) в 3 мл диметилформамида. После перемешивания на протяжении 10 мин добавляют капля по капле 2 М раствора йодида метила в метил-трет-бутиловом эфире (3,05 ммоль). Реакционную смесь перемешивают всю ночь при температуре окружающей среды и затем разбавляют водой, экстрагируют этилацетатом, промывают (насыщенным раствором NaCl), сушат (MgSO4), фильтруют и затем упаривают до сухого состояния. Остаток хроматографируют на кварце, элюируя со смесью дихлорметана/ацетона, что дает указанный продукт. Температура плавления: 130-131C. Элементный микроанализ: Пример 24: 2-(2-фторэтил)-8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид. Суспензию продукта примера 1 (2,06 ммоль) в 100 мл ацетонитрила перемешивают на протяжении 24 ч в присутствии карбоната цезия (4,12 ммоль) и 1-бром-2-фторэтана (4,12 ммоль). Реакционную смесь затем фильтруют и фильтрат упаривают до сухого состояния. Сырой продукт хроматографируют на кварце, элюируя со смесью дихлорметана/метанола 98/2. Продукт преобразуют в соль в этаноле, при помощи добавления 4N раствора HCl в диоксане, что дает указанный продукт в виде гидрохлорида. Температура плавления: 95-98C. Фармакологическое исследование Пример А. Исследование действия соединений на деполяризацию мембраны, вызываемую АМРА в первичных культурах нейронов крысы. Тест содержит измерение in vitro с применением средств флюоресценции, деполяризации мембраны в культивируемых эмбриональных нейронах крыс, вызываемой совместным действием АМРА и тестируемым соединением, по сравнению с действием одного только АМРА. Клетки головного мозга помещали в культуру и сохраняли в инкубаторе для культур клеток на протяжении 18 дней. После инкубации культуральную среду забирали и заменяли средой для заключения флуоресцентных препаратов для измерения мембранного потенциала (20 мкл; набор для измерения мембранного потенциала от компанииMolecular Devices) и оставляли при температуре окружающей среды на протяжении 1 ч. Снимали показания основной флюоресценцию лунок (аппарат FDSS от компании Hamamatsu), клетки затем инъециро- 10020259 вали АМРА (20 мкл; диапазон концентрации: от 3 до 100 мкМ) и действие АМРА измеряли кинетически. Тестируемое соединение затем вводили в лунки (20 мкл; в диапазоне концентрации, как указано для АМРА) и действие соединения измеряли кинетически. В конце каждого из двух периодов кинетического измерения результат для каждой лунки представляет собой усредненные данные за последние 15 с периода. Вычерчивали кривые действия АМРА при различных концентрациях соединения. Для каждой концентрации соединения результат представляет собой область под кривой АМРА при указанной концентрации и вычисляли EC2X (концентрация соединения, которая удваивает мембранный потенциал, вызываемый АМРА). Соединения изобретения значительно усиливают возбуждающее действие АМРА. Как пример, соединение примера 1 обладает EC2X, которое составляет 25 мкМ. Пример В. Распознавание объекта беспородной белой мышью. Тест распознавания объекта (Behav. Brain Res., 1988, 31, 47-59) основан на спонтанной исследовательской активности животного и имеет свойства эпизодической памяти у людей. Этот тест на запоминание является чувствительным к старению (Eur. J. Pharmacol., 1997, 325, 173-180) и к холинергическим дисфункциям (Pharm. Biochem. Behav., 1996, 53 (2), 277-283) и основан на различиях в исследовании 2 объектов достаточно подобной формы - один знакомый, другой новый. Методика испытаний, которая была адаптирована к беспородной белой мыши, содержала 3 фазы, которые происходили в том же замкнутом пространстве, где проводилось испытание. Во время первой фазы, которая длилась 40 мин, мыши привыкали к окружающей среде. Во время второй фазы, которая проводилась на следующий день, объект помещали в замкнутое пространство, и мышь могла свободно его исследовать. Как только продолжительность указанного исследования достигала 20 с, мышь доставали из замкнутого пространства. В ходе третьей фазы (5 мин), 24 ч спустя, были предоставлены как тот же самый объект (который приобретал статус "знакомого" объекта), так и новый объект. Продолжительность исследования, выраженную в секундах, рассчитывали для каждого из двух объектов. Контрольные животные, которым перед этим давали только носитель посредством перорального введения за 60 мин до каждой из указанных 3 фаз, исследовали "знакомый" объект и "новый" объект на протяжении одинакового периода, что указывает о том,что об объекте, представленном ранее, забыли. Животные, получавшие соединения, которые облегчают память и познавательные способности, предпочтительно исследуют новый объект, что указывает на то,что память об объекте, представленном ранее, была сохранена. Когда проводили исследования в соответствии с протоколом примера В, соединения формулы (I) в соответствии с изобретением показали себя эффективными для улучшения запоминания. Например, результаты, которые были получены с соединением примера 1 в соответствии с настоящим изобретением,показывают примеры значительно большего времени исследования нового объекта, по сравнению со знакомым объектом, при приеме соединения внутрь в дозах, которые составляют 1 и 3 мг/кг. Пример С. Действие соединений на ток, вызываемый NMDA в ооцитах Xenopus laevis, введенных с поли(А+) иРНК из коры головного мозга крысы. Электрофизиологические записи проводят на ооцитах Xenopus laevis, введенных с поли(А+) иРНК из коры головного мозга крысы и экспрессирующих, среди прочего, глутаматергические рецепторыNMDA-типа из коры головного мозга крысы, в плексигласовой регистрирующей камере, через которую непрерывно перфузирует раствор OR2, не содержащий магний (который блокирует открытие канала рецептора NMDA) и при температуре окружающей среды. Внутренний поток, вызываемый применениемNMDA, зарегистрирован при потенциале покоя, который составляет -60 мВ, посредством применения стандартного двухэлектродного режима фиксации потенциала. NMDA (310-4 M) применяют с перфузионным раствором в присутствии 310-5 М глицина на протяжении 30 с каждые 5 мин, при постоянной скорости перфузии, которая составляет 3 мл/мин. Амплитуду тока, вызванного NMDA, измеряли на пике тока. Тестируемые соединения применяют при повышенных дозах к тому же ооциту в перфузионном растворе 45 с до 30 с во время и 30 с после применения 310-4 М NMDA в присутствии 310-5 М глицина каждые 5 мин. Амплитуду тока, вызванного NMDA в присутствии соединения, нормализуют и выражают как процент тока, вызванного в том же ооците, в отсутствие продукта, что соответствует 100% ответа. ИК 50, которая соответствует концентрации продукта, который ингибирует ток, вызываемый NMDA, на 50%, определяют посредством нелинейной регрессии, при помощи применения переменно-наклонной сигмоидальной модели концентрация-ответ. Соединения изобретения существенным образом ингибируют действие NMDA. Как пример, соединения примера 1 имеют ИК 50, которое составляет 9 мкМ. где R1 и R2, которые могут быть одинаковыми или разными, каждый, представляют собой атом водорода; атом галогена; прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена; прямую или разветвленную (C1C6)алкоксильную группу; прямую или разветвленную (C1-C6)алкилтиогруппу; прямую или разветвленную (C1-C6)алкоксикарбонильную группу; карбоксильную группу; прямую или разветвленную (C1C6)ацильную группу; гидроксильную группу; прямую или разветвленную (C1-C6)гидроксиалкильную группу; цианогруппу; нитрогруппу; аминогруппу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; аминогруппу, которая является замещенной прямой или разветвленной (C1-C6)ацильной группой; аминокарбонильную группу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1C6)алкильными группами; аминосульфонильную группу, которая является незамещенной или замещенной одной или более прямыми или разветвленными (C1-C6)алкильными группами; (C1C6)алкилсульфониламино(C1-C6)алкильную группу, в которой алкильные фрагменты являются прямыми или разветвленными; N-гидроксикарбоксимидамидную группу или бензилоксигруппу;R3 представляет собой атом водорода или прямую или разветвленную (C1-C6)алкильную группу,(C3-C8)циклоалкильную группу или (C3-С 8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным;R4 представляет собой атом водорода или прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена,их оптические и позиционные изомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что группа R1 представляет собой атом водорода или гидроксильную группу, гидроксиметильную группу, этоксикарбонильную группу, аминогруппу или N-метиламинокарбонильную группу. 3. Соединения формулы (I) в соответствии с п.1 или 2, отличающиеся тем, что группа R1 находится в положении мета или пара. 4. Соединения формулы (I) в соответствии с любым из пп.1-3, отличающиеся тем, что группы R2 иR4 представляют собой атомы водорода. 5. Соединения формулы (I) в соответствии с любым из пп.1-4, отличающиеся тем, что группа R3 представляет собой атом водорода или метильную группу. 6. Соединения формулы (I) в соответствии с п.1, которые представляют собой 8-фенокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин 1,1-диоксид; этил 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]бензоат; 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]-N-метилбензамид; 3-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенилметанол; 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол; 4-[(5-метил-1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]фенол; 4-[(1,1-диоксидо-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси]анилин,а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исход- 12020259 ное соединение формулы (II) где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III) где R5 является, как определено выше,которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV) где R5 является, как определено выше,которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V) где R5 является, как определено выше,которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI) которое вступает в реакцию с бороновой кислотой формулы (VII) где R1 и R2 являются, как определено для формулы (I),с получением соединения формулы (I/а) где R1 и R2 являются, как определено выше,при этом получение соединения формулы (I/а) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто двойному алкилированию по атомам азота в положениях 2 и 5, при помощи действия сильного основания в присутствии алкилирующего агента R'-X, где R' представляет собой прямую или разветвленную (C1C6)алкильную группу и X представляет собой атом галогена, с получением соединения формулы (I/b) где R1, R2 и R' являются, как определено выше,где соединения формул (I/a) и (I/b) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием, с последующим разделением на их оптические и позиционные изомеры. 8. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исходное соединение формулы (II) где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III) где R5 является, как определено выше,которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV) где R5 является, как определено выше,которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V) где R5 является, как определено выше,которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI) которое вступает в реакцию с бороновой кислотой формулы (VII) где R1 и R2 являются, как определено для формулы (I),с получением соединения формулы (I/а) где R1 и R2 являются, как определено выше,при этом получение соединения формулы (I/a) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агентаR'4-X, где R'4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, и X представляет собой атом галогена, с получением соединения формулы (I/с) где R1, R2 и R'4 являются, как определено выше,которое может быть подвергнуто алкилированию на атоме азота в положении 5, при помощи действия основания в присутствии алкилирующего агента R'3-X, где R'3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3-C8)циклоалкильную группу или (C3-C8)циклоалкил(C1C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным, X представляет собой атом галогена, до получения соединения формулы (I/d) где R1, R2, R'3 и R'4 являются, как определено выше,где соединения формул (I/a), (I/с) и (I/d) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием с последующим разделением на их оптические и позиционные изомеры. 9. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что исходное соединение формулы (II) где R5 представляет собой прямую или разветвленную (C1-C6)алкоксильную группу,вступает в реакцию с тионилхлоридом в присутствии диметилформамида с получением соединения формулы (III) где R5 является, как определено выше,которое затем взаимодействует с 2-хлорэтиламином в основной среде с получением соединения формулы (IV) где R5 является, как определено выше,которое после снятия защитной группы в кислой среде затем циклизуют с получением соединения формулы (V) где R5 является, как определено выше,которое затем взаимодействует с трехбромистым бором с получением соединения формулы (VI) которое вступает в реакцию с бороновой кислотой формулы (VII) где R1 и R2 являются, как определено для формулы (I),с получением соединения формулы (I/а) где R1 и R2 являются, как определено выше,при этом получение соединения формулы (I/а) состоит из одностадийного взаимодействия соединения формулы (VI) с соединением формулы (VII) и последующего модифицирования заместителей соединения бороновой кислоты, где соединение формулы (I/a) может затем быть подвергнуто алкилированию на атоме азота в положении 5, посредством реакции восстановительного аминирования, применяя восстановитель, выбранный из триацетоксиборогидрида натрия или цианоборогидрида в присутствии либо [(1-этоксициклопропил)окси]триметилсилана,либо соединения формулы (VIII) где R"3 представляет собой атом водорода или прямую или разветвленную (C1-C5)алкильную группу, (C3-C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C5)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным,либо в качестве альтернативы соединение формулы (IX) 0n4,до получения соединения формулы (I/е) где R"'3 представляет собой прямую или разветвленную (C1-C6)алкильную группу, (C3C8)циклоалкильную группу или (C3-C8)циклоалкил(C1-C6)алкильную группу, в которой алкильный фрагмент является прямым или разветвленным;R1 и R2 являются, как определено выше,которое может быть подвергнуто алкилированию на атоме азота в положении 2, при помощи действия основания в присутствии алкилирующего агента R"4-X, где R"4 представляет собой прямую или разветвленную (C1-C6)алкильную группу, которая является незамещенной или замещенной одним или более атомами галогена, X представляет собой атом галогена, до получения соединения формулы (I/f) где R1, R2, R"'3 и R"4 являются, как определено выше,где соединения формул (I/a), (I/е) и (I/f) могут затем быть очищены и/или превращены в их соли присоединения с фармацевтически приемлемой кислотой или основанием, с последующим разделением на их оптические и позиционные изомеры. 10. Соединение формулы (VI) отличающееся тем, что оно применяется в качестве интермедиата в синтезе соединений формулы(I). 11. Фармацевтическая композиция, содержащая в качестве действующего вещества соединение в соответствии с любым из пп.1-6, в комбинации с одним или более фармацевтически приемлемыми, нетоксичными, инертными носителями. 12. Фармацевтическая композиция в соответствии с п.11 для изготовления лекарственных средств в качестве модуляторов АМРА(-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота)рецепторов и антагонистов NMDA(N-метил-D-аспарат)-рецепторов. 13. Фармацевтическая композиция в соответствии с п.11 для изготовления лекарственных средств для лечения или профилактики прогрессирующих и острых нейродегенеративных заболеваний. 14. Фармацевтическая композиция в соответствии с п.13, где нейродегенеративные заболевания выбраны из группы, включающей болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, хорею Хантингтона, корсаковский психоз, шизофрению, деменцию лобной доли, подкорковую деменцию, сосудистую деменцию, эпилепсию, острые церебральные сосудистые расстройства, депрессивные и тревожные состояния.
МПК / Метки
МПК: A61P 25/00, C07D 285/36, A61K 31/554
Метки: фармацевтические, способ, содержащие, получения, композиции, бензотиадиазепина, соединения
Код ссылки
<a href="https://eas.patents.su/19-20259-soedineniya-benzotiadiazepina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения бензотиадиазепина, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Титановая плоская заготовка для горячей прокатки, способ ее получения и способ ее прокатки
Следующий патент: Механическая передача с гибким толкателем
Случайный патент: Лекарственные средства, содержащие производные полигидроксиалкилпиразина, новые производные полигидроксиалкилпиразина и их получение