Способ стереоселективного получения (-)-галофената и его интермедиатов
Номер патента: 15673
Опубликовано: 31.10.2011
Авторы: Чжу Ян, Ченг Пенг, Чжао Зючюн, Чен Ксин, Ма Цзингуан
Формула / Реферат
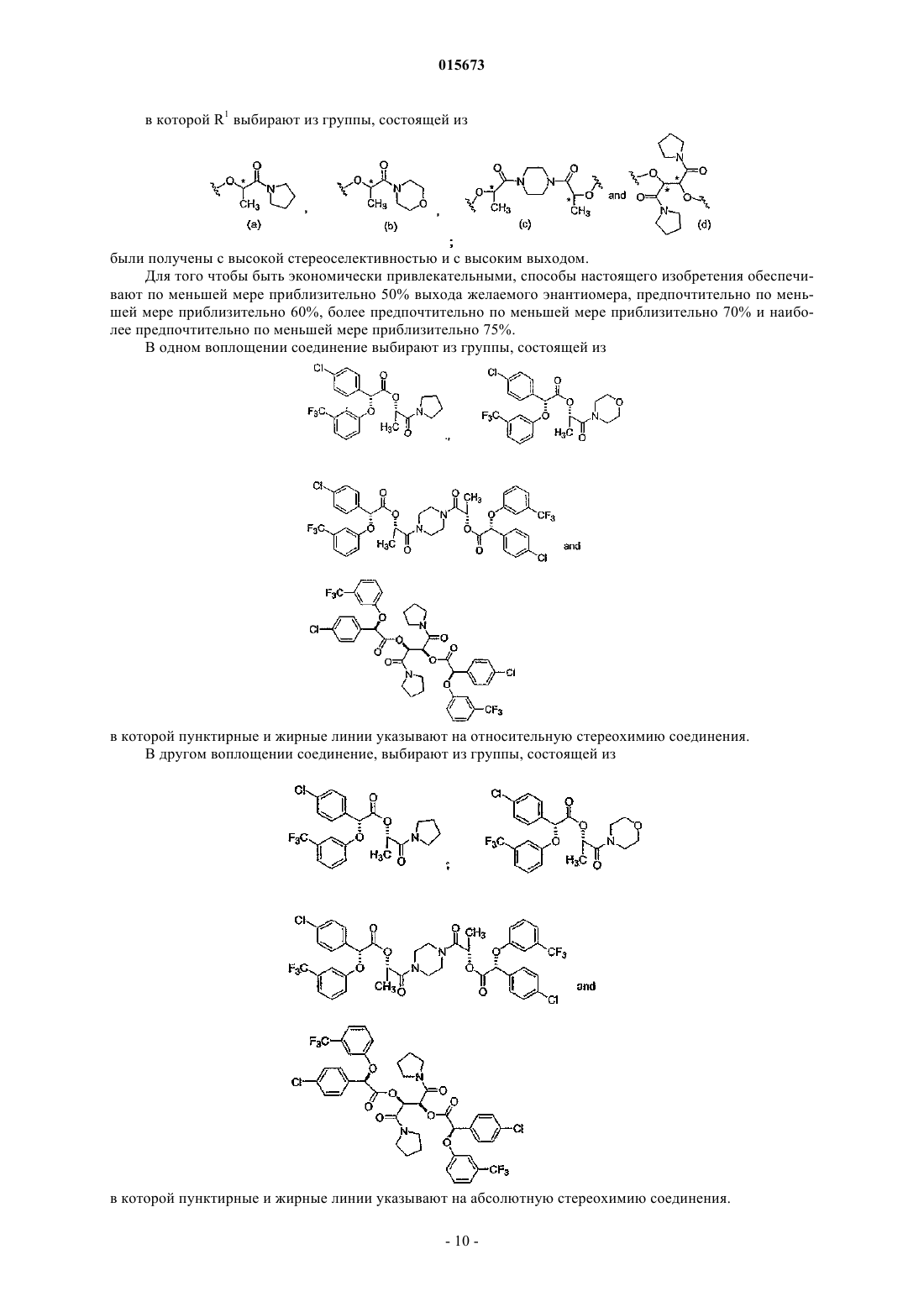
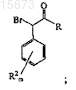
1. Способ получения соединения, имеющего формулу (I)
в которой R1 выбирают из группы, состоящей из

каждый R2независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы;
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
нижний индекс m представляет собой целое число от 0 до 3;
значком * указан атом углерода, обогащенный одной стереоизомерной конфигурацией;
волнистая линия указывает место присоединения R1;
включающий:
(a) взаимодействие соединения формулы (II)
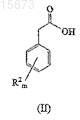
с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;
(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;
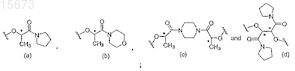
(c) этерифицирование продукта, полученного на стадии (b), хиральным спиртом, который выбирают из группы, состоящей из
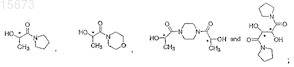
в смешивающемся растворителе для стереоселективного получения соединения, имеющего формулу (I).
2. Способ по п.1, в котором R1 представляет собой
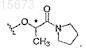
3. Способ по любому из предшествующих пунктов, в котором соединение формулы (II) представляет собой 4-хлорфенилуксусную кислоту.
4. Способ по любому из предшествующих пунктов, в котором вещество, активирующее карбонил, представляет собой тионилгалоид.
5. Способ по любому из предшествующих пунктов, в котором агент, активирующий карбонил, представляет собой тионилхлорид.
6. Способ по любому из предшествующих пунктов, в котором бром присутствует в концентрации, по меньшей мере приблизительно равной 1 мол.экв. количества соединения формулы (II).
7. Способ по любому из предшествующих пунктов, в котором растворитель представляет собой галогенированный алифатический растворитель.
8. Способ по любому из предшествующих пунктов, в котором растворитель представляет собой 1,2-дихлорэтан.
9. Способ по любому из предшествующих пунктов, в котором указанные условия включают проведение бромирования при температуре по меньшей мере приблизительно 70°C.
10. Способ по любому из предшествующих пунктов, дополнительно включающий удаление избытка брома при пониженном давлении перед указанной стадией (c).
11. Способ по любому из предшествующих пунктов, в котором способ проводят в одном реакционном сосуде.
12. Способ по любому из предшествующих пунктов, в котором выделяют только соединение формулы (I).
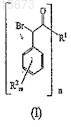
13. Соединение формулы (IV)
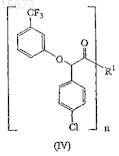
в котором R1 выбирают из группы, состоящей из
![]()
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
значком * указан атом углерода, обогащенный одной из стереоизомерных конфигураций;
волнистая линия указывает место присоединения R1.
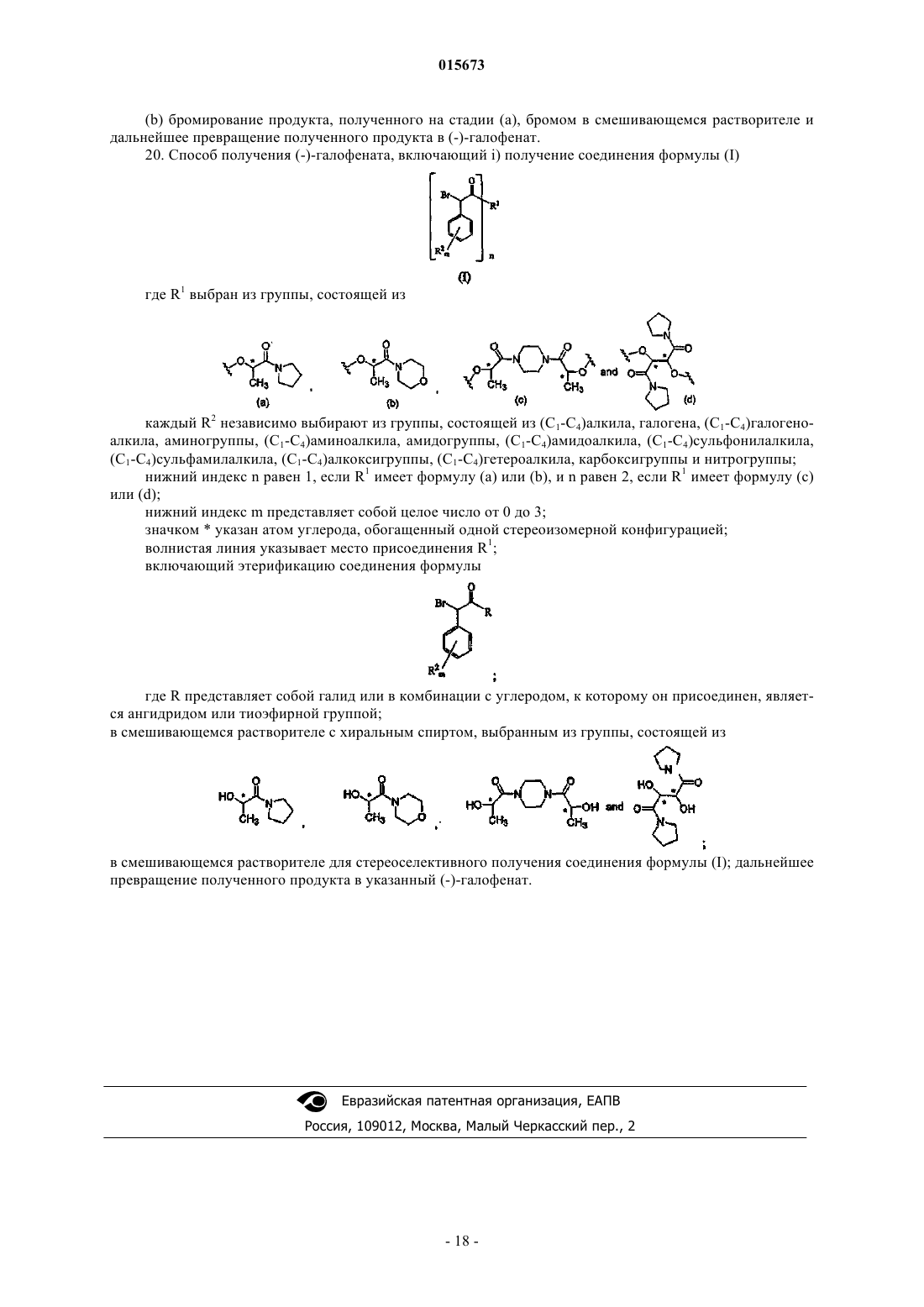
14. Соединение, которое выбирают из группы соединений, имеющих формулу
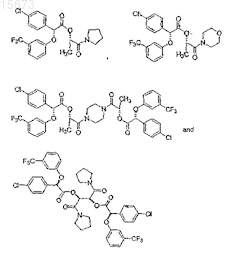
в которых пунктирные и жирные линии указывают на относительную стереохимию соединения.
15. Соединение, которое выбирают из группы соединений, имеющих формулу
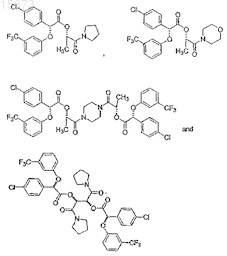
в которой пунктирные и жирные линии указывают на абсолютную стереохимию соединения.
16. Композиция, включающая соединение по п.14 или 15 в энантиомерном избытке, равном по меньшей мере приблизительно 95%.
17. Способ получения соединения, имеющего формулу (I)
в которой R1 выбирают из группы, состоящей из
каждый R2независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы;
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
нижний индекс m представляет собой целое число от 0 до 3;
значком * указан атом углерода, обогащенный одной стереоизомерной конфигурацией;
волнистая линия указывает место присоединения R1;
включающий этерификацию соединения формулы
где R представляет собой галид или в комбинации с углеродом, к которому он присоединен, является ангидридом или тиоэфирной группой; в смешивающемся растворителе с хиральным спиртом, выбранным из группы, состоящей из
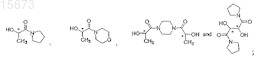
в смешивающемся растворителе для стереоселективного получения соединения, имеющего формулу (I).
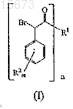
18. Способ получения (-)-галофената, включающий i) получение соединения формулы (I)
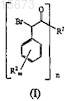
где R1выбран из группы, состоящей из
![]()
каждый R2независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы;
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
нижний индекс m представляет собой целое число от 0 до 3;
значком * указан атом углерода, обогащенный одной стереоизомерной конфигурацией;
волнистая линия указывает место присоединения R1;
включающий:
(a) взаимодействие соединения формулы (II)
с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;
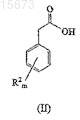
(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;
(c) этерифицирование продукта, полученного на стадии (b), хиральным спиртом, который выбирают из группы, состоящей из
![]()
в смешивающемся растворителе для стереоселективного получения соединения формулы (I); дальнейшее превращение полученного продукта в указанный (-)-галофенат.
19. Способ получения (-)-галофената, включающий i) получение соединения формулы (I)

где R1выбран из группы, состоящей из
![]()
каждый R2независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы;
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
нижний индекс m представляет собой целое число от 0 до 3;
значком * указан атом углерода, обогащенный одной стереоизомерной конфигурацией;
волнистая линия указывает место присоединения R1;
включающий:
(a) взаимодействие соединения формулы (II)
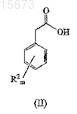
с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;
(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе и дальнейшее превращение полученного продукта в (-)-галофенат.
20. Способ получения (-)-галофената, включающий i) получение соединения формулы (I)

где R1выбран из группы, состоящей из
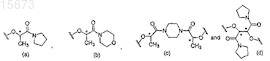
каждый R2независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы;
нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1имеет формулу (c) или (d);
нижний индекс m представляет собой целое число от 0 до 3;
значком * указан атом углерода, обогащенный одной стереоизомерной конфигурацией;
волнистая линия указывает место присоединения R1;
включающий этерификацию соединения формулы
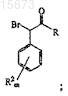
где R представляет собой галид или в комбинации с углеродом, к которому он присоединен, является ангидридом или тиоэфирной группой;
в смешивающемся растворителе с хиральным спиртом, выбранным из группы, состоящей из
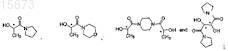
в смешивающемся растворителе для стереоселективного получения соединения формулы (I); дальнейшее превращение полученного продукта в указанный (-)-галофенат.
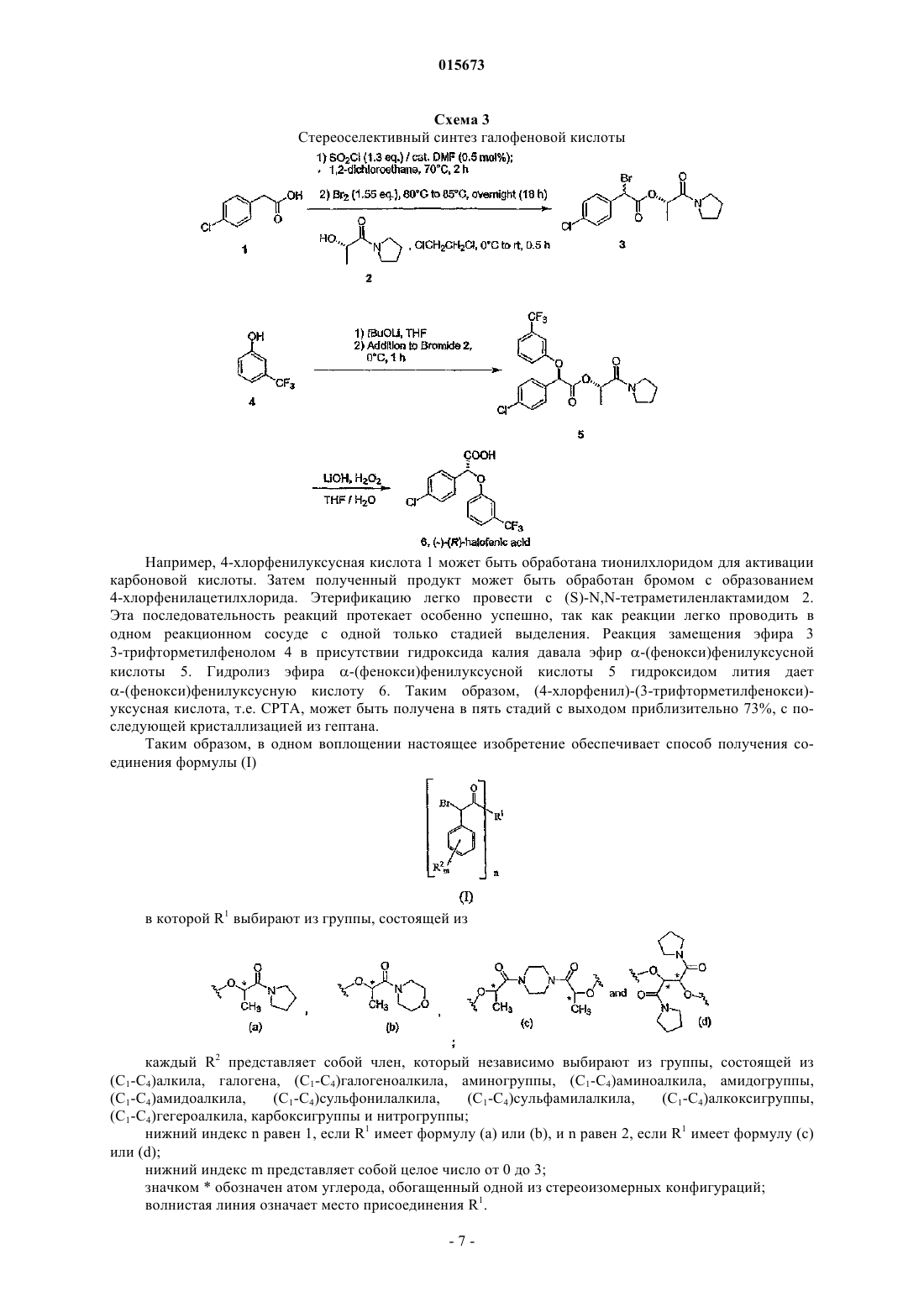
Текст
Дата публикации и выдачи патента Номер заявки СПОСОБ СТЕРЕОСЕЛЕКТИВНОГО ПОЛУЧЕНИЯ (-)-ГАЛОФЕНАТА И ЕГО ИНТЕРМЕДИАТОВ Настоящее изобретение обеспечивает соединения, имеющие формулу (IV), и способы получения соединения -(фенокси)фенилускусной кислоты, имеющего формулу (I), в которой R1 представляет собой член, который выбирали из группы, состоящей из (a), (b), (c), (d), каждый R2 представляет собой член, который независимо выбирали из группы, состоящей из (C1-C4)алкила, галогена,(C1-C4)галогеналкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила,(C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила,карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), иn равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; и волнистая линия указывает место присоединения R1. 015673 Перекрестные ссылки на имеющие отношение заявки Заявка на данное изобретение претендует на все преимущества заявки на патент США серийный номер 60/720300, зарегистрированной 23 сентября 2005 г., и на все преимущества заявки на патент США,серийный номер еще не присвоен, зарегистрированной 20 сентября 2006 г. и озаглавленной "Способ стереоселективного получения (-)-галофената и его производных (номер по реестру у поверенного 016325020510US), раскрытие которых включено в настоящий документ путем отсылки. Область техники, к которой относится изобретение Настоящее изобретение имеет отношение к стереоселективному способу получения (-)-галофената(4-хлор(3-трифторметилфенокси)фенилуксусной кислоты) и его интермедиатов. Уровень техники Эфирные и амидные производные (-)-4-хлор(3-трифторметилфенокси)фенилуксусной кислоты(галофеновой кислоты) представляют собой хиральные соединения и полезны для улучшения различных физиологических условий, включая условия, связанные с депонированием липидов крови, с диабетом типа II и гиперлипидемией (см., например, заявку на патент США 10/656567 и патент США 6262118,которые включены в настоящий документ путем отсылки во всей своей полноте). Галофеновая кислота содержит единственный хиральный центр на асимметрично замещенном атоме углерода, находящемся в-положении по отношению к карбонильному атому углерода, и, следовательно, существует в двух энантиомерных формах. Было обнаружено, что способность (-)-энантиомера галофеновой кислоты ингибировать цитохром Р 450 2C9 примерно в 20 раз меньше по сравнению с (+)-энантиомером. Id. Введение рацемической галофеновой кислоты или ее производных может привести к множеству проблем, связанных с взаимодействием лекарственного средства с другими лекарственными средствами, включая антикоагулянты, противоспалительные соединения и другие лекарственные средства, которые метаболизируются с помощью этого фермента. Id. Для того чтобы снизить возможность взаимодействий между лекарственными средствами, желательно вводить (-)-энантиомер галофеновой кислоты или ее производные, которые в значительной степени свободны от (+)-энантиомера. Таким образом,-(фенокси)фенилуксусные кислоты или их производные, обогащенные энантиомерными формами,представляют собой ценные химические интермедиаты для получения фармацевтических соединений. Как будет показано ниже, в литературе сообщалось о различных путях синтеза для получения производных -(фенокси)фенилуксусной кислоты. К сожалению, с помощью известных способов синтеза эти молекулы часто бывает трудно получить с высокой энантиомерной чистотой и с высокими выходами. Схема 1 Синтез -(фенокси)фенилуксусных кислот Как показано на схеме 1, Devine et al. смогли получить -(фенокси)фенилуксусные кислоты стереоселективно, применяя в качестве хирального вспомогательного вещества полученный из пирролидина лактамид (см. патенты США 5708186 и 5856519, идеи которых включены в этот документ путем отсылки). Однако этот способ также обладает некоторыми недостатками, включая a) многочисленные стадии выделения и b) низкие выходы при выделении. Следовательно, существует необходимость в более эффективном способе стереоселективного получения -(фенокси)фенилуксусной кислоты, а также ее про-1 015673 изводных, например (-)-галофената. Совершенно удивительно, что настоящее изобретение удовлетворяет этой и другим потребностям. Сущность изобретения Настоящее изобретение обеспечивает способы, которые могут быть применены для надежного превращения замещенных фенилуксусных кислот в соответствующие производные-(замещенной)фенилуксусной кислоты с высокими выходами и с высокой энантиомерной чистотой. По существу, в одном воплощении настоящее изобретение обеспечивает способ получения соединения формулы (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена,(C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила,(C1-C4)сульфонилалкила, (C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значокозначает атом углерода, обогащенный одной из стереоизомерных конфигураций; волнистая линия означает место присоединения R1; этот способ включает:(a) взаимодействие соединения формулы (II) с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалогенида, ангидрида и реагента, генерирующего тиоэфир, в совместимом растворителе;(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;(c) этерифицирование продукта, полученного на стадии (b) с хиральным спиртом, который выбирают из группы, состоящей из-2 015673 В другом воплощении настоящее изобретение обеспечивает соединения -(замещенной)фенилуксусной кислоты формулы (IV) нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); значкомобозначен атом углерода, обогащенный одной из стереоизомерных конфигураций; волнистая линия означает место присоединения R1. Отличительные черты, цели и преимущества изобретения и его предпочтительные воплощения станут ясными из последующего подробного описания изобретения. Осуществление изобретенияI. Определения. Термин "алкил" означает неразветвленные или разветвленные группы алифатических углеводородных цепей длиной от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода и более предпочтительно от 1 до 4 атомов углерода. Типичные алкильные группы включают, но не ограничиваются,метил, этил, н-пропил, 2-пропил, трет-бутил, пентил и им подобные. Термин "арил" означает моновалентную моноциклическую или бициклическую ароматическую углеводородную часть молекулы, имеющую от 6 до 10 атомов углерода в кольце. Если не оговорено или не указано иначе, арильная группа может быть замещена одним или более заместителями, предпочтительно одним, двумя или тремя заместителями и более предпочтительно одним или двумя заместителями, которые выбирают из алкила, галогеналкила, нитрогруппы и галогена. Более точно, термин "арил" включает,но не ограничивается, фенил, 1-нафтил и 2-нафтил и им подобными, каждый из которых был необязательно замещен одним или более заместителем (заместителями), рассмотренным выше. Термин "хиральный" или "хиральный центр" означает атом углерода, имеющий четыре разных заместителя. Однако основной критерий хиральности - это невозможность наложить друг на друга зеркальные отображения. Термины"СРТА" и "галофеновая кислота" применяются в этом документе взаимозаменяемо, означают (4-хлорфенил)(3-трифторметилфенокси)уксусную кислоту. Термин "смесь энантиомеров" означает хиральное соединение, представляющее собой смесь энантиомеров, включая рацемическую смесь. Предпочтительно смесь энантиомеров означает хиральное соединение, имеющее в значительной степени равные количества каждого из энантиомеров. Более предпочтительно смесь энантиомеров означает рацемическую смесь, в которой каждый энантиомер присутствует в равном количестве. Термин "обогащенный энантиомером" означает композицию, в которой один из энантиомеров присутствует в более высоком количестве, по сравнению с тем количеством, в котором он присутствовал до того, как композиция была подвергнута разделению. Термин "избыток энантиомера" или "%ее" означает степень различия между первым энантиомером и вторым энантиомером. Избыток энантиомера определяется по уравнению: %ее = (% первого энантиомера) - (% второго энантиомера). Таким образом, если композиция включала 98% первого энантиомера и 2% второго энантиомера, избыток энантиомера по первому энантиомеру равен 96% (98-2%). Термины "галогенид" и "галоген" применяют в этом документе взаимозаменяемо, означают галоген, который включает F, Cl, Br и I, а также псевдогалогениды, такие как -CN и -SCN. Термин "галогеналкил" означает алкильную группу, такую как была определена в этом документе,у которой один или более атомов водорода заменены галогенами, включая пергалогеналкилы, такие как трифторметил.-3 015673 Термин "гетероалкил" означает разветвленную или неразветвленную нециклическую насыщенную алкильную часть молекулы, содержащую один гетероатом или более, или один содержащий гетероатомы заместитель или более, в которой гетероатомы представляют собой O, N или S. Типичные содержащие гетероатомы заместители включают =O, -ORa, -C(=O)Ra, -NRaRb, -N(Ra)C(=O)Rb, -C(=O)NRaRb и -S(O)nRa(где n представляет собой целое число от 0 до 2). Каждый из Ra и Rb независимо представляет собой водород, алкил, галогеноалкил, арил или аралкил. Типичные примеры гетероалкилов включают, например,N-ацетил-2-аминоэтил (т.е. -CH2CH2NHC(=O)CH3). Термин "металл" включает металлы I, II группы и переходные металлы, а также металлы основной группы, такие как B и Si. Термин "оптическая чистота" означает количество определенного энантиомера, присутствующего в композиции. Например, если композиция включает 98% первого энантиомера и 2% второго энантиомера,оптическая чистота первого энантиомера равна 98%. Если не указано иначе, термин "фенил" означает необязательно замещенную фенильную группу. Подходящие фенильные заместители были такими же, как те, что были описаны в определении термина"арил". Подобным образом, термин "фенокси" означает часть молекулы, имеющую формулу -OAra, в которой Ara представляет собой фенил, как было определено в этом документе. Таким образом, термин"-(фенокси)фенилуксусная кислота" означает уксусную кислоту, у которой во 2-м положении находится заместитель, необязательно замещенный фенил и необязательно замещенные феноксигруппы. Термин "защитная группа" означает часть молекулы, которая будучи прикрепленной к реакционоспособной группе в молекуле, маскирует, снижает или предотвращает этот тип реакционной способности. Примеры защитных групп можно найти в работах T.W. Greene and P.G.M. Wuts, Protective Groupsin Organic Synthesis, 3rd edition, John WileySons, New York, 1999 and Harrison and Harrison et al.,Compendium of Synthetic Organic Methods, Vols. 1-8 (John Wiley and Sons, 1971-1996), эти публикации включены в этот документ путем отсылок во всей своей полноте. Типичные защитные группы гидроксилов включают группы ацилов, бензиловый и трифениловые эфиры, тетрагидропираниловые эфиры, триалкилсилиловые эфиры и аллиловые эфиры. Типичные защитные группы аминов включают формил, ацетил, трифторацетил, бензил, бензилоксикарбонил (CBZ), трет-бутоксикарбонил (Boc), триметилсилил(TMS), 2-триметилсилилэтансульфонил (SES), тритил и замещенные тритиловые группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил (FMOC), нитровератрилоксикарбонил (NVOC) и им подобные. Термин "скорость" в том случае, когда он имеет отношение к образованию продукта реакции, означает кинетические и/или термодинамические скорости. Так как было применено в этом документе, термины "обработка", "взаимодействие" или "реагирование" означают добавление или смешивание двух или более реагентов в подходящих условиях для получения указанного и/или желаемого продукта. Следует учесть, что реакция, в которой получают указанный и/или желаемый продукт, необязательно может непосредственно происходить в результате соединения двух реагентов, которые добавляют исходно, т.е. в смеси может существовать образовавшийся один интермедиат или более, что, в конце концов, приводит к образованию указанного и/или желаемого продукта. Как применено в этом документе, термины "определенные выше" и "определенные в этом документе", если они имеют отношение к разнообразным введенным путем отсылок терминам, означают определение в широком смысле как изменяющихся, так и предпочтительных, более предпочтительных и наиболее предпочтительных определений, если это имеет место. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. В описании оптически активного соединения, префиксы R и S применяют для обозначения абсолютной конфигурации молекулы по отношению к ее хиральному (хиральным) центру (центрам). Префиксы "d" и "l" или (+) и (-) применяют для того,чтобы показать направление вращения плоскополяризованного света этим соединением, где (-) или (l) означает, что соединение является "левовращающим", и где (+) или (d) означает, что соединение является "правовращающим". Не существует корреляции между номенклатурой для абсолютной стереометрии и для вращения энантиомера. Для данной химической структуры эти соединения, называемые "стереоизомеры", идентичны, за исключением того, что они представляют собой зеркальные отображения друг друга. Специфический стереоизомер может быть также обозначен как "энантиомер", смесь таких изомеров часто называют "энантиомерной" или "рацемической" смесью. См., например, Streitwiesser, A.Publishing Co., U.S.A. 1981). Термины "в значительной степени свободный от его (+)-стереоизомера", "в значительной степени свободный от его (+)-энантиомера", применяемые взаимозаменяемо в этом документе, означают, что композиции содержат в значительной степени высокую долю (-)-изомера по сравнению с (+)-изомером. В предпочтительном воплощении термин "в значительной степени свободный от его (+)-стереоизомера" означает, что композиция по меньшей мере на 90 мас.% состоит из (-)-изомера и на 10 мас.% или меньше из (+)-изомера. В более предпочтительном воплощении термин "в значительной степени свободный от его (+)-стереоизомера" означает, что композиция содержит по меньшей мере 99 мас.% (-)-изомера и-4 015673 1 мас.% или менее (+)-изомера. В наиболее предпочтительном воплощении термин "в значительной степени свободный от его (+)-стереоизомера" означает, что композиция содержит более чем 99 мас.%(-)-изомера. Эти проценты рассчитывают на основе общего количества изомеров в композиции.II. Введение. Хотя энантиомеры хирального соединения имеют строго одинаковые химические связи, пространственная ориентация атомов в энантиомерах различается. Таким образом, один энантиомер хирального лекарственного средства часто проявляет желаемую активность со значительно сниженным побочным эффектом (побочными эффектами), чем другой энантиомер. Поскольку разделение рацематов часто применяют в промышленных способах получения оптически активных, т.е. хиральных, соединений, в последние годы хиральный синтез достиг большого прогресса. Настоящее изобретение обеспечивает способ синтеза производного хирального эфира -галогенфенилуксусной кислоты. Хиральный эфир -галогенфенилуксусной кислоты направляет алкилирование 3-трифторметилфенола для стереоселективного получения производных -(фенокси)фенилуксусной кислоты. Таким образом, соединения, полученные с помощью способов настоящего изобретения, применимы для получения производных -(фенокси)фенилуксусной кислоты, таких как те, что были раскрыты в патентной заявке США 10/656567 и патенте США 6262118 с высоким выходом продукта. В особенности соединения и способы настоящего изобретения полезны при получении (-)-галофената.III. Стереоселективный синтез. Как было отмечено выше, предыдущие стереоселективные способы получения (-)-галофената требовали многочисленных стадий и приводили к композиции с низким выходом или с недостаточной оптической чистотой, для того чтобы считать их коммерчески рентабельными. Однако авторы настоящего изобретения обнаружили, что в определенных условиях, раскрытых в этом документе, соединение-(фенокси)фенилуксусной кислоты с достаточной оптической чистотой можно получить с высоким выходом и высокой оптической чистотой за несколько стадий выделения. Эти высокие выходы были необычными, так как бромирование подобных соединений бромом не приводило к высоким выходам (см.,Harpp et al. J. Org. Chem. 40(23): 3420 (1975). Таким образом, в одном аспекте способы настоящего изобретения были основаны на удивительном и неожиданном открытии авторов настоящего изобретения,заключавшегося в том, что замещенные фенилуксусные кислоты могут быть активированы, бромированы бромом и этерифицированы с получением промежуточного продукта хирального-галогенфенилуксусного эфира с высоким выходом. Этот промежуточный продукт можно затем использовать для стереоселективного получения производных -(фенокси)фенилуксусной кислоты. В частности, способы настоящего изобретения обеспечивают желаемый энантиомер производного -(фенокси)фенилуксусной кислоты с выходами по меньшей мере приблизительно 40%, предпочтительно по меньшей мере приблизительно 50%, более предпочтительно по меньшей мере приблизительно 60% и наиболее предпочтительно по меньшей мере приблизительно 70%. В частности, способы настоящего изобретения обеспечивают желаемое: энантиомер соединения -(фенокси)фенилуксусной кислоты с оптической чистотой по меньшей мере приблизительно 90%, предпочтительно по меньшей мере приблизительно 95%, более предпочтительно по меньшей мере приблизительно 97% и наиболее предпочтительно по меньшей мере приблизительно 98%. Один из методов стереоселективного получения производных -(фенокси)фенилуксусной кислоты,таких как xiv, показан в общих чертах на схеме 2. Схема 2 Основной путь Таким образом, фенилуксусная кислота x может быть превращена в активированное производное карбоновой кислоты и затем галогенирована молекулярным бромом с получением галоида-бромфенилацетила xi в две стадии. Фенилуксусная кислота предпочтительно представляла собой галогенфенилуксусную кислоту, более предпочтительно 4-галогенфенилуксусную кислоту и более предпоч-5 015673 тительно 4-хлорфенилуксусную кислоту. Примеры карбоксильных активирующих агентов, подходящих для применения в настоящем изобретении, включают, но не ограничивают тионилгалоиды, такие как тионилхлорид (SOCl2); ангидриды,такие как трифторуксусный ангидрид (TFAA) и реагенты, образующие тиоэфиры. Агент, активирующий карбоновую кислоту, представляет собой предпочтительно тионилгалогенид и более предпочтительно тионилхлорид. Он коммерчески доступен в виде прозрачной жидкости и может быть применен в чистом виде или в смешивающемся растворителе. Галогенангидрид затем превращают в хиральный эфир xiii, в котором R1 представляет собой хиральное спиртовое вспомогательное вещество. Может быть применено большое количество хиральных вспомогательных веществ, включая те, что будут раскрыты ниже в разделе Примеры. Предпочтительно примененное хиральное вспомогательное вещество приводит к образованию только одного диастереомера -(фенокси)фенилуксусной кислоты. Следует признать, что хиральное спиртовое вспомогательное соединение само по себе должно быть достаточной энантиомерной чистоты для того, чтобы получить высокообогащенное энантиомером производное -(фенокси)фенилуксусной кислоты. Таким образом,один энантиомер в -положении без труда может быть получен, например, путем удаления хирального вспомогательного соединения. В одном особом воплощении хиральное вспомогательное соединение представляет собой хиральное спиртовое соединение формулы Предпочтительно хиральный спирт имеет формулу Реакция замещения эфира xi соответственно замещенным фенольным соединением xii в присутствии основания, такого как гидроксид, дает эфир -(фенокси)фенилуксусной кислоты xiii. Примеры оснований, которые могут быть применены в реакции замещения, включают, но не ограничиваются, гидроксид, такой как гидроксид лития, гидроксид калия, гидроксид натрия и им подобные; алкоксид, такой как алкоксид лития, алкоксид калия, гидроксид натрия и им подобные; и т.п.; гидрид, такой как гидрид лития, гидрид калия, гидрид натрия и им подобные; и т.п. Гидролиз эфира -(фенокси)фенилуксусной кислоты xiii дает -(фенокси)фенилуксусную кислотуxiv. Примеры гидролизующих веществ, которые могут быть применены, включают, но не ограничиваются, гидроксид, такой как гидроксид лития, гидроксид калия, гидроксид натрия и им подобные; гидроперекись, такую как гидроперекись лития, гидроперекись калия, гидроперекись натрия и им подобные; и т.п. Этот путь синтеза показан более подробно на схеме 3.-6 015673 Схема 3 Стереоселективный синтез галофеновой кислоты Например, 4-хлорфенилуксусная кислота 1 может быть обработана тионилхлоридом для активации карбоновой кислоты. Затем полученный продукт может быть обработан бромом с образованием 4-хлорфенилацетилхлорида. Этерификацию легко провести с (S)-N,N-тетраметиленлактамидом 2. Эта последовательность реакций протекает особенно успешно, так как реакции легко проводить в одном реакционном сосуде с одной только стадией выделения. Реакция замещения эфира 3 3-трифторметилфенолом 4 в присутствии гидроксида калия давала эфир -(фенокси)фенилуксусной кислоты 5. Гидролиз эфира -(фенокси)фенилуксусной кислоты 5 гидроксидом лития дает-(фенокси)фенилуксусную кислоту 6. Таким образом, (4-хлорфенил)-(3-трифторметилфенокси)уксусная кислота, т.е. СРТА, может быть получена в пять стадий с выходом приблизительно 73%, с последующей кристаллизацией из гептана. Таким образом, в одном воплощении настоящее изобретение обеспечивает способ получения соединения формулы (I) каждый R2 представляет собой член, который независимо выбирают из группы, состоящей из(C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы,(C1-C4)амидоалкила,(C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила,(C1-C4)алкоксигруппы,(C1-C4)гегероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомобозначен атом углерода, обогащенный одной из стереоизомерных конфигураций; волнистая линия означает место присоединения R1.(a) активацию карбоновой кислоты соединения формулы (II) агентом, активирующим карбоксильные группы, в смешивающемся растворителе; взаимодействие соединения формулы (II) с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалогенида, ангидрида и генерирующего тиоэфир реагента; в смешивающемся растворителе;(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;(c) этерифицирование продукта, полученного на стадии (b), хиральным спиртом, который выбирают из группы, состоящей из в смешивающемся растворителе. Авторы настоящего изобретения обнаружили, что бромирующий агент, примененный при получении -(фенокси)фенилуксусной кислоты существенно влияет на легкость выделения и суммарный выход способа. Например, если применяют бром в способе получения соединения -(фенокси)фенилуксусной кислоты, получают более высокие суммарные выходы, по сравнению с применением других галогенирующих агентов. Количество примененного галогенирующего агента не особенно важно. Примененное количество обычно было больше чем 1,00 мол.экв., предпочтительно приблизительно 1,5 мол.экв. или более, более предпочтительно приблизительно 1,55 мол.экв. Реакции обычно проводят в смешивающемся растворителе. Смешивающийся растворитель представляет собой такой растворитель, который инертен в условиях проведения реакции и легко растворяет реагирующие вещества. Подходящие растворители для описанных выше реакций известны специалистам в этой области техники. Например, подходящие растворители для реакций активации карбоновой кислоты, бромирования и этерификации включают, но не ограничиваются, апротонные растворители, такие как галогенированные алканы, тетрагидрофуран, ароматические углеводороды, диалкилэфиры и их смеси. Галогенированный алкан представляет собой особенно предпочтительный растворитель, более предпочтительно 1,2-дихлорэтан. В одном воплощении процесс бромирования включает нагревание реакционной среды до температуры в диапазоне от приблизительно 70C до точки кипения раствора, предпочтительно от приблизительно 80 до приблизительно 85C. Нагревание проводят до тех пор, пока реакция не заканчивается, на это обычно требуется от приблизительно 1 до приблизительно 24 ч, предпочтительно от приблизительно 2 до приблизительно 18 ч. При более низких температурах может потребоваться продление времени реакции. Специалистам в этой области техники будет легко понять, что за протеканием этой и других реакций в способе настоящего изобретения можно следить с помощью, например, HPLC, и реакция может считаться законченной, когда количество не прореагировавших исходных реагентов станет меньше чем приблизительно 1%. Бром может быть удален перед добавлением хирального спиртового вспомогательного вещества. Это может быть выполнено путем присоединения реакционного сосуда к вакуумному насосу и удаления брома при пониженном давлении. Давление, скорость и степень удаления не особенно важны.-8 015673 Раствор может быть охлажден перед добавлением и/или после добавления хирального спиртового вспомогательного вещества. Таким образом, учитывается экзотермическая природа реакции этерификации. Скорость и степень охлаждения реакционного раствора не особенно важны. В одном воплощении реакция этерификации включает охлаждение реакционной среды до температуры в диапазоне приблизительно от 0C до комнатной температуры. Реакцию проводят до завершения, для чего обычно требовалось приблизительно от 5 до приблизительно 60 мин, обычно приблизительно 30 мин. В одном воплощении этот способ может быть выполнен в одном реакционном сосуде. В другом воплощении выделяют только конечный продукт, соединение формулы (I). В особенности способы настоящего изобретения были направлены на промежуточные продукты в синтезе -(фенокси)фенилуксусной кислоты, имеющие формулу (V) в которой R3 представляет собой галогеналкил иR2 представляет собой галоид. В одном особом воплощении способы настоящего изобретения были направлены на синтез-(фенокси)фенилуксусной кислоты формулы (I) или, предпочтительно формулы (V), в которой R2 представляет собой хлор. В другом воплощении способы настоящего изобретения были направлены на получение -(фенокси)фенилуксусной кислоты формулы (I) или предпочтительно формулы (V), в которой R3 представляет собой предпочтительно трифторметил. В еще одном воплощении настоящего изобретения способы были направлены на стереоселективный синтез соединений формулы V, в которой R2 представляет собой Cl и R3 представляет собой CF3, например галофеновую кислоту. В одном особом воплощении соединения -(замещенной)фенилуксусной кислоты формулы (IV) нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2 если R1 имеет формулу (c) или (d); значкомобозначен атом углерода, обогащенный одной из стереоизомерных конфигураций; волнистая линия означает место присоединения R1, синтезированного с помощью хирального вспомогательного соединения. Особенно предпочтительное соединение формул (I) и (IV), приведенных выше, представляет собой соединение, в котором R1 представляет собой были получены с высокой стереоселективностью и с высоким выходом. Для того чтобы быть экономически привлекательными, способы настоящего изобретения обеспечивают по меньшей мере приблизительно 50% выхода желаемого энантиомера, предпочтительно по меньшей мере приблизительно 60%, более предпочтительно по меньшей мере приблизительно 70% и наиболее предпочтительно по меньшей мере приблизительно 75%. В одном воплощении соединение выбирают из группы, состоящей из в которой пунктирные и жирные линии указывают на относительную стереохимию соединения. В другом воплощении соединение, выбирают из группы, состоящей из в которой пунктирные и жирные линии указывают на абсолютную стереохимию соединения.- 10015673 Следует заметить, что, поскольку способы настоящего изобретения обсуждаются с отсылкой на обогащение (-)-энантиомера галофеновой кислоты, способы настоящего изобретения также подходят для обогащения (+)-энантиомера. Способ настоящего изобретения, главным образом, обеспечивает соединение, обогащенное (-)-энантиомером на основе энантиомерного обогащения хирального вспомогательного соединения и стереоселективности реакции. Применение (+)-энантиомера может быть без труда усовершенствовано применением противоположного энантиомера хирального спиртового вспомогательного соединения. Например, (+)-энантиомер можно получить, применив (R)-N,N-тетраметиленлактамид. Хиральное вспомогательное соединение может быть удалено на описанной выше стадии превращения и использовано повторно/повторно запущено в цикл. Таким образом, способ настоящего изобретения легко может быть превращен в технологический процесс рециркулирующего типа.IV. Синтез хиральных спиртовых вспомогательных соединений. Один способ получения хирального спиртового вспомогательного соединения 2 показан на схеме 4. Синтез хирального вспомогательного соединения Реакция эфира молочной кислоты 7 с избытком подходящего циклического амина дает хиральное вспомогательное соединение 2. При применении избытка циклического амина на эквивалент эфира превращение было значительным, а степень рацемизации была минимальной. Например, пирролидин 8 (т.е. то место, где R6 комбинируется для образования 5-членного кольца) особенно выгоден, так как пирролидин представляет собой хороший растворитель для эфира молочной кислоты, а реакция проводится аккуратно. Таким образом, (S)-N,N-тетраметиленлактамид может быть получен за одну стадию с выходом приблизительно 95%.V. Полезность обогащенного энантиомера -(фенокси)фенилуксусной кислоты. Энантиомерно чистые соединения -(фенокси)фенилуксусной кислоты представляют собой полезные промежуточные продукты при получении разнообразных фармацевтически активных соединений,включая соединения -(фенокси)фенилуксусной кислоты, раскрытые в патентной заявке США 10/656567 и в патенте США 6262118. Таким образом, другой аспект настоящего изобретения обеспечивает способ энантиоселективного получения соединения -(фенокси)фенилацетата формулы из соединения -(фенокси)фенилуксусной кислоты, имеющего формулу (V), в которой R3 представляет собой алкил или галогеналкил, R2 представляет собой галоген и R7 представляет собой гетероалкил,предпочтительно N-ацетил-2-аминоэтил (т.е. часть молекулы, имеющей формулу -CH2CH2NHC(=O)CH3). Способ включает стереоселективный синтез соединения -(фенокси)фенилуксусной кислоты,имеющего формулу (V), как было описано выше, и реагирование обогащенного энантиомера-(фенокси)фенилуксусной кислоты с реагентом, активирующим карбоновую кислоту. Подходящие реагенты, активирующие карбоновую кислоту, включают тионилгалогениды (например, тионилхлорид),ангидриды (например, TFAA), реагенты, генерирующие тиоэфиры, и другие реагенты, активирующие карбоновую кислоту, известные специалисту в этой области техники. Активированные -(фенокси)фенилуксусной кислоты затем реагировали с соединением, имеющим формулу (R7-O)wM, например, производным N-ацетилэтаноламина, с образованием энантиомерно обогащенного соединения -(фенокси)фенилацетата, имеющего формулу (VI), в которой R7 был таким, как было определено выше, М представляет собой водород или металл, например Na, K, Li, Ca, Mg, Cs и т.д.,и индекс w представляет окисленное состояние М. Авторы настоящего изобретения обнаружили, что реакция между активированной кислотой и соединением, имеющим формулу (R7-O)wM, может быть проведена без какой-либо существенной рацемизации. Дополнительные цели, преимущества и новые черты этого изобретения станут ясны специалистам в этой области техники при рассмотрении следующих примеров, которые не следует считать ограничивающими.- 11015673 Примеры Реагенты и экспериментальное подтверждение. Если не указано иначе, реагенты и растворители приобретали в фирмах "Aldrich Chemical" или"Fisher Scientific". Процессы проводили в атмосфере азота. Для регулирования температуры воды в охлаждающей рубашке прямостенных стеклянных реакторов с нижним сливом применяли контролирующий процесс компьютер Camile, присоединенный к рециркулирующей системе нагревания и охлаждения. Если не указано иначе, растворители удаляли с помощью роторного испарителя Buchi при от 15 до 25 торр с температурой бани вплоть до 40C. Твердые образцы высушивали в вакуумной печи при 40C,от 15 до 25 торр. Для вакуумных перегонок применяли для получения вакуума величиной менее чем 1 торри вакуумный насос Cenco HYVAC. Уровни воды определяли методом Karl Fisher с помощью кулонометра Metrohm 756 KF и реагента HYDRANAL Coulomat AG. Точки плавления определяли с помощью прибора Mettler Toledo FP62, pH измеряли с помощью калиброванного pH-метра Orion Model 290A. ЯМР-спектры протона и 13C регистрировали с помощью спектрофотометра Bruker Avance 300 МГц. Хиральный HPLC-анализ проводили при X=240 нм, впрыскивая 10 мкл образца, растворенного в подвижной фазе, на колонке (R,R)WHELK-O 1,5 мкм 2504,6 мм (Regis Technologies), и элюируя со скоростью 1,0 мл/мин смесью гексаны/2-пропанол/уксусная кислота, взятые в соотношении 95/5/0,4 (об./об./об.). Ахиральный HPLC-анализ проводили при X=220 нм, впрыскивая 5 мкл образца, растворенного в подвижной фазе на колонке Phenomenex LUNA 5 мкм C18(2) 2504,6 мм при 25C. При скорости тока,равной 1,5 мл/мин, применяли градиент, исходный состав элюата: 66 об.% воды/34 об.% ацетонитрила/0,1 об.% ацетонитрила, который линейно увеличивали за 20 мин до 26 об.% воды/74 об.% ацетонитрила /0,1 об.% ацетонитрила. Для анализа кислых растворов эфиров, таких как галофенат, в качестве растворителя для впрыскивания применяли ацетонитрил. При определении концентраций продукта для галофената использовали метод HPLC с применением метода внешнего стандарта, процедуру ахирального анализа проводили при концентрации образца менее чем 2,5 мг/мл. Пример 1. Синтез хирального спиртового вспомогательного соединения.(S)-N,N-Тетраметиленлактамид (2). Пирролидин (120 г, 1,69 моль; 2 экв.) добавляют по каплям к 100 г (0,847 моль) этил-(S)-(-)-лактата при 0C и перемешивают при комнатной температуре в течение 3 дней. После удаления при пониженном давлении избытка пирролидина и полученного этанола осадок масла очищают перегонкой (104C,2 mmHg) и получают 113 г (93%) (S)-N,N-тетраметиленлактамида (2) в виде бледно-желтого масла. 1H ЯМР (CDCl3):4,30 (1H, q, J=6,63 Гц), 3,74 (1H, br, OH), 3,31-3,61 (4H, m), 1,85-2,03 (4H, m),1,34 (1H, d, J=6,24 Гц) млн/ч. Пример 2. Получение (-)-галофената (6). Получение соединения (3). В 2-литровую 3-горлую колбу, погруженную в масляную баню при атмосферном давлении с воронкой и холодильником, добавляют 500 мл безводного 1,2-дихлорэтана, 4-хлорфенилуксусную кислоту(174,04 г, 98%, 1,0 моль (Acros одну порцию, DMF (0,40 мл, приблизительно 0,5 мол.%), одну порцию тионилхлорида (95 мл, 1,3 моль, 1,3 экв.) в течение 1 мин. Полученную смесь нагревают до 70C (температура масляной бани) в течение 15 мин. Энергичное выделение газа начиналось приблизительно через 5 мин после начала нагревания (при 40-45C). Энергичное выделение газа стабилизировали и затем выделение газа останавливалось. После перемешивания при 70C в течение 2 ч к получившемуся бледножелтому раствору (при 65C) добавляли бром (80 мл, приблизительно 249 г, 1,55 моль; 1,55 экв.) в течение 1 мин до получения коричневого раствора. Реакционную смесь перемешивали при температуре от 80 до 85C (температура масляной бани) в течение ночи (приблизительно 18 ч) и затем охлаждали до комнатной температуры. Этот раствор -бромхлорангидирида хранили при комнатной температуре и применяли на следующей стадии образования эфира без дополнительной очистки. Полученный выше раствор неочищенного хлорангидрида (138 г, 0,138 моль) в 1,2-дихлорэтане разводили 100 мл 1,2-дихлорэтана. Избыток брома удаляли перегонкой при пониженном давлении до тех пор, пока не оставалось приблизительно 100 мл раствора. Затем раствор хлорангидрида добавляли по каплям к раствору (S)-N,N-тетраметиленлактамида (20,1 г, 0,140 моль) и триэтиламина (14,78 г,0,147 моль) в 100 мл 1,2-дихлорэтана при 0C. Полученную коричневую смесь нагревали до комнатной температуры в течение 1 ч. Реакционную смесь заливали водой (100 мл), органический слой отделяли и промывали 100 мл 10%-ного Na2S2O3, а затем насыщенным NaHCO3 (100 мл). Органический слой высушивали над Na2SO4, затем концентрировали при пониженном давлении и получали 45,8 г неочищенного продукта в виде коричневого масла, которое применяли на следующей стадии без дополнительной очистки.- 12015673 Получение соединения (c). К раствору -трифтор-м-крезола (3,3 г; 0,0204 моль) в безводном THF (20 мл) при комнатной температуре добавляли по каплям трет-бутоксид лития (20 мл 1,0 М раствора в THF; 0,02 моль). Полученный раствор феноксида лития добавляли по каплям к раствору бромида 3 (неочищенный, 7,5 г; 0,02 моль) в 40 мл THF при -5C. После перемешивания при -5C в течение 1 ч заранее смешанный раствор перекиси водорода (Fisher 30%; 105 мл, 0,4 моль) и LiOHH2O (21 г, 0,05 моль) в воде (50 мл) добавляли при комнатной температуре в течение 20 мин. Реакционную смесь перемешивали при 0-4C в течение 1 ч, гасили насыщенным водным бисульфитом натрия (150 мл), затем добавляли 1N HCl для того,чтобы довести pH раствора до приблизительно 2, THF удаляли перегонкой при пониженном давлении, и затем реакционную среду разводили EtOAc (100 мл). Органический слой промывали водой и соляным раствором, высушивали над Na2SO4 и выпаривали, получая 7 г неочищенной кислоты. Неочищенную кислоту кристаллизовали из гептана, получая 4,6 г белого сухого вещества. Хиральный HPLC-анализ 96,5:3,5 энантиомеров. Получение галофеновой кислоты можно было проводить, используя такие же условия с другими хиральными вспомогательными соединениями, перечисленными выше. Пример 3. Альтернативное получение галофената (6). К раствору -трифтор-м-крезола (6,71 г; 0,041 моль) в безводном THF (20 мл) и толуоле (30 мл) при комнатной температуре добавляли гидроксид гидрат лития (1,68 г, 40 ммоль). Растворитель удаляли после 1 ч и осадок растворяли в 30 мл безводного THF (30 мл). Полученный раствор феноксида лития добавляли по каплям к раствору бромида 3 (неочищенный, 14,9 г; 0,04 моль) и NaI (0,3 г) в 100 мл THF при перемешивании при комнатной температуре в течение 1 ч при -5C и в течение дополнительных 3 ч при температуре от -5 до 0C. 1H ЯМР показал исчезновение бромида 3. Перекись водорода (Fisher 30%; 209 мл, 0,8 моль) добавляли к раствору гидроксида лития (4,2 г,0,09 моль) в воде (100 мл) и смесь перемешивали при комнатной температуре в течение 20 мин. Этот раствор затем медленно добавляли к холодному раствору лактамида 4 в THF при 0C. Реакционную смесь перемешивали при 0-4C в течение 1 ч, гасили 1N HCl и доводили pH до 2, THF удаляли перегонкой при пониженном давлении и затем реакционную среду разводили EtOAc (150 мл). Органический слой промывали водой, насыщенным Na2S2O3 и соляным раствором, высушивали над Na2SO4 и выпаривали, получая неочищенную кислоту. Неочищенную кислоту кристаллизовали из гептана, получая 8,4 г белого твердого вещества (99:1 энантиомеры, определенные с помощью хирального HPLC). Понятно, что примеры и воплощения, описанные в этом документе, служат только для иллюстративных целей и что могут быть предложены различные модификации и изменения специалистами в этой области техники в границах прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, процитированные в этом описании, включены в него во всей своей полноте для любых целей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения, имеющего формулу (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; волнистая линия указывает место присоединения R1;(a) взаимодействие соединения формулы (II) с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;(c) этерифицирование продукта, полученного на стадии (b), хиральным спиртом, который выбирают из группы, состоящей из в смешивающемся растворителе для стереоселективного получения соединения, имеющего формулу (I). 2. Способ по п.1, в котором R1 представляет собой 3. Способ по любому из предшествующих пунктов, в котором соединение формулы (II) представляет собой 4-хлорфенилуксусную кислоту. 4. Способ по любому из предшествующих пунктов, в котором вещество, активирующее карбонил,представляет собой тионилгалоид. 5. Способ по любому из предшествующих пунктов, в котором агент, активирующий карбонил,представляет собой тионилхлорид. 6. Способ по любому из предшествующих пунктов, в котором бром присутствует в концентрации,по меньшей мере приблизительно равной 1 мол.экв. количества соединения формулы (II). 7. Способ по любому из предшествующих пунктов, в котором растворитель представляет собой галогенированный алифатический растворитель. 8. Способ по любому из предшествующих пунктов, в котором растворитель представляет собой 1,2-дихлорэтан. 9. Способ по любому из предшествующих пунктов, в котором указанные условия включают проведение бромирования при температуре по меньшей мере приблизительно 70C. 10. Способ по любому из предшествующих пунктов, дополнительно включающий удаление избытка брома при пониженном давлении перед указанной стадией (c). 11. Способ по любому из предшествующих пунктов, в котором способ проводят в одном реакционном сосуде. 12. Способ по любому из предшествующих пунктов, в котором выделяют только соединение формулы (I). 13. Соединение формулы (IV) нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); значкомуказан атом углерода, обогащенный одной из стереоизомерных конфигураций; волнистая линия указывает место присоединения R1. 14. Соединение, которое выбирают из группы соединений, имеющих формулу в которых пунктирные и жирные линии указывают на относительную стереохимию соединения. 15. Соединение, которое выбирают из группы соединений, имеющих формулу в которой пунктирные и жирные линии указывают на абсолютную стереохимию соединения. 16. Композиция, включающая соединение по п.14 или 15 в энантиомерном избытке, равном по меньшей мере приблизительно 95%. 17. Способ получения соединения, имеющего формулу (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; волнистая линия указывает место присоединения R1; включающий этерификацию соединения формулы где R представляет собой галид или в комбинации с углеродом, к которому он присоединен, является ангидридом или тиоэфирной группой; в смешивающемся растворителе с хиральным спиртом, выбранным из группы, состоящей из в смешивающемся растворителе для стереоселективного получения соединения, имеющего формулу (I). 18. Способ получения (-)-галофената, включающий i) получение соединения формулы (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c)- 16015673 или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; волнистая линия указывает место присоединения R1; включающий:(a) взаимодействие соединения формулы (II) с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе;(c) этерифицирование продукта, полученного на стадии (b), хиральным спиртом, который выбирают из группы, состоящей из в смешивающемся растворителе для стереоселективного получения соединения формулы (I); дальнейшее превращение полученного продукта в указанный (-)-галофенат. 19. Способ получения (-)-галофената, включающий i) получение соединения формулы (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; волнистая линия указывает место присоединения R1; включающий:(a) взаимодействие соединения формулы (II) с реагентом, активирующим карбоновую кислоту, который выбирают из группы, состоящей из тионилгалоидов, ангидридов и реагентов, генерирующих тиоэфир; в смешивающемся растворителе;(b) бромирование продукта, полученного на стадии (a), бромом в смешивающемся растворителе и дальнейшее превращение полученного продукта в (-)-галофенат. 20. Способ получения (-)-галофената, включающий i) получение соединения формулы (I) каждый R2 независимо выбирают из группы, состоящей из (C1-C4)алкила, галогена, (C1-C4)галогеноалкила, аминогруппы, (C1-C4)аминоалкила, амидогруппы, (C1-C4)амидоалкила, (C1-C4)сульфонилалкила,(C1-C4)сульфамилалкила, (C1-C4)алкоксигруппы, (C1-C4)гетероалкила, карбоксигруппы и нитрогруппы; нижний индекс n равен 1, если R1 имеет формулу (a) или (b), и n равен 2, если R1 имеет формулу (c) или (d); нижний индекс m представляет собой целое число от 0 до 3; значкомуказан атом углерода, обогащенный одной стереоизомерной конфигурацией; волнистая линия указывает место присоединения R1; включающий этерификацию соединения формулы где R представляет собой галид или в комбинации с углеродом, к которому он присоединен, является ангидридом или тиоэфирной группой; в смешивающемся растворителе с хиральным спиртом, выбранным из группы, состоящей из в смешивающемся растворителе для стереоселективного получения соединения формулы (I); дальнейшее превращение полученного продукта в указанный (-)-галофенат.
МПК / Метки
МПК: A61K 31/5375, A61K 31/495, A61K 31/4025, C07D 207/06, C07D 265/30, A61K 31/40, C07D 241/04
Метки: получения, галофената, способ, стереоселективного, интермедиатов
Код ссылки
<a href="https://eas.patents.su/19-15673-sposob-stereoselektivnogo-polucheniya-galofenata-i-ego-intermediatov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ стереоселективного получения (-)-галофената и его интермедиатов</a>
Предыдущий патент: Тканезащитные пептиды и их применения
Следующий патент: Жидкие составы, содержащие диалкилсульфосукцинат и ингибиторы гидроксифенилпируват-диоксигеназы
Случайный патент: N-[(замещенное пятичленное ди- или триазадиненасыщенное кольцо) карбонил] гуанидиновые производные для лечения ишемии