Производные хинолина и их использование в качестве противоопухолевых средств
Номер патента: 7205
Опубликовано: 25.08.2006
Авторы: Хорвитц Джером П., Полин Лиза, Хейзелдайн Стюарт Т., Корбетт Томас Х.
Формула / Реферат
1. Соединение формулы I
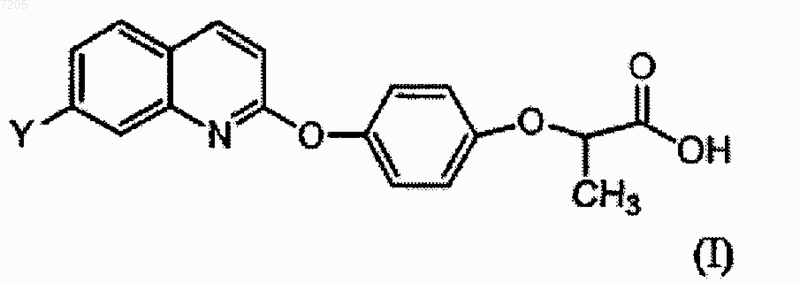
где Y представляет собой F, Cl, Br, метил или метокси; или его фармацевтически приемлемая соль.
2. Соединение по п.1, где Y представляет собой F.
3. Соединение по п.1, где Y представляет собой Cl.
4. Соединение по п.1, где Y представляет собой Br.
5. Соединение по п.1, где Y представляет собой -OMe.
6. Соединение по п.1, где Y представляет собой метил.
7. Соединение по любому из пп.1-6, в котором углерод, несущий метильную группу, находится в (R) конфигурации.
8. Соединение по любому из пп.1-6, в котором углерод, несущий метильную группу, находится в (S) конфигурации.
9. Соединение по п.1, которое представляет собой 2-[4-(7-хлорхинолин-2-илокси)фенокси]пропионовую кислоту.
10. Соединение по п.1, которое представляет собой (R) 2-[4-(7-хлорхинолин-2-илокси)фенокси]пропионовую кислоту.
11. Композиция для лечения рака у млекопитающих, включающая соединение по любому из пп.1-10 в сочетании с фармацевтически приемлемым разбавителем или носителем.
12. Соединение по любому из пп.1-10 для использования в медикаментозном лечении.
13. Применение соединения по любому из пп.1-10 для производства лекарственного средства для лечения рака у млекопитающего.
14. Терапевтический способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по любому из пп.1-10.
Текст
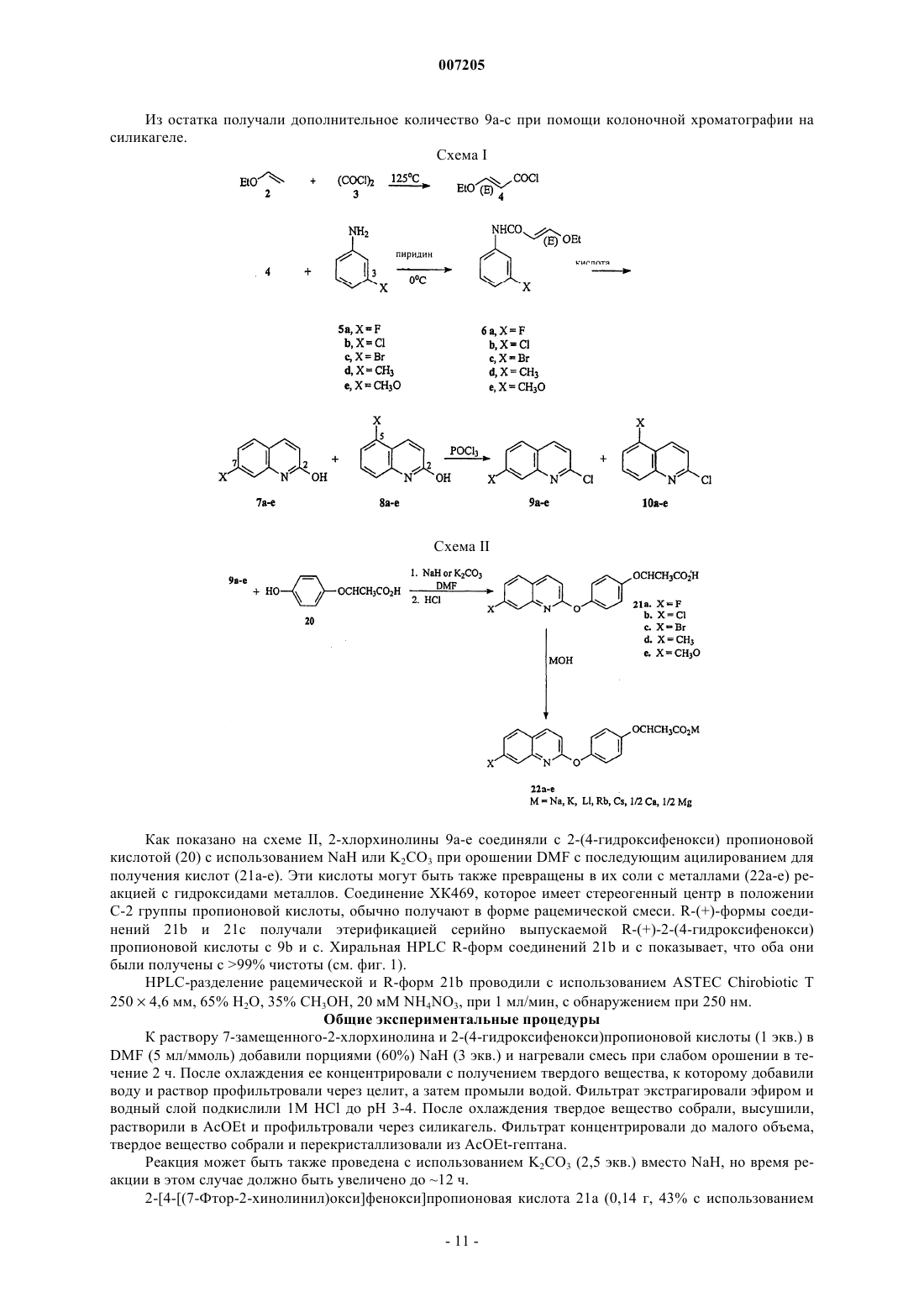
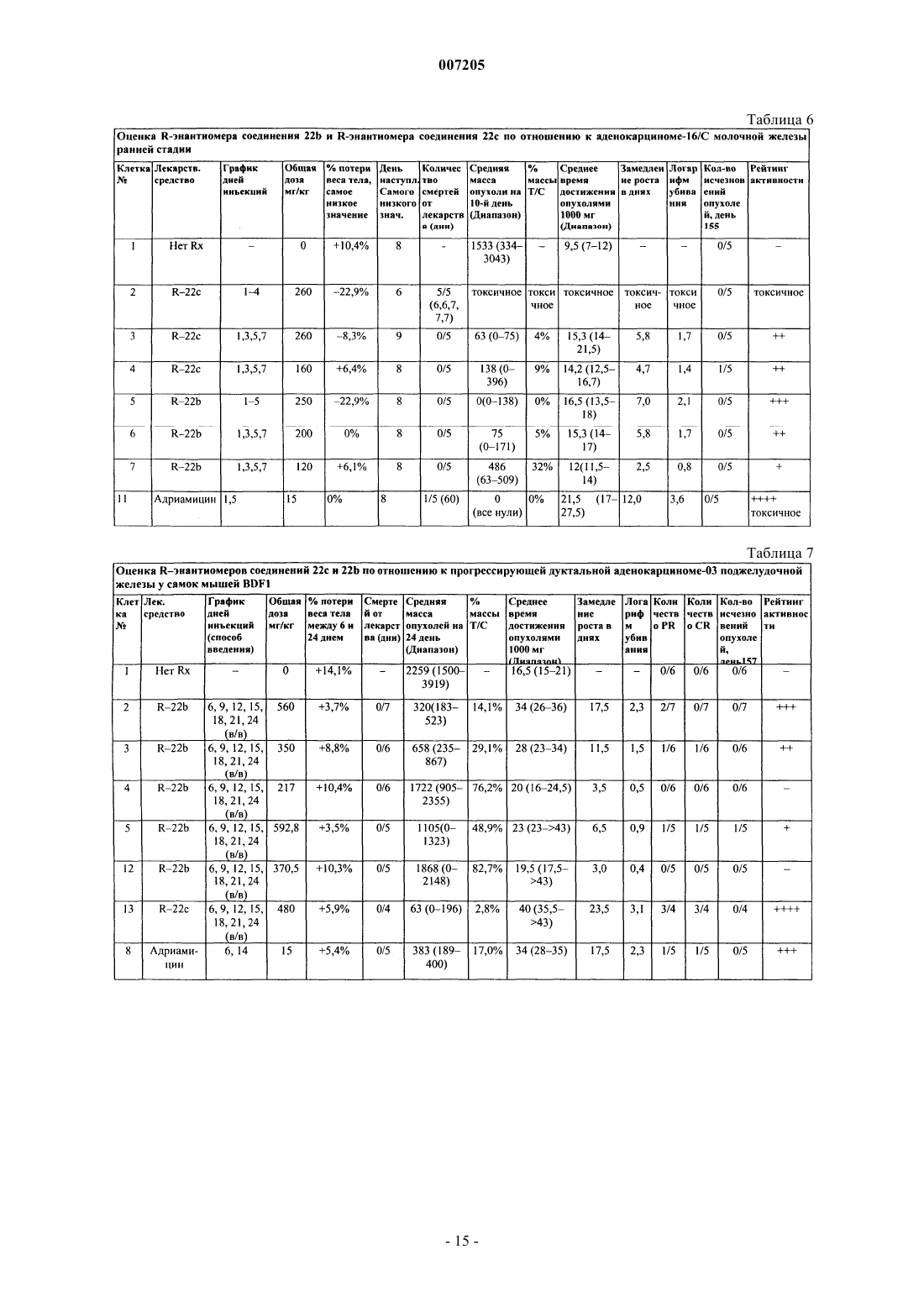
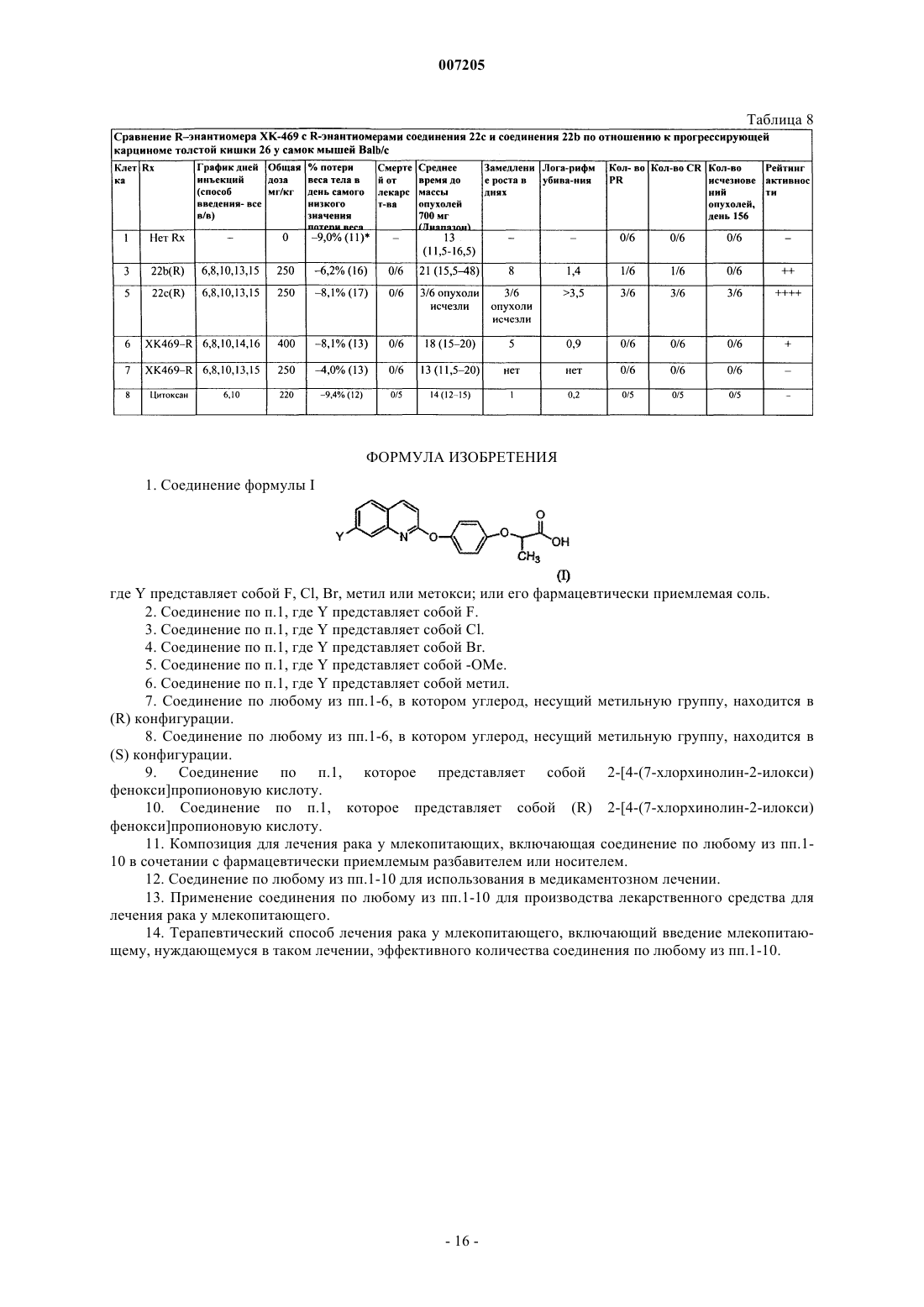
007205 Приоритет изобретения Данная заявка истребует приоритет согласно ст.35 U.S.С 119(e) по предварительной заявке США 60/309144, зарегистрированной 31.07.2001. Государственное финансирование Изобретение, описанное здесь, сделано при частичной государственной поддержке в виде субсидииNCI-NIH Grant Number CA82341, выданной National Cancer Institute (Национальным институтом онкологии). Правительство Соединенных Штатов имеет в изобретении определенные права. Уровень техники В патенте США 4629493 описаны гербицидные соединения следующей формулы: в которой А представляет собой -CH- или -N-; X представляет собой галоген; n= 0, 1 или 2; R1 представляет собой галоген или низшую алкильную группу и R2 представляет собой -ОН, в числе других значений. Одно из этих соединений в настоящее время серийно выпускается для борьбы с однолетними и многолетними травяными сорняками в широколистных культурах. Это соединение имеет следующую формулу:Corbett et. al., Investigational New Drugs. 16 129-139 (1998), оценивают ряд хиноксалиновых соединений на активность по отношению к твердым опухолям у мышей. Сообщается, что следующее соединение(называемое ХК 469) обладает активностью широкого спектра против трансплантабельных опухолей мышей Сообщается также, что это соединение обладает относительно низкой эффективностью и имеет несколько нежелательных побочных эффектов, включая токсичность in vivo, например, паралитическая непроходимость кишечника, эпителиальное повреждение желудочно-кишечного тракта, костно-мозговая токсичность, нервно-мышечная токсичность и потеря веса. В настоящее время существует необходимость в дополнительных противоопухолевых средствах. Краткое описание изобретения Данное изобретение относится к соединениям, являющимся эффективными противоопухолевыми средствами. В соответствии с этим, изобретение относится к соединению формулы I где Y представляет собой F, Cl, Br, метил или метокси; или к его фармацевтически приемлемой соли. Изобретение также относится к терапевтическому способу ингибирования роста опухолевых клеток у млекопитающих, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по данному изобретению. Изобретение также относится к терапевтическому способу лечения рака у млекопитающих, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по изобретению. Изобретение также относится к использованию соединения по изобретению в терапевтических целях. Изобретение также относится к использованию соединения по изобретению для производства лекарственного средства для лечения рака у млекопитающих. Краткое описание чертежа На чертеже показано разделение путем HPLC рацемического соединения 21b (схема II) и Rэнантиомера соединения 21b с использованием Chirobiotic T2504,6 мм, 65% Н 2 О, 35% СН 3 ОН, 20 мМ-1 007205 Подробное описание изобретения Специалистам в соответствующей области техники будет понятно, что могут существовать соединения по изобретению, имеющие хиральный центр, которые могут быть выделены в оптически активных и в рацемических формах. Некоторые соединения могут проявлять полиморфизм. Следует понимать, что данное изобретение включает все рацемические, оптически активные, полиморфные или стереоизомерные формы соединения по изобретению или их смеси, которые обладают полезными свойствами, описанными здесь, при этом в химической технологии хорошо известны способы получения оптически активных форм (например, путем выделения рацемической формы перекристаллизационными методиками,синтезом из оптически активных исходных материалов, хиральным синтезом, или хроматографическим разделением с использованием хиральной неподвижной фазы) и способы определения противоопухолевой активности с использованием стандартных испытательных методик, описанных здесь, или с использованием других подобных испытательных методик, хорошо известных в науке. Специфическим значением для Y является атом фтора. Другим специфическим значением для Y является атом хлора. Другим специфическим значением для Y является атом брома. Другим специфическим значением для Y является группа метокси (-OMe). Специфической группой соединений формулы I являются соединения, в которых углерод, несущий метильную группу, находится в (S)-конфигурации. Предпочтительной группой соединений формулы I являются соединения, в которых углерод, несущий метильную группу, находится в (R)-конфигурации. Предпочтительные соединения по изобретению включают 2-[4-(7-хлорхинолин-2 илокси)фенокси]пропионовую кислоту (соединение 21b); 2-[4-(7-бромхинолин-2-илокси)фенокси] пропионовую кислоту (соединение 21 с); 2-[4-(7-фторхинолин-2-илокси)фенокси]пропионовую кислоту(соединение 21 а) и их фармацевтически приемлемые соли (например, соединения 22 а, 22b и 22 с). Более предпочтительно соединения по изобретению включают (R) 2-[4-(7-хлорхинолин-2-илокси)фенокси] пропионовую кислоту (соединение 21b) или ее фармацевтически приемлемую соль (например, соединение 22b) и (R) 2-[4-(7-бромхинолин-2-илокси)фенокси]пропионовую кислоту (соединение 21 с) или ее фармацевтически приемлемую соль (например, соединение 22 с). В случаях, когда соединения являются достаточно основными или кислотными для образования стабильных нетоксичных кислотных или основных солей, может быть целесообразно применение этих соединений в виде солей. Примеры фармацевтически приемлемых солей включают соли с органическими кислотами, которые предоставляют физиологически приемлемый анион, например, тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, -кетоглутарат и глицерофосфат. Могут быть также образованы полезные неорганические соли, включая гидрохлорид,сульфат, нитрат, бикарбонат и карбонат. Фармацевтически приемлемые соли могут быть получены с использованием стандартных процедур,хорошо известных в химической технологии, например, путем реакции достаточно основного соединения, такого как амин, с подходящей кислотой, предоставляющей физиологически приемлемый анион. Также могут использоваться соли карбоновых кислот с щелочными металлами (например, натрия, калия или лития) или щелочно-земельными металлами (например, кальция). Соединения формулы I могут входить в состав фармацевтических композиций и вводиться млекопитающему-хозяину, такому как человек, в разнообразных формах, адаптированных к выбранному способу применения, т.е. пероральному или парентеральному, например, внутривенному, внутримышечному, местному или подкожному способу применения. Так, соединения по изобретению могут систематически вводиться, например, перорально, в сочетании с фармацевтически приемлемым носителем, таким как инертное разбавляющее вещество или усвояемый пищевой носитель. Они могут быть заключены в твердые или мягкие желатиновые капсулы,могут быть спрессованы в таблетки или могут приниматься пациентом непосредственно с пищей. Для перорального терапевтического применения активное соединение может быть смешано с одним или более наполнителей и использоваться в форме глотательных таблеток, таблеток для рассасывания, пилюль,капсул, эликсиров, суспензий, сиропов, вафель и т.д. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентный состав композиций и препаратов, безусловно,может варьироваться и может составлять от 2 до 60 вес.% данной единичной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях обеспечивает эффективный уровень дозировки. Таблетки, пилюли, капсулы и т.п. могут также содержать следующие компоненты: связующее, такое как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; наполнители, такие как дикальция фосфат; дезинтеграторы, такие как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; смазочные вещества, такие как стеарат магния; и подсластители, такие как сахароза,фруктоза, лактоза или аспартам, или ароматизаторы, такие как перечная мята или винтергриновое масло,или может добавляться вишневый ароматизатор. Если единичной лекарственной формой является капсула, она может содержать, кроме перечисленных веществ, жидкий носитель, такой как растительное масло-2 007205 или полиэтиленгликоль. Различные другие вещества могут присутствовать в качестве покрытий или других модификаторов физической формы твердой единичной лекарственной формы. Например, таблетки,пилюли или капсулы могут иметь покрытие из желатина, воска, шеллака или сахара и т.п. Сироп или эликсир может содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метили пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как вишневый или апельсиновый. Разумеется, любое вещество, используемое в изготовлении лекарственной формы, должно быть фармацевтически приемлемым и по существу нетоксичным в используемых количествах. Кроме того,активное соединение может входить в состав препаратов и устройств замедленного действия. Активное соединение также может применяться внутривенно или интраперитонеально путем вливания или инъекции. Растворы активного соединения или его солей могут быть приготовлены в воде,возможно, в смеси с нетоксичным поверхностно-активным веществом (ПАВ). Также могут быть изготовлены дисперсии в глицерине, жидких полиэтиленгликолях, триацетине и смесях этих веществ в маслах. В обычных условиях хранения и использования эти препараты содержат консерванты, предотвращающие рост микроорганизмов. Лекарственные формы, пригодные для инъекций или вливаний, могут включать стерильные водные растворы или стерильные порошки, включающие активный ингредиент, которые адаптированы для быстрого приготовления стерильных растворов или дисперсий для инъекций или вливаний, возможно, инкапсулированные в липосомах. Во всех случаях конечная лекарственная форма должна быть стерильной,текучей и стабильной в условиях производства и хранения. Жидким носителем может быть растворитель или жидкая дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин,пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, нетоксические глицериловые эфиры и их приемлемые смеси. Надлежащая текучесть может обеспечиваться, например, путем образования липосом, путем поддержания требуемого размера частиц в случае дисперсий или путем использования поверхностно-активных веществ. Воздействие микроорганизмов может быть предотвращено при помощи различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тиомерсала и т.п. Во многих случаях предпочтительно включение изотонических веществ, например, сахаров, буферов или хлорида натрия. Пролонгированное всасывание композиций для инъекций может обеспечиваться путем использования в этих композициях веществ, замедляющих всасывание, например, моностеарата алюминия и желатина. Стерильные растворы для инъекций изготавливают путем растворения активного ингредиента в требуемом количестве подходящего растворителя с различными другими ингредиентами, описанными выше, по мере надобности, с последующей стерилизацией. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительные способы приготовления включают вакуумную сушку и сублимационную сушку, с получением порошка активного ингредиента вместе с любым желаемым дополнительным ингредиентом, присутствующим в описанных ранее стерильнофильтрованных растворах. Для местного применения соединения по изобретению могут использоваться в чистом виде, т.е., если они представляют собой жидкости. Однако в целом предпочтительно нанесение их на кожу в виде композиций или составов, включающих дерматологически приемлемый носитель, который может быть твердым или жидким. Пригодные твердые носители включают тонкоизмельченные твердые вещества, такие как тальк,глина, микрокристаллическая целлюлоза, кремнезем, глинозем и т.п. Пригодные жидкие носители включают воду, диметилсульфоксид (DMSO), спирты или гликоли, или водоспиртовые/гликольные смеси, в которых соединения по изобретению могут быть растворены или диспергированы в эффективном количестве, возможно, при помощи ПАВ. Для оптимизации свойств в конкретных случаях использования могут быть введены добавки, такие как ароматизаторы и дополнительные противомикробные средства. Результирующие жидкие композиции могут наноситься из абсорбирующих подушек, используемых для пропитки бинтов и другого перевязочного материала, или распыляются на пораженную область с использованием распылителей насосного или аэрозольного типа. Загустители, такие как синтетические полимеры, соли и эфиры жирных кислот, жирные спирты,модифицированные целлюлозы или модифицированные минеральные вещества также могут быть использованы с жидкими носителями для образования распределяемых паст, гелей, мазей, мыл и т.п., для нанесения непосредственно на кожу пользователя. Примеры полезных дерматологических композиций, которые могут быть использованы для доставки соединений формулы I в кожу, известны в медицине; например, см. Jacquet et al. (патент США 4608392), Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman (патент США 4820508). Полезные дозировки соединений формулы I могут быть определены путем сравнения их активности in vitro, а также их активности in vivo в животных моделях. Способы экстраполяции эффективных доз для мышей и других животных на людей известны в медицине, например, см. патент США 4938949. Количество соединения или его активной соли или производного, требуемое для использования в-3 007205 лечении, будет изменяться не только в зависимости от конкретной выбранной соли, но и от способа применения, природы заболевания, подлежащего лечению, и состояния пациента, и в конечном счете будет определяться лечащим врачом. Соединение удобно применять в виде единичной лекарственной формы, например, содержащей 51000 мг/м 2, предпочтительно 10-750 мг/м 2, наиболее предпочтительно 50-500 мг/м 2 активного ингредиента на одну лекарственную форму. Желаемая доза может быть представлена в виде одной дозы или разделена на несколько доз, принимаемых через определенные промежутки времени, например, две, три, четыре или более субдоз в день. Сама субдоза может быть также разделена, например, на ряд отдельных, свободно распределенных по времени приемов. Соединения по изобретению являются активными противоопухолевыми средствами и обладают высокой эффективностью и/или сниженной токсичностью по сравнению с XK 469. Предпочтительно соединения по изобретению более эффективны и менее токсичны, чем (R) XK 469, и/или избегают потенциального участка катаболического метаболизма, с которым встречается XK 469, т.е. имеют метаболический профиль, отличный от XK 469. Данное изобретение относится к терапевтическим способам лечения рака у млекопитающего, которые включают введение млекопитающему, имеющему рак, эффективного количества соединения или композиции по изобретению. Млекопитающие включают приматов, людей, грызунов, собак, кошек, коров, овец, лошадей, свиней, коз и т.д. Рак включает любые типы злокачественных новообразований, например, рак толстой кишки, рак молочной железы, меланома и лейкоз, и в целом отличается нежелательной клеточной пролиферацией, например, нерегулируемым ростом, отсутствием дифференциации, инвазией в локальную ткань и метастазами. Способность соединения по изобретению лечить рак может определяться путем использования аналитических методик, известных в медицине. Например, режимы лечения, оценка токсичности, анализ данных, количественная оценка убивания опухолевых клеток и биологическое значение использования различных видов трансплантабельных опухолей описаны в литературе. Кроме того, способность соединений лечить рак может быть определена с использованием тестов, описанных ниже. В тестах A-H использованы следующие общие методики. Поддержание опухолей и содержание животных. В исследованиях использовали дуктальную аденокарциному-03 поджелудочной железы, В 16 меланому, аденокарциному-16/C/Adr молочной железы, аденокарциному-17/Adr молочной железы, аденокарциному-26 толстой кишки и аденокарциному-16/С молочной железы. Опухоли поддерживали в исходном штамме мышей С 57 В 1/6 (для опухолей поджелудочной железы 03, В 16), Balb/c (для опухолей толстой кишки 26) и С 3 Н (для опухолей молочной железы). Опухоли трансплантировали в соответствующий гибрид F1 (BDF1 = самки С 57 В 1/6 и самцы X DBA/2) или в исходный штамм для химиотерапевтических исследований. Индивидуальные значения веса тела мышей для каждого опыта отличались в пределах 5 г, а все мыши в начале лечения весили более 17 г. Мыши получали пищу и воду без ограничений. Химиотерапия твердых опухолей. Животных объединяли, имплантировали подкожно 30-60 г фрагментов опухолей при помощи троакара 12 калибра на день 0 и снова объединяли перед неизбирательным распределением на различные группы лечения и контрольные группы. На ранней стадии лечения химиотерапию начинали в течение 1-3 дней после имплантации опухоли, когда количество клеток было относительно мало (107-108). Для исследования поздних стадий или стадий прогрессирования опухолям давали вырасти в течение 5 или более дней до начала лечения. Опухоли измеряли калибром дважды в неделю. Мышей умерщвляли, когда вес опухоли достигал 1500 мг. Вес опухоли оценивали на основе двухмерных измерений Вес опухоли (в мг) = (аb2 )/2,где а и b представляют собой длину и ширину опухоли (мм) соответственно. Конечные точки для оценки противоопухолевой активности к твердым опухолям.a). Замедление роста опухоли (величина T-C), где T - среднее время (в днях), требуемое для достижения опухолями в группе лечения предварительно заданной величины (например, 1000 мг), а С - среднее время (в днях), требуемое для достижения опухолями в контрольной группе того же размера. Выжившие мыши с исчезнувшими опухолями были исключены из этих расчетов (для случаев излечения составлена отдельная таблица). Эта величина представляет собой важный критерий противоопухолевой активности, так как она дает возможность количественной оценки убивания опухолевых клеток.b). Расчет убивания опухолевых клеток для подкожно (SC) растущих опухолей производили по следующей формуле: где T-C - замедление роста опухоли, как описано выше, a Td - время удвоения объема опухоли (в днях),оцененное по оптимально подогнанной прямой на логарифмическом графике экспоненциального роста-4 007205 опухолей в контрольной группе (в диапазоне от 100 до 800 мг). Перевод величин T - С в десятичный логарифм убивания клеток возможен благодаря тому, что Td опухолей, возобновивших рост после лечения(Rx), приближается к значениям Td опухолей у необработанных контрольных мышей. Перевод замедления опухолевого роста (величина T - С) в десятичный логарифм убивания клеток в этом эксперименте оправдан большим количеством излечений, полученных в результате использования 5 исследуемых препаратов. Излечения представляют собой явный показатель убивания опухолевых клеток (в большей степени, чем стаз репликации опухолевых клеток). В некоторых случаях, как для данных оценки in vivo за прошлый период, так и для данных, представленных здесь, важно сравнение логарифмических величин убивания в исследованиях, существенно отличающихся по методике. С этой целью была составлена таблица активности, которая приведена ниже. Следует отметить, что понадобился рейтинг активности в диапазоне отдодля того, чтобы вызвать частичную регрессию (PR) или полную регрессию (CR) 100-300-мг масс большинства трансплантированных твердых опухолей мышей. Таким образом, соединение с рейтингом активности + илине может рассматриваться как активное по обычным клиническим критериям. PR представляет собой снижение массы опухоли менее чем на 50% от размера до лечения. CR представляет собой снижение массы опухоли до величины менее пальпируемого размера (т.е. снижение до нулевой обнаружимой массы). Перевод десятичного логарифма убивания клеток в оценку активности Измерения в группах лечения и в контрольных группах проводили, когда размер опухолей в контрольной группе достигал примерно 700-1200 мг (среднее значение в группе). Величина Т/С в процентах является показателем противоопухолевой эффективности: Т/С = 0% означает отсутствие опухолевого роста. Т/С = 100% означает отсутствие противоопухолевой активности, т.е. обрабатываемые и контрольные опухоли росли одинаково. Величина Т/С 42% рассматривается как существенная противоопухолевая активность по критериям Drug Evaluation Branch of the Division of Cancer Treatment (NCI) (подразделение оценки лекарственных средств отдела лечения рака Национального онкологического института). Величина Т/С 10% рассматривается как весьма существенная противоопухолевая активность, и этот уровень используется NCI для подтверждения успешности клинических испытаний в случае соответствия требованиям токсичности, состава и некоторым другим требованиям (так называемая активность уровня DN-2). Самое низкое значение потери веса тела (среднее или групповое) более 20% или уровень смертности от лекарства более 20% рассматривается в большинстве испытаний одиночных лечебных курсов, как показатель чрезмерно токсической дозы. Изготовление лекарственных препаратов для инъекций мышам. Соединение 22b (натриевая соль) в тестах A-H готовили в 1% растворе бикарбонатата натрия, дистиллированной воде или буферизованном фосфатом солевом растворе (PBS), с доведением рН до 7,0-7,5 соляной кислотой и вводили внутривенно (в/в) или перорально (п/о), в объеме 0,2 мл на инъекцию. Тест А. Оценка по отношению к дуктальной аденокарциноме 03 поджелудочной железы ранней стадии. Дуктальная аденокарцинома 03 поджелудочной железы высокочувствительна к таксолу (рейтинг активности ). Она чувствительна к адриамицину (рейтинг активности ), умеренно чувствительна к VP-16, цитоксану и CisDDPt (рейтинг активности ) и слабо чувствительна к 5-FU (рейтинг активности +). Самкам мышей BDF1 (получены в NCI-Raleigh) (дата рождения (здесь далее Д.Р.) 27 марта 2000; дата поступления (здесь далее Д.П.) 9 апреля 2000) имплантировали (дата имплантации опухоли (здесь далее Д.И.) 17 марта 2000) опухоль дуктальной аденокарциномы 03 поджелудочной железы и разделили на группу лечения и контрольную группу. Группе лечения вводили соединение 22b ежедневно в дни 3-9(в/в). Результаты теста А приведены в табл. 1. Тест В. Оценка по отношению к меланоме В 16 ранней стадии. Меланома В 16 представляет собой крайне нечувствительную к лекарственным средствам опухоль при подкожной (SC) имплантации. Она нечувствительна к VP-16, винбластину и Аrа-С (отрицательный(-) рейтинг активности), минимально чувствительна к таксолу, адриамицину и камптотецину (рейтинг активности + или +/-), слабо чувствительна к 5-FU, циотоксану и CisDDPt (рейтинг активности ). Вы-5 007205 сокоактивными являются лишь BCNU и другие нитрозомочевины (рейтинг активности ). Самкам мышей BDF1 (приобретенные в NCI-CRL-Ral) (Д.Р. 24 января 2000, Д.П.29 февраля 2000),средний вес 21,6 г, имплантировали клетки меланомы В 16, пассаж 138 (Д.И. 17 апреля 2000). Величина Td (время удвоения объема опухоли) составила 1 день. Мышей разделили на контрольную группу и три экспериментальные группы. Контрольная группа (клетка 1) не получала лечения. В клетке 1 опухоль достигла 1000 мг за 7 дней (1 день Td), и рост опухоли соответствовал ожидаемому. В клетке 2 соединение 22b (рацемическое) вводили внутривенно (в/в) при 40 мг/кг/инъекцию,один раз в день, в дни 1-4. Всего ввели 320 мг/кг. Эта доза была токсичной и привела к 1/5 смертей от лекарства на 7-й день. Причиной смерти была костно-мозговая токсичность, что показал маленький размер селезенки. Желудочно-кишечный тракт при исследовании оказался пустым, что означало отсутствие приема пищи перед смертью. Эта доза обусловила серьезную потерю веса -20,8%; самое низкое значение наступило на 7-й день, с полным восстановлением на 11-й день. Потеря веса -20% является показателем чрезмерной токсичности по стандартам N.С.I. В данном случае, введение соединения 22b (рацемического) было ассоциировано с замедлением нервной проводимости у мышей. При дозах 50 мг/кг токсичность была умеренной, но продолжалась в течение 20 мин в 1-й день и 8 мин на 4-й день. При высоких дозах,например, 80 мг/кг, лекарственное средство показывало существенную пост-инъекционную нервномышечную токсичность, которая продолжалась более 20 мин, но полностью проходила в течение 2 ч. Ее признаком был явный паралич задних конечностей, означающий, что токсичность связана со скоростью проводимости, поскольку, чем длиннее нерв, тем сильнее поражена функция. Как описано ниже, это замедление нервной проводимости наблюдается при использовании рацематов и S-энантиомеров описываемых соединений. Во всех случаях использования R-энантиомерных форм этот эффект отсутствует. В клетке 3 соединение 22b вводили в/в при 50 мг/кг/инъекцию, ежедневно, в дни 1-5. Всего ввели 250 мг/кг. При этой дозе процент потери веса тела составил -13% (самое низкое значение наступило на 7-й день, полное восстановление на 11-й день, т.е. время восстановления хозяина - 4 дня). Эта доза была активной (Т/С = 0, логарифм убивания 2,6, рейтинг активности ). В клетке 4 соединение 22b вводили в/в при 30 мг/кг/инъекцию ежедневно, в дни 1-6. Всего ввели 180 мг/кг. Эта доза привела к потере веса тела -7,4% (самое низкое значение наступило на 5-й день, полное восстановление - на 9-й день). Эта доза была активной (Т/С = 15,6%, логарифм убивания 1,8, рейтинг активности ). Результаты теста В представлены в табл. 2. Тест С. Оценка по отношению к аденокарциноме молочной железы-16/C/Adr ранней стадии. Аденокарцинома молочной железы-16/C/Adr ранней стадии представляет собой р-гликопротеинотрицательную опухоль с мультилекарственной устойчивостью. Самок мышей С 3 Н получали в NCIKingston-CRL (Д.Р. 3 апреля 2000; Д.П.16 мая 2000). Средний вес мышей составлял 26,3 г. Мышам имплантировали аденокарциному молочной железы -16/C/Adr ранней стадии, пассаж 183, и разделили на контрольную группу (клетка 1) и две экспериментальные группы (клетка 2 и клетка 3) (Д.И.О. 22 июня 2000). Контрольные животные (клетка 1) не получали лечения. Рацемическую форму соединения 22b (хлорсодержащий аналог) вводили экспериментальным группам следующим образом: В клетке 1 опухоль достигла 1000 мг за 16 дней (1,2 дней Td), и рост опухоли соответствовал ожидаемому. В клетке 2 общую дозу 504 мг/кг соединения 22b вводили в/в. Эта обработка вызвала умеренный нервно-мышечный эффект в виде нарушения походки, продолжавшийся около 10 мин после инъекции. Токсичность была наиболее очевидна в первые два дня и стала менее очевидной при последующих инъекциях. Эта доза вызвала потерю веса тела -15% (самое низкое значение наступило на 7-й день, полное восстановление - на 12-й день). Интересно то, что в ходе второго курса обработки мыши набрали вес(дни 11-13). Лекарственное средство оказалось активным при этой дозе (Т/С=0%, логарифм убивания 2,0,рейтинг активности ). В клетке 3 вводили общую дозу 324 мг/кг соединения 22b. Эта доза вызвала незначительное нарушение походки и потерю веса тела -1,1% у животных в клетке 3 (самое низкое значение наступило на 7-й день, полное восстановление - на 8-й день). Лекарственное средство оказалось неактивным при такой дозировочной схеме (Т/С=53%, логарифм убивания 0,6). Результаты теста С приведены в табл. 3. Тест D. Оценка рацемического соединения 22 с по отношению к аденокарциноме молочной железы 17/Adr ранней стадии.-6 007205 Рацемическую смесь соединения 22 с (бромсодержащий аналог) оценивали по отношению к опухоли молочной железы с мультилекарственной устойчивостью (Маm-17/Adr). Самок мышей С 3 Н/HeN (MTV-отр.) получили в N.C.L Frederick (Д.Р. 9 октября 2000; Д.П.14 ноября 2000). Средний вес мышей составлял 29,3 г. Мышам имплантировали Mam-17/Аdr/пассаж 220 (ргликопротеинположительная опухоль с мультилекарственной устойчивостью) (Д.И. 2 января 2001; Td = 1,0 день). Соединение 22 с (рацемическое) приготовили для введения путем суспендирования в 5% этаноле, 1% РОЕ-80 и 1% бикарбонате натрия с получением раствора. Затем добавили P.B.S. и довели рН до 7 соляной кислотой. 0,2 мл на инъекцию вводили в/в. Животные в клетке 1 не получали лечения. Рост опухоли соответствовал ожидаемому и достиг 1000 мг на 7-й день (в диапазоне 7-9) (Td = 1,0 день). Животным в клетке 3 вводили рацемический препарат соединения 22 с внутривенно при 50 мг/кг/инъекцию в 1-й день; 62,5 мг/кг во 2-й день и 60 мг/кг/инъекцию в дни 3, 6, 7, 8 для получения общей дозы 352,5 мг/кг. Эта доза вызвала умеренную потерю веса тела -5,5% и умеренное замедление нервной проводимости, продолжавшееся около 10 мин при дозе 60-62,5 мг/кг. Симптомы выражались в слабом нарушении походки. Эта доза показала впечатляющую противоопухолевую активность (Т/С = 0,логарифм убивания 4,2, рейтинг активности ). Опухоли достигли 1000 мг на 21-й день (в диапазоне 19-42). Ни одно противоопухолевое средство, стандартное или экспериментальное, не превышало такой степени активности по отношению к этой опухоли. В клетке 4 животные получали рацемический препарат соединения 22 с путем в/в инъекции при 30 мг/кг в 1-й день; 37,5 мг/кг во 2-й день; и 36 мг/кг/инъекцию в дни 3, 6, 7, 8 до получения общей дозы 211,5 мг/кг. При этой дозе нарушения походки не было. Эта доза также была высокоактивной (логарифм убивания 3,0). Опухоли достигли 1000 мг на 17-й день (в диапазоне 14-21). Как оказалось, рацемический препарат соединения 22 с обладает нервно-мышечной токсичностью того же типа, что и при испытании рацемического препарата соединения 22b, но менее тяжелой (см. тест В). Результаты представлены в табл. 4. Тест E. Оценка R-энантиомера соединения 22b и соединения 22 а по отношению к аденокарциноме молочной железы-17/Adr ранней стадии. Активность R-энантиомера соединения 22b и соединения 22 а (фторсодержащий аналог) оценивали по отношению к опухоли молочной железы Mam-17/Adr, которая представляет собой р-гликопротеинположительную опухоль с мультилекарственной устойчивостью. Самок мышей С 3 Н/HeN (MTV-отр.) получали в N.C.L-Frederick (Д.Р. 20 ноября 2000; Д.П. 2 января 2001). Средний вес мышей составлял 25,9 г. Мышам имплантировали Маm-17/Аdr/пассаж-223 (Д.И. 12 февраля 2001; Td = 1,2 дня) и разделили на контрольную группу и группу лечения. Рацемический препарат соединения 22 а суспендировали в 3% этаноле, 1% РОЕ-80 и 0,25% бикарбонате натрия с получением раствора. Затем добавили P.B.S. и довели рН до 7 соляной кислотой. Объем 0,2 мл на инъекцию вводили животным внутривенно. R-энантиомер соединения 22b суспендировали в 3% этаноле, 1% РОЕ-80 и 0.5% бикарбонате натрия с получением раствора. Затем добавили P.В.S. и довели рН до 7 соляной кислотой. Объем 0,2 мл на инъекцию вводили животным внутривенно. В клетке 1 контрольная группа не получала лечения, и опухоли достигли 1000 мг за 9,0 дней (8,510), Td = 1,2 дня. Рост опухоли соответствовал ожидаемому. В клетке 3 животным вводили 36 мг/кг рацемического соединения 22 а внутривенно(в/в) в 1-й день и 48 мг/кг/инъекцию в дни 2-7 до общей дозы 324 мг/кг. Увеличение индивидуальных доз оказалось невозможным из-за тяжелой нервно-мышечной токсичности (замедление нервной проводимости, приводящее к двигательной дисфункции конечностей, как передних, так и задних). Дисфункция продолжалась 15 мин для передних конечностей и дольше для задних. Эта доза была активной (Т/С = 14%, логарифм убивания 1,5, рейтинг активности ). Однако улучшения по сравнению с соединением 22b или соединением 22 с явно не наблюдалось. Животные в клетках 4 и 5 получали более низкие дозы препарата рацемического соединения 22 а, чем в клетке 3. Эти дозы были неактивны. Животным в клетке 6 вводили R-энантиомер соединения 22b, и нервно-мышечная токсичность не проявлялась. В тесте В рацемическая форма соединения 22b вызывала замедление нервной проводимости. Этот результат показывает, что S-энантиомер ответственен за нервно-мышечную токсичность соединения 22b. S-энантиомерную форму специально синтезировали позднее и вводили при 80 мг/кг/инъекцию и при 50 мг/кг/инъекцию, в/в; обе дозы показали выраженную нервно-мышечную токсичность. В клетке 6 R-энантиомер соединения 22b вводили в/в при 83 мг/кг/инъекцию, в дни 1-4, до общей дозы 332 мг/кг. Эта доза была токсичной и убила всех пятерых мышей (в дни 7, 7, 8, 9, 10). Причиной смерти было повреждение эпителия ЖКТ, вызвавшее отторжение эпителия ЖКТ и в результате диарею. Трое из мышей имели слегка увеличенные заполненные пищей желудки, что показывает гастропарез или паралитическую непроходимость кишечника. Размеры селезенок всех мышей были около нормы, т.е. соединение не проявило существенной токсичности у мышей. В клетке 7 животным вводили R-энантиомер соединения 22b внутривенно (в/в) при 55 мг/кг/инъекцию, в дни 1-4 до общей дозы 220 мг/кг. Эта доза была довольно токсичной, вызвала 1/5-7 007205 смертей от лекарства и большую потерю веса тела (-23,4%, самое низкое значение на 9-й день и полное восстановление на 14-й день). Одна смерть была вызвана повреждением эпителия ЖКТ (диарея), осложненным костно-мозговой токсичностью (маленькая селезенка). Однако эта доза была высокоактивной(Т/С = 0, логарифм убивания 3,3, рейтинг активности ). Опухоли достигли 1000 мг на 22 день (1823). В клетке 8 содержали только одну мышь, которую использовали для контроля исходной токсичности с целью оценки нервно-мышечной токсичности. Ей ввели инъекцию одной дозы препарата Rэнантиомера соединения 22b в количестве 124,5 мг/кг только в 1-й день. Нервно-мышечная токсичность не была обнаружена. Доза была умеренно активной и нетоксичной (Т/С = 35%, логарифм убивания 0,8,рейтинг активности +). Таким образом, эти данные показывают, что соединение 22 а было активным (клетка 2). Rэнантиомер соединения 22b не имеет нервно-мышечной токсичности, наблюдающейся у рацемической формы этого лекарственного средства. Был получен и испытан S-энантиомер, который оказался ответственным за нервно-мышечную токсичность. Результаты представлены в табл. 5. Тест F. Оценка R-энантиомера соединения 22b и R-энантиомера соединения 22 с по отношению к аденокарциноме молочной железы-16/С ранней стадии. В этом испытании сравнивали R-энантиомеры соединения 22 с и соединения 22b. Оба эти соединения совершенно не показали нервно-мышечной токсичности. Летальные дозоограничивающие токсичности этих соединений подобны (повреждение эпителия ЖКТ). Самок мышей С 3 Н получили в N.C.1 (Д.Р. 22 января 2001; Д.П. 27 января 2001). Средний вес мышей составил 19,2 г. Мышам имплантировали SC аденокарциному молочной железы-16/С пассаж-170, которая представляет собой быстрорастущую, высокоинвазивную, высокометастатическую опухоль (Д.И. 8 марта 2001; величина Td составила 1,2 дня). Каждый из R-энантиомеров, соединения 22 с и соединения 22b, суспендировали в 3% этаноле, 1% РОЕ-80, 0,5% бикарбонате натрия (объемн.) с получением раствора, затем добавили P.В.S. и довели рН до 7 соляной кислотой. Адриамицин (ADRIA; партия 20338 с) суспендировали в дистиллированной воде с получением раствора и довели рН до 6,0. Мышам вводили 0,2 мл на в/в-инъекцию. В клетке 1 животные не получали лечения, и рост опухоли соответствовал ожидаемому. Опухоли достигли 1000 мг на 9,5-й день (в диапазоне 7-12) (Td = 1,0 день). В клетке 2 мышам вводили R-энантиомер соединения 22 с внутривенно при 65 мг/кг/инъекцию в дни 1-4 до общей дозы 260 мг/кг. После инъекций нервно-мышечная токсичность не наблюдалась. Все мыши погибли через 2-3 дня после последней обработки от повреждения эпителия ЖКТ. В клетке 3 мышам вводили R-энантиомер соединения 22 с внутривенно при 65 мг/кг/инъекцию через день (в дни 1, 3, 5, 7) до общей дозы 260 мг/кг. Для этой серии аналогов наблюдалось очень быстрое восстановление хозяев и отсутствие смертей. Мыши показали потерю веса тела -8,3% (самое низкое значение на 9-й день и полное восстановление на 12-й), что означает, что общая доза при таком прерывистом графике лечения была адекватной и не избыточной. При таком графике нервно-мышечная токсичность также не наблюдалась. Эта доза была активной (Т/С = 4%; логарифм убивания 1,7; рейтинг активности ). В клетке 4 мышам вводили R-энантиомер соединения 22 с внутривенно при 40 мг/кг/инъекцию по тому же графику, что и в клетке 3 (т.е. в дни 1, 3, 5, 7) до общей дозы 160 мг/кг. Токсичность не наблюдалась, и мыши во время лечения набрали вес (+6,4% прибавки в весе). Эта доза также была активной (Т/С = 9%; логарифм убивания 1,4; 1/5 излечений; рейтинг активности , если не учитывать излечения). Мышам с исчезнувшей опухолью снова имплантировали опухоль Маm16/С на 155-й день. Имплантат успешно вырос, что показывает, что иммуногенные факторы в предыдущем излечении не участвовали. В клетке 5 мышам вводили R-энантиомер соединения 22b внутривенно при 50 мг/кг/ин. в дни 1-5 до общей дозы 250 мг/кг. Нервно-мышечная токсичность после инъекций не наблюдалась. Эта доза вызвала чрезмерную потерю веса, но без смертей. Мыши снова набрали весь потерянный вес в течение 5 дней (-22,9% потери веса тела на 8-й день, полное восстановление на 13-й день, показывающее, что потеря веса отчасти была обусловлена обезвоживанием). Эта доза была высокоактивной (Т/С = 0%; логарифм убивания 2,1; рейтинг активности ). В клетке 6 мышам вводили R-энантиомер соединения 22b внутривенно при 50 мг/кг/инъекцию в дни 1, 3, 5, 7 до общей дозы 200 мг/кг. Эта доза оказалась хорошо переносимой и не вызвала потери веса. Она была активной (Т/С = 5%; логарифм убивания 1,7; рейтинг активности ). Вероятно, при таком графике могла быть введена более высокая доза, учитывая отсутствие потери веса. В клетке 7 мышам вводили R-энантиомер соединения 22b внутривенно при 30 мг/кг/инъекцию по тому же графику, что и в клетке 6, до общей дозы 120 мг/кг. Мыши набрали вес. Эта доза была умеренно активной (Т/С = 32%; логарифм убивания 0,8; рейтинг активности +). В клетке 11 мышам вводили адриамицин в качестве положительного контрольного опыта. По данным за прошлый период, адриамицин представляет собой одно из наиболее активных средств против таких опухолей. 7,5 мг/кг/инъекцию вводили внутривенно в дни 1 и 5, до общей дозы 15 мг/кг. Хотя по-8 007205 тери веса не наблюдалось, мыши не начинали набирать вес до 11-го дня, а потом начали набирать лишь умеренно. В этой группе была одна замедленная смерть, обусловленная лекарством. Как и ожидалось, это средство оказалось высокоактивным (Т/С = 0%; логарифм убивания 3,6; рейтинг активности , хотя при токсичной дозе). При дозах, которые вызывали менее 10% потери веса тела, R-энантиомер соединения 22b и Rэнантиомер соединения 22 с были одинаково активными, с логарифмом убивания 1,7 для каждого (см. клетки 3 и 6). При одинаковой активности доз R-энантиомер соединения 22b показал потребность в несколько более низкой дозе (200 мг/кг - см. клетку 6), чем R-энантиомер соединения 22 с (260 мг/кг - см. клетку 4). Результаты представлены в табл. 6. Тест G. Оценка R-энантиомеров соединений 22 с и 22b по отношению к дуктальной аденокарциноме 03 поджелудочной железы поздней стадии. В этом испытании сравнивали R-энантиомеры соединения 22 с и соединения 22b. Самок мышей BDFl получали в N.С.L, CRL-Ral (Д.P. 26 февраля 2001; Д.П. 10 марта 2001). Мыши имели средний вес 22,5 г. Мышам имплантировали SC дуктальную аденокарциному-03 поджелудочной железы, пассаж 143. (Д.И. 29 мая 2001; Td = 2,3 дня).(объемн.) с получением раствора. Затем добавили дистиллированную воду и довели рН до 7 соляной кислотой. Мышам вводили 0,2 мл на в/в-инъекцию. R-энантиомер соединения 22b суспендировали в 3% этаноле, 1% РОЕ-80, 0,5% бикарбонате натрия (объемн.) с получением раствора. Затем добавили дистиллированную воду и довели рН до 7,5 соляной кислотой. Мышам вводили 0,2 мл на в/в-инъекцию или перорально(РО). Адриамицин (производство ADRIA; партия 2033 ВС) суспендировали в дистиллированной воде с получением раствора, при рН 6.0. Мышам вводили 0,2 мл на внутривенную инъекцию. Лечение начали через 6 дней после имплантации, в это время опухоли имели пальпируемый размер(в среднем 126 мг). Лечение было длительным (18 дней), для того чтобы выявить четкие различия в эффективности соединений. В клетке 1 животные не получали лечения, и рост опухоли соответствовал ожидаемому. Опухоли достигли 1000 мг на 16,5 день (в диапазоне 15-21; Td = 2,3 дней). В клетке 2 мышам вводили соединение 22b (R-энантиомер) внутривенно при 80 мг/кг/инъекцию по прерывистому графику (1 раз в день, в дни 6, 9, 12, 15, 18, 21, 24) до общей дозы 560 мг/кг. Такой курс оказался хорошо переносимым и не вызвал ни потери веса, ни смертей. Мыши были возбуждены после в/в-инъекций, но это состояние продолжалось лишь несколько минут. Нервно-мышечная токсичность при применении R-энантиомера не наблюдалась. Эта доза была активной (логарифм убивания 2,3, PR 2/7, рейтинг активности ). Эта дозировочная схема явно оказалась хуже для соединения 22 с (Rэнантиомер). В клетке 3 мышам вводили соединение 22b (R-энантиомер) внутривенно при 50 мг/кг/ин. по прерывистому графику (1 раз в день, в дни 6, 9, 12, 15, 18, 21, 24) до общей дозы 350 мг/кг. Такой курс оказался хорошо переносимым и не вызвал ни потери веса, ни смертей. Эта доза была активной (логарифм убивания 1,5, CR 1/6, рейтинг активности ). В клетке 4 мышам вводили соединение 22b (R-энантиомер) внутривенно при 31 мг/кг/ин. по прерывистому графику (1 раз в день, в дни 6, 9, 12, 15, 18, 21, 24) до общей дозы 217 мг/кг. Такой режим оказался хорошо переносимым, с существенной прибавкой в весе. Эта доза была неактивной (логарифм убивания 0,5, рейтинг активности -). В клетке 5 мышам вводили соединение 22b (R-энантиомер) SC при 31,2 мг/кг/ин. по ежедневному графику (в дни 6-24) до общей дозы 592,8 мг/кг. Режим оказался хорошо переносимым, лишь с небольшой потерей веса и без смертей. Мыши не показывали возбуждения после SC инъекций. Эта доза была лишь умеренно активной (логарифм убивания 0,9, CR 1/5, рейтинг активности +). Одной мыши, у которой исчезла опухоль, повторно имплантировали 30 мг фрагментов опухоли Р 03 в день 157. Имплантат вырос, что показывает, что иммуногенные факторы в предыдущем излечении не участвовали. Такой ежедневный график SC инъекций явно оказался хуже прерывистого графика в/в инъекций (сравните с клеткой 2). В клетке 6 мышам вводили соединение 22b (R-энантиомер) SC при 19,5 мг/кг/ин. по ежедневному графику (в дни 6-24) до общей дозы 370,5 мг/кг. Режим оказался хорошо переносимым, без потери веса и без смертей. Мыши не показывали возбуждения после SC инъекций. Эта доза была неактивной(логарифм убивания 0,4, рейтинг активности -). Такой ежедневный график SC-инъекций явно оказался хуже прерывистого графика в/в-инъекций (сравните с клеткой 3). В клетке 12 мышам вводили соединение 22 с (R-энантиомер). В наличии было лишь ограниченное количество лекарственного средства, поэтому испытывали только один уровень внутривенной дозировки, и можно было использовать только четырех мышей на группу. Соединение 22 с вводили в/в при 80 мг/кг/ин. по прерывистому графику (1 раз в день, в дни 6, 9, 12, 15, 18, 21) до общей дозы 480 мг/кг. Инъекцию в 24-й день отменили, поскольку запас лекарства был исчерпан. Режим оказался хорошо перено-9 007205 симым, без потери веса и без смертей. Мыши были возбуждены после в/в инъекции, но это состояние продолжалось лишь несколько минут. Для этого аналога соединения наблюдалось несколько большее возбуждение, чем для соединения 22b. Нервно-мышечная токсичность при применении R-энантиомера не была отмечена. Эта доза была высокоактивной (логарифм убивания 3,1, 3/4 полных регрессий, рейтинг активности ). Этот дозировочный график для соединения 22 с был заметно лучше, чем для соединения 22b, по отношению к этой дукатальной аденокарциноме поджелудочной железы. В клетке 13 мышам вводили адриамицин в качестве положительного контрольного опыта. По данным за прошлый период, адриамицин является высокоактивным средством против такой опухоли. 7,5 мг/кг/инъекцию вводили внутривенно в дни 6 и 14 до общей дозы 15 мг/кг (близко к максимальной переносимой дозе). Эта доза в данном испытании оказалась хорошо переносимой, без потери веса и без смертей. Как и ожидалось, это средство оказалось высокоактивным (логарифм убивания 2,3; CR 1/5, рейтинг активности ).R-энантиомер соединения 22 с заметно превосходил соединение 22b при прерывистом графике в/в инъекций. Прерывистый график в/в инъекций явно оказался лучше графика ежедневного орального введения. Результаты представлены в табл. 7. Тест Н. Оценка R-энантиомеров ХК-469, соединения 22b и соединения 22 с по отношению к прогрессирующей карциноме толстой кишки 26 у самок мышей Balb/c. В этом испытании сравнивали активность R-энантиомеров ХК-469, соединения 22 с и соединения 22b по отношению к прогрессирующей карциноме толстой кишки 26 у самок мышей Balb/c. Соединение 22 с было заметно более активным, чем соединение 22b или соединение ХК 469 по отношению к этой карциноме. В клетке 2 применяли 22b при 400 мг/кг, а в клетке 4 применяли 22 с при 400 мг/кг. Обе дозы оказались токсичными и исключены из данной таблицы.Звездочка означает, что опухоль была высокометастатической и токсической и вызывала существенную потерю веса тела. В группах лечения потерю веса определяли до того, как опухоль оказывала существенное воздействие. Дозы соединений XK469-R, 22b и 22 с готовили одинаково, с использованием 3% этанола, 1%РОЕ 80 и 0,5% бикарбоната натрия. Объем инъекций составлял 0,2 мл/мышь в/в. Цитоксан готовили в дистиллированной воде и вводили в/в в объеме 0,2 мл/мышь. Мыши представляли собой самок Balb/c: DOB 2/12/01; DOA 3/27/01; DOT 8/8/01, со средним весом тела 24,7 г в начале применения Rx. Опухоль представляла собой карциному толстой кишки-26, пассаж 141; дата имплантации 8/8/01, двусторонняя SCимплантация 30-60-мг фрагментов. Все опухоли имели размер от 63 до 171 мг на 6-й день, день первого лечения Rx. В клетке 1: контрольная группа; рост соответствовал ожидаемому, Td 1,7 дней. В клетке 3: 22b: 50 мг/кг/инъекцию вводили в/в в дни 6, 8, 10, 13 и 15 до общей дозы 250 мг/кг. Это обеспечило 1/6 полных регрессий и логарифм убивания 1,4 (рейтинг активности ). В клетке 5: 22 с: 50 мг/кг/инъекцию вводили в/в в дни 6, 8, 10, 13 и 15 до общей дозы 250 мг/кг. Это обеспечило 3/6 полных регрессий и 3/6 выживших мышей с исчезнувшей опухолью на 55-й день. Эти мыши остались в отличном состоянии, увеличили вес и размер скелета. Им имплантировали 30-мг фрагменты карциномы толстой кишки 26 в 156-й день. Имплантаты успешно выросли, что показывает,что иммуногенные факторы в предыдущем излечении не участвовали (рейтинг активности ). В клетке 6: XK469-R: 80 мг/кг/инъекцию вводили в/в в дни 6, 8,10, 14 и 16 до общей дозы 400 мг/кг (по данным за прошлый период, MTD (максимальная переносимая доза) находится в диапазоне 400-450 мг/кг). Регрессий не было. Эта доза обусловила логарифм убивания 0,9 (рейтинг активности +). В клетке 7: XK469-R: 50 мг/кг/инъекцию вводили в/в в дни 6, 8, 10, 13 и 15 до общей дозы 250 мг/кг. Эта доза была неактивной. В клетке 8: Вводили в/в цитоксан при 110 мг/кг на инъекцию в дни 6 и 10 до общей дозы 220 мг/кг. Существенной активности отмечено не было. По данным за прошлый период, цитоксан активен по отношению к этой опухоли, если лечение начато в 1 день (на следующий день после имплантации). Результаты представлены в табл. 8. Далее изобретение проиллюстрировано при помощи 20 неограничивающих примеров. Пример 1. Синтез [4-[(7-замещенных-2-хинолинил)окси]фенокси]пропионовых кислот (схемы I-III). На схеме I показано получение в одном реакторе транс-3-этоксиакрилоилхлорида (4) путем реакции этилвинилового эфира (2) и оксалилхлорида (3), с последующим декарбоксилированием, описанное в(патент США 4710507) для получения транс-N-(4-бром-3-метилфенил)-3-этоксипропенамида. Циклизацию последнего с получением смеси 5-(8 а-3) и 7-замещенных хинилоин-2-олов (7 а-е) осуществляли в концентрированной серной или соляной кислоте (Campbell and Roberts). Эту смесь, в свою очередь, превращали в соответствующие производные 2-хлорихинолина (9 а-е) и (10 а-е) путем орошения с оксихлоридом фосфора (Campbell and Roberts). Основное количество 7-замещенных производных (9 а-е) отделяли от региоизомеров (10 а-е) фракционной кристаллизацией.- 10007205 Из остатка получали дополнительное количество 9 а-с при помощи колоночной хроматографии на силикагеле. Схема I Как показано на схеме II, 2-хлорхинолины 9 а-е соединяли с 2-(4-гидроксифенокси) пропионовой кислотой (20) с использованием NaH или K2CO3 при орошении DMF с последующим ацилированием для получения кислот (21 а-е). Эти кислоты могут быть также превращены в их соли с металлами (22 а-е) реакцией с гидроксидами металлов. Соединение ХК 469, которое имеет стереогенный центр в положении С-2 группы пропионовой кислоты, обычно получают в форме рацемической смеси. R-(+)-формы соединений 21b и 21 с получали этерификацией серийно выпускаемой R-(+)-2-(4-гидроксифенокси) пропионовой кислоты с 9b и с. Хиральная HPLC R-форм соединений 21b и с показывает, что оба они были получены с 99% чистоты (см. фиг. 1).HPLC-разделение рацемической и R-форм 21b проводили с использованием ASTEC Chirobiotic T 2504,6 мм, 65% H2O, 35% CH3OH, 20 мМ NH4NO3, при 1 мл/мин, с обнаружением при 250 нм. Общие экспериментальные процедуры К раствору 7-замещенного-2-хлорхинолина и 2-(4-гидроксифенокси)пропионовой кислоты (1 экв.) вDMF (5 мл/ммоль) добавили порциями (60%) NaH (3 экв.) и нагревали смесь при слабом орошении в течение 2 ч. После охлаждения ее концентрировали с получением твердого вещества, к которому добавили воду и раствор профильтровали через целит, а затем промыли водой. Фильтрат экстрагировали эфиром и водный слой подкислили 1M HCl до рН 3-4. После охлаждения твердое вещество собрали, высушили,растворили в AcOEt и профильтровали через силикагель. Фильтрат концентрировали до малого объема,твердое вещество собрали и перекристаллизовали из AcOEt-гептана. Реакция может быть также проведена с использованием K2CO3 (2,5 экв.) вместо NaH, но время реакции в этом случае должно быть увеличено до 12 ч. 2-[4-[(7-Фтор-2-хинолинил)окси]фенокси]пропионовая кислота 21 а (0,14 г, 43% с использованиемR-(+)-2-[4-[(7-xлop-2-xинoлинил)oкcи]фeнoкcи]пpoпиoнoвyю кислоту получали из серийно выпускаемой R-(+)-2-(4-гидроксифенокси)пропионовой кислоты. Продукт был идентичен во всех отношениях рацемическому продукту и показывал вращение плоскости поляризации света []25 +19 С 0,5, 0,1NR-(+)-2-[4-[(7-Бpoм-2-хинолинил)окси]фенокси]пропионовую кислоту получали из серийно выпускаемой R-(+)-2-(4-гидроксифенокси)пропионовой кислоты. Продукт был идентичен во всех отношениях рацемическому продукту и показывал вращение плоскости поляризации света []25 +22,0 С 0,5, 0,1NHz, 3H). 13C ЯМР (100 MHz, DMSO-d6)174,0, 162,9, 161,5, 155,1, 148,3, 147,7, 140,5, 129,5, 123,4, 120,9,117,5, 116,1, 110,5, 107,0,72,5,56,1, 19,1. MS (EI) m/z (%) 339 (M+ ,62), 323 (10), 294 (8), 280 (13), 266 (35),250 (13), 175 (7), 158 (100), 142 (18), 115 (10), 77 (6). HRMS (EI) m/z 339,1105 (M+, рассч. для C19H17NO5 339,1107). Пример 2. Ниже приведены примеры лекарственных форм, содержащих соединение формулы I (соединение Х), для терапевтического или профилактического использования для людей.(i) Таблетка 1 Соединение Х Лактоза Повидон Натрия кроскармеллоза Микрокристаллическая целлюлоза(ii) Таблетка 2 Соединение X Микрокристаллическая целлюлоза Крахмал Крахмал-гликолят натрия Стеарат магния(iii) Капсула Соединение Х Коллоидный диоксид кремния Лактоза Пептизированный крахмал Стеарат магния(iv) Раствор для инъекций 1 (1 мг/мл) Соединение X (в форме свободной кислоты) Двухосновный фосфат натрия Одноосновный фосфат натрия Хлорид натрия 1,0H раствор гидроксида натрия (для доведения рН до 7,0-7,5) Стеарат магния(v) Раствор для инъекций 2 (10 мг/мл) Соединение X (в форме свободной кислоты) Одноосновный фосфат натрия Двухосновный фосфат натрия Полиэтиленгликоль 400 01H раствор гидроксида натрия (для доведения рН до 7,0-7,5) Стеарат магния(vi) Аэрозоль Соединение X Олеиновая кислота Трихлормонофторметан Дихлордифторметан Дихлортетрафторэтан мг/мл 1,0 12,0 0,7 4,5 Сколько необходимо Сколько необходимо до 1 мл мг/мл 10,0 0,3 1,1 200,0 Сколько необходимо Сколько необходимо до 1 мл мг/упаковку 20,0 10,0 5000,0 10000,0 5000,0 Приведенные выше составы могут быть получены при помощи обычных процедур, хорошо известных в фармацевтике. Все публикации, патенты и патентные документы включены в данную заявку в виде ссылки, как если бы они были включены по отдельности. Изобретение было описано выше на основе различных специфических и предпочтительных вариантов осуществления и методик. Однако следует понимать, что в нем могут быть произведены различные вариации и модификации, которые не выходят за рамки области изобретения. где Y представляет собой F, Cl, Br, метил или метокси; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где Y представляет собой F. 3. Соединение по п.1, где Y представляет собой Cl. 4. Соединение по п.1, где Y представляет собой Br. 5. Соединение по п.1, где Y представляет собой -OMe. 6. Соединение по п.1, где Y представляет собой метил. 7. Соединение по любому из пп.1-6, в котором углерод, несущий метильную группу, находится в(R) конфигурации. 8. Соединение по любому из пп.1-6, в котором углерод, несущий метильную группу, находится в(S) конфигурации. 9. Соединение по п.1, которое представляет собой 2-[4-(7-хлорхинолин-2-илокси) фенокси]пропионовую кислоту. 10. Соединение по п.1, которое представляет собой (R) 2-[4-(7-хлорхинолин-2-илокси) фенокси]пропионовую кислоту. 11. Композиция для лечения рака у млекопитающих, включающая соединение по любому из пп.110 в сочетании с фармацевтически приемлемым разбавителем или носителем. 12. Соединение по любому из пп.1-10 для использования в медикаментозном лечении. 13. Применение соединения по любому из пп.1-10 для производства лекарственного средства для лечения рака у млекопитающего. 14. Терапевтический способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по любому из пп.1-10.
МПК / Метки
МПК: C07D 215/22, A61P 35/00, A61K 31/47
Метки: производные, хинолина, качестве, средств, противоопухолевых, использование
Код ссылки
<a href="https://eas.patents.su/18-7205-proizvodnye-hinolina-i-ih-ispolzovanie-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина и их использование в качестве противоопухолевых средств</a>
Предыдущий патент: Идрапаринукс для лечения и вторичной профилактики случаев венозной тромбоэмболии у пациентов с тромбозом глубоких вен
Следующий патент: Растворитель для нанесения химических соединений на древесину
Случайный патент: Бициклические гетероциклы и фармацевтические композиции, содержащие эти соединения