17α-фторалкилстероиды, способ их получения и содержащие эти соединения фармацевтические композиции
Номер патента: 5772
Опубликовано: 30.06.2005
Авторы: Вирва Ральф, Элгер Вальтер, Кауфманн Гюнтер, Ринг Свен
Формула / Реферат
1. 17a-фторалкилстероиды общей формулы I
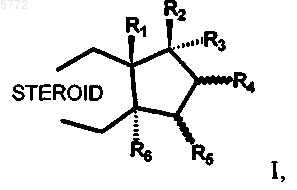
в которой R1 представляет собой C1-C4алкильную группу;
R2 представляет собой гидроксигруппу, группу OC(O)-R20 или OR21, где R20 и R21 обозначают C1-C12алкильную группу, C3-C8циклоалкильную группу, арильную группу или арил-C1-C4алкильную группу;
R3 представляет собой остаток формулы CnF2n+1, где n обозначает 1, 2, 3, 4, 5 или 6;
R4 и R5 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;
R5 и R6 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик,
STEROID представляет собой стероидную ABC-циклическую систему субформул A, B, C, D, E и F

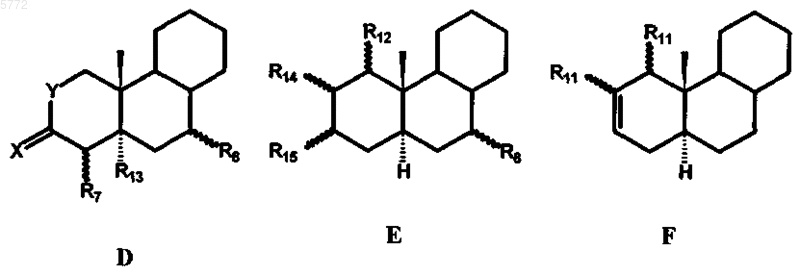
при этом в формулах A и C в положении 1,2 может находиться дополнительная двойная связь, а в формуле B в положении 8,9 и в положении 11, 12 могут находиться одна или две дополнительные двойные связи;
R7 представляет собой атом водорода, атом галогена, гидроксильную группу или трифторметильную группу;
X обозначает атом кислорода или два атома водорода;
R8 представляет собой атом водорода, метильную или этильную группу;
R9 представляет собой атом водорода либо атом галогена или вместе с R10 образует двойную связь;
R10 представляет собой атом водорода, гидроксильную группу, метильную либо этильную группу или вместе с R9 образует двойную связь;
R11 представляет собой атом водорода, C1-C4алкильную группу, нитрильную группу, гидроксиметиленовую или формильную группу;
R12 представляет собой атом водорода, C1-C4алкильную группу или нитрильную группу;
R11 и R12 наряду с вышеуказанными значениями вместе образуют метиленовый мостик;
R13 представляет собой атом водорода или вместе с R7 образует двойную связь;
R14 и R15 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо, [2,3c]оксадиазольное кольцо, [3,2c]изоксазольное кольцо или [3,2c]пиразольное кольцо;
Y обозначает атом кислорода или азота;
при этом волнистые линии y R7, R8, R11, R12, R13, R14 и R15 означают, что данные заместители могут находиться в a- либо b-положении, за исключением соединений из группы, включающей
17b-гидрокси-17a-трифторметиландрост-4-ен-3-он,
17b-гидрокси-17a-трифторметилэстр-4-ен-3-он,
17b-гидрокси-17a-трифторметилэстр-4,9-диен-3-он,
17b-гидрокси-17a-трифторметилэстр-4,9,11-триен-3-он,
13-этил-17b-гидрокси-17a-трифторметилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-трифторметилгон-4,9-диен-3-он и
13-этил-17b-гидрокси-17a-трифторметилгон-4,9,11-триен-3-он.
2. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы A.
3. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы B.
4. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы C.
5. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы D.
6. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы E.
7. 17a-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы F.
8. 17a-фторалкилстероиды по любому из пп.1-7, при этом R1 представляет собой метильную группу.
9. 17a-фторалкилстероиды по любому из пп.1-8, при этом R2 представляет собой гидроксигруппу, формилоксигруппу, ацетилоксигруппу, пропионилоксигруппу, бутирилоксигруппу, [(транс-4-бутилциклогексил)карбонил]оксигруппу, фенилпропионилоксигруппу, изобутирилоксигруппу, гептанилоксигруппу или ундеканилоксигруппу.
10. 17a-фторалкилстероиды по любому из пп.1-9, при этом R3 представляет собой трифторметильную группу или пентафторэтильную группу.
11. 17a-фторалкилстероиды по любому из пп.1-3 и 8-10, при этом R8 представляет собой метильную группу.
12. 17a-фторалкилстероиды по любому из пп.1-5 и 8-11, при этом R7 представляет собой атом фтора, хлора либо брома или трифторметильную либо гидроксигруппу.
13. 17a-фторалкилстероиды по любому из пп.1, 2 и 8-11, при этом R10 представляет собой гидроксигруппу.
14. 17a-фторалкилстероиды по любому из пп.1, 2 и 8-12, при этом R9 представляет собой атом фтора.
15. 17a-фторалкилстероиды по любому из пп.1, 4, 7 и 12, при этом R11 представляет собой гидроксиметиленовую группу или формильную группу.
16. 17a-фторалкилстероиды по любому из пп.1, 5, 11 и 12, при этом Y обозначает атом кислорода.
17. 17a-фторалкилстероиды по п.1 из группы, включающей
17b-гидрокси-17a-трифторметил-7a-метиландрост-4-ен-3-он,
17b,4-дигидрокси-17a-трифторметиландрост-4-ен-3-он,
17b-гидрокси-17a-трифторметил-4-хлорандрост-4-ен-3-он,
17b-гидрокси-17a-трифторметил-4-бромандрост-4-ен-3-он,
17b-гидрокси-17a,4-бис(трифторметил)андрост-4-ен-3-он,
17b, 11b-дигидрокси-17a-трифторметиландрост-4-ен-3-он,
17b, 11b-дигидрокси-17a-трифторметил-9a-фторандрост-4-ен-3-он,
17b-гидрокси-17a-трифторметиландрост-1,4-диен-3-он,
17b-гидрокси-17a-трифторметил-4-хлорандрост-1,4-диен-3-он,
17b,4-дигидрокси-17a-трифторметиландрост-1,4-диен-3-он,
17b-гидрокси-17a-трифторметил-7a-метиландрост-1,4-диен-3-он,
17b-гидрокси-17a-трифторметил-7a-метил-4-хлорандрост-1,4-диен-3-он,
17b-гидрокси-17a-пентафторэтиландрост-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метиландрост-4-ен-3-он,
17b,4-дигидрокси-17a-пентафторэтиландрост-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-4-хлорандрост-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-4-бромандрост-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-4-трифторметиландрост-4-ен-3-он,
17b, 11b-дигидрокси-17a-пентафторэтиландрост-4-ен-3-он,
17b, 11b-дигидрокси-17a-пентафторэтил-9a-фторандрост-4-ен-3-он,
17b-гидрокси-17a-пентафторэтиландрост-1,4-диен-3-он,
17b-гидрокси-17a-пентафторэтил-4-хлорандрост-1,4-диен-3-он,
17b,4-дигидрокси-17a-пентафторэтиландрост-1,4-диен-3-он,
17b-гидрокси-17a-пентафторэтил-4-трифторметиландрост-1,4-диен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метиландрост-1,4-диен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метил-4-хлорандрост-1,4-диен-3-он,
17b-гидрокси-17a-трифторметил-7a-метилэстр-4-ен-3-он,
17b,4-дигидрокси-17a-трифторметилэстр-4-ен-3-он,
17b-гидрокси-17a-трифторметил-4-хлорэстр-4-ен-3-он,
17b-гидрокси-17a-трифторметил-4-бромэстр-4-ен-3-он,
17b-гидрокси-17a,4-бис(трифторметил)эстр-4-ен-3-он,
17b-гидрокси-17a-трифторметил-7a-метилэстр-4,9-диен-3-он,
17b-гидрокси-17a-трифторметил-7a-метилэстр-4,9,11-триен-3-он,
17b-гидрокси-17a-пентафторэтилэстр-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метилэстр-4-ен-3-он,
17b,4-дигидрокси-17a-пентафторэтилэстр-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-4-хлорэстр-4-ен-3-он,
17b-гидрокси-17a-пентафторэтил-4-бромэстр-4-ен-3 -он,
17b-гидрокси-17a-пентафторэтил-4-трифторметилэстр-4-ен-3-он,
17b-гидрокси-17a-пентафторэтилэстр-4,9-диен-3-он,
17b-гидрокси-17a-пентафторэтилэстр-4,9,11-триен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метилэстр-4,9-диен-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метилэстр-4,9,11-триен-3-он,
13-этил-17b-гидрокси-17a-трифторметил-4-хлоргон-4-ен-3-он,
13-этил-17b,4-дигидрокси-17a-трифторметилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-трифторметил-7a-метилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-трифторметил-7a-метилгон-4,9-диен-3-он,
13-этил-17b-гидрокси-17a-трифторметил-7a-метилгон-4,9,11-триен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтил-7a-метилгон-4-ен-3-он,
13-этил-17b,4-дигидрокси-17a-пентафторэтилгон-4-ен-3-он,
13 -этил-17b-гидрокси-17a-пентафторэтил-4-хлоргон-4-ен-3-он,
13 -этил-17b-гидрокси-17a-пентафторэтил-4-бромгон-4-ен-3-он,
13 -этил-17b-гидрокси-17a-пентафторэтил-4-трифторметилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтилгон-4,9-диен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтилгон-4,9,11-триен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтил-7a-метилгон-4,9-диен-3-он,
13-этил-17b-гидрокси-17a-пентафторэтил-7a-метилгон-4,9,11-триен-3-он,
17b-гидрокси-17a-трифторметил-5a-андростан-3-он,
17b-гидрокси-17a-пентафторэтил-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-7a-метил-5a-андростан-3-он,
17b-гидрокси-17a-пентафторэтил-7a-метил-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-2-гидроксиметилен-5a-андростан-3-он,
17b-гидрокси-17a-пентафторэтил-2-гидроксиметилен-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-2a-метил-5a-андростан-3-он,
17b-гидрокси-17a-пентафторэтил-2a-метил-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-1a-метил-5a-андростан-3 -он,
17b-гидрокси-17a-пентафторэтил-1a-метил-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-5a-андрост-2-ен,
17b-гидрокси-17a-пентафторэтил-5a-андрост-2-ен,
17b-гидрокси-17a-трифторметил-2-метил-5a-андрост-2-ен,
17b-гидрокси-17a-пентафторэтил-2-метил-5a-андрост-2-ен,
17b-гидрокси-17a-трифторметил-2-циано-5a-андрост-2-ен,
17b-гидрокси-17a-пентафторэтил-2-циано-5a-андрост-2-ен,
17b-гидрокси-17a-трифторметил-2-формил-5a-андрост-2-ен,
17b-гидрокси-17a-пентафторэтил-2-формил-5a-андрост-2-ен,
17b-гидрокси-17a-трифторметил-[2,3c]оксадиазол-5a-андростан,
17b-гидрокси-17a-пентафторэтил-[2,3c]оксадиазол-5a-андростан,
17b-гидрокси-17a-трифторметил-[3,2c]изоксазол-5a-андростан,
17b-гидрокси-17a-пентафторэтил-[3,2c]изоксазол-5a-андростан,
17b-гидрокси-17a-трифторметил-[3,2c]пиразол-5a-андростан,
17b-гидрокси-17a-пентафторэтил-[3,2c]пиразол-5a-андростан,
17b-гидрокси-17a-трифторметил-2b,3b-эпитио-5a-андростан,
17b-гидрокси-17a-пентафторэтил-2b,3b-эпитио-5a-андростан,
17b-гидрокси-17a-трифторметил-2a,3a-эпитио-5a-андростан,
17b-гидрокси-17a-пентафторэтил-2a,3a-эпитио-5a-андростан,
17b-гидрокси-17a-трифторметил-2-окса-5a-андростан-3-он,
17b-гидрокси-17a-пентафторэтил-2-окса-5a-андростан-3-он,
17b-гидрокси-17a-трифторметил-5a-андрост-1-ен-3-он,
17b-гидрокси-17a-пентафторэтил-5a-андрост-1-ен-3-он,
17b-гидрокси-17a-трифторметил-1-метил-5a-андрост-1-ен-3-он,
17b-гидрокси-17a-пентафторэтил-1-метил-5a-андрост-1-ен-3-он,
17b-гидрокси-17a-трифторметил-2-метил-5a-андрост-1-ен-3-он и
17b-гидрокси-17a-пентафторэтил-2-метил-5a-андрост-1-ен-3-он.
18. Способ получения 17a-фторалкилстероидов общей формулы I по п.1, отличающийся тем, что соединения общей формулы II
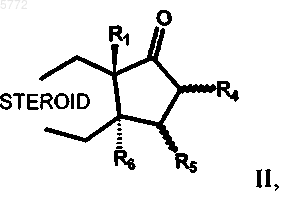
в которой R1, R4, R5, R6 и STEROID имеют значения, указанные в п.1, в присутствии фторида подвергают взаимодействию с перфторалкилтриалкилсиланами (Alk)3SiCnF2n+1 или с фторалкиллитием LiCnF2n+1, соответственно со фторалкильными реактивами Гриньяра ZMgCnF2n+1, где n обозначает 1, 2, 3, 4, 5 или 6, Z обозначает атом хлора, брома или иода и Alk обозначает C1-C4алкил.
19. Фармацевтические композиции, содержащие в своем составе по меньшей мере один 17a-фторалкилстероид общей формулы I по любому из пп.1-17, при необходимости вместе с фармацевтически приемлемыми вспомогательными веществами и носителями.
20. 17a-фторалкилстероиды общей формулы I по любому из пп.1-17 для применения в качестве терапевтического активного вещества.
21. Применение 17a-фторалкилстероидов общей формулы I
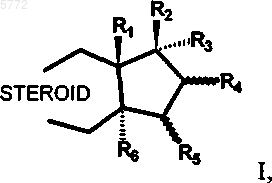
в которой R1 представляет собой C1-C4алкильную группу;
R2 представляет собой гидроксигруппу, группу OC(O)-R20 или OR21, где R20 и R21 обозначают C1-C12алкильную группу, C3-C8циклоалкильную группу, арильную группу или арил-C1-C4алкильную группу;
R3 представляет собой остаток формулы CnF2n+1, где n обозначает 1, 2, 3, 4, 5 или 6;
R4 и R5 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;
R5 и R6 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;
STEROID представляет собой стероидную ABC-циклическую систему субформул A, B, C, D, E и F
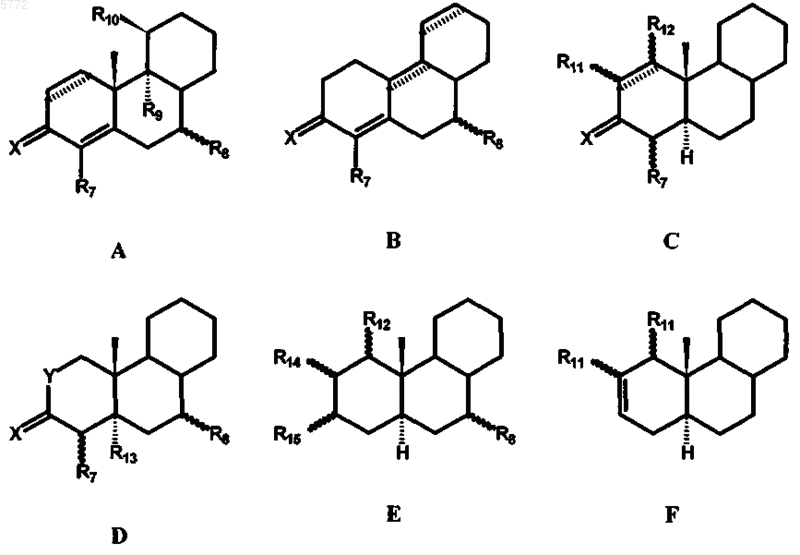
при этом в формулах A и C в положении 1, 2 может находиться дополнительная двойная связь, а в формуле B в положении 8, 9 и в положении 11, 12 могут находиться одна или две дополнительные двойные связи;
R7 представляет собой атом водорода, атом галогена, гидроксильную группу или трифторметильную группу;
X обозначает атом кислорода или два атома водорода;
R8 представляет собой атом водорода, метильную или этильную группу;
R9 представляет собой атом водорода либо атом галогена или вместе с R10 образует двойную связь;
R10 представляет собой атом водорода, гидроксильную группу, метильную либо этильную группу или вместе с R9 образует двойную связь;
R11 представляет собой атом водорода, C1-C4алкильную группу, нитрильную группу, гидроксиметиленовую или формильную группу;
R12 представляет собой атом водорода, C1-C4алкильную группу или нитрильную группу;
R11 и R12 наряду с вышеуказанными значениями вместе образуют метиленовый мостик;
R13 представляет собой атом водорода или вместе с R7 образует двойную связь;
R14 и R15 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо, [2,3c]оксадиазольное кольцо, [3,2c]изоксазольное кольцо или [3,2c]пиразольное кольцо;
Y обозначает атом кислорода или азота;
при этом волнистые линии y R7, R8, R11, R12, R13, R14 и R15 означают, что данные заместители могут находиться в a - либо b -положении, за исключением соединений из группы, включающей
17b-гидрокси-17a-трифторметиландрост-4-ен-3-он,
17b-гидрокси-17a-трифторметилэстр-4-ен-3-он,
17b-гидрокси-17a-трифторметилэстр-4,9-диен-3-он,
17b-гидрокси-17a-трифторметилэстр-4,9,11-триен-3-он,
13-этил-17b-гидрокси-17a-трифторметилгон-4-ен-3-он,
13-этил-17b-гидрокси-17a-трифторметилгон-4,9-диен-3-он и
13-этил-17b-гидрокси-17a-трифторметилгон-4,9,11-триен-3-он,
для получения фармацевтических композиций, предназначенных для контроля репродуктивной способности у мужчин, для гормонзаместительной терапии (ГЗТ) у мужчин и женщин или для лечения обусловленных гормональными факторами заболеваний у мужчин и женщин, таких, например, как эндометриоз, рак молочной железы или гипогонадизм.
Текст
Настоящее изобретение относится к 17-метиленстероидам, к способу их получения и к содержащим эти соединения фармацевтическим композициям. Предлагаемые в изобретении соединения обладают андрогенной активностью. 17-перфторалкилированные соединения эстранового и 13-этилгонанового ряда известны. 17 гидрокси-17-трифторметилэстр-4-ен-3-он, 17-гидрокси-17-трифторметилэстр-4,9-диен-3-он и 17 гидрокси-17-трифторметилэстр-4,9,11-триен-3-он,а также 13-этил-17-гидрокси-17-трифторметилгон-4-ен-3-он, 13-этил-17-гидрокси-17-трифторметилгон-4,9-диен-3-он и 13-этил-17-гидрокси 17-трифторметилгон-4,9,11-триен-3-он описаны в Sci. China, серия В: Chem. 40(3) (1997), cc. 294-301,CN 94-11218, соответственно в Bioorg. Med. Chem. Lett. 5(17) (1995), cc. 1899-1902. Согласно этим публикациям указанные соединения обладают гестагенной активностью. 17-Гидрокси-17 трифторметиландрост-4-ен-3-он описан в заявке WO 9313122 в качестве промежуточного продукта. Что касается 17-пентафторэтилалкилированных стероидов эстранового, соответственно андростанового ряда,то до настоящего времени они не известны. Согласно настоящему изобретению в нем предлагаются 17-фторалкилстероиды общей формулы IR2 представляет собой гидроксигруппу, группу OC(O)-R20 или OR21, где R20 и R21 обозначают С 1 С 12 алкильную группу, С 3-С 8 циклоалкильную группу, арильную группу или арил-С 1-С 4 алкильную группу;R3 представляет собой остаток формулы CnFmH0, где n обозначает 1, 2, 3, 4, 5 или 6, m обозначает число больше 1, а сумма m+о равна 2n+1;R4 и R5 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;R5 и R6 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик, STEROID представляет собой стероидную ABC-циклическую систему субформул А,В, С, D, Е и F при этом в формулах А и С в положении 1,2 может находиться дополнительная двойная связь, а в формуле В в положении 8,9 и в положении 11,12 могут находиться одна или две дополнительные двойные связи;R7 представляет собой атом водорода, атом галогена, гидроксильную группу или трифторметильную группу;X обозначает атом кислорода, два атома водорода или гидроксииминогруппу;R8 представляет собой атом водорода, метильную или этильную группу;R9 представляет собой атом водорода либо атом галогена или вместе с R10 образует двойную связь,10R представляет собой атом водорода, гидроксильную группу, метильную либо этильную группу или вместе с R9 образует двойную связь;R11 представляет собой атом водорода, С 1-С 4 алкильную группу, нитрильную группу, гидроксиметиленовую или формильную группу,-1 005772R12 представляет собой атом водорода, С 1-С 4 алкильную группу или нитрильную группу;R11 и R12 наряду с вышеуказанными значениями вместе образуют метиленовый мостик;R13 представляет собой атом водорода или вместе с R7 образует двойную связь;R14 и R15 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо,[2,3 с]оксадиазольное кольцо, [3,2 с]изоксазольное кольцо или [3,2 с]пиразольное кольцо;Y обозначает атом кислорода или азота; при этом волнистые линии y R7, R8, R11, R12, R13, R14 и R15 означают, что данные заместители могут находиться в - либо -положении, за исключением соединений из группы, включающей 17-гидрокси-17-трифторметиландрост-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4,9-диен-3-он,17-гидрокси-17-трифторметилэстр-4,9,11-триен-3-он,13 -этил-17-гидрокси-17-трифторметилгон-4-ен-3-он,13-этил-17-гидрокси-17-трифторметилгон-4,9-диен-3-он и 13-этил-17-гидрокси-17-трифторметилгон-4,9,11-триен-3-он. Предлагаемые в изобретении соединения обладают андрогенной активностью. Под понятием "С 1-С 4 алкильная группа" согласно настоящему изобретению имеется в виду разветвленная или линейная алкильная группа с 1-4 атомами углерода. В качестве примеров можно назвать метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Под понятием "С 1-С 12 алкильная группа" согласно настоящему изобретению имеется в виду разветвленная или линейная алкильная группа с 1-12 атомами углерода. В качестве примеров можно назвать метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутип, н-пентил, изопентил, н-гексил, 2 метиленпентил, 3-метиленпентил, 2,2-диметилбутил, 2,3-диметилбутил, октил, нонил, децил и ундецил. Вышеназванная С 3-С 8 циклоалкильная группа представляет собой согласно изобретению моно- либо бициклическую группу, такую, например, как циклопропил, циклобутил, циклопентил или циклогексил. Под понятием "арильная группа" согласно настоящему изобретению имеется в виду замещенная или незамещенная арильная группа с 6-15 атомами углерода, например фенильная группа, замещенная фенильная группа, такая как галогенфенильная группа или нитрофенильная группа, или нафтильная группа. Под понятием "арил-С 1-С 4 алкильная группа" согласно настоящему изобретению имеется в виду замещенный арилом алкил, содержащие вместе 7-15 атомов углерода, при этом арил может в свою очередь нести другие заместители, такие, например, как атом галогена. В качестве примера можно назвать свободную либо ароматически замещенную бензильную группу, такую как бензильная группа или галогенбензильная группа. Под понятием "атом галогена" в контексте настоящего описания подразумевается атом фтора, хлора, брома или иода. Остаток формулы CnFmH0, где n обозначает 1, 2, 3, 4, 5 или 6, m обозначает число больше 1, а суммаm+о равна 2n+1, может представлять собой разветвленный или линейный фторалкил с 1-6 атомами углерода, при этом в качестве примеров такого остатка можно назвать трифторметил, пентафторэтил, гептафтор-н-пропил и гептафторизопропил, предпочтительным из которых согласно изобретению является трифторметил или пентафторэтил. Если STEROID представляет собой стероидную циклическую систему субформулы А, то R7 предпочтительно обозначает атом водорода, атом хлора или гидроксигруппу, R10 предпочтительно обозначает атом водорода или гидроксигруппу, a R9 предпочтительно обозначает атом водорода или атом фтора. Если STEROID представляет собой стероидную циклическую систему субформулы В, то R7 предпочтительно обозначает атом водорода, атом хлора или гидроксигруппу, a R8 предпочтительно обозначает атом водорода или метильную группу. Если STEROID представляет собой стероидную циклическую систему субформулы С, то R7 предпочтительно обозначает атом водорода, атом хлора или гидроксигруппу, a R11 предпочтительно обозначает гидроксиметиленовую группу либо формильную группу или R11 и R12 вместе образуют двойную связь. Если STEROID представляет собой стероидную циклическую систему субформулы D, то R7 предпочтительно обозначает атом водорода, атом хлора или гидроксигруппу, R8 предпочтительно обозначает атом водорода или метильную группу, a R13 и R7 вместе образуют предпочтительно двойную связь и Y предпочтительно обозначает атом кислорода. Если STEROID представляет собой стероидную циклическую систему субформулы Е, то R8 предпочтительно обозначает атом водорода или метильную группу, a R14 и R15 предпочтительно образуют вместе тиирановое кольцо или [3,2 с]пиразольное кольцо. Если STEROID представляет собой стероидную циклическую систему субформулы F, то R11 предпочтительно обозначает С 1-С 4 алкильную группу или нитрильную группу.R1 обозначает предпочтительно метильную группу.R3 обозначает предпочтительно трифторметильную группу или пентафторэтильную группу. К особенно предпочтительным относятся следующие 17-фторалкилстероиды: 1) 17-гидрокси-17-трифторметил-7-метиландрост-4-ен-3-он,2) 17,4-дигидрокси-17-трифторметиландрост-4-ен-3-он,3) 17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-он,4) 17-гидрокси-17-трифторметил-4-бромандрост-4-ен-3-он,5) 17-гидрокси-17,4-бис(трифторметил)андрост-4-ен-3-он,6) 17, 11-дигидрокси-17-трифторметиландрост-4-ен-3-он,7) 17, 11-дигидрокси-17-трифторметил-9-фторандрост-4-ен-3-он,8) 17-гидрокси-17-трифторметиландрост-1,4-диен-3-он,9) 17-гидрокси-17-трифторметил-4-хлорандрост-1,4-диен-3-он,10) 17,4-дигидрокси-17-трифторметиландрост-1,4-диен-3-он,11) 17-гидрокси-17-трифторметил-7-метиландрост-1,4-диен-3-он,12) 17-гидрокси-17-трифторметил-7-метил-4-хлорандрост-1,4-диен-3-он,13) 17-гидрокси-17-пентафторэтиландрост-4-ен-3-он,14) 17-гидрокси-17-пентафторэтил-7-метиландрост-4-ен-3-он,15) 17,4-дигидрокси-17-пентафторэтиландрост-4-ен-3-он,16) 17-гидрокси-17-пентафторэтил-4-хлорандрост-4-ен-3-он,17) 17-гидрокси-17-пентафторэтил-4-бромандрост-4-ен-3-он,18) 17-гидрокси-17-пентафторэтил-4-трифторметиландрост-4-ен-3-он,19) 17, 11-дигидрокси-17-пентафторэтиландрост-4-ен-3-он,20) 17, 11-дигидрокси-17-пентафторэтил-9-фторандрост-4-ен-3-он,21) 17-гидрокси-17-пентафторэтиландрост-1,4-диен-3-он,22) 17-гидрокси-17-пентафторэтил-4-хлорандрост-1,4-диен-3-он,23) 17,4-дигидрокси-17-пентафторэтиландрост-1,4-диен-3-он,24) 17-гидрокси-17-пентафторэтил-4-трифторметиландрост-1,4-диен-3 -он,25) 17-гидрокси-17-пентафторэтил-7-метиландрост-1,4-диен-3-он,26) 17-гидрокси-17-пентафторэтил-7-метил-4-хлорандрост-1,4-диен-3-он,27) 17-гидрокси-17-трифторметил-7-метилэстр-4-ен-3-он,28) 17,4-дигидрокси-17-трифторметилэстр-4-ен-3-он,29) 17-гидрокси-17-трифторметил-4-хлорэстр-4-ен-3-он,30) 17-гидрокси-17-трифторметил-4-бромэстр-4-ен-3-он,31) 17-гидрокси-17,4-бис(трифторметил)эстр-4-ен-3-он,32) 17-гидрокси-17 а-трифторметил-7-метилэстр-4,9-диен-3-он,33) 17-гидрокси-17-трифторметил-7-метилэстр-4,9,11-триен-3-он,34) 17-гидрокси-17-пентафторэтилэстр-4-ен-3-он,35) 17-гидрокси-17-пентафторэтил-7-метилэстр-4-ен-3-он,36) 17,4-дигидрокси-17-пентафторэтилэстр-4-ен-3-он,37) 17-гидрокси-17-пентафторэтил-4-хлорэстр-4-ен-3-он,38) 17-гидрокси-17-пентафторэтил-4-бромэстр-4-ен-3-он,39) 17-гидрокси-17-пентафторэтил-4-трифторметилэстр-4-ен-3-он,40) 17-гидрокси-17-пентафторэтилэстр-4,9-диен-3-он,41) 17-гидрокси-17-пентафторэтилэстр-4,9,11-триен-3-он,42) 17-гидрокси-17-пентафторэтил-7-метилэстр-4,9-диен-3-он,43) 17-гидрокси-17-пентафторэтил-7-метилэстр-4,9,11-триен-3-он,44) 13-этил-17-гидрокси-17-трифторметил-4-хлоргон-4-ен-3-он,45) 13-этил-17,4-дигидрокси-17-трифторметилгон-4-ен-3-он,46) 13-этил-17-гидрокси-17-трифторметил-7-метилгон-4-ен-3-он,47) 13-этил-17-гидрокси-17-трифторметил-7-метилгон-4,9-диен-3-он,48) 13-этил-17-гидрокси-17-трифторметил-7-метилгон-4,9,11-триен-3-он,49) 13-этил- 17-гидрокси-17-пентафторэтилгон-4-ен-3-он,50) 13 -этил-17-гидрокси-17-пентафторэтил-7-метилгон-4-ен-3-он,51) 13-этил-17,4-дигидрокси-17-пентафторэтилгон-4-ен-3-он,52) 13-этил-17-гидрокси-17-пентафторэтил-4-хлоргон-4-ен-3-он,53) 13-этил-17-гидрокси-17-пентафторэтил-4-бромгон-4-ен-3-он,-3 005772 54) 13-этил-17-гидрокси-17-пентафторэтил-4-трифторметилгон-4-ен-3-он,55) 13-этил-17-гидрокси-17-пентафторэтилгон-4,9-диен-3-он,56) 13-этил-17-гидрокси-17-пентафторэтилгон-4,9,11-триен-3-он,57) 13-этил-17-гидрокси-17-пентафторэтил-7-метилгон-4,9-диен-3-он,58) 13-этил-17-гидрокси-17-пентафторэтил-7-метилгон-4,9,11-триен-3-он,59) 17-гидрокси-17-трифторметил-5-андростан-3-он,60) 17-гидрокси-17-пентафторэтил-5-андростан-3-он,61) 17-гидрокси-17-трифторметил-7-метил-5-андростан-3-он,62) 17-гидрокси-17-пентафторэтил-7-метил-5-андростан-3-он,63) 17-гидрокси-17-трифторметил-2-гидроксиметилен-5-андростан-3-он,64) 17-гидрокси-17-пентафторэтил-2-гидроксиметилен-5-андростан-3-он,65) 17-гидрокси-17-трифторметил-2-метил-5-андростан-3-он,66) 17-гидрокси-17-пентафторэтил-2-метил-5-андростан-3-он,67) 17-гидрокси-17-трифторметил-1-метил-5-андростан-3-он,68) 17-гидрокси-17-пентафторэтил-1-метил-5-андростан-3-он,69) 17-гидрокси-17-трифторметил-5-андрост-2-ен,70) 17-гидрокси-17-пентафторэтил-5-андрост-2-ен,71) 17-гидрокси-17-трифторметил-2-метил-5-андрост-2-ен,72) 17-гидрокси-17-пентафторэтил-2-метил-5-андрост-2-ен,73) 17-гидрокси-17-трифторметил-2-циано-5-андрост-2-ен,74) 17-гидрокси-17-пентафторэтил-2-циано-5-андрост-2-ен,75) 17-гидрокси-17-трифторметил-2-формил-5-андрост-2-ен,76) 17-гидрокси-17-пентафторэтил-2-формил-5-андрост-2-ен,77) 17-гидрокси-17-трифторметил-[2,3 с]оксадиазол-5-андростан,78) 17-гидрокси-17-пентафторэтил-[2,3 с]оксадиазол-5-андростан,79) 17-гидрокси-17-трифторметил-[3,2 с]изоксазол-5-андростан,80) 17-гидрокси-17-пентафторэтил-[3,2 с]изоксазол-5-андростан,81) 17-гидрокси-17-трифторметил-[3,2 с]пиразол-5-андростан,82) 17-гидрокси-17-пентафторэтил-[3,2 с]пиразол-5-андростан,83) 17-гидрокси-17-трифторметил-2,3-эпитио-5-андростан,84) 17-гидрокси-17-пентафторэтил-2,3-эпитио-5-андростан,85) 17-гидрокси-17-трифторметил-2,3-эпитио-5-андростан,86) 17-гидрокси-17-пентафторэтил-2,3-эпитио-5-андростан,87) 17-гидрокси-17-трифторметил-2-окса-5-андростан-3-он,88) 17-гидрокси-17-пентафторэтил-2-окса-5-андростан-3-он,89) 17-гидрокси-17-трифторметил-5-андрост-1-ен-3-он,90) 17-гидрокси-17-пентафторэтил-5-андрост-1-ен-3-он,91) 17-гидрокси-17-трифторметил-1-метил-5-андрост-1-ен-3-он,92) 17-гидрокси-17-пентафторэтил-1-метил-5-андрост-1-ен-3-он,93) 17-гидрокси-17-трифторметил-2-метил-5-андрост-1-ен-3-он и 94) 17-гидрокси-17-пентафторэтил-2-метил-5-андрост-1-ен-3-он. Еще одним объектом настоящего изобретения является способ получения 17-фторалкилстероидов общей формулы I, заключающийся в том, что соединения общей формулы II в которой R1, R4, R5, R6 и STEROID имеют значения, указанные в п.1 формулы изобретения, в присутствии фторида подвергают взаимодействию с перфторалкилтриалкилсиланами (Alk)3SiCnFmHo или с фторалкиллитием LiCnFmHo, соответственно с фторалкильными реактивами Гриньяра ZMgCnFmHo, где n обозначает 1, 2, 3, 4, 5, или 6, m обозначает число больше 1, а сумма m+о равна 2n, Z обозначает атом хлора,брома или иода и Alk обозначает С 1-С 4 алкил. Фторированную 17-алкильную цепь можно вводить путем присоединения (перфторалкил)триметилсиланов в присутствии фторида (реактив Рупперта и его гомологи, см. Journ. Org. Chem. 56(1991), cc. 984-989) или путем присоединения фторалкиллития, соответственно фторалкильных реактивов Гриньяра к 17-оксогруппе общей формулы II. 17-перфторалкильные цепи можно вводить путемJourn. Org. Chem. 52 (1987), с. 2481). Указанные в общей формулы II заместители R4 , R5 и R6 по известным специалистам методам целесообразно вводить в стероидный цикл D до введения фторированной 17-алкильной цепи. Для получения соединений общей формулы II субформул A-F можно использовать известные стероидные основные компоненты. Так, например, можно использовать следующие стероидные основные компоненты: для стероидной циклической системы А: андрост-4-ен-3,17-дион и дегидроэпиандростерон; для стероидной циклической системы В: 19-нортестостерон и 3,3-диметоксиэстр-5(10)-17-он (DD 79-213049); для стероидных циклических систем С, D и Е: эпиандростерон; для стероидной циклической системы F: 5-андрост-2-ен-17-он из эпиандростерона (US 3098851). Содержащиеся в субструктурах исходных материалов для стероидных циклических систем A-F функциональные группы при необходимости можно защищать по методам, известным специалистам в данной области. Так, например, кетогруппы в исходных материалах субструктур A-F по методам, известным специалистам, можно защищать в виде кеталей или тиоацеталей. Заместители R7-R15 по известным специалистам методам можно вводить в субструктуры A-F как до,так и после встраивания 17-алкильной цепи. Предлагаемые в изобретении соединения обладают андрогенной активностью, что наглядно подтверждают представленные ниже результаты исследования аффинности к андрогеновым рецепторам Результаты исследования позволяют сделать вывод о том, что перед предлагаемыми в изобретении соединениями общей формулы I открываются широкие возможности их применения для контроля фертильности (репродуктивной способности) у мужчин, для гормонзаместительной терапии (ГЗТ) у мужчин и женщин или для лечения обусловленных гормональными факторами заболеваний у мужчин и женщин,таких, например, как эндометриоз, рак молочной железы или гипогонадизм. Объектом настоящего изобретения в соответствии с этим являются также фармацевтические композиции, содержащие в своем составе по меньшей мере один 17-фторалкилстероид общей формулы I, при необходимости вместе с фармацевтически приемлемыми вспомогательными веществами и носителями. Эти фармацевтические композиции и лекарственные средства могут назначаться для перорального, ректального, вагинального, подкожного, чрескожного, внутривенного или внутримышечного введения. Наряду с обычными носителями и/или разбавителями в их состав входит по меньшей мере одно соединение общей формулы I. Лекарственные средства по изобретению вместе с обычными твердыми либо жидкими носителями или разбавителями и обычно используемыми в этих целях фармацевтически-технологическими вспомогательными веществами в зависимости от предусматриваемой методики введения изготавливают по известной технологии в соответствующей дозировке. Предпочтительные композиции представляют собой лекарственные формы, предназначенные для перорального введения. Такими лекарственными формами являются, например, таблетки, филмтаблетки, драже, капсулы, пилюли, порошки, растворы либо суспензии или же формы с эффектом депо. В качестве очевидных могут рассматриваться композиции, предназначенные для парентерального введения, такие как растворы для инъекции. Далее можно назвать среди прочих такие композиции, как суппозитории или средства для вагинального применения. Таблетки можно изготавливать, например, путем смешения активного вещества с известными вспомогательными веществами, например с инертными разбавителями, такими как декстроза, сахар,сорбит, маннит, поливинилпирролидон, с разрыхлителями, такими как кукурузный крахмал или альги-5 005772 новая кислота, со связующими, такими как крахмал или желатин, со смазывающими веществами, такими как стеарат магния или тальк, и/или со средствами, обеспечивающими эффект депо, такими как карбоксиполиметилен, карбоксиметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут также состоять из нескольких слоев. Соответствующим образом могут изготавливаться и драже, а именно, нанесением на полученные аналогично таблеткам ядра покрытия (оболочки) из обычно используемых в этих целях веществ, таких,например, как поливинилпирролидон, шеллак, гуммиарабик, тальк, оксид титана или сахар. При этом оболочка драже также может состоять из нескольких слоев, для формирования которых могут использоваться такие же вспомогательные вещества, что и указанные выше для таблеток. В состав содержащих соединения общей формулы I по изобретению растворов и суспензий дополнительно могут входить вкусовые добавки, такие как сахарин, цикламат или сахар, а также, например,ванилин или апельсиновый экстракт. Кроме того, они могут содержать также вспомогательные суспендирующие вещества, такие как натрийкарбоксиметилцеллюлоза, или консерванты, такие как nгидроксибензоат. Содержащие соединения общей формулы I капсулы можно изготавливать, например, смешением соединения(-ний) общей формулы I с инертным носителем, таким как лактоза или сорбит, и последующим инкапсулированием в желатиновые капсулы. Соответствующие суппозитории можно изготавливать, например, смешением с предусмотренными для этих целей носителями, такими как нейтральные жиры или полиэтиленгликоль либо с их производными. Ниже настоящее изобретение более подробно поясняется на примерах, которые не ограничивают его объем. Пример 1. 17-Гидрокси-17-трифторметиландрост-4-ен-3-он 10 г 3-ацетоксидегидроэпиандростерона растворяют в 300 мл ТГФ и смешивают с 0,5 г фторида тетрабутиламмония. Затем при перемешивании при комнатной температуре медленно добавляют по каплям 15 мл трифторметилтриметилсилана и перемешивают в течение 3 ч. После этого добавляют 200 мл полуконцентрированного раствора гидрокарбоната натрия и под вакуумом отгоняют ТГФ. Остаток трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл. Объединенные органические экстракты сушат, концентрируют и хроматографируют на силикагеле. В результате получают 12 г 3-ацетокси-17-триметилсилилокси-17-трифторметиландрост-5-ена. 12 г 3-ацетокси-17-триметилсилилокси-17-трифторметиландрост-5-ена растворяют в 100 мл ТГФ и смешивают при комнатной температуре с 20 мл 30%-ной фтористо-водородной кислоты. По истечении 3 ч смесь сливают на 200 мл 12%-ного раствора аммиака, трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл, органические экстракты сушат и концентрируют. В результате получают 9 г 3-ацетокси-17-гидрокси-17-трифторметиландрост-5-ена, который растворяют в 300 мл метанола и смешивают с 6 г гидроксида калия. После 30-минутного перемешивания при комнатной температуре нейтрализуют 2 н. соляной кислотой и метанол удаляют под вакуумом. Остаток четырежды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл и объединенные органические экстракты сушат и концентрируют. В результате получают 7,5 г 3,17-дигидрокси-17-трифторметиландрост-5-ена, который в течение 3 ч нагревают с обратным холодильником совместно с 80 мл циклогексанона, 5 г триизопропанолята алюминия и 250 мл толуола. Смеси дают остыть, после чего смешивают ее с 200 мл 2 н. раствора тартрата натрия-калия, органическую фазу отделяют и дважды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл. Объединенные органические экстракты концентрируют, остаток очищают хроматографией и кристаллизуют из метанола. Таким путем получают 17-гидрокси-17-трифторметиландрост-4-ен-3-он. 1 Н-ЯМР (ДМСО-D6): 0,89 (s, 3 Н, Н-18), 1,15 (s, 3 Н, Н-19), 5,62 (s, 1H, Н-4). 19F-ЯМР: -75,3. Пример 2. 17-Гидрокси-17-трифторметил-7-метиландрост-4-ен-3-он 7 г 17-гидрокси-17-трифторметиландрост-4-ен-3-она в течение 30 мин кипятят вместе с 8,5 г хлоранила в 200 мл трет-бутанола с обратным холодильником. Затем смеси дают остыть и концентрируют ее досуха. Остаток хроматографируют на силикагеле. Для последующей очистки перекристаллизовывают из смеси дихлорметана и гексана. В результате получают 17-гидрокси-17-трифторметиландрост 4,6-диен-3-он. 1 Н-ЯМР: 1,04 (s, 3 Н, Н-18), 1,13 (s, 3 Н, Н-19), 5,69 (s, 1H, Н-4), 6,11 (m, 2H, Н-6, Н-7). 19F-ЯМР: -75,3. К раствору метилмагнийиодида (полученному из 2,5 г магния и 6,4 мл метилиодида в 80 мл диэтилового эфира) добавляют 80 мл ТГФ и после охлаждения до -5 С добавляют 1 г моногидрата ацетата меди, растворенного в 50 мл ТГФ. Далее охлаждают до -20 С и затем по каплям добавляют раствор 5 г 17 гидрокси-17-трифторметиландрост-4,6-диен-3-она в 80 мл ТГФ. По истечении 2 ч сливают на смесь ледяной воды и 2 н. серной кислоты и трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 80 мл. Органический экстракт сушат и концентрируют. Остаток хроматографируют на силика-6 005772 геле. Для последующей очистки перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-трифторметил-7-метиландрост-4-ен-3-он. 1 Н-ЯМР: 0,77 (d, J=7 Гц, 3 Н, Н-7-метил), 0,99 (s, 3 Н, Н-18), 1,20 (s, 3 Н, Н-19), 5,73 (m, 1H, Н-4). 19F-ЯMP: -75,3. Пример 3. 17-Гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-он Стадия 1. 17-гидрокси-17-трифторметил-4,5-эпоксиандростан-3-он 2 г 17-гидрокси-17-трифторметиландрост-4-ен-3-она растворяют в 120 мл метанола, а также в 70 мл ТГФ и при 10 С смешивают с 20 мл раствора пероксида водорода (35%-ного). При перемешивании добавляют 5 мл 10%-ного раствора гидроксида натрия и продолжают перемешивать еще в течение 3 ч. Реакционный раствор концентрируют до объема 50 мл, затем смешивают с 50 мл дихлорметана и 25 мл воды и органическую фазу отделяют. Далее промывают полуконцентрированным раствором тиосульфата, сушат и концентрируют досуха. Полученный остаток представляет собой смесь 4,5-, соответственно 4,5-эпоксидов и без дальнейшей очистки его используют на последующей стадии. Стадия 2. 17-Гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-он 2 г смеси эпоксидов (из стадии 1) растворяют в 200 мл ацетона и при 5 С смешивают с 12 мл концентрированной соляной кислоты. По истечении 2 ч нейтрализуют раствором соды и ацетон удаляют под вакуумом. Остаток экстрагируют дихлорметаном. Органические экстракты сушат и концентрируют. После кристаллизации из смеси дихлорметана и гексана получают 17-гидрокси-17-трифторметил-4 хлорандрост-4-ен-3-он. 1 Н-ЯМР: 0,99 (s, 3 Н, Н-18), 1,24 (s, 3 Н, Н-19). 19F-ЯMP: -75,3. Пример 4. 17,4-дигидрокси-17-трифторметиландрост-4-ен-3-он 2 г смеси эпоксидов (стадия 1, получение 17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3 она) растворяют в 20 мл уксусной кислоты, содержащей 2 об.% концентрированной серной кислоты, и раствор в течение 24 ч выдерживают при 10 С. После этого его смешивают с 200 мл этилового эфира уксусной кислоты и нейтрализуют раствором соды. Органическую фазу сушат и концентрируют. Остаток хроматографируют на силикагеле и кристаллизуют из этилового эфира уксусной кислоты/гексана. 1 Н-ЯМР: 0,99 (s, 3 Н, Н-18), 1,19 (s, 3 Н, Н-19), 6,10 (s, 1H, 4-ОН). 19(2,3-дихлор-5,6-дициано-1,4-бензохинон). Затем осадок отфильтровывают, промывают толуолом и фильтрат концентрируют. Остаток хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. 1 Н-ЯМР: 1,02 (s, 3 Н, Н-18), 1,24 (s, 3 Н, Н-19), 6,07 (m, 1H, Н-4), 6,22 (dd, J=1,6, 10 Гц, 1 Н, Н-2), 7,04F-ЯMP: -75,4. Пример 6. 17-Гидрокси-17-трифторметил-4-хлорандрост-1,4-диен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-трифторметил-4-хлорандрост-4 ен-3-она аналогично рекомендации по получению 17-гидрокси-17-трифторметиландрост-1,4-диен-З она. 1F-ЯMP: -75,8. Пример 7. 17-Гидрокси-17-трифторметил-7-метилэстр-4-ен-3-он Стадия 1. 7-Метилэстр-4-ен-3,17-дион 10 г 17-гидрокси-7 а-метилэстр-4-ен-3-она (получение см. Steroids (1963), стр. 317) растворяют в 200 мол ацетона и при 20 С оксидируют 15 мл 8 н. хромосерной кислоты. По завершении реакции добавляют 10 мл метанола и дают нагреться до комнатной температуры. Затем под вакуумом удаляют растворители и остаток смешивают с 300 мл воды, при этом продукт выпадает в осадок. Его отделяют вакуум-фильтрацией, получая в результате 6,5 г 7-метилэстр-4-ен-3,17-диона. Стадия 2. 3,3-Этилендитио-7-метилэстр-4-ен-17-он 5 г 7-метилэстр-4-ен-3,17-диона растворяют в 50 мл метанола и смешивают с 3 мл этандитиола. Затем добавляют 1,5 мл диэтилэтерата трифторида бора и перемешивают при комнатной температуре в течение 2 ч, при этом продукт выпадает в виде кристаллов. Его отделяют вакуум-фильтрацией, получая в результате 6 г 3,3-этилендитио-7-метилэстр-4-ен-17-она. Стадия 3. 17-Гидрокси-17-трифторметил-7-метилэстр-4-ен-3-он 5 г 3,3-этилендитио-7-метилэстр-4-ен-17-она смешивают в 150 мл ТГФ при комнатной температуре с 0,25 г фторида тетрабутиламмония и затем медленно по каплям добавляют 8 мл трифторметилтриметилсилана. После 3-часового перемешивания добавляют 200 мл полуконцентрированного раствора гидрокарбоната натрия и под вакуумом отгоняют ТГФ. Остаток трижды экстрагируют этиловым эфиром-7 005772 уксусной кислоты порциями по 100 мл. Объединенные органические экстракты сушат, концентрируют и хроматографируют на силикагеле. В результате получают 3 г 17-триметилсилилокси-17 трифторметил-3,3-этилендитио-7-метилэстр-4-ена. 3 г 17-триметилсилилокси-17-трифторметил-3,3-этилендитио-7-метилэстр-4-ена растворяют в 40 мл ТГФ и при комнатной температуре смешивают с 5 мл 30%-ной фтористо-водородной кислоты. По истечении 3 ч смесь сливают на 200 мл 12%-ного раствора аммиака, трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл, органические экстракты сушат и концентрируют. Остаток растворяют в 100 мл 95%-ного метанола, смешивают с 9 мл метилиодида, а также с 2,5 г карбоната кальция и в течение 20 ч нагревают с обратным холодильником. После охлаждения смесь подвергают вакуум-фильтрации и фильтрат концентрируют до образования сухого остатка, который хроматографируют затем на силикагеле и кристаллизуют из дихлорметана/гексана. В результате получают 17 гидрокси-17-трифторметил-7-метилэстр-4-ен-3-он. 1 Н-ЯМР (D6-ДМСО): 0,70 (d, J=7,7 Гц, 3 Н, 7-метил), 0,93 (s, 3 Н, Н-18), 5,71 (s, 1 Н, Н-4). 19F-ЯMP: -75,5. Пример 8. 17-гидрокси-17-трифторметил-4-хлорэстр-4-ен-3-он и 17,4-дигидрокси-17 трифторметилэстр-4-ен-3-он. Стадия 1. 17-Гидрокси-17-трифторметилэстр-4-ен-3-он 10 г 3,3-диметоксиэстр-5(10)-ен-17-она растворяют в 300 мл ТГФ и смешивают с 0,5 г фторида тетрабутиламмония. Далее при перемешивании при комнатной температуре медленно добавляют по каплям 15 мл трифторметилтриметилсилана и перемешивают в течение 3 ч. Затем добавляют 200 мл полуконцентрированного раствора гидрокарбоната натрия и под вакуумом отгоняют ТГФ. Остаток трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл. Объединенные органические экстракты сушат и концентрируют. Таким путем получают 17-триметилсилилокси-17-трифторметил-3,3 диметоксиэстр-5(10)-ен. 12 г 17-триметилсилилокси-17-трифторметил-3,3-диметоксиэстр-5(10)-ена растворяют в 100 мл ТГФ и смешивают при комнатной температуре с 20 мл 30%-ной фтористо-водородной кислоты. По истечении 24 ч смесь сливают на 200 мл 12%-ного раствора аммиака, трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл, органические экстракты сушат и концентрируют. Остаток очищают хроматографией на силикагеле и в результате получают 17-гидрокси-17-трифторметилэстр 4-ен-3-он. 1 Н-ЯМР (CDCl3): 1,00 (s, 3H, Н-18), 5,82 (s, 1H, Н-4). 19F-ЯMP:-75,l. Стадия 2. 17-Гидрокси-17-трифторметил-4,5-эпоксиэстран-3-он Указанное в заголовке соединение получают аналогично получению 17-гидрокси-17 трифторметил-4,5-эпоксиандростан-3-она. Образовавшийся остаток представляет собой смесь 4,5-,соответственно 4,5-эпоксидов и без дальнейшей очистки его используют на последующей стадии. Стадия 3. 17-Гидрокси-17-трифторметил-4-хлорэстр-4-ен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-трифторметил-4,5 эпоксиэстран-3-она аналогично получению 17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-она. 1 Н-ЯМР (CDCl3): 1,00 (s, 3 Н, Н-18). 19F-ЯMP: -75,3. Стадия 4. 17,4-дигидрокси-17-трифторметилэстр-4-ен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-трифторметил-4,5 эпоксиэстран-3-она аналогичной получению 17,4-дигидрокси-17-трифторметиландрост-4-ен-3-она. 1F-ЯMP: -75,3. Пример 9. 17-Гидрокси-17-пентафторэтиландрост-4-ен-3-он 20 г 3,3-этилендитиоандрост-4-ен-17-она суспендируют в 600 мл диэтилового эфира и при перемешивании охлаждают до -78 С. Затем добавляют 48 г пентафторэтилиодида, а после этого медленно по каплям добавляют 76 мл 1,5-молярного раствора комплекса состава метиллитийбромид лития в диэтиловом эфире. Далее в течение 2 ч перемешивают при -78 С, после чего сливают на 2 л насыщенного раствора гидрокарбоната натрия. Затем экстрагируют этиловым эфиром уксусной кислоты, сушат и концентрируют. Остаток растворяют в 500 мл 95%-ного метанола, смешивают с 72 мл метилиодида, а также с 20 г карбоната кальция и в течение 20 ч нагревают с обратным холодильником. После охлаждения проводят вакуум-фильтрацию и фильтрат концентрируют до образования сухого остатка, который затем хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-пентафторэтиландрост-4-ен-3-он. 1 Н-ЯМР (CDCl3): 0,99 (s, 3H, Н-18), 1,19 (s, 3H, Н-19), 5,74 (s, 1H, Н-4). 19 Пример 10. 17-Гидрокси-17-пентафторэтил-4-хлорандрост-4-ен-3-он и 17,4-дигидрокси-17 пентафторэтиландрост-4-ен-3-он. Стадия 1. 17-гидрокси-17-пентафторэтил-4,5-эпоксиандростан-3-он Указанное в заголовке соединение получают аналогично получению 17-гидрокси-17 трифторметил-4,5-эпоксиандростан-3-она. Образовавшийся остаток представляет собой смесь 4,5-,соответственно 4,5-эпоксидов и без дальнейшей очистки его используют на последующей стадии. Стадия 2. 17-гидрокси-17-пентафторэтил-4-хлорандрост-4-ен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-пентафторэтил-4,5 эпоксиандростан-3-она аналогично получению 17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3 она. 1 Н-ЯМР (CDCl3): 0,99 (s, 3H, Н-18), 1,23 (s, 3H, Н-19). 19F-ЯМР: -77,4 (3F, CF3), -119,2 (2F, CF2). Стадия 3. 17,4-дигидрокси-17-пентафторэтиландрост-4-ен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-пентафторэтил-4,5 эпоксиандростан-3-она аналогично получению 17,4-дигидрокси-17-трифторметиландрост-4-ен-3-она. 1 Н-ЯМР (CDCl3): 0,98 (s, 3H, Н-18), 1,18 (s, 3H, Н-19), 6,09 (s, 1H, 4-ОН). 19F-ЯМР: -77,4 (3F, CF3), -119,5 (2F, CF2). Пример 11. 17-гидрокси-17-пентафторэтил-7-метиландрост-4-ен-3-он Стадия 1. 17-гидрокси-17-пентафторэтиландрост-4,6-диен-3-он 1 г 17-гидрокси-17-пентафторэтиландрост-4-ен-3-она в течение 30 мин кипятят совместно с 1,2 г хлоранила в 50 мл трет-бутанола с обратным холодильником, затем смеси дают остыть и концентрируют ее до образования сухого остатка, который хроматографируют на силикагеле. 1 Н-ЯМР (CDCl3): 1,04 (s, 3H, Н-18), 1,12 (s, 3H, Н-19), 5,68 (s, 1H, Н-4), 6,11 (m, 2H, Н-6, Н-7). 19F-ЯМР: -77,4 (3F, CF3), -119,0 (2F, CF2). К раствору метилмагнийиодида (полученному из 5 г магния и 13 мл метилиодида в 150 мл диэтилового эфира) добавляют 160 мл ТГФ, затем охлаждают до -5 С и добавляют 2 г моногидрата ацетата меди,растворенного в 100 мл ТГФ. После охлаждения до -20 С по каплям добавляют раствор 10 г 17 гидрокси-17-пентафторэтиландрост-4,6-диен-3-она в 120 мл ТГФ. По истечении 2 ч сливают на ледяную воду/2 н. серную кислоту и трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 80 мл. Органический экстракт сушат и концентрируют. Остаток хроматографируют на силикагеле. Для последующей очистки его перекристаллизовывают из этилового эфира уксусной кислоты. 1 Н-ЯМР (CDCl3): 0,78 (d, J=8 Гц, 3H, Н-7 Ме), 1,01 (s, 3H, Н-18), 1,21 (s, 3H, Н-19), 5,74 (s 1H, Н-4). 19F-ЯМР: -77,4 (3F, CF3), -119,3 (2F, CF2). Пример 12. 17-гидрокси-17-пентафторэтилэстр-4-ен-3-он. 20 г 3,3-диметоксиэстр-5(10)-ен-17-она растворяют в 600 мл диэтилового эфира и при перемешивании охлаждают до -78 С. Затем добавляют 48 г пентафторэтилиодида, а после этого медленно по каплям добавляют 76 мл 1,5-молярного раствора комплекса состава метиллитийбромид лития в диэтиловом эфире. Далее в течение 2 ч перемешивают при -78 С, после чего сливают на 2 л насыщенного раствора гидрокарбоната натрия. Затем экстрагируют этиловым эфиром уксусной кислоты, сушат и концентрируют. Остаток хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-пентафторэтилэстр-4-ен-3-он. 1 Н-ЯМР (CDCl3): 1,02 (s, 3H, Н-18), 5,83 (s, 1H, Н-4). 19F-ЯMP: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 13. 17-Гидрокси-17-пентафторэтил-7-метилэстр-4-ен-3-он. 3,3-этилендитио-7-метилэстр-4-ен-17-он (см. получение 17-гидрокси-17-трифторметил-7 метилэстр-4-ен-3-она) аналогично тому, как описано выше, подвергают взаимодействию с комплексом состава пентафторэтилиодид/метиллитий/бромид лития. Сырой продукт растворяют в 500 мл 95%-ного метанола, смешивают с 72 мл метилиодида, а также с 20 г карбоната кальция и в течение 20 ч нагревают с обратным холодильником. После охлаждения проводят вакуум-фильтрацию и фильтрат концентрируют до образования сухого остатка, который затем хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-пентафторэтил 7-метилэстр-4-ен-3-он. 1 Н-ЯМР (CDCl3): 0,77 (d, J=8 Гц, 3H, Н-7 Ме), 1,02 (s, 3H, Н-18), 5,84 (s 1H, Н-4). 19F-ЯМР: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 14. 17,4-Дигидрокси-17-пентафторэтилэстр-4-ен-3-он Стадия 1. 17-Гидрокси-17-пентафторэтил-4,5-эпоксиэстран-3-он Указанное в заголовке соединение получают аналогично получению 17-гидрокси-17 трифторметил-4,5-экпоксиандростан-3-она. Образовавшийся в результате остаток представляет собой смесь 4,5-, соответственно 4,5-эпоксидов и без дальнейшей очистки его используют на последующей стадии. Стадия 2. 17,4-дигидрокси-17-пентафторэтилэстр-4-ен-3-он Указанное в заголовке соединение получают из 17-гидрокси-17-пентафторэтил-4,5 эпоксиэстран-3-она аналогично получению 17,4-дигидрокси-17-трифторметиландрост-4-ен-3-она. 1 Н-ЯМР (CDCl3): 1,00 (s, 3H, Н-18), 6,10 (s, 1H, 4-ОН). 19F-ЯМР: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 15. 17-Гидрокси-17-пентафторэтил-4-хлорэстр-4-ен-3-он. Указанное в заголовке соединение получают из 17-гидрокси-17-пентафторэтил-4,5 эпоксиэстран-3-она аналогично получению 17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-она. 1 Н-ЯМР (CDCl3): 1,01 (s, 3H, Н-18). 19F-ЯMP: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 16. 17-Гидрокси-17-трифторметил-5-андростан-3-он. Стадия 1. 3-ацетокси-17-триметилсилилокси-17-трифторметил-5-андростан 10 г 3-ацетоксиэпиандростерона растворяют в 300 мл ТГФ и смешивают с 0,5 г фторида тетрабутиламмония. Далее при перемешивании при комнатной температуре медленно добавляют по каплям 15 мл трифторметилтриметилсилана и перемешивание продолжают еще в течение 3 ч. Затем добавляют 200 мл полуконцентрированного раствора гидрокарбоната натрия и под вакуумом отгоняют ТГФ. Остаток трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл. Объединенные органические экстракты сушат, концентрируют и хроматографируют на силикагеле. В результате получают 9 г 3-ацетокси-17-триметилсилилокси-17-трифторметил-5-андростана. Стадия 2. 3-Ацетокси-17-гидрокси-17-трифторметил-5-андростан 9 г 3-ацетокси-17-триметилсилилокси-17-трифторметил-5-андростана растворяют в 100 мл ТГФ и при комнатной температуре смешивают с 20 мл 30%-ной фтористо-водородной кислоты. По истечении 3 ч смесь сливают на 200 мл 12%-ного раствора аммиака, трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл, органические экстракты сушат и концентрируют. Таким путем получают 7 г 3-ацетокси-17-гидрокси-17-трифторметил-5-андростана. Стадия 3. 3, 17-Дигидрокси-17-трифторметил-5-андростан 7 г 3-ацетокси-17-гидрокси-17-трифторметил-5-андростана растворяют в 300 мл метанола и смешивают с 6 г гидроксида калия. После 30-минутного перемешивания при комнатной температуре нейтрализуют 2 н. соляной кислотой и метанол удаляют под вакуумом. Остаток четырежды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл и объединенные органические экстракты сушат и концентрируют. В результате получают 4,5 г 3,17-дигидрокси-17-трифторметил-5-андростана. Стадия 4. 17-Гидрокси-17-трифторметил-5-андростан-3-он Полученный на стадии 3 продукт оксидируют в 50 мл ацетона при 0 С 9 мл 8 н. хромсерной кислоты. По завершении реакции добавляют 2 мл метанола и 50 мл воды, после чего ацетон удаляют под вакуумом, при этом продукт выпадает в осадок. Его отделяют вакуум-фильтрацией и промывают водой. Для очистки продукт хроматографируют и кристаллизуют из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-трифторметил-5-андростан-3-он. 1 Н-ЯМР (CDCl3): 0,96 (s, 3H, H-18), 1,02 (s, 3H, Н-19). 19F-ЯМР: -75,4. Пример 17. 17-Гидрокси-17-пентафторэтил-5-андростан-3-он. Стадия 1. 3-Триметилсилилокси-5-андростан-17-он 10 г эпиандростерона растворяют в 75 мл ДМФ и 20 мл пиридина и смешивают с 10 мл триметилхлорсилана. По истечении 3 ч смесь сливают в 300 мл насыщенного раствора гидрокарбоната натрия,после чего отделяют вакуум-фильтрацией, промывают водой и получают в результате 15 г 3 триметилсилилокси-5 а-андростан-17-она. Стадия 2. 3, 17-Дигидрокси-17-пентафторэтил-5-андростан 15 г 3-триметилсилилокси-5-андростан-17-она растворяют в 300 мл диэтилового эфира и охлаждают до -78 С. Затем добавляют 14 г пентафторэтилиодида, а после этого по каплям добавляют 38 мл 1,5-молярного раствора комплекса метиллитийбромид лития в диэтиловом эфире. Далее выдерживают в течение 1 ч для перемешивания и затем сливают на 1 л насыщенного раствора гидрокарбоната натрия,экстрагируют этиловым эфиром уксусной кислоты и концентрируют. Остаток растворяют в 100 мл ТГФ и смешивают с 8 г фторида тетрабутиламмония. По истечении 30 мин добавляют 200 мл насыщенного раствора гидрокарбоната натрия и ТГФ удаляют под вакуумом, при этом продукт выпадает в осадок. Его отделяют вакуум-фильтрацией и промывают водой. В результате получают 13 г 3,17b-дигидрокси-17 пентафторэтил-5-андростана. Стадия 3. 17-Гидрокси-17-пентафторэтил-5-андростан-3-он 10 г 3,17-дигидрокси-17-пентафторэтил-5-андростана оксидируют в 100 мл ацетона при 0 С 16 мл 8 н. хромсерной кислоты. Затем добавляют 3 мл метанола, 100 мл воды и ацетон удаляют под вакуумом, при этом продукт выпадает в виде кристаллов. Его отделяют вакуум-фильтрацией и промывают водой. Таким путем получают 17-гидрокси-17-пентафторэтил-5-андростан-3-он.F-ЯMP: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 18. 17-Гидрокси-17-трифторметил-2-гидроксиметилен-5-андростан-3-он. 4 г 17-гидрокси-17-трифторметил-5-андростан-3-она смешивают в 150 мл толуола с 3,2 г гидрида натрия и 8 мл этилового эфира муравьиной кислоты. По истечении 4 ч осторожно гидролизуют водой. Затем подкисляют 5 н. соляной кислотой, органическую фазу отделяют, сушат и концентрируют. Для очистки ее хроматографируют на силикагеле и кристаллизуют из ацетона/гексана. Таким путем получают 17-гидрокси-17-трифторметил-2-гидроксиметилен-5-андростан-3-он. 1 Н-ЯМР (CDCl3): 0,76 (s, 3H, Н-18), 0,97 (s, 3H, Н-19), 8,62 (m, 1H, Н-2-СНО). 19F-ЯMP: -75,2. Пример 19. 17-Гидрокси-17-пентафторэтил-2-гидроксиметилен-5-андростан-3-он. Указанное в заголовке соединение получали аналогично примеру 17 из 17-гидрокси-17 пентафторэтил-5-андростан-3-она. 1 Н-ЯМР (CDCl3): 0,77 (s, 3H, Н-18), 0,96 (s, 3H, Н-19), 8,62 (m, 1H, Н-2-СНО). 19F-ЯMP: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 20. 17-Гидрокси-17-трифторметил-[3.2 с]пиразол-5-андростан. 1 г 17-гидрокси-17-трифторметил-2-гидроксиметилен-5-андростан-3-она в течение 30 мин нагревают с обратным холодильником в 50 мл этанола, добавляя при этом 0,3 мл гидрата гидразина. Затем концентрируют, осаждают с помощью воды и проводят вакуум-фильтрацию. Продукт очищают путем кристаллизации из трет-бутилметилового эфира/гексана. Таким путем получают 17-гидрокси-17 трифторметил-[3,2 с]пиразол-5-андростан. 1 Н-ЯМР (CDCl3): 0,74 (s, 3H, Н-18), 0,96 (s, 3H, Н-19). 19F-ЯMP: -75,3. Пример 21. 17-Гидрокси-17-пентафторэтил-[3,2 с]пиразол-5-андростан. Указанное в заголовке соединение получают аналогично примеру 19 из 17-гидрокси-17 пентафторэтил-2-гидроксиметилен-5-андростан-3-она. 1 Н-ЯМР (CDCl3): 0,74 (s, 3H, Н-18), 0,96 (s, 3H, Н-19). 19F-ЯМР: -77,3 (3F, CF3), -119,3 (2F, CF2). Пример 22. 17-Гидрокси-17-трифторметил-5-андрост-1-ен-3-он. 10 г 17-гидрокси-17-трифторметил-5-андростан-3-она при перемешивании в 200 мл ТГФ смешивают с гидробромидом пиридинийпербромида. По истечении 15 мин добавляют 250 мл насыщенного раствора гидрокарбоната натрия, экстрагируют хлороформом, сушат и концентрируют. Остаток совместно с 10 г карбоната лития и 20 г бромида лития в 100 мл ТГФ нагревают в течение 6 ч с обратным холодильником. Затем дают остыть, разбавляют 500 мл толуола, промывают водой, сушат и концентрируют. Для последующей очистки продукт хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17-гидрокси-17-трифторметил-5 андрост-1-ен-3-он. 1 Н-ЯМР (CDCl3): 0,98 (s, 3H, Н-18), 1,02 (s, 3H, Н-19), 5,85 (d, J=10 Гц, 1 Н, Н-2), 7,12 (d, J=10 Гц,1 Н, Н-1). 19F-ЯМР: -75,3. Пример 23. 17-Гидрокси-17-пентафторэтил-5-андрост-1-ен-3-он. Указанное в заголовке соединение получают аналогично примеру 21 из 17-гидрокси-17 пентафторэтил-5-андростан-3-она. 1 Н-ЯМР (CDCl3): 0,98 (s, 3H, Н-18), 1,02 (s, 3H, Н-19), 5,85 (d, J=10 Гц, Ш, Н-2), 7,12 (d, J=10 Гц, 1 Н,Н-1). 19F-ЯМР: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 24. 17-Гидрокси-17-трифторметил-2-окса-5-андростан-3-он. 4 г 17-гидрокси-17-трифторметил-5 а-андрост-1-ен-3-она подвергают в 200 мл 90%-ной уксусной кислоты взаимодействию с 30 г тетраацетата свинца и 280 мг тетраоксида осмия. По истечении 24 ч выдержки при комнатной температуре разбавляют 500 мл воды и трижды экстрагируют хлороформом. Объединенные органические фазы подщелачивают 2 н. едким натром и трижды экстрагируют 2 н. едким натром порциями по 200 мл. Объединенные водные фазы подкисляют 5 н. соляной кислотой и трижды экстрагируют хлороформом. Объединенные органические фазы сушат и концентрируют. Остаток растворяют в 80 мл ТГФ и 80 мл метанола. Далее при перемешивании последовательно добавляют раствор 1 г гидрокарбоната натрия в 75 мл воды и 4,2 г борогидрида натрия. По истечении 2 ч подкисляют концентрированной соляной кислотой, экстрагируют этиловым эфиром уксусной кислоты, сушат и концентрируют. Для последующей очистки продукт хроматографируют на силикагеле и перекристаллизовывают из этилового эфира уксусной кислоты. Таким путем получают 17 гидрокси-17-трифторметил-2-окса-5-андростан-3-он. 1 Н-ЯМР (CDCl3): 0,94 (s, 3H, Н-18), 1,00 (s, 3H, Н-19), 2,22 (dd, J=19,l, 13,1 Гц, 1 Н, Н-4), 2,53 (dd,J=18,7, 5,8 Гц, 1 Н, Н-4), 3,92 (d, J=10 Гц, 1 Н, Н-1), 4,21 (d, J=10 Гц, 1 Н, Н-1).F-ЯMP: -75,4. Пример 25. 17-Гидрокси-17-пентафторэтил-2-окса-5-андростан-3-он. Указанное в заголовке соединение получают аналогично примеру 23 из 17-гидрокси-17 пентафторэтил-5-андрост-1-ен-3-она. 1 Н-ЯМР (CDCl3): 0,94 (s, 3H, Н-18), 1,00 (s, 3H, Н-19), 2,22 (dd, J=19,1, 13,0 Гц, 1 Н, Н-4), 2,53 (dd,J=19,1, 6,2 Гц, 1 Н, Н-4), 3,93 (d, J=10 Гц, 1 Н, Н-1), 4,22 (d, J=10 Гц, 1 Н, Н-1). 19F-ЯМР: -77,3 (3F, CF3), -119,2 (2F, CF2). Пример 26. 17-гидрокси-17-трифторметил-5-андрост-2-ен. Стадия 1. 17-триметилсилилокси-17-трифторметил-5-андрост-2-ен 10 г 5-андрост-2-ен-17-она (получение согласно US-A 3098851) растворяют в 300 мл ТГФ и смешивают с 0,5 г фторида тетрабутиламмония. Затем при перемешивании при комнатной температуре медленно добавляют по каплям 15 мл трифторметилтриметилсилана и продолжают перемешивать еще в течение 3 ч. После этого добавляют 200 мл полуконцентрированного раствора гидрокарбоната натрия и ТГФ отгоняют под вакуумом. Остаток трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл. Объединенные органические экстракты сушат, концентрируют и хроматографируют на силикагеле. В результате получают 10 г 17-триметилсилилокси-17-трифторметил-5-андрост-2-ена. Стадия 2. 17-Гидрокси-17-трифторметил-5-андрост-2-ен 10 г 17-триметилсилилокси-17-трифторметил-5-андрост-2-ена растворяют в 100 мл ТГФ и смешивают при комнатной температуре с 20 мл 30%-ной фтористо-водородной кислоты. По истечении 3 ч смесь сливают на 200 мл 12%-ного раствора аммиака, трижды экстрагируют этиловым эфиром уксусной кислоты порциями по 100 мл, органические экстракты сушат и концентрируют. После кристаллизации из метанола получают 17-гидрокси-17-трифторметил-5-андрост-2-ен. 1 Н-ЯМР (CDCl3): 0,76 (s, 3H, Н-18), 0,93 (s, 3H, Н-19), 5,60 (m, 2H, Н-2, Н-3). 19F-ЯМР:-75,1. Пример 27. 17-Гидрокси-17-пентафторэтил-5-андрост-2-ен. 15 г 5-андрост-2-ен-17-она растворяют в 300 мл диэтилового эфира и охлаждают до -78 С. Далее добавляют сначала 14 г пентафторэтилиодида, а затем по каплям добавляют 38 мл 1,5-молярного раствора комплекса метиллитийбромид лития. После этого выдерживают в течение 1 ч для перемешивания компонентов между собой и затем смесь сливают на 1 л насыщенного раствора гидрокарбоната натрия,экстрагируют этиловым эфиром уксусной кислоты и концентрируют. Остаток хроматографируют на силикагеле и таким путем получают 17-гидрокси-17-пентафторэтил-5-андрост-2-ен. 1 Н-ЯМР (CDCl3): 0,76 (s, 3H, Н-18), 0,95 (s, 3H, Н-19), 5,62 (m, 2 Н, Н-2, Н-3). 19R2 представляет собой гидроксигруппу, группу OC(O)-R20 или OR21, где R20 и R21 обозначают С 1 С 12 алкильную группу, С 3-С 8 циклоалкильную группу, арильную группу или арил-С 1-С 4 алкильную группу;R3 представляет собой остаток формулы CnF2n+1, где n обозначает 1, 2, 3, 4, 5 или 6;R4 и R5 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;R5 и R6 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик, STEROID представляет собой стероидную ABC-циклическую систему субформул А,В, С, D, Е и F при этом в формулах А и С в положении 1,2 может находиться дополнительная двойная связь, а в формуле В в положении 8,9 и в положении 11,12 могут находиться одна или две дополнительные двойные связи;R7 представляет собой атом водорода, атом галогена, гидроксильную группу или трифторметильную группу;X обозначает атом кислорода или два атома водорода;R8 представляет собой атом водорода, метильную или этильную группу;R9 представляет собой атом водорода либо атом галогена или вместе с R образует двойную связь;R10 представляет собой атом водорода, гидроксильную группу, метильную либо этильную группу или вместе с R9 образует двойную связь;R11 представляет собой атом водорода, С 1-С 4 алкильную группу, нитрильную группу, гидроксиметиленовую или формильную группу;R12 представляет собой атом водорода, С 1-С 4 алкильную группу или нитрильную группу;R11 и R12 наряду с вышеуказанными значениями вместе образуют метиленовыи мостик;R13 представляет собой атом водорода или вместе с R7 образует двойную связь;R14 и R15 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо,[2,3 с]оксадиазольное кольцо, [3,2 с]изоксазольное кольцо или [3,2 с]пиразольное кольцо;Y обозначает атом кислорода или азота; при этом волнистые линии yR7, R8, R11, R12, R13, R 14 и R15 означают, что данные заместители могут находиться в - либо -положении, за исключением соединений из группы, включающей 17-гидрокси-17-трифторметиландрост-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4,9-диен-3-он,17-гидрокси-17-трифторметилэстр-4,9,11-триен-3-он,13-этил-17-гидрокси-17-трифторметилгон-4-ен-3-он,13-этил-17-гидрокси-17-трифторметилгон-4,9-диен-3-он и 13-этил-17-гидрокси-17-трифторметилгон-4,9,11-триен-3-он. 2. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы А. 3. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы В. 4. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы С. 5. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы D. 6. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы Е. 7. 17-фторалкилстероиды по п.1, при этом STEROID представляет собой стероидную циклическую систему субформулы F. 8. 17-фторалкилстероиды по любому из пп.1-7, при этом R1 представляет собой метильную группу. 9. 17-фторалкилстероиды по любому из пп.1-8, при этом R2 представляет собой гидроксигруппу,формилоксигруппу, ацетилоксигруппу, пропионилоксигруппу, бутирилоксигруппу, [(транс-4- 13005772 бутилциклогексил)карбонил]оксигруппу, фенилпропионилоксигруппу, изобутирилоксигруппу, гептанилоксигруппу или ундеканилоксигруппу. 10. 17-фторалкилстероиды по любому из пп.1-9, при этом R3 представляет собой трифторметильную группу или пентафторэтильную группу. 11. 17-фторалкилстероиды по любому из пп.1-3 и 8-10, при этом R8 представляет собой метильную группу. 12. 17-фторалкилстероиды по любому из пп.1-5 и 8-11, при этом R7 представляет собой атом фтора, хлора либо брома или трифторметильную либо гидроксигруппу. 13. 17-фторалкилстероиды по любому из пп.1, 2 и 8-11, при этом R10 представляет собой гидроксигруппу. 14. 17-фторалкилстероиды по любому из пп.1, 2 и 8-12, при этом R9 представляет собой атом фтора. 15. 17-фторалкилстероиды по любому из пп.1, 4, 7 и 12, при этом R11 представляет собой гидроксиметиленовую группу или формильную группу. 16. 17-фторалкилстероиды по любому из пп.1, 5, 11 и 12, при этом Y обозначает атом кислорода. 17. 17-фторалкилстероиды по п.1 из группы, включающей 17-гидрокси-17-трифторметил-7-метиландрост-4-ен-3-он,17,4-дигидрокси-17-трифторметиландрост-4-ен-3-он,17-гидрокси-17-трифторметил-4-хлорандрост-4-ен-3-он,17-гидрокси-17-трифторметил-4-бромандрост-4-ен-3-он,17-гидрокси-17,4-бис(трифторметил)андрост-4-ен-3-он,17, 11-дигидрокси-17-трифторметиландрост-4-ен-3-он,17, 11-дигидрокси-17-трифторметил-9-фторандрост-4-ен-3-он,17-гидрокси-17-трифторметиландрост-1,4-диен-3-он,17-гидрокси-17-трифторметил-4-хлорандрост-1,4-диен-3-он,17,4-дигидрокси-17-трифторметиландрост-1,4-диен-3-он,17-гидрокси-17-трифторметил-7-метиландрост-1,4-диен-3-он,17-гидрокси-17-трифторметил-7-метил-4-хлорандрост-1,4-диен-3-он,17-гидрокси-17-пентафторэтиландрост-4-ен-3-он,17-гидрокси-17-пентафторэтил-7-метиландрост-4-ен-3-он,17,4-дигидрокси-17-пентафторэтиландрост-4-ен-3-он,17-гидрокси-17-пентафторэтил-4-хлорандрост-4-ен-3-он,17-гидрокси-17-пентафторэтил-4-бромандрост-4-ен-3-он,17-гидрокси-17-пентафторэтил-4-трифторметиландрост-4-ен-3-он,17, 11-дигидрокси-17-пентафторэтиландрост-4-ен-3-он,17, 11-дигидрокси-17-пентафторэтил-9-фторандрост-4-ен-3-он,17-гидрокси-17-пентафторэтиландрост-1,4-диен-3-он,17-гидрокси-17-пентафторэтил-4-хлорандрост-1,4-диен-3-он,17,4-дигидрокси-17-пентафторэтиландрост-1,4-диен-3-он,17-гидрокси-17-пентафторэтил-4-трифторметиландрост-1,4-диен-3-он,17-гидрокси-17-пентафторэтил-7-метиландрост-1,4-диен-3-он,17-гидрокси-17-пентафторэтил-7-метил-4-хлорандрост-1,4-диен-3-он,17-гидрокси-17-трифторметил-7-метилэстр-4-ен-3-он,17,4-дигидрокси-17-трифторметилэстр-4-ен-3-он,17-гидрокси-17-трифторметил-4-хлорэстр-4-ен-3-он,17-гидрокси-17-трифторметил-4-бромэстр-4-ен-3-он,17-гидрокси-17,4-бис(трифторметил)эстр-4-ен-3-он,17-гидрокси-17-трифторметил-7-метилэстр-4,9-диен-3-он,17-гидрокси-17-трифторметил-7-метилэстр-4,9,11-триен-3-он,17-гидрокси-17-пентафторэтилэстр-4-ен-3-он,17-гидрокси-17-пентафторэтил-7-метилэстр-4-ен-3-он,17,4-дигидрокси-17-пентафторэтилэстр-4-ен-3-он,17-гидрокси-17-пентафторэтил-4-хлорэстр-4-ен-3-он,17-гидрокси-17-пентафторэтил-4-бромэстр-4-ен-3 -он,17-гидрокси-17-пентафторэтил-4-трифторметилэстр-4-ен-3-он,17-гидрокси-17-пентафторэтилэстр-4,9-диен-3-он,17-гидрокси-17-пентафторэтилэстр-4,9,11-триен-3-он,17-гидрокси-17-пентафторэтил-7-метилэстр-4,9-диен-3-он,- 14005772 17-гидрокси-17-пентафторэтил-7-метилэстр-4,9,11-триен-3-он,13-этил-17-гидрокси-17-трифторметил-4-хлоргон-4-ен-3-он,13-этил-17,4-дигидрокси-17-трифторметилгон-4-ен-3-он,13-этил-17-гидрокси-17-трифторметил-7-метилгон-4-ен-3-он,13-этил-17-гидрокси-17-трифторметил-7-метилгон-4,9-диен-3-он,13-этил-17-гидрокси-17-трифторметил-7-метилгон-4,9,11-триен-3-он,13-этил-17-гидрокси-17-пентафторэтилгон-4-ен-3-он,13-этил-17-гидрокси-17-пентафторэтил-7-метилгон-4-ен-3-он,13-этил-17,4-дигидрокси-17-пентафторэтилгон-4-ен-3-он,13 -этил-17-гидрокси-17-пентафторэтил-4-хлоргон-4-ен-3-он,13 -этил-17-гидрокси-17-пентафторэтил-4-бромгон-4-ен-3-он,13 -этил-17-гидрокси-17-пентафторэтил-4-трифторметилгон-4-ен-3-он,13-этил-17-гидрокси-17-пентафторэтилгон-4,9-диен-3-он,13-этил-17-гидрокси-17-пентафторэтилгон-4,9,11-триен-3-он,13-этил-17-гидрокси-17-пентафторэтил-7-метилгон-4,9-диен-3-он,13-этил-17-гидрокси-17-пентафторэтил-7-метилгон-4,9,11-триен-3-он,17-гидрокси-17-трифторметил-5-андростан-3-он,17-гидрокси-17-пентафторэтил-5-андростан-3-он,17-гидрокси-17-трифторметил-7-метил-5-андростан-3-он,17-гидрокси-17-пентафторэтил-7-метил-5-андростан-3-он,17-гидрокси-17-трифторметил-2-гидроксиметилен-5-андростан-3-он,17-гидрокси-17-пентафторэтил-2-гидроксиметилен-5-андростан-3-он,17-гидрокси-17-трифторметил-2-метил-5-андростан-3-он,17-гидрокси-17-пентафторэтил-2-метил-5-андростан-3-он,17-гидрокси-17-трифторметил-1-метил-5-андростан-3 -он,17-гидрокси-17-пентафторэтил-1-метил-5-андростан-3-он,17-гидрокси-17-трифторметил-5-андрост-2-ен,17-гидрокси-17-пентафторэтил-5-андрост-2-ен,17-гидрокси-17-трифторметил-2-метил-5-андрост-2-ен,17-гидрокси-17-пентафторэтил-2-метил-5-андрост-2-ен,17-гидрокси-17-трифторметил-2-циано-5-андрост-2-ен,17-гидрокси-17-пентафторэтил-2-циано-5-андрост-2-ен,17-гидрокси-17-трифторметил-2-формил-5-андрост-2-ен,17-гидрокси-17-пентафторэтил-2-формил-5-андрост-2-ен,17-гидрокси-17-трифторметил-[2,3 с]оксадиазол-5-андростан,17-гидрокси-17-пентафторэтил-[2,3 с]оксадиазол-5-андростан,17-гидрокси-17-трифторметил-[3,2 с]изоксазол-5-андростан,17-гидрокси-17-пентафторэтил-[3,2 с]изоксазол-5-андростан,17-гидрокси-17-трифторметил-[3,2 с]пиразол-5-андростан,17-гидрокси-17-пентафторэтил-[3,2 с]пиразол-5-андростан,17-гидрокси-17-трифторметил-2,3-эпитио-5-андростан,17-гидрокси-17-пентафторэтил-2,3-эпитио-5-андростан,17-гидрокси-17-трифторметил-2,3-эпитио-5-андростан,17-гидрокси-17-пентафторэтил-2,3-эпитио-5-андростан,17-гидрокси-17-трифторметил-2-окса-5-андростан-3-он,17-гидрокси-17-пентафторэтил-2-окса-5-андростан-3-он,17-гидрокси-17-трифторметил-5-андрост-1-ен-3-он,17-гидрокси-17-пентафторэтил-5-андрост-1-ен-3-он,17-гидрокси-17-трифторметил-1-метил-5-андрост-1-ен-3-он,17-гидрокси-17-пентафторэтил-1-метил-5-андрост-1-ен-3-он,17-гидрокси-17-трифторметил-2-метил-5-андрост-1-ен-3-он и 17-гидрокси-17-пентафторэтил-2-метил-5-андрост-1-ен-3-он. 18. Способ получения 17-фторалкилстероидов общей формулы I по п.1, отличающийся тем, что соединения общей формулы II в которой R1 , R4 , R5 , R6 и STEROID имеют значения, указанные в п.1, в присутствии фторида подвергают взаимодействию с перфторалкилтриалкилсиланами (Alk)3SiCnF2n+1 или с фторалкиллитиемLiCnF2n+1, соответственно со фторалкильными реактивами Гриньяра ZMgCnF2n+1, где n обозначает 1, 2, 3,4, 5, или 6, Z обозначает атом хлора, брома или иода и Alk обозначает С 1-С 4 алкил. 19. Фармацевтические композиции, содержащие в своем составе по меньшей мере один 17 фторалкилстероид общей формулы I по любому из пп.1-17, при необходимости вместе с фармацевтически приемлемыми вспомогательными веществами и носителями. 20. 17-фторалкилстероиды общей формулы I по любому из пп.1-17 для применения в качестве терапевтического активного вещества. 21. Применение 17-фторалкилстероидов общей формулы IR2 представляет собой гидроксигруппу, группу OC(O)-R20 или OR21, где R20 и R21 обозначают С 1 С 12 алкильную группу, С 3-С 8 циклоалкильную группу, арильную группу или арил-С 1-С 4 алкильную группу;R3 представляет собой остаток формулы CnF2n+1, где n обозначает 1, 2, 3, 4, 5 или 6;R4 и R5 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;R5 и R6 каждый представляет собой атом водорода или оба вместе образуют двойную связь или метиленовый мостик;STEROID представляет собой стероидную ABC-циклическую систему субформул А, В, С, D, Е и F при этом в формулах А и С в положении 1,2 может находиться дополнительная двойная связь, а в формуле В в положении 8,9 и в положении 11,12 могут находиться одна или две дополнительные двойные связи;R7 представляет собой атом водорода, атом галогена, гидроксильную группу или трифторметильную группу;X обозначает атом кислорода или два атома водорода;R8 представляет собой атом водорода, метильную или этильную группу;R9 представляет собой атом водорода либо атом галогена или вместе с R10 образует двойную связь;R10 представляет собой атом водорода, гидроксильную группу, метильную либо этильную группу или вместе с R9 образует двойную связь;R11 представляет собой атом водорода, С 1-С 4 алкильную группу, нитрильную группу, гидроксиметиленовую или формильную группу;R12 представляет собой атом водорода, С 1-С 4 алкильную группу или нитрильную группу;R11 и R12 наряду с вышеуказанными значениями вместе образуют метиленовый мостик;R13 представляет собой атом водорода или вместе с R7 образует двойную связь;R14 и R15 вместе образуют двойную связь, оксирановое кольцо, тиирановое кольцо,[2,3 с]оксадиазольное кольцо, [3,2 с]изоксазольное кольцо или [3,2 с]пиразольное кольцо;Y обозначает атом кислорода или азота; при этом волнистые линии y R7, R8, R11, R12, R13, R14 и R15 означают, что данные заместители могут находиться в - либо -положении, за исключением соединений из группы, включающей 17-гидрокси-17-трифторметиландрост-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4-ен-3-он,17-гидрокси-17-трифторметилэстр-4,9-диен-3-он,17-гидрокси-17-трифторметилэстр-4,9,11-триен-3-он,13-этил-17-гидрокси-17-трифторметилгон-4-ен-3-он,13-этил-17-гидрокси-17-трифторметилгон-4,9-диен-3-он и 13-этил-17-гидрокси-17-трифторметилгон-4,9,11-триен-3-он,для получения фармацевтических композиций, предназначенных для контроля репродуктивной способности у мужчин, для гормонзаместительной терапии (ГЗТ) у мужчин и женщин или для лечения обусловленных гормональными факторами заболеваний у мужчин и женщин, таких, например, как эндометриоз, рак молочной железы или гипогонадизм.
МПК / Метки
МПК: A61K 31/565, A61P 5/26, C07J 1/00
Метки: эти, 17α-фторалкилстероиды, композиции, получения, способ, фармацевтические, соединения, содержащие
Код ссылки
<a href="https://eas.patents.su/18-5772-17alpha-ftoralkilsteroidy-sposob-ih-polucheniya-i-soderzhashhie-eti-soedineniya-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">17α-фторалкилстероиды, способ их получения и содержащие эти соединения фармацевтические композиции</a>
Предыдущий патент: Легкий теплоизоляционный формованный продукт с высокой механической прочностью и способ его получения
Следующий патент: Способ получения замещённых бензимидазола
Случайный патент: Способ и установка для экономичного получения малосернистого высокооктанового бензина






















