Гидроксамиды (4-сульфониламино)тетрагидропиран-4-карбоновой кислоты
Формула / Реферат
1. Соединение формулы
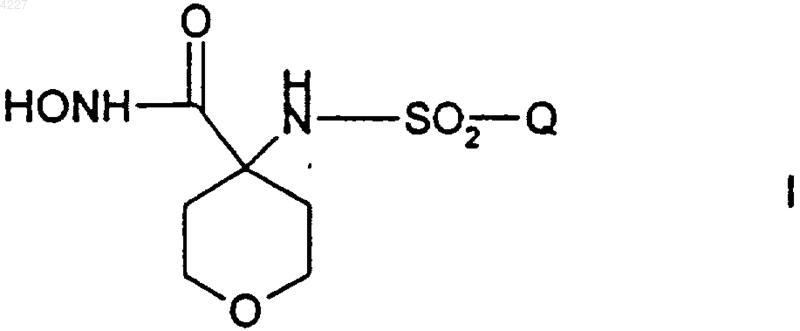
где Q представляет собой (C1-C6)алкил, (C6-C10)арил, (C2-C9)гетероарил, (C6-C10)арилокси(C1-C6)алкил, (C6-C10)арилокси(C6-C10)арил, (C6-C10)арилокси(C2-C9)гетероарил, (C6-C10)арил(C1-C6)алкил, (C6-C10)арил(C6-C10)арил, (C6-C10)арил(C2-C9)гетероарил, (C6-C10)арил(C6-C10)арил(C1-C6)алкил, (C6-C10)арил(C6-C10)арил(C6-C10)арил, (C6-C10)арил(C6-C10)арил(C2-C9)гетероарил, (C2-C9)гетероарил(C1-C6)алкил, (C2-C9)гетероарил(C6-C10)арил, (C2-C9)гетероарил(C2-C9)гетероарил, (C6-C10)арил(C1-C6)алкокси(C1-C6)алкил, (C6-C10)арил(C1-C6)алкокси(C6-C10)арил, (C6-C10)арил(C1-C6)алкокси(C2-C9)гетероарил, (C2-C9)гетероарилокси(C1-C6)алкил, (C2-C9)гетероарилокси(C6-C10)арил, (C2-C9)гетероарилокси(C2-C9)гетероарил, (C2-C9)гетероарил(C1-C6)алкокси(C1-C6)алкил, (C2-C9)гетероарил(C1-C6)алкокси(C6-C10)арил или (C2-C9)гетероарил(C1-C6)алкокси(C2-C9)гетероарил;
где каждый из (C6-C10)арильных или (C2-C9)гетероарильных остатков указанных (C6-C10)арила, (C2-C9)гетероарила, (C6-C10)арилокси (C1-C6)алкила, (C6-C10)арилокси(C6-C10)арила, (C6-C10)арилокси (C2-C9)гетероарила, (C6-C10)арил(C1-C6)алкила, (C6-C10)арил(C6-C10)арила, (C6-C10)арил(C2-C9)гетероарила, (C6-C10)арил(C6-C10)арил(C1-C6)алкила, (C6-C10)арил(C6-C10)арил(C6-C10)арила, (C6-C10)арил(C6-C10)арил(C2-C9)гетероарила, (C2-C9)гетероарил(C1-C6)алкила, (C2-C9)гетероарил(C6-C10)арила, (C2-C9)гетероарил(C2-C9)гетероарила, (C6-C10)арил(C1-C6)алкокси(C1-C6)алкила, (C6-C10)арил(C1-C6)алкокси(C6-C10)арила, (C6-C10)арил(C1-C6)алкокси(C2-C9)гетероарила, (C2-C9)гетероарилокси(C1-C6)алкила, (C2-C9)гетероарилокси(C6-C10)арила, (C2-C9)гетероарилокси(C2-C9)гетероарила, (C2-C9)гетероарил (C1-C6)алкокси(C1-C6)алкила, (C2-C9)гетероарил(C1-C6)алкокси(C6-C10)арила или (C2-C9)гетероарил(C1-C6)алкокси(C2-C9)гетероарила является необязательно замещенным по любому из атомов углерода на кольце, способных к образованию дополнительной связи с помощью одного или нескольких заместителей в кольце, независимо выбранных из фтора, хлора, брома, (C1-C6)алкила, (C1-C6)алкокси, перфтор(C1-C3)алкила, перфтор(C1-C3)алкокси и (C6-C10)арилокси;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где Q представляет собой необязательно замещенный (C6-C10)арил, (C6-C10)арил(C6-C10)арил, (C6-C10)арилокси(C6-C10)арил, (C6-C10)арилокси(C2-C9)гетероарил, (C2-C9)гетероарил, (C2-C9)гетероарил(C2-C9)гетероарил, (C6-C10)арил(C2-C9)гетероарил, (C2-C9)гетероарил(C6-C10)арил, (C2-C9)гетероарилокси(C6-C10)арил, (C6-C10)арил(C1-C6)алкокси(C6-C10)арил или (C2-C9)гетероарил(C1-C6)алкокси(C6-C10)арил.
3. Соединение по п.1, где Q представляет собой необязательно замещенный (C6-C10)арилокси(C6-C10)арил.
4. Соединение по п.3, где кольцо (C6-C10)арилокси указанной (C6-C10)арилокси(C6-C10)арильной группы является необязательно монозамещенным в 4-м положении кольца.
5. Соединение по п.1, где указанное соединение является выбранным из группы, включающей
гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(фенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(4-пиридилокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(4-фторфенил)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(4-фторфенилметокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты;
гидроксиамид 4-[4-(фенилметокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты и
гидроксиамид 4-[4-(4-фторфенилэтокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты.
6. Фармацевтическая композиция для лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника, болезнь Крона, эмфизему, хроническую обструктивную болезнь легких, болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание периодонта, буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз (включая отрыв атеросклеротических бляшек), аневризму аорты (включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда, инсульт, ишемию головного мозга, черепно-мозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень, депрессию, периферическую нейропатию, боль, церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез сосудов в роговице глаз, травму роговицы, дегенерацию пятна, аномальное заживление ран, ожоуш, сахарный диабет, прорастание опухоли, рост опухоли, метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис и септический шок, у млекопитающего, включая человека, включающая количество соединения по п.1, эффективного при таких лечениях, и фармацевтически приемлемый носитель.
7. Способ лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника, болезнь Крона, эмфизему, хроническую обструктивную болезнь легких, болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание периодонта, буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз (включая отрыв атеросклеротических бляшек), аневризму аорты (включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда, инсульт, ишемию головного мозга, черепно-мозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень, депрессию, периферическую нейропатию, боль, церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез сосудов в роговице глаз, травму роговицы, дегенерацию пятна, аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли, метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис и септический шок, у млекопитающего, включая человека, включающий введение указанному млекопитающему количества соединения по п.1, эффективного при лечении такого состояния.
8. Фармацевтическая композиция для лечения состояния, которое может быть излечено путем ингибирования матриксных металлопротеиназ у млекопитающего, включая человека, содержащая количество соединения по п.1, эффективное для такого лечения, и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция для лечения состояния, которое может быть излечено путем ингибирования репролизина у млекопитающих, включая человека, содержащая количество соединения по п.1, эффективное для такого лечения, и фармацевтически приемлемый носитель.
10. Способ ингибирования матриксных металлопротеиназ у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
11. Способ ингибирования репролизина у млекопитающих, включая человека, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к производным гидроксамида (4-сульфониламино) тетрагидропиран-4-карбоновой кислоты и к фармацевтическим композициям, и к способам лечения. Соединения по настоящему изобретению являются ингибиторами цинк-металлоэндопептидаз, особенно тех, которые принадлежат к подсемействам матриксных металлопротеиназ(также называемой ММР или матриксином), и репролизина (также известного как адамилзин) метцинкинов (Rawlings, et al. Methods in Enzymology, 248, 183-228 (1995) and Stocker, et al.,Protein Science, 4, 823-840 (1995. Подсемейство ферментов ММР в настоящее время содержит семнадцать членов (ММР 1, ММР-2, ММР-3, ММР-7, ММР-8, ММР-9,ММР-10, ММР-11, ММР-12, ММР-13, ММР-14,ММР-15, ММР-16, ММР-17, ММР-18, ММР-19,ММР-20). Ферменты подсемейства ММР наиболее известны своей ролью в регуляции оборота белков межклеточных тканей, и в таком качестве играют важную роль в таких нормальных физиологических процессах, как репродукция,развитие и дифференцировка. Кроме того, ферменты ММР выраженно присутствуют во многих патологических ситуациях, в которых осуществляется аномальный метаболизм соединительной ткани. Например, ММР-13, фермент,обладающий сильной деградирующей активностью в отношении коллагена типа II (основной тип коллагена в хряще), как показано, присутствует в избыточных количествах в остеоартритном хряще (Mitchell, et al., J. Clin. Invest. 97, 761(1996. Другие ферменты ММР (ММР-2, ММР 3, ММР-8, ММР-9, ММР-12) также присутствуют в избыточных количествах в остеоартритном хряще, и ингибирование некоторых или всех этих ферментов подсемейства ММР, как ожидается, будет замедлять или блокировать ускоренную потерю хрящевой ткани, типичную для болезней суставов, таких как остеоартрит или ревматоидный артрит. Репролизины млекопитающих известны как ADAM (A Disintegrin And Metalloproteinase)(1995 и содержат домен дизинтегрина в дополнение к домену, подобному металлопротеиназе. В настоящее время идентифицированы двадцать три различных ADAM.ADAM-17, также известный как фермент,преобразующий фактор некроза опухоли альфа(ТАСЕ), представляет собой наиболее известный ADAM. ADAM-17 (ТАСЕ) является ответственным за расщепление связанного с клетками фактора некроза опухоли - альфаTNF-, как наблюдалось, принимает участие во многих инфекционных и аутоиммунных заболеваниях (W. Friers, FEBS Letters, 285, 199 (1991. Более того, показано, что TNF- является первичным медиатором воспалительной реакции,наблюдаемой при сепсисе и септическом шоке(Spooner, et al., Clinical Immunology and Immunopathology, 62 S11 (1992. Существуют две формы TNF-, мембранный белок типа II с относительной молекулярной массой 26000 (26 кДа) и растворимая форма с молекулярной массой 17 кДа, генерируемая из связывающего клетки белка путем специфического протеолитического расщепления. Растворимая формаTNF- с молекулярной массой 17 кДа высвобождается клеткой и ассоциирована с вредными эффектами TNF-. Эта форма TNF- является также способной к действию в областях, удаленных от области синтеза. Таким образом, ингибиторы ТАСЕ предотвращают образование растворимого TNF- и предотвращают вредные эффекты растворимого фактора. Выбранные соединения по настоящему изобретению являются сильными ингибиторами агреканазы, фермента, играющего важную роль при деградации агрекана хрящей. Агреканаза,как полагают, также является ADAM. Потеря агрекана из межклеточной ткани хряща представляет собой важный фактор при развитии таких заболеваний суставов, как остеоартрит и ревматоидный артрит, и ингибирование агреканазы, как ожидается, будет замедлять или блокировать потерю хрящевой ткани при этих заболеваниях. Другие ADAM, которые, как показано, выраженно присутствуют в патологических ситуациях, включают ADAM TS-1 (Kuno, et al., J.Comm., 235, 437-442, (1997. Насколько известно, выраженное присутствие, наличие физиологических субстратов и связь ADAM с заболеваниями увеличивает общую значимость роли ингибирования этого класса ферментов, которое будет встречено с признательностью. Заболевания, при которых ингибирование ферментов ММР и/или ADAM будет обеспечивать терапевтическое преимущество, включают артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника,болезнь Крона, эмфизему, острый респираторный дистресс-синдром, бронхиальную астму,хроническую обструктивную болезнь легких,болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание периодонта, буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз (включая отрыв атеросклеротических бляшек), аневризму аорты(включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сер 3 дечную недостаточность, инфаркт миокарда,инсульт, ишемию головного мозга, черепномозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень,депрессию, периферическую нейропатию, боль,церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез в роговице глаз,травму роговицы, дегенерацию пятна сетчатки,аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли,метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис, септический шок, и другие заболевания, характеризуемые выраженной экспрессией металлопротеиназы или ADAM. Настоящее изобретение также относится к способу использования соединений по настоящему изобретению для лечения указанных выше заболеваний млекопитающих, в частности,людей, и к фармацевтическим композициям,пригодным для этого. Замечено, что различные сочетания ММР и ADAM присутствуют в различных патологических ситуациях. Поэтому ингибиторы со специфическими селективностями к индивидуальным ADAM и/или ММР могут быть предпочтительными для отдельных заболеваний. Например, ревматоидный артрит представляет собой воспалительное заболевание суставов, характеризуемое избыточными уровнями TNF и потерями составляющих межклеточной ткани сустава. В этом случае, соединение, которое ингибирует ТАСЕ и агреканазу, а также ММР, такие как ММР-13, могут представлять собой предпочтительную терапию. В противоположность этому, при заболевании сустава с меньшим воспалением, таком как остеоартрит, могут быть предпочтительными соединения, которые ингибируют ММР, разрушающие межклеточную ткань, такие как ММР-13, но не ТАСЕ. Авторы настоящего изобретения также обнаружили, что является возможным создание ингибиторов с дифференцированной активностью к металлопротеазам. В частности, например, авторы настоящего изобретения оказались способными создавать молекулы, которые селективно ингибируют матриксную металлопротеазу-13 (ММР-13) преимущественно по сравнению с ММР-1. Ингибиторы матриксной металлопротеиназы и репролизина хорошо известны в литературе. В частности, публикация РСТ WO 96/33172, опубликованная 24 октября 1996 года,относится к циклическим арилсульфониламиногидроксамовым кислотам, которые пригодны для использования в качестве ингибиторов ММР. Патент США 5672615, публикация РСТ 4 РСТ WO 98/34918, опубликованная 13 августа 1998 года, озаглавленная "Arylsulfonyl Hydroxamic Acid Derivatives", все относятся к циклическим гидроксамовым кислотам, которые являются пригодными для использования в качестве ингибиторов ММР. Публикации РСТ WO 96/27583 и WO 98/07697, опубликованные 7 марта 1996 года и 26 февраля 1998 года, соответственно, относятся к арилсульфонил гидроксамовым кислотам. Публикация РСТ WO 98/03516, опубликованная 29 января 1998 года,относится к фосфинатам с активностью по отношению ММР. Публикация РСТ 98/34915,опубликованная 13 августа 1998 года, озаглавленная "N-Hydroxy-b-Sulfonyl Propionamide Derivatives" относится к пропионилгидроксамидам в качестве пригодных для использования ингибиторов ММР. Публикация РСТ WO 98/33768,опубликованная 6 августа 1998 года, озаглавленная "Arylsulfonylamino Hydroxamic Acid Derivatives", относится к N-замещенным арилсульфониламиногидроксамовым кислотам. Публикация РСТ WO 98/30566, опубликованная 16 июля 1998 года, озаглавленная "Cyclic Sulfone Derivatives," относится к циклическим сульфон-гидроксамовым кислотам в качестве ингибиторов ММР. Предварительная заявка на патент США 60/55208, поданная 8 августа 1997 года, относится к биарилгидроксамовым кислотам в качестве ингибиторов ММР. Предварительная заявка на патент США серийный No. 60/55207, поданная 8 августа 1997 года, озаглавленная "Aryloxyarylsulfonylamino Hydroxamic Acid Derivatives" относится к арилоксисульфонилгидроксамовым кислотам в качестве ингибиторов ММР. Предварительная заявка на патент США 60/62766, поданная 24 октября 1997 года, озаглавленная "The Use of MMP-13Selective Inhibitors For The Treatment of Osteoarthntis and Other MMP Mediated Disorders," относится к использованию селективных ингибиторов MMP-13 для лечения воспаления и других расстройств. Предварительная заявка на патент США серийный 60/68261, поданная 19 декабря 1997 года, относится к использованию ингибиторов ММР для лечения образования сосудов на роговице глаз и других расстройств. Каждая из упомянутых выше публикаций и заявок тем самым включается сюда в качестве ссылки во всей ее полноте. Краткое описание изобретения Настоящее изобретение относится к соединению формулы или его фармацевтически приемлемым солям, где Q представляет собой (С 1-С 6)алкил, (С 6 С 10)арил, (С 2-С 9)гетероарил, (С 6-С 10)арилокси(С 6-С 10)арил,(С 2-С 9)гетероарил(С 2-С 9)гетероарил, (С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкил,(С 6-С 10)арил(C1-С 6)алкокси(С 6-С 10)арил, (С 6-С 10) арил(C1-С 6)алкокси(С 2-С 9)гетероарил, (С 2-С 9)гетероарилокси(C1-С 6)алкил, (С 2-С 9)гетероарилокси(С 6-С 10)арил, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарил, (С 2-С 9)гетероарил(C1-С 6)алкокси(С 1 С 6)алкил, (С 2-С 9)гетероарил(C1-С 6)алкокси(С 6 С 10)арил или (С 2-С 9)гетероарил(C1-С 6)алкокси(С 2-С 9)гетероарил; где каждый из (С 6-С 10)арильных или (С 2 С 9)гетероарильных остатков указанных (С 6-С 10) арила, (С 2-С 9)гетероарила, (С 6-С 10)арилокси(C1 С 6)алкила, (С 6-С 10)арилокси(С 6-С 10)арила, (С 6 С 10)арилокси(С 2-С 9)гетероарила,(С 6-С 10)арил(С 2-С 9)гетероарила, (С 6-С 10)арил(C1-С 6)алкокси(C1-С 6)алкила, (С 6-С 10)арил(C1-С 6)алкокси(С 6 С 10)арила, (С 6-С 10)арил(С 1-С 6)алкокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарилокси(C1-С 6)алкила,(С 2-С 9)гетероарилокси(С 6-С 10)арила, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(C1-С 6)алкила, (С 2-С 9)гетероарил(C1-С 6)алкокси(С 6-С 10)арила или (С 2-С 9)гетероарил(C1-C6)алкокси(С 2-С 9)гетероарила является необязательно замещенным на любом из атомов углерода на кольце, способных к образованию дополнительной связи, с помощью одного или нескольких заместителей на каждом кольце, независимо выбранных из фтора, хлора,брома, (C1-C6)алкила, (С 1-С 6)алкокси, перфтор(С 1-С 3)алкила, перфтор(С 1-С 3)алкокси и (С 6-С 10) арилокси; или к его фармацевтически приемлемой соли. Термин "алкил", как он используется здесь, если не указано иного, включает насыщенные одновалентные углеводородные радикалы, содержащие прямые, разветвленные или циклические группы, или их сочетания. Термин "алкокси", как он используется здесь, включает О-алкильные группы, где "алкил" является таким, как определено выше. Термин "арил", как он используется здесь,если не указано иного, включает органический радикал, производный ароматического углеводорода путем удаления одного атома водорода,такой как фенил или нафтил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей фтор, хлор, бром,перфтор(С 1-С 6)алкил (включая трифторметил), 004227(С 1-С 6)алкокси, (С 6-С 10)арилокси, перфтор(C1 С 3)алкокси (включая трифторметокси и дифторметокси) и (C1-С 6)алкил. Термин "гетероарил", как он используется здесь, если не указано иного, включает органический радикал, производный ароматического гетероциклического соединения путем удаления одного атома водорода, такой как пиридил, фурил, пирроил, тиенил, изотиазолил, имидазолил,бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил,изоиндолил, пуринил, карбазолил, изоксазолил,тиазолил, оксазолил, бензтиазолил, или бензоксазолил, необязательно замещенный 1-2 заместителями, выбранными из группы, включающей фтор, хлор, трифторметил, (C1-C6)алкокси, (С 6 С 10)арилокси, трифторметокси, дифторметокси и (C1-C6)алкил. Предпочтительные гетероарилы включают пиридил, фурил, тиенил, изотиазолил, пиразинил, пиримидил, пиразолил, изоксазолил, тиазолил или оксазолил. Наиболее предпочтительные включают пиридил, фурил или тиенил. Предпочтительные соединения формулы I включают такие, где Q представляет собой необязательно замещенный (С 6-С 10)арил, (С 6-С 10) арил(С 6-С 10)арил, (С 6-С 10)арилокси(С 6-С 10)арил,(С 6-С 10)арилокси(С 2-С 9)гетероарил, (С 2-С 9)гетероарил,(С 2-С 9)гетероарил(С 2-С 9)гетероарил,(С 6-С 10)арил(С 2-С 9)гетероарил,(С 2-С 9)гетероарил(С 6-С 10)арил, (С 2-С 9)гетероарилокси(С 6-С 10) арил, (С 6-С 10)арил(C1-С 6)алкокси(С 6-С 10)арил,или(С 2-С 9)гетероарил(C1-С 6)алкокси(С 6-С 10) арил. Другие предпочтительные соединения формулы I включают такие, где Q представляет собой необязательно замещенный (С 6-С 10)арилокси(С 6-С 10)арил. Конкретные предпочтительные соединения формулы I включают следующие соединения: гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(фенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-пиридилокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенил)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенилметокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 7 гидроксиамид 4-[4-(фенилметокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; и гидроксиамид 4-[4-(4-фторфенилэтокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. Настоящее изобретение также относится к фармацевтической композиции для лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника,болезнь Крона, эмфизему, острый респираторный дистресс-синдром, бронхиальную астму,хроническую обструктивную болезнь легких болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль (такую как солидные раковые опухоли,включая рак прямой кишки, рак молочной железы, рак легких и рак простаты, и гематопоетические злокачественные заболевания, лейкемии и лимфомы), изъязвления тканей, рестеноз, заболевания периодонта, буллезный эпидермолиз,остеопороз, ослабление имплантированного искусственного сустава, атеросклероз, (включая отрыв атеросклеротических бляшек), аневризму аорты (включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда,инсульт, ишемию головного мозга, черепномозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень,депрессию, периферическую нейропатию, боль,церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез в роговице глаз,травму роговицы, дегенерацию пятна сетчатки,аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли,метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис, септический шок, и другие заболевания, характеризующиеся активностью репролизина, у млекопитающих, включая человека, включающей количество соединения формулы I или его фармацевтически приемлемой соли, эффективной при таких лечениях, и фармацевтически приемлемого носителя. Настоящее изобретение также относится к фармацевтическим композициям для ингибирования (а) матриксных металлопротеиназ или других металлопротеиназ, участвующих в деградации межклеточной ткани, или (b) репролизина млекопитающих (таких как агреканаза илиADAM TS-1, 10, 12, 15 и 17, наиболее предпочтительно ADAM-17) у млекопитающих, включая человека, содержащим эффективное количество соединения формулы I или его фармацевтически приемлемой соли. 8 Настоящее изобретение также относится к способу лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника, болезнь Крона, эмфизему, хроническую обструктивную болезнь легких, болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание периодонта, буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз, (включая отрыв атеросклеротических бляшек), аневризму аорты(включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда,инсульт, церебральную ишемию, черепномозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные расстройства, болезнь Хантингтона, болезнь Паркинсона, мигрень,депрессию, периферическую нейропатию, боль,церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез в роговице глаз,травму роговицы, дегенерацию пятна сетчатки,аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли,метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис, септический шок, и других заболеваний, характеризующихся активностью металлопротеиназы, и других заболеваний, характеризующихся активностью репролизина, у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы I или его фармацевтически приемлемой соли, эффективного при лечении таких состояний. Настоящее изобретение также относится к способу ингибирования (а) матриксных металлопротеиназ или других металлопротеиназ, участвующих в деградации межклеточной ткани,или (b) репролизина млекопитающих (такого как агреканаза или ADAM TS-1, 10, 12, 15 и 17,предпочтительно ADAM-17) у млекопитающих,включая человека, включающему введение эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также определяет фармацевтические композиции, включающие соединения-предшественники соединений формулы I. Настоящее изобретение также определяет способы лечения или профилактики расстройств, которые могут быть вылечены или предотвращены путем ингибирования матриксных металлопротеиназ или ингибирования репролизина млекопитающих, включающих введение соединений-предшественников соединений формулы I. Соединения формулы I, имею 9 щие свободные амино, амидо, гидрокси или карбоксильные группы, могут быть преобразованы в соединения-предшественники. Соединения-предшественники включают соединения,где аминокислотный остаток или полипептидная цепь из двух или более (например, двух,трех или четырех) аминокислотных остатков,которые ковалентно присоединены через пептидные связи к свободным амино, гидроксигруппам или группам карбоновых кислот соединений формулы I. Аминокислотные остатки включают все 20 существующих в природе аминокислот, обычно обозначаемых символами из трех букв, а также включают 4-гидроксипролин,гидроксилизин, демозин, изодемозин, 3 метилгистидин, норвалин, бета-аланин, гаммааминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин, и метионин сульфон. Соединения-предшественники также включают соединения, где карбонаты, карбаматы, амиды и алкиловые сложные эфиры ковалентно связаны с указанным заместителем формулы I через боковую углеродную цепь карбонильной группы соединения-предшественника . Специалист в данной области заметит, что соединения по настоящему изобретению являются пригодными для использования при лечении широкого ряда заболеваний. Специалист в данной области также заметит, что при использовании соединения по настоящему изобретению для лечения конкретного заболевания, соединения по настоящему изобретению могут объединяться с различными существующими терапевтическими агентами, используемыми при такой болезни. Для лечения ревматоидного артрита соединения по настоящему изобретению могут объединяться с такими агентами, как ингибиторы TNF-, например, анти-TNF моноклональные антитела и молекулы иммуноглобулинов рецепторов TNF (такие как Enbrel), с малыми дозами метотрексата, лефунимида, гидроксихлорхина, д-пенициламина, ауранофина, или парентерального или перорального золота. Соединения по настоящему изобретению могут быть также использованы в сочетании с существующими терапевтическими агентами для лечения остеоартрита. Соответствующие агенты для комбинированного использования включают стандартные нестероидные противовоспалительные средства (здесь и далее НСПВЛС), такие как пироксикам, диклофенак,пропионовые кислоты, такие как напроксен,флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин, СОХ-2 ингибиторы, такие как целекоксиб и рофекоксиб, анальгетики и вещества для внутрисуставной терапии, такие как кортикостероиды и хиалуроновые кислоты, такие как хиалган и синвиск. 10 Соединения по настоящему изобретению могут быть также использованы в сочетании с противораковыми средствами, такими как эндостатин и ангиостатин или цитотоксическими лекарственными средствами, такими как адриамицин, дауномицин, цис-платина, этопозид,таксол, таксотер, и алкалоидами, такими как винкристин, и антиметаболитами, такими как метотрексат. Соединения по настоящему изобретению могут быть также использованы в сочетании с сердечно-сосудистыми средствами, такими как блокаторы кальциевых каналов, с агентами, понижающими уровень липидов, такими как статины, фибраты, бета-блокаторы, ингибиторы Асе, антагонисты рецепторов ангиотензина-2 и ингибиторы агрегации бляшек. Соединения по настоящему изобретению могут быть также использованы в сочетании с агентами для центральной нервной системы,такими как антидепрессанты (такие как сертралин), лекарствами от болезни Паркинсона (такие как депренил, L-допа, реквип, миратекс,ингибиторы МАОВ, такие как селегин, и расагилин, ингибиторы соmР, такие как Tasmar, ингибиторы А-2, ингибиторы повторного извлечения допамина, антагонисты NMDA, агонисты никотина, агонисты допамина, и ингибиторы нейронной синтазы окиси азота), и лекарствами против болезни Aльцгеймера, такими как арицепт, такрин, ингибиторы СОХ-2, пропентофилин или метрифонат. Соединения по настоящему изобретению могут быть также использованы в сочетании с агентами против остеопороза, такими как дролоксифен или фосомакс и иммунодепрессивными агентами, такими как FK-506 и рапамицин. Подробное описание изобретения Следующая далее схема реакции иллюстрирует получение соединений по настоящему изобретению. Если не указано по иному, Q в схемах реакции и в дискуссии, которая следует далее, определяется также как и выше. Схема 1 Схема 1 относится к получению соединений формулы I. Обращаясь к схеме 1, соединение формулыI получают из карбоновой кислоты формулы II путем обработки 1-(3-диметиламинопропил)-3 этилкарбодиимидом и 1-гидроксибензтриазолом в полярном растворителе, таком как N,Nдиметилформамид, с последующим добавлением гидроксиламина в реакционную смесь через период времени в пределах между примерно 15 мин и примерно 1 ч, предпочтительно примерно через 30 мин. Гидроксиламин предпочтительно получают in situ из солевой формы, такой как гидроксиламин гидрохлорид, в присутствии основания, такого как триэтиламин. Альтернативно, соединение формулы I может быть получено из соединения формулы II путем взаимодействия с защищенным производным гидроксиламина или его солевой формой, где гидроксильная группа является защищенной в качестве трет-бутилового, бензилового, аллилового или 2-триметилсилилэтилового простого эфира. Удаление гидроксильной защитной группы осуществляется путем гидрогенолиза, для бензильной защитной группы (5% палладий на сульфате бария является предпочтительным катализатором), или путем обработки сильной кислотой, такой как трифторуксуная кислота, для трет-бутильной защитной группы. Аллильная защитная группа может быть удалена путем обработки гидридом трибутилолова и уксусной кислотой в присутствии катализатора бис(трифенилфосфин)палладий(II) хлорида. 2 Триметилсилилэтиловый простой эфир может быть удален путем взаимодействия с сильной кислотой, такой как трифторуксусная кислота или путем взаимодействия с источником фтора,таким как эфират трифторида бора. Взаимодействие соединения II с гидроксиамином, солью гидроксиламина, защищенным производным гидроксиламина или солью защищенного производного гидроксиламина может быть также осуществлено в присутствии(бензтриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфата и основания, такого как триэтиламин, в инертном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при температуре в пределах примерно между 0 и примерно 50 С, предпочтительно при комнатной температуре, в течение периода времени в пределах между примерно 1 ч и примерно 3 днями, предпочтительно в течение примерно 1 дня. Другая процедура преобразования соединения формулы II в соединение формулы I представляет собой взаимодействие соединения формулы II с O-бензилгидроксиламингидрохлоридом в присутствии (бензтриазол-1-илокси) трис-(диметиамино)фосфоний гексафторфосфата и триэтиламина, с использованием метиленхлорида в качестве растворителя. Последующее удаление O-бензильной защитной группы для получения соединения формулы I осуществляется затем путем гидрирования при давлении водорода 3 атмосферы и при комнатной температуре, с использованием 5% палладия на сульфате бария в качестве катализатора. Предпочтительный растворитель представляет собой метанол. Время реакции может изменяться от около 1 ч до около 2 дней (8 ч является предпочтительным временем). Предпочтительная процедура для преобразования соединения формулы II в соединение формулы I представляет собой взаимодействие соединения формулы II с оксалилхлоридом в метиленхлориде в присутствии каталитически эффективного количества ДМФ в течение 16 ч. Полученный хлорангидрид взаимодействует при 0 С с N,O-бис(триметилсилил)гидроксиламином, полученным путем взаимодействия гидроксиламин гидрохлорида с хлортриметилсиланом в пиридине, при температуре от 0 С до комнатной температуры. Продукт формулы I получают после нескольких часов взаимодействия при температуре от 0 С до комнатной температуры с последующей обработкой кислым водным раствором, которая удаляет все триметилсилильные остатки. В определенных случаях является предпочтительным получение соединения формулыI путем взаимодействия гидроксиламина, соли гидроксиламина, защищенного производного гидроксиламина или соли защищенного производного гидроксиламина с активированным сложным эфиром формулы III. Взаимодействие осуществляют в инертном растворителе, таком как N,N-диметилформамид, при температуре,находящейся в пределах примерно от комнатной температуры до примерно 80 С, предпочтительно около 60 С, в течение периода времени от около 1 ч до около 2 дней. Если используется защищенное производное гидроксиламина или соль защищенного производного гидроксиламина, удаление защитной группы осуществляют так, как описано выше. Производное активиро 13 ванного сложного эфира формулы III получают путем обработки соединения формулы II (бензтриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфатом и основанием, таким как триэтиламин, в инертном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при температуре, находящейся между примерно 0 и примерно 50 С, предпочтительно при комнатной температуре, в течение периода времени в пределах между примерно 1 ч и примерно 3 днями, предпочтительно в течение примерно 1 дня. Промежуточное соединение формулы II получают путем омыления соединения формулыIV. Взаимодействие осуществляется в растворителе, таком как водный раствор этанола, с избытком гидроксидов металлов, таких как гидроксид натрия или гидроксид лития, при температуре от около 20 до около 100 С, (то есть от комнатной температуры до температуры дефлегмации растворителя), предпочтительно около 80 С. Реакционную смесь, как правило,перемешивают при комнатной температуре в течение периода времени в пределах между примерно 30 мин и примерно 1 неделей, предпочтительно в течение примерно 16 ч. Соединение формулы IV получают путем взаимодействия соединения формулы V с реакционноспособным функциональным производным сульфоновой кислоты (QSO2OH), например сульфонилхлоридом (QSO2Cl), в присутствии основания. Соответствующие основания включают гидроксид натрия, триэтиламин или диизопропилэтиламин, предпочтительно триэтиламин. Соответствующие растворители включают диметилформамид (ДМФ), метиленхлорид, тетрагидрофуран, диоксан, воду или ацетонитрил,предпочтительно ДМФ. Реакционную смесь перемешивают при температуре, находящейся в пределах между около 0 и около 50 С, предпочтительно от около 20 до около 25 С (то есть комнатная температура), в течение периода времени в пределах между примерно 10 мин и примерно 2 днями, предпочтительно в течение примерно 1 дня. Соединение формулы V получают путем гидролиза соединения формулы IV. Конкретно,соединение формулы VI обрабатывают водным раствором кислоты, предпочтительно в присутствии несмешивающегося органического растворителя, такого как этиловый эфир, диизопропиловый эфир или метиленхлорид. Соответствующие кислоты включают соляную кислоту и серную кислоту. Реакционную смесь перемешивают при комнатной температуре в пределах между около 0 и около 50 С, предпочтительно,от около 20 до около 25 С (то есть комнатная температура), в течение периода времени между около 10 мин и около 2 днями, предпочтительно в течение около 1 дня. Соединение формулы VI получают путем взаимодействия аминокислотного производного 14 формулы VII с соединением формулы VIII в присутствии основания и растворителя, где Х представляет собой Сl, Вr, I, тозилат или мезилат. Соответствующие основания включают этиленгликоль, гидрид натрия, диизопропиламид лития или гексаметилдисилазид натрия. Соответствующие растворители включают диметиловый эфир, диметилформамид, тетрагидрофуран или диметилсульфоксид. Реакционную смесь перемешивают при температуре в пределах от около -20 до около 25 С, предпочтительно от около 0 до около 20 С (то есть комнатная температура), в течение периода времени между примерно 10 мин и примерно 2 днями, предпочтительно в течение примерно 1 дня. Соединения формулы VII и VIII могут быть получены способами, хорошо известными специалистам в данной области. Примеры таких соединений включают метилглицинбензофенонимин и этилглицинбензофенонимин. Фармацевтически приемлемые соли кислотных соединений по настоящему изобретению являются солями, образованными с основаниями, а именно, катионными солями, такими как соли щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний, а также солями аммония, такими как соли аммония, триметиламмония, диэтиламмония и трис-(гидроксиметил)метиламмония. Подобно этому, кислотно-аддитивные соли таких кислот как неорганические кислоты, органические карбоновые и органические сульфоновые кислоты, например, хлористо-водородная кислота, метансульфоновая кислота, малеиновая кислота, которые также способные взаимодействовать с основной группой, такой как пиридил, составляют часть структуры. Способность соединений формулы I или их фармацевтически приемлемых солей (далее также упоминаемых здесь как соединения по настоящему изобретению) ингибировать металлопротеиназы или репролизин млекопитающих,и, как следствие, демонстрировать их эффективность при лечении заболеваний, характеризуемых металлопротеиназой или продуцированием фактора некроза опухоли, продемонстрирована с помощью следующих далее исследований in vitro. Биологическое исследование Ингибирование коллагеназы человека (ММР-1) Рекомбинатную коллагеназу человека активируют трипсином. Количество трипсина оптимизируют для каждой порции коллагеназы-1,но при типичном взаимодействии используют следующее отношение: 5 мкг трипсина на 100 мкг коллагеназы. Трипсин и коллагеназу инкубируют при комнатной температуре в течение 10 мин, затем добавляют пятикратный избыток(50 мг/10 мг трипсина) ингибитора трипсина из соевых бобов. 15 Готовят исходные растворы (10 мМ) ингибиторов в диметилсульфоксиде, а затем их разбавляют, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ 25 мкл раствора каждой концентрации затем добавляют трехкратно в соответствующие лунки 96-луночного планшета для микрофлюоресцентного анализа. Конечная концентрация ингибитора после добавления фермента и субстрата будет представлять собой разбавление 1:4. Положительный контроль (фермент, без ингибитора) размещается в лунках D7-D12, и отрицательный контроль (без фермента, без ингибитора) размещается в лунках D1-D6. Коллагеназу-1 разбавляют до концентрации 240 нг/мл, а затем добавляют по 25 мл в соответствующие лунки планшета для микрофлюоресцентного анализа. Конечная концентрация коллагеназы в исследованиях составляет 60 нг/мл. Субстрат (DNP-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) приготавливают как 5 мМ исходный раствор в диметилсульфоксиде, а затем разбавляют до 20 мкМ в буфере для анализа. Анализ инициируется путем добавления по 50 мл субстрата на лунку планшета для микрофлюоресцентного анализа с получением конечной концентрации 10 мМ. Отсчеты флюоресценции (возбуждение 360 нм, испускание 460 нм) производят в момент времени 0, а затем через 20 минутные интервалы. Исследование проводится при комнатной температуре с типичным временем проведения анализа 3 ч. График зависимости интенсивности флюоресценции от времени строят затем как для контрольных, так и для содержащих коллагеназу образцов (усредняются данные от трехкратных определений). Момент времени, который обеспечивает хороший сигнал (по меньшей мере в 5 раз больше, чем контроль), и который находится в линейной части кривой (как правило, около 120 мин), выбирают для определения значенийIС 50. Сигнал в нулевой момент времени используется в качестве контроля для каждого соединения при каждой концентрации, и эти значения вычитают из данных для 120 мин. Данные представляют на графике как зависимость концентрации ингибитора от % контроля (интенсивность флюоресценции ингибитора, деленная на интенсивность флюоресценции самой коллагеназы х 100). Значения IC50 определяют из концентрации ингибитора, которая дает сигнал,составляющий 50% от контроля. Если получаемые значения IC50 составляют меньше чем 0,03 мМ, ингибиторы исследуют при концентрациях 0,3, 0,03 и 0,003 мМ. Ингибирование желатиназы (ММР-2) Рекомбинантную желатиназу человека массой 72 кД (ММР-2, желатиназа А) активируют в течение 16-18 ч 1 мМ п-аминофенилртуть ацетатом (из свежеприготовленного 100 16 мМ исходного раствора в 0,2 н NaOH) при 4 С,с легким покачиванием. 10 мМ исходные растворы ингибиторов в диметилсульфоксиде разбавляют последовательно в буфере для анализа (50 мМ Трис, рН 7,5, 200 мМ NaCl, 5 мМ CaCl2, 20 мкМ ZnCl2 и 0,02% BRIJ-35 (объем/объем, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Дальнейшие разбавления производятся,если это необходимо, следуя этой же схеме. Самое меньшее, в каждом исследовании готовят четыре концентрации ингибитора для каждого соединения. 25 мкл каждой концентрации затем добавляют трехкратно в лунки черного 96 луночного планшета для микрофлюоресцентного анализа с круглым дном. Поскольку конечный объем пробы составляет 100 мкл, конечные концентрации ингибитора получают в результате еще одного разбавления 1:4 (то есть 30 мкМ 3 мкМ 0,3 мкМ 0,03 мкМ, и так далее). Также приготавливают трехкратный абсолютный (без фермента, без ингибитора) и положительный ферментный контроль (с ферментом,без ингибитора). Активированный фермент разбавляют до 100 нг/мл в буфере для анализов, по 25 мкл на лунку добавляют в соответствующие лунки микропланшета. Конечная концентрация фермента при исследованиях составляет 25 нг/мл(0,34 нМ). Исходный 5 мМ раствор субстрата (McaPro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2) в диметилсульфоксиде разбавляют в буфере для анализов до 20 мкМ. Исследования инициируются путем добавления 50 мкл разбавленного субстрата с получением конечной концентрации при анализе субстрата 10 мкМ. В нулевой момент времени непосредственно записывают отсчет интенсивности флюоресценции (возбуждение 320 излучение 390), и последующие отсчеты производят каждые 15 мин при комнатной температуре с помощью PerSeptive Biosystems CytoFluorMulti-Well Plate Reader с приростом по 90 единиц. Строят график зависимости интенсивности флюоресценции фермента и абсолютного контроля от времени. Один из ранних моментов времени на линейной части этой кривой выбирают для определения значения IC50. Значение в нулевой момент времени для каждого соединения при каждом разбавлении вычитается из значения в более поздние моменты времени, и данные затем выражаются как процент от контроля с ферментом (интенсивность флюоресценции ингибитора, деленная на интенсивность флюоресценции положительного контроля с ферментом х 100). Строят график зависимости концентрации ингибитора от процента контроля с ферментом. Значения IС 50 определяют как концентрацию ингибитора, которая дает сигнал, со 17 ставляющий 50% от положительного контроля с ферментом. Ингибирование активности стромелизина (ММР-3) Рекомбинантный стромелизин человека(ММР-3, стромелизин-1) активируют в течение 20-22 ч 2 мМ ацетата п-аминофенилртути (из свежеприготовленного 100 мМ исходного раствора в 0,2 н NaOH) при 37 С. 10 мМ исходные растворы ингибиторов в диметилсульфоксиде разбавляют последовательно в буфере для анализа (50 мМ Трис, рН 7,5, 150 мМ NaCl, 10 мМ CaCl2 и 0,05% BRIJ-35(объем/объем, используя следующую схему: 10 мМ 120 мкМ 12 мкМ 1,2 мкМ 0,12 мкМ Дальнейшие разбавления производятся,если это необходимо, следуя этой же схеме. Самое меньшее, по четыре концентрации ингибитора для каждого соединения приготавливают в каждом исследовании. 25 мкл раствора каждой концентрации, затем добавляют трехкратно в лунки черного 96-луночного планшета для микрофлюоресцентного анализа с круглым дном. Поскольку конечный объем пробы составляет 100 мкл, конечные концентрации ингибитора получают в результате еще одного разбавления 1:4 (то есть 30 мкМ 3 мкМ 0,3 мкМ 0,03 мкМ, и так далее). Также приготавливают трехкратный абсолютный (без фермента, без ингибитора) и положительный ферментный контроль (с ферментом, без ингибитора). Активированный фермент разбавляют до 200 нг/мл в буфере для анализа, добавляют по 25 мкл на лунку в соответствующие лунки микропланшета. Конечная концентрация фермента при исследованиях составляет 50 нг/мл (0,875 нМ). В исходный 10 мМ раствор субстрата(Mca-Arg-Pro-Lys-Pro-Val-Glu-Nva-Trp-ArgLys(Dnp)-NH2) в диметилсульфоксиде разбавляют в буфере для анализов до 6 мкМ. Исследования инициируются путем добавления 50 мкл разбавленного субстрата с получением конечной концентрации при анализе субстрата 3 мкМ. В нулевой момент времени непосредственно записывают отсчет интенсивности флюоресценции (возбуждение 320, излучение 390) и последующие отсчеты производят каждые 15 мин при комнатной температуре с помощью PerSeptiveBiosystems CytoFluor Multi-Well Plate Reader с приростом по 90 единиц. Строят график зависимости средней интенсивности флюоресценции фермента и абсолютного контроля от времени. Один из ранних моментов времени на линейной части этой кривой выбирают для определения значения IC50. Значение в нулевой момент времени для каждого соединения при каждом разбавлении вычитается из значения в более поздние моменты времени, и данные затем выражаются как процент от контроля с ферментом (интенсивность флюо 004227 18 ресценции ингибитора, деленная на интенсивность флюоресценции положительного контроля с ферментом х 100). Строят график зависимости концентрации ингибитора от процента контроля с ферментом. Значения IC50 определяют как концентрацию ингибитора, которая дает сигнал, составляющий 50% от положительного контроля с ферментом. Ингибирование ММР-13 Рекомбинантную ММР-13 человека активируют 2 мМ АРМА (ацетат п-аминофенилртути) в течение 2,0 ч, при 37 С и разбавляют до 240 нг/мл буфере для анализов (50 мМ Трис, рН 7,5, 200 мМ хлорида натрия, 5 мМ хлорида кальция, 20 мМ хлорида цинка, 0,02%BRIJ 35). По 25 мкл разбавленного фермента добавляют на лунку 96-луночного планшета для микрофлюоресцентного анализа. Затем фермент при анализе разбавляют в отношении 1:4 путем добавления ингибитора и субстрата с получением конечной концентрации в пробе 60 нг/мл. Исходные растворы ингибиторов (10 мМ) готовят в диметилсульфоксиде, а затем разбавляют в буфере для анализов таким же образом,как в схеме разбавления ингибитора для ингибирования коллагеназы-1 человека (ММР-1): По 25 мкл раствора каждой концентрации добавляют трехкратно на планшет для микрофлюоресцентного анализа. Конечные концентрации в исследовании составляют 30 мМ, 3 ммМ, 0,3 ммМ и 0,03 ммМ. Субстрат (Dnp-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) получают таким же образом, как и для ингибирования коллагеназы человека (ММР-1), и по 50 мкл добавляют в каждую лунку с получением конечной концентрации пробы 10 мкМ. Отсчеты флюоресценции(возбуждение 360 нМ; испускание 450 нМ) считывают в момент времени 0 и каждые 5 мин в течение 1 ч. Положительные контроли и отрицательные контроли приготавливают трехкратно, как описано для исследования ММР-1. Значения IC50 определяются так же, как при ингибировании коллагеназы человека(ММР-1). Если полученное значение IC50 составляет меньше, чем 0,03 мМ, ингибиторы затем исследуют при конечных концентрациях 0,3 мМ, 0,03 ммМ, 0,003 ммМ и 0,0003 мМ. Ингибирование продуцирования TNF Способность соединений или их фармацевтически приемлемых солей к ингибированию продуцирования TNF и, как следствие, чтобы продемонстрировать их эффективность для лечения заболеваний, включающих продукциюTNF, демонстрируется с помощью следующего исследования in vitro: Моноциты человека выделяют из обработанной антикоагулянтом крови человека с использованием одностадийного метода разделения с помощью фикол-хайпак. (2) Моноциты промывают три раза в сбалансированном соле 19 вом растворе Хенкса (HBSS) с двухвалентными катионами и повторно суспендируют с плотностью 2 х 106/мл в HBSS, содержащей 1% BSA. Дифференциальные отсчеты, считываемые с использованием анализатора Abbott Cell Dyn 3500, показывают, что моноциты составляют от 17 до 24% от общего числа клеток в этих препаратах. 180 мкл клеточной суспензии аликвотируют в 96-луночные планшеты с плоским дном(Costar). Добавления соединений и LPS (конечная концентрация 100 нг/мл) дает конечный объем 200 мкл. Все условия воспроизводятся трехкратно. После 4 ч инкубации при 37 С в инкубаторе с атмосферой увлажненного СО 2 планшеты удаляют и центрифугируют (10 мин примерно при 250 х g), и супернатанты удаляют и исследуют на содержание TNF- с использованием набора RD ELISA Kit. Ингибирование продуцирования растворимогоTNFСпособность соединений или их фармацевтически приемлемых солей к ингибированию высвобождения клетками TNF- и, как следствие, чтобы продемонстрировать их эффективность при лечении заболеваний, включающих дисрегуляцию растворимого TNF-,демонстрируется с помощью следующих исследований in vitro: Способ оценки активности рекомбинантного фермента, преобразующего TNFЭкспрессия рекомбинантного ТАСЕ Фрагмент ДНК, кодирующий сигнальную последовательность, препродомен, продомен и каталитический домен ТАСЕ (аминокислоты 1473), может быть амплифицирован с помощью цепной реакции полимеразы с использованием библиотеки комплементарной ДНК легкого человека в качестве матрицы. Амплифицированный фрагмент затем клонируют в вектор pFastBac. Последовательность ДНК вставки подтверждается для обеих спиралей. Бакмид, полученный с использованием pFastBac у Е. coliSF9. Вирусные частицы затем амплифицируют до стадий P1, P2, Р 3. Вирус Р 3 инфицируют в клетки насекомых, как SF9, так и High Five, и выращивают при 27 С в течение 48 ч. Среду собирают и используют для исследований и дальнейшей очистки. Получение субстрата с гашением флюоресценции Готовят модельный пептидный субстратTNF- (LY-ЛейцинАланинГлютаминАланинВалин-АгрининСерин-СеринЛизин(CTMR)-Агринин (LУ=Люцифер желтый; СТМR=Карбокситетраметил-Родамин, и концентрацию устанавливают по поглощению на 560 нм (E560 60000 M-1CM-1) по методу Geoghegan, KF, "Improved method for converting an unmodified peptide to an energytransfer substrate for a proteinase" 20 тид включает позицию расщепления на проTNF, который расщепляется in vivo с помощью ТАСЕ. Экспрессия рекомбинантного ТАСЕ Фрагмент ДНК, кодирующий сигнальную последовательность, препродомен, продомен и каталитический домен ТАСЕ (аминокислоты 1-473),амплифицируют с помощью цепной реакции полимеразы с использованием библиотеки комплементарной ДНК легкого человека в качестве матрицы. Амплифицированный фрагмент затем клонируют в вектор pFastBac. Последовательность ДНК вставки подтверждается для обеих спиралей. Бакмиду, полученную с использованием pFastBac у Е. coliDH10Bac, трансфицируют в клетки насекомых SF9. Вирусные частицы затем размножаются до стадийP1, P2, Р 3. Вирус Р 3 инфицируют в клетки насекомых, как SF9, так и High Five, и выращивают при 27 С в течение 48 ч. Среду собирают и используют для исследований и дальнейшей очистки. Ферментативная реакция Реакция, проводимая на 96-луночном планшете (Dynatech), состоит из 70 мкл буферного раствора (25 мМ Hepes-HCl, pH 7,5, плюс 20 мкМZnCl2), 10 мкл 100 мкМ субстрата с гашением флюоресценции, 10 мкл раствора исследуемого соединения в ДМСО (5%), и количества ферментаr-ТАСЕ, которое вызывает 50% расщепление через 60 мин - при общем объеме 100 мкл. Специфичность ферментативного расщепления амидной связи между аланином и валином проверяют с помощью ВЭЖХ и масс-спектрометрии. Начальные скорости расщепления отслеживают путем измерения скорости увеличения интенсивности флюоресценции на 530 нм (возбуждение на 409 нм) в течение 30 мин. Эксперимент контролируют следующим образом: 1) по базовой флюоресценции субстрата; 2) по флюоресценции полностью расщепленного субстрата; 3) по гашению или приращению флюоресценции растворами, содержащими, исследуемое соединение. Данные анализируют следующим образом. Скорости "контрольных" реакций, не содержащих исследуемое соединение, усредняют для определения значения 100%. Скорость реакции в присутствии исследуемого соединения сравнивают со скоростью в отсутствие соединения и табулируют как"процент от контроля, не содержащего исследуемое соединение". Строят графики "% от контроля" как функции от логарифма концентрации соединения,и определяют положение точки, соответствующей половине максимального значения функции или значению IC50. Все соединения по настоящему изобретению имеют значения IC50, меньшие чем 1 мкМ,предпочтительно меньшие чем 50 нМ. Наиболее предпочтительные соединения по настоящему изобретению являются по меньшей мере в 100 раз менее сильнодействующими по отношению к r-ММР-1, чем в указанных выше исследованиях ТАСЕ. 21 Исследования моноцитов человека Моноциты человека выделяют из обработанной антикоагулянтом крови человека с использованием одностадийного метода разделения с помощью фикол-хайпак. (2) Моноциты промывают три раза в сбалансированном солевом растворе ХенксаCell Dyn 3500, показывают, что моноциты составляют от 17 до 24% от общего числа клеток в этих препаратах. 180 мкл клеточной суспензии аликвотируют в 96-луночные планшеты с плоским дном (Costar). Добавления соединений и LPS (конечная концентрация 100 нг/мл) дает конечный объем 200 мкл. Все условия воспроизводятся трехкратно. После 4 ч инкубации при 37 С в инкубаторе с атмосферой увлажненного СО 2 планшеты удаляют и центрифугируют (10 мин примерно при 250 х g) и супернатанты удаляют и исследуют на содержание TNF- с использованием набора RD ELISA Kit. Исследования агреканазы Первичные свиные хондроциты из хряща суставов конечности выделяют с помощью последовательного расщепления трипсина и коллагеназы с последующим расщеплением коллагеназы в течение ночи и размещают по 2 х 105 клеток на лунку в 48-луночные планшеты при 5 мкКюри/мл 35S (1000 Кюри/ммоль) серы, в планшеты, покрытые коллагеном типа I. Клеткам предоставляют возможность инкорпорировать метку в их протеогликановый матрикс (около 1 недели) при 37 С, в атмосфере с 5% CO2. В ночь перед началом исследования монослои хондроцитов промывают два разаDMEM/1% PSF/G, а затем оставляют для инкубации в течение ночи в свежем DMEM/1% FBS. На следующее утро хондроциты промывают 1 раз в DMEM/1% PSF/G. Последней промывке позволяют осесть на планшеты в инкубаторе во время осуществления разбавлении. Среды и разбавления могут быть получены, как описано ниже в таблице. Контрольные среды Среды IL-1DMEM+IL-1 (5 нг/мл) Приготовление всех исходных растворов соединений при 10 мМ ДМСО. Приготовление 100 мкМ исходного раствора каждого соединения в DMEM в 96-луночном планшете. Хранение в холодильнике в течение ночи. Приготовление на следующий день последовательных разбавлений вDMEM с IL-1 до 5 мкМ, 500 нМ и 50 нМ. Отсасывание последней промывки из лунок и добавление 50 мкл соединения из указанных выше разбавлений к 450 мкл сред IL-1 в соответствующие лунки 48 луночных планшетов. Конечные концентрации соединения равны 500 нМ, 50 нМ и 5 нМ. Все свободные лунки заполняются трехкратно пробами с контролем и одним только IL-1 в каждой лунке. 22 Планшеты метят и используют только внутренние 24 лунки на планшете. На одном из планшетов несколько рядов лунок обозначают как IL-1 (без лекарства) и контроль (без IL-1, без лекарства). С этих контрольных рядов периодически снимаются отсчеты для отслеживания выхода протеогликана, меченного 35S. Среды с контролем и IL-1 добавляют в лунки (450 мкл) с последующим добавлением соединения (50 мкл) таким образом, чтобы инициировать исследование. Планшеты инкубируют при 37 С, в атмосфере с 5% CO2. При 40-50% высвобождения (когда число отсчетов в минуту от сред IL-1 в 4-5 раз больше,чем в контрольных средах), что оценивается с по отсчетам сцинцилляций в жидкости (LSC) образцов сред, исследование заканчивают (через 9-12 ч). Среды удаляют из всех лунок и помещают в сцинциляционные пробирки. Добавляют сцинцилляционную жидкость и регистрируют отсчеты радиоактивности (LSC). Для солюбилизации слоев клеток в каждую лунку добавляют 500 мкл буфера с папаиновым гидролизатом (0,2 М Трис, рН 7,0, 5 мМ EDTA, 5 мМ DTT и 1 мг/мл папаина). Планшеты с расщепляющим раствором инкубируют при 60 С в течение ночи. Слой клеток удаляют с планшета на следующий день и помещают в сцинциляционные пробирки. Затем добавляют сцинциллят, и регистрируют отсчеты образцов (LSC). Процент отсчетов от высвобожденного фермента определяется от общего количества,присутствующего в каждой лунке. Определяются средние значения по трем точкам, и вычитаются значения для контроля для каждой лунки. Процент ингибирования для соединения отсчитывают от образцов с IL-1 в качестве 0% ингибирования (100% от общего числа отсчетов). Для введения млекопитающим, включая людей, для ингибирования матриксных металлопротеиназ или продуцирования фактора некроза опухоли (TNF), может быть использовано множество обычных способов, включая пероральное, парентеральное и местное введение. Как правило, активное соединение вводят перорально и парентерально при дозировках в пределах от около 0,1 и 25 мг/кг массы тела субъекта, подвергающегося лечению, в сутки, предпочтительно от около 0,3 до 5 мг/кг. Однако обязательно будет осуществляться некоторое изменение дозировки в зависимости от состояния субъекта, подвергающегося лечению. Лицо,ответственное за введение, будет в каждом случае определять соответствующую дозировку для индивидуального субъекта. Соединения по настоящему изобретению могут вводиться в виде большого числа различных лекарственных форм, как правило, терапевтически эффективные соединения по настоящему изобретению присутствуют в таких дозированных формах при уровнях концентрации, на 23 ходящихся в пределах от около 5,0 до около 70 мас.% . Для перорального введения могут быть использованы таблетки, включающие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат дикальция и глицин, вместе с различными разрыхлителями, такими как крахмал(и предпочтительно крахмал из кукурузы, картофеля и тапиоки), альгиновая кислота и некоторые комплексные силикаты, вместе со связующими для гранулирования, такими как поливинилпирролидон, сахароза, желатин и смола акации. Кроме того, для целей таблетирования часто являются очень полезными смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа могут также быть использованы в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этой связи также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения являются желательными водные суспензии и/или эликсиры, активный ингредиент может быть объединен с различными подслащающими или ароматизирующими агентами, красящим материалом или красителем, и, если это желательно,с эмульгирующими и/или суспендирующими агентами, а также с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин, и с различными подобными их сочетаниями. В случае животных они предпочтительно содержатся в корме или питьевой воде при концентрации 55000 частей на миллион, предпочтительно от 25 до 500 частей на миллион. Для парентерального введения (внутримышечного, внутрибрюшинного, подкожного и внутривенного использования), как правило,приготавливают стерильный раствор для инъекций активного ингредиента. Могут быть использованы растворы терапевтического соединения по настоящему изобретению либо в кунжутном или в арахисовом масле, либо в водном растворе пропиленгликоля. В водных растворах должен содержаться буфер, и должен быть установлен рН, больший, чем 8, если это необходимо, и жидкий разбавитель сначала должен быть сделан изотоническим. Эти водные растворы являются пригодными для внутривенных инъекций. Масляные растворы являются пригодными для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществляют с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области. В случае животных, соединения могут вводиться внутримышечно или подкожно при уровнях доз от около 0,1 до 50 мг/кг/день, предпочтительно от 0,2 до 10 мг/кг/день, в одной дозе или вплоть до 3 разделенных доз. 24 Для местного глазного введения непосредственное нанесение на подлежащий воздействию глаз может использоваться в форме приготовления глазных капель, аэрозолей, гелей или мазей, или может быть включено в глазной щиток из коллагена (такого как поли-2 гидроксиэтилметакрилат и его сополимеры),или из гидрофильного полимера. Материалы могут также наноситься в виде контактной линзы или с помощью локального резервуара, или как субконъюктивальный препарат. Для введения в глазницы, как правило, готовят стерильный раствор для инъекций активного ингредиента. Могут быть использованы растворы терапевтического соединения по настоящему изобретению в водном растворе или суспензии (размер частиц, меньший, чем 10 мкм). Водные растворы должны содержать соответствующий буфер, и значение рН должны быть установлены предпочтительно между 5 и 8, если необходимо, и жидкий разбавитель сначала должен быть сделан изотоническим. Для увеличения вязкости или для замедления высвобождения могут быть добавлены небольшие количества полимеров (таких как целлюлозные полимеры, декстран, полиэтиленгликоль, или альгиновая кислота). Такие растворы пригодны для использования в целях введения в глазницы. Приготовление всех этих растворов в стерильных условиях легко осуществляется с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области. В случае животных, соединения могут вводиться в глазницы при уровнях доз от около 0,1 до 50 мг/кг/день, предпочтительно от 0,2 до 10 мг/кг/день, в одной дозе или вплоть до 3 разделенных доз. Активные соединения по настоящему изобретению также могут быть представлены в виде ректальных композиций, таких как суппозитории, или удерживаемых клизм, например, содержащих обычные основы для суппозиториев,такие как масло какао или другие глицериды. Для назального введения или введения путем ингаляции активные соединения по настоящему изобретению могут быть удобно доставлены в виде раствора или суспензии из контейнера с закачанным спреем, который сжимается или прокачивается пациентом, или в виде аэрозоля из находящегося под давлением контейнера или распылителя с использованием соответствующего пропелланта, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная дозировка может определяться путем создания клапана для доставки отмеренного количества. Находящийся под давлением контейнер или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (изготовленные, например, из желатина) для использо 25 вания в ингаляторе или при вдувании могут быть изготовлены, как содержащие порошкообразную смесь соединения по настоящему изобретению и соответствующей порошкообразной основы, такой как лактоза или крахмал. Настоящее изобретение иллюстрируется с помощью следующих далее примеров приготовления и примеров, но не является ограниченным их деталями. Пример 1. Гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты.(А) Этиловый эфир 4-[N-(дифенилметилен)амино]-тетрагидропиран-4-карбоновой кислоты. К суспензии гидрида натрия (6,56 г, 0,164 моль) в диметиловом эфире этиленгликоля (150 мл) при 0 С по каплям через воронку добавляют раствор этилового эфира N-(дифенилметилен) глицина (20,60 г, 0,07398 моль) в диметиловом эфире этиленгликоля (50 мл). Раствор 2 бромэтилового эфира (23,21 г, 0,090 моль) в диметиловом эфире этиленгликоля (50 мл) затем добавляют примерно в течение 5 мин, 10 мл частями, к раствору диметилового эфира этиленгликоля. Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют диэтиловым эфиром и промывают водой. Водный слой экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния, и концентрируют с получением мутного желтого масла (28,692 г). Хроматография на силикагеле, элюирование сначала 4 л 5% этилацетата/гексана, затем 4 л 10% этилацетата/гексана дает этиловый эфир 4[N-(дифенилметилен)амино]тетрагидропиран-4 карбоновой кислоты в виде прозрачного желтого масла (16,114 г, 64%). 1H ЯМР (СDСl3)7,58 (д, 2 Н), 7,36 (м,4 Н), 7,28 (т, 2 Н), 7,08 (м, 2 Н), 3,99 (м, 2 Н), 3,70,(м, 2 Н), 3,66 (кв, 2 Н), 2,10 (м, 2 Н), 1,99 (м, 2 Н),1,08 (т, 3 Н). MS Масс-спектры при химической ионизации и при атмосферном давлении: 338(В) Этиловый эфир 4-аминотетрагидропиран-4-карбоновой кислоты. К раствору этилового эфира 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты (16,0 г, 0,047 моль) в диэтиловом эфире (120 мл) добавляют 1 М водный раствор соляной кислоты (100 мл). Смесь интенсивно перемешивают при комнатной температуре в течение 16 ч. Слои отделяют и водный слой промывают диэтиловым эфиром. Водный слой доводят до значения рН 10 с помощью разбавленного водного раствора гидроксида аммония и экстрагируют дихлорметаном. Органический экстракт сушат над сульфатом натрия и концентрируют с получением этилового эфира 4 004227(м, 2 Н), 1,24 (т, 3 Н). 13 С ЯМР (СDСl3)176,48, 63,70, 61,09,54,78, 35,05, 14,15. MS Масс-спектры при химической ионизации и при атмосферном давлении: 210 (M1).(С) Этиловый эфир 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4 карбоновой кислоты. К раствору этилового эфира 4-аминотетрагидропиран-4-карбоновой кислоты (7,00 г,0,0404 моль) в N,N-диметилформамиде (40 мл) добавляют триэтиламин (5,94 мл, 0,043 моль). Добавляют по частям твердый 4-(4-фторфенокси)бензолсульфонилхлорид (12,165 г, 0,0424 моль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч, и затем большую часть растворителя удаляют путем выпаривания в вакууме. Остаток распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Водный слой экстрагируют дихлорметаном. Объединенные органические слои промывают насыщенным солевым раствором и сушат над сульфатом натрия. Выпаривание растворителя в вакууме дает сырой этиловый эфир 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты в виде янтарного масла (21,05 г). Флэш-хроматография на силикагеле с элюированием 25% этилацетатом/гексаном, а затем 50% этилацетатом/гексаном дает этиловый эфир 4-[4-(4-фторфенокси)бензолсульфониламино] тетрагидропиран-4-карбоновой кислоты в виде почти белого кристаллического твердого продукта (12,15 г, 71%, т.пл. 116-117 С). 1H ЯМР (СDСl3)7,79 (д, 2 Н), 7,09 (т, 2 Н),7,02 (м, 2 Н), 6,97 (д, 2 Н), 5,10 (с, 1 Н), 4,01 (кв,2 Н), 3,60 (м, 4 Н), 2,08 (м, 2 Н). 1,84 (ушир. д,2 Н), 1,23 (т, 3 Н). МС Масс-спектры при химической ионизации и при атмосферном давлении: 424 (М 1).(D) 4-[4-(4-Фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновая кислота. Способ А. Раствор этилового эфира 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (12,1 г, 0,0286 моль) в тетрагидрофуране (190 мл) обрабатывают водным раствором 3 М гидроксида натрия (95 мл, 0,286 моль) и перемешивают при комнатной температуре в течение 4 дней. Растворитель выпаривают в вакууме и остаток распределяют между водой и диэтиловым эфиром. Водный слой промывают диэтиловым эфиром, подкисляют до рН, равного 1, 3 н водным раствором соляной кислоты и экстрагируют дихлорметаном. После промывания водой органический 27 экстракт сушат над сульфатом натрия и концентрируют с получением 4-[4-(4-фторфенокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (11,241 г, 99%) в виде желтоватой твердой пены. Способ В. Раствор этилового эфира 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (34,19 г, 0,807 моль) в этаноле (330 мл) обрабатывают водным раствором 3 М гидроксида натрия (330 мл, 0,990 моль) и нагревают с обратным холодильником в течение ночи. Растворитель выпаривают в вакууме и остаток распределяют между водой и диэтиловым эфиром. Водный слой промывают диэтиловым эфиром, подкисляют до рН 1 водным раствором 3 н соляной кислоты и экстрагируют этилацетатом. После промывания водой органический экстракт сушат над сульфатом натрия и концентрируют с получением 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (31,26 г, 98%) в виде белого кристаллического твердого продукта. 1(ушир. м, 3 Н), 2,01 (м, 2 Н). 1,80 (ушир. д, 2 Н). МС Масс-спектры при химической ионизации и при атмосферном давлении: 394 (М+-1) (-ион).(бензотиазол-1-илокси)трис(диметиламино) фосфоний гексафторфосфат (13,27 г, 0,030 моль) добавляют последовательно к раствору 4[4-(4-фторфенокси)-бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (11,22 г,0,028 моль) в безводном N,N-диметилформамиде (140 мл). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. Затем еще добавляют диизопропилэтиламин (4,0 мл, 0,051 моль) и O-бензилгидроксиламингидрохлорид (5,46 г 0,034 моль) и полученную смесь перемешивают при 60 С в течение 18 ч. После концентрирования в вакууме остаток обрабатывают 0,5 н водным раствором соляной кислоты и экстрагируют этилацетатом. Органический экстракт промывают насыщенным водным раствором бикарбоната натрия, водой, и насыщенным солевым раствором. Раствор сушат над сульфатом магния, отфильтровывают и концентрируют до одной четвертой от начального объема. Добавление такого же объема гексана осаждает N-бензилоксиамид 4[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоно-вой кислоты (11,595 г,81,6%) в виде белого кристаллического твердого продукта (т.пл. 175-176 С).H ЯМР (СDСl3)7,76 (д, 2 Н), 7,35 (м,5 Н), 7,05 (т, 2 Н), 6,96 (м, 4 Н), 5,38 (ушир.с, 1 Н),4,86 (с, 2 Н), 3 57 (м, 2 Н), 344 (м, 2 Н), 2,01 (м,2 Н), 1,77 (ушир. д, 2 Н), 1 54 (ушир. с, 1 Н). МС при химической ионизации и при атмосферном давлении: 501 (M1).(F) Гидроксиамид 4-[4-(4-фторфенокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. Способ А. Раствор N-бензилоксиамида 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (11,28 г, 0,0225 моль) в этилацетате (600 мл) обрабатывают 5% палладием на сульфате бария (5,0 г) и гидрируют в аппарате Парра со встряхиванием при давлении 3 атмосферы в течение 18 ч. После фильтрования через найлон (размер пор 0,45 мм) для удаления катализатора, слой на фильтре промывают метанолом. Объединенный фильтрат и промывную жидкость выпаривают и остаток извлекают горячим метанолом. Охлаждение дает сырой гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (5,941 г, 64%, т.пл. 176-177 С) в виде белого кристаллического твердого продукта. Маточную жидкость выпаривают и остаток кристаллизуют из 50% метанол/дихлорметана с получением еще гидроксиамида 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (0,660 г, т.пл. 184185 С) в виде белых иголок. Маточную жидкость снова выпаривают и остаток кристаллизуют из метанол/дихлорметана с получением еще продукта (1,861 г, т.пл. 176-177 С). Перекристаллизация первой порции из метанола/дихлорметана дает аналитически чистый гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты (3,091 г, т.пл. 184-185 С). Способ В. Оксалилхлорид (11,83 г, 0,0932 моль, 1,1 экв.) и ДМФ (0,13 мл) добавляют к перемешиваемой суспензии карбоновой кислоты (33,25 г,0,0841 моль) в сухом метиленхлориде (300 мл) при комнатной температуре. Наблюдается некоторое образование пузырьков. Суспензию, которая медленно становится желтоватым раствором, перемешивают в течение ночи при комнатной температуре. В это время раствор гидрохлорида гидроксиламина (7,65 г, 0,110 моль. 1,3 экв.) в сухом пиридине (51,4 мл, 0,635 моль, 7,5 экв.) при 0 С обрабатывают хлортриметилсиланом, вызывая образование белого осадка. Эту суспензию перемешивают при комнатной температуре в течение ночи. Обе колбы затем охлаждают до 0 С и добавляют раствор хлорангидрида кислоты к суспензии силилированного гидроксиламина. Полученную смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 2 ч. Добавляют 1000 мл водного раствора 2 н НСl и перемешивают при 29 комнатной температуре в течение 1 ч. Слои разделяют, водный слой экстрагируют три раза этилацетатом (500 мл). Объединенные органические слои промывают водой и насыщенным солевым раствором и сушат над сульфатом магния, отфильтровывают, и объем фильтрата уменьшают до 300 мл, при этом осаждается большое количество белого кристаллического твердого продукта. Его охлаждают в течение ночи в холодильнике. Твердый продукт собирают путем вакуумного фильтрования, промывают холодным 1:1 этилацетатом/гексаном и сушат в высоком вакууме с получением 30,311 г желаемой гидроксамовой кислоты (87,8%) в виде белого кристаллического твердого продукта (т.пл. 189-190 С). 1(м, 2 Н), 3,31 (м, 2 Н), 1,78 (м, 4 Н). 13 С ЯМР (DMSO)169,65, 160,66, 137,50,129,39, 122,34, 122,25, 117,75, 117,44, 117,24,62,94, 58,45, 33,34. MS Масс-спектры при химической ионизации и при атмосферном давлении: 409 (M+-1) (-ион). Пример приготовления А. 4-(4-Фторфенокси)бензолсульфонилхлорид. Хлорсульфоновую кислоту (26 мл, 0,392 моль) добавляют по каплям к охлажденному на льду 4-фторфеноксибензолу (36,9 г, 0,196 моль) с механическим перемешиванием. Когда завершается добавление, смесь перемешивают при комнатной температуре в течение 4 ч. Смесь затем выливают в воду со льдом. Продукт 4-(4 фторфенокси)бензолсульфонилхлорид (18,6 г,33%) собирают путем фильтрования и сушат на воздухе. Пример приготовления В. Натрий 4-(3 метилбутокси)бензолсульфонат. Раствор 4-гидроксибензолсульфоновой кислоты (10,0 г, 43,1 ммоль) и гидроксида натрия(3,3 г, 83 ммоль) в воде (40 мл) перемешивают с раствором 1-йод-3-метилбутана (11,3 мл, 86,4 ммоль) в изопропаноле (60 мл), и полученную смесь нагревают с обратным холодильником в течение 2 дней. Изопропанол удаляют путем выпаривания в вакууме. Указанное в заголовке соединение, 10,0 г (87%), собирают путем фильтрования и промывают изопропанолом. Пример приготовления С. 4-(3-Метилбутокси)бензолсульфонилхлорид. Смесь натрий 4-(3-метилбутокси)бензолсульфоната (2,5 г, 9,4 ммоль), тионилхлорида(10 мл) и 5 капель N,N-диметилформамида нагревают с обратным холодильником в течение 5 ч. После охлаждения избыток тионилхлорида выпаривают и остаток извлекают этилацетатом. Раствор охлаждают на ледяной бане и добавляют воду. Органическую фазу выпаривают и промывают водой и насыщенным солевым раствором. После сушки над сульфатом натрия(2,2 г, 55 ммоль) в воде (15 мл) смешивают с раствором 2-(бромэтил)циклопентана (15,0 г,84,7 ммоль) в изопропаноле (40 мл) и полученную смесь нагревают с обратным холодильником в течение 2 дней. Изопропанол удаляют путем выпаривания в вакууме. Указанное в заголовке соединение, 4,7 г (57%), собирают путем фильтрования и промывают изопропанолом. Пример приготовления Е. 4-(3-Метилбутокси)бензолсульфонилхлорид. Смесь натрий 4-(2-циклопентилэтокси) бензолсульфоната (2,5 г, 8,6 ммоль), тионилхлорида (15 мл), и нескольких капель N,N-диметилформамида нагревают с обратным холодильником в течение 5 ч. После охлаждения избыток тионилхлорида выпаривают и остаток извлекают этилацетатом. Раствор охлаждают на ледяной бане и добавляют воду. Органическую фазу отделяют и промывают водой и насыщенным солевым раствором. После сушки над сульфатом натрия растворитель выпаривают с получением указанного в заголовке соединения в виде масла, 2,24 г (90%). Пример приготовления F. 4-Фторбифенилсульфонилхлорид. Хлорсульфоновую кислоту (8,7 мл, 0,13 моль) добавляют по каплям к 4-фторбифенилу(10,2 г, 59 ммоль), перемешивая при этом на ледяной бане. Перемешивание продолжают с охлаждением на льду в течение 0,5 ч, и затем реакционную смесь выливают на лед. Полученный белый осадок собирают путем фильтрования и растворяют в хлороформе. Раствор хлороформа промывают водой и насыщенным солевым раствором, сушат над сульфатом магния и концентрируют с получением белого твердого продукта. Желаемый продукт, 4-фторбифенилсульфонилхлорид (4,3 г, 27%), отделяют от 4 фторбифенилсульфоновой кислоты (нежелательный побочный продукт) путем кристаллизации последнего из этилацетата и кристаллизации оставшегося материала из гексана. Пример приготовления G. Натрий 4-(4 фторбензилокси)бензолсульфонат. К раствору 4-гидроксибензолсульфоновой кислоты (5,13 г, 22,1 ммоль) в водном растворе 1 н гидроксида натрия (23 мл) добавляют раствор 4-фторбензилбромида (3,3 мл, 26,5 ммоль) в этаноле (20 мл). Полученную смесь нагревают с обратным холодильником в течение 2 дней. При охлаждении и отстаивании осаждается белый твердый продукт. Осажденный продукт,натрий 4-(4-фторбензилокси)бензолсульфонат,4,95 г (74%) собирают путем фильтрования и(275 мг, 1,31 ммоль). Полученную смесь нагревают с обратным холодильником в течение 7 ч. После охлаждения на ледяной бане и гашения водой (15 мл) смесь экстрагируют этилацетатом. Органическую фазу промывают насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют с получением 4-(4 фторбензилокси) бензолсульфонилхлорида в виде белого твердого продукта (130 мг, 26%) . Пример приготовления I. 4-(4-Хлорфенокси)бензолсульфонилхлорид. Хлорсульфоновую кислоту (9,7 мл, 0,147 моль) добавляют по каплям к 4-хлорфеноксибензолу (12,6 мл, 73,4 ммоль) при комнатной температуре с перемешиванием. Когда добавление заканчивается, смесь перемешивают при комнатной температуре в течение 1 ч и затем выливают в воду со льдом. Твердый продукт собирают путем фильтрования, сушат на воздухе и перекристаллизовывают из петролейного эфира и этилацетата с получением 4-(4 хлорфенокси)бензолсульфонилхлорида (7,43 г,33%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы(С 6-С 10)арил или (C2-C9)гетероарил(C1-С 6)алкокси(C2-C9)гетероарил; где каждый из (С 6-С 10)арильных или (C2C9)гетероарильных остатков указанных (С 6 С 10)арила, (C2-C9)гетероарила, (С 6-С 10)арилокси(C2-C9)гетероарила, (C2-C9)гетероарил (C1-С 6) алкокси (C1-С 6)алкила, (C2-C9)гетероарил(C1-С 6) алкокси(С 6-С 10)арила или (C2-C9)гетероарил(C1 С 6)алкокси (C2-C9)гетероарила является необязательно замещенным по любому из атомов углерода на кольце, способных к образованию дополнительной связи с помощью одного или нескольких заместителей в кольце, независимо выбранных из фтора, хлора, брома, (C1(C1-C6)алкокси,перфтор(C1C6)алкила,C3)алкила, перфтор(C1-C3)алкокси и (С 6-С 10) арилокси; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где Q представляет собой необязательно замещенный (С 6-С 10)арил,(С 6-С 10)арил(С 6-С 10)арил, (С 6-С 10)арилокси(С 6 С 10)арил,(С 6-С 10)арилокси(С 2-С 9)гетероарил,(С 2-С 9)гетероарил, (С 2-С 9)гетероарил(С 2-С 9)гетероарил, (С 6-С 10)арил(С 2-С 9)гетероарил, (С 2-С 9) гетероарил(С 6-С 10)арил, (С 2-С 9)гетероарилокси(С 6-С 10)арил, (С 6-С 10)арил(С 1-С 6)алкокси(С 6-С 10) арил или (С 2-С 9)гетероарил(C1-С 6)алкокси(С 6 С 10)арил. 3. Соединение по п.1, где Q представляет собой необязательно замещенный (С 6-С 10)арилокси(С 6-С 10)арил. 4. Соединение по п.3, где кольцо (С 6 С 10)арилокси указанной (С 6-С 10)арилокси(С 6 С 10)арильной группы является необязательно монозамещенным в 4-м положении кольца. 5. Соединение по п.1, где указанное соединение является выбранным из группы, включающей гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(фенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-пиридилокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенил)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенилметокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 4-[4-(фенилметокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты и гидроксиамид 4-[4-(4-фторфенилэтокси) бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. 6. Фармацевтическая композиция для лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника, болезнь Крона, эмфизему, хроническую обструктивную болезнь легких, болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции,гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание периодонта,буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз (включая отрыв атеросклеротических бляшек), аневризму аорты (включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда, инсульт, ишемию головного мозга, черепно-мозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень, депрессию, периферическую нейропатию, боль, церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз,ангиогенез сосудов в роговице глаз, травму роговицы, дегенерацию пятна, аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли, метастазы опухоли,рубцевание сетчатки, склерит, СПИД, сепсис и септический шок, у млекопитающего, включая человека, включающая количество соединения по п.1, эффективного при таких лечениях, и фармацевтически приемлемый носитель. 7. Способ лечения состояний, выбранных из группы, включающей артрит (включая остеоартрит и ревматоидный артрит), воспалительную болезнь кишечника, болезнь Крона, эмфизему, хроническую обструктивную болезнь легких, болезнь Альцгеймера, токсический эффект трансплантации органов, кахексию, аллергические реакции, гиперчувствительность по типу контактного дерматита, злокачественную опухоль, изъязвление тканей, рестеноз, заболевание 34 периодонта, буллезный эпидермолиз, остеопороз, ослабление имплантированного искусственного сустава, атеросклероз (включая отрыв атеросклеротических бляшек), аневризму аорты(включая аневризму брюшной аорты и аневризму артерий головного мозга), застойную сердечную недостаточность, инфаркт миокарда,инсульт, ишемию головного мозга, черепномозговую травму, травму спинного мозга, нейродегеративные заболевания (острые и хронические), аутоиммунные заболевания, болезнь Хантингтона, болезнь Паркинсона, мигрень,депрессию, периферическую нейропатию, боль,церебральную амилоидную ангиопатию, усиление внимания или интеллектуальной деятельности, боковой амиотрофический склероз, рассеянный склероз, ангиогенез сосудов в роговице глаз, травму роговицы, дегенерацию пятна,аномальное заживление ран, ожоги, сахарный диабет, прорастание опухоли, рост опухоли,метастазы опухоли, рубцевание сетчатки, склерит, СПИД, сепсис и септический шок, у млекопитающего, включая человека, включающий введение указанному млекопитающему количества соединения по п.1, эффективного при лечении такого состояния. 8. Фармацевтическая композиция для лечения состояния, которое может быть излечено путем ингибирования матриксных металлопротеиназ у млекопитающего, включая человека,содержащая количество соединения по п.1, эффективное для такого лечения, и фармацевтически приемлемый носитель. 9. Фармацевтическая композиция для лечения состояния, которое может быть излечено путем ингибирования репролизина у млекопитающих, включая человека, содержащая количество соединения по п.1, эффективное для такого лечения, и фармацевтически приемлемый носитель. 10. Способ ингибирования матриксных металлопротеиназ у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества соединения по п.1. 11. Способ ингибирования репролизина у млекопитающих, включая человека, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
МПК / Метки
МПК: C07D 309/14, A61P 29/00, A61K 31/35
Метки: гидроксамиды, 4-сульфониламино)тетрагидропиран-4-карбоновой, кислоты
Код ссылки
<a href="https://eas.patents.su/18-4227-gidroksamidy-4-sulfonilaminotetragidropiran-4-karbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Гидроксамиды (4-сульфониламино)тетрагидропиран-4-карбоновой кислоты</a>
Предыдущий патент: Способ удаления конденсирующихся паров из потока природного газа у устья скважины, устройство для его осуществления и устьевой узел, включающий такое устройство
Следующий патент: Модулятор иммунного ответа alpha2- макроглобулиновый комплекс
Случайный патент: Мощный трансформатор или катушка индуктивности






















