Производные аминоалкилхроманов, обеспечивающие релаксацию мускулатуры дна желудка
Номер патента: 3365
Опубликовано: 24.04.2003
Авторы: Версхейрен Вим Гастон, Вигеринк Пит Том Берт Поль, Шровен Марк Франсис Жозефин, Де Брюйн Марк Франс Леопольд
Формула / Реферат
1.Соединение формулы (I)
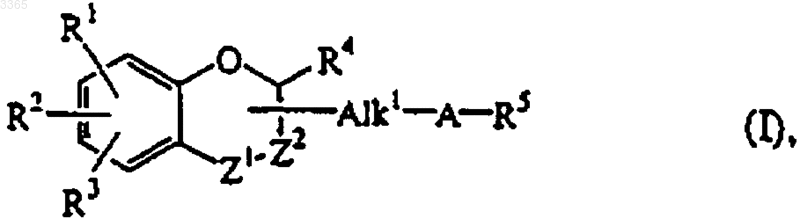
его стереохимически изомерная форма, его N-оксидная форма или фармацевтически приемлемая соль присоединения кислоты, где
Alk1 является карбонилом или C1-4алкандиилом, необязательно замещенным гидрокси;
-Z1-Z2- радикал формулы
-CH= (e-6),
-O-CH2- (e-2),
-CH2-CH2- (e-4);
R1, R2 и R3, каждый независимо, выбран из водорода, C1-6алкила, C1-6алкокси, галогена, гидрокси, C1-6алкилоксикарбонила;
или когда R1 и R2 присоединены к смежным атомам углерода, взятые вместе R1 и R2 могут образовывать бивалентный радикал формулы
-CH=CH-CH=CH= (A-4),
R4 представляет собой водород, C1-6алкил или прямую связь, когда радикал -Z1-Z2- имеет формулу (e-6);
A - бивалентный радикал формулы
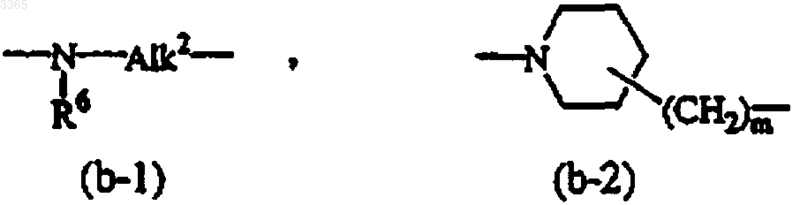
где атом азота связан с Alk1, и m равно 0 или 1;
Alk2 является C1-6алкандиилом;
R6 является водородом, C1-6алкилом, C1-4 алкилоксикарбонилом, фенилметилом;
R5 является радикалом формулы

где X - кислород или NR9;
R7 представляет собой водород или C1-6алкил;
R9 - циано или аминокарбонил;
R10 является водородом или C1-6алкилом; а Q - бивалентный радикал формулы
-CH2-CH2-(d-1),
-CH=CH-(d-4),
-CH2-CH2-CH2-(d-2),
-CH2-CO-(d-5),
где необязательно один или два атома водорода у одного и того же или разных атомов углерода могут быть замещены C1-4алкилом, гидрокси или фенилом, либо
Q - бивалентный радикал формулы
при условии, что когда радикал -Z1-Z2- представлен формулой (e-2), а бивалентный радикал Q формулами (d-1) или (d-2), один или два атома водорода на одном или разных атомах углерода в указанных формулах (d-1) или (d-2) замещены C1-4 алкилом, гидрокси или фенилом.
2. Соединение по п.1, в котором бивалентный радикал A имеет формулу (b-1).
3. Соединение по п.1, в котором бивалентный радикал A имеет формулу (b-2).
4. Соединение по п.1, в котором R4 является водородом; A представляет собой радикал формулы (b-1), где R6 является водородом или C1-6алкилом, a Alk2 представляет собой C2-4алкандиил; или A представляет собой радикал формулы (b-2), R5 является радикалом формулы (c-1), где X представляет собой водород, a Q имеет формулу (d-1) или (d-2), в которой один или два атома водорода у одного или того же или разных атомов углерода необязательно могут быть замещены C1-4алкилом.
5. Соединение по п.1, представляющее собой 1-[3-[[(3,4-дигидро-2H-1-бензопиран-2-ил)метил]амино]пропил]тетрагидро-2(1H)пиримидинон; его стереоизомерную форму или фармацевтически приемлемую соль присоединения кислоты.
6. Соединение по п.5, представляющее собой [R-(R*,R*)]-2,3-дигидроксибутандиоат (R)-1-[3-[[(3,4-дигидро-2H-1-бензопиран-2-ил)метил]амино]пропил]тетрагидро-2(1H)пиримидинона.
7. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по пп.1-6.
8. Применение соединения по пп.1-6 в качестве средства для релаксации мускулатуры дна желудка.
9. Применение соединения по любому из пп.1-6 для лечения состояний, связанных с нарушением или задержкой релаксации мускулатуры дна желудка.
10. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (II) алкилируют промежуточным соединением (III) в реакционно-инертном растворителе и необязательно в присутствии подходящего основания,
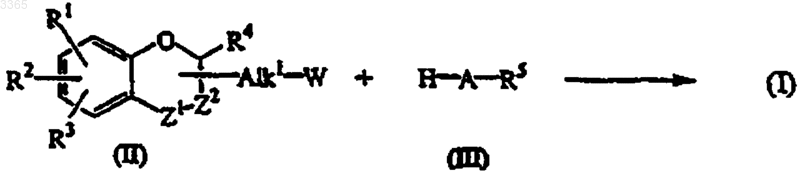
где значения радикалов A, R1, R2, R3, R4 и R5 такие, как определено в п.1, a W - соответствующая удаляемая группа и, если желательно, полученное таким образом соединение формулы (I) переводят в другое соединение формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно, соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно, соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или, если желательно, получают стереохимически изомерные формы.
11. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (IV), где Alk1 представляет собой прямуюсвязь или C1-5алкандиил, подвергают восстановительному алкилированию с промежуточным соединением формулы (III)
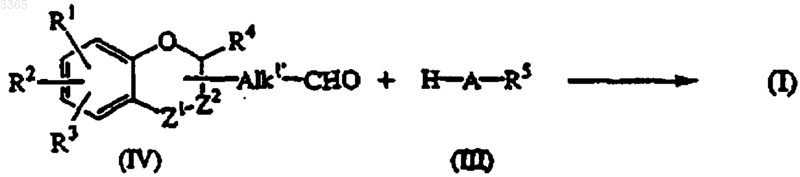
где значения радикалов A, R1, R2, R3, R4 и R5 такие, как определено в п.1 и/или, если желательно, полученное таким образом соединение формулы (I) переводят в другое соединение формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно, соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно, соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или, если желательно, получают стереохимически изомерные формы.
12. Способ получения соединения формулы (I), в котором промежуточное соединение, формулы (V), где Alk1 представляет собой прямую связь или С1-5алкандиил, подвергают взаимодействию с промежуточным соединением формулы (III)
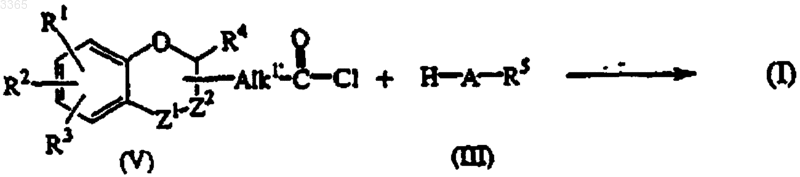
причем в вышеприведенных реакционных схемах значения радикалов A, R1, R2, R3, R4 и R5 такие же, как определено в п.1 и/или, если желательно, полученное таким образом соединение формулы (I) переводят в другое соединение формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно, соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно, соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или, если желательно, получают стереохимически изомерные формы.
Текст
1 Настоящее изобретение относится к новым аминометилхромановым соединениям, обладающим способностью обеспечивать релаксацию мускулатуры дна желудка. Изобретение также относится к способам получения таких соединений, фармацевтическим композициям,содержащим указанные соединения, а также применению указанных соединений в качестве лекарственных средств. Близкие по структуре к заявленным соединениям производные аминометилхромана описаны в патенте US-5541199 как селективные агонисты ауторецепторов, полезные в качестве антипсихотических средств. Другие структурно родственные производные аминометилхромана,обладающие сродством к церебральным 5 гидрокситриптаминовым рецепторам 5-HT1 типа и потому приемлемые для лечения заболеваний центральной нервной системы, описываются в патенте US-5137901. ЕР-0546388, опубликованный 16 июня 1993 г., описывает родственные по структуре производные аминометилхромана, обладающие сродством к церебральным 5-гидрокситриптаминовым рецепторам 5-HT1 типа и рецепторам допамина D2-типа. В ЕР-0628310, опубликованном 14 декабря 1994 г., описывается использование тех же самых производных аминометилхромана для ингибирования ВИЧпротеазы. В DE-2400094, опубликованном 18 июля 1974 г., описаны 1-[1-[2-(1,4-бензодиоксан-2-ил)2-гидроксиэтил]-4-пиперидил-2]-бензимидазолиноны, обладающие способностью понижать кровяное давление. В WO 93/17017, опубликованном 2 сентября 1993 г., описаны [(бензодиоксан, бензофуран или бензопиран)алкиламино]алкилзамещенные гуанидины как селективные вазоконстрикторы,приемлемые для лечения состояний, связанных с расширением сосудов, таких как, например,мигрень, так называемая "гистаминовая" головная боль и головная боль, связанная с сосудистыми расстройствами.WO 95/05383, опубликованный 23 февраля 1995 г., описывает производные дигидробензопиранпиримидина, также обладающие сосудосуживающими свойствами. Другие структурно родственные производные аминометилхромана описываются в WO 97/28157, опубликованном 7 августа 1997 г., как антагонисты 2-адренергических рецепторов,приемлемые для лечения дегенеративных неврологических состояний. Соединения настоящего изобретения отличаются по структуре от известных вышеперечисленных соединений природой заместителяR5, а также фармакологически тем, что неожиданно оказалось, что эти соединения обладают способностью обеспечивать релаксацию мускулатуры дна желудка. Кроме того, дополнительным фармакологическим преимуществом со 003365 2 единений настоящего изобретения является то,что они обладают незначительной сосудосуживающей активностью или не имеют ее вовсе. В процессе потребления пищи дно желудка, т.е. его проксимальная часть желудка расслабляется и обеспечивает "резервуарную" функцию. Установлено, что пациенты с ухудшенной адаптивностью к расслаблению мускулатуры дна желудка во время поступления пищи в желудок сверхчувствительны к растяжению желудка и у них появляются симптомы диспепсии. Поэтому полагают, что соединения, которые способны нормализовать ухудшенную фундальную релаксацию желудка, т.е. снижать тонус мускулатуры дна желудка, являются полезными с точки зрения избавления пациентов от неприятностей, связанных с указанными диспепсическими симптомами. Настоящее изобретение включает соединения формулы (I) их стереохимически изомерную форму, их Nоксидную форму и фармацевтически приемлемую соль присоединения кислоты, где Alk1 является карбонилом, или С 1-4 алкандиилом необязательно замещенным гидрокси;R1, R2 и R3, каждый независимо, выбран из водорода, C1-6 алкила, C1-6 алкокси, галогена,гидрокси, C1-6 алкилоксикарбонила; или когда R1 и R2 присоединены к смежным атомам углерода, взятые вместе R1 и R2 могут образовывать бивалентный радикал формулы-СН=СН-СН=СН= (а-4),R4 представляет собой водород, C1-6 алкил или прямую связь, когда радикал -Z1-Z2- имеет формулу (е-6); А - бивалентный радикал формулы где атом азота связан с Alk1, и m равно 0 или 1;R7 представляет собой водород или C1-6 алкил;R10 является водородом или C1-6 алкилом; а-СН 2-СН 2- (d-1),-CH=CH- (d-4),-СН 2-СН 2-СН 2- (d-2),-CH2-CO- (d-5),где необязательно 1 или 2 атома водорода у одного и того же или разных атомов углерода могут быть замещены C1-4 алкилом, гидрокси или фенилом, либо или при условии, что, когда радикал -Z1-Z2 представлен формулой (е-2), а радикал Q формулами (d-1) или (d-2), 1 или 2 атома водорода на одном или разных атомах углерода в указанных формулах (d-1) или (d-2) замещены C1-4 алкилом, гидрокси или фенилом. В нижеследующих определениях галоген является родовым понятием для фтора, хлора,брома и иода;C1-4 алкил означает радикалы насыщенных углеводородов с прямой и разветвленной цепочкой, содержащие от 1 до 4 атомов углерода,такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил и т.п.; C1-6 алкил включает C1-4 алкил и его более высокие гомологи с 5 или 6 атомами углерода, такие как,например, 2-метилбутил, пентил, гексил и др.,С 3-6 циклоалкил включает циклопропил, циклобутил, циклопентил и циклогексил; С 3-6 алкенил означает радикалы ненасыщенных углеводородов с прямой и разветвленной цепочкой, содержащие от 3 до 6 атомов углерода, такие как пропенил, бутенил, пентенил или гексенил; C1-2 алкандиил означает метилен или 1,2-этандиил;C2-4 алкандиил означает бивалентные углеводородные радикалы с прямой или разветвленной цепочкой, содержащие от 2 до 4 атомов углерода, такие как, например, 1,2-этандиил, 1,3 пропандиил, 1,4-бутандиил и их разветвленные изомеры; C1-5 алкандиил означает бивалентные углеводородные радикалы с прямой или разветвленной цепочкой, содержащие от 1 до 5 атомов углерода, например метилен, 1,2 этандиил,1,3-пропандиил,1,4-бутандиил, 1,5-пентандиил и их разветвленные изомеры; C1-6 алкандиил включает C1-5 алкандиил и его более высокие гомологи с 6 атомами углерода, например, 1,6-гександиил и т.п. Термин Термин "стереохимически изомерные формы" в данном здесь значении подразумевает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если иное не указано, изображение химической структуры соединений означает смесь всех возможных стереохимически изомерных форм, т.е. смеси,содержащие диастереомеры и энантиомеры основной молекулярной структуры. В частности,стереогенные центры могут иметь R- или Sконфигурацию; заместители в бивалентных циклических (частично) насыщенных радикалах могут быть или цис-, или трансконфигурации. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию указанной двойной связи. Очевидно, что стереохимически изомерные формы соединений формулы (I) следует считать входящими в объем данного изобретения. Имеется в виду, что фармацевтически приемлемые соли присоединения кислот в том смысле, какой здесь подразумевается, включают терапевтически активные нетоксичные формы солей, полученные присоединением кислот,которые могут образовываться из соединений формулы (I). Фармацевтически приемлемые соли присоединения кислот легко могут быть получены в результате обработки основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородную или бромисто-водородную кислоты, такие как серная, азотная, фосфорная и др. кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиоевая кислота), малоновая, янтарная (т.е. бутандиоевая кислота), малеиновая, фумаровая, яблочная, виннокаменная, лимонная, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, цикламовая,салициловая, п-аминосалициловая, памовая и др. аналогичные кислоты. Наоборот, указанные солевые формы могут быть переведены в форму свободного основания обработкой соответствующим основанием. Термин соль присоединения в данном здесь значении включает также сольваты, которые так же как и соли, могут образовываться из соединений формулы (I). Такие сольваты являются, например, гидратами, алкоголятами и т.п. Подразумевается, что N-оксидные формы соединений формулы (I), которые могут быть получены известными способами, включают те соединения формулы (I), в которых бивалент 5 ный радикал формулы А представляет собой радикал формулы (b-1), где R6 - отличен от водорода, или бивалентный радикал формулы А представляет собой радикал формулы (b-2), где атом азота окислен до N-оксида. Соединения, представляющие интерес,представляют собой такие соединения формулы(I), в которых имеет место одно или более из следующих ограничений: бивалентный радикал А имеет формулу (b1); бивалентный радикал А имеет формулу (b2); Предпочтительны соединения I, в которыхR4 является водородом; А представляет собой радикал формулы (b-1), где R6 является водородом или C1-6 алкилом, a Alk2 представляет собой С 2-4 алкандиил; или А представляет собой радикал формулы (b-2), R5 является радикалом формулы (с-1), где Х представляет собой кислород, R7 представляет собой водород, a Q имеет формулу (d-1) или (d-2), в которой один или два атома водорода у одного или того же или разных атомов углерода необязательно могут быть замещены C1-4 алкилом. Самыми предпочтительными являются соединения представляющие собой 1-[3-(3,4 дигидро-2 Н-1-бензопиран-2-ил)метил]амино] пропил]тетрагидро-2(1 Н)-пиримидинон; его стереоизомерную форму или фармацевтически приемлемую соль присоединения кислоты; и соединение, представляющее собой [R(R,R)]-2,3-дигидроксибутандиоат(R)-1-[3(3,4-дигидро-2 Н-1-бензопиран-2-ил)метил] амино]пропил]тетрагидро-2(1 Н)пиримидинона. Следующими объектами изобретения являются фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения I, и применение соединения I для релаксации мускулатуры дна желудка. Следующим объектом изобретения является применение соединения I для лечения состояний, связанных с нарушением или задержкой релаксации мускулатуры дна желудка. Соединения данного изобретения могут, в основном, быть получены алкилированием промежуточного соединения формулы (III) промежуточным соединением формулы (II), где W соответствующая удаляемая группа, такая как,например, галоген, например фтор, хлор, бром,иод, или в некоторых случаях W может также быть сульфонилоксигруппой, например метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и аналогичные им по реакционной способности удаляемые группы. Реакцию можно проводить в реакционноинертном растворителе, таком как, например,ацетонитрил или тетрагидрофуран, и необязательно в присутствии подходящего основания,такого как, например, карбонат натрия, карбонат калия, оксид кальция или триэтиламин. Пе 003365 6 ремешиванием можно увеличить скорость реакции. Реакцию обычно удобно проводить при температуре, в интервале от комнатной до температуры кипячения с обратным холодильником, и, при желании, реакция может выполняться в автоклаве при повышенном давлении. Соединения формулы (I) могут также быть получены восстановительным алкилированием промежуточного соединения формулы (IV), гдеAlk1' представляет собой прямую связь или C1-5 алкандиил, после хорошо известных методик восстановительного алкилирования промежуточного соединения формулы (III). Данное восстановительное алкилирование может осуществляться в реакционно-инертном растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как, например, боргидрид, например, боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. Обычной практикой является и использование водорода в качестве восстановителя в сочетании с подходящим катализатором, таким как, например, палладий-на-угле, родий-на-угле или платина-на-угле. В случае использования водорода в качестве восстановителя может быть желательным добавление дегидратирующего агента к реакционной смеси, такого как третбутоксид алюминия. Для предотвращения нежелательного дальнейшего гидрирования определенных функциональных групп реагентов и продуктов реакции, может быть целесообразным добавление в реакционную смесь соответствующего каталитического яда, например тиофена или хинолин-серы. Чтобы увеличить скорость реакции, температура реакционной смеси может быть повышена в пределах от комнатной до температуры ее дефлегмации при необязательном повышении давления . Альтернативно, соединения формулы (I) могут также быть получены взаимодействием хлорангидрида кислоты формулы (V), где Alk1' представляет собой прямую связь, с промежуточным соединением формулы (III) в подходящих реакционных условиях. Данная реакция может проводиться в восстановительных условиях воздействием газообразным водородом в присутствии подходящего катализатора, такого как, например, палладийна-угле, родий-на-угле, в подходящем раствори 7 теле, например, этилацетате и в присутствии оксида магния. Для предотвращения нежелательного дальнейшего гидрирования определенных функциональных групп реагентов и продуктов реакции, может быть целесообразным добавление в реакционную смесь соответствующего каталитического яда, например тиофена или хинолин-серы. Чтобы увеличить скорость реакции, температура реакционной смеси может быть повышена в пределах от комнатной до температуры ее кипения с обратным холодильником при необязательном повышении давления. Соединения формулы (I) могут быть также получены превращением соединений формулы(I) друг в друга согласно хорошо известным реакциям превращения групп. Например, соединения формулы (I), в котором R6 представляет собой фенилметил, может быть переведен в соответствующие соединения формулы (I), гдеR6 -водород, с помощью известных методов дебензилирования. Такое дебензилирование может выполняться по известным методикам, таким как каталитическое восстановление с помощью соответствующих катализаторов, например, платины-на-угле, палладия-на-угле в соответствующих растворителях, таких как метанол, этанол, 2-пропанол, диэтиловый эфир,тетрагидрофуран и т.п. Кроме того, соединения формулы (I), где R6 - водород, могут быть алкилированы с помощью хорошо известных методик, таких как, например, восстановительное Nалкилирование подходящим альдегидом или кетоном, или соединения формулы (I), где R6 водород, могут быть подвергнуты взаимодействию с ацилгалогеном или ангидридом кислоты. Соединения формулы (I) могут также быть превращены в соответствующие N-оксидные формы с помощью известных методик перевода трехвалентного азота в его N-окись. Данную реакцию окисления азота вообще можно осуществлять путем взаимодействия исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов,например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, перексобензойная кислота или галогензамещенная перексобензойная кислота; например, 3-хлорперексобензойная кислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, третбутил-гидропероксид. Подходящими растворителями являются, например, низшие спирты,например этанол и т.п., углеводороды, например толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан и смеси этих растворителей. 8 Исходные вещества и некоторые из промежуточных веществ являются известными соединениями, коммерчески доступны и могут быть получены в соответствии с обычными реакционными схемами, известными в данной области. Например, ряд промежуточных соединений формулы (II), (VI) или (V) могут быть получены согласно известным методикам, описанным в заявках WO 93/17017 и WO 95/053837. Соединения формулы (I) и некоторые промежуточные соединения могут иметь в своей структуре один или несколько стереогенных центров, существующих в R- или S-конфигурации, таких как, например, атом углерода,несущий заместитель R4, и атом углeрода, связанный с остатком -Аlk1-А-R5. Соединения формулы (I), если они получены вышеуказанными способами, могут получаться в виде рацемических смесей энантиомеров, которые можно разделить с помощью известных в данной области методик разделения. Рацемические соединения формулы (I) могут быть переведены в соответствующие диастереомерные солевые формы взаимодействием с соответствующей хиральной кислотой. Такие диастереомерные формы солей потом разделяют, например, путем селективной или фракционной кристаллизации и энантиомеры высвобождают из них щелочью. Другой способ выделения энантиомерных форм соединений формулы(I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных веществ при условии, что реакция протекает и стереоспецифически сохраняется. Предпочтительно, если хотят получить определенный стереоизомер, его синтезируют, используя стереоспецифические методы получения. В этих методах будут успешно использоваться энантиомерно чистые исходные вещества. Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые соли и стереоизомерные формы обладают весьма ценным свойством обеспечивать релаксацию мускулатуры дна желудка, как показано в фармакологическом примере C.1, в тесте, озаглавленном как "Тонус желудка, измеряемый с помощью электронного баростата у находящихся в сознании собаках". Кроме того, как показано во втором фармакологическом примере С.2 "Сосудистосуживающая активность на базилярной артерии", соединения настоящего изобретения обладают дополнительными полезными фармакологическими свойствами, которые заключаются в том, что эти соединения не являются вазоконстрикторами или обладают сосудисто-суживающeй активностью в незначительной степени. Сосудисто-суживающая активность может вы 9 зывать нежелательные побочные эффекты, такие как коронарные спазмы, которые могут вызывать боли в грудной клетке. В связи со способностью соединений настоящего изобретения вызывать релаксацию дна желудка заявленные соединения применяются для лечения состояний, связанных с затрудненной или ухудшенной релаксацией дна желудка,таких как, например, диспепсия, раннее насыщение, вздутие живота и анорексия. Диспепсию характеризуют как нарушение моторной функции (перистальтики) желудка. Симптомы ее могут вызываться замедленным опорожнением желудка или ухудшенной релаксацией дна желудка при проглатывании пищи. Теплокровные, включая человека (названные здесь объединенно пациентами), страдающие от симптомов диспепсии как результата замедленного опорожнения желудка, обычно имеют нормальный тонус мышц дна желудка, и у них проявления диспепсии можно облегчить применением прокинетического средства, например,цисаприда. Пациенты могут иметь симптомы диспепсии и без нарушений опорожнения желудка. У них диспептические симптомы могут быть результатом чрезмерного сокращения мускулатуры дна желудка или сверхчувствительности, приводящих к уменьшенной растяжимости и нарушениям адаптивного характера снижения тонуса мускулатуры дна желудка. Сверхсильное сокращение мышц дна желудка приводит к уменьшению его растяжимости. Растяжимость желудка можно выразить как отношение объема желудка к давлению, оказываемому стенкой желудка. Растяжимость желудка связана с тонусом, который является результатом тонического сокращения мышечных волокон проксимального отдела желудка. Эта проксимальная часть желудка, подвергающаяся упорядоченному тоническому сокращению (желудочный тонус),выполняет в желудке "резервуарную" функцию. Пациенты, страдающие от раннего насыщения, не могут завершить обычный прием пищи, т.к. они испытывают чувство насыщения прежде, чем в состоянии закончить нормальный прием пищи. Обычно в начале приема пищи в желудке происходит адаптивное снижение сокращения его мышц. Такое адаптивное расслабление мышц желудка невозможно, когда их растяжимость затруднена, что приводит к ослабленной релаксации мышц дна желудка. Исходя из полезности соединений формулы (I) вытекает, что настоящее изобретение также предусматривает способ лечения теплокровных, включая человека (названных здесь в целом пациентами), страдающих от ухудшенной релаксации мускулатуры дна желудка при проглатывании пищи. Поэтому способ лечения предназначен для лечения больных, страдающих от таких расстройств, как диспепсия, раннее насыщение, вздутие живота и анорексия. 10 Следовательно, предусматривается применение соединения формулы (I) в качестве лекарственного средства и, в частности, применение соединения формулы (I) для изготовления лекарства для лечения расстройств, характеризующихся неудовлетворительной фундальной релаксацией при проглатывании пищи. Предполагается их использование как с профилактической, так и лечебной целями. Симптомы ухудшенной релаксации мускулатуры дна желудка могут развиться и вследствие приема внутрь химических веществ, например, Selective Seretonine Re-uptake Inhibitors(SSR'Is), таких как флуоксетин, флувоксамин,циталопрам и сертралин. Другим функциональным гастроинтестинальным расстройством является синдром раздраженного кишечника (IBS), одно из проявлений которого, как установлено, связано с гиперчувствительностью кишки к растяжению. Поэтому, исходя из этого, полагают, что регулирование этой гиперчувствительности с помощью заявленных соединений, обладающих свойствами снижать тонус мускулатуры дна желудка, может облегчить болезненные проявления у лиц, страдающих IBS. Соответственно предусматривается использование соединения формулы (I) для изготовления лекарства для лечения IBS (синдром болезненно чувствительной кишки). Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения в форме соли присоединения кислоты или основания в качестве активного ингредиента объединяют, тщательно перемешивая с фармацевтически приемлемым носителем, который может отличаться широким разнообразием форм, зависящим от типа препарата, который предпочтителен для назначения. Эти фармацевтические композиции в виде желательных стандартных доз подходят для применения орального и ректального путей введения, а также для парентеральных инъекций. Например, при получении композиций в виде стандартной дозы для орального применения могут применяться некоторые из ряда обычных фармацевтических сред, такие как,например, вода, гликоли, масла, спирты и аналогично - в случае жидких препаратов для орального применения, таких как суспензии,сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин,смазывающие вещества, связующие, дезинтегрирующие агенты и аналогично - в случае порошков, пилюль, капсул и таблеток. Благодаря простоте применения таблетки и капсулы представляют собой самую благоприятную для использования стандартную дозированную форму для орального применения, в которой обычно используются твердые фармацевтические носители. Для композиций для парентерального введения носитель будет, как правило, включать 11 стерильную воду, по крайней мере, в большем количестве, хотя и другие ингредиенты могут быть включены, например, для повышения растворимости. Растворы для инъекций, к примеру,готовят используя носитель, включающий солевой раствор, раствор глюкозы или их смесь. Суспензии для инъекций могут также быть приготовлены с использованием соответствующих жидких носителей, суспендирующих агентов и т.п. В композициях для подкожного введения носитель обычно включает средство, увеличивающее проницаемость, и/или подходящий смачивающий агент, необязательно соединенный с подходящими добавками любой природы, взятыми в минорных количествах, которые не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать введение под кожу и/или могут быть полезными в процессе приготовления целевых композиций. Эти композиции могут быть введены различными путями, например, в виде трандермального пластыря, аппликации, в виде мази. Соли присоединения кислот (I) вследствие их повышенной растворимости в воде по сравнению с соответствующей основной формой вполне очевидно больше подходят для приготовления водных композиций. Особенно удобно готовить вышеперечисленные фармацевтические композиции в виде стандартной дозированной формы для того,чтобы их было легко вводить и для стандартизации дозирования. Стандартная дозированная форма в том смысле, который подразумевается в описании и формуле изобретения, называется физически дискретные единицы, пригодные в качестве стандартных доз, при этом подсчитано,что каждая единица, содержащая заранее определенное количество активного ингредиента,оказывает в сочетании с требуемым фармацевтическим носителем желаемый терапевтический эффект. Примерами таких единичных дозированных форм являются таблетки (включая как таблетки с покрытием, так и без покрытия), капсулы, пилюли, порошки, облатки, растворы и суспензии для инъекций, порционные дозы в объеме чайной или столовой ложки и т.п. и их отдельные разновидности. Вводимые орально фармацевтические композиции могут быть в виде единичных дозированных форм, например, таблеток (предназначенных как для проглатывания, так и для жевания), капсул, желатиновых капсул, полученных обычными методами с использованием фармацевтически пригодных наполнителей,таких как связывающие агенты (например,предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие агенты 12 крахмал или гликолят натрийкрахмала); или увлажняющие средства (например, натрийлаурилсульфат). На таблетки может быть нанесено покрытие способами, хорошо известными в данной области. Жидкие препараты для орального применения могут быть в виде, например, растворов,сиропов или суспензий или они могут представлять собой сухой продукт для смешивания с водой или другим подходящим для использования средством. Такие жидкие препараты могут быть приготовлены обычным путем, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или камедь акации); неводные носители(например, миндальное масло, эфиры жирных кислот или этиловый спирт); консервирующие вещества (например, метил- или пропил-пгидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители предпочтительно включают, по меньшей мере, один сильный подсластитель, такой как сахарин, сахарин натрия и кальция, аспартам,ацесульфам калия, цикламат натрия, алитам,дигидрохальконовый подсластитель, монеллин,стевиозид или сукралозу (4,1',6'-трихлор-4,1',6'тридезоксигалактосахарозу), предпочтительно сахарин, сахарин-натрий или кальций, и необязательно объемный наполнитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, гидрированный сироп глюкозы,ксилит, карамель или мед. Сильные подсластители обычно применяются в низких концентрациях. Например, в случае с сахарином натрия концентрация может колебаться от 0,04 до 0,1% (вес/объем) в зависимости от общего объема конечного состава, и предпочтительно от 0,06% в составах с низкими дозами и 0,08% в составах с высокими дозами. Объемный наполнитель может эффективно использоваться в больших количествах, в интервале от 10 до 35%, предпочтительно от 10 до 15% (вес/объем). Фармацевтически приемлемыми улучшителями вкуса, которые могут маскировать горький вкус ингредиентов в составах с низким содержанием компонентов, предпочтительно являются такие, которые придают вкус фруктов и ягод, например вишни, малины, черной смородины или клубники. Комбинация двух улучшителей вкуса может приводить к очень хорошим результатам. В составах с высокой дозировкой компонентов могут потребоваться такие улучшители вкуса, как ароматизаторы - шоколадная карамель, прохладная мята и аромат фантазии,или подобные им более сильные фармацевтически приемлемые улучшители вкуса. Каждый улучшитель вкуса может содержаться в конеч 13 ной композиции в концентрации от 0,05 до 1%(вес/объем). Предпочтительно удобно использовать комбинации указанных сильных улучшителей вкуса. Предпочтительно использование такого улучшителя вкуса, который не меняет и не теряет своего вкуса и аромата в кислой среде состава. Соединения данного изобретения могут вводиться в состав композиций - препаратов депо (пролонгированного действия). Такие составы с повышенной продолжительностью действия могут имплантироваться (например, подкожно или внутримышечно) или вводиться путем инъекции внутримышечно. Например, соединения могут быть объединены в составе с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами,или (применяться) в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Соединения данного изобретения могут входить в составы для парентерального введения путем инъекций, обычно внутривенных,внутримышечных и подкожных инъекций, например болюсной инъекции или непрерывной внутривенной инфузии. Составы для инъекций могут быть в виде единичной дозированной формы, например, в ампулах или в контейнерах с множеством доз с добавленным консервантом. Композиции могут быть в виде суспензий, растворов или эмульсий в масляных или водных средах и могут содержать другие обычно применяемые средства, например, изотонизирующие, суспендирующие, стабилизирующие и/или диспергирующие агенты. Или же активный ингредиент может быть в виде порошка, соединяемого перед использованием с подходящим носителем, например стерильной апирогенной водой. Соединения данного изобретения могут также входить в составы для ректального применения, например суппозитории или клизмы,содержащие, например, обычные суппозиторные основы, такие как масло какао или другие глицериды. Для интраназального введения соединения данного изобретения могут применяться, например, в виде спрея, порошка или в виде капель. Составы настоящего изобретения могут необязательно включать вещества, представляющие тетеоризм, такие как симетикон, альфаD-галактозидазу и т.п. В целом, полагают, что терапевтически эффективная доза должна составлять от 0,001 до 2 мг/кг массы тела, предпочтительно от 0,02 до 0,5 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента при режиме приема его от 2 до 4 раз в день. 14 Экспериментальная часть В опытах, описанных ниже, использовали следующие аббревиатуры: "ACN", означающая ацетонитрил; "THF", обозначающая тетрагидрофуран; "DCM" - дихлорметан; "DIPE" - диизопропиловый эфир; "DMF" - N,N-диметилформамид. Для некоторых химических веществ использовались их химические формулы, например H2 - газообразный водород, N2 - газообразный азот, CH2Cl2 - дихлорметан, СН 3 ОН - метанол, NН 3 -аммиак, НСl - соляная кислота, NaOH- гидроксид натрия. В тех случаях, когда выделен стереохимический изомер, первый обозначен как "А", а второй - как "В", независимо от действительной стереохимической конфигурации. А. Получение промежуточных соединений. Пример А.1.(0,37 моль) в этаноле (100 мл) добавили к раствору 3,4-дигидро-2 Н-1-бензопиран-2-карбоновой кислоты (0,36 моль) в этаноле (200 мл). Смесь оставили для кристаллизации. Осадок отфильтровали и высушили. Остаток кристаллизовали из этанола 4 раза. Осадок отфильтровали и высушили. Остаток перенесли в воду,обработали 10% НСl и проэкстрагировали диэтиловым эфиром. Органический слой отделили, высушили, отфильтровали и отогнали растворитель, получив 8,6 г (-)-(R)-3,4-дигидро-2 Н 1-бензопиран-2-карбоновой кислотыb) Промежуточное соединение (1) (2,14 моль) перемешивали в толуоле (1280 мл) в инертной атмосфере. Добавили этанол (640 мл) и серную кислоту (21 мл, 96%) при комнатной температуре. Реакционную смесь перемешивали и нагревали с обратным холодильником в инертной атмосфере в течение 3,5 ч. Реакционную смесь охлаждали при комнатной температуре. Медленно добавили раствор NаНСО 3 (68 г) в воде (1900 мл) и смесь перемешивали 15 мин. Органический слой отделили, высушили,отфильтровали и фильтрат концентрировали до объема в 600 мл. Концентрат, этиловый эфир(-)-(R)-3,4-дигидро-2 Н-1-бензопиран-2-карбоновой кислоты, использовался на следующей стадии (промеж. соединение 2). с) Смесь толуола (1000 мл) и этанола (абсолютный, 520 мл) перемешивали. Борогидрид натрия (2,13 моль) добавляли при комнатной температуре в инертной атмосфере. Смесь нагревали до 50 С. По каплям при 50 С добавили промежуточное соединение (2) (2,14 моль) в течение 90 мин (экзотермический подъем температуры на 15 С; требуется охлаждение). Реакционную смесь перемешивали в течение 90 мин при 50 С. В процессе перемешивания добавляли воду (1500 мл). Затем при слабом охла 15 ждении по каплям добавляли 2-пропанол (100 мл). Смесь гасили соляной кислотой (180 мл). Органический слой отделяли, сушили, фильтровали и отгоняли растворитель, получая 295 г (-)(R)-3,4-дигидро-2 Н-1-бензопиран-2-метанолаd.) Смесь промежуточного соединения (3)(0,18 моль) в толуоле (110 мл) и N,Nдиэтилэтанамина (29 мл) перемешивали и охлаждали на водяной бане. Метилсульфонилхлорид(0,20 моль) добавляли по каплям к реакционной смеси и перемешивали ее при комнатной температуре в течение 30 мин. Добавили воды. Органический слой отделили, промыли водой, высушили, отфильтровали и отогнали растворитель. Остаток подвергли кристаллизации из(эфир) (промеж. соединение 4). Пример А.2. а) Смесь -3,4-дигидро-2 Н-бензопиран-2 карбонилхлорида (0,5 моль) в N,N-диметилацетамиде (150 мл) и DIPE (350 мл) гидрировали при использовании в качестве катализатора палладия-на-активированном угле (10%, 5,0 г) в присутствии раствора тиофена в метаноле (4%,4 мл). После поглощения H2 (1 экв.) катализатор отфильтровали. К фильтрату добавили ацетат калия (5 г). Был добавлен метанол (100 мл) и получали смесь(10%, 5 г). После поглощения водорода (1 экв.) катализатор отфильтровали и фильтрат выпаривали с получением остатка (В). Смесь остатка(В) в смеси (А) и метаноле (100 мл) гидрировали с катализатором палладий-на-активированном угле (5 г) в присутствии раствора тиофена в метаноле (4%, 3 мл). После поглощения водорода (1 экв.) катализатор отфильтровали и фильтрат выпарили. Остаток перенесли в воду и проэкстрагировали диэтиловым эфиром. Отделенный органический слой высушили, отфильтровали и фильтрат обработали активированным древесным углем, затем отфильтровали через дикалит и растворитель выпарили. Остаток кристаллизовали из DIPE, отфильтровали и высушили, получив 64,4 г (41,8%) продукта (фракция 1). Часть (6,3 г) этой фракции пeрекристаллизовали из DIPE, отфильтровали и высушили,получив 4,53 продукта. Фильтрат концентрировали, перемешали, получившийся осадок отфильтровали и высушили, получив 35 г (22,4%)b) Смесь промежуточного соединения (5)(фракции 1+2) в метаноле (1300 мл) и раствор соляной кислоты в 2-пропаноле (400 мл) пере 003365 16 мешивали при комнатной температуре в течение ночи. Осадок отфильтровали и высушили, получив 72,4 г продукта. Часть этой фракции растворили в воде, добавили щелочи и проэкстрагировали диэтиловым эфиром. Отделенный органический слой высушили, отфильтровали и отогнали растворитель, получив 36,9 г -1-[3,4 дигидро-2 Н-1-бензопиран-2-ил)метил]-4 пиперидинамина (промеж. соединение 6).c) Смесь промежуточного соединения (6)(0,047 моль) и акрилонитрила (0,047 моль) в этаноле (250 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Растворитель выпарили. Остаток очищали на силикагеле в стеклянной колонке (элюент: СН 2 Сl2/ СН 3 ОН от 95/5 до 90/10). Нужные фракции отбирали и выпаривали растворитель. Добавили толуол и удалили его азеотропной перегонкой в роторном испарителе с получением 11,5 гd) Смесь промежуточного соединения (7)(0,013 моль) в растворе аммиака в метаноле (200 мл) гидрировали с использованием в качестве катализатора никеля Ренея (3,0 г). После поглощения водорода (2 экв.) катализатор отфильтровали и фильтрат подвергли выпариванию с получением 3,6 г -N-[1-[(3,4-дигидро-2 Н-1 бензопиран-2-ил)-метил]-4-пиперидинил]-1,3 пропандиамина (промеж. соединение 8). Пример А.3.a) Смесь 1-[2-гидрокси-3-метил-4-(фенилметокси)фенил]этанона (0, 098 моль) и этандиовой кислоты, диэтилового эфира (0,11 моль) в толуоле (100 мл) добавили по каплям к смеси метоксида натрия (0,22 моль) в толуоле (150 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 2 ч. Растворитель выпаривали. Остаток добавили к смеси уксусной кислоты (150 мл) и соляной кислоты (50 мл). Реакционную смесь перемешали и кипятили с обратным холодильником в течение 1 ч. Смесь вылили на лед. Получившийся осадок отфильтровали и высушили (вакуум; 70 С), получив 29 г (95,4%) 8-метил-4-оксо-7(фенилметокси)-4 Н-1-бензопиран-2-карбоновой кислоты (промеж. соединение 9).b) Смесь промежуточного соединения (9)(0,093 моль) и метансульфокислоты (11 г) в метаноле (500 мл) гидрировали с катализатором палладий-на-активированном угле (3 г). После поглощения водорода (4 экв.) катализатор отфильтровывали. Фильтрат выпаривали, остаток растворили в ДСМ и органический раствор промыли водой, высушили и выпарили растворитель, получив 19,2 г -метил-3,4-дигидро-7 гидрокси-8-метил-2 Н-1-бензопиран-2-карбоксилата (промеж. соединение 10). с) Реакция в токе N2. Раствор гидрида диизобутилалюминия в толуоле (25%) добавили по каплям к смеси промежуточного соединения(10) (0,077 моль) в толуоле (250 мл) и THF (20 мл), перемешиваемой при -70. Реакционную смесь перемешивали в течение 1 ч при -70 С,затем разрушали метанолом (35 мл). Реакционную смесь выливали в воду и эту смесь подкисляли соляной кислотой. Отделили органический слой и промыли его водой. Видную фазу экстрагировали DCM. Объединенные органические слои высушили, отфильтровали и растворитель выпарили, получив 13 г (87,8%) -3,4-дигидро 7-гидрокси-8-метил-2 Н-1-бензопиран-2-карбоксальдегида (промеж. соединение 11). Пример А.4.a) Смесь N-[1-(фенилметил)-4-пиперидинил]-1,3-пропандиамина (0,035 моль) и 2,2 диоксида 1,3,2-бензодиоксатиола (0,035 моль) в 1,4-диоксане (250 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем перемешивали в течение 2 дней при 20 С. Растворитель выпарили. Остаток кристаллизовали из ACN/H2O. Осадок отфильтровывали и сушили с получением 7,65 г тетрагидро-2-[1(фенилметил)-4-пиперидинил]-2 Н-1,2,6-тиадиазина 1,1-диоксида (промеж. соединение 12).b) Смесь промежуточного соединения (12)(0,021 моль) в метаноле (150 мл) гидрировали с катализатором палладий-на-активированном угле (2,0 г). После поглощения Н 2 (1 экв.) катализатор отфильтровали и фильтрат выпаривали. Остаток кристаллизовали из ACN. Осадок отфильтровали и высушили с получением 2,3 г(0,076 моль) в этаноле (250 мл) перемешивали и кипятили с обратным холодильником 4 ч. Растворитель выпарили, получив 20,0 г (102,4%,неочищенный остаток, используемый на следующей реакционной стадии без дальнейшей очистки) 3-1-(фенилметил)-4-пиперидинил] метил]амино]пропаннитрила (промеж. соединение 14).b) Смесь промежуточного соединения (14)(0,078 моль) в растворе аммиака в метаноле (400 мл) гидрировали с катализатором, в качестве которого использовался никель Ренея (3 г). После поглощения водорода (2 экв.) катализатор отфильтровывали и фильтрат выпаривали с получением 20,2 г (99,4%, используемого на следующей стадии без очистки) N-1-(фенилметил)-4-пиперидинил]метил]-1,3-пропандиаминаc) Смесь промежуточного соединения 15(0,027 моль) перемешивали и кипятили с обратным холодильником в течение ночи. Растворитель выпарили. Остаток очищали хроматогра 003365 18 фией на колонке с силикагелем (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 93/7). Нужные фракции отбирали, растворитель выпаривали с получением 2,9 г продукта. Часть этой фракции (0,5 г) перекристаллизовывали из ACN, отфильтровывали и сушили, получая 0,14 г тетрагидро-1-1(фенилметил)-4-пиперидинил]метил]2(1 Н)пиримидинона (промеж. соединение 16).d) Смесь промежуточного соединения (16)(0,0084 моль) в метаноле (150 мл) гидрировали,используя палладий-на-активированном угле (1 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывали,фильтрат выпаривали с получением 1,25 г(1 Н)пиримидинона (промеж. соединение 17). В. Получение конечных соединений. Пример В.1. Смесь промежуточного соединения 4(1 Н)пиримидинона (0,011 моль) и оксида кальция (1 г) в THF (50 мл) перемешивали в течение ночи при 100 С (автоклав). Реакционную смесь фильтровали через дикалит и фильтрат выпаривали. Остаток очищали хроматографией на колонке с силикагелем (элюент CH2Cl2/ (СН 3 ОН/(1:1); []=-54,56 (с=0,1% в DMF) (соединение 3). Пример В.2. Смесь 3,4-дигидро-2 Н-1-бензопиран-2-карбоксальдегида (0,015 моль) и 1-(3-аминопропил) тетрагидро-2(1 Н)пиримидинтиона (0,01 моль) в метаноле (150 мл) гидрировали в течение 2 дней при комнатной температуре (атмосферное давление) с палладием-на-активированном угле (2 г) в качестве катализатора. После поглощения Н 2 (1 экв.) катализатор отфильтровали и фильтрат выпарили. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Очищенные фракции собирали и растворитель выпаривали. Остаток (0,3 г) растворяли в этаноле (30 мл) и переводили в соль этандиовой кислоты (1:1) с помощью этандиовой кислоты(10%) (5 г) в качестве катализатора в присутст 19 вии раствора (4%) тиофена в метаноле (5 мл). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат собирали в смесь ацетата натрия (7 г) в метаноле (200 мл). Добавили смесь 1-(3-аминопропил)тетрагидро-2(1 Н) пиримидинона (0,2 моль) в метаноле (200 мл) и смесь гидрировали (16 ч при 25 С; 16 ч при 50 С) с катализатором, в качестве которого использовали родий-на-активированном угле (5%,3 г) в присутствии раствора (4%) тиофена в метаноле (3 мл). После поглощения водорода катализатор отфильтровывали и фильтрат выпаривали. Остаток перемешивали в воде, обрабатывали 50% NaOH и экстрагировали ДСМ. Отделенный органический слой высушивали, отфильтровывали и растворитель выпаривали. Остаток оставляли на ночь в 2-пропаноле (500 мл). Супернатант декантировали и остаток очищали хроматографией на колонке с силикагелемTHF (100 мл). Реакционный раствор перемешивали в течение 17 ч при комнатной температуре. Растворитель выпарили, к остатку добавили воды и смесь проэкстрагировали толуолом. Отделили органический слой, высушили, отфильтровали и выпарили растворитель. Остаток кристаллизовали из этилацетата (50 мл). Осадок отфильтровали и высушили, получив 3,3 г (42%)-1-[3-(3,4-дигидро-2 Н-1-бензопиран-2-ил) метил](фенилметил)амино]пропил]тетрагидро 2(1 Н)пиримидинона (соединение 13); т.пл. 94,7 С. Пример В.5. Дифениловый эфир цианокарбонимидокислоты (0,01 моль) добавили к раствору -N(3-аминопропил)-N'-[(3,4-дигидро-2 Н-1-бензопиран-2-ил)метил]-1,3-пропандиамина(0,01 моль) в ДСМ (100 мл), перемешиваемому при комнатной температуре. Реакционную смесь перемешивали 17 ч при комнатной температуре. Растворитель выпарили. Остаток очищали хроматографией на колонке с силикагелем (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Очищенные фракции собирали, растворитель выпарили. Остаток растворили в этаноле (50 мл) и перевели в соль этандиовой кислоты (1:1) с помощью этандиовой кислоты (1,27 г, 0,01 моль). Осадок отфильтровали и высушили (вакуум), получив 2,5 г (59,9%) этандиоата -[1-[3-(3,4-дигидро 2 Н-1-бензопиран-2-ил)метил]амино]пропил] гексагидро-2-пиримидинилиден]цианамида (1:1) 20 Пример В.6. Раствор соединения (13) (0,009 моль) в метаноле (150 мл) гидрировали при 50 С с катализатором палладий-на-активированном угле (2 г). После поглощения H2 (1 экв.) катализатор отфильтровали и фильтрат выпарили. Остаток растворили в этаноле (100 мл) и перевели с помощью этандиовой кислоты (1,16 г; 0,009 моль) в соль этандиовой кислоты (1:1). Осадок отфильтровали и высушили в вакууме, получив 2,8 г (79,1%) этандиоата -1-[3-(3,4-дигидро 2 Н-1-бензопиран-2-ил)метил]амино]пропил] тетрагидро-2(1 Н)пиримидинона (1:1) (соединение 1); т.пл. 226,3 С. Пример В.7. Смесь соединения (2) (0,0125 моль) и 2 пропанона (0,017 моль) в метаноле (150 мл) гидрировали при 50 С с помощью палладия-наактивированном угле (2 г) в качестве катализатора в присутствии раствора (4%) тиофена в метаноле (2 мл). После поглощения водорода (1 экв.) катализатор отфильтровали и фильтрат выпарили. Остаток очищали хроматографией на колонке с силикагелем (элюент: CH2Cl2/(СН 3 ОН/NН 3) 94/5/1). Очищенные фракции собирали, растворитель выпаривали. Остаток высушивали с получением 2,226 г (R)-1-[3-(3,4 дигидро-2 Н-1-бензопиран-2-ил)метил](1-метилэтил)амино]пропил]тетрагидро-2(1 Н)пиримидинона (соединение 12). Пример В.8. Раствор (RR,SS)-3,4-дигидро-2-оксиранил 2 Н-1-бензопирана (2,5 г) и 1-(4-пиперидинил)-2 имидазолидинона (2,4 г) в этаноле (70 мл) перемешивали в течение 16 ч при температуре кипения с обратным холодильником. Реакционной смеси давали остыть до комнатной температуры и выпаривали до сухого состояния с получением 3,7 г (RR,SS)-1-[1-[2-(3,4-дигидро-2 Н-1-бензопиран-2-ил)-2-гидроксиэтил]-4-пиперидинил]-2 имидазолидинона (соединение 20). Пример В.9. Смесь N-циано-N-[1-[(3,4-дигидро-2H-1 бензопиран-2-ил)метил]-4-пиперидинил]-N'(2,2-диметоксиэтил)гуанидина (0,0153 моль) и НСl (0,5 Н, 46 мл) в THF (160 мл) перемешивали и кипятили с обратным холодильником в течение 100 мин. Добавили ледяной воды. Для хорошего отделения добавили порциями Nа 2 СО 3. Отделили органический слой, добавили DCM,промыли всю массу водой, высушили, отфильтровали, растворитель выпарили. Отделили остаток и очистили его хроматографией на колонке с силикагелем (выделение первого соединения: элюент СН 2 Сl2/СН 3 ОН 95/5; выделение второго соединения: СН 2 Сl2/(СН 3 ОН/NН 3) 90/10). Две группы очищенных фракций были собраны и растворитель в них выпарен. Каждый остаток кристаллизовали из ACN. Каждый осадок отфильтровывали и высушивали, получив 1,75 г[1-[1-[(3,4-дигидро-2 Н-1-бензопиран-2-ил)метил]-4-пиперидинил]-1 Н-имидазол-2-ил]циа 21 намида (соединение 59) и 0,48 г -[1-[1-[(3,4 дигидро-2 Н-1-бензопиран-2-ил)метил]-4-пиперидинил]-1 Н-имидазол-2-ил]мочевины (соединение 66). Пример В.10. Соединение (139) (0,0039 моль), ВВr3(0,03 моль), 1 М в DCM, (30 мл) и DCM (50 мл) перемешивали и охлаждали в бане со льдом. Реакционную смесь перемешивали 2 ч при 20 С. Смесь разрушали H2O/NH4OH (50/50; 100 мл) при охлаждении в бане со льдом. Смесь перемешивали в течение 1 ч. Органический слой отделили, высушили, отфильтровали и выпарили растворитель. Остаток кристаллизовали из этанола. Осадок отфильтровали и высушили с получением 0,60 г -(R,S)-1-[1-[2-(3,4 дигидро-8-гидрокси-2 Н-1-бензопиран-2-ил)-2 гидроксиэтил]-4-пиперидинил]-3,4,5,6-тетрагидро-2 (1 Н)пиримидинона (соединение 141). Пример В.11. Смесь соединения (150) (0,0028 моль) в метаноле (100 мл) гидрировали с помощью Pd/C(10%, 1,0 г) в качестве катализатора. После поглощения водорода (1 экв.) катализатор отфильтровывали и фильтрат выпаривали. Остаток растворяли в смеси метанол/DIPE и переводили в соль этандиовой кислоты (1:1). Осадок отфильтровали и высушили, получив 0,56 гTHF (100 мл) перемешивали в течение ночи при 150 С в атмосфере моноксида углерода при давлении 0,51106 Па (5 атм). Реакционную смесь отфильтровывали, фильтрат выпаривали и очищали колоночной хроматографией на сили 003365 22 кагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Очищенные фракции собирали, растворитель выпаривали, получая -2-3-(гексагидро-2 оксо-1-пиримидинил)пропил](фенилметил)амино]метил]-3,4-дигидро-2 Н-1-бензопиран-6 карбоксамид (соединение 51). Пример В.13. Триэтиламин (0,01 моль) добавили к соединению (3) (0,0066 моль) в DCM (50 мл). Добавили ацетилхлорид (0,0066 моль) и реакционную смесь перемешивали 24 ч при комнатной температуре. Смесь промыли водой, затем высушили, отфильтровали и выпарили растворитель, получив 1,91 г этил(R)-[(3,4-дигидро-2 Н-1 бензопиран-2-ил)метил][3-(гексагидро-2-оксо-1 пиримидинил)пропил]карбамата(соединение 56). В фрагменте в соединениях формулы (I) атомы углерода нумеруются следующим образом: В табл. с F-1 до F-8 перечислены соединения, которые были получeны согласно каждому из вышеприведенных примеров. В таблицах были использованы следующие обозначения:C4H6O5 означает соль 2-гидроксибутандиовой кислоты (соль яблочной кислоты), .C2H2O4 означает соль этандиовой кислоты, .С 4 Н 6 О 6 означает соль [R-(R,R)]-2,3-дигидроксибутандиовой кислоты (соль L-виннокаменной кислоты),-(Е)-С 4 Н 4O4 означает соль (Е)-2-бутандиовой кислоты (соль фумаровой кислоты), .(Z)-С 4H4 О 4 означает соль (Z)-2-бутендиовой кислоты (соль малеиновой кислоты), .С 2 Н 6 О означает этанолат, .С 3 Н 8 О означает 2-пропанолат и с.С 6 Н 11 означает циклогексил.mр. - точка плавления Таблица F-3mp. - точка плавления Таблица F-5mp. - точка плавления Таблица F-6mр. - точка плавления Таблица F-7mр. - точка плавления Таблица F-8C.1. Желудочный тонус, определенный с помощью электронного баростата на собаках,находящихся в сознании. Тонус желудка нельзя измерить манометрическими методами. Поэтому применяют электронный баростат. Это позволяет изучить физиологическую модель, изменение желудочного тонуса у собак, находящихся в сознании, и влияние на него испытуемых соединений. Баростат состоит из инжекционной воздушной системы, которая связана двухпросветной 14-French поливиниловой трубкой с ультратонким дряблым (в ненакачанном состоянии) полиэтиленовым мешком (максимальный объем: 700 л). Колебания тонуса желудка измеряли, регистрируя изменение объема воздуха внутри внутрижелудочного объема (мешка) при постоянном или изменяющемся давлении. Баростат поддерживает постоянное (предварительно выбранное) давление внутри наполненного воздухом полиэтиленового мешка, введенного внутрь желудка, при изменении объема воздуха внутри мешка с помощью электронной системы с обратной связью. Таким образом, баростат измеряет моторную активность желудка (сокращение или расслабление) как изменения внутреннего объема желудка (уменьшение или увеличение соответственно) при постоянном внутрижелудочном объеме. Баростат состоит из индикатора растяжения, связанного с помощью электронного реле с воздушной инжекционно-аспирационной системой. Как индикатор натяжения, так и инжекционная система связаны с помощью двухпросветной поливиниловой трубки с ультратонким полиэтиленовым мешком. Шкала на баростате позволяет выбирать уровень давления,который необходимо поддерживать внутри внутрижелудочного мешка. Собаки (самки породы коротконогие гончие) весом 7-17 кг были приучены стоять спокойно в "конструкции Павлова". Им в желудок при общей анастезии и в асептических условиях были имплантированы канюли. После срединной лапаротомии было сделано рассечение стенки желудка в продольном направлении между большей и меньшей кривизной, двумя сантиметрами выше нервов Latarjet'a. Канюля была вшита в желудочную стенку с помощью шва двойной ниткой и представляла собой твердый остаток раны в левом квадранте подреберной области. Собакам предоставлялся восстановительный период в 2 недели. В начале эксперимента канюля была открыта для удаления желудочного сока или остатков пищи. В случае необходимости желудок промывали 40-50 мл тепловатой воды. Ультратонкий мешок баростата помещали в область дна желудка через желудочную канюлю. Для гарантии легкого раскрытия внутрижелудочного мешка в процессе эксперимента внутрь мешка 30 инжектировали объем 150-200 мл очень быстрым повышением давления до максимум 14 мм Нg (около 1,87 кПа). Эту процедуру повторяли дважды. Затем давали 1 ч для стабилизации. После 30 мин стабилизационного периода при внутрижелудочном давлении 2 мм Нg (oколо 0,27 кПа) строили кривые зависимости объема и давления при увеличении внутрижелудочного давления ступенчатым повышением по 2 мм Нg(0,27 кПа) (максимально до 14 мм Нg (около 1,87 кПа (11 мин при 2 мм Нg (0,27 кПа) и 3 мин при каждом ступенчатом повышении). Эти изменения давления должны устанавливаться либо мануально, либо могут быть произведены с помощью компьютерной программы (LabVIEW). Перед введением лекарственного средства должны наблюдаться, по крайней мере, две стабильные кривые. Затем подкожно вводят испытуемое соединение между первыми 3-5 мин при 2 мм Нg(0,27 кПа). Испытуемые соединения подвергли скринингу при 0,63 мг/кг (подкожно). Другие дозы и способы применения испытывались, если в процессе скрининга было установлено, что испытуемое соединение активно. Четыре новые кривые "давление-объем" были построены для того, чтобы оценить эффект от применения соединения. В табл. С-1 суммировано влияние соединений (в ) на релаксацию мускулатуры дна желудка спустя 1 ч после введения. Таблица С-1 Соединение С.2. Сосудосуживающая активность базилярной артерии. Сегменты базилярных артерий, взятых от свиней (анестезированных с помощью пентобарбитала натрия), были помещены для регистрации изометрического напряжения в бани для органов. Препараты выдерживали в бане в растворе Krebs-Henseleit. Раствор выдерживали при 37 С, пропускали смесь газов 95% O2 - 5% CO2. Препараты растягивали, пока не было получено стабильное исходное (базальное) напряжение в 2 г. Препараты были подвергнуты обработке серотонином (3 х 10-7 М) для сокращения. Определяли ответную реакцию на добавление серотонина и затем серотонин отмывали. Процедуру повторяли до получения стабильных ответных реакций. После этого в баню для органов вводили испытуемое соединение и определяли сокращение препарата. Этот конструктивный ответ выражали в процентах от ответа, полученного перед этим от введения серотонина. 31 Величина ED50 (молярная концентрация) определяется как концентрация, при которой испытуемое соединение вызывает 50% сосудосуживающегося ответа, полученного при введении серотонина. Указанные величины ED50 оценивали в экспериментах в трех различных повторностях. Испытывали большое число соединений. Следующие соединения имеют величины его стереохимически изомерная форма, его Nоксидная форма или фармацевтически приемлемая соль присоединения кислоты, гдеAlk1 является карбонилом или С 1-4 алкандиилом, необязательно замещенным гидрокси;R1, R2 и R3, каждый независимо, выбран из водорода, C1-6 алкила, C1-6 алкокси, галогена,гидрокси, C1-6 алкилоксикарбонила; или когда R1 и R2 присоединены к смежным атомам углерода, взятые вместе R1 и R2 могут образовывать бивалентный радикал формулы-СН=СН-СН=СН= (а-4),R4 представляет собой водород, C1-6 алкил или прямую связь, когда радикал -Z1-Z2- имеет формулу (е-6); А - бивалентный радикал формулы где атом азота связан с Alk1, и m равно 0 или 1;R7 представляет собой водород или C1-6 алкил;R10 является водородом или C1-6 алкилом; а-СН 2-СН 2- (d-1),-CH=CH- (d-4),-СН 2-СН 2-СН 2- (d-2),-CH2-CO- (d-5),где необязательно один или два атома водорода у одного и того же или разных атомов углерода могут быть замещены C1-4 алкилом, гидрокси или фенилом, либо при условии, что когда радикал -Z1-Z2- представлен формулой (е-2), а бивалентный радикалQ формулами (d-1) или (d-2), один или два атома водорода на одном или разных атомах углерода в указанных формулах (d-1) или (d-2), замещены C1-4 алкилом, гидрокси или фенилом. 2. Соединение по п.1, в котором бивалентный радикал А имеет формулу (b-1). 3. Соединение по п.1, в котором бивалентный радикал А имеет формулу (b-2). 4. Соединение по п.1, в котором R4 является водородом; А представляет собой радикал формулы (b-1), где R6 является водородом илиC1-6 алкилом, a Alk2 представляет собой C2-4 алкандиил; или А представляет собой радикал формулы (b-2), R5 является радикалом формулы(с-1), где Х представляет собой водород, a Q имеет формулу (d-1) или (d-2), в которой один или два атома водорода у одного или того же или разных атомов углерода необязательно могут быть замещены C1-4 алкилом. 5. Соединение по п.1, представляющее собой 1-[3-(3,4-дигидро-2 Н-1-бензопиран-2-ил) метил]амино]пропил]тетрагидро-2(1 Н)пиримидинон; его стереоизомерную форму или фармацевтически приемлемую соль присоединения кислоты. 6. Соединение по п.5, представляющее собой [R-(R,R)]-2,3-дигидроксибутандиоат (R)1-[3-(3,4-дигидро-2 Н-1-бензопиран-2-ил)метил]амино]пропил]тетрагидро-2(1 Н)пиримидинона. 7. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по пп.1-6. 8. Применение соединения по пп.1-6 в качестве средства для релаксации мускулатуры дна желудка. 9. Применение соединения по любому из пп.1-6 для лечения состояний, связанных с нарушением или задержкой релаксации мускулатуры дна желудка. 10. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (II) алкилируют промежуточным соединением (III) в реакционно-инертном раство 33 рителе и необязательно в присутствии подходящего основания, где значения радикалов A, R1, R2, R3, R4 и R5 такие, как определено в п.1, a W - соответствующая удаляемая группа и, если желательно,полученное таким образом соединение формулы(I) переводят в другое соединение формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно, соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно, соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или,если желательно, получают стереохимически изомерные формы. 11. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (IV), где Alk1 представляет собой прямую связь или С 1-5 алкандиил, подвергают восстановительному алкилированию с промежуточным соединением формулы (III) где значения радикалов A, R1, R2, R3, R4 и R5 такие, как определено в п.1 и/или, если желательно, полученное таким образом соединение формулы (I) переводят в другое соединение 34 формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно,соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно,соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или, если желательно, получают стереохимически изомерные формы. 12. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (V), где Alk1 представляет собой прямую связь или С 1-5 алкандиил, подвергают взаимодействию с промежуточным соединением формулы (III) причем в вышеприведенных реакционных схемах значения радикалов A, R1, R2, R3, R4 и R5 такие же, как определено в п.1 и/или, если желательно, полученное таким образом соединение формулы (I) переводят в другое соединение формулы (I) с помощью известных реакций взаимопревращения; и/или, если желательно,соединение формулы (I) переводят в соль присоединения кислоты; и/или, если желательно,соль присоединения кислоты соединения формулы (I) переводят щелочью в форму свободного основания, и/или,если желательно, получают стереохимически изомерные формы.
МПК / Метки
МПК: A61K 31/454, C07D 405/14, A61P 1/04
Метки: обеспечивающие, мускулатуры, релаксацию, желудка, производные, аминоалкилхроманов, дна
Код ссылки
<a href="https://eas.patents.su/18-3365-proizvodnye-aminoalkilhromanov-obespechivayushhie-relaksaciyu-muskulatury-dna-zheludka.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аминоалкилхроманов, обеспечивающие релаксацию мускулатуры дна желудка</a>
Предыдущий патент: Способ получения витамина а
Следующий патент: Антиидиотипические моноклональные антитела, их применение в активной иммунотерапии злокачественных опухолей и содержащие их композиции
Случайный патент: Охлаждающий элемент и способ изготовления охлаждающих элементов












