Способ лечения множественной миеломы
Номер патента: 24364
Опубликовано: 30.09.2016
Авторы: Демо Сьюзан Д., Кирк Кристофер Дж., Беннетт Марк К.
Формула / Реферат
1. Способ лечения множественной миеломы, включающий введение пациенту комбинации, содержащей (1) терапевтически эффективное количество ингибитора протеасомы, представляющего собой пептид эпоксикетон или его фармацевтически приемлемую соль, и (2) терапевтически эффективное количество дексаметазона,
где ингибитор протеасомы, представляющий собой пептид эпоксикетон, имеет следующую структурную формулу:
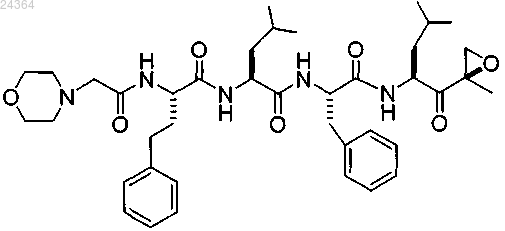
где пептид эпоксикетон и дексаметазон вводят в течение от примерно 5 мин до примерно 48 ч один после другого, и
где эффективность, показанная при комбинированном введении (1) и (2), превосходит эффективность, показанную при индивидуальном введении любого из (1) или (2).
2. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого.
3. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого.
4. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме.
5. Способ по п.1, где (1) и (2), каждый, вводят внутривенно.
6. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах.
7. Способ по п.6, где один из (1) и (2) вводят внутривенно, а другой вводят перорально.
8. Способ по п.7, где (1) вводят внутривенно, а (2) вводят перорально.
9. Способ по п.1, где способ дополнительно включает введение леналидомида.
10. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят после введения дексаметазона.
11. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого.
12. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого.
13. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме.
14. Способ по п.10, где (1) и (2), каждый, вводят внутривенно.
15. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах.
16. Способ по п.15, где один из (1) и (2) вводят внутривенно, а другой вводят перорально.
17. Способ по п.16, где (1) вводят внутривенно, а (2) вводят перорально.
18. Способ по любому из пп.10-17, где способ дополнительно включает введение леналидомида.
19. Способ по любому из пп.1-18, где множественная миелома представляет собой фармакорезистентную множественную миелому.
20. Способ по любому из пп.1-19, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят в виде фармацевтической композиции, которая включает ингибитор протеасомы, представляющий собой пептид эпоксикетон, циклодекстрин и, необязательно, буфер.
Текст
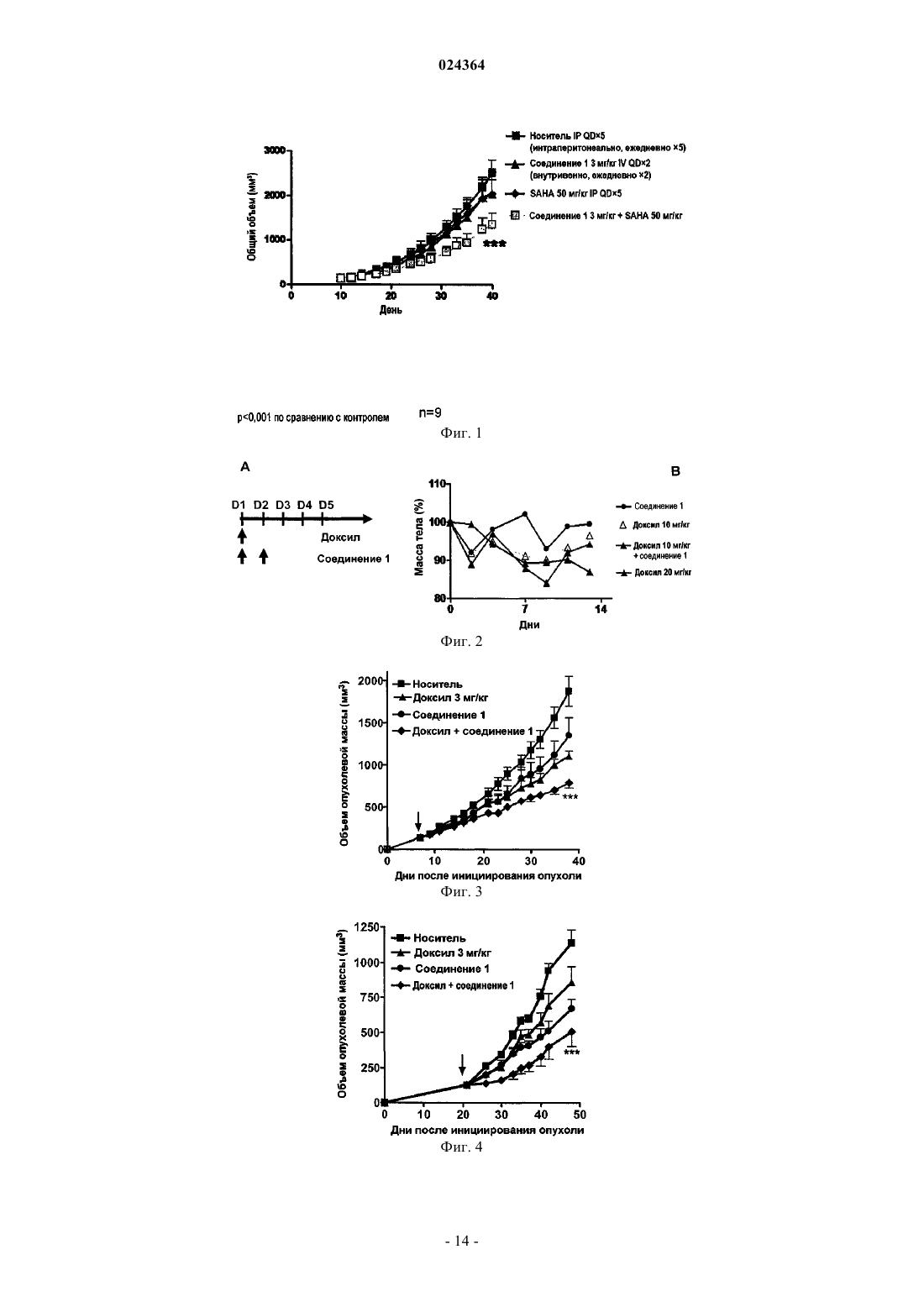
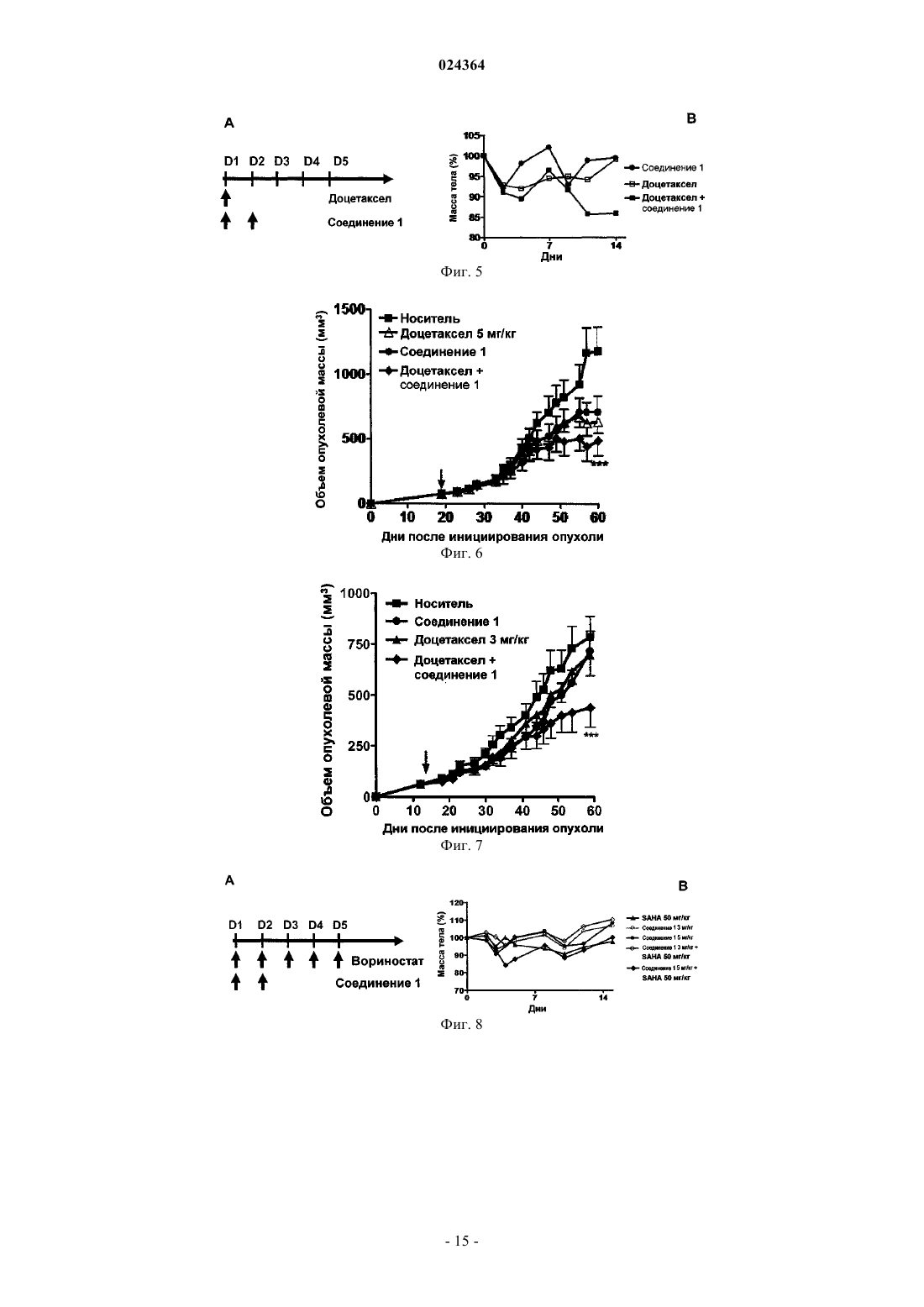
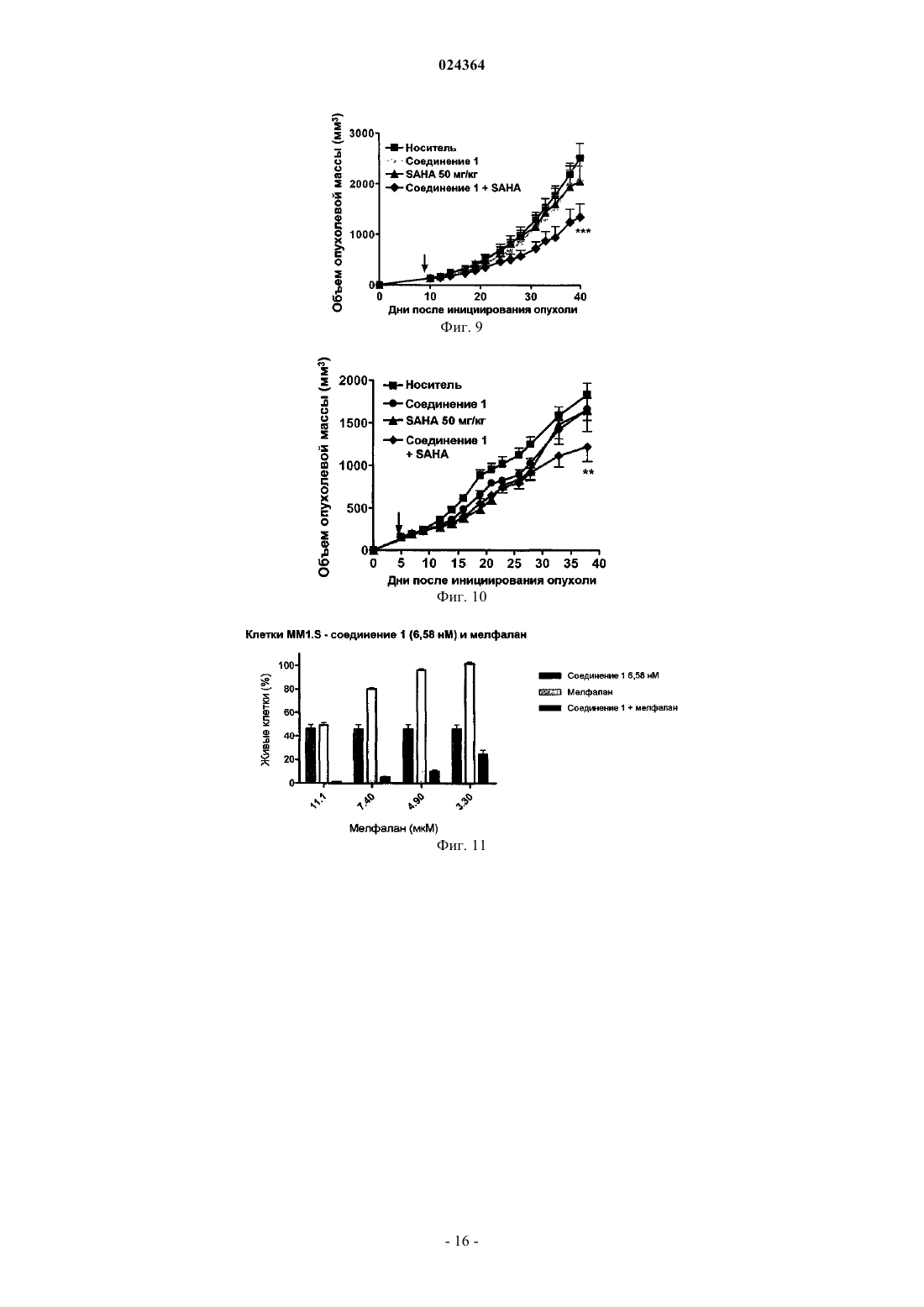
СПОСОБ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ Настоящее изобретение относится к способу лечения множественной миеломы, включающему введение пациенту комбинации, содержащей (1) терапевтически эффективное количество ингибитора протеасомы, представляющего собой пептид эпоксикетон или его фармацевтически приемлемую соль, и (2) терапевтически эффективное количество дексаметазона, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, имеет следующую структурную формулу: и где пептид эпоксикетон и дексаметазон вводят в течение от примерно 5 мин до примерно 48 ч один после другого, и где эффективность, показанная при комбинированном введении (1) и (2),превосходит эффективность, показанную при индивидуальном введении любого из (1) или (2). Предпосылки изобретения В организмах эукариот, распад белка преимущественно опосредуется убиквитиновым путем, при котором белок, предназначенный для разрушения, связывается с полипептидом убиквитином, состоящим из 76 аминокислотных остатков. После введения этого нацеливающего фрагмента убиквитинированные белки играют роль субстрата для протеасомы 26S, т.е. мультикаталитической протеазы, которая расщепляет белки на короткие пептиды, за счет проявления трех основных видов своей протеолитической активности. Играя основную роль во внутриклеточном обороте белков, опосредованное протеосомой разрушение играет также ключевую роль во многих процессах, как, например, презентации главного комплекса гистосовместимости (МНС) I класса, апоптозе, делении клеток и активации NF-kB. Протеосома 20S представляет собой мультикаталитический протеазный комплекс цилиндрической формы с массой 700 кДа, включающий 28 субъединиц, входящих в 4 цикла, играющий важную роль в регулировке клеточного роста, презентации главного комплекса гистосовместимости класса I, апоптозе,процессинге антигенов, активации NF-kB и передаче провоспалительных сигналов. У дрожжей и других эукариот, внешнее кольцо сформировано из 7 различных -субъединиц, и внутреннее кольцо образовано 7 различными -субъединицами, -субъединицы служат сайтами связывания регуляторных комплексов 19S (РА 700) и 11S (РА 28), а также физической границей для внутренней протеолитической полости, образованной двумя циклами -субъединиц. Таким образом, считается, что in vivo протеасома существует в форме частиц 26S ("26S протеасома"). Эксперименты in vivo показали, что ингибирование формы 20S протеасомы может быть легко скоррелировано с ингибированием 26S протеасомы. Отщепление аминоконцевых пропоследовательностей -субъединиц при образовании частиц оставляет открытыми аминоконцевые остатки треонина, которые выполняют функцию каталитических нуклеофилов. Таким образом,субъединицы, отвечающие за каталитическую активность протеасомы, обладают нуклеофильными аминоконцевыми остатками, и эти субъединицы принадлежат к семейству гидролаз с N-концевым нуклеофилом (Ntn) (в которых нуклеофильный N-концевой остаток представляет собой, например, Cys, Ser, Thr и другие нуклеофильные фрагменты). Это семейство включает, например, пенициллин G ацилазу (PGA),пенициллин V ацилазу (PVA), глутамин PRPP амидотрансферазу (GAT) и бактериальную гликозиласпарагиназу. Кроме -субъединиц, экспрессируемых всеми эукариотами, у высших позвоночных имеются также три -интерферон-индуцируемые -субъединицы (LMP7, LMP2 и MECL1), которые присутствуют вместо их обычных аналогов X, Y и Z соответственно, меняя, тем самым, каталитическую активность протеасомы. С помощью различных пептидных субстратов были определены три основных вида протеолитической активности протеасомы 20S эукариот: химотрипсин-подобная активность (СТ-L), которая вызывает расщепление после крупных гидрофобных остатков; трипсин-подобная активность (T-L), которая вызывает расщепление после основных остатков; и пептидил-глутамил пептид гидролизующая активность (PGPH), которая приводит к расщеплению после кислотных остатков. Кроме того, протеосоме было приписано два дополнительных, менее характерных вида активности: BrAAP активность, которая вызывает расщепление после аминокислотных остатков с разветвленной цепью; и SNAAP активность,которая приводит к расщеплению после небольших нейтральных аминокислот. Основной вклад в протеолитическую активность протеосомы, по-видимому, вносят различные каталитические сайты, поскольку ингибиторы, точечные мутации в -субъединицах и замена -интерферон-индуцирующих-субъединиц меняет разные виды активности в различной степени. Сущность изобретения Настоящее изобретение относится к способу лечения множественной миеломы, включающему введение пациенту, в комбинации, (1) терапевтически эффективного количества ингибитора протеасомы,представляющего собой пептид эпоксикетон или его фармацевтически приемлемую соль, и (2) терапевтически эффективного количества дексаметазона,где ингибитор протеасомы, представляющий собой пептид эпоксикетон, имеет следующую структурную формулу: где пептид эпоксикетон и дексаметазон вводят в течение от примерно 5 мин до примерно 48 ч один после другого, и где эффективность, показанная при комбинированном введении (1) и (2) превосходит эффективность, показанную при индивидуальном введении любого из (1) или (2). Краткое описание иллюстративного материала На фиг. 1 показан график зависимости объема опухоли от времени для мышей, получавших носитель, соединение 1, SAHA или соединение 1 в комбинации с SAHA, после того, как размер опухоли, со-1 024364 стоящей из клеток RL, достигал примерно 50 мм 3. На фиг. 2A показано расписание введения препаратов для комбинированной терапии с применением доксила и соединения 1. На фиг. 2B показаны результаты исследования токсичности для комбинированной терапии с применением доксила и соединения 1, где доксил вводят в дозировке 10 или 20 мг/кг и соединение 1 вводят в дозировке 5 мг/кг. На фиг. 3 приведена зависимость размера колоректальной опухоли НТ 29 от времени при введении носителя, доксила (3 мг/кг), соединения 1 (5 мг/кг) и комбинации соединения 1 и доксила. На фиг. 4 показана зависимость размера немелкоклеточной опухоли легких А 549 от времени при введении носителя, доксила (3 мг/кг), соединения 1 (5 мг/кг) и комбинации соединения 1 и доксила. На фиг. 5A показано расписание введения препаратов для комбинированной терапии с применением доцетаксела и соединения 1. На фиг. 5 В показаны результаты исследования токсичности для комбинированной терапии с применением доцетаксела и соединения 1, где доцетаксел вводят в дозировке 10 мг/кг и соединение 1 вводят в дозировке 5 мг/кг. На фиг. 6 показана зависимость размера немелкоклеточной опухоли легких А 549 от времени при введении носителя, соединения 1 (5 мг/кг), доцетаксела (5 мг/кг) и комбинации соединения 1 и доцетаксела. На фиг. 7 показана зависимость размера немелкоклеточной опухоли легких А 549 от времени при введении носителя, соединения 1 (3 мг/кг), доцетаксела (3 мг/кг) и комбинации соединения 1 и доцетаксела. На фиг. 8 А показано расписание введения препаратов для комбинированной терапии с применением SAHA и соединения 1. На фиг. 8 В показаны результаты исследования токсичности для комбинированной терапии с применением вориностата и соединения 1, где SAHA вводят в дозировке 50 мг/кг и соединение 1 вводят в дозировке 3 или 5 мг/кг. На фиг. 9 показана зависимость размера лимфомы RL от времени при введении носителя, соединения 1 (3 мг/кг), SAHA (50 мг/кг) и комбинации соединения 1 и SAHA. На фиг. 10 показана зависимость размера опухоли яичников ES2 от времени при введении носителя,соединения 1 (5 мг/кг), SAHA (50 мг/кг) и комбинации соединения 1 и SAHA. На фиг. 11 показано действие комбинации соединения 1 и мелфалана на клетки MM1.S. На фиг. 12A показаны предварительные результаты фазы Ib исследования с наращиванием дозы, в котором использовалась комбинация карфилзомиба и леналидомида с дексаметазоном в низкой дозировке, у пациентов с рецидивирующей множественной миеломой. В первых трех группах семнадцать пациентов подходили для оценки реакции и токсичности. Максимальная переносимая доза (MTD) не была достигнута, и не сообщалось о серьезных нежелательных явлениях 3 или 4 степени, связанных с препаратами. На фиг. 12B показаны предварительные результаты фазы Ib исследования с наращиванием дозы, в котором использовалась комбинация карфилзомиба и леналидомида с дексаметазоном в низкой дозировке, у пациентов с рецидивирующей множественной миеломой. Реакция носила долговременный характер. Подробное описание изобретения Настоящее изобретение относится к способу лечения множественной миеломы, включающему введение пациенту, в комбинации (1), терапевтически эффективного количества ингибитора протеасомы,представляющего собой пептид эпоксикетон или его фармацевтически приемлемую соль, и (2) терапевтически эффективного количества дексаметазона,где ингибитор протеасомы, представляющий собой пептид эпоксикетон, имеет следующую структурную формулу: где пептид эпоксикетон и дексаметазон вводят в течение от примерно 5 мин до примерно 48 ч один после другого, и где эффективность, показанная при комбинированном введении (1) и (2) превосходит эффективность, показанную при индивидуальном введении любого из (1) или (2). В предпочтительном варианте осуществления настоящего изобретения ингибитор протеасомы,представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого. В другом предпочтительном варианте осуществления настоящего изобретения ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого. В другом предпочтительном варианте осуществления настоящего изобретения ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме. В другом предпочтительном варианте осуществления настоящего изобретения пептид эпоксикетон и дексаметазон каждый вводят внутривенно. В другом предпочтительном варианте осуществления настоящего изобретения ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах. При этом наиболее предпочтительно один из них вводить внутривенно, а другой перорально. В частности, в предпочтительно варианте пептид эпоксикетон вводят внутривенно, а дексаметазон вводят перорально. В другом предпочтительном варианте осуществления настоящего изобретения способ дополнительно включает введение леналидомида. В другом предпочтительном варианте осуществления настоящего изобретения ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят после введения дексаметазона. В наиболее предпочтительном варианте ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого. В другом наиболее предпочтительном варианте ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого. В другом наиболее предпочтительном варианте ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме. Причем наиболее предпочтительно каждый из них вводить внутривенно. В другом наиболее предпочтительном варианте ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах. Причем наиболее предпочтительно один из них вводить внутривенно, а другой перорально. В частности, предпочтительно пептид эпоксикетон вводить внутривенно, а дексаметазон вводить перорально. В другом наиболее предпочтительном варианте способ дополнительно включает введение леналидомида. В одном из вариантов осущеатвления настоящего изобретения множественная миелома может представлять собой фармакорезистентную множественную миелому. В ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят в виде фармацевтической композиции, которая включает ингибитор протеасомы, представляющий собой пептид эпоксикетон, циклодекстрин и, необязательно, буфер. В настоящем описании "фермент" может являться любой частично или полностью белковой молекулой, которая способствует каталитическому протеканию химической реакции. Эти ферменты могут являться нативными ферментами, слитыми ферментами, проферментами, апоферментами, денатурированными ферментами, фарнезилированными ферментами, убиквитинированными ферментами, ферментами, ацилированными жирными кислотами, геранил-геранилированными ферментами, GPI-связанными ферментами, липид-связанными ферментами, пренилированными ферментами, природными или искусственными мутантными ферментами, ферментами с модификациями боковых цепей или основной цепи,ферментами с лидерными последовательностями и ферментами, образовавшими комплекс с небелковыми веществами, например протеогликанами, протеолипосомами. Ферменты можно получать различными путями, включая природную экспрессию, промотируемую экспрессию, клонирование, пептидный синтез в растворе и на твердой фазе и подобные способы, известные специалистам в данной области техники. Термин "ингибитор" в настоящем патенте предназначен для описания соединения, которое блокирует или уменьшает активность фермента (например, ингибирование протеолитического расщепления стандартных флуорогенных пептидных субстратов). Ингибитор может вызывать конкурентное, бесконкурентное или неконкурентное ингибирование. Ингибитор может связываться обратимо или необратимо,и, следовательно, этот термин охватывает соединения, которые являются суицидными субстратами фермента. Ингибитор может вызывать изменения одного или нескольких участков в пределах или вблизи от активных сайтов фермента, или он может вызывать конформационные изменения на любом участке молекулы фермента. Термин "пептид" в настоящем описании включает не только стандартную амидную связь со стандартными -заместителями, но и обычно используемые пептидомиметики, другие модифицированные связи, не встречающиеся в природе боковые цепи и модификации боковых цепей, которые подробно описаны ниже. Термины "профилактика" или "предупреждение" приняты в технике, и при их использовании в связи с болезненным состоянием, например местным рецидивом (например, боли), заболеванием, например раком, комплексом синдромов, например сердечной недостаточностью, или любым другим медицинским состоянием эти термины хорошо понятны специалистам в данной области и включают введение композиции, которая уменьшает частоту появления или замедляет возникновение симптомов медицинского состояния у субъекта, по сравнению с субъектом, не получавшим эту композицию. Так, профилактика рака включает, например, сокращение частоты выявляемых случаев роста опухоли в группе пациентов,получающих профилактическое лечение, по сравнению с контрольной группой, не получающей лечения,и/или отсрочку появления выявляемого роста раковых опухолей в группе, получавшей лечение, по сравнению с контрольной группой, не получавшей лечения, например в статистически и/или клинически значимом количестве. Профилактика инфекции включает, например, сокращение числа диагнозов данной инфекции в группе, получавшей профилактическое лечение, по сравнению с контрольной группе, не получавшей профилактического лечения, и/или отсрочку появления симптомов инфекции в группе, получавшей профилактическое лечение, по сравнению с контрольной группой, не получавшей лечения. Профилактика боли включает, например, уменьшение силы болевых ощущений или, в качестве альтернативы, отсрочку появления ощущения боли, у субъектов группы, получавшей профилактическое лечение, по сравнению с контрольной группой, не получавшей лечения. Термин "профилактическое или терапевтическое" лечение принят в данной области техники и включает введение субъекту одной или нескольких композиций по настоящему изобретению. Если введение осуществлялось до клинических проявлений нежелательного состояния (например, заболевания или другого нежелательного состояния у животного реципиента), то лечение является профилактическим(т.е. лечение предохраняет реципиента от развития нежелательного состояния), в то же время, если введение происходит после проявления нежелательного состояния, то лечение является терапевтическим(т.е. оно предназначено для уменьшения, облегчения или стабилизации существующего нежелательного состояния или его побочных эффектов). Подразумевается, что термин "протеасома" в настоящем описании включает иммуно- и конститутивные протеасомы."Терапевтически эффективное количество" соединения, применительно к способу лечения по настоящему изобретению, относится к количеству соединения (соединений) в препарате, которые при введении в качестве составной части желаемой схемы лечения (млекопитающим, предпочтительно человеку) облегчают симптомы, улучшают состояние или замедляют наступление болезненных состояний, согласно клинически приемлемым стандартам для подвергаемого лечению расстройства или состояния,или косметической цели, например при разумном соотношении польза риск, применимом к любому медицинскому лечению. В настоящем описании термин "лечение" включает обращение развития, уменьшение или купирование симптомов, клинических признаков и лежащей в их основе патологии, для улучшения или стабилизации состояния субъекта. Комбинированная терапия. В соответствии с настоящим изобретением введение пептид эпоксикетона может предшествовать введению другого терапевтического средства (дексаметазона) или следовать за ним, с интервалами от нескольких минут до нескольких дней. В некоторых из таких вариантов осуществления пептид эпоксикетон и другое терапевтическое средство (дексаметазон) могут вводиться в течение примерно 1, примерно 5, примерно 1, примерно 30, примерно 60 мин, примерно 2, примерно 4, примерно 6, примерно 8,примерно 10, примерно 12, примерно 18, примерно 24, примерно 36 или даже примерно 48 ч или более один после другого. Предпочтительно введение пептид эпоксикетона и другого терапевтического средства (дексаметазона) должно осуществляться в течение примерно 1, примерно 5, примерно 30 или даже примерно 60 мин один после другого. В некоторых вариантах осуществления пептид эпоксикетон и другое терапевтическое средство(дексаметазон) могут вводиться по различным расписаниям (например, пептид эпоксикетон можно вводить один раз в день, тогда как другое терапевтическое средство можно вводить лишь один раз в три недели), так чтобы в некоторых ситуациях введение пептид эпоксикетона и другого терапевтического средства происходило в интервале примерно 60 мин один после другого, тогда как в других случаях введение пептид эпоксикетона и другого терапевтического средства происходило в течение нескольких дней или даже недель один после другого. В настоящем описании термин "схема лечения" означает заранее определенное расписание применения одного или нескольких терапевтических средств для лечения рака. Соответственно, если терапевтическое средство вводят "отдельно", схема лечения не включает применение другого терапевтического агента для лечения рака. В соответствии с настоящим изобретением комбинация, описанная в настоящем патенте, имеет синергическую природу, т.е. терапевтическое действие комбинации пептид эпоксикетона и другого терапевтического средства (дексаметазона) превышает сумму эффектов отдельных компонентов. Описанные в настоящем патенте соединения можно вводить в различных формах, в зависимости от заболевания, лечение которого осуществляется, а также возраста, состояния и массы тела пациента, что хорошо известно в технике. Например, если соединения предполагается вводить перорально, их можно включать в состав таблеток, капсул, гранул, порошков или сиропов; или с целью парентерального введения их можно включить в состав препаратов для инъекции (внутривенной, внутримышечной или подкожной) или препаратов для капельной инфузии. Эти составы можно получать обычными способами и,если это желательно, действующий ингредиент можно смешать с любой обычной добавкой или наполни-4 024364 телем, например связующим веществом, дезинтегрирующим агентом, смазывающим средством, корригирующим веществом, солюбилизирующим средством, суспендирующим средством, эмульгирующим агентом, средством для формирования покрытия, циклодекстрином и/или буфером. Дозировка должна меняться в зависимости от симптомов, возраста и массы тела пациента, природы и тяжести расстройства,которое предполагается лечить или предупреждать, пути введения или лекарственной формы. Количество действующего ингредиента, которое можно смешать с носителем для получения единицы дозированной лекарственной формы, как правило должно являться таким количеством соединения, которое вызывает терапевтический эффект. В одном из вариантов осуществления настоящего изобретения ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят в виде фармацевтической композиции, которая включает ингибитор протеасомы, представляющий собой пептид эпоксикетон, циклодекстрин и, необязательно, буфер. Такие фармацевтические композиции, как правило, включают фармацевтически эффективное количество ингибитора протеасомы, которое, например, облегчает проявления рака при введении пациенту. В некоторых вариантах осуществления пептид эпоксикетон и другой терапевтический агент (дексаметазон) могут иметь одну и ту же форму (например, оба средства могут вводиться в форме таблеток или оба средства можно вводить внутривенно), тогда как в некоторых альтернативных вариантах осуществления пептид эпоксикетон и другой терапевтический агент могут иметь различные формы (например,одно средство можно вводить в форме таблеток, тогда как другое вводится внутривенно). Точное время введения и/или количество композиции, которые позволят добиться наилучших результатов с точки зрения эффективности лечения данного пациента, будут зависеть от активности, фармакокинетики и биодоступности конкретного соединения, физиологического состояния пациента (включая его возраст, пол, тип и стадию заболевания, общее физическое состояние, чувствительность к данной дозировке и тип медикаментозного лечения), пути введения и т.д. Однако приведенные выше указания можно использовать как основу для точного подбора лечения, например определения оптимального времени введения и/или количества вводимого препарата, что потребует проведения лишь рутинной экспериментальной работы, заключающейся в наблюдении за субъектом и подборе дозировки и/или времени введения. Фраза "фармацевтически приемлемый" применяется в настоящем описании для обозначения таких лигандов, материалов, композиций и/или дозированных форм, которые в рамках обоснованного суждения медицины подходят для применения в контакте с тканями людей и животных, не проявляя слишком сильного токсического действия, не вызывая раздражения, аллергической реакции или других проблем или осложнений, и соответствуют разумному соотношению польза/риск. Фраза "фармацевтически приемлемый носитель" в настоящем патенте означает фрамацевтически приемлемый материал, композицию или носитель, например жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава и отсутствия вреда для пациента. Некоторые материалы, которые могут применяться в качестве фармацевтически приемлемых носителей,включают: (1) сахара, например лактозу, глюкозу и сахарозу; (2) крахмалы, например кукурузный крахмал, картофельный крахмал, и замещенный или незамещенный -циклодекстрин; (3) целлюлозу и ее производные, например натрий карбоксиметилцеллюлозу, этилцеллюлозу и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) различные наполнители, например масло какао и воски для суппозиториев; (9) различные масла, например арахисовое масло, масло хлопчатника,саффлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли,например пропиленгликоль; (11) полиолы, например глицерин, сорбит, маннит и полиэтиленгликоль;(12) сложные эфиры, например этилолеат и этиллаурат; (13) агар-агар; (14) буферирующие средства, например гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах. В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению являются апирогенными, т.е. не вызывают значительного повышения температуры при введении пациенту. Термин "фармацевтически приемлемая соль" относится к сравнительно нетоксичным кислотноаддитивным солям ингибиторов по настоящему изобретению, образованным органическими и неорганическими кислотами. Эти соли можно получать in situ при окончательном выделении и очистке ингибитора (ингибиторов), или в результате отдельной реакции очищенного ингибитора (ингибиторов) в форме свободного основания с подходящей органической или неорганической кислотой, с выделением полученной при этом соли. Типовые примеры солей включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты,глюкогептонаты, лактобионаты, лаурилфосфонаты, соли аминокислот и т.п. (см., например, Berge et al. В других случаях ингибиторы, применимые в способах по настоящему изобретению, могут включать одну или несколько кислотных функциональных групп, и, таким образом, способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. Термин "фармацевтически приемлемые соли" в этих случаях относится к сравнительно нетоксичным аддитивным солям ингибиторов по настоящему изобретению, образованным неорганическими и органическими основаниями. Эти соли аналогично можно получать in situ во время завершающего выделения и очистки ингибитора (ингибиторов), или в результате отдельной реакции очищенного ингибитора (ингибиторов) в форме свободной кислоты с подходящим основанием, например гидроксидом, карбонатом или бикарбонатом,или фармацевтически приемлемым катионом металла, с аммиаком или фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Типовые примеры солей щелочных или щелочноземельных металлов включают соли лития, натрия, калия, кальция, магния, алюминия и т.п. Типовые примеры органических аминов, применимых для получения основно-аддитивных солей, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и т.п. (см., например,Berge et al. выше). Смачивающие агенты, эмульгаторы и смазывающие вещества, например лаурилсульфат натрия и стеарат магния, а также красящие средства, средства, способствующие высвобождению, вещества, образующие покрытия, подсластители, вкусоароматические средства и отдушки, консерванты и антиоксиданты, также могут входить в состав композиции. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, например аскорбиновую кислоту, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, например аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат,альфа-токоферол и т.п.; и (3) агенты, образующие хелатные комплексы с металлами, например лимонную кислоту, этилендиамин тетрауксусную кислоту (ЭДТА), сорбит, винную кислоту, фосфорную кислоту и т.п. Составы, подходящие для перорального введения, могут иметь форму капсул, крахмальных капсул,пилюль, таблеток, лекарственных леденцов (с применением ароматизированной основы, как правило,сахарозы, гуммиарабика или трагаканта), порошков, гранул или раствора или суспензии в водной или неводной жидкой среде, или жидких эмульсий масло-в-воде или вода-в-масле, или эликсира или сиропа,или пастилок (с применением инертной матрицы, например желатина и глицерина или сахарозы и гуммиарабика) и/или полоскания для рта и т.п., где каждая из перечисленных лекарственных форм содержит заранее определенное количество ингибитора (ингибиторов) по настоящему изобретению в качестве действующего ингредиента. Композицию можно вводить также в форме болюса, электуария или пасты. В твердых дозированных формах для перорального введения (капсулах, таблетках, пилюлях, драже,порошках, гранулах и т.п.) действующий ингредиент смешан содним или несколькими фармацевтически приемлемыми носителями, например цитратом натрия или дикальцийфосфатом и/или любым из следующих компонентов: (1) наполнителями или разбавителями, например крахмалами, циклодекстринами,лактозой, сахарозой, глюкозой, маннитом и/или кремниевой кислотой; (2) связующими веществами, например карбоксиметилцеллюлозой, альгинатами, желатином, поливинилпирролидоном, сахарозой и/или гуммиарабиком; (3) увлажнителями, например глицерином; (4) дезинтегрирующими средствами, например агар-агаром, карбонатом кальция, крахмалом картофеля или маниока, альгиновой кислотой, некоторыми силикатами и карбонатом натрия; (5) агентами, замедляющими растворение, такими как парафин;(6) ускорителями абсорбции, например четвертичными аммониевыми соединениями; (7) смачивающими агентами, например цетиловым спиртом или моностеаратом глицерина; (8) абсорбентами, например каолином и бентонитовой глиной; (9) смазывающими средствами, например тальком, стератом кальция,стеаратом магния твердыми полиэтиленгликолями, лаурилсульфатом натрия и их смесями; и (10) красителями. В случае капсул, таблеток и пилюль фармацевтические композиции могут также включать буферирующие средства. Твердые композиции подобного типа могут также применяться в качестве наполнителей в мягких и твердых желатиновых капсулах, с использованием таких эксципиентов, как лактоза и молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п. Таблетки можно изготавливать прессованием или формованием, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получить, используя связующее вещество (например, желатин или гидроксипропилметилцеллюлозу), смазывающее средство,инертный разбавитель, консервант, дезинтегрирующее средство (например, крахмал гликолят натрия или поперечно сшитую натрий карбоксиметилцеллюлозу), поверхностно-активное вещество или диспергирующее средство. Формованные таблетки можно изготовить путем формования в подходящем агрегате смеси порошкообразного ингибитора (ингибиторов), смоченных инертным жидким разбавителем. Таблетки и другие твердые дозированные формы, например драже, капсулы, пилюли и гранулы,могут быть необязательно снабжены насечками, или покрытиями и оболочками, например кишечными покрытиями и другими видами покрытий, хорошо известными в технике изготовления фармацевтических препаратов. Кроме того, упомянутым лекарственным формам можно придать такой состав, чтобы обеспечить медленное или регулируемое высвобождение входящего в них действующего ингредиента,-6 024364 например добавлением гидроксипропилметилцеллюлозы в различных пропорциях, для обеспечения желаемого профиля высвобождения, а также применяя другие полимерные матрицы, липосомы и/или микросферы. Препараты можно подвергнуть стерилизации, например фильтрованием через фильтры, удерживающие бактерии, или введением стерилизующих агентов в форму твердых стерильных композиций,которые можно растворить в стерильной воде или некоторых других стерильных средах, подходящих для инъекций, непосредственно перед введением. Эти композиции могут также необязательно содержать средства для придания непрозрачности и могут иметь такой состав, чтобы высвобождать действующий ингредиент (ингредиенты) только или преимущественно в определенной части желудочно-кишечного тракта, необязательно с задержкой. Примеры подходящих для применения композиций включения охватывают полимерные вещества и воски. В подходящих случаях, действующий ингредиент может также находиться в микроинкапсулированной форме, вместе с одним или несколькими из описанных выше эксципиентов. Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо действующего ингредиента, жидкие дозированные формы могут содержать инертные разбавители, обычно применяемые в технике, как, например, воду или другие растворители, солюбилизирующие средства и эмульгаторы, например этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат,пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое масло, арахисовое масло, кукурузное масло, масло проростков, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры сорбитана и жирных кислот, а также смеси перечисленных веществ. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, например смачивающие средства, эмульгирующие и суспендирующие средства, подсластители, вкусоароматические добавки, красители, отдушки и консервирующие средства. Кроме действующего ингибитора (ингибиторов) по настоящему изобретению суспензии могут содержать суспендирующие средства, например этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтилен сорбита и сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия,бентонит, агар-агар и трагакант, а также их смеси. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, включают один или несколько ингибиторов в комбинации с одним или несколькими фармацевтически приемлемыми стерильными водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть превращены в стерильные растворы и дисперсии для инъекций непосредственно перед применением, и могут содержать антиоксиданты, буферы, бактериостатические средства, растворимые вещества, придающие составу изотоничность с кровью предполагаемого реципиента, суспендирующие агенты или загустители. Примеры подходящих водных или неводных носителей, которые могут применяться в фармацевтических композициях по настоящему изобретению, включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, например оливковое масло, и подходящие для инъекций органические эфиры, например этилолеат. В случае дисперсий необходимую текучесть можно поддерживать, например, применением покрывающих материалов, таких как, лецитин, за счет сохранения требуемого размера частиц, а также с помощью поверхностоактивных веществ. Эти композиции могут также содержать адъюванты, например консерванты, смачивающие средства, эмульгирующие средства и диспергирующие средства. Прекращение деятельности микроорганизмов можно обеспечить включением в состав различных антибактериальных и противогрибковых средств,например парабенов, хлорбутанола, фенолсорбиновой кислоты и т.п. Кроме того, может быть желательно ввести в композицию средства, регулирующие тоничность, например сахара, хлорид натрия и т.п. Кроме того, пролонгированной абсорбции инъецируемой фармацевтической формы можно добиться включением в ее состав агентов, которые замедляют абсорбцию, например моностеарата алюминия и желатина. В некоторых случаях для продления действия лекарственного средства, желательно замедлить его абсорбцию при подкожной или внутримышечной инъекции. Замедление абсорбции при парентеральном введении лекарственной формы достигается, например, растворением или суспендированием лекарственного средства в масляном носителе. Предназначенные для инъекций формы пролонгированного действия получают микроинкапсулированием ингибитора (ингибиторов) в матрице из биоразрушаемых полимеров, например полилактидаполигликолида. В зависимости от относительного количества лекарственного средства и полимера, а также природы конкретного применяемого полимера, можно регулировать скорость высвобождения лекарственного средства. Примеры других биоразрушаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые составы пролонгированного действия получают также путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма. Фразы "парентеральное введение" и "введенный парентерально" в настоящем описании означают способ введения, отличный от энтерального и местного введения, обычно с помощью инъекции, и этот термин охватывает, не ограничиваясь перечисленным, внутривенные, внутримышечные, внутриартериальные, интратекальные, интракапсулярные, внутриглазничные, внутрисердечные, внутрикожные, интраперитонеальные, транстрахеальные, подкожные, субкутикулярные, интраартрикулярные, подкапсулярные, субарахноидальные, интраспинальные и интрастернальные инъекции и инфузии. Фразы "системное введение", "введенный системно", "периферическое введение" и "введенный периферически" в настоящем описании означают введение лиганда, лекарственного средства или другого материала иначе, чем непосредственно в центральную нервную систему, с тем, чтобы указанный материал поступал в систему пациента и, следовательно, подвергался метаболизму и другим подобным процессам, например приведенные фразы относятся к подкожному введению. Введение пациенту терапевтических композиций по настоящему изобретению должно осуществляться в соответствии с общими протоколами введения химиотерапевтических средств, с учетом токсичности, в случае ее наличия. Предполагается, что при необходимости можно было бы повторить цикл лечения. Кроме того, имеется в виду, что различные стандартные способы лечения или вспомогательная противораковая терапия, а также хирургическое вмешательство, могут применяться в комбинации с описанным мышьяксодержащим средством. Независимо от выбранного пути введения ингибитор (ингибиторы) по настоящему изобретению,который может применяться в виде соответствующим образом гидратированной формы, и/или фармацевтические композиции по настоящему-изобретению, включают в состав фармацевтически приемлемых дозированных форм с применением стандартных методик, известных специалистам в данной области техники. Фактическое содержание действующих ингредиентов в фармацевтических композициях по настоящему изобретению можно менять, с тем, чтобы получить количество действующего ингредиента, композицию и форму введения, которые позволят добиться желаемой терапевтической реакции у данного пациента, но без токсического действия на его организм. Помещенные ниже по тексту примеры приведены для более полной иллюстрации предпочтительных вариантов осуществления настоящего изобретения. Эти примеры никоим образом не следует истолковывать, как ограничение объема изобретения, который определен приложенной формулой изобретения. Применение соединений. Упорядоченное разрушение белков имеет решающее значение для поддержания нормальной деятельности клетки, и протеасома участвует в процессе разрушения белка. Протеасома контролирует уровни белков, которые важны для развития клеточного цикла и апоптоза, в нормальных и злокачественных клетках; например циклинов, каспаз, BCL2 и nF-kB (Kumatori et al., Proc. Natl. Acad. Sci USA (1990) 87: 7071-7075; Almond et al., Leukemia (2002) 16: 433-443). Поэтому неудивительно, что ингибирование активности протеасомы можно трансформировать в способ лечения различных болезненных состояний,например злокачественных, незлокачественных и аутоиммунных заболеваний, в зависимости от клеток,вовлеченных в развитие заболевания. Химиотерапевтические средства и лекарственные средства, применяемые для лечении заболеваний,при которых целесообразно уничтожение аномальных клеток, например аутоиммунных заболеваний,таких как рассеянный склероз и ревматоидный артрит, а также рака. Хотя механизм действия каждой группы химиотерапевтических средств может отличаться, их действие, как правило, направлено на нарушение способности клеток к пролиферации. Пептид эпоксикетон или его фармацевтически приемлемая соль в комбинации с одним или несколькими другими терапевтическими средствами, могут применяться при лечении широкого спектра раковых заболеваний и аутоиммунных заболеваний. В настоящем патенте термины "рак" или "раковое заболевание" включают, не ограничиваясь этим,переносимые кровью или солидные опухоли. Термин "рак" относится к заболеваниям крови, костей, органов, кожных тканей и сосудистой системы, включая, но не ограничиваясь этим, рак мочевого пузыря,крови, костей, мозга, груди, шейки матки, грудной клетки, ободочной кишки, эндометрия, пищевода,глаз, головы, почек, печени, легких, лимфатических узлов, полости рта, шейного отдела, яичников, поджелудочной железы, простаты, прямой кишки, почек, кожи, желудка, яичек, гортани и матки. Конкретные разновидности рака включают, не ограничиваясь этим, лейкемию (острую лимфоцитарную лейкемию (ALL), острую миелогенную лейкемию (AML), хроническую лимфоцитарную лейкемию (CLL),хроническую миелогенную лейкемию (CML), волосато-клеточную лейкемию), новообразования зрелых В-клеток (лимфому из малых лимфоцитов, В-клеточную пролимфоцитарную лейкемию, лимфоплазматическую лимфому (например, макроглобулинемию Вальденстрема), лимфому из клеток краевой зоны селезенки, миелому клеток плазмы, плазмацитому, заболевания, вызванные отложением моноклонального иммуноглобулина, болезни тяжелых цепей, экстранодальную лимфому из В-клеток краевой зоны(лимфому MALT), нодальную лимфому из клеток краевой зоны (NMZL), фолликулярную лимфому,лимфому из клеток мантийной зоны, диффузную В-клеточную лимфому, медиастинальную (тимическую) В-крупноклеточную лимфому, внутрисосудистую В-крупноклеточную лимфому, первичную эф-8 024364 фузионную лимфому и лимфому/лейкемию Беркитта), новообразования зрелых Т-клеток и природных клеток-киллеров (NK) (Т-клеточную пролимфоцитарную лейкемию, Т-клеточную крупноклеточную гранулярную лимфоцитарную лейкемию, агрессивную NK-клеточную лейкемию, Т-клеточную лейкемию/лимфому взрослых, экстранодальную NK/T-клеточную лимфому, Т-клеточную лимфому с энтеропатией, печеночно-селезеночную Т-клеточную лимфому, бластную NK-клеточную лимфому, грибовидный микоз (синдром Сезари), первичную анапластическую крупноклеточную лимфому кожи, лимфоматоидный папулез, ангиоиммунобластную Т-клеточную лимфому, неспецифическую периферическую Т-клеточную лимфому и анапластическую крупноклеточную лимфому), Ходжкинские лимфомы (вариант с нодулярным склерозом, смешанно-клеточный вариант, вариант с большим количеством лимфоцитов, вариант с истощением или без истощения лимфоидной ткани, вариант с преобладанием нодулярных лимфоцитов), миелому (множественную миелому, индолентную миелому, вялотекущую миелому), хроническую миелопролиферативную болезнь (CMPD) (например, хроническую миелогенную лейкемию,хроническую нейтрофильную лейкемию, хроническую эозинофильную лейкемию, истинную полицитемию, хронический идиопатический миелофиброз, эссенциальную тромбоцитемию и случаи хронической миелопролиферативной болезни,не поддающиеся классификации),миелодиспластические/миелопролиферативные заболевания (например, хроническую миеломоцитарную лейкемию, атипическую хроническую миелоидную лейкемию, юношескую миеломоноцитарную лейкемию и миелодиспластические/миелопролиферативные заболевания, не поддающиеся классификации), миелодиспластические синдромы (MDS) (например, рефрактерную анемию, рефрактерную анемию с кольцевыми сидеробластами, рефрактерную цитопению с мультилинеарной дисплазией, рефрактерную анемию с избытком бластов, случаи миелодиспластического синдрома, не поддающиеся классификации, и миелодиспластический синдром, связанный с изолированной аномалией del (5q)хромосомы), лимфопролиферативные расстройства, связанные с иммунодефицитом, новообразования гистиоцитов и дендритных клеток, мастоцитоз (например, кожный мастоцитоз, вялотекущий системный мастоцитоз (ISM), системный мастоцитоз с ассоциированным клональным гематологическим заболеванием, не связанным с линией мастоцитов(SM-AHNMD), агрессивный системный мастоцитоз (ASM), базофильную лейкемию (MCL), мастоцитому(MCS) и мастоцитому некожной локализации), хондросаркому, саркому Эвинга, фибросаркому, злокачественную гигантоклеточную опухоль, миеломную костную болезнь, остеосаркому, рак груди (гормонозависимый, гормононезависимый), гинекологические раковые заболевания (рак шейки матки, эндометрия, фаллопиевых труб, трофобластическую болезнь беременных, рак яичников, брюшной полости, матки, влагалища и вульвы), базальноклеточную карциному (ВСС), плоскоклеточную карциному (SCC),злокачественную меланому, выбухающую дерматофибросаркому, карциному клеток Меркеля, саркому Капоши, астроцитому, пилоцитарную астроцитому, дисэмбриопластическую нейроэпителиальную опухоль, олигодендроглиомы, эпендимому, мультиформную глиобластому, смешанные глиомы, олигоастроцитомы, медуллобластому, ретинобластому, нейробластому, герминому, тератому, злокачественную мезотелиому (перитонеальную мезотелиому, перикардиальную мезотелиому, плевральную мезотелиому), гастро-энтеро-панкреатическую или гастроэнтеропанкреатическую нейроэндокринную опухоль(GEP-NET), карциноид, панкреатическую эндокринную опухоль (PET), колоректальную аденокарциному, колоректальную карциному, агрессивную нейроэндокринную опухоль, слизеобразующую лейомиосаркому аденокарциному, перстневидно-клеточную аденокарциному, гепатоклеточную карциному, холангиокарциному, гепатобластому, гемангиому, аденому печени, фокальную нодулярную гиперплазию(нодулярную регенеративную гиперплазию, гамартому), немелкоклеточную карциному легких (NSCLC)(плоскоклеточную карциному легких, аденокарциному, крупноклеточную карциному легких), мелкоклеточную карциному легких, карциному щитовидной железы, рак простаты (гормон-рефрактерный, андроген-независимый, андроген-зависимый, гормон-нечувствительный) и саркомы мягких тканей (фибросаркому, злокачественную фиброзную гистиоцитому, дерматофибросаркому, липосаркому, рабдомиосаркому, лейомиосаркому, гемангиосаркому, синовиальную саркому, злокачественную опухоль оболочки периферических нервов/нейрофибросаркому, экстраскелетную остеосаркому). Термин "аутоиммунное заболевание" в настоящем патенте означает заболевание или расстройство,возникающее из-за реакции организма на свои собственные ткани и направленное против них. Примеры аутоиммунных заболеваний или расстройств включают, не ограничиваясь этим, воспалительные реакции, например воспалительные заболевания кожи, в т.ч. псориаз и дерматит (например, атопический дерматит); системную склеродермию и склероз; реакции, связанные с воспалительным заболеванием кишечника (например, болезнь Крона и язвенный колит); синдром расстройства дыхания (включая синдром расстройства дыхания у взрослых; ARDS); дерматит; менингит; энцефалит; увеит; колит; гломерулонефрит; аллергические состояния, например экзему и астму и другие состояния, включающие инфильтрацию Т-клеток и хронические воспалительные реакции; атеросклероз; недостаточность адгезии лейкоцитов; ревматоидный артрит; системную красную волчанку (SLE); сахарный диабет (например,сахарный диабет типа I или инсулинозависимый сахарный диабет); рассеянный склероз; синдром Рейно; аутоиммунный тиреоидит; аллергический энцефаломиелит; синдром Шегрена; юношеский диабет; и иммунные реакции, связанные с немедленной и замедленной аллергией, опосредованной цитокинами и Т-лимфоцитами, обычно проявляющиеся при туберкулезе, саркоидозе, полимиозите, грануломатозе и васкулите; злокачественную анемию (болезнь Аддисона); заболевания, включающие диапедез лейкоцитов; воспалительные расстройства центральной нервной системы (ЦНС); синдром множественного поражения органов; гемолитическую анемию (включая, но не ограничиваясь этим, криоглобулинемию или Кумбс-позитивную анемию); миастению gravis; заболевания, опосредованные комплексом антигенантитело; болезнь Гудпасчера; антифосфолипидный синдром; аллергический неврит; болезнь Грейвса; миастенический синдром Ламберта-Итона; буллезный пемфигоид; пемфигус (пузырчатку); аутоиммунные полиэндокринопатии; болезнь Рейтера; синдром мышечной скованности; болезнь Бехчета; гигантоклеточный артериит; сложный иммунный нефрит; IgA нефропатию; IgM полиневропатию; иммунную тромбоцитопеническую пурпуру (ITP) или аутоиммунную тромбоцитопению. В некоторых вариантах раковое заболевание представляет собой гематологическое раковое заболевание, выбранное из лимфомы из клеток мантийной зоны, диффузной В-клеточной лимфомы (DLBCL),Т-клеточных лимфом или лейкемий (например, кожной Т-клеточной лимфомы (CTCL), некожной периферической Т-клеточной лимфомы, лимфомы, ассоциированной с Т-клеточным лимфотропным вирусом человека (HTLV), Т-клеточной лейкемии/лимфомы взрослых (ATLL, острой лимфоцитарной лейкемии,острой миелогенной лейкемии (например, острой моноцитарной лейкемии и острой промиелоцитарной лейкемии), хронической лимфоцитарной лейкемии (например, хронической В-клеточной лейкемии),хронической миелогенной лейкемии, болезни Ходжкина, неходжкинской лимфомы (например, лимфомы Беркитта), миеломы, множественной миеломы и миелодиспластического синдрома. В некоторых вариантах осуществления раковое заболевание выбрано из множественной миеломы и лимфомы. В некоторых вариантах раковое заболевание представляет собой солидную опухоль, нейробластому или меланому, выбранную из мезотелиомы, нейробластомы мозга, ретинобластомы, глиомы, опухоли Вильмса, рака костей и сарком мягких тканей, раковых опухолей головы и шейного отдела (например,ротовой полости, гортани и пищевода), урогенитальных раковых заболеваний (например, простаты, мочевого пузыря, почек, матки, яичников, яичек, прямой и ободочной кишки), рака легких (например, мелкоклеточной карциномы и немелкоклеточной карциномы легких, включая плоскоклеточную карциному и аденокарциному), рака груди, рака поджелудочной железы, базальноклеточной карциномы, метастатической карциномы кожи, плоскоклеточной карциномы (как язвенного, так и папиллярного типа), рака желудка, рака мозга, рака печени, рака надпочечников, рака почек, рака щитовидной железы, медуллярной карциномы, остеосаркомы, саркомы мягких тканей, саркомы Эвинга, саркомы ретикулярных клеток и саркомы Капоши. В некоторых вариантах осуществления раковое заболевание выбрано из рака яичников (например, аденокарциномы яичников), немелкоклеточного рака легких и колоректального рака. Кроме того, раковые заболевания включают педиатрические формы всех упомянутых выше раковых заболеваний. Кроме того, в настоящем изобретении разработан способ лечения фармакорезистентных опухолей. В некоторых вариантах осуществления фармакорезистентная опухоль является множественной миеломой. Под термином "фармакорезистентный" подразумевается состояние, которое демонстрируют врожденную устойчивость или приобретенную устойчивость. Под "врожденной устойчивостью" подразумевается характеристический профиль экспрессии в раковых клетках ключевых генов важных сигнальных путей, включая, но не ограничиваясь этим, апоптоз, прогрессию клеток и репарацию ДНК, которые способствуют более быстрому росту раковых клеток, по сравнению с их нормальными аналогами. Под"приобретенной устойчивостью" понимаются многофакторные явления, происходящие при образовании и прогрессии опухоли, которые могут влиять на восприимчивость опухолевых клеток к лекарственным средствам. Приобретенная устойчивость может быть следствием нескольких механизмов, например, но не ограничиваясь этим, изменения мишеней для лекарственных средств, ухудшения аккумуляции лекарственного средства, изменения распределения лекарства внутри клетки, ослабления взаимодействия лекарство-мишень, усиления реакции детоксификации, нарушения регуляции клеточного цикла, увеличения репарации поврежденных ДНК и снижения апоптотичской реакции. Несколько указанных механизмов могут действовать одновременно и/или могут взаимодействовать друг с другом. Их активация и/или инактивация может происходить вследствие генетических или эпигенетических явлений или в присутствии онковирусных белков. Приобретенная устойчивость может возникать в отношении отдельных лекарственных препаратов, но может также проявляться более широко, в отношении большого числа различных лекарственных препаратов с различными химическими структурами и различными механизмами действия. Эта форма устойчивости именуется мультилекарственной устойчивостью. Пептид эпоксикетон или его фармацевтически приемлемая соль в комбинации с одним или несколькими другими терапевтическими средствами, могут применяться для лечения нейродегенеративных заболеваний и состояний, включая, но не ограничиваясь этим, инсульт, ишемическое поражение нервной системы, травму нервной системы (например, ударное повреждение мозга, травму спинного мозга и травматическое повреждение нервной системы), рассеянный склероз и другие иммунно-опосредованные невропатии (например, синдром Джулиана-Барре и его варианты, острую моторную аксональную невропатию, острую воспалительную демиелинизирующую полиневропатию и синдром Фишера), комплекс ВИЧ/СПИД-деменция, аксономию, диабетическую невропатию, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, рассеянный склероз, бактериальный, паразитарный, грибковый и вирусный менингит, энцефалит, сосудистую деменцию, мультиинфарктную деменцию, деменцию с тельцами Леви,деменцию лобной доли мозга, например болезнь Пика, подкорковые деменции (например, болезнь Гентингтона или прогрессирующий супрануклеарный паралич), синдромы очаговой атрофии коры головного мозга (например, первичную афазию), метаболически-токсические деменции (например, хронический гипотиреоидизм или дефицит витамина В 12) и деменции, вызванные инфекциями (например, сифилисом или хроническим менингитом). Примеры Пример 1. У мышей с иммунной недостаточностью (BNX, Charles River Laboratories) вызывали развитие опухоли путем подкожного введения клеток человеческой лимфомы RL (1107/мышь) в правый бок в общем объеме 0,1 мл фосфатного буферного солевого раствора (PBS). Когда опухоли достигали размера примерно 50 мм 3 (что показано стрелкой на фиг. 1), мышей случайным образом разбивали по группам (9 мышей в группе). Соединение 1 вводили внутривенно (IV) в 10% растворе (мас./об.) сульфобутиловый эфир-бета-циклодекстрина в водном 10 мМ цитратном буфере рН 3,5. Введение осуществляли в 1 и 2 дни каждой недели. Препарат SAHA готовили в 100% ДМСО и вводили интраперитонеально (IP) в дни 1-5 каждой недели. =Р 0,001 (соединение 1+SAHA по сравнению с носителем) по результатам двухфакторного ANOVA и апостериорных сравнений Бонферрони. Пример 2. Клеточные линии и реагенты: линии клеток лимфомы человека (RL), немелкоклеточной опухоли легких (А 549) и опухоли кишечника (НТ-29) приобретали у АТСС (Manassas, VA). ИнгибиторChemicals (Ann Arbor, MI). Препарат Doxil приобретали в местной аптечной сети. Исследование токсичности: самкам мышей BNX в возрасте 4-6 недель вводили химиотерапевтические средства различных классов в форме монотерапии или в комбинации с карфилзомибом. Двухнедельное исследование токсичности проводили с использованием дозировок и расписания введения, которые отражены в сопроводительной информации к соответствующим фигурам. Токсичность измеряли по потере массы тела три раза в неделю. Исследования ксенотрансплантатов: развитие опухолей вызывали с помощью подкожной (s.c.) инъекции клеток указанных выше линий (во время имплантации количество пассажей 9 и выживаемость 95%) в правый бок мышей BNX (n=8/9 на группу). В случае клеток RL вводили 0,1 мл клеточной суспензии, содержащей 1107 клеток. В случае клеток НТ-29, ES2 и А 549 вводили 0,1 мл суспензии, содержащей 5106 клеток. Мышей случайным образом разбивали на группы и начинали введение препаратов,когда размер опухоли достигал примерно 100 мм 3. Во всех группах размеры опухолей измеряли трижды в неделю, регистрируя наибольшие перпендикулярные диаметры, и рассчитывали объемы опухолей, используя уравнение V (мм 3) = (длинаширина 2)/2. Статистический анализ: для сравнения результатов в различных группах проводили двухфакторный анализ ANOVA с последующим апостериорным анализом Бонферрони, используя программу GraphPadPrism (версия 4.01). Результаты считали статистически значимыми при р 0,05. Соединение 1 в комбинации с доксилом показало хорошую переносимость при подходящей для клинического применения схеме введения, при MTD 10 мг/кг доксилаQ7D (iv) и MTD 5 мг/кг карфилзомибаQD2 (iv). Как показано на фиг. 2A, применялась схема введения доксил в день 1 (iv), через 1 ч соединение 1 в дни 1, 2 (iv). Двухнедельное исследование токсичности проводили на мышах BNX (n=5),и определяли потерю массы тела, которая показана на фиг. 2B, где максимальная переносимая доза(MTD) доксила в качестве единственного лекарственного средства у мышей BNX составляла 20 мг/кг, в то время как MTD доксила в комбинации с соединением 1 (5 мг/кг) при изученной схеме введения составляла 10 мг/кг. Соединение 1 в MTD (5 мг/кг) и доксил в суб-MTD дозировке (3 мг/кг) (n=10 в группе) на искусственно полученной модели ксенотрансплантата колоректального рака НТ 29, продемонстрировали повышенную противоопухолевую активность (комбинированная терапия р 0,001 по сравнению с контролем или индивидуальным введением карфилзомиба; р 0,01 по сравнению с индивидуальным введением доксила), что показано на фиг. 3 (стрелки указывают на начало периода введения). Аналогичные результаты наблюдались для искусственно полученной модели ксенотрансплантата немелкоклеточного рака легких А 549 (комбинированное введение р 0,001 по сравнению с контролем или индивидуальным введение доксила; статистическая значимость отсутствует по сравнению с индивидуальным введением карфилзомиба), что показано на фиг. 4 (стрелки указывают на начало периода введения). Соединение 1 в комбинации с доцетакселом показало хорошую переносимость при подходящей для клинического применения схеме введения, при MTD 10 мг/кг доцетакселаQ7D (iv) и MTD 5 мг/кг соединения 1QD2 (iv). Как показано на фиг. 5A, применялась схема введения доцетаксел в день 1 (iv),через 1 ч соединение 1 дни 1, 2 (iv). Затем проводили двухнедельное исследование токсичности на мышах BNX (n=5) и определяли потерю массы тела, причем MTD доцетаксела в комбинации с карфилзомибом при этой схеме введения составляла 10 мг/кг. Результаты для комбинация соединения 1 в MTD (5 мг/кг) и доцетаксела в суб-MTD дозировке(5 мг/кг) (n=10 в группе) на искусственно полученной модели ксенотрансплантата немелкоклеточного рака легких А 549, (комбинированная терапия р 0,001 по сравнению с контролем; р 0,05 по сравнению с индивидуальным введением карфилзомиба, NS по сравнению с доцетакселом), показаны на фиг. 6 (стрелки указывают на начало периода введения). Результаты для комбинация соединения 1 в суб-MTD дозировке (3 мг/кг) и доцетаксела в суб-MTD дозировке (5 мг/кг) (n=10 в группе) на искусственно полученной модели ксенотрансплантата немелкоклеточного рака легких А 549, (комбинированная терапия р 0,001 по сравнению с контролем; р 0,01 по сравнению с карфилзомибом и доцетакселом), показаны на фиг. 7 (стрелки указывают на начало периода введения). Комбинация соединения 1 и вориностата показала хорошую переносимость при подходящей для клинического применения схеме введения, при 50 мг/кгQD5 вориностата (ip) и MTD 5 мг/кг соединения lQD2 (iv). MTD вориностата не определяли. Вориностат вводили в дни 1-5 (ip), через 1 ч соединение 1 в дни 1, 2 (iv), как показано на фиг. 8 А. Токсичность при введении мышам BNX соединения 1 и вориностата, определенная по потере массы тела, в исследованных группах оказалась близкой, и это дает возможность предположить, что такая комбинация хорошо переносилась экспериментальными животными (фиг. 8 В). Действие комбинации соединения 1 (3 мг/кг) и вориностата (50 мг/кг) (n=8 в группе) на искусственно полученные опухоли RL показано на фиг. 9 (стрелки указывают на начало периода введения). Действие комбинации соединения 1 (3 мг/кг) и вориностата (50 мг/кг) (n=8 в группе) на искусственно полученные опухоли ES2 Р 0,01; и Р 0,001 по сравнению с монотерапией и носителем, показано на фиг. 10 (стрелки указывают на начало периода введения). Введение соединения 1 хорошо переносилось в комбинации с ингибитором гистон деацетилазы(вориностатом), средством для разрушения микротрубок (доцетакселом) и антрациклином (доксилом) при клинически применимых схемах введения для каждого индивидуального средства. Комбинация соединения 1 и вориностата приводила к значительному ослаблению роста лимфомы (RL) по сравнению с контрольным введением носителя или индивидуальным введением любого из средств (р 0,001 относительно контроля; р 0,01 относительно индивидуального введения соединения 1 или вориностата). Комбинация соединения 1 и доцетаксела привела к значительному ослаблению роста опухоли А 549 по сравнению с контрольной группой, получавшей носитель, а также по сравнению с введением любого индивидуального средства (р 0,001 по отношению к контролю; р 0,01 по отношению к индивидуальному введению карфилзомиба или доцетаксела). Аналогичные результаты наблюдались в модели ксенотрансплантата НТ-29, где комбинация соединения 1 и доксила значимо уменьшает опухолевую нагрузку(р 0,001 относительно контроля или индивидуального введения карфилзомиба; р 0,01 относительно индивидуального введения доксила). Соединение 1 и доксил в суб-MTD дозировках демонстрируют синергетическое противоопухолевое действие в модели солидной опухоли. Аналогично, соединение 1 в комбинации с доцетакселом в суб-MTD дозах позволяет добиться синергетического противоопухолевого действия в модели рака легких человека. Соединение 1 в комбинации с вориностатом вызывает синергетический противоопухолевый эффект в модели лимфомы. Соединение 1 в комбинации с вориностатом проявляет эффективные противоопухолевые свойства в модели рака яичников. Пример 3. Соединение 1 тестировали при концентрации 6,58 нМ в комбинации с мелфаланом в четырех различных дозировках: 11,1; 7,4; 4,9 и 3,3 мкМ. Клетки ММ 1.S (множественной миеломы, восприимчивые к дексаметазону) помещали в планшеты в количестве 200000 клеток/мл в объеме 45 мкл и затем предварительно обрабатывали мелфаланом в течение 24 ч. Затем добавляли соединение 1 и клетки инкубировали в течение дополнительных 24 ч при концентрации 6,58 нМ. Затем к образцам клеток добавляли раствор глиоксалазы для клеточного титрования в соотношении 1:1 и осуществляли считывание для определения выживаемости. Рассчитывали значения комбинационных коэффициентов, используя программуCalcusyn, причем значения 0,9 соответствовали синергии, 0,9-1,0 соответствовали аддитивности и значения 1,1 - антагонизму. Полученные результаты показали, что соединение 1 и мелфалан проявляли синергическое и аддитивное действие при указанных концентрациях, что показано на фиг. 11. Эквиваленты. Специалисты в данной области поймут или будут способны установить, с помощью не более чем обычного объема экспериментальной работы, многочисленные эквиваленты соединений и способов их применения, описанных в настоящем патенте. Считается, что эти эквиваленты входят в объем настоящего изобретения и охвачены следующей далее по тексту формулой изобретения. Все упомянутые выше литературный источники и публикации включены в настоящий патент посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения множественной миеломы, включающий введение пациенту комбинации, содержащей (1) терапевтически эффективное количество ингибитора протеасомы, представляющего собой пептид эпоксикетон или его фармацевтически приемлемую соль, и (2) терапевтически эффективное количество дексаметазона,где ингибитор протеасомы, представляющий собой пептид эпоксикетон, имеет следующую структурную формулу: где пептид эпоксикетон и дексаметазон вводят в течение от примерно 5 мин до примерно 48 ч один после другого, и где эффективность, показанная при комбинированном введении (1) и (2), превосходит эффективность, показанную при индивидуальном введении любого из (1) или (2). 2. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого. 3. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого. 4. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме. 5. Способ по п.1, где (1) и (2), каждый, вводят внутривенно. 6. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах. 7. Способ по п.6, где один из (1) и (2) вводят внутривенно, а другой вводят перорально. 8. Способ по п.7, где (1) вводят внутривенно, а (2) вводят перорально. 9. Способ по п.1, где способ дополнительно включает введение леналидомида. 10. Способ по п.1, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят после введения дексаметазона. 11. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 30 мин один после другого. 12. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в течение примерно 4 ч один после другого. 13. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в одной и той же форме. 14. Способ по п.10, где (1) и (2), каждый, вводят внутривенно. 15. Способ по п.10, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, и дексаметазон вводят в различных формах. 16. Способ по п.15, где один из (1) и (2) вводят внутривенно, а другой вводят перорально. 17. Способ по п.16, где (1) вводят внутривенно, а (2) вводят перорально. 18. Способ по любому из пп.10-17, где способ дополнительно включает введение леналидомида. 19. Способ по любому из пп.1-18, где множественная миелома представляет собой фармакорезистентную множественную миелому. 20. Способ по любому из пп.1-19, где ингибитор протеасомы, представляющий собой пептид эпоксикетон, вводят в виде фармацевтической композиции, которая включает ингибитор протеасомы, представляющий собой пептид эпоксикетон, циклодекстрин и, необязательно, буфер.
МПК / Метки
МПК: A61K 31/165, A61K 31/167, A61K 38/08, A61K 38/07, A61K 38/04, A61P 35/00
Метки: множественной, лечения, миеломы, способ
Код ссылки
<a href="https://eas.patents.su/18-24364-sposob-lecheniya-mnozhestvennojj-mielomy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения множественной миеломы</a>