Способ получения глюкопиранозилзамещенных производных бензилбензола
Номер патента: 22032
Опубликовано: 30.10.2015
Авторы: Реннер Свенья, Пост Маттиас, Вебер Дирк, Орлих Зимоне, Вирт Томас, Хамм Райнер, Фидлер Тобиас, Ван Сяоюнь, Фильзер Кристиан
Формула / Реферат
1. Способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы III
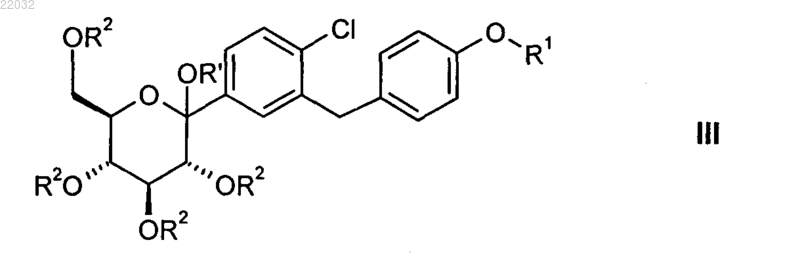
в которой R1 обозначает (R)-тетрагидрофуран-3-ил или (S)-тетрагидрофуран-3-ил, и
R2 обозначает триметилсилил, и
R' обозначает водород или (С1-С6)алкил,
включающий стадии (S2), (S3), (S4) и (S5):
(S2) - взаимодействие металлоорганического соединения формулы VI
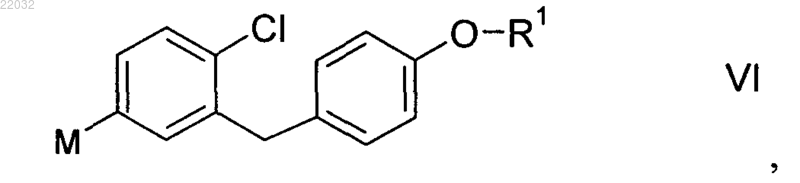
в которой R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает О, Br, I или органический остаток,
с глюконолактоном общей формулы IV
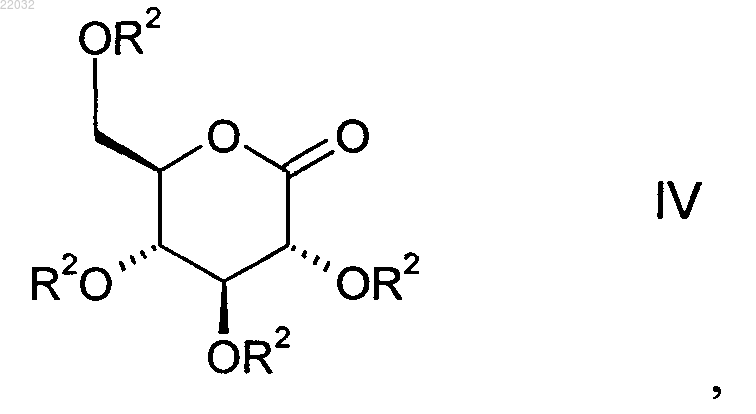
в которой R2 отвечает вышеприведенному определению,
в органическом растворителе или смеси двух или более органических растворителей,
(S3) - добавление водного раствора, содержащего одну или более кислот, таким образом, чтобы реакционная смесь образовала водную фазу и органическую фазу, в результате чего органическая фаза имела бы рН в диапазоне от 1 до 6,
(S4) - отделение органической фазы, содержащей полученный на стадии (S2) аддукт от водной фазы, и
(S5) - взаимодействие полученного аддукта с водой, или спиртом R'-OH, где R' обозначает (С1-С6)алкил, или их смесью в присутствии одной или более кислот.
2. Способ по п.1, дополнительно включающий стадию (S1):
(S1) - введение соединения формулы V
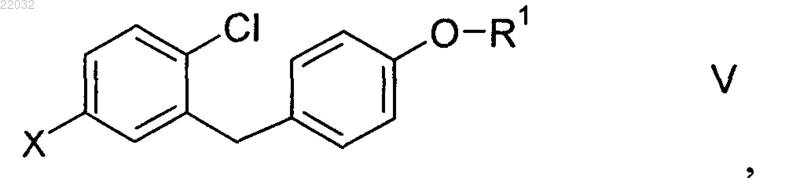
в которой R1 отвечает приведенному в п.1 определению, а X обозначает Br, I или трифлат,
во взаимодействие с магнием, литием, магниевым реактивом Гриньяра или литийорганическим соединением в органическом растворителе или смеси двух или более органических растворителей, с целью получения металлоорганического соединения формулы VI
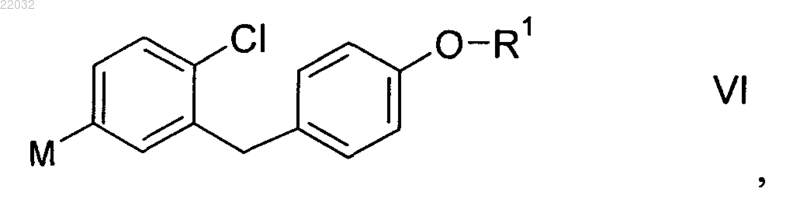
в котором R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает Cl, Br, I или органический остаток.
3. Способ по п.2, в котором на стадии (S1) соединение формулы V вводят во взаимодействие с (С3-С4)алкилмагнийхлоридом или бромидом.
4. Способ по п.3, в котором в начале, в течение или в конце стадии (S1) и/или в начале или в течение стадии (S2) к реакционной смеси добавляют бромид лития и/или хлорид лития, причем мольное соотношение (С3-С4)алкилмагнийхлорида или бромида и бромида лития и/или хлорида лития находится в диапазоне от 1:10 до 10:1.
5. Способ по пп.2, 3 или 4, в котором количество магния, лития, магниевого реактива Гриньяра или литийорганического соединения по отношению к соединению формулы V находятся в пределах от 0,5 до 2 моль, предпочтительно приблизительно эквимолярны.
6. Способ по пп.1-4 или 5, в котором растворители выбраны из группы, включающей тетрагидрофуран, 2-метилтетрагидрофуран, трет-бутилметиловый эфир, диэтиловый эфир, гептан, толуол, бензол, диоксан, метилциклогексан, гексан, диметилсульфоксид, дихлорметан и хлороформ, предпочтительно выбраны из тетрагидрофурана и 2-метилтетрагидрофурана.
7. Способ по одному или более из пп.2-6, в котором реакция на стадии (S1) и/или стадии (S2) может быть осуществлена в диапазоне температур от -70 до 10°С.
8. Способ по одному или более из пп.1-7, в котором количество глюконолактона по отношению к металлоорганическому соединению формулы VI находится в пределах от 0,8 до 3 моль, предпочтительно от 1 до 2 моль, наиболее предпочтительно 1,06 моль.
9. Способ по одному из пп.1-8, в котором водный раствор содержит одну или несколько кислот, выбранных из группы, включающей лимонную кислоту, винную кислоту, щавелевую кислоту, янтарную кислоту, уксусную кислоту, хлоруксусную кислоту, дихлоруксусную кислоту, трифторуксусную кислоту, соляную кислоту, серную кислоту и азотную кислоту.
10. Способ по п.9, в котором водный раствор содержит от 2 до 30 мас.% лимонной кислоты.
11. Способ по п.10, в котором водный раствор содержит от 5 до 20 мас.% лимонной кислоты.
12. Способ по одному или более из пп.1-11, в котором на стадии (S3) органическая фаза имеет рН в диапазоне от 1 до 4.
13. Способ по одному из пп.1-12, в котором органическая фаза реакционной смеси на стадии (S3) содержит 2-метилтетрагидрофуран в количестве в диапазоне от 2 до 60 мас.% по отношению к общему количеству органической фазы в реакционной смеси.
14. Способ по п.13, в котором количество 2-метилтетрагидрофурана находится в диапазоне от 10 до 40 мас.% по отношению к общему количеству органической фазы реакционной смеси.
15. Способ по одному или более из пп.1-14, в котором R' обозначает водород, метил или этил, предпочтительно метил.
16. Способ по одному или более из пп.1-15, в котором на стадии (S5) аддукт, получаемый на стадии (S4), вводят во взаимодействие со спиртом R'-OH, где спирт R'-OH выбран из группы, включающей метанол, этанол, 1-пропанол, 2-пропанол, н-бутанол, трет-бутанол или их смеси, предпочтительно метанол.
17. Способ по одному или более из пп.1-16, в котором на стадии (S5) при добавлении одной или более кислот следует достичь рН, который составляет от 0 до 7, предпочтительно от 0 до 4, более предпочтительно от 1 до 2.
18. Способ по одному или более из пп.1-17, в котором на стадии (S5) одну или более кислоту выбирают из группы, включающей соляную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, трифторуксусную кислоту, лимонную кислоту, винную кислоту, щавелевую кислоту и янтарную кислоту, предпочтительно соляную кислоту.
19. Способ по одному или более из пп.1-18, в котором на стадии (S5) температура взаимодействия находится в диапазоне от -50 до 50°С, предпочтительно от 0 до 30°С, наиболее предпочтительно от 15 до 25°С.
20. Способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы II
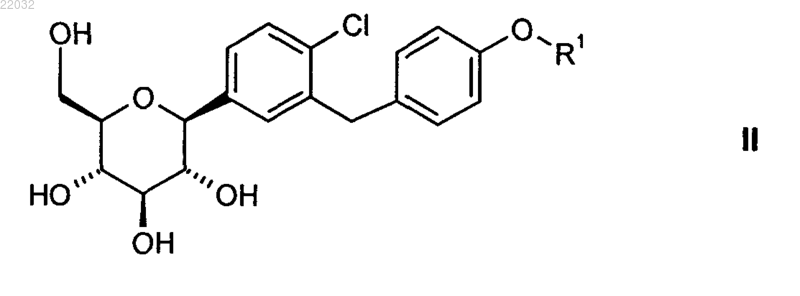
в которой R1 обозначает (R)-тетрагидрофуран-3-ил или (S)-тетрагидрофуран-3-ил, где глюкопиранозилзамещенное производное бензилбензола общей формулы III

в которой R1 отвечает вышеприведенному определению, и
R2 обозначает триметилсилил, и
R' обозначает водород или (С1-С6)алкил,
получают по одному из пп.1-19 с последующей стадией (S6):
(S6) - взаимодействие глюкопиранозилзамещенного производного бензилбензола общей формулы III с восстановителем.
Текст
СПОСОБ ПОЛУЧЕНИЯ ГЛЮКОПИРАНОЗИЛЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ БЕНЗИЛБЕНЗОЛА Изобретение относится к способам получения глюкопиранозилзамещенного производного бензилбензола общей формулы III в которой R1 отвечает определению согласно п.1 формулы изобретения.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Изобретение относится к способу получения глюкопиранозилзамещенных производных бензилбензола формулы III в которой R1, R2 и R' отвечают приведенным ниже определениям. Помимо этого настоящее изобретение относится к способам получения промежуточных соединений и исходных веществ, относящихся к способу получения глюкопиранозилзамещенных производных бензилбензола. Предпосылки к созданию изобретения В международной заявке на изобретение WO 2005/092877 описаны глюкопиранозилзамещенные производные бензола общей формулы в которой группы R1-R6, а также R7a, R7b, R7c отвечают приведенным в цитируемом документе определениям. Подобные соединения обладают ценным ингибирующим эффектом в отношении натрийзависимого котранспортера глюкозы SGLT, в особенности, SGLT2. В международной заявке на изобретение WO 2006/117359 описана кристаллическая форма 1-хлор 4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3-илокси)бензил]бензола и ее синтез. В международной заявке на изобретение WO 2006/120208 описаны несколько способов синтеза соединения в котором R1 обозначает циклобутил, циклопентил, циклогексил, R-тетрагидрофуран-3-ил, Sтетрагидрофуран-3-или или тетрагидропиран-4-ил. Пример XVIII цитируемого документа относится к синтезу 1-хлор-4-(-D-глюкопираноз-1-ил)-2-(4-(S)-тетрагидрофуран-3-илоксибензил)бензола. Согласно варианту Е цитируемого примера, (S)-3-[4-(5-иод-2-хлорбензил)фенокси]тетрагидрофуран вводят во взаимодействие с i-PrMgCl/LiCl в тетрагидрофуране (ТГФ) при низких температурах с целью получения металлоорганического промежуточного соединения. На стадии разложения остатков реагентов водной фазой добавляют водный раствор NH4Cl (25 мас. %). После добавления метил-трет-бутилового эфира органический слой, содержащий промежуточный продукт, отделяют. При попытках осуществления данного способа в более крупном масштабе было обнаружено, что разделение водной и органической фаз может вызвать затруднения в результате, например, образования трех фаз. Цель настоящего изобретения Целью настоящего изобретения является нахождение предоставляющих преимущества способов получения глюкопиранозилзамещенных производных бензилбензола формулы III, в частности, надежных способов, посредством которых продукт может быть получены с высокими выходами, энантиомерной или диастереомерной чистотой и которые позволяют осуществить изготовление продукта в коммерчески пригодных масштабах с низкими техническими издержками и высоким выходом за один проход в единицу времени. Другой целью настоящего изобретения является нахождение коммерчески осуществимого способа получения глюкопиранозилзамещенных производных бензилбензола формулы III, включающего стадию разложения остатков реагентов водной фазой, который позволяет осуществить надежное и легкое разделение водной и органической фаз. Еще одной целью настоящего изобретения является нахождение способа получения исходных веществ для вышеупомянутого способа изготовления. Прочие цели настоящего изобретения должны быть очевидны опытному специалисту в соответствующей области исходя из вышеизложенного и нижеследующего описания. Объект настоящего изобретения В первом варианте осуществления настоящего изобретения его объектом является способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы IIIR' обозначает водород или (С 1-С 6)алкил,включающий стадии (S2), (S3), (S4) и (S5):(S2): взаимодействие металлоорганического соединения формулы VI в которой R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает Cl, Br, I или органический остаток, с глюконолактоном общей формулы IV в которой R2 отвечает вышеприведенному определению, в органическом растворителе или смеси двух или более органических растворителей,(S3): добавление водного раствора, содержащего одну или более кислот, таким образом, чтобы реакционная смесь образовала водную фазу и органическую фазу, в результате чего органическая фаза имела бы рН в диапазоне от 1 до 6,(S4): отделение органической фазы, содержащей полученный на стадии (S2) аддукт от водной фазы,и(S5): взаимодействие полученного аддукта с водой, или спиртом R'-OH, где R' обозначает (С 1-С 6) алкил, или их смесью в присутствии одной или более кислот. Было обнаружено, что разделение водной и органической фаз на стадии (S3) протекает более надежным и, как следствие, более пригодным для производства в коммерческих масштабах образом, когда органическая фаза характеризуется рН в диапазоне примерно от 0 до 7. Таким образом, на стадии (S3) следует добавлять к реакционной смеси водный раствор, содержащий одну или более кислот, таким образом, чтобы органическая фаза имела рН в диапазоне примерно от 0 до 7. В результате усовершенствования в разделении фаз весь способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы III показал себя надежным способом, с помощью которого можно получить продукт с хорошими выходами и высокой чистотой в коммерчески пригодных масштабах. Дополнительным преимуществом является то, что смены растворителей в ходе осуществления способа сводятся к минимуму и что время осуществления способа в целом минимизируется. В описанном выше варианте Е примера XVIII международной заявки на изобретение WO 2006/120208 также осуществлялась стадия разложения остатков реагентов водной фазой с помощью водного раствора NH4Cl (25 мас.%). Но при попытках увеличить масштабы осуществления данного способа было обнаружено, что разделение водной и органической фаз может вызвать затруднения в результате,например, образования трех фаз. Согласно данному примеру, измеренный в органической фазе рН составляет 9-10, что находится вне предпочтительного диапазона рН согласно стадии (S3) настоящего изобретения. В другом варианте осуществления настоящего изобретения его объектом является способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы II в которой R1 обозначает (R)-тетрагидрофуран-3-ил или (S)-тетрагидрофуран-3-ил, где глюкопиранозилзамещенное производное бензилбензола общей формулы IIIR' обозначает водород или (С 1-С 6)алкил,получают согласно вышеприведенному способу с последующей стадией (S6):(S6) взаимодействие глюкопиранозилзамещенного производного бензилбензола общей формулы III с восстановителем. Подробное описание изобретения Если иное не оговорено специально, группы, остатки и заместители, в частности, R1, R2, R', М, X,отвечают выше- и нижеприведенным определениям. В том случае, если остатки, заместители или группы встречаются в соединении несколько раз, они могут иметь одинаковые или различные значения. В способах и соединениях согласно настоящему изобретению предпочтительными являются следующие значения групп и заместителей: R' предпочтительно обозначает водород, метил или этил, наиболее предпочтительно, метил. Исходное вещество формулы VI может быть получено с помощью известных специалисту в соответствующей области способов. Способ согласно настоящему изобретению предпочтительно включает дополнительную стадию (S1) с целью получения металлоорганического соединения формулы VI: (S1): введение соединения формулы V в которой R1 отвечает вышеприведенному определению, а X обозначает Br, I или трифлат, во взаимодействие с магнием, литием, магниевым реактивом Гриньяра или литийорганическим соединением в органическом растворителе или смеси двух или более органических растворителей, с целью получения металлоорганического соединения формулы VI в котором R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает Cl, Br, I или органический остаток. В нижеследующем описании способы согласно настоящему изобретению описаны в подробностях. Глюкопиранозилзамещенное производное бензилбензола III может быть получено из Dглюконолактона или его производного посредством взаимодействия требуемого производного бензилбензола в форме металлоорганического соединения формулы VI (схема 1). Схема 1. Добавление металлоорганического соединения к глюконолактону На стадии (S1) получают металлоорганическое соединение формулы VI посредством взаимодействия соединения формулы V с магнием, литием, магниевым реактивом Гриньяра или литийорганическим соединением в органическом растворителе или смеси двух или более органических растворителей. Реакция является так называемой реакцией обмена галогена на металл или встраивания металла по связи углерод-галоген. Группа X предпочтительно обозначает иод. Реакция может быть осуществлена с элементарным магнием или литием. В том случае, когда самопроизвольной реакции не происходит, могут быть добавлены промоторы, такие как иод, тетрахлорметан или подметан. Альтернативно, реакция может быть осуществлена с литийорганическим соединением, таким как (С 1-С 6)алкиллитий, предпочтительно н-, втор- или трет-бутиллитий. Предпочтительно, реакцию осуществляют с магниевым реактивом Гриньяра, таким как (С 3-С 4)алкил- или арилмагнийхлориды или бромиды, например, изопропил или вторбутилмагнийхлорид или -бромид, трет-бутилмагнийхлорид или -бромид, фенилмагнийхлорид или-бромид. Получаемые таким образом соединения, функционализированные магнием или литием, могут быть необязательно подвергнуты трансметаллированию с помощью солей металлов, таких как, например, трихлорид церия, хлорид или бромид цинка, хлорид или бромид индия или хлорид или бромид ме-3 022032 ди, с целью получения альтернативных металлоорганических соединений (VI), подходящих для присоединения. В качестве промоторов в начале, в продолжении или в конце осуществления стадии (S1) могут быть добавлены дополнительные соли, такие как бромид лития и/или хлорид лития. Альтернативно, подобные промоторы могут быть добавлены в начале или в продолжении стадии (S2). Наиболее предпочтительно, соединение формулы V вводят во взаимодействие со смесью изопропилмагнийхлорида и хлорида лития. Мольное соотношение реактива Гриньяра, в частности (С 3-С 4)алкилмагнийхлорида или бромида, например iPrMgCl, и бромида лития и/или хлорида лития, в частности LiCl, предпочтительно находится в диапазоне 1:10 до 10:1, наиболее предпочтительно составляет примерно 1:1. Смесь iPrMgCl :LiCl состава 1:1 коммерчески доступна, например, в концентрации примерно от 12 до 16% мас./мас. в тетрагидрофуране, и также известна как "раствор Турбогриньяр". Предпочтительные количества магния,лития, магниевого реактива Гриньяра или литийорганического соединения по отношению к соединению формулы V находятся в пределах примерно от 0,5 до 2 моль, наиболее предпочтительно приблизительно эквимолярны. Было обнаружено, что количества ниже примерно 1 моль приводят к потерям в выходе, а количества свыше примерно 1 моль приводят к образованию нежелательных побочных продуктов. Взаимодействие осуществляют в органическом растворителе или смеси двух или более органических растворителей. Предпочтительные растворители выбраны из группы включающей тетрагидрофуран, 2 метилтетрагидрофуран, трет-бутилметиловый эфир (ТБМЭ), диэтиловый эфир, гептан, толуол, бензол,диоксан, метилциклогексан, гексан, диметилсульфоксид, дихлорметан и хлороформ. Наиболее предпочтительными растворителями являются тетрагидрофуран и 2-метилтетрагидрофуран. Реакция может быть осуществлена в диапазоне температур от -100 до +50 С, предпочтительно от -70 до 10 С, наиболее предпочтительно от -40 до -10 С. Ход реакции может отслеживаться, например, с помощью методов высокоэффективной жидкостной хроматографии, инфракрасной (ИК) спектроскопии в ближней ИК-области,ИК-спектроскопии. Предпочтительное время взаимодействия находится в диапазоне от 10 до 600 мин. Продукт реакции формулы VI может быть выделен, хотя подобное выделение не является необходимым. Вышеприведенные взаимодействия предпочтительно осуществляют в атмосфере инертного газа. Предпочтительными инертными газами являются аргон и азот. На стадии (S2) глюконолактон формулы IV добавляют к соединению формулы VI в органическом растворителе или смеси двух или более органических растворителей. Предпочтительными растворителями являются растворители, описанные в связи со стадией (S1). Предпочтительно, глюконолактон добавляют к получаемой на стадии (S1) реакционной смеси. Заместители R2 предпочтительно обозначают триметилсилил, триэтилсилил, триизопропил, трибутилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, ацетил, бензил, бензоил, аллил, метоксиметил, тетрагидропиранил. Наиболее предпочтительно R2 обозначает триметилсилил. Предпочтительные количества глюконолактона по отношению к металлоорганическому соединению формулы VI находятся в пределах примерно от 0,8 до 3 моль, более предпочтительно примерно от 1 до 2 моль, наиболее предпочтительно примерно 1,06 моль. Взаимодействие может быть осуществлено в диапазоне температур от-100 до +50 С, предпочтительно от -70 до 10 С, наиболее предпочтительно от -20 до -5 С. Ход реакции может, например, отслеживаться с помощью методов ВЭЖХ, спектроскопии ядерного магнитного резонанса (ЯМР), газовой хроматографии (ГХ), спектроскопии ближней ИК-области или ИК-спектроскопии. Предпочтительное время взаимодействия находится в пределах от 15 до 600 мин. Продукт реакции формулы VI может быть выделен. Вышеописанные взаимодействия предпочтительно осуществляют в атмосфере инертного газа. Предпочтительными инертными газами являются аргон и азот. На стадии (S3) к реакционной смеси, получаемой на стадии (S2), добавляют водный раствор, содержащий одну или более кислоту, таким образом, чтобы реакционная смесь образовала водную фазу и органическую фазу, причем органическая фаза приобрела бы рН в диапазоне примерно от 0 до 7. В принципе, для достижения искомого диапазона рН могут быть применены все неорганические или органические кислоты. Предпочтительными кислотами являются органические кислоты, такие как лимонная кислота, винная кислота, щавелевая кислота, янтарная кислота, уксусная кислота, хлоруксусная кислота,дихлоруксусная кислота или трифторуксусная кислота, или неорганические кислота, такие как соляная кислота, серная кислота или азотная кислота. Кислота может представлять собой аммонийную соль, такую как хлорид аммония. Кислота может являться частью буферной системы, такой как уксусная кислота/ацетат (например, уксусная кислота и ацетат натрия), дигидрофосфат/гидрофосфат (например,KH2PO4/Na2HPO4), трис(трис(гидроксиметил)аминометан) или HEPES (2-(4-(2-гидроксиэтил)-1 пиперазинил)этансульфокислота). Более предпочтительными кислотами являются лимонная кислота и уксусная кислота, в особенности лимонная кислота. Водный раствор может дополнительно содержать смеси вышеупомянутых кислот или, дополнительно, соли, например, хлорид натрия, хлорид калия, бромид натрия, бромид калия, хлорид лития, бромид лития или их смеси. Количество одной или более кислот в водном растворе предпочтительно таково, чтобы реакционная смесь образовывала водную фазу и органическую фазу, причем органическая фаза имела бы рН в диапазоне примерно от 0 до 7. Более предпочтительный диапазон рН составляет примерно от 1 до 6, еще более предпочтительно примерно от 1 до 4, наиболее предпочтительно примерно от 2 до 3. Было обнаружено, что рН, принадлежащий к предпоч-4 022032 тительному диапазону рН, как он описан выше, позволяет хорошо осуществить разделение водной и органической фаз. Предполагается, не связывая себя какой-либо теорией, что при величинах рН в предпочтительных диапазонах промежуточный продукт характеризуется наибольшей устойчивостью. При величинах рН, ниже предпочтительных, наблюдалось возникновение трех фаз. Опять же, не связывая себя какой-либо теорией, предполагается, что при низких величинах рН защитные группы в глюкопиранозильном цикле могут быть расщеплены, в результате чего лишенный защиты промежуточный продукт может образовать дополнительную фазу. При величинах рН выше предпочтительных разделение фаз, как было обнаружено, затруднено или невозможно вследствие образования эмульсий. Величина рН может быть измерена в органической фазе с помощью способов, хорошо известных химикам, таких как электроды для измерения рН и рН-индикаторы, включая индикаторную бумагу и тестовые полоски. Предпочтительно, величину рН измеряют при данной температуре органической фазы, более предпочтительно при температуре между примерно 0 и 40 С, еще более предпочтительно между примерно 10 и 30 С, например, при комнатной температуре (примерно от 20 до 25 С). Величина рН может быть измерена в органической фазе после разделения фаз, например, сразу после разделения или несколькими часами позднее. Предпочтительная концентрация одной или более кислот, таких как, например, лимонная кислота, в водном растворе находится в пределах примерно от 2 до 30 мас.%, более предпочтительно примерно от 5 до 20 мас.%, наиболее предпочтительно примерно 10 мас.%. Отношение объема водного раствора к объему реакционной смеси, получаемой на стадии (S2), предпочтительно находится в диапазоне примерно от 0,1 до 5, более предпочтительно примерно от 0,2 до 2, еще более предпочтительно примерно от 0,2 до 1, наиболее предпочтительно примерно от 0,3 до 0,6, например примерно 0,4. Водный раствор может быть добавлен к реакционной смеси предпочтительно при температуре в диапазоне примерно от -50 до 40 С, еще более предпочтительно примерно от -10 до 25 С. Добавление водного раствора может быть осуществлено предпочтительно в продолжение по крайней мере 15 мин, еще более предпочтительно 60 мин. Для достижения еще лучшего разделения водной и органической фаз может иметь преимущество добавление на данной стадии взаимодействия или в ходе предшествующих стадий взаимодействия (S1) или (S2) одного или более дополнительных органических растворителей к реакционной смеси. Предпочтительные дополнительные органические растворители могут быть выбраны из группы, включающей 2 метилтетрагидрофуран, толуол, изопропилацетат, этилацетат, н-бутилацетат, трет-бутилметиловый эфир,н-гептан, ацетон, метилэтилкетон, метилизобутилкетон, диоксан, тетрагидрофуран, метилциклогексан и гексан. Наиболее предпочтительным дополнительным органическим растворителем является 2 метилтетрагидрофуран. Количество дополнительного органического растворителя по отношению к общему количеству органической фазы реакционной смеси предпочтительно находится в диапазоне примерно от 2 до 60 мас.%, более предпочтительно примерно от 5 до 50 мас.%, еще более предпочтительно от примерно 10 мас.% до 40 мас.%, наиболее предпочтительно примерно от 15 до 35 мас.%. Перед добавлением дополнительного органического растворителя объем органической фазы может быть уменьшен посредством перегонки реакционной смеси, предпочтительно при пониженном давлении. Отгонку предпочтительно осуществляют при температуре меньшей или равной примерно 35 С. Получаемая после осуществления стадии (S3) реакционная смесь демонстрирует присутствие водной фазы и органической фазы, причем продукт взаимодействия согласно стадии (S2) преимущественно находится в органической фазе. На стадии (S4) органическую фазу, содержащую получаемый на стадии (S2) аддукт, отделяют от водной фазы. Способы разделения жидких фаз хорошо известны специалисту в соответствующей области. Разделение фаз предпочтительно осуществляют при температуре в диапазоне примерно от -20 до 50 С, более предпочтительно примерно от 0 до 30 С. Получаемая органическая фаза включает большую часть получаемого на стадии (S2) аддукта. Водная фаза может быть однократно или многократно промыта органическим растворителем или смесью органических растворителей, и органические фазы могут быть объединены. Предпочтительные органические растворители описаны выше в связи со стадиями(S1), (S2) и (S3). Перед осуществлением следующей стадии взаимодействия часть объема или полный объем одного или более органических растворителей предпочтительно отгоняют, предпочтительно, при пониженном давлении. Отгонку предпочтительно осуществляют при температуре меньшей или равной примерно 35 С. На стадии (S5) получаемый на стадии (S4) аддукт вводят во взаимодействие с водой или спиртомR'-OH, где R' обозначает (С 1-С 6)алкил, или их смесью в присутствии одной или более кислот. Спирт R'OH предпочтительно выбран из группы, включающей метанол, этанол, 1-пропанол, 2-пропанол, нбутанол, трет-бутанол или их смеси. Предпочтительным спиртом является метанол. Спирт предпочтительно задействуют в количестве, превышающем эквимолярное количество, таким образом, что он выступает также и в качестве растворителя. В принципе, на данной стадии взаимодействия могут быть применены все неорганические или органические кислоты. При добавлении одной или более кислот следует предпочтительно достичь рН ниже примерно 7. Предпочтительный диапазон рН составляет примерно от 0 до 7, более предпочтительно примерно от 0 до 4, еще более предпочтительно примерно от 1 до 2. Кислоту предпочтительно выбирают из группы, включающей соляную кислоту, серную кислоту,азотную кислоту, уксусную кислоту, трифторуксусную кислоту, лимонную кислоту, винную кислоту,щавелевую кислоту и янтарную кислоту. Более предпочтительной кислотой является соляная кислота,которая может быть задействована, например, в виде раствора HCl в этаноле, HCl в пропаноле, HCl в диоксане. Альтернативно, может быть использован газообразный HCl. Предпочтительная температура взаимодействия находится в диапазоне примерно от -50 до 50 С, более предпочтительно примерно от 0 до 30 С, наиболее предпочтительно примерно от 15 до 25 С. Преимущества в отношении полного превращения в продукт формулы III достигаются посредством последующей перегонки, предпочтительно при пониженном давлении и предпочтительно при температуре меньшей или равной примерно 35 С. Было обнаружено, что улучшение полноты превращения достигается при добавлении к реакционной смеси в ходе перегонки дополнительного количества спирта R'-OH. Взаимодействие предпочтительно завершается в пределах 120 мин. Ход взаимодействия может отслеживаться с помощью, например,ВЭЖХ. После завершения взаимодействия остающуюся в реакционной смеси кислоту предпочтительно частично или целиком нейтрализуют посредством добавления одного или более оснований. Предпочтительная величина рН после добавления основания предпочтительно находится в диапазоне от, примерно,5 до 6. Предпочтительными основаниями являются, например, триэтиламин, аммиак, триметиламин, налкиламины (такие как, например, метиламин, этиламин), диизопропилэтиламин (DIPEA), карбонат натрия, гидрокарбонат натрия, карбонат калия, этаноламин, 1,4-диазабицико[2.2.2]октан (DABCO), 1,8 диазабицикло[5.4.0]ундец-7-ен (ДБУ). Наиболее предпочтительным основанием является триэтиламин. Предпочтительно отгоняют растворитель частично или целиком, предпочтительно при пониженном давлении. Для достижения преимуществ добавляют растворитель или смесь растворителей и снова отгоняют, по крайней мере, частично. Добавление растворителя с последующей отгонкой может быть повторено один или более раз с целью снижения содержания воды в реакционной смеси. Растворитель предпочтительно выбирают из группы, включающей ацетонитрил, пропионитрил, тетрагидрофуран и диоксан. В конце может быть добавлен другой растворитель или смесь растворителей. Предпочтительный растворитель выбирают из группы, включающей хлористый метилен, этилацетат, изопропилацетат, хлороформ,1,2-дихлорэтан, диметоксиэтан, N,N'-диметилформамид, н-метилпирролидон, диметилсульфоксид, тетрагидрофуран, 2-метилтетрагидрофуран, диоксан, диэтиловый эфир и трет-бутилметиловый эфир. Предпочтительным растворителем является хлористый метилен. Достигаются преимущества при определении содержания воды в получаемой в результате реакционной смеси, например, с помощью титрования по Карлу Фишеру, ГХ, ЯМР-спектроскопии, ИК-спектроскопии и спектроскопии в ближней ИК-области. Содержание воды в получаемой в результате реакционной смеси предпочтительно составляет менее 5000 миллионных долей, более предпочтительно менее 2000 м.д. Производные глюкозы формулы II могут быть синтезированы посредством стадии (S6), которая представляет собой восстановление аномерной связи углерод-кислород соединения III (схема 2). Схема 2. Восстановление соединения IIIR', R1 и R2 отвечают приведенным выше определениям. Предпочтительным значением R2 является водород или триС 1-С 3)алкил)силил, такой как триметилсилил. R' предпочтительно обозначает водород или (С 1-С 4)алкил, в частности, метил или этил. На стадии (S6) восстановление может быть проведено с одним или более восстановителями в присутствии одной или более кислот Льюиса или без кислоты Льюиса. Подходящие восстановители включают, например, силаны (такие как, например, триэтилсилан, 1,1,3,3-тетраметилдисилоксан (TMDS),трипропилсилан, триизопропилсилан (TIPS), дифенилсилан), комплексы боранов (такие как, например,цианоборгидрид натрия (NaCNBH3, боргидирид цинка) или гидриды алюминия (такие как, например,алюмогидрид лития (LiAlH4), диизобутилалюминийгидрид или триизопропилалюмогидрид лития(Li(iPr)3AlH. Предпочтительным восстановителем является триэтилсилан. Количество восстановителя по отношению к соединению формулы III предпочтительно находится в диапазоне примерно от 1 до 5 моль, более предпочтительно примерно от 2 до 4 моль, наиболее предпочтительно примерно 2,7 моль. Подходящими кислотами Льюиса являются, например, хлорид алюминия, эфират трифторида бора, триметилсилилтрифлат, тетрахлорид титана, тетрахлорид олова, трифлат скандия, иодид цинка или трифлат меди (II). Предпочтительной кислотой Льюиса является хлорид алюминия. Количество кислоты Льюиса по отношению к соединению формулы III предпочтительно находится в диапазоне примерно от 1 до 5 моль, более предпочтительно примерно от 2 до 4 моль, наиболее предпочтительно примерно 2,1 моль. Реакцию осуществляют в органическом растворителе или в смеси органических растворителей. Предпочтительными растворителями являются, например, ацетонитрил, дихлорметан, пропионитрил, тетрагидрофуран или диоксан. Предпочтительными растворителями являются ацетонитрил, хлористый мети-6 022032 лен и их смеси. Предпочтительные температуры взаимодействия находятся в пределах между примерно 50 С и 50 С, более предпочтительно между примерно 0 и 30 С, наиболее предпочтительно между примерно 10 до 20 С. Предпочтительно получаемую на стадии (S4) реакционную смесь добавляют к смеси одной или более кислот Льюиса, одного или более органических растворителей одного или более восстановителей. Добавление реакционных компонентов предпочтительно осуществляют в диапазоне продолжительности примерно от 15 до 600 мин, более предпочтительно в диапазоне между 45 и 120 мин. Реакционную смесь предпочтительно перемешивают, например, в течение примерно от 0 до 600 мин,более предпочтительно в течение примерно от 30 до 120 мин при температуре в диапазоне примерно от 80 до 50 С, предпочтительно примерно от 0 до 35 С, наиболее предпочтительно примерно от 15 до 25 С. Альтернативно, на стадии (S6) в качестве восстановителя может быть использован водород. Данная реакция может быть осуществлена в присутствии катализатора на основе переходного металла, такого как палладий на угле, никель Ренея, оксид платины, оксид палладия. Подходящие условия взаимодействия и растворители для гидрирования известны специалистам в соответствующей области. Например,подходящими растворителями являются тетрагидрофуран, этилацетат, метанол, этанол, вода или уксусная кислота, подходящие температуры взаимодействия лежат в диапазоне от примерно -40 до 100 С, а подходящее давление водорода находится в диапазоне примерно от 1 до 10 тор. Вышеописанные стадии восстановительного синтеза предпочтительно осуществляют в атмосфере инертного газа. Предпочтительными инертными газами являются аргон и азот. После завершения взаимодействия к реакционной смеси добавляют воду. В продолжение добавления внутренняя температура предпочтительно находится в диапазоне от 20 до 40 С. Предпочтительный временной интервал добавления составляет предпочтительно от 15 до 120 мин. Вместо воды может быть добавлен водный раствор. Подходящими водными растворами, например, являются растворы солей, такие как раствор хлорида натрия (рассол), раствор хлорида калия, NaHCO3, раствор Na2CO3 или раствор К 2 СО 3. Альтернативно, могут быть задействованы водные буферные растворы, такие как растворы хлорида аммония, уксусной кислоты/ацетата, KH2PO4/Na2HPO4, трис (трис(гидроксиметил)аминометан),HEPES (2-(4-(2-гидроксиэтил)-1-пиперазинил)этансульфокислота). Согласно предпочтительному варианту осуществления настоящего изобретения реакционную смесь частично перегоняют при пониженном давлении или при атмосферном давлении и при температуре меньшей или равной примерно 35 С, более предпочтительно меньшей или равной примерно 55 С. После этого реакционную смесь охлаждают примерно до температуры от 30 до 35 С и разделяют водную фазу и органическую фазу. Водная фаза может быть однократно или многократно промыта органическим растворителем или смесью органических растворителей, и органические фазы могут быть объединены. Достигаются преимущества, если к органической фазе добавляют органический растворитель или смесь органических растворителей и отгоняют растворители частично или целиком, предпочтительно при пониженном давлении и при температуре меньшей или равной примерно 35 С, более предпочтительно, меньшей или равной примерно 40 до 50. Подходящими растворителями являются толуол, изопропилацетат, н-бутилацетат, этилацетат, трет-бутилметиловый эфир, -гептан, ацетон, метилэтилкетон,метилизобутилкетон, диоксан, тетрагидрофуран, бензол, метилциклогексан, гексан, 2-метилтетрагидрофуран или их смеси. Толуол является предпочтительным растворителем. Продукт может быть получен посредством кристаллизации, например, как это описано в международной заявке на изобретение WO 2006/117359 или как это описано здесь ниже. Альтернативно на дополнительной стадии перед кристаллизацией к органической фазе добавляют при температуре, меньшей или равной примерно от 40 до 50 С, органический растворитель или смесь органических растворителей. Подходящими растворителями являются ацетонитрил, пропионитрил, толуол, изопропилацетат, н-бутилацетат, этилацетат, трет-бутилметиловый эфир, н-гептан, ацетон, метилэтилкетон, метилизобутилкетон, диоксан, тетрагидрофуран, бензол, метилциклогексан, гексан, 2 метилтетрагидрофуран или их смеси. Ацетонитрил является предпочтительным растворителем. После этого процентное содержание ацетонитрила в органической фазе определяют с помощью метода ГХ (газовой хроматографии). Процентное содержание ацетонитрила находится в пределах примерно от 10 до 40 предпочтительно между примерно 20 и 30%. После этого к органической фазе в температурном диапазоне примерно от 40 до 48 С, предпочтительно при температуре около 45 С добавляют затравочные кристаллы. Достигаются преимущества, если в данном температурном диапазоне продолжают перемешивание в течение примерно от 10 до 240 мин, более предпочтительно от 15 до 120 мин. После этого органическую фазу охлаждают от интервала температур примерно от 40 до 48 С до интервала температур примерно от 15 до 20 С в течение промежутка времени от 30 до 120 мин, предпочтительно примерно 60 мин. После этого к органической фазе добавляют воду или водный раствор. Добавление вод или водного раствора предпочтительно осуществляют в интервале температур примерно от 15 до 25 С, предпочтительно 20 С. Помимо этого, добавление предпочтительно осуществляют в продолжение примерно от 30 до 120 мин, предпочтительно примерно 60 мин. Подходящими водными растворами являются, например,-7 022032 солевые растворы, такие как раствор хлорида натрия (рассол), раствор хлорида калия, раствор NaHCO3,раствор Na2CO3 или раствор K2CO3, или же водный буферный раствор. Водные буферные растворы представляют собой, например, растворы хлорида аммония, уксусной кислоты/ацетата, KH2PO4/Na2HPO4 трис(трис(гидроксиметил)аминометан), HEPES (2-(4-(2-гидроксиэтил)-1-пиперазинил)этансульфокислота). После этого предпочтительно смесь охлаждают до интервала температур примерно от 0 до 5 С в продолжение примерно от 45 до 120 мин, предпочтительно примерно 60 мин. Затем предпочтительно продолжают перемешивание смеси в течение примерно от 3 до 24 ч, предпочтительно примерно 12 ч в температурном диапазоне примерно от 0 до 5 С. После этого собирают продукт с помощью подходящих способов фильтрования или центрифугирования, после чего промывают собранный продукт органическим растворителем. Подходящими растворителями являются ацетонитрил, пропионитрил, толуол, изопропилацетат, н-бутилацетат, этилацетат, третбутилметиловый эфир, н-гептан, ацетон, метилэтилкетон, метилизобутилкетон, диоксан, тетрагидрофуран, бензол, метилциклогексан, гексан, 2-метилтетрагидрофуран или их смеси. Предпочтительным растворителем является толуол. Достигаются преимущества, если после этого сушат выделенный продукт с помощью подходящего оборудования для сушки в продолжение примерно от 1 до 192 ч, предпочтительно примерно от 5 до 96 ч при температурах от примерно 20 до 120 С, предпочтительно примерно от 20 до 70 С. Сушку предпочтительно осуществляют при пониженном давлении и в атмосфере инертного газа. Предпочтительными инертными газами являются аргон и азот. Глюконолактон формулы IV может быть синтезирован исходя из D-(+)-глюконо-дельта-лактона формулы IVa (схема 3). Схема 3. Синтез глюконолактона IV Способы преобразования D-(+)-глюконо-дельта-лактона формулы IVa с целью получения искомого глюконолактона формулы IV, в котором R2 отвечает приведенному выше определению, хорошо известны специалисту в соответствующей области. Ниже описан в подробностях предпочтительный способ, в котором R2 обозначает триметилсилил. Суспензию D-(+)-глюконо-дельта-лактона формулы IV в органическом растворителе или смеси органических растворителей, одно или несколько оснований и один или несколько катализаторов обрабатывают одним или несколькими силилирующими агентами. Предпочтительными органическими растворителями являются тетрагидрофуран, 2-метилтетрагидрофуран, диоксан или также трет-бутилметиловый эфир (ТБМЭ), диэтиловый эфир, гептан, толуол, бензол или их смеси. Предпочтительными основаниями являются 4-метилморфолин, диизопропилэтиламин (DIPEA), триэтиламин (ТЭА), NaHCO3, K2CO3,Na2CO3, KOH, NaOH. Предпочтительными катализаторами являются 4-диметиламинопиридин, пиридин,триэтиламин. Предпочтительными силилирующими агентами являются хлортриметилсилан, гексаметилдисилазан, бис(триметилсилил)ацетамид, триметилсилилимидазол, триметилсилилдиметилдиамин, N,N'бистриметилсилилмочевина или их смеси. Основание предпочтительно задействуют в мольном избытке,более предпочтительно в диапазоне примерно от 4 до 10 моль, наиболее предпочтительно примерно от 5 до 8 моль по отношению к исходному веществу формулы IV. Предпочтительное количество катализатора находится в диапазоне примерно от 0,001 до 0,5 моль, более предпочтительно примерно от 0,01 до 0,2 моль по отношению к исходному веществу формулы IV. Предпочтительное количество силилирующего агента находится в диапазоне примерно от 4 до 10 моль по отношению к исходному веществу формулыIV. Взаимодействие предпочтительно осуществляют при температуре в пределах примерно от -50 до 100 С, более предпочтительно примерно от -10 до 30 С. Добавление силилирующего агента предпочтительно осуществляют в продолжение примерно от 1 до 6 ч. После завершения добавления реакционную смесь перемешивают предпочтительно в продолжение примерно от 1 до 6 ч при температуре примерно от -50 до 100 С, более предпочтительно примерно от -10 до 30 С, в частности от 0 до 20 С. Преобразование может отслеживаться с помощью известных способов, таких как ВЭЖХ-анализ, ГХ, ЯМР- и ИКспектроскопия. После этого добавляют органический растворитель или смесь органических растворителей и охлаждают смесь предпочтительно до температуры примерно от 0 до 10 С. Предпочтительными органическими растворителями являются н-гептан, 2-метилтетрагидрофуран, диоксан, третбутилметиловый эфир, диэтиловый эфир, толуол, бензол, изопропилацетат, н-бутилацетат, этилацетат. После этого добавляют воду или водный раствор, предпочтительно, при температуре в диапазоне 0-10 С. Водный раствор может содержать соль, как-то раствор хлорида натрия, хлорида калия, NaHCO3, Na2CO3,K2CO3, или буферную систему, такую как хлорид аммония, уксусную кислоту, ацетат, дигидрофосфат,-8 022032 гидрофосфат, трис(трис(гидроксиметил)аминометан), HEPES (2-(4-(2-гидроксиэтил)-1-пиперазинил) этансульфокислота). После завершения добавления может быть продолжено перемешивание смеси,предпочтительно при внутренней температуре в диапазоне примерно от -50 до 100 С, более предпочтительно примерно от 0 до 35 С. После прекращения перемешивания разделяют фазы и последовательно однократно или многократно промывают органический слой водой или водным раствором, как это описано здесь выше. После этого отгоняют органический растворитель предпочтительно при температуре меньшей или равной примерно 40 С, в частности при пониженном давлении. К остатку добавляют один или несколько органических растворителей. Предпочтительными органическими растворителями являются н-гептан, метилциклогексан, трет-бутилметиловый эфир, 2-метилтетрагидрофуран, этилацетат,изопропилацетат, н-бутилацетат, толуол, бензол. Получаемый таким образом раствор может быть профильтрован. После этого отгоняют растворитель, предпочтительно при температуре, меньшей или равной примерно 40 С, предпочтительно при пониженном давлении. Содержание воды в остатке может быть определено с помощью анализа по Карлу Фишеру, ГХ, ЯМР- или ИК-спектроскопии. Продукт получают в виде маслянистого вещества. Соединение формулы V может быть синтезировано исходя из кетона формулы VII посредством восстановления (схема 4). Схема 4. Синтез соединения формулы V Способы восстановления кетона формулы VII с целью получения искомого соединения формулы V,в котором X представляет собой Br, I или трифлат, a R1 отвечает приведенному выше определению, хорошо известны специалисту в соответствующей области. Ниже описан в подробностях предпочтительный способ, в котором X обозначает иод. К раствору кетона формулы VII и кислоты Льюиса в органическом растворителе или смеси органических растворителей добавляют восстановитель. Подходящими восстановителями являются, например,силаны, такие как 1,1,3,3-тетраметилдисилоксан, триэтилсилан и триизопропилсилан, или боргидриды,такие как NaBH4, или алюмогидриды, такие как LiAlH4. Предпочтительными кислотами Льюиса являются хлорид алюминия, BF3OEt2, трис(пентафторфенил)боран, трифторуксуная кислота, соляная кислота или InCl3. Подходящими органическими растворителями являются, например, галогенированные углеводороды, такие как дихлорметан и 1,2-дихлорэтан, толуол, бензол, гексан, ацетонитрил и их смеси, наиболее предпочтительно толуол. Температура взаимодействия предпочтительно находится в диапазоне примерно от -30 до 80 С, предпочтительно от 10 до 30 С, еще более предпочтительно примерно от 0 до 25 С. Количество восстановителя, равно как и количество кислоты Льюиса предпочтительно находится в диапазоне примерно от 1 до 2 моль, более предпочтительно примерно 1,2 моль по отношению к кетону. Добавление осуществляют предпочтительно в продолжение примерно от 1 до 5 ч, более предпочтительно в пределах между примерно 1 и 2 ч. После завершения добавления смесь перемешивают в течение предпочтительно дополнительных 1-2 ч. Степень превращения может быть определена с помощью ВЭЖХ-анализа, ГХ, ЯМР- или ИК-спектроскопии. После этого предпочтительно разлагают всякий избыток восстановителя с помощью известных специалисту в соответствующей области способов. Например,обрабатывают реакционную смесь кетоном или спиртом, такими как ацетон, метилэтилкетон, метанол,этанол, 2-пропанол или н-бутанол и перемешивают в течение примерно от 1 до 5 ч, предпочтительно при температуре в диапазоне примерно от 20 до 30 С. Какое-либо остаточное содержание восстановителя может быть проанализировано посредством ГХ, ЯМР- или ИК-спектроскопии. Достигаются преимущества при включении дополнительной стадии реакции, на которой разлагают остатки реагентов в реакционной смеси с помощью водного раствора. Водный раствор (предпочтительный диапазон рН от 1 до 14) может содержать кислоту, такую как соляная кислота, серная кислота, азотная кислота, лимонная кислота, винная кислота, щавелевая кислота, янтарная кислота, уксусная кислота, трифторуксусная кислота,или буферную систему, такую как хлорид аммония, уксусная кислота/ ацетат, дигидрофосфат, гидрофосфат, трис (трис(гидроксиметил)аминометан), HEPES (2-(4-(2-гидроксиэтил)-1-пиперазинил)этансульфокислота), или основание, такое как NaHCO3, K2CO3, Na2CO3, KOH, NaOH. Реакционную смесь перемешивают, например, в течение примерно от 30 до 120 мин при внутренней температуре примерно от 40 до 60 С. После завершения фазы разделяют и целиком или частично отгоняют органический растворитель из органической фазы, предпочтительно при температуре меньшей или равной, примерно,80 С предпочтительно при пониженном давлении. Продукт формулы V может быть поучен посредством кристаллизации. Для этого добавляют к остатку органический растворитель или смесь органических растворителей, предпочтительно при температуре в диапазоне примерно от 50 до 80 С. Предпочтительной является смесь толуола и этанола, в которой предпочтительное массовое соотношение составляет примерно от 1:1 до 1:20, более предпочтительно примерно 1:8. Толуол может быть заменен ацетонитрилом,трет-бутилметиловым эфиром, н-гептаном, бензолом, метилциклогексаном, 2-метилтетрагидрофураном,изопропилацетатом (IPAc), этилацетатом (EtOAc) или н-бутилацетатом. Этанол может быть заменен 2-9 022032 пропанолом, н-бутанолом, ацетоном, метилэтилкетоном, водой или тетрагидрофураном. Реакционную смесь охлаждают, предпочтительно до температуры в диапазоне примерно от 0 до 50 С, более предпочтительно до примерно 20-40 С. Предпочтительно добавляют затравочные кристаллы, которые могут быть получены, например, согласно международной заявке на изобретение WO 2006/117359. Перемешивание при этой температуре может быть продолжено, например, в течение от 30 до 60 мин. После этого смесь может быть охлаждена далее, например, до температуры примерно от -10 до 5 С и подвергнута перемешиванию в течение дополнительного времени. Продукт формулы V может быть собран, например, на фильтре или на центрифуге, и промыт подходящим растворителем или смесью растворителей,таким как этанол. Продукт может быть высушен, предпочтительно при температуре меньшей или равной примерно 60 С, более предпочтительно примерно 40 С и при пониженном давлении. Кетон формулы VII может быть синтезирован исходя из кетона формулы VIII (схема 5). Схема 5. Синтез кетона формулы VII Способы замены группы Z на группу О-R1, в которой R1 отвечает приведенному выше определению, a Z предпочтительно обозначает фтор, в частности посредством нуклеофильного замещения хорошо известны специалисту в соответствующей области. Группа X отвечает вышеприведенному определению. Ниже предпочтительный способ описан в подробностях. Кетон формулы VIII вводят во взаимодействие с алканолом R1-OH, в котором R1 отвечает приведенному выше определению, в органическом растворителе или в смеси двух или более органических растворителей. Количество алканола R1-OH предпочтительно находится в диапазоне, примерно, от 1 до 2 моль, более предпочтительно 1,1 моль на моль кетона формулы VIII. Данное взаимодействие предпочтительно осуществляют в присутствии основания, такого как (С 1-С 4)алкоксиды щелочных металлов, карбонаты щелочных металлов, гидроксиды щелочных металлов, фосфаты щелочных металлов, триС 1-С 3)алкил) амины и другие азотсодержащие органические основания. Примерами предпочтительных оснований являются трет-бутилат лития, или натрия, или калия, карбонат натрия, или калия, или цезия, гидроксид натрия или калия, нейтральный фосфат калия, триэтиламин, этилдиизопропиламин, (триметилсилил)амид натрия (Na ГМДС), диазабициклоундецен (ДБУ), 1,4-диазабицикло[2.2.2]октан (DABCO) или их смеси. Более предпочтительные основания выбраны из трет-бутилата натрия или калия, гидроксида натрия или калия, карбоната цезия, смеси карбоната цезия и карбоната калия или смесей перечисленного. Количество основания предпочтительно находится в диапазоне от 1 до 5 моль, более предпочтительно примерно от 1 до 2 моль, в частности, примерно 1,2 моль основания на моль промежуточного соединения VIII. В том случае, если основание является карбонатом, фосфатом или их смесями, общее количество основания находится, более предпочтительно, в диапазоне от 2 до 4 моль основания, наиболее предпочтительно примерно 3 моль основания на моль промежуточного соединения VIII. Боле предпочтительным основанием является трет-бутилат калия, например, как-то в виде раствора в тетрагидрофуране примерно от 10 до 30 мас.%. Подходящими органическими растворителями являются, например, тетрагидрофуран, 2-метилтетрагидрофуран или диоксан. Предпочтительный временной интервал для добавления реагентов составляет примерно от 1 до 20 ч, предпочтительно от 2,5 до 6,5 ч. Предпочтительная температура во время добавления реагентов находится в диапазоне примерно от -20 до 70 С, более предпочтительно примерно от 15 до 25 С. После завершения добавления смесь предпочтительно перемешивают в продолжение примерно от 5 до 500 мин при температуре в диапазоне примерно от -20 до 70 С,более предпочтительно примерно от 15 до 25 С. Ход реакции может отслеживаться например с помощью ВЭЖХ-анализа, ЯМР- или ИК-спектроскопии. После этого добавляют воду или водный раствор. Водный раствор может содержать кислоту, такую как соляная кислота, серная кислота, азотная кислота, лимонная кислота, винная кислота, щавелевая кислота, янтарная кислота, уксусная кислота, трифторуксусная кислота, или буферную систему, такую как хлорид аммония, уксусная кислота/ацетат, дигидрофосфат,гидрофосфат,трис(2-(4-(2-гидроксиэтил)-1 пиперазинил)этансульфокислота), или основание, такое как NaHCO3, K2CO3, Na2CO3, KOH, NaOH. Реакционную смесь перемешивают, например, в течение примерно от 5 до 500 мин при внутренней температуре примерно от -20 до 70 С, более предпочтительно примерно 15-30 С. После завершения разделяют фазы и отгоняют органический растворитель из органической фазы частично или целиком, предпочтительно, при температуре меньшей или равной до примерно 50 С, предпочтительно, при пониженном давлении. Продукт формулы VII может быть подвергнут дополнительной очистке и выделению. Для этого к остатку добавляют органический растворитель или смесь органических растворителей предпочтительно при температуре в диапазоне примерно от 40 до 50 С. Предпочтительными растворителями являются, например, 2-пропанол, метанол, этанол, 1-пропанол, н-бутанол,ацетон, метилэтилкетон, изопропилацетат, этилацетат, н-бутилацетат, трет-бутилметиловый эфир, н- 10022032 гептан, метилциклогексан, 2-метилтетрагидрофуран, ацетонитрил, вода, толуол, тетрагидрофуран, диоксан, хлористый метилен, N-метилпирролидон, N,N'-диметилформамид или их смеси. Реакционную смесь охлаждают предпочтительно до температуры в диапазоне примерно от -25 до 40 С, более предпочтительно до температуры примерно от -5 до 5 С. Охлаждение может происходить в продолжение, примерно от 0,1 до 20 ч. Продукт формулы VII может быть собран например на фильтре или в центрифуге и промыт подходящим растворителем или смесью растворителей, таким как 2-пропанол и/или третбутилметиловый эфир. Другие подходящие растворители были описаны здесь выше. Продукт может быть высушен предпочтительно при температуре меньшей или равной примерно 70 С, более предпочтительно примерно 45 С и при пониженном давлении. Кетон формулы VIII может быть синтезирован исходя из производного бензойной кислоты формулы IX (схема 6). Схема 6. Синтез кетона формулы VIII Достигаются преимущества, если соответствующую бензойную кислоту получают исходя из производного бензойной кислоты формулы IX, в которой X обозначает Br, I или трифлат, предпочтительно,иод, посредством взаимодействия с хлорангидридом щавелевой кислоты. Данное взаимодействие предпочтительно осуществляют в присутствии катализатора, такого как диметилформамид. Условия взаимодействия и растворители хорошо известны специалисту в соответствующей области. Например, на первой стадии реакции (1) в качестве растворителя может быть взят фторбензол, который затем образует реагент (Z обозначает фтор) на второй стадии реакции (2). Вторая стадия реакции (2) может быть охарактеризована как ацилирование по Фриделю-Крафтсу или по типу Фриделя-Крафтса, хорошо известный способ в органическом синтезе. В принципе, хлорбензойная кислота может быть заменена другими производными бензойной кислоты, такими как, например,ангидриды, сложные эфиры бензойной кислоты или бензонитрилы. Достигаются преимущества при осуществлении взаимодействия в присутствии катализатора, такого как AlCl3, FeCl3, иод, железо, ZnCl2,серная кислота или трифторметансульфокислота, все из которых используются в каталитических количествах или вплоть до стехиометрических количеств. Предпочтительным катализатором является AlCl3. Взаимодействие может быть осуществлено с дополнительными растворителями или без таковых. Дополнительные растворители представляют собой хлорированные углеводороды, такие как, например, дихлорметан или 1,2-дихлорэтан, или углеводороды, такие как гексана, или их смеси. Согласно предпочтительному варианту осуществления, взаимодействие проводят с использованием избытка фторбензола,который дополнительно выступает в качестве растворителя. Предпочтительные температуры в процессе взаимодействия находятся в пределах от -30 до 140 С, предпочтительно от 15 до 60 С. После завершения взаимодействия остатки реагентов в реакционной смеси могут быть подвергнуты разложению с помощью воды. Предпочтительно органические растворители отгоняют. Промежуточное соединение VIII может быть выделено, предпочтительно, посредством кристаллизации, например, из воды, (С 1-С 3) алканолов и их смесей, таких как вода/2-пропанол. Помимо указанного, получаемые соединения и промежуточные соединения могут быть разделены на свои энантиомерные и/или диастереомерные формы, как это упоминалось здесь выше. Так, например,цис/транс-смеси могут быть разделены на соответствующие цис- и транс- изомеры, а соединения с, по крайней мере, одним оптически активным атомом углерода могут быть разделены на свои энантиомерные формы. Так, например, цис/транс-смеси могутбыть разделены с помощью хроматографии на соответствующие цис- и транс- изомеры, получаемые соединения и промежуточные соединения, которые находятся в виде рацематов, могут быть разделены с помощью способов, которые известны сами по себе (сравн.Allinger N. L. и Eliel E. L. в "Topics in Stereochemistry" (Темы в стереохимии), т. 6, Wiley Interscience,1971), на свои оптические антиподы, а соединения или промежуточные соединения по крайней мере с двумя асимметрическими атомами углерода могут быть разделены на свои диастереомеры на основе их физико-химических различий с помощью способов, которые известны сами по себе, например, хроматографии и/или дробной кристаллизации, и, если таковые соединения получают в рацемической форме,они могут быть затем разделены на энантиомеры, как это упомянуто выше. Энантиомеры предпочтительно разделяют с помощью колоночного разделения на хиральных фазах или посредством перекристаллизации из оптически активного растворителя, или посредством взаимодействия с оптически активным веществом, которое образует с рацемическим соединением соли или производные, такие как, например, сложные эфиры или амиды, в частности, с кислотами и их активированными производными или спиртами, и разделения диастереомерной смеси получаемых таким образом производных или солей, например, на основе их различия в растворимости, причем антиподы в свободной форме могут быть высвобождены из чистых диастереомерных солей или производных под действи- 11022032 ем подходящих агентов. Широко используемыми оптически активными кислотами являются, например,D- и L-формы винной кислоты или дибензоилвинной кислоты, ди-о-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфокислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Оптически активный спирт может представлять собой, например, (+) или (-)-ментол, а оптически активная ацильная группа в амидах, например, может представлять собой (+)- или(-)-ментилоксикарбонил. Кроме того, соединения и промежуточные соединения по настоящему изобретению могут быть преобразованы в свои соли, в частности, для фармацевтического применения, в физиологически приемлемые соли с неорганическими или органическими кислотами. Кислоты, которые могут быть использованы для этой цели, включают, например, соляную кислоту, бромисто-водородную кислоту, серную кислоту, метансульфокислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту или малеиновую кислоту. Достигаются преимущества, если соединения по настоящему изобретению могут быть также получены с помощью способов, описываемых в нижеследующих примерах, которые для этой цели могут быть также объединены со способами, известными специалисту в соответствующей области из литературы, например, в особенности, способами, описанными в международных заявках на изобретение WO 2006/120208, WO 2006/117359 и WO 2005/092877. В вышеприведенном и нижеследующем тексте атомы водорода гидроксильных групп не показаны в явном виде в каждом из случаев в структурных формулах. Нижеследующие примеры предназначены для иллюстрации настоящего изобретения, не ограничивая его. Термины "комнатная температура" или "температура внешней среды" обозначают температуру около 20 С.TMS - триметилсилил. Пример 1. Синтез фторида VIII.1 Добавляют ангидрид щавелевой кислоты (176 кг, 1386 моль, 1,14 экв.) к смеси 2-хлор-5 иодбензойной кислоты (343 кг, 1214 моль) (соединение IX.1), фторбензола (858 кг) и N,Nдиметилформамида (2 кг) в продолжение 3 ч при температуре в диапазоне примерно от 25 до 30 С (образование газа). После завершения добавления реакционную смесь перемешивают в течение дополнительных 2 ч при температуре примерно от 25 до 30 С. Отгоняют растворитель (291 кг) при температуре между 40 и 45 С (р=200 мбар). После этого реакционный раствор (911 кг) добавляют к хлориду алюминияAlCl3 (181 кг) и фторбензолу (192 кг) при температуре между примерно 25 и 30 С в продолжение 2 ч. Перемешивают реакционный раствор при той же температуре в течение примерно еще одного часа. Затем реакционную смесь добавляют к 570 кг воды в продолжение примерно 2 ч при температуре между примерно 20 и 30 С и перемешивают еще в течение часа. После разделения фаз делят органическую фазу(1200 кг) на две половины (600 кг каждая). Из первой половины органической фазы отгоняют растворитель (172 кг) при температуре примерно 40 до 50 С (р=200 мбар). После этого добавляют 2-пропанол(640 кг). Нагревают раствор до температуры примерно 50 С, а затем фильтруют через картридж с активированным углем (марки clear filtration). Картридж может быть заменен в ходе фильтрования и промыт после фильтрования смесью фторбензол/2-пропанол (1:4, 40 кг). Отгоняют растворитель (721 кг) при температуре примерно от 40 до 50 С и р=200 мбар. После этого добавляют 2-пропанол (240 кг) при температуре в диапазоне между примерно 40 и 50 С. Если содержание фторбензола превышает 1% по данным ГХ, отгоняют еще 140 кг растворителя и добавляют 2-пропанол (140 кг). После этого раствор охлаждают примерно от 50 до 40 С в продолжение одного часа и добавляют затравочные кристаллы (50 г). Раствор дополнительно охлаждают примерно от 40 до 20 С в продолжение 2 ч. Добавляют воду (450 кг) при температуре примерно 20 С в продолжение 1 ч и перемешивают суспензию при температуре примерно 20 С в течение еще одно часа, после чего фильтруют суспензию. Осадок на фильтре промывают смесью 2-пропанол/вода (1:1, 800 кг). Продукт сушат до достижения уровня содержания воды 0,06% масс/масс. Вторую половину органической фазы обрабатывают идентичным образом. Всего получают 410 кг (выход 94%) продукта цветом от белого до грязно-белого в кристаллическом виде. Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 2. Синтез кетона VII.1. К раствору фторида VIII.1 (208 кг), тетрагидрофурана (407 кг) и (S)-3-гидрокситетрагидрофурана(56 кг) добавляют в продолжение 3 ч при температуре от 16 до 25 С раствор трет-бутилата калия (20%) в тетрагидрофуране (388 кг). После завершения добавления смесь перемешивают в течение 60 мин при температуре 20 С. После этого определяют степень превращения с помощью ВЭЖХ-анализа. Добавляют в продолжение 20 мин воду (355 кг) при температуре 21 С (разложение остатков реагентов водной средой). Реакционную смесь перемешивают в течение 30 мин (температура 20 С). Выключают мешалку и оставляют смесь стоять в течение 60 мин (температура 20 С). Разделяют фазы и отгоняют растворитель из органической фазы при температуре от 19 до 45 С и при пониженном давлении. Добавляют к остатку при температуре от 40 до 46 С 2-пропанол (703 кг) и отгоняют растворитель при температуре от 41 до 50 С и при пониженном давлении. Добавляют к остатку при температуре 47 С 2-пропанол (162 кг) и отгоняют растворитель при температуре 40 до 47 С и при пониженном давлении. После этого смесь охлаждают до температуры 0 С в продолжение 1 ч 55 мин. Продукт собирают на центрифуге, промывают смесью 2-пропанола (158 кг) и затем трет-бутилметиловым эфиром (88 кг) и сушат при температуре от 19 до 43 С и при пониженном давлении. Получают 227 кг продукта (91,8%) в виде бесцветного твердого вещества. Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 3. Синтез иодида V.1. К раствору кетона VII.1 (217,4 кг) и хлорида алюминия (AlCl3, 81,5 кг) в толуоле (366,8 кг) добавляют в продолжение 1 ч 30 мин 1,1,3,3-тетраметилдисилоксан (TMDS, 82,5 кг) (температура: 18-26 С). После завершения добавления смесь перемешивают в течение еще 1 ч при температуре 24 С. После этого определяют степень превращения с помощью ВЭЖХ-анализа. Затем обрабатывают реакционную смесь ацетоном (15,0 кг), перемешивают в течение 1 ч 5 мин при температуре 27 С и анализируют остаточное содержание TMDS с помощью ГХ. После этого добавляет к реакционной смеси смесь воды (573 кг) и концентрированной HCl (34 кг) при температуре от 20 до 51 С (разложение остатков реагентов водой средой). Реакционную смесь перемешивают в течение 30 мин (температура 51 С). Выключают мешалку и оставляют смесь стоять в течение 20 мин (температура 52 С). Разделяют фазы и отгоняют растворитель из органической фазы при температуре 53-73 С и при пониженном давлении. Добавляют к остатку при температуре от 61 до 70 С толуол (52,8 кг) и этанол (435,7 кг). Охлаждают реакционную смесь до температуры 36 С и добавляют затравочные кристаллы (0,25 кг). Продолжают перемешивание при данной температуре в течение 35 мин. После этого охлаждают смесь до температуры от 0 до 5 С и перемешивают в течение дополнительных 30 мин. Продукт собирают на центрифуге, промывают этанолом (157 кг) и сушат при температуре от 15 до 37 С при пониженном давлении. Получают 181 кг (82,6%) продукта в виде бесцветного твердого вещества. Продукт идентифицируют по времени удерживания в ВЭЖХ. Пример 4. Синтез лактона IV.1. Суспензию D-(+)-глюконо-дельта-лактона IVa.1 (42,0 кг), тетрагидрофурана (277,2 кг), 4 метилморфолина (НММ, 152,4 кг) и 4-диметиламинопиридина (ДМАП, 1,44 кг) обрабатывают хлортриметилсиланом (TMSC1, 130,8 кг) в продолжение 50 мин при температуре от 13 до 19 С. После завершения добавления продолжают перемешивание в течение 1 ч 30 мин при температуре 20 до 22 С и определяют степень превращения с помощью ВЭЖХ-анализа. После этого добавляют н-гептан (216,4 кг) и охлаждают смесь до температуры 5 С. Добавляют при температуре от 3 до 5 С воду (143 кг) в продолжение 15 мин. После завершения добавления смесь нагревают до температуры 15 С и перемешивают в течение 15 мин. Выключают мешалку и оставляют смесь стоять в течение 15 мин. После этого разделяют фазы и последовательно дважды промывают органический слой водой (по 143 кг). Затем отгоняют растворитель при температуре 38 С и при пониженном давлении и добавляют к остатку н-гептан (130 кг). Получаемый таким образом раствор фильтруют и промывают фильтр н-гептаном (63 кг) (раствор продукта и раствор от фильтра объединяют). После этого отгоняют растворитель при температуре 39 до 40 С и при пониженном давлении. Содержание воды в остатке определяют с помощью анализа по Карлу Фишеру (результат: 0,0%). Получают 112,4 кг продукта в виде маслянистого вещества (содержащего остаточный н-гептан, который объясняет выход 100%). Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 5 а. Синтез гликозида II.1. К раствору иодида V.1 (267 кг) в тетрагидрофуране (429 кг) добавляют раствор "Турбогриньяр"iPrMgCl = 0,9-1,1 моль/моль) (472 кг) при температуре от -21 до -15 С в продолжение 1 ч 50 мин. По завершении добавления определяют степень превращения с помощью ВЭЖХ-анализа. Взаимодействие считается завершенным, когда площадь пика, соответствующего иодиду V.1 меньше 5,0% общей площади обоих пиков, иодида V.1 и соответствующего деиодированного производного иодида V.I. Если взаимодействие не завершено, добавляют дополнительно количество раствора "Турбогриньяр" до достижения указанного критерия. В данном конкретном случае результат составил 3,45%. После этого добавляют при температуре от -25 до -18 С лактон IV.1 (320 кг) в продолжение 1 ч 25 мин. Получаемую таким образом смесь перемешивают в течение еще 1 ч 30 мин при температуре от -13 до -18 С. По завершении определяют степень превращения с помощью ВЭЖХ-анализа (для сведения). По завершении добавляют при температуре от -13 до 19 С в продолжение 1 ч 25 мин к реакционной смеси объемом примерно 2500 л раствор лимонной кислоты в воде (938 л, концентрация: 10 мас.%). Растворитель частично отгоняют из реакционной смеси (остаточный объем: 1816-1905 л) при температуре от 20 до 30 С и при пониженном давлении и добавляют 2-метилтетрагидрофуран (532 кг). Затем выключают мешалку и разделяют фазы при температуре 29 С. После разделения фаз величину рН органической фазы измеряют с помощью рН-электрода (Mettler Toledo MT НА 405 DPA SC) или, альтернативно, с помощью рН-чувствительной индикаторной бумаги (такой как pH-Fix 0-14, Macherey and Nagel). Измеренная величина рН находится в пределах от 2 до 3. После этого отгоняют из органической фазы растворитель при температуре от 30 до 33 С и при пониженном давлении и добавляют метанол(1202 кг), после чего добавляют при температуре 20 С 1,25 н. раствор HCl в метаноле (75 кг) (рН 0). Полноты преобразования в ацеталь III.1 достигают в результате последующей перегонки при температуре от 20 до 32 С и при пониженном давлении и добавления метанола (409 кг). Завершение взаимодействия достигается при выполнении двух критериев: 1) соотношение суммы площадей на хроматограмме ВЭЖХ для альфа-формы и бета-формы промежуточного соединения III.1 по отношению к площади, отвечающей промежуточному соединению IIIa.1,больше или равно 96,0% : 4,0%. 2) Соотношение площади на хроматограмме ВЭЖХ для альфа-формы промежуточного соединенияIII.1 и для бета-формы III.1 больше или равно 97,0% к 3,0%. В данном конкретном случае оба критерия выполнены. Добавляют триэтиламин (14 кг) (рН = 7,4) и отгоняют растворитель при пониженном давлении, затем добавляют ацетонитрил (835 кг) и снова отгоняют при пониженном давлении. Эти действия повторяют (добавление ацетонитрила: 694 кг) и добавляют к получаемой таким образом смеси хлористый метилен (640 кг) с целью получения смеси ацеталя III. 1 в ацетонитриле и хлористом метилене. Содержание воды в смеси определяют с помощью титрования по Карду Фишеру (результат: 0,27%). После этого добавляют реакционную смесь в продолжение 1 ч 40 мин при температуре 10 до 19 С к заранее приготовленной смеси AlCl3 (176 кг), хлористого метилена (474 кг), ацетонитрила (340 кг), и триэтилсилана (205 кг). Получаемую таким образом смесь перемешивают при температуре от 18 до 20 С в течение 70 мин. После завершения взаимодействия добавляют при температуре от 20 до 30 С в про- 14022032 должение 1 ч 30 мин воду (1263 л), частично перегоняют смесь при температуре от 30 до 53 С и при атмосферном давлении и разделяют фазы. Добавляют к органической фазе толуол (698 кг) и отгоняют растворитель при пониженном давлении при температуре от 22 до 33 С. После этого кристаллизуют продукт посредством добавления затравочных кристаллов (0,5 кг) при температуре 31 С и добавляют после охлаждения до температуры 20 С воду (267 кг). Реакционную смесь охлаждают до температуры 5 С в продолжение 55 мин и перемешивают при температуре от 3 до 5 С в течение 12 ч. Наконец, собирают продукт на центрифуге в виде бесцветного кристаллического твердого вещества, промывают толуолом(348 кг) и сушат при температуре от 22 до 58 С. Получают 211 кг (73%) продукта. Продукт идентифицируют по времени удерживания в ВЭЖХ. Пример 5 б. Синтез гликозида II.1. К раствору иодида V.1 (30 г) в тетрагидрофуране (55 мл) добавляют при температуре от -14 до-13 С в продолжение 35 мин раствор "Турбогриньяр" (раствор изопропилмагнийхлорида/хлорида лития,14 мас.% iPrMgCl в ТГФ, мольное соотношение LiCl : iPrMgCl = 0,9 - 1,1 моль/моль) (53 г). По завершении добавления определяют степень превращения с помощью ВЭЖХ-анализа. Взаимодействие считается завершенным, если площадь пика, соответствующего иодиду V.1 составляет меньше 5,0% от общей площади обоих пиков, иодида V.1 и соответствующего деиодированного производного иодида V.1. Если взаимодействие не завершено, добавляют дополнительно количество раствора "Турбогриньяр" до достижения указанного критерия. В данном конкретном случае результат составил 0,35%. После этого добавляют при температуре от -15 до -6 С лактон IV.1 (36 г) в продолжение 15 мин. Получаемую таким образом смесь перемешивают в течение еще 1 ч при температуре от -6 до -7 С. По завершении определяют степень превращения с помощью ВЭЖХ-анализа (для сведения). По завершении добавляют при температуре от -13 до 10 С в продолжение 30 мин к реакционной смеси раствор лимонной кислоты в воде (105 мл, концентрация: 10 мас.%). Растворитель частично отгоняют из реакционной смеси (остаточный объем: 200 мл) при температуре от 20 до 35 С и при пониженном давлении и добавляют 2 метилтетрагидрофуран (71 мл). После этого перемешивают смесь в течение 25 мин при температуре 30 С. Затем выключают мешалку и разделяют фазы при температуре 30 С. После разделения фаз величину рН органической фазы измеряют с помощью рН-электрода (Mettler Toledo MT НА 405 DPA SC) или, альтернативно, с помощью рН-чувствительной индикаторной бумаги (такой как pH-Fix 0-14, Macherey and Nagel). Измеренная величина рН равна 3. После этого отгоняют из органической фазы растворитель при температуре 35 С и при пониженном давлении и добавляют метанол (126 мл), после чего добавляют при температуре 25 С 1,25 н. раствор HCl в метаноле (10,1 мл) (рН 1-2). Полноты преобразования в ацеталь III. 1 достигают в результате последующей перегонки при температуре 35 С и при пониженном давлении и добавления метанола (47 мл). Завершение взаимодействия достигается при выполнении двух критериев: 1) соотношение суммы площадей на хроматограмме ВЭЖХ для альфа-формы и бета-формы промежуточного соединения III.1 по отношению к площади, отвечающей промежуточному соединению IIIa.1,больше или равно 96,0% : 4,0%. В данном конкретном случае соотношение составляет 99,6% : 0,43%; 2) соотношение площади на хроматограмме ВЭЖХ для альфа-формы промежуточного соединенияIII. 1 и для бета-формы III.1 больше или равно 97,0% к 3,0%. В данном конкретном случае соотношение составляет 98,7% : 1,3%. Добавляют триэтиламин (2,1 мл) (рН 9) и отгоняют растворитель при температуре 35 С и при пониженном давлении, затем добавляют ацетонитрил (120 мл) и снова отгоняют при пониженном давлении и при температуре от 30 до 35 С. Эти действия повторяют (добавление ацетонитрила: 102 мл) и добавляют к получаемой таким образом смеси хлористый метилен (55 мл) с целью получения смеси ацеталяIII.1 в ацетонитриле и хлористом метилене. Содержание воды в смеси определяют с помощью титрования по Карду Фишеру (результат: 0,04%). После этого добавляют реакционную смесь в продолжение 1 ч 5 мин при температуре 20 С к заранее приготовленной смеси AlCl3 (19,8 г), хлористого метилена (49 мл), ацетонитрила (51 мл), и триэтилсилана (23 г). Получаемую таким образом смесь перемешивают при температуре от 20 до 30 С в течение 60 мин. После завершения взаимодействия добавляют при температуре от 20 С в продолжение 25 мин воду (156 мл), частично перегоняют смесь при температуре 55 С и при атмосферном давлении и разделяют фазы при температуре 33 С. Нагревают смесь до температуры 43 С, добавляют толуол (698 кг) и отгоняют растворитель при пониженном давлении при температуре от 41 до 43 С. После этого добавляют ацетонитрил (10 мл) при температуре 41 С и определяют процентное содержание ацетонитрила с помощью ГХ. В данном конкретном случае процентное содержание ацетонитрила составляет 27 мас.%. После этого кристаллизуют продукт посредством добавления затравочных кристаллов (0,1 г) при температуре 44 С и продолжают перемешивание смеси при температуре 44 С в течение 15 мин. Затем охлаждают смесь до температуры 20 С в продолжение 60 мин и добавляют при температуре 20 С воду (142 мл) в продолжение 30 мин. Реакционную смесь охлаждают до температуры от 0 до 5 С в продолжение 60 мин и перемешивают при температуре от 3 С в течение 16 ч. Наконец, собирают продукт на фильтре в виде бесцветного кристаллического твердого вещества, промывают толуолом (80 мл) и сушат при температуре от 20 до 70 С. Получают 20,4 г (62,6%) продукта. Продукт идентифицируют по времени удерживания в ВЭЖХ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы IIIR' обозначает водород или (С 1-С 6)алкил,включающий стадии (S2), (S3), (S4) и (S5):(S2) - взаимодействие металлоорганического соединения формулы VI в которой R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает О, Br, I или органический остаток,с глюконолактоном общей формулы IV в которой R2 отвечает вышеприведенному определению,в органическом растворителе или смеси двух или более органических растворителей,(S3) - добавление водного раствора, содержащего одну или более кислот, таким образом, чтобы реакционная смесь образовала водную фазу и органическую фазу, в результате чего органическая фаза имела бы рН в диапазоне от 1 до 6,(S4) - отделение органической фазы, содержащей полученный на стадии (S2) аддукт от водной фазы, и(S5) - взаимодействие полученного аддукта с водой, или спиртом R'-OH, где R' обозначает (С 1-С 6) алкил, или их смесью в присутствии одной или более кислот. 2. Способ по п.1, дополнительно включающий стадию (S1):(S1) - введение соединения формулы V в которой R1 отвечает приведенному в п.1 определению, а X обозначает Br, I или трифлат,во взаимодействие с магнием, литием, магниевым реактивом Гриньяра или литийорганическим соединением в органическом растворителе или смеси двух или более органических растворителей, с целью получения металлоорганического соединения формулы VI в котором R1 отвечает вышеприведенному определению, а М обозначает Li, Mg или MgQ, где Q обозначает Cl, Br, I или органический остаток. 3. Способ по п.2, в котором на стадии (S1) соединение формулы V вводят во взаимодействие с(С 3-С 4)алкилмагнийхлоридом или бромидом. 4. Способ по п.3, в котором в начале, в течение или в конце стадии (S1) и/или в начале или в течение стадии (S2) к реакционной смеси добавляют бромид лития и/или хлорид лития, причем мольное соотношение (С 3-С 4)алкилмагнийхлорида или бромида и бромида лития и/или хлорида лития находится в диапазоне от 1:10 до 10:1. 5. Способ по пп.2, 3 или 4, в котором количество магния, лития, магниевого реактива Гриньяра или литийорганического соединения по отношению к соединению формулы V находятся в пределах от 0,5 до 2 моль, предпочтительно приблизительно эквимолярны. 6. Способ по пп.1-4 или 5, в котором растворители выбраны из группы, включающей тетрагидрофуран, 2-метилтетрагидрофуран, трет-бутилметиловый эфир, диэтиловый эфир, гептан, толуол, бензол,диоксан, метилциклогексан, гексан, диметилсульфоксид, дихлорметан и хлороформ, предпочтительно выбраны из тетрагидрофурана и 2-метилтетрагидрофурана. 7. Способ по одному или более из пп.2-6, в котором реакция на стадии (S1) и/или стадии (S2) может быть осуществлена в диапазоне температур от -70 до 10 С. 8. Способ по одному или более из пп.1-7, в котором количество глюконолактона по отношению к металлоорганическому соединению формулы VI находится в пределах от 0,8 до 3 моль, предпочтительно от 1 до 2 моль, наиболее предпочтительно 1,06 моль. 9. Способ по одному из пп.1-8, в котором водный раствор содержит одну или несколько кислот, выбранных из группы, включающей лимонную кислоту, винную кислоту, щавелевую кислоту, янтарную кислоту, уксусную кислоту, хлоруксусную кислоту, дихлоруксусную кислоту, трифторуксусную кислоту, соляную кислоту, серную кислоту и азотную кислоту. 10. Способ по п.9, в котором водный раствор содержит от 2 до 30 мас.% лимонной кислоты. 11. Способ по п.10, в котором водный раствор содержит от 5 до 20 мас.% лимонной кислоты. 12. Способ по одному или более из пп.1-11, в котором на стадии (S3) органическая фаза имеет рН в диапазоне от 1 до 4. 13. Способ по одному из пп.1-12, в котором органическая фаза реакционной смеси на стадии (S3) содержит 2-метилтетрагидрофуран в количестве в диапазоне от 2 до 60 мас.% по отношению к общему количеству органической фазы в реакционной смеси. 14. Способ по п.13, в котором количество 2-метилтетрагидрофурана находится в диапазоне от 10 до 40 мас.% по отношению к общему количеству органической фазы реакционной смеси. 15. Способ по одному или более из пп.1-14, в котором R' обозначает водород, метил или этил, предпочтительно метил. 16. Способ по одному или более из пп.1-15, в котором на стадии (S5) аддукт, получаемый на стадии(S4), вводят во взаимодействие со спиртом R'-OH, где спирт R'-OH выбран из группы, включающей метанол, этанол, 1-пропанол, 2-пропанол, н-бутанол, трет-бутанол или их смеси, предпочтительно метанол. 17. Способ по одному или более из пп.1-16, в котором на стадии (S5) при добавлении одной или более кислот следует достичь рН, который составляет от 0 до 7, предпочтительно от 0 до 4, более предпочтительно от 1 до 2. 18. Способ по одному или более из пп.1-17, в котором на стадии (S5) одну или более кислоту выбирают из группы, включающей соляную кислоту, серную кислоту, азотную кислоту, уксусную кислоту,трифторуксусную кислоту, лимонную кислоту, винную кислоту, щавелевую кислоту и янтарную кислоту, предпочтительно соляную кислоту. 19. Способ по одному или более из пп.1-18, в котором на стадии (S5) температура взаимодействия находится в диапазоне от -50 до 50 С, предпочтительно от 0 до 30 С, наиболее предпочтительно от 15 до 25 С. 20. Способ получения глюкопиранозилзамещенного производного бензилбензола общей формулы в которой R1 обозначает (R)-тетрагидрофуран-3-ил или (S)-тетрагидрофуран-3-ил, где глюкопиранозилзамещенное производное бензилбензола общей формулы IIIR' обозначает водород или (С 1-С 6)алкил,получают по одному из пп.1-19 с последующей стадией (S6):(S6) - взаимодействие глюкопиранозилзамещенного производного бензилбензола общей формулы
МПК / Метки
МПК: C07D 309/10
Метки: получения, бензилбензола, способ, производных, глюкопиранозилзамещенных
Код ссылки
<a href="https://eas.patents.su/18-22032-sposob-polucheniya-glyukopiranozilzameshhennyh-proizvodnyh-benzilbenzola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения глюкопиранозилзамещенных производных бензилбензола</a>
Предыдущий патент: Способ и агломерационное устройство ленточного типа для непрерывного спекания гранулированного минерального материала
Следующий патент: Способ получения катализатора дегидрирования метилпиперидина до метилпиридина
Случайный патент: Молотковая дробилка












