Способ получения глюкопиранозилзамещённых производных бензилбензола и промежуточных продуктов для их получения
Номер патента: 14468
Опубликовано: 30.12.2010
Авторы: Тан Вэньюнь, Чжан Ли, Кришнамурти Дхилипкумар, Сунь Сюфэн, Хань Чженсюй, Сенанаяке Крис Х., Эккхардт Маттиас, Ван Сяоюнь, Химмельсбах Франк
Формула / Реферат
1. Способ получения соединений общей формулы I
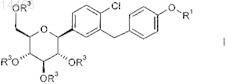
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R3 обозначает водород;
характеризующийся тем, что в соединении общей формулы II
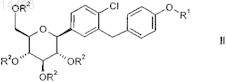
в которой R1 является таким, как определено выше в настоящем изобретении, и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (C1-С18-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил, арил-С1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; при условии, что по меньшей мере один заместитель R2 не обозначает водород;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
защитные группы R2, не обозначающие водород, отщепляют.
2. Способ получения соединений общей формулы II
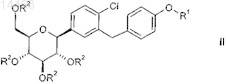
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (C1-С18-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил, арил-С1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
характеризующийся тем, что соединение общей формулы III
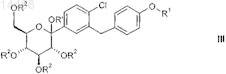
в которой R1 и все R2являются такими, как определено выше в настоящем изобретении, и
R' обозначает водород, С1-С6-алкил, (С1-С4-алкил)карбонил, (C1-C4-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил; где "арил" является таким, как определено выше в настоящем изобретении;
вводят в реакцию с восстановительным реагентом.
3. Способ получения соединений общей формулы III
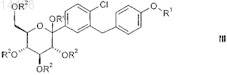
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (С1-С18-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил, арил-С1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; и
R' обозначает водород, С1-С6-алкил, (С1-С4-алкил)карбонил, (С1-С4-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
характеризующийся тем, что металлоорганическое соединение формулы VI
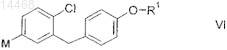
в которой R1 является таким, как определено выше в настоящем изобретении, и
М обозначает Li или MgHal, где Hal обозначает Cl, Br или I;
или его производное, полученное переметаллированием;
указанное соединение формулы VI можно получить путем обмена галоген-металл или путем внедрения металла в связь углерод-галоген галогенбензилбензола общей формулы V
![]()
в которой R1 является таким, как определено выше в настоящем изобретении, и
X обозначает Br или I;
и необязательно последующим переметаллированием прибавляют к глюконолактону общей формулы IV
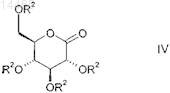
в которой R2 является таким, как определено выше в настоящем изобретении,
затем полученный аддукт вводят в реакцию с водой или спиртом R'-OH, где R' обозначает С1-С6-алкил, в присутствии кислоты и необязательно продукт, полученный по реакции с водой, где R' обозначает Н, в последующей реакции с ацилирующим реагентом превращают в продукт формулы III, в которой R' обозначает (С1-С4-алкил)карбонил, (С1-С4-алкил)оксикарбонил, арилкарбонил или арил(С1-С3-алкил)карбонил, где "арил" является таким, как определено выше в настоящем изобретении.
4. Способ получения соединений общей формулы XXXIII
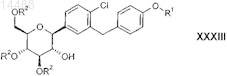
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (C1-С18-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил, арил-С1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; и
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
характеризующийся тем, что защищенный D-глюкаль формулы XXX
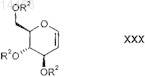
в которой R2 является таким, как определено выше в настоящем изобретении;
металлируют с получением металлированного D-глюкаля формулы XXXI
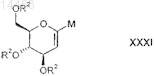
в которой R2 является таким, как определено выше в настоящем изобретении, и
М обозначает литий- или магнийсодержащий фрагмент;
который необязательно переметаллируют с получением металлированного D-глюкаля формулы XXXI, в которой М обозначает магний-, цинк-, индий-, бор-, олово-, кремний- или хромсодержащий фрагмент; и
металлированный или переметаллированный D-глюкаль формулы XXXI вводят в реакцию с агликоном формулы V
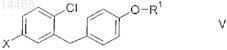
в которой R1 является таким, как определено выше в настоящем изобретении, и
X обозначает отщепляющуюся группу;
в присутствии катализатора, содержащего переходный металл, и получают производное глюкаля формулы XXXII
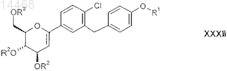
в которой R1 и R2являются такими, как определено выше в настоящем изобретении; и
производное глюкаля формулы XXXII превращают в продукт формулы XXXIII путем присоединения молекулы воды по двойной связи глюкального фрагмента, предпочтительно путем гидроборирования двойной связи с последующим расщеплением связи углерод-бор или путем эпоксидирования или дигидроксилирования двойной связи с последующим восстановлением образовавшейся аномерной связи углерод-кислород.
5. Способ получения соединений общей формулы XXXIII

в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (C1-С18-алкил)оксикарбонил, арилкарбонил, арил (С1-С3-алкил)карбонил, арил-С1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; и
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
характеризующийся тем, что защищенный D-глюкаль формулы XXX
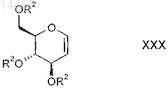
в которой R2 является таким, как определено выше в настоящем изобретении;
эпоксидируют с получением соответствующего глюкальоксида формулы XXXIV
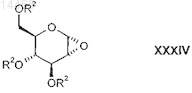
в которой R2 является таким, как определено выше в настоящем изобретении;
и глюкальоксид формулы XXXIV вводят в реакцию с металлированным агликоном формулы VI
![]()
в которой R1 является таким, как определено выше в настоящем изобретении, и
М обозначает литий-, магний-, цинк-, индий-, алюминий- или борсодержащий фрагмент;
и получают продукт формулы XXXIII.
6. Способ по п.4 или 5, характеризующийся тем, что соединение общей формулы XXXIII превращают в соединение общей формулы I
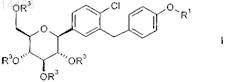
в которой R1 является таким, как определено выше в настоящем изобретении, и
R3 обозначает Н;
путем отщепления защитных групп R2, не обозначающих водород.
7. Способ получения соединений общей формулы II
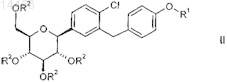
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С18-алкил)карбонил, (С1-С18-алкил)оксикарбонил, арилкарбонил, арил(С1-С3-алкил)карбонил, арил-C1-С3-алкил, аллил, RaRbRcSi, CRaRbORc, где две соседние группы R2могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил, арил или арил-С1-С3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1;
характеризующийся тем, что производное глюкозы формулы XXXV
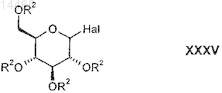
в которой R2 является таким, как определено выше в настоящем изобретении, и
Hal обозначает F, Cl, Br, С1-С3-алкилкарбонилоксигруппу, C1-С3-алкилоксикарбонилоксигруппу или С1-С3-алкилоксигруппу;
вводят в реакцию с металлированным агликоном формулы VI
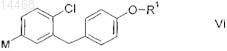
в которой R1 является таким, как определено выше в настоящем изобретении, и
М обозначает литий-, магний-, цинк-, индий- или борсодержащий фрагмент;
и получают продукт формулы II.
8. Способ получения соединений общей формулы V
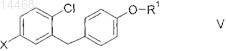
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
X обозначает атом брома или атом йода;
характеризующийся тем, что производное бензоилхлорида формулы XII
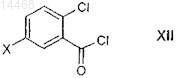
в которой X является таким, как определено выше;
или его производное, такое как ангидрид, сложный эфир бензойной кислоты или бензонитрил; вводят в реакцию с галогенбензолом формулы XXVII
![]()
в которой Z5 обозначает атом фтора, хлора или йода;
в присутствии катализатора и получают промежуточное соединение формулы XXVI
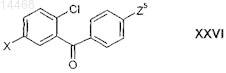
в которой X и Z5 являются такими, как определено выше в настоящем изобретении; и
промежуточное соединение формулы XXVI вводят в реакцию с R1-ОН, где R1 является таким, как определено выше в настоящем изобретении, или его анионом в присутствии основания и получают производное бензофенона формулы VII
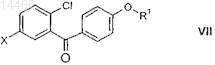
в которой X и R1 являются такими, как определено выше в настоящем изобретении; и
производное бензофенона формулы VII вводят в реакцию с восстановительным реагентом в присутствии кислоты Льюиса и получают соединение формулы V, определенное выше.
9. Способ получения соединения общей формулы II
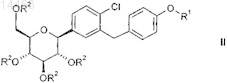
в которой R1 и R2являются такими, как определено в п.2,
характеризующийся тем, что агликон формулы V
![]()
в которой X и R1 являются такими, как определено в п.8,
получают способом по п.8 и указанное соединение общей формулы V превращают в металлоорганическое соединение формулы VI
![]()
в которой R1 является таким, как определено выше в настоящем изобретении, и
М обозначает Li или MgHal, где Hal обозначает Cl, Br или I;
путем обмена галоген-металл или путем внедрения металла в связь углерод-галоген соединения общей формулы V и необязательно последующего переметаллирования; и
указанное металлоорганическое соединение формулы VI вводят в реакцию с глюконолактоном общей формулы IV
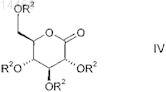
в которой R2 является таким, как определено выше в настоящем изобретении,
способом по п.3 и получают промежуточный продукт формулы III
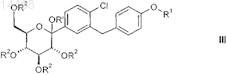
в которой R2, R' и R1являются такими, как определено в п.3, и
указанный промежуточный продукт формулы III вводят в реакцию с восстановительным реагентом по п.2 и получают соединение формулы II.
10. Способ по п.9, в котором в формуле II заместитель R2 обозначает водород и в формуле IV заместитель R2 обозначает защитную группу, определенную в п.3, и в формуле III заместитель R2обладает таким же значением, как в формуле IV, или обозначает водород.
11. Способ по одному или большему количеству предыдущих пунктов, в котором R1обозначает R-тетрагидрофуран-3-ил или S-тетрагидрофуран-3-ил.
12. Соединение общей формулы II
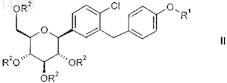
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С4-алкил)карбонил, (C1-С4-алкил)оксикарбонил, арил-метил, RaRbRcSi; при условии, что по меньшей мере один заместитель R2 не обозначает водород;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные группы.
13. Соединение общей формулы II по п.12, в которой R2 независимо друг от друга обозначают водород, (С1-С4-алкил)карбонил или (С1-С4-алкил)оксикарбонил при условии, что по меньшей мере один заместитель R2не обозначает водород.
14. Соединение общей формулы II по п.12, выбранное из группы, включающей
1-хлор-4-(2,3,4,6-тетра-О-ацетил-D-глюкопираноз-1-ил)-2-(4-(R)-тетрагидрофуран-3-илоксибензил)бензол;
1-хлор-4-(2,3,4,6-тетра-О-ацетил-D-глюкопираноз-1-ил)-2-(4-(S)-тетрагидрофуран-3-илоксибензил)бензол.
15. Соединение общей формулы III
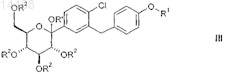
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С4-алкил)карбонил, (C1-С4-алкил)оксикарбонил, арил-метил, RaRbRcSi;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил;
R' обозначает водород, С1-С6-алкил;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные группы.
16. Соединение общей формулы III по п.15, в которой R2 независимо друг от друга обозначают водород, (С1-С4-алкил)карбонил или (С1-С4-алкил)оксикарбонил.
17. Соединение общей формулы III по п.15, выбранное из группы, включающей
1-хлор-4-(1-метокси-D-глюкопираноз-1-ил)-2-(4-(R)-тетрагидрофуран-3-илоксибензил)бензол;
1-хлор-4-(1-метокси-D-глюкопираноз-1-ил)-2-(4-(S)-тетрагидрофуран-3-илоксибензил)бензол.
18. Соединение общей формулы VI
![]()
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
М обозначает Li или MgHal, где Hal обозначает Cl, Br или I.
19. Соединение общей формулы V
![]()
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
X обозначает Br или I.
20. Соединение формулы V по п.19, выбранное из группы, включающей
(S)-4-бром-1-хлор-2-(4-тетрагидрофуран-3-илоксибензил)бензол;
(R)-4-бром-1-хлор-2-(4-тетрагидрофуран-3-илоксибензил)бензол;
4-бром-1-хлор-2-(4-тетрагидропиран-4-илоксибензил)бензол;
(S)-4-йод-1-хлор-2-(4-тетрагидрофуран-3-илоксибензил)бензол;
(R)-4-йод-1-хлор-2-(4-тетрагидрофуран-3-илоксибензил)бензол;
4-йод-1-хлор-2-(4-тетрагидропиран-4-илоксибензил)бензол.
21. Соединение общей формулы VII
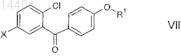
или формулы XIX
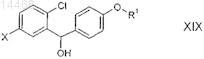
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
X обозначает Br или I.
22. Соединение формулы VII по п.21, выбранное из группы, включающей
(5-бром-2-хлорфенил)-(4-(R)-тетрагидрофуран-3-илоксифенил)метанон;
(5-бром-2-хлорфенил)-(4-(S)-тетрагидрофуран-3-илоксифенил)метанон;
(5-йод-2-хлорфенил)-(4-(R)-тетрагидрофуран-3-илоксифенил)метанон;
(5-йод-2-хлорфенил)-(4-(S)-тетрагидрофуран-3-илоксифенил)метанон.
23. Соединение общей формулы XXVI
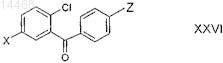
в которой X обозначает Br или I; и
Z обозначает гидроксигруппу, фтор, хлор, бром, йод, С1-С4-алкилсульфонилоксигруппу, арилсульфонилоксигруппу, арил-С1-С3-алкилсульфонилоксигруппу, ди(С1-С6-алкилокси)боронил, дигидроксиборонил, KF3B, NaF3B или LiF3B; и
L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С3-алкил, С1-С4-алкоксигруппу и нитрогруппу;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, которые могут быть моно- или полизамещенными с помощью L1;
при условии, что соединения, в которых X обозначает Br, Z обозначает бром и в которых X обозначает Br, a Z обозначает йод, не включены.
24. Соединение формулы XXVI по п.23, выбранное из группы, включающей
(5-бром-2-хлорфенил)-(4-фторфенил)метанон;
(5-йод-2-хлорфенил)-(4-фторфенил)метанон.
25. Соединение общей формулы XXXII
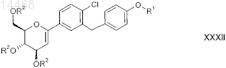
в которой R1 обозначает R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил и
R2 независимо друг от друга обозначают водород, (С1-С4-алкил)карбонил, (С1-С4-алкил)оксикарбонил, арил-метил, RaRbRcSi;
Ra, Rb, Rc независимо друг от друга обозначают С1-С4-алкил;
где арильные группы, указанные в определении приведенных выше групп, означают фенильные группы.
Текст
СПОСОБ ПОЛУЧЕНИЯ ГЛЮКОПИРАНОЗИЛЗАМЕЩННЫХ ПРОИЗВОДНЫХ БЕНЗИЛБЕНЗОЛА И ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ ИХ ПОЛУЧЕНИЯ В изобретении описаны способы получения соединений общей формулы I в которой группы R1 и R3 являются такими, как определено в п.1 формулы изобретения. Кроме того, в изобретении описаны промежуточные продукты, полученные в этих способах.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) 014468 Настоящее изобретение относится к способу получения глюкопиранозилзамещенных производных бензилбензола формулы I в которой заместители R1 и R3 являются такими, как определено ниже в настоящем изобретении. Кроме того, настоящее изобретение относится к способам получения промежуточных продуктов и исходных веществ для способа получения глюкопиранозилзамещенных производных бензилбензола. Кроме того,настоящее изобретение относится к таким промежуточным продуктам и исходным веществам. Уровень техники В заявке на международный патент 2005/092877 описаны глюкопиранозилзамещенные производные бензола общей формулы в которой группы R1-R6 и R7a, R7b, R7c являются такими, как определено в настоящем изобретении. Такие соединения оказывают полезное ингибирующее воздействие на натрийзависимый сопереносчик глюкозыSGLT, в особенности SGLT2. Задача изобретения Задачей настоящего изобретения является разработка новых способов получения глюкопиранозилзамещенных производных бензилбензола формулы I; в частности способов, с помощью которых продукт можно получить с высокими выходами, высокой энантиомерной или диастереоизомерной чистоты и которые обеспечивают получение продукта в коммерческом масштабе при низких производственных расходах и высоким выходом с единицы производственной мощности и за единицу времени. Другой задачей настоящего изобретения является разработка способов получения исходных веществ для указанного выше способа получения. Дополнительные задачи настоящего изобретения относятся к новым промежуточным продуктам и исходным веществам для способа, предлагаемого в настоящем изобретении. Другие задачи настоящего изобретения будут понятны для специалиста в данной области техники непосредственно из приведенного выше и ниже описания. Объекты изобретения Первым объектом настоящего изобретения является способ получения соединений общей формулы IR3 обозначает водород; характеризующийся тем, что в соединении общей формулы IIR1 является таким, как определено выше в настоящем изобретении, иR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (C1-С 18 алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил, арил-С 1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; при условии, что по меньшей мере один заместитель R2 неRa, Rb, Rc независимо друг от друга обозначают С 1-С 4-алкил, арил или арил-C1-С 3-алкил, где алкил может быть моно- или полизамещен галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, С 1-С 3-алкил, С 1 С 4-алкоксигруппу и нитрогруппу; где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1; защитные группы R2, не обозначающие водород, отщепляют, предпочтительно гидролизуют. Вторым объектом настоящего изобретения является способ получения соединений общей формулы IIR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (C1-С 18 алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил, арил-C1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb;Ra, Rb, Rc независимо друг от друга обозначают С 1-С 4-алкил, арил или арил-C1-С 3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С 3-алкил, С 1 С 4-алкоксигруппу и нитрогруппу; где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1; характеризующийся тем, что соединение общей формулы III в которой R1 и все R2 являются такими, как определено выше в настоящем изобретении, иR' обозначает водород, C1-С 6-алкил, (С 1-С 4-алкил)карбонил, (С 1-С 4-алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил; где "арил" является таким, как определено выше в настоящем изобретении; вводят в реакцию с восстановительным реагентом. Третьим объектом настоящего изобретения является способ получения соединений общей формулы IIIR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (C1-С 18 алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил, арил-С 1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; иRa, Rb, Rc независимо друг от друга обозначают С 1-С 4-алкил, арил или арил-С 1-С 3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С 3-алкил, C1 С 4-алкоксигруппу и нитрогруппу;R' обозначает водород, C1-С 6-алкил, (С 1-С 4-алкил)карбонил, (С 1-С 4-алкил)оксикарбонил, арилкарбонил, арил(C1-С 3-алкил)карбонил; где арильные группы, указанные в определении приведенных выше групп, означают фенильные-2 014468 или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1; характеризующийся тем, что металлоорганическое соединение формулы VI в которой R1 является таким, как определено выше в настоящем изобретении, и М обозначает Li илиMgHal, где Hal обозначает Cl, Br или I; или его производное, полученное переметаллированием; указанное соединение формулы VI можно получить путем обмена галоген-металл или путем внедрения металла в связь углерод-галоген галогенбензилбензола общей формулы V в которой R1 является таким, как определено выше в настоящем изобретении, и X обозначает Br или I; и необязательно последующим переметаллированием, прибавляют к глюконолактону общей формулы IV в которой R2 является таким, как определено выше в настоящем изобретении, затем полученный аддукт вводят в реакцию с водой или спиртом R'-OH, где R' обозначает C1-С 6-алкил, в присутствии кислоты и необязательно продукт, полученный по реакции с водой, где R' обозначает Н, в последующей реакции с ацилирующим реагентом превращают в продукт формулы III, в которой R' обозначает (C1-С 4 алкил)карбонил, (C1-С 4-алкил)оксикарбонил, арилкарбонил или арил(C1-С 3-алкил)карбонил, где "арил" является таким, как определено выше в настоящем изобретении. Четвертым объектом настоящего изобретения является способ получения соединений общей формулы XXXIII в которой R1, R2 являются такими, как определено выше и ниже в настоящем изобретении; характеризующийся тем, что защищенный D-глюкаль формулы XXX в которой R2 является таким, как определено выше в настоящем изобретении; металлируют с получением металлированного D-глюкаля формулы XXXI в которой R2 является таким, как определено выше в настоящем изобретении, и М обозначает литий- или магнийсодержащий фрагмент; который необязательно переметаллируют с получением металлированного D-глюкаля формулыXXXI, в которой М обозначает магний-, цинк-, индий-, бор-, олово-, кремний- или хромсодержащий фрагмент; и металлированный или переметаллированный D-глюкаль формулы XXXI вводят в реакцию с агликоном формулы V в которой R1 является таким, как определено выше в настоящем изобретении, иX обозначает отщепляющуюся группу; в присутствии катализатора, содержащего переходный металл,и получают производное глюкаля формулы XXXII в которой R1 и R2 являются такими, как определено выше в настоящем изобретении; и производное глюкаля формулы XXXII превращают в продукт формулы XXXIII путем присоединения молекулы воды по двойной связи глюкального фрагмента, предпочтительно путем гидроборирования двойной связи с последующим расщеплением связи углерод-бор или путем эпоксидирования или дигидроксилирования двойной связи с последующим восстановлением образовавшейся аномерной связи углерод-кислород. Пятым объектом настоящего изобретения является способ получения соединений общей формулы в которой R1, R2 являются такими, как определено выше и ниже в настоящем изобретении; характеризующийся тем, что защищенный D-глюкаль формулы XXX в которой R2 является таким, как определено выше в настоящем изобретении; эпоксидируют с получением соответствующего глюкальоксида формулы XXXIV в которой R2 является таким, как определено выше в настоящем изобретении; и глюкальоксид формулы XXXIV вводят в реакцию с металлированным агликоном формулы VI в которой R1 является таким, как определено выше в настоящем изобретении, и М обозначает литий-,магний-, цинк-, индий-, алюминий- или борсодержащий фрагмент; и получают продукт формулы XXXIII. Шестым объектом настоящего изобретения является способ получения соединений общей формулы II в которой R1, R2 являются такими, как определено выше и ниже в настоящем изобретении; характеризующийся тем, что производное глюкозы формулы XXXV в которой R2 является таким, как определено выше в настоящем изобретении, и Hal обозначает F, Cl, Br,C1-С 3-алкилкарбонилоксигруппу, C1-С 3-алкилоксикарбонилоксигруппу или C1-С 3-алкилоксигруппу; вводят в реакцию с металлированным агликоном формулы VI в которой R1 является таким, как определено выше в настоящем изобретении, и М обозначает литий-,магний-, цинк-, индий- или борсодержащий фрагмент; и получают продукт формулы II. Седьмым объектом настоящего изобретения является способ получения соединений общей формулы VX обозначает атом брома или атом йода; характеризующийся тем, что производное бензоилхлорида формулы XII в которой X является таким, как определено выше; или его производное, такое как ангидрид, сложный эфир бензойной кислоты или бензонитрил; вводят в реакцию с галогенбензолом формулы XXVII в которой Z5 обозначает атом фтора, хлора или йода; в присутствии катализатора и получают промежуточное соединение формулы XXVI в которой X и Z5 являются такими, как определено выше в настоящем изобретении; и промежуточное соединение формулы XXVI вводят в реакцию с R1-ОН, где R1 является таким, как определено выше в настоящем изобретении, или с его анионом, предпочтительно в растворителе или смеси растворителей, в присутствии основания и получают производное бензофенона формулы VII в которой X и R1 являются такими, как определено выше в настоящем изобретении; и производное бензофенона формулы VII вводят в реакцию с восстановительным реагентом, предпочтительно в растворителе или смеси растворителей, в присутствии кислоты Льюиса и получают соединение формулы V, определенное выше. Восьмым объектом настоящего изобретения является способ получения соединений общей формулы II в которой R1 и R2 являются такими, как определено выше в настоящем изобретении,характеризующийся тем, что агликон формулы V в которой X и R1 являются такими, как определено выше в настоящем изобретении, получают способом, соответствующим седьмому объекту настоящего изобретения, и указанный галогенбензилбензол общей формулы V превращают в металлоорганическое соединение формулы VI в которой R1 является таким, как определено выше в настоящем изобретении, и М обозначает Li или MgHal, где Hal обозначает Cl, Br или I; путем обмена галоген-металл или путем внедрения металла в связь углерод-галоген галогенбензилбензола общей формулы V и необязательно последующего переметаллирования; и указанное металлоорганическое соединение формулы VI вводят в реакцию с глюконолактоном общей формулы IV в которой R2 является таким, как определено выше в настоящем изобретении, способом, соответствующим третьему объекту настоящего изобретения, и получают промежуточный продукт формулы III в которой R2, R' и R1 являются такими, как определено выше в настоящем изобретении, и указанный промежуточный продукт формулы III вводят в реакцию с восстановительным реагентом в соответствии со вторым объектом настоящего изобретения и получают соединение формулы II. Девятым объектом настоящего изобретения являются соединения общей формулы IIR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (С 1-С 18 алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил, арил-C1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb; при условии, что по меньшей мере один заместитель R2 не обозначает водород;Ra, Rb, Rc независимо друг от друга обозначают C1-С 4-алкил, арил или арил-C1-С 3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С 3-алкил, C1 С 4-алкоксигруппу и нитрогруппу;-6 014468 где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1. Другим объектом настоящего изобретения являются соединения общей формулы IIIR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (С 1-С 18 алкил)оксикарбонил, арилкарбонил, арил(C1-С 3-алкил)карбонил, арил-С 1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb;Ra, Rb, Rc независимо друг от друга обозначают C1-С 4-алкил, арил или арил-С 1-С 3-алкил, где алкильные или арильные группы могут быть моно- или полизамещенными галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С 3-алкил, C1 С 4-алкоксигруппу и нитрогруппу;R' обозначает водород, C1-С 6-алкил, (С 1-С 4-алкил)карбонил, (С 1-С 4-алкил)оксикарбонил, арилкарбонил, арил(С 1-С 3-алкил)карбонил; где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1. Другим объектом настоящего изобретения являются соединения общей формулы VIR1 обозначает циклобутил, циклопентил, циклогексил, R-тетрагидрофуран-3-ил, S-тетрагидрофуран-3-ил или тетрагидропиран-4-ил; и М обозначает Li или MgHal, где Hal обозначает Cl, Br или I. Другим объектом настоящего изобретения являются соединения общей формулы VX обозначает Br или I. Другим объектом настоящего изобретения являются соединения формулы VIIX обозначает Br или I. Другим объектом настоящего изобретения являются соединения формулы XXVI"арил" является таким, как определено выше в настоящем изобретении. Другим объектом настоящего изобретения являются соединения формулы XXXIIR2 независимо друг от друга обозначают водород, (С 1-С 18-алкил)карбонил, (С 1-С 18 алкил)оксикарбонил, арилкарбонил, арил(C1-С 3-алкил)карбонил, арил-С 1-С 3-алкил, аллил, RaRbRcSi,CRaRbORc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, CRaRb или CRaORb-CRaORb;Ra, Rb, Rc независимо друг от друга обозначают C1-С 4-алкил, арил или арил-C1-С 3-алкил, где алкильные группы могут быть моно- или полизамещенными галогеном;L1 независимо друг от друга выбраны из группы, включающей фтор, хлор, бром, C1-С 3-алкил, С 1 С 4-алкоксигруппу и нитрогруппу; где арильные группы, указанные в определении приведенных выше групп, означают фенильные или нафтильные группы, предпочтительно фенильные группы, которые могут быть моно- или полизамещенными с помощью L1. Подробное описание изобретения Если не указано иное, то группы, остатки и заместители, в частности R1, R2, R3, R', Ra, Rb, Rc, L1, M,X и Z, являются такими, как определено выше и ниже в настоящем изобретении. Если остатки, заместители или группы содержатся в соединении несколько раз, то они могут обладать одинаковыми или разными значениями. В способах и соединениях, предлагаемых в настоящем изобретении, предпочтительными являются указанные ниже значения групп и заместителей.Ra, Rb, Rc независимо друг от друга предпочтительно обозначают метил, этил, н-пропил или изопропил, трет-бутил или фенил; наиболее предпочтительно метил.R' предпочтительно обозначает водород, метил или этил. Способы, предлагаемые в настоящем изобретении, подробно описаны ниже. На схеме 0 представлено превращение соединения II в соединение I путем удаления защитных групп R2, не обозначающих водород, содержащихся в соединении II, в котором R1, R2 и R3 являются такими, как определено выше в настоящем изобретении. Схема 0 Синтез С-гликозида формулы I путем удаления защитных групп Используемую ацильную защитную группу R2 отщепляют, например, гидролитически в водном растворителе, например в воде, смеси изопропанол/вода, уксусная кислота/вода, тетрагидрофуран/вода или диоксан/вода, в присутствии кислоты, такой как трифторуксусная кислота, хлористо-водородная кислота или серная кислота или в присутствии основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия или апротонно, например, в присутствии йодтриметилсилана, при температурах от 0 до 120 С, предпочтительно при температурах от 10 до 100 С. Трифторацетильную группу R2 предпочтительно отщепляют путем обработки кислотой, такой как хлористо-водородная кислота, необязательно в присутствии растворителя, такого как уксусная кислота,при температурах от 50 до 120 С или путем обработки раствором гидроксида натрия необязательно в присутствии растворителя, такого как тетрагидрофуран или метанол, при температурах от 0 до 50 С.-8 014468 Любую используемую ацетальную или кетальную защитную группу R2 отщепляют, например, гидролитически в водном растворителе или водной смеси растворителей, например в воде, смеси изопропанол/вода, уксусная кислота/вода, тетрагидрофуран/вода или диоксан/вода, в присутствии кислоты, такой как трифторуксусная кислота, хлористо-водородная кислота или серная кислота или апротонно, например, в присутствии йодтриметилсилана, при температурах от 0 до 120 С, предпочтительно при температурах от 10 до 100 С. Силильную группу R2, например триметилсилил, отщепляют, например, в воде, водной смеси растворителей или в низшем спирте, таком как метанол или этанол, в присутствии основания, такого как гидроксид лития, гидроксид натрия, карбонат калия или метоксид натрия. Для использования в водных или спиртовых растворителях также подходят кислоты, такие как, например, хлористо-водородная кислота, трифторуксусная кислота или уксусная кислота. Для расщепления в органических растворителях, таких как, например, диэтиловый эфир, тетрагидрофуран или дихлорметан, также можно использовать фторсодержащие реагенты, такие как, например, тетрабутиламмонийфторид. Бензильную, метоксибензильную или бензилоксикарбонильную группу R2 предпочтительно отщепляют гидрогенолитически, например, водородом в присутствии катализатора, такого как палладий на угле, в подходящем растворителе, таком как метанол, этанол, этилацетат или ледяная уксусная кислота,необязательно с прибавлением кислоты, такой как хлористо-водородная кислота, при температурах от 0 до 100 С, но предпочтительно при температурах окружающей среды, равных от 20 до 60 С, и при давлении водорода, равном от 1 до 7 бар, но предпочтительно от 3 до 5 бар. Однако 2,4-диметоксибензильную группу предпочтительно отщепляют в трифторуксусной кислоте в присутствии анизола. трет-Бутильную или трет-бутоксикарбонильную группу R2 предпочтительно отщепляют путем обработки кислотой, такой как трифторуксусная кислота или хлористо-водородная кислота, или путем обработки йодтриметилсиланом необязательно с использованием растворителя, такого как метиленхлорид,диоксан, метанол или диэтиловый эфир. Производные глюкозы формулы II можно синтезировать путем восстановления аномерной связи углерод-кислород соединения III (схема 1). Схема 1 Восстановление соединения IIIR' и R1 являются такими, как определено выше в настоящем изобретении. R2 является таким, как определено выше в настоящем изобретении, и обозначает, например, водород, ацетил, пивалоил, бензоил, трет-бутоксикарбонил, бензилоксикарбонил, триалкилсилил, бензил или замещенный бензил. В случае, если две соседние группы R2 связаны друг с другом с образованием мостиковой группы, они предпочтительно образуют ацеталь, такой как, например, бензилиденацеталь, кеталь, такой как, например,изопропилиденацеталь, или этиленовую группу, что приводит к образованию диоксана, как, например,комбинация с 2,3-диметоксибутиленом, который по положениям 2 и 3 бутиленовой группы присоединен к атомам кислорода пиранозы. Предпочтительным значением R2 является водород или три-(C1-С 3-алкил)силил, такой как триметилсилил или триизопропилсилил. R' предпочтительно обозначает водород или С 1-С 4-алкил, более предпочтительно метил или этил. Восстановление можно проводить восстановительным реагентом в присутствии кислоты Льюиса или без нее. Подходящие восстановительные реагенты включают, например, силаны, такие как, например, триэтилсилан, трипропилсилан, триизопропилсилан или дифенилсилан, борогидрид натрия, цианоборогидрид натрия, борогидрид цинка, комплексы борана, литийалюминийгидрид, диизобутилалюминийгидрид или йодид самария. Подходящими кислотами Льюиса являются, такие как, например, эфират трифторида бора, триметилсилилтрифлат, тетрахлорид титана, тетрахлорид олова, трифлат скандия,трифлат меди(II) или йодид цинка; или подходящими кислотами Льюиса являются кислоты Бренстеда,такие как, например, хлористо-водородная кислота, толуолсульфоновая кислота, трифторуксусная кислота или уксусная кислота. В зависимости от восстановительного реагента восстановление можно проводить без кислоты Льюиса. Реакцию можно проводить в растворителе, таком как, например, метиленхлорид, хлороформ, ацетонитрил, толуол, гексан, диэтиловый эфир, тетрагидрофуран, диоксан, этанол,вода или их смеси. Растворитель предпочтительно выбрать с учетом используемого восстановительного реагента и необязательной кислоты Льюиса. Предпочтительные температуры реакции составляют от -80 до 120 С, более предпочтительно от -30 до 80 С.-9 014468 Одна особенно подходящая комбинация реагентов включает, например, триэтилсилан и эфират трифторида бора, которые обычно используют в ацетонитриле, дихлорметане или их смеси при температурах от -60 до 60 С. Восстановление предпочтительно проводят при отсутствии воды, предпочтительно при содержании воды в реакционной смеси, составляющей менее 2000 ч./млн, еще более предпочтительно менее 1000 ч./млн. В дополнение к указанным выше восстановительным реагентам для указанного восстановления можно использовать водород. Это превращение можно проводить в присутствии катализатора, содержащего переходный металл, такого как, например, палладий на угле, оксид палладия, оксид платины или никель Ренея, в растворителях, таких как, например, тетрагидрофуран, этилацетат, метанол, этанол, вода или уксусная кислота, при температурах от -40 до 100 С и при давлениях водорода, равных от 1 до 10 торр. Производные глюкозы формулы III можно синтезировать из D-глюконолактона или его производных по реакции необходимого бензилбензола в виде металлоорганического соединения (схема 2 а). Схема 2 а Присоединение металлоорганического соединения к глюконолактону На схеме 2 а и в последующих разделах описаны предпочтительные условия и варианты осуществления способа, соответствующего третьему объекту настоящего изобретения. Реагент Гриньяра или литиевое производное бензилбензола (VI) можно получить из бромированного или йодированного бензилбензола V по так называемой реакции обмена галоген-металл или путем внедрения металла в связь углерод-галоген. Обмен галоген-металл для синтеза соответствующего литиевого соединения VI можно проводить, например, с использованием литийорганического соединения,таким как, например, н-, втор- или трет-бутиллития. Предпочтительное количество литийорганического соединения находится в диапазоне примерно от 1 до 2 моль, более предпочтительно примерно эквимолярное количество в пересчете на бензилбензол V. Аналогичное соединение магния также можно получить путем обмена галоген-металл с подходящим реагентом Гриньяра, таким как С 3-С 4-алкилмагнийхлорид или -бромид, например изопропил- или втор-бутилмагнийбромид или -хлорид, или диизопропил- или ди-втор-бутилмагний, при отсутствии или в присутствие дополнительной соли, такой как, например, хлорид лития, который может ускорять реакцию металлирования. Конкретные переметаллирующие магнийорганические соединения также можно образовать in situ из подходящих предшественников (см., например, публикации Angew. Chem. 2004,116, 3396-3399 и Angew. Chem. 2006, 118, 165-169 и цитированную в них литературу). Реагент Гриньяра предпочтительно использовать в количестве, находящемся в диапазоне примерно от 1 до 5 моль на 1 моль бензилбензола V. Реакции обмена галоген-металл предпочтительно проводят при температуре от -100 до 40 С, особенно предпочтительно от -80 до 10 С. Более предпочтительный диапазон температур для реакции обмена галоген-литий составляет от -80 до -15 С. Реакцию обмена галоген-металл предпочтительно проводят в инертном растворителе или их смесях, таких как, например, диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир диэтиленгликоля, толуол, гексан, диметилсульфоксид, дихлорметан или их смеси. Особенно предпочтительные растворители выбраны из группы, включающей тетрагидрофуран, диметиловый эфир диэтиленгликоля, гексан и их смеси. Полученные таким образом соединения, содержащие магний или литий, необязательно можно переметаллировать солями металлов, такими как, например, трихлорид церия, хлорид или бромид цинка,- 10014468 хлорид или бромид индия, и получить альтернативные металлоорганические соединения (VI), пригодные для проведения реакции присоединения. Альтернативно, металлоорганическое соединение VI также можно получить путем внедрения металла по связи углерод-галоген галогенароматического соединения V. Элементами, подходящими для такого превращения, являются литий и магний. Внедрение можно провести в растворителях, таких как,например, диэтиловый эфир, диоксан, тетрагидрофуран, толуол, гексан, диметилсульфоксид и их смеси при температурах в диапазоне от -80 до 100 С, предпочтительно от -70 до 40 С. В случаях, когда самопроизвольная реакция не протекает без активации металла, может потребоваться его активация, такая как, например, обработка 1,2-дибромэтаном, йодом, триметилсилилхлоридом, уксусной кислотой, хлористо-водородной кислотой и/или обработка ультразвуком. Прибавление металлоорганического соединения VI к глюконолактону или его производным (IV) предпочтительно проводят при температурах от -100 до 40 С, особенно предпочтительно от -80 до -10 С,в инертном растворителе или их смесях, и получают соединение формулы III. В случае, если соединениеVI является литийорганическим соединением, прибавление еще более предпочтительно проводить при температурах в диапазоне от -80 до -20 С. В случае, если соединение VI является магнийорганическим соединением, особенно предпочтительные температуры во время прибавления находятся в диапазоне от-30 до -15 С. Все указанные выше реакции можно проводить на воздухе, хотя предпочтительно проведение в атмосфере инертного газа. Предпочтительными инертными газами являются аргон и азот. Реакции металлирования и/или сочетания также можно проводить в микрореакторах и/или микросмесителях, которые обеспечивают высокие скорости обмена, например, методикам, описанным в WO 2004/076470. Подходящими растворителями для присоединения металлированного соединения VI к соответствующим образом защищенному глюконолактону IV являются, например, диэтиловый эфир, толуол, метиленхлорид, гексан, тетрагидрофуран, диоксан, N-метилпирролидон и их смеси. Реакции присоединения можно проводить без каких-либо дополнительных вспомогательных веществ или в присутствии промотора, такого как, например, BF3OEt2 или Me3SiCl, что может быть полезным в случае медленно реагирующих компонентов реакции сочетания (см. публикацию М. Schlosser,Organometallics in Synthesis, John WileySons, Chichester/New York/Brisbane/Toronto/Singapore, 1994). Предпочтительными значениями заместителей R2 на схеме 2 а являются бензил, замещенный бензил, триалкилсилил, особенно предпочтительно - три-(C1-С 3-алкил)силил, такой как триметилсилил,триизопропилсилил, 4-метоксибензил и бензил. Если два соседних заместителя R2 связаны друг с другом, то эти два заместителя предпочтительно являются частью бензилиденацеталя, 4 метоксибензилиденацеталя, изопропилкеталя или образуют диоксан с 2,3-диметоксибутиленом, который по положениям 2 и 3 бутана присоединен к соседним атомам кислорода пиранозы. Группа R предпочтительно обозначает водород, С 1-С 4-алкил, С 1-С 4-алкилкарбонил или С 1-С 4-алкилоксикарбонил, особенно предпочтительно водород, метил или этил. Группу R' вводят после присоединения металлоорганического соединения VI или его производного к глюконолактону IV. Если R' обозначает водород или C1-С 4-алкил, то реакционную смесь обрабатывают спиртом, предпочтительно С 1-С 4-алканолом, таким как, например, метанол или этанол, или водой в присутствии кислоты, такой как, например, уксусная кислота, метансульфоновая кислота, толуолсульфоновая кислота, серная кислота, трифторуксусная кислота или хлористо-водородная кислота. Эту реакцию со спиртом или водой предпочтительно проводят при температурах в диапазоне примерно от 0 до 80 С,особенно предпочтительно примерно от 20 до 60 С. Во время включения R' защитные группы R2 могут отщепиться, если они неустойчивы при использованных условиях проведения реакции, что приводит к соответствующему протонированному соединению, т.е. к соединению III, в котором R2 обозначает Н. Например, защитные группы, в которых R2 обозначает триалкилсилил, такой как триметилсилил, обычно отщепляют во время обработки реакционной смеси спиртом и/или водой в присутствии кислоты и таким образом получают соединение III, в котором R2 обозначает Н.R' также можно ввести после получения содержащего водород соединения III (R'=Н) по реакции аномерной гидроксигруппы с подходящим электрофилом, таким как, например, метилйодид, диметилсульфат, этилйодид, диэтилсульфат, ацетилхлорид или уксусный ангидрид, в присутствии основания,такого как, например, триэтиламин, этилдиизопропиламин, карбонат натрия, калия или цезия, гидроксид натрия, калия или цезия. Гидроксигруппу также можно депротонировать до прибавления электрофила,например, гидридом натрия. Методика 2, представленная на схеме 2b, иллюстрирует синтез С-глюкозидов, в котором исходным веществом является соответствующим образом защищенный D-глюкаль XXX (см. публикации Synlett 2004, pp. 1235-1238; Org. Lett. 2003, 5, pp. 405-2408 и цитированную в них литературу, в которой описаны аналогичные методики). Защищенный D-глюкаль XXX металлируют с получением производного Dглюкаля XXXI, в котором М обозначает литий-, магний-, цинк-, индий-, бор-, олово-, кремний- или хромсодержащий фрагмент; предпочтительно литий, галогенид магния, галогенид цинка, галогенид индия, бороновую кислоту, эфир бороновой кислоты. Металлирование глюкаля XXX по атому С-1 можно проводить путем депротонирования сильным основанием. Сильными основаниями, способными депротонировать глюкаль, могут быть литийсодержащие основания, такие как, например, н-бутиллитий, вторбутиллитий или трет-бутиллитий. Полученный таким образом литиированный по атому С-1 глюкаль можно переметаллировать с помощью различных электрофильных источников металла и получить соответствующие металлированные по атому С-1 производные глюкаля. Источниками металла, подходящими для последующего превращения, сочетания, с алгиконовым фрагментом, являются системы, содержание, например, литий, магний, цинк, индий, бор, олово, кремний и хром. Переметаллирование глюкаля с заменой лития на один из указанных выше металлов можно проводить, например, с помощью соответствующих галогенидов, таких как хлорид, бромид или йодид, сульфонатов, таких как, например, трифторметансульфонат, и алкоксидов, таких как, например, метоксид, этоксид, пропоксид и изопропоксид вводимого металла. В зависимости от заменяющего металла можно использовать соединение металла, содержащее более одного глюкального остатка, такое как соответствующий триглюкальиндий или диглюкальцинк. Также можно использовать соответствующие моноглюкальпроизводные металлов. Металлирование глюкаля с помощью сильного основания, предпочтительно литийсодержащего основания, предпочтительно проводят в инертных растворителях, таких как, например, тетрагидрофуран, эфир, диоксан,диметоксиэтан, гексан и толуол. Предпочтительные температуры находятся в диапазоне от -80 до 50 С. Переметаллирование можно проводить в тех же растворителях в зависимости от электрофильных металлсодержащих соединений и в том же диапазоне температур. Из числа электрофильных металлсодержащих соединений, применимых для переметаллирования, к числу наиболее подходящих относятся следующие: триалкилхлорстаннан, тетрахлорстаннан, триалкилхлорсилан, триалкоксихлорсилилхлорид или-бромид, трихлорид бора, триалкилбораты, диалкилхлорборат, трихлорид индия, хлорид, трифлат или бромид цинка, хлорид или бромид магния. Эти перечни никоим образом не означают ограничения используемых электрофильных металлсодержащих соединений указанными выше, а приведен для того,чтобы указать электрофилы, которые можно использовать. Для описанных выше и ниже реакций защитные группы R2 предпочтительно выбирать с учетом их стабильности в щелочных средах, предпочтительно,если группы R2 независимо друг от друга обозначают -SiRaRbRc, где две соседние группы R2 могут быть связаны друг с другом с образованием мостиковой группы SiRaRb, в которой Ra, Rb, Rc являются такими,как определено выше в настоящем изобретении, предпочтительно, если они обозначают изопропил. Полученные таким образом металлированные производные глюкаля формулы XXXI можно ввести в реакцию сочетания с агликоном V, в котором группа X обозначает отщепляющуюся группу, предпочтительно выбранную из группы, включающей хлор, бром, йод, сульфонат, такой как, например, трифторметансульфонат, тозилат, бензолсульфонат и мезилат, хлорсульфонат, сульфоновую кислоту и ее соли, гидроксикарбонил или его соли, нитрил и соли диазония. Реакции сочетания предпочтительно проводят в присутствии катализатора, содержащего переходный металл, такого как, например, соли, комплексы или различные формы элементарного палладия, меди, железа и никеля. Комплексы можно образоватьin situ или до прибавления переходного металла к реакционной смеси. Лигандами в комплексах переход- 12014468 ного металла могут являться, например, триарилфосфин, арилдиалкилфосфин, триалкилфосфин, фосфит,1,3-дизамещенный дигидроимидазолийкарбен, 1,3-дизамещенный имидазолийкарбен и алкены. Реакцию предпочтительно проводят в инертном органическом растворителе или их смесях. Подходящими растворителями могут являться, например, тетрагидрофуран, диоксан, диметоксиэтан, гексан, толуол, бензол,диметилформамид, диметилацетамид, N-метилпирролидинон, ацетон, этилацетат, вода, метанол, этанол,пропанол, изопропанол, этиленгликоль, полиэтиленгликоль. Реакции сочетания предпочтительно проводят при температуре от -80 до 180 С, более предпочтительно от -20 до 120 С. Заключительной стадией синтеза на схеме 2b является формальное присоединение воды по двойной связи глюкального фрагмента. Это присоединение можно провести, например, путем гидробиорирования, которое приводит к образованию 2-бор-2-дезоксипроизводного глюкозы, которое можно превратить в соответствующее соединение глюкозы окислением связи углерод-бор. Боранами, подходящими для гидроборинования, являются, например, боран или его аддукты с простыми эфирами, простыми тиоэфирами или аминами, алкилбораны или диалкилбораны, такие как, например, гексилборан, тексилборан, диэтилборан и 9-BBN (9 борабицикло[3.3.1]нонан), пинаколборан, катехинборан, галоген- или дигалогенборан, такой как, например, дихлорборан. Гидроборирование можно проводить, например, в тетрагидрофуране, гексане, циклогексане, эфире, толуоле, бензоле, дихлорметане. Предпочтительный диапазон температур составляет от-50 до 150 С, более предпочтительный от -20 до 50 С. Окислительное расщепление связи углерод-бор можно проводить окислительным реагентом, таким как, например, пероксид водорода, третбутилпероксид водорода, перборат натрия и триалкиламин-N-оксид. В зависимости от окислительного реагента реакцию предпочтительно проводят в присутствии основания, такого как, например, гидроксид натрия. Реакцию предпочтительно проводят в инертном органическом растворителе или их смесях. Предпочтительные растворители выбраны из группы, включающей тетрагидрофуран, вода, спирты, диоксан, диметоксиэтан, циклогексан, гексан, толуол, дихлорметан и их смеси. Предпочтительный диапазон температур составляет от -30 до 150 С, более предпочтительный от 0 до 110 С. Для присоединения воды по двойной связи альтернативой гидроборированию является комбинация эпоксидирования или дигидроксилирования двойной связи с восстановлением образовавшейся аномерной связи углеродкислород. Подходящими для эпоксидирования окислительными реагентами являются, например, диметилдиоксиран, трифтордиметилдиоксиран, 3-хлорпербензойная кислота, пероксид водорода и кислород в присутствии катализатора, содержащего переходный металл. Другим подходящим окислительным реагентом является пероксомоносерная кислота, пероксодисерная кислота и их соли в присутствии по меньшей мере одного кетона, предпочтительно тройных солей формулы 2KHSO5KHSO4K2SO4, которые имеются в продаже, например, под торговыми названиями OXONE (товарный знак фирмы E.I. duPont de Nemours) и CAROAT (товарный знак фирмы Degussa, Peroxid-Chemie GmbHCo. KG, Dr.Gustav-Adolph-Str. 3, D-82049 Pullach, Germany) в комбинации с кетоном, предпочтительно ацетоном. Дигидроксилирование можно проводить, например, с помощью тетраоксида осмия и дикалийосмийтетраоксида, предпочтительно в присутствии вспомогательного окислителя, такого как, например, гексацианоферрат калия, пероксид водорода или N-метилморфолин N-оксид; гидролитическое раскрытие оксирана, происходящее в результате эпоксидирования, также позволяет получить продукт дигидроксилирования. Окисление можно проводить в инертных органических растворителях или их смесях, таких как,например, дихлорметан, тетрагидрофуран, эфир, гексан, циклогексан, диоксан, ацетон, этилацетат, ацетонитрил, вода, спирты и их смеси. Предпочтительный диапазон температур составляет от -80 до 100 С,предпочтительно от -50 до 50 С. Восстановление аномерной связи углерод-кислород оксирана или продукта дигидроксилирования можно проводить с помощью восстановительных реагентов, таких как, например, триалкилсиланы, такие как, например, триэтилсилан, борогидридов, таких как, например, борогидрид натрия, и гидридов алюминия, таких как, например, диизобутилалюминийгидрид. В зависимости от восстановительного реагента необходимо или, по меньшей мере, благоприятно присутствие кислоты Льюиса, такой как, например, эфират трифторида бора, хлориды цинка, триметилсилилхлорид или трифлат, алкил-, диалкилгалогенид или галогенид алюминия, трифлат меди, и кислот Бренстеда, таких как,например, хлористо-водородная кислота, уксусная кислота, алкил- или арилсульфоновые кислоты, трифторуксусная кислота. Дихлорметан, ацетонитрил, тетрагидрофуран, эфир, гексан входят в число предпочтительных растворителей. Предпочтительный диапазон температур составляет от -80 до 120 С. Также можно использовать водород в комбинации с катализатором, содержащим переходный металл, таким как, например, палладий на угле, никель Ренея и гидроксид палладия. Затем продукт формулы XXXIII можно превратить в продукт формулы I путем отщепления, предпочтительно гидролиза защитных групп R2, не обозначающих водород, предпочтительно с использованием методик, описанных выше в настоящем изобретении. На схеме 2 с проиллюстрирован альтернативный путь получения С-глюкозидов, в котором исходным веществом является глюкаль XXX (см., например, публикации Synlett 2003, pp. 870-872; Tetrahedron 2002, 55, pp. 1997-2009 и цитированную в них литературу, в которой описаны аналогичные методики). Эпоксидирование с помощью подходящего окислительного реагента превращает глюкаль XXX в соответствующий глюкальоксид XXXIV. Условия реакции, подходящие для этого превращения, уже описаны для аналогичного превращения глюкаля XXXII, показанного на схеме 2b. Из числа описанных окислительных реагентов предпочтительными являются диметилдиоксиран и трифтордиметилдиоксиран, полученные отдельно или образовавшиеся in situ. Указанное окисление можно провести с помощью, например, пероксомоносерной кислоты, пероксодисерной кислоты их солей в присутствии по меньшей мере одного кетона, предпочтительно тройных солей формулы 2KHSO5KHSO4K2SO4, которые имеются в продаже, например, под торговыми названиями OXONE (товарный знак фирмы E.I. du Pont deNemours) и CAROAT (товарный знак фирмы Degussa, Peroxid-Chemie GmbHCo. KG, Dr.-GustavAdolph-Str. 3, D-82049 Pullach, Germany) в комбинации с кетоном, предпочтительно ацетоном. Реакцию предпочтительно проводят при температурах в диапазоне от -80 до 0 С в инертном органическом растворителе или их смесях. Предпочтительные растворители выбраны из группы, включающей диоксан,1,2-диметоксиэтан, толуол, гексан, тетрагидрофуран, диэтиловый эфир, дихлорметан и их смеси. В описанных выше и ниже реакциях защитные группы R2 предпочтительно независимо друг от друга выбраны из группы, включающей С 1-С 4-алкилкарбонил, С 1-С 4-алкилоксикарбонил, арилметил и RaRbRcSi, где арил, Ra, Rb и Rc являются такими, как определено выше в настоящем изобретении. Последующая реакция, раскрытие эпоксида металлированным агликоном формулы VI, в которой М обозначает литий-, магний-, цинк-, индий-, алюминий- или борсодержащий фрагмент, дает искомый Сглюкозид. Для этого превращения предпочтительным значением М является литий, галогенид магния,галогенид цинка, галогенид индия, галогенид алюминия, диалкилалюминийгалогенид или производное бороновой кислоты. Синтез литиевого или магниевого производного соединения VI подробно описан на схеме 2 а, и переметаллирование этих соединений с образованием альтернативных содержащих металл соединений можно провести аналогично переметаллированию литиированного глюкаля в металлсодержащие производные, приведенные на схеме 2b. Реакция раскрытия эпоксида может протекать без вспомогательного вещества или в присутствии соли или комплекса переходного металла, такого как, например, цианид или галогенид меди, или в присутствии кислоты Льюиса, такой как, например, эфират трифторида бора или триметилсилилхлорид или трифлат. Подходящими инертными растворителями могут являться, например, ацетон, эфир, тетрагидрофуран, ацетонитрил, дихлорметан, толуол, гексан и их смеси. Предпочтительный диапазон температур составляет от -80 до 60 С. Затем продукт формулы XXXIII можно превратить в продукт формулы I путем отщепления, предпочтительно гидролиза защитных групп R2, не обозначающих водород, предпочтительно с использованием методик, описанных выше в настоящем изобретении. Производное глюкозы XXXV, содержащее возможно отщепляющуюся группу Hal у аномерного атома углерода, также можно использовать в качестве исходного вещества для сочетания с металлированным арилагликоном VI (см. публикацию J. Carbohydr. Chem. 1994, 13, pp. 303-321 и цитированную в ней литературу, в которой описаны аналогичные методики). Подходящими отщепляющимися группамиHal могут быть галогенидные, алкоксидные, ацильные группы, такие как карбоксилатные или карбонатные; предпочтительно F, Cl, Br, С 1-С 3-алкилкарбонилоксигруппа, С 1-С 3-алкилоксикарбонилоксигруппа или С 1-С 3-алкилоксигруппа, такая как, например, Cl, Br, метоксид, ацетат или метилкарбонат. Подходящими металлами М, присоединенными к арильному фрагменту, являются, например, литий, магний в виде, например, галогенида магния, цинк в виде, например, галогенида цинка, индий в виде, например,дигалогенида индия, бор в виде, например, бороновой кислоты или эфира бороновой кислоты. Получение этих металлированных арилов из соответствующих галогенированных ароматических соединений описано на схеме 2 с. Реакции замещения можно проводить при отсутствии или в присутствии дополнительной кислоты Льюиса, такой как, например, эфират трифторида бора, триметилсилилхлорид или трифлат в зависимости от использующегося металлсодержащего соединения или донора глюкозила. Реакцию предпочтительно проводят в инертных органических растворителях или их смесях. Предпочтительный растворитель предпочтительно выбирают с учетом необходимых металлированного агликона,донора глюкозила и вспомогательных веществ; предпочтительными могут быть следующие растворители: тетрагидрофуран, диоксан, толуол, гексан, эфир, N-метилпирролидинон, диметилацетамид, диметилформамид, ацетонитрил, дихлорметан и их смеси. Реакцию сочетания обычно проводят при температуре от -80 до 120 С, предпочтительно от -60 до 60 С. В описанных выше и ниже реакциях защитные группыR2 предпочтительно независимо друг от друга выбраны из группы, включающей С 1-С 4-алкилкарбонил,С 1-С 4-алкилоксикарбонил, арилметил и RaRbRcSi, где арил, Ra, Rb и Rc являются такими, как определено выше в настоящем изобретении. Затем продукт формулы II можно превратить в продукт формулы I путем отщепления, предпочтительно гидролиза защитных групп R2, не обозначающих водород, предпочтительно с использованием методик, описанных выше в настоящем изобретении. Синтез галогенароматического соединения V можно проводить с помощью стандартных методик органической химии или, по меньшей мере, методик, известных из специальной литературы по органическому синтезу (см., в частности, публикацию J. March, Advanced Organic Reactions, Reactions, Mechanisms, and Structure, 4th Edition, John WileySons, Chichester/New York/Brisbane/Toronto/Singapore, 1992 и цитированную в ней литературу). Примеры таких методик приведены в описанных ниже методологиях синтеза. На приведенных ниже схемах X обозначает бром или йод,Alk обозначает С 1-С 4-алкил,R обозначает С 1-С 4-алкил, С 1-С 4-алкоксигруппу, CF3, арил или арил-С 1-С 3-алкил, где арильные группы могут быть моно- или полизамещенными с помощью L1;R1 является таким, как определено выше в настоящем изобретении; иL1 является таким, как определено выше в настоящем изобретении; если не указано иное. На схеме 3 описан синтез агликона V с использованием в качестве исходного вещества производного бензофенона IX, которое можно получить из производного бензойной кислоты и фенилалкилового эфира или металлированного фенилалкилового эфира (см. схемы 5, 8 и 9). Первой стадией является отщепление эфирного фрагмента в соединении IX, которое можно провести в нейтральной, кислой и щелочной среде. Подходящими для этого превращения кислыми реагентами являются, например, трихлорид или трибромид, или трийодид бора, триметилсилил йодид, хлорид или бромид алюминия, бромистоводородная кислота, хлористо-водородная кислота, хлорид церия, трифторуксусная кислота и трифторметилсульфоновая кислота, которые можно использовать совместно с нуклеофилом, таким как, например, галогениды металлов, такие как, например, йодид натрия, вода, алкилтиолы, тиоанизол и диалкилсульфиды, которые могут связывать отщепляющуюся алкильную группу. В зависимости от использующейся кислоты предпочтительными являются растворители, выбранные из группы, включающей галоге- 15014468 нированные углеводороды, такие как, например, дихлорметан, хлороформ или 1,2-дихлорэтан, ацетонитрил, толуол, гексан, уксусная кислота и их комбинации. Также возможно проведение реакций без дополнительного растворителя. Реакции обычно проводят при температуре от -90 до 150 С, предпочтительно от -80 до 50 С. Отщепление в нейтральной или щелочной среде можно проводить, например, с помощью тиолятов металлов, таких как, например, сульфид натрия, этантиолят натрия, триметилсилилтиолят натрия, тиофенолят натрия, цианид натрия и йодид лития, в растворителях, таких как, например, диметилформамид, диметилацетамид, 1,3-диметил-2-оксогексагидропиримидин, N-метилпирролидон, тетрагидрофуран, коллидин и хинолин при температурах от 0 до 250 С, предпочтительно от 50 до 180 С. Вторая стадия, представленная на схеме 3, включает присоединение остатка R1 к фенольному атому кислорода соединения VIII. Это превращение можно провести в щелочной среде как классическую реакцию нуклеофильного замещения. Соответственно, фенол депротонируют основанием с образованием соответствующего фенолята. Подходящими основаниями являются, например, соли металлов группы I или II,предпочтительно карбонаты, гидроксиды, алкоголяты, такие как, например, метоксид, этоксид или третбутоксид, и гидриды металлов, такие как, например, гидрид натрия. Реакцию можно провести в полярных и неполярных растворителях, а также без растворителя, предпочтительно в спиртах, таких как, например, этанол, изопропанол или бутанол, ацетон, вода, диметилформамид, диметилацетамид, Nметилпирролидон, диметилсульфоксид, тетрагидрофуран, дихлорметан и их смеси. Затем полученный фенолят вводят в реакцию с электрофильным реагентом для R1 при температурах от 20 до 180 С, предпочтительно от 40 до 120 С. Подходящими электрофилами для R1 являются, например, галогениды, такие как хлориды, бромиды или йодиды, алкилсульфонаты, такие как, например, метилсульфонат, трифторметансульфонат,арилсульфонаты,такие как,например,4-бромфенилсульфонат,4 метилфенилсульфонат или фенилсульфонат. Альтернативной методикой присоединения R1 к фенолу VIII является присоединение фенола VIII к группе R1, в которой имеется соответствующим образом расположенная двойная связь С=С. Эту реакцию можно проводить в присутствии кислоты Бренстеда, такой как,например, трифторметансульфоновая кислота, хлористо-водородная кислота, серная кислота, или катализаторов, содержащих переходные металлы, таких как, например, соли платины, палладия или золота или их комплексы; предпочтительными солями являются трифлат, хлорид, бромид и йодид (см., например, публикацию Cai-Guang Yang and Chuang He; J. Am Chem. Soc. 2005, 727 и цитированную в ней литературу). Растворитель, наиболее подходящий для присоединения, зависит от используемой кислоты или переходного металла. Могут быть подходящими такие растворители, как, например, толуол, бензол,дихлорметан, 1,2-дихлорэтан, ацетонитрил, тетрагидрофуран, диметилацетамид, N-метилпирролидон,гексан и этилацетат. Реакцию проводят при температуре от 0 до 200 С, предпочтительно от 20 до 140 С. На схеме 3 заключительным является восстановление бензофенона VII с получением агликона V. Восстановительными реагентами, подходящими для этого превращения, являются, например, силан, такой как, например, Et3SiH и триизопропилсилан, борогидрид, такой как, например, NaBH4, и гидрид алюминия, такой как, например, LiAlH4, в присутствии кислоты Льюиса, такой как, например,BF3OEt2, трис(пентафторфенил)боран, трифторуксусная кислота, хлористо-водородная кислота, хлорид алюминия или InCl3. Реакции предпочтительно проводят в растворителях, таких как, например, галогенированные углеводороды, такие как дихлорметан и 1,2-дихлорэтан, толуол, бензол, гексан, ацетонитрил и их смеси при температурах от -30 до 150 С, предпочтительно от 20 до 100 С. Восстановление водородом в присутствии катализатора, содержащего переходный металл, такого как, например, Pd на угле, является другой возможной методикой синтеза, но в данном случае оно может оказаться менее подходящим вследствие конкурентных реакций восстановления, протекающих для остальной части молекулы. Также возможно восстановление по Вольфу-Кишнеру или его варианты. Таким образом, кетон превращается гидразином или его производным, таким как, например, 1,2-бис(трет-бутилдиметилсилил)гидразин, в гидразон, который в сильнощелочной реакционной среде и при нагревании разлагается с образованием дифенилметана V и азота. Реакцию можно проводить в одном реакторе или после выделения гидразона или его производного посредством двух отдельных стадий реакции. Подходящие основания включают, например, KOH, NaOH или KOtBu в растворителях, таких как, например, этиленгликоль, толуол, ДМСО (диметилсульфоксид), 2-(2-бутоксиэтокси)этанол или трет-бутанол; также можно проводить реакции без использования растворителей. Реакции можно проводить при температурах от 20 до 250 С, предпочтительно от 80 до 200 С. Альтернативой проводимому в щелочной среде восстановлению по Вольфу-Кишнеру является восстановление по Клеменсену, которое протекает в кислой среде и которое также можно использовать в настоящем изобретении, если одновременно не протекает дегалогенирование. На схеме 4 представлена немного иная методика синтеза агликона V, чем на схеме 3. Однако расщепление эфира и этерификацию, приведенную на схеме 4, можно в основном провести при условиях проведения реакции, аналогичных использованным в методике синтеза, описанной выше для получения соединений VIII и VII. Схема 4 Синтез агликона V - методика 2 На схеме 5 описано получение агликона V с использованием в качестве исходных веществ известного бензоилхлорида XII и фенилового эфира XIII. Первую стадию, получение бензофенона VII, можно охарактеризовать, как реакцию Фриделя-Крафтса или ацилирование типа Фриделя-Крафтса, что является хорошо известной и широко применяющейся методикой органического синтеза. В принципе, бензоилхлорид XII можно заменить другими производными бензойной кислоты, такими как, например, ангидриды, эфиры или бензонитрилы. В этой классической реакции можно использовать самые различные субстраты и ее обычно проводят в присутствии катализатора, такого как, например, AlCl3, FeCl3, йод, железо, ZnCl2, серная кислота или трифторметансульфоновая кислота, которую используют в каталитических или стехиометрических количествах. Реакции предпочтительно проводят в хлорированных углеводородах, таких как, например, дихлорметан или 1,2-дихлорэтан, в углеводородах, таких как, например, гексан при температурах в диапазоне от -30 до 140 С, предпочтительно от 30 до 100 С. Однако можно использовать другие растворители и смеси растворителей, а также проводить реакции без растворителя или реакции в микроволновой печи. Вторая стадия реакции на схеме 5 аналогична последней реакции на схеме 3, как это описано выше в настоящем изобретении. На схеме 6 представлен альтернативный синтез агликона V путем проводимого по реакции типа Фриделя-Крафтса алкилирования фенилового эфира XIII содержащим бензильную группу электрофиломXIV (см. публикации Angew. Chem. 2005, 117, pp. 242-246 и Syn. Commun. 2004, 34, pp. 3161-3165 и цитированную в них литературу). Реакцию обычно проводят в присутствии катализатора, предпочтительно кислоты Льюиса, такой как, например, хлорид скандия, хлорид цинка, хлорид алюминия или трифторид бора, кислоты Бренстеда, такой как, например, серная кислота, хлористо-водородная кислота или фторид водорода, соли лантанида, такой как, например, сульфат церия или хлорид иттербия, соли актинида, соли или комплекса переходного металла, такого как, например, IrCl3nH2O, RhCl3nH2O, H2[PtCl6]6H2O илиH2[PdCl6]6 Н 2 О. Катализаторы можно использовать в стехиометрических или избыточных количествах,хотя во многих случаях достаточны стехиометрические или даже каталитические количества. Реакции обычно проводят при избытке ароматического соединения XIII по отношению к содержащему бензильную группу электрофилу, без растворителя; хотя также можно использовать инертные растворители,такие как, например, галогенированные углеводороды или углеводороды. Реакцию обычно проводят при температурах от 0 до 200 С, предпочтительно от 20 до 140 С. Схема 6 Синтез агликона V - методика 4 По методике, представленной на схеме 7, сначала синтезируют фениловый эфир XVI из монозамещенного фенола XV, что можно выполнить аналогично этерификации, представленной на схеме 3. На второй стадии, указанной на схеме 7, остаток Z2 заменяют на металл или замещенный металлсодержащий остаток. Литий- или магнийзамещенные ароматические соединения XVII можно получить из хлорированных, бромированных или йодированных ароматических соединений XV таким же образом, как в случае металлированного агликона VI, описанного на схеме 2 а. Соответствующее борзамещенное соединение, такое как, например, бороновая кислота, эфир бороновой кислоты или диалкиларилборан, можно получить из этих металлированных фенилов XVII по реакции с подходящим борсодержащим электрофилом, таким как, например, эфир бороновой кислоты, эфир галогенбороновой кислоты, эфир алкилбороновой кислоты, эфир диалкилбороновой кислоты, тригалогенборан и их производные. Кроме того, боронилированное ароматическое соединение XVII также можно получить из соответствующих хлорированных, бромированных, йодированных или псевдогалогенированных предшественников, таких как, например, трифторметансульфонированный или тозилированный предшественник и диборпроизводное, такое как, например, бис(пинаколято)дибор и бис(неопентилгликолято)дибор, или борана, такого как, например, пинаколборан, с помощью катализируемой переходным металлом реакции (см., например, публикацию Tetrahedron Lett. 2003, p. 4895-4898 и цитированную в ней литературу). Переходным металлом является, например, палладий, который используют в виде металла, соли или комплекса; обычными источниками Pd являются, например, палладий на угле, ацетат палладия, хлорид палладия, бромид палладия,дибензилиденацетонат палладия, которые используют поодиночке или в комбинации с лигандом, таким как, например, фосфины, такие как, например, трициклогексилфосфин, трифенилфосфин, 1,1'бис(дифенилфосфино)ферроцен и тритолилфосфин, или фосфиты, или соли имидазолия, такие как 1,3 диарил- или диалкилимидазолийгалогениды или -псевдогалогениды, или соли дигидроимидазолия. Та- 18014468 кой комплекс переходного металла с лигандом можно получить in situ или с помощью отдельной стадии. Реакции предпочтительно проводят в присутствии основания, такого как, например, триэтиламин, ацетат калия, карбонат калия, фосфат калия, гидроксид натрия, триэтиламин или этилдиизопропиламин, в растворителях, таких как, например, ацетонитрил, тетрагидрофуран, диметилсульфоксид, диметилформамид, диметилацетамид, N-метилпирролидон, диоксан, толуол и их смеси при температуре от 0 до 180 С,предпочтительно от 60 до 140 С. Литий- или магнийзамещенные фенилы XVII самопроизвольно присоединяются к бензальдегиду XVIII с образованием диарилметанола XIX. Эту реакцию можно провести в растворителях, таких как, диэтиловый эфир, тетрагидрофуран, толуол, дихлорметан, диоксан, углеводороды, таких как, например, гексан и их смеси при температурах в диапазоне от -100 до 20 С, предпочтительно от -80 до 0 С. Арилбороновые кислоты XVII можно присоединить к производному бензальдегидаXVIII с помощью катализируемой родием реакции и получить соответствующий диарилметанол XIX(см., например, публикацию Adv. Synth. Catal. 2001, p. 343-350 и цитированную в ней литературу). Заключительной стадией, представленной на схеме 7, является восстановление диарилметанола XIX в агликон V. Подходящими для этого превращения восстановительными реагентами являются, например,NaBH4, LiAlH4, iBu2AlH, Et3SiH, iPr3SiH или Ph2SiClH. Реакцию обычно проводят в присутствии кислоты Льюиса, такой как, например, BF3OEt2, трифторуксусная кислота, хлористо-водородная кислота, InCl3 или AlCl3, в растворителе, таком как галогенированные углеводороды, такие как, например, дихлорметан или 1,2-дихлорэтан, толуол, углеводороды, такие как, например, гексан, ацетонитрил или их смеси при температурах от -80 до 150 С, предпочтительно от -20 до 100 С. Восстановление водородом в присутствии катализатора, содержащего переходный металл, такой как, например, Pd на угле, в принципе, также возможно, хотя при использовании этой методики необходимо соблюдать особую осторожность, чтобы полностью сохранить целостность остальной части молекулы. Схема 7 Синтез агликона V - методика 5 По методике синтеза, представленной на схеме 8, сначала металлированное производное фенилового эфира XXI присоединяют к бензойной кислоте или ее производному (XX), такому как эфиры бензойной кислоты, ангидриды бензойной кислоты, бензамиды, такие как, например, типа Вайнреба, бензонитрилы или бензоилхлориды, и получают бензофенон VII. Литиевые или магниевые производные фениловых эфиров XXI в большинстве случаев можно присоединить к бензамидам, эфирам бензойной кислоты,бензоилхлоридам, ангидридам бензойной кислоты, и бензонитрилам и получить искомый бензофенонVII, но только литиированные фениловые эфиры взаимодействуют с бензойными кислотами с получением этого же соединения. Последнюю реакцию можно провести, например, в тетрагидрофуране, диоксане,диэтиловом эфире, бензоле, толуоле, гексане и их смеси при температуре от -80 до 100 С, предпочтительно от -30 до 40 С. Бензонитрилы и бензамиды, такие как, например, соответствующий амид типа Вайнреба или близкое к нему производное, предпочтительно вводить в реакцию с тетрагидрофуране,диоксане, толуоле, гексане, эфире и их смеси при температурах в диапазоне от -90 до 50 С, предпочтительно от -80 до 20 С. Бензоилхлориды и ангидриды и эфиры бензойной кислоты обычно используют в инертных растворителях, таких как тетрагидрофуран, диэтиловый эфир, толуол, дихлорметан, диоксан,углеводороды, такие как, например, гексан или их смесях при низких температурах, предпочтительно от-80 до 0 С. Для исключения двойного присоединения металлоорганического соединения к бензоилхлоридам, ангидридам или эфирам бензойной кислоты с образованием соответствующего спирта присоединение можно предпочтительно проводить в присутствии поглощающего реагента, такого как, например,триметилсилилхлорид. Альтернативной методикой исключения двойного присоединения в указанных выше случаях может быть переметаллирование с образованием менее реакционноспособного нуклеофила XXI. Подходящими металлами являются, например, цинк, церий, хром или индий, которые вводят,например, в виде хлорида, бромида, йодида или псевдогалогенида, такого как, например, трифторметан- 19014468 сульфонат, для переметаллирования литий- или магнийсодержащего соединения с получением соответствующего менее реакционноспособного, более селективного металлорганического соединения XXI. Переметаллирование предпочтительно проводят в растворителе, в котором образовалось исходное металлоорганическое соединение (см. выше), при температурах от -90 до 0 С. Переметаллирование не ограничивается указанными металлами и борсодержащими соединениями, уже указанными на схеме 7, и можно использовать, например, станнаны или силаны. Некоторые из переметаллированных соединений самопроизвольно взаимодействуют с соответствующим содержащим бензоильную группу электрофилом, в особенности с бензоилхлоридом и ангидридом бензойной кислоты, но может быть полезным прибавление катализатора, содержащего переходный металл. В частности, для получения диарилкетонов VII можно использовать производные соединений XXI, полученные с помощью арилбороновых кислот, их эфиров, диалкилборанов, арилтрифторборатов, станнанов, силанов, индия, хрома и цинка, и провести их сочетание с производными бензоилхлорида XX при катализе переходным металлом, таким как, например, палладий, медь, железо, никель, который можно использовать в виде элемента или соли, такой как,например, ацетат, хлорид, бромид, йодиды, ацетилацетонат, трифторметансульфонат и цианид, в сочетании с лигандами, такими как, например, фосфиты, фосфины, такие как, например, трифенилфосфин, трициклогексилфосфин, тритолилфосфин, 1,3-замещенные имидазолиевые или дигидроимидазолиевые соединения. Содержащие активный переходный металл соединения можно получить до прибавления к компонентам реакции сочетания, а также в присутствии компонентов реакции in situ. Подходящими растворителями являются, например, диметилформамид, диметилацетамид, N-метилпирролидон, диметилсульфоксид, диоксан, эфир, гексан, толуол, тетрагидрофуран, дихлорметан или их смеси, которые предпочтительно используют при температуре от -50 до 150 С, особенно предпочтительно при температуре от 0 до 120 С. Заключительное превращение с получением агликона V подробно описано выше и его аналогичным образом можно использовать в этом случае. Схема 8 Синтез агликона V - методика 6 В соответствии со схемой 9 металлированные арилы XXIII, которые можно синтезировать так, как описано выше, также можно ввести в реакцию с содержащими бензильную группу электрофилами XXII,такими как, например, бензилхлориды, -бромиды, -йодиды, -сульфонаты, -фосфонаты, -карбонаты или-карбоксилаты, и получить диарилметаны V. Литиевые или магниевые производные фенилсодержащих соединений XXIII полезно (но не всегда обязательно) вводить в реакцию в присутствии переходного металла, такого как, например, медь, железо, никель или палладий (см. например, публикации Org. Lett. 2001, 5, 2871-2874 и Tetrahedron Lett. 2004, p. 8225-8228 и цитированную в них литературу). Подходящими растворителями являются, например, тетрагидрофуран, диоксан, толуол, дихлорметан, гексан, эфир или их смеси. Температуры, при которых проводят реакции, находятся в диапазоне от -90 до 20 С, предпочтительно от -80 до -20 С. Переходный металл можно использовать в виде элемента, например, на угле, в виде соли, такой как, например, ацетат, ацетилацетонат, цианид, хлорид, бромид, йодид, трифторметансульфонат, или в виде комплекса, такого как, например, с дибензилиденацетонами, фосфитами,фосфинами, такими как, например, трифенилфосфин, трициклогексилфосфин или тритолилфосфин, или с карбенами, полученными, например, из 1,3-замещенных имидазолиевых или дигидроимидазолиевых соединений. Содержащие активный переходный металл соединения можно получить in situ в присутствии компонентов реакции или до прибавления к компонентам реакции сочетания. Содержащие металл арилы XXIII, включающие, например, остаток, содержащий бор, олово, кремний, цинк, индий, хром,предпочтительно используют в комбинации с катализатором, содержащим переходный металл. Подходящими содержащими металл соединениями этого типа являются, например, бороновые кислоты, эфиры бороновых кислот, диалкилбораны, трифторбораты, триалкилстаннаны, трихлорстаннаны, триалкоксисиланы, дигалогениндийзамещенные или галогенцинкзамещенные соединения. Замещенные металлом соединения XXIII можно синтезировать, как это описано выше, путем переметаллирования, исходя из соответствующих литий- или магнийсодержащих производных соединений или, как в случае цинка,хрома и индия, также непосредственно из соответствующего арилхлорида, -бромида или -йодида путем- 20014468 внедрения элементарного металла. Реакцию сочетания с содержащим бензильную группу электрофилом можно проводить в тетрагидрофуране, диметилформамиде, диметилацетамиде, N-метилпирролидоне,диметилсульфоксиде, толуоле, эфире, диоксане, дихлорметане, ацетонитриле, гексане, воде, спиртах,таких как, например, этанол, изопропанол или их смеси, при температурах проведения реакции, равных от -30 до 180 С, предпочтительно от 20 до 150 С. В зависимости от металла может быть полезным или даже важным использование дополнительного основания, такого как, например, триэтиламин, этилдиизопропиламин, карбонат цезия, или калия, или натрия, или лития, трет-бутоксид натрия или лития, фосфат калия, фторид калия или цезия или тетрабутиламмонийфторид, гидроксид натрия, гидроксид таллия,метоксид натрия и/или других добавок, таких как, например, хлорид лития, соли серебра, такие как, например, карбонат или оксид, тетрабутиламмонийбромид и бромид натрия (см., например, публикацию М. Schlosser, Organometallics in Synthesis, John WileySons, Chichester/New York/Brisbane/Toronto, 1994 и цитированную в ней литературу). Схема 9 Синтез агликона V - методика 7 На схеме 10 описано получение агликона V через промежуточный продукт XXVI, который можно получить в соответствии со схемой 8. Если Z5 обозначает галоген, такой как F, то промежуточный продукт XXVI альтернативно можно получить ацилированием по Фриделю-Крафтсу в соответствии со схемой 5. Замену Z5 в соединении XXVI на O-R1 можно провести по разным методикам. В случаях, когда Z5 предпочтительно обозначает фтор, хлор, йод, трифторметилсульфонат O-R1 можно присоединить путем электрофильного замещения по ароматическому кольцу, при котором R1-ОН или его анион замещает Z5 по схеме присоединение/элиминирование. Реакцию обычно проводят в растворителях, таких как, например, диметилформамид, диметилацетамид, диметилсульфоксид, тетрагидрофуран, диоксан, третбутанол, толуол, N-метилпирролидон, вода, спирт или их смеси в присутствии основания, такого как,например, трет-бутоксид лития, или натрия, или калия, карбонат натрия, калия или цезия, гидроксид натрия или калия, трикалийфосфат, триэтиламин, этилдиизопропиламин или диазабициклоундецен, при температурах в диапазоне от 0 до 180 С, предпочтительно от 40 до 140 С. R1-ОН также можно использовать в качестве растворителя и его можно депротонировать, например, гидридом натрия или натрием и получить алкоксид до присоединения соединения XXVI. Для усиления нуклеофильности системы R1-Ометалл может быть полезным прибавление краун-эфиров, таких как, например, 18-краун-6. Сочетание выделяемого промежуточного продукта XXVI с R1-ОН также можно проводить в присутствии соли или комплекса переходного металла, такого как, например, полученный из Pd или Си (реакция Ульмана или типа Ульмана). В этом случае Z5 предпочтительно обозначает йод или трифторметансульфонат. Те же самые растворители, основания, добавки и температуры, указанные для некаталитической реакции, можно использовать для каталитической, за тем исключением, что последнюю предпочтительно проводить в атмосфере инертного газа, такого как аргон или азот. Катализатор обычно используется в виде элемента как такового или на угле, в виде соли, такой как, например, хлорид, бромид, ацетат, цианид, или в воде комплекса с лигандами, такими как, например, фосфиты, фосфины, дибензилиденацетон, 1,3 дизамещенные имидазол- или дигидроимидазолкарбены. Если Z5 обозначает арилбороновую кислоту или трифторборат, то R1-ОН можно присоединить с помощью катализируемой медью(II) реакции с использованием источника меди, такого как, например, ацетат меди(II), в присутствии основания, такого как, например, триэтиламин или пиридин, в растворителях, таких как, например, тетрагидрофуран, дихлорметан, 1,2-дихлорэтан, ацетонитрил, диоксан, диметилформамид, диметилацетамид или Nметилпирролидон. Реакцию можно проводить со стехиометрическими количествами содержащего медь катализатора или в присутствии вспомогательного окислителя, такого как, например, кислород, пиридинN-оксид или тетраметилпиперидиноксид, с использованием только каталитических количеств катализатора. Полезны сухие растворители и присутствие осушающих реагентов, таких как, например, молекулярные сита (см., например, публикацию Angew. Chem. 2003, 115, pp. 5558-5607 и цитированную в ней литературу). На схеме 11 представлена предпочтительная методика получения агликона V, которая соответствует схеме 10, но промежуточный продукт XXVI получают ацилированием по Фриделю-Крафтсу в соответствии со схемой 5. На схеме 11 и в последующих разделах описаны предпочтительные условия и варианты осуществления способа, соответствующего седьмому объекту настоящего изобретения. Для получения агликона V в качестве исходных веществ используют известный бензоилхлорид XII и галогенбензол XXVII. Заместитель X предпочтительно обозначает атом брома или йода. Предпочтительным значением заместителя Z5 является атом фтора. Первую стадию, получение бензофенона XXVI,можно охарактеризовать, как реакцию Фриделя-Крафтса или ацилирование типа Фриделя-Крафтса, что является хорошо известной методикой органического синтеза. В принципе, бензоилхлорид XII можно заменить другими производными бензойной кислоты, такими как, например, ангидриды, эфиры или бензонитрилы. Эту реакцию предпочтительно проводят в присутствии катализатора, такого как, например,AlCl3, FeCl3, йод, железо, ZnCl2, серная кислота или трифторметансульфоновая кислота, которую используют в каталитических или доходящих до стехиометрических количествах. Предпочтительным катализатором является AlCl3. Реакцию можно проводить с использованием и без использования дополнительных растворителей. Предпочтительными дополнительными растворителями являются хлорированные углеводороды, такие как, например, дихлорметан или 1,2-дихлорэтан, углеводороды, такие как, например,гексан или их смеси. В предпочтительном варианте осуществления реакцию проводят с использованием избытка галогенбензола XXVII, который дополнительно выступает в качестве растворителя. Предпочтительные температуры проведения реакции составляют от -30 до 140 С, предпочтительно от 30 до 85 С. После завершения реакции ее можно остановить водой. Органические растворители предпочтительно удалять. Промежуточный продукт XXVI можно выделить, предпочтительно путем кристаллизации, например, из воды. Вторая стадия реакции на схеме 11, которая представляет собой замещение Z5 на O-R1, аналогична второй стадии реакции на схеме 10, приведенной выше в настоящем изобретении. В предпочтительном варианте осуществления O-R1 в соответствии с правилами нуклеофильного замещения присоединяется по ароматическому кольцу, в котором R1-ОН или его анион замещает Z5 по схеме присоединение/элиминирование. Реакцию предпочтительно проводят в растворителе, таком как, например, диметилформамид, диметилацетамид, диметилсульфоксид, тетрагидрофуран, диоксан, трет-бутанол, толуол,гептан, N-метилпирролидон, вода, спирт или их смеси. Предпочтительные растворители выбраны из группы, включающей диметилформамид, тетрагидрофуран и диметилацетамид. Эту реакцию предпочтительно проводят в присутствии основания, такого как С 1-С 4-алкоксиды щелочных металлов, карбонаты щелочных металлов, гидроксиды щелочных металлов, фосфаты щелочных металлов, три(С 1-С 3-алкил)амины и другие N-содержащие органические основания. Примерами предпочтительных оснований являются трет-бутоксид лития или натрия, или калия, карбонат натрия, калия или цезия, гидроксид натрия или калия, трикалийфосфат, триэтиламин, этилдиизопропиламин,бис(триметилсилил)амид натрия (NaHMDS), диазабициклоундецен (DBU), 1,4-диазабицикло[2.2.2]октан(DABCO) или их смеси. Более предпочтительные основания выбраны из группы, включающей третбутоксид натрия или калия, гидроксид натрия или калия, карбонат цезия, смесь карбоната цезия и карбоната калия или их смеси. Количество основания предпочтительно находится в диапазоне от 1 до 5 моль основания на 1 моль промежуточного продукта XXVI. В случае, если основанием является карбонат,фосфат или их смеси, более предпочтительно, если полное количество основания находится в диапазоне от 2 до 4 моль основания, наиболее предпочтительно примерно 3 моль основания на 1 моль промежуточного продукта XXVI. Реакцию предпочтительно проводят при температурах в диапазоне примерно от -20 до 60 С, более- 22014468 предпочтительно примерно от -10 до 40 С, еще более предпочтительно примерно от 0 до 30 С. Промежуточный продукт VII можно выделить из реакционной смеси, предпочтительно кристаллизацией, например, из смеси этанола и воды. Путь синтеза, соответствующий схеме 11, завершается восстановлением бензофенона VII с образованием агликона V. Восстановительными реагентами, подходящими для этого превращения, являются силаны, предпочтительно три(С 1-С 3-алкил)силаны, такие как, например, триэтилсилан, диметилэтилсилан и триизопропилсилан, борогидриды, такие как, например, NaBH4, и гидриды алюминия, такие как,например, LiAlH4, в присутствии кислоты Льюиса, такой как, например, BF3OEt2,трис(пентафторфенил)боран, трифторуксусная кислота, хлористо-водородная кислота, хлорид алюминия или InCl3. Особенно предпочтительным восстановительным реагентом является Et3SiH в присутствии кислоты Льюиса, такой как, например, BF3OEt2. Другим особенно предпочтительным восстановительным реагентом является NaBH4 в присутствии кислоты Льюиса, такой как, например, трифторуксусная кислота. Количество восстановительного реагента, предпочтительно Et3SiH, предпочтительно составляет примерно от 1 до 5 моль, еще более предпочтительно примерно от 2 до 4 моль, наиболее предпочтительно примерно 3 моль на 1 моль бензофенона VII. Количество кислоты Льюиса, предпочтительно BF3OEt2,предпочтительно составляет примерно от 1 до 5 моль, еще более предпочтительно примерно от 1 до 3 моль на 1 моль бензофенона VII. Реакцию восстановления предпочтительно проводят в растворителе, таком как галогенированные углеводороды, например дихлорметан и 1,2-дихлорэтан, толуол, бензол, гексан, ацетонитрил и их смеси. Восстановление предпочтительно проводят при температурах примерно от -30 до 100 С, более предпочтительно примерно от -20 до 50 С, еще более предпочтительно примерно от -10 до 25 С. Агликон формулы V можно выделить и очистить или можно использовать для синтеза конечного продукта формулы I без дополнительной очистки. С использованием агликона формулы V в качестве исходного вещества продукт формулы I можно получить по методикам, описанным выше в настоящем изобретении, предпочтительно по методикам,описанным и представленным на схеме 2 а. Схема 11 Синтез агликона V - предпочтительный вариант осуществления В реакциях, описанных выше в настоящем изобретении, любую содержащуюся реакционноспособную группу, такую как этинил, гидроксигруппа, аминогруппа, алкиламиногруппа или иминогруппа,можно защитить во время реакции с помощью обычных защитных групп, которые отщепляются после проведения реакции. Например, защитной группой гидроксигруппы могут быть триметилсилильная, ацетильная, тритильная, бензильная или тетрагидропиранильная группа. Защитными группами для аминогруппы, алкиламиногруппы или иминогруппы могут быть, например, формильная, ацетильная, трифторацетильная, этоксикарбонильная, трет-бутоксикарбонильная, бензилоксикарбонильная, бензильная, метоксибензильная или 2,4-диметоксибензильная группа. Кроме того, полученные соединения и промежуточные продукты можно разделить на энантиомеры и/или диастереоизомеры, как указано выше в настоящем изобретении. Так, например, цис/транс-смеси можно разделить на цис- и транс-изомеры и соединения, содержащие по меньшей мере один оптически активный атом углерода можно разделить на энантиомеры. Так, например, цис/транс-смеси можно разделить с помощью хроматографии на цис- и транс- 23014468 изомеры, полученные соединения и промежуточные продукты, образующиеся в виде рацематов, можно разделить по методикам, которые сами по себе известны (см. Allinger N. L. and Eliel E. L. in "Topics inStereochemistry", Vol. 6, Wiley Interscience, 1971) на их оптические антиподы и соединения или промежуточные продукты, которые содержат по меньшей мере 2 асимметрических атома углерода, можно разделить на диастереоизомеры на основании различий их физико-химических характеристик по методикам,которые сами по себе известны, например, с помощью хроматографии и/или фракционной кристаллизации, и, если эти соединения образуются в виде рацематов, то их затем можно разделить на энантиомеры так, как это указано выше. Энантиомеры предпочтительно разделяют с помощью колонок, содержащих хиральные фазы, или посредством перекристаллизации из оптически активного растворителя, или по реакции с оптически активным веществом, которое образует с рацемическим соединением соли или производные, такие как,например, сложные эфиры или амиды, предпочтительно с кислотами и их активированными производными, или спиртами с разделением полученной таким образом смеси диастереоизомеров солей или производных, например, на основании различия их растворимостей, и свободные антиподы можно выделить из чистых диастереоизомеров солей или производных путем обработки подходящими реагентами. Обычно использующимися оптически активными кислотами являются, например, D- и L-формы винной кислоты или дибензоилвинной кислоты, ди-о-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Оптически активным спиртом может быть, например, (+)- или (-)-ментол и оптически активной ацильной группой в амидах, например, может быть (+)- или (-)-ментилоксикарбонильная группа. Кроме того, соединения и промежуточные продукты, предлагаемые в настоящем изобретении, можно превратить в их соли для применения в фармацевтике, предпочтительно в физиологически приемлемые соли с неорганическими или органическими кислотами. Кислоты, которые можно использовать для этой цели, включают, например, хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту и малеиновую кислоту. Соединения, предлагаемые в настоящем изобретении, также с успехом можно получить по методикам, описанным в приведенных ниже примерах, которые для этой цели можно сочетать с методиками,известными специалистам из литературы, например, предпочтительно с методиками, описанными в WO 98/31697, WO 01/27128, WO 02/083066, WO 03/099836 и WO 2004/063209. Выше и ниже в настоящем описании в структурных формулах не всегда явно указаны атомы Н гидроксигрупп. Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения без его ограничения. В случае, если давление указано в единицах "торр", соответствующие значения можно пересчитать в единицы СИ по соотношению 1 торр = 133,322 Па. Выражения "комнатная температура" и"температура окружающей среды" означают температуру, равную примерно 20 С. Ас - ацетил,Bu - бутил,Et - этил,EtOAc - этилацетат,i-Pr - изопропил,Me - метил,МеОН - метанол,МТБЭ - метил-трет-бутиловый эфир,ТГФ - тетрагидрофуран. Экспериментальные методики Пример I. (5-Бром-2-хлорфенил)-(4-метоксифенил)метанон. 38,3 мл Оксалилхлорида и 0,8 мл диметилформамида прибавляют к смеси 100 г 5-бром-2 хлорбензойной кислоты с 500 мл дихлорметана. Реакционную смесь перемешивают в течение 14 ч, затем фильтруют и отделяют от всех летучих компонентов на роторном испарителе. Остаток растворяют в 150 мл дихлорметана, полученный раствор охлаждают до -5 С и прибавляют 46,5 г анизола. Затем 51,5 г трихлорида алюминия порциями прибавляют так, чтобы температура не превышала 5 С. Раствор перемешивают в течение еще 1 ч при температуре от 1 до 5 С и затем выливают в измельченный лед. Органическую фазу отделяют и водную фазу трижды экстрагируют дихлорметаном. Объединенные органические фазы промывают водным раствором 1 М хлористо-водородной кислоты, дважды 1 М раствором гидроксида натрия и рассолом. Органическую фазу сушат, растворитель удаляют в вакууме и остаток пере- 24014468 кристаллизовывают из этанола. Выход: 86,3 г (64% от теоретического). Масс-спектр (ИЭР+ (ионизация электрораспылением: m/z = 325/327/329 (Br+Cl) [М+Н]+. Указанные ниже соединения можно получить аналогично тому, как это выполнено в примере I.(1) (5-Бром-2-хлорфенил)-(4-(R)-тетрагидрофуран-3-илоксифенил)метанон. Реакцию проводят по описанной выше методике, за тем исключением, что используют 2 экв. трихлорида алюминия. Реакционную смесь перемешивают при комнатной температуре после прибавления трихлорида алюминия.(2) (5-Бром-2-хлорфенил)-(4-(S)-тетрагидрофуран-3-илоксифенил)метанон. Реакцию проводят по описанной выше методике, за тем исключением, что используют 2 экв. трихлорида алюминия. Реакционную смесь перемешивают при комнатной температуре после прибавления трихлорида алюминия. Вариант А. 8,7 мл Оксалилхлорида и 0,3 мл диметилформамида прибавляют к смеси 24 г 5-бром-2 хлорбензойной кислоты с 150 мл дихлорметана. Реакционную смесь перемешивают в течение 14 ч, затем фильтруют и отделяют от всех летучих компонентов на роторном испарителе. Остаток растворяют в 105 мл фторбензола и нагревают до 85 С. Затем порциями прибавляют 13,3 г трихлорида алюминия и полученную реакционную смесь перемешивают в течение 16 ч при 85 С. После охлаждения до температуры окружающей среды реакционную смесь выливают в смесь 300 г измельченного льда и 100 мл концентрированной хлористо-водородной кислоты. Полученную смесь дважды экстрагируют этилацетатом. Объединенные органические экстракты промывают 1 М водным раствором гидроксида натрия, 1 М водным раствором хлористо-водородной кислоты и рассолом. После сушки над сульфатом магния растворитель удаляют в вакууме. Затвердевший остаток промывают петролейным эфиром и сушат в вакууме. Выход: 25,0 г (80% от теоретического). Масс-спектр (ИЭР+): m/z = 313/315/317 (Br+Cl) [M+H]+. Вариант В. К раствору 9,42 г 5-бром-2-хлорбензойной кислоты в 40 мл фторбензола и 0,1 мл N,Nдиметилформамида при температуре от 0 до 10 С прибавляют 4 мл оксалилхлорида. Раствор перемешивают примерно при 20 С в течение 2 ч. Избыточное количество оксалилхлорида выпаривают. Остаток разбавляют с помощью 38 мл фторбензола и при 0 С пятью порциями прибавляют 5,87 г хлорида алюминия. Раствор перемешивают при 80 С в течение 5 ч и реакцию останавливают с помощью 60 мл воды при температуре от 0 до 25 С. Продукт экстрагируют с помощью 50 мл изопропилацетата и дважды промывают с помощью 40 мл 3 мас.% рассола. Растворитель удаляют выпариванием и продукт кристаллизуют из гептана и воды. Выход: 11,94 г (92,4% от теоретического). Масс-спектр (ИЭР+): m/z = 314/316 (Cl) [М+Н]+. Пример III. (2-Хлор-5-йодфенил)-(4-фторфенил)метанон. К раствору 48,94 г 2-хлор-5-йодбензойной кислоты в 180 мл фторбензола и 0,3 мл N,Nдиметилформамида при температуре от 0 до 10 С прибавляют 16,2 мл оксалилхлорида. Раствор перемешивают примерно при 20 С в течение 2 ч. Избыточное количество оксалилхлорида выпаривают. Остаток- 25014468 разбавляют с помощью 166 мл фторбензола и при 0 С пятью порциями прибавляют 25,93 г хлорида алюминия. Раствор перемешивают при 75 С в течение 1,5 ч и реакцию останавливают с помощью 300 мл воды при температуре от 0 до 25 С. Продукт экстрагируют с помощью 300 мл изопропилацетата и дважды промывают с помощью 200 мл рассола (3 мас.%). Остаток воды и растворитель удаляют выпариванием. Выход: 60,56 г (95% от теоретического). Масс-спектр (ИЭР+): m/z = 361/363 (Cl) [М+Н]+. Пример IV. (5-Бром-2-хлорфенил)-(4-(S)-тетрагидрофуран-3-илоксифенил)метанон. Вариант А. К раствору 8,1 г (S)-3-гидрокситетрагидрофурана в 200 мл диметилформамида прибавляют 10,3 г трет-бутоксида калия. Смесь перемешивают при комнатной температуре в течение 10 мин и затем 24,0 г(5-бром-2-хлорфенил)-(4-фторфенил)метанона прибавляют при охлаждении на водяной бане так, чтобы температура раствора была ниже 35 С. Реакционную смесь перемешивают в течение 14 ч при комнатной температуре и затем разбавляют с помощью 1000 мл воды. Полученную смесь экстрагируют этилацетатом и объединенные экстракты промывают водой и рассолом. После сушки над сульфатом магния растворитель удаляют и остаток перекристаллизовывают из этанола. Выход: 22,5 г (77% от теоретического). Масс-спектр (ИЭР+): m/z = 382/384/386 (Br+Cl) [M+H]+. Вариант В. К раствору 19,00 г (5-бром-2-хлорфенил)-(4-фторфенил)метанона в 60 мл тетрагидрофурана и 5,87 г(S)-3-гидрокситетрагидрофурана прибавляют 9,60 г трет-бутоксида калия в 90 мл тетрагидрофурана при температуре от 0 до 5 С. Раствор перемешивают при 10 С в течение 0,5 ч. Реакцию останавливают с помощью 60 мл воды и 40 мл метил-трет-бутилового эфира при температуре от 0 до 25 С. Продукт промывают с помощью 80 мл рассола (3 мас.%). Растворитель удаляют выпариванием и вещество кристаллизуют из 135 мл смеси 2:1 изопропилацетат/вода. Выход: 20,1 г (87% от теоретического). Масс-спектр (ИЭР+): m/z = 382/384 (Cl) [М+Н]+. Пример V. (2-Хлор-5-йодфенил)-4-[(S)-(тетрагидрофуран-3-ил)окси]фенилметанон. К раствору 60,56 г (2-хлор-5-йодфенил)-(4-фторфенил)метанона в 170 мл тетрагидрофурана и 16,46 г (S)-3-гидрокситетрагидрофурана при температуре от 0 до 5 С прибавляют 26 г трет-бутоксида калия в 250 мл тетрагидрофурана. Раствор перемешивают при 10 С в течение 0,5 ч. Реакцию останавливают с помощью 170 мл воды и 170 мл метил-трет-бутилового эфира при температуре от 0 до 25 С. Продукт промывают с помощью 170 мл рассола (3 мас.%). Растворитель удаляют выпариванием и кристаллизуют из 220 мл изопропилацетата. Выход: 65,1 г (90% от теоретического). Масс-спектр (ИЭР+): m/z = 428/430 (Cl) [М+Н]+. Пример VI. 4-Бром-2-бромметил-1-хлорбензол. 4-бром-1-хлор-2 014468 гидроксиметилбензола и 5,9 г трифенилфосфина в 50 мл тетрагидрофурана, охлажденному до 5 С. После 1 ч перемешивания при температуре окружающей среды осадок отфильтровывают и растворитель удаляют в вакууме. Остаток очищают с помощью хроматографии на силикагеле (циклогексан/этилацетат 50:1). Выход: 4,9 г (76% от теоретического). Масс-спектр (EI): m/z = 282/284/286 (Br+Cl) [M]+. Пример VII. 4-Бром-1-хлор-2-(4-метоксибензил)бензол. Раствор 86,2 г (5-бром-2-хлорфенил)-(4-метоксифенил)метанона и 101,5 мл триэтилсилана в 75 мл дихлорметана и 150 мл ацетонитрила охлаждают до 10 С. Прибавляют 50,8 мл эфирата трифторида бора так, чтобы температура не превышала 20 С. Раствор перемешивают в течение 14 ч при температуре окружающей среды, а затем прибавляют еще 9 мл триэтилсилана и 4,4 мл эфирата трифторида бора. Раствор перемешивают в течение еще 3 ч при температуре от 45 до 50 С и затем охлаждают до температуры окружающей среды. Прибавляют раствор 28 г гидроксида калия в 70 мл воды и полученную реакционную смесь перемешивают в течение 2 ч. Затем органическую фазу отделяют и водную фазу трижды экстрагируют диизопропиловым эфиром. Объединенные органические фазы дважды промывают 2 М раствором гидроксида калия и один раз рассолом и затем сушат над сульфатом натрия. После удаления растворителя остаток промывают этанолом и сушат при 60 С. Выход: 50,0 г (61% от теоретического). Масс-спектр (ИЭР+): m/z = 310/312/314 (Br+Cl) [M+H]+. Указанные ниже соединения можно получить аналогично тому, как это выполнено в примере VII. Раствор 14,8 г 4-бром-1-хлор-2-(4-метоксибензил)бензола в 150 мл дихлорметана охлаждают в бане со льдом. Затем прибавляют 50 мл 1 М раствора трибромида бора в дихлорметане и раствор перемешивают в течение 2 ч при температуре окружающей среды. Затем раствор повторно охлаждают в бане со льдом и по каплям прибавляют насыщенный раствор карбоната калия. При температуре окружающей среды значение рН смеси 1 М водным раствором хлористо-водородной кислоты доводят примерно до 1,органическую фазу отделяют и водную фазу еще раз трижды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и растворитель полностью удаляют. Выход: 13,9 г (98% от теоретического). Масс-спектр (ИЭР-): m/z = 295/297/299 (Br+Cl) [M-H]-. Пример IX. 4-Бром-1-хлор-2-(4-циклопентилоксибензил)бензол. К смеси 40,0 г 4-(5-бром-2-хлорбензил)фенола и 71,0 г карбоната цезия в 300 мл этанола прибавляют 23 мл йодциклопентана. Смесь перемешивают при 60 С в течение ночи и затем охлаждают до температуры окружающей среды. Этанол выпаривают и к остатку прибавляют воду. Полученную смесь экстрагируют этилацетатом, объединенные экстракты сушат над сульфатом натрия и растворитель удаляют. Остаток фильтруют через силикагель (циклогексан/этилацетат 100:110:1). Выход: 34,4 г (70% от теоретического). Масс-спектр (ИЭР+): m/z = 364/366/368 (Br+Cl) [M]+. Указанные ниже соединения можно получить аналогично тому, как это выполнено в примере IX. Вариант А. К суспензии 250 г (5-бром-2-хлорфенил)-4-[(S)-(тетрагидрофуран-3-ил)окси]фенилметанона в 1,33 л ацетонитрила и 314 мл триэтилсилана при 20 С прибавляют 93 мл диэтилэфирата трифторида бора. Раствор перемешивают при 20 С в течение 16 ч. Смесь фильтруют и фильтрат нейтрализуют с помощью 1,5 л 1,5 М раствора гидроксида натрия при температуре от 0 до 20 С. Растворитель удаляют выпариванием и остаток разбавляют с помощью 1,3 л метил-трет-бутилового эфира. Продукт промывают с помощью 1,2 л 0,1 М NaOH, а затем с помощью 1 л воды. Растворитель удаляют выпариванием и большую часть триэтилсиланола удаляют путем отгонки с толуолом. Выход: 218 г (90% от теоретического). Масс-спектр (ИЭР+): m/z = 368/370 (Cl) [М+Н]+. Вариант В. К суспензии 50,00 г (5-бром-2-хлорфенил)-4-[(S)-(тетрагидрофуран-3-ил)окси]фенилметанона в 260 мл ацетонитрила и 34,68 г диметилэтилсилана при 20 С прибавляют 20,45 г диэтилэфирата трифторида бора. Раствор перемешивают при 20 С в течение 16 ч. Смесь фильтруют и фильтрат нейтрализуют с помощью 290 мл 1,5 М раствора гидроксида натрия при температуре от 0 до 20 С. Растворитель удаляют выпариванием и остаток разбавляют с помощью 260 мл метил-трет-бутилового эфира. Продукт промывают с помощью 240 мл 0,1 М NaOH, а затем с помощью 200 мл воды. Растворитель удаляют выпариванием и большую часть диметилэтилсиланола удаляют путем отгонки с гептаном. Выход: 45,76 г (95% от теоретического). Масс-спектр (ИЭР+): m/z = 368/370 (Cl) [М+Н]+. Вариант С. К суспензии 1,91 г (5-бром-2-хлорфенил)-4-[(S)-(тетрагидрофуран-3-ил)окси]фенилметанона и 0,38 г борогидрида натрия в 10 мл метиленхлорида (или, альтернативно, фторбензола) при 0 С прибавляют 5,92 г трифторуксусной кислоты. Раствор перемешивают при 20 С в течение 16 ч и реакцию останавливают с помощью 20 мл воды и 20 мл МТБЭ при температуре от 0 до 20 С. Продукт промывают с помощью 20 мл воды. Растворитель удаляют выпариванием. Выход: от 1,6 до 1,75 г (от 87 до 95% от теоретического). Вариант D. К суспензии 1,91 г (5-бром-2-хлорфенил)-4-[(S)-(тетрагидрофуран-3-ил)окси]фенилметанона и 0,8 г борогидрида натрия в 10 мл изопропилацетата при 0 С прибавляют 11,4 г трифторуксусной кислоты. Раствор перемешивают при 20 С в течение 16 ч и реакцию останавливают с помощью 20 мл воды и 20 мл МТБЭ при температуре от 0 до 20 С. Продукт промывают с помощью 20 мл воды. Растворитель удаляют выпариванием. Выход: 1,6-1,75 г (87-95% от теоретического).
МПК / Метки
МПК: C07H 15/203
Метки: производных, получения, способ, глюкопиранозилзамещённых, промежуточных, бензилбензола, продуктов
Код ссылки
<a href="https://eas.patents.su/30-14468-sposob-polucheniya-glyukopiranozilzameshhyonnyh-proizvodnyh-benzilbenzola-i-promezhutochnyh-produktov-dlya-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения глюкопиранозилзамещённых производных бензилбензола и промежуточных продуктов для их получения</a>
Предыдущий патент: Валковая мельница
Следующий патент: Бинарные смеси гиалуроновой кислоты и их терапевтическое применение
Случайный патент: Сварочная машина для сварки рельсов пути












