Новые соединения и методы их применения
Номер патента: 1603
Опубликовано: 25.06.2001
Авторы: Уотсон Кейт Джеффри, Криппнер Гай Й., Рис Филлип А., Джин Бетти, Ву Вен-Янг
Формула / Реферат
1. Макромолекулярное соединение, имеющее присоединенные к этому соединению одну или несколько молекул (агентов, связывающих нейраминидазу), которые связываются с активным центром нейраминидазы вируса гриппа, но не расщепляются этой нейраминидазой.
2. Макромолекулярное соединение по п.1, в котором агент, связывающий нейраминидазу, присоединен к молекуле через спейсерную или линкерную группу так, чтобы этот агент не был пространственно затруднен главной цепью макромолекулы.
3. Макромолекулярное соединение по п.1 или 2, в котором агент, связывающий нейраминидазу, имеет IC50, равную 10-6 М или менее.
4. Макромолекулярное соединение по любому из пп.1-3, в котором агент связывающий нейраминидазу, является производным сиаловой кислоты.
5. Макромолекулярное соединение по п.4, в котором производое сиаловой кислоты представляет собой соединение (I)
соединение (I) GG167
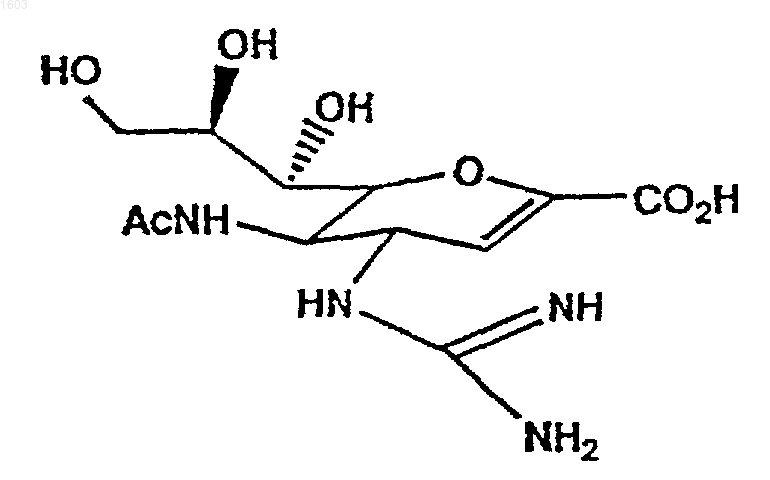
функционализированное в 7-ом положении структуры сиаловой кислоты.
6. Макромолекулярное соединение по любому из пп.1-5 формулы (II)
(X-Y)n-M-(Z)m
где Х представляет собой связывающееся с нейраминидазой производное 2,3-дегидросиаловой кислоты (2)

которое присоединяется в 7-ом положении посредством спейсерной группы Y к макромолекуле М, и Z представляет собой необязательный дополнительный заместитель на этой макромолекуле, в которой спейсерная группа Y соединена с группой W, и
где R представляет азидогруппу, незамещенную или замещенную гуанидиногруппу или незамещенную или замещенную аминогруппу;
R2 представляет СОСН3, СОСF3, SО2СН3 или SO2СF3;
W представляет O(C=O)NH, O(C=S)NH, NH(C=O)NH или NH(C=S)NH и присоединен посредством NH к группе Y;
m представляет целое число от 0 до 1000; и
n представляет целое число от 1 до 1000;
спейсерная группа Y представляет необязательно замещенную цепь, включающую до 1000 атомов, выбранных из атомов углерода, азота, кислорода и серы; и
макромолекула М представляет собой синтетический или природный полимер, белок, антитело или фермент с молекулярным весом от 104 до 107, ковалентно или нековалентно связанный со спейсерной группой Y.
7. Макромолекулярное соединение по любому из пп.1-3 формулы (IIA)
(X'-Y)n-M-(Z)m
где X' представляет связывающееся с нейраминидазой производное циклогексенила формулы (2а)
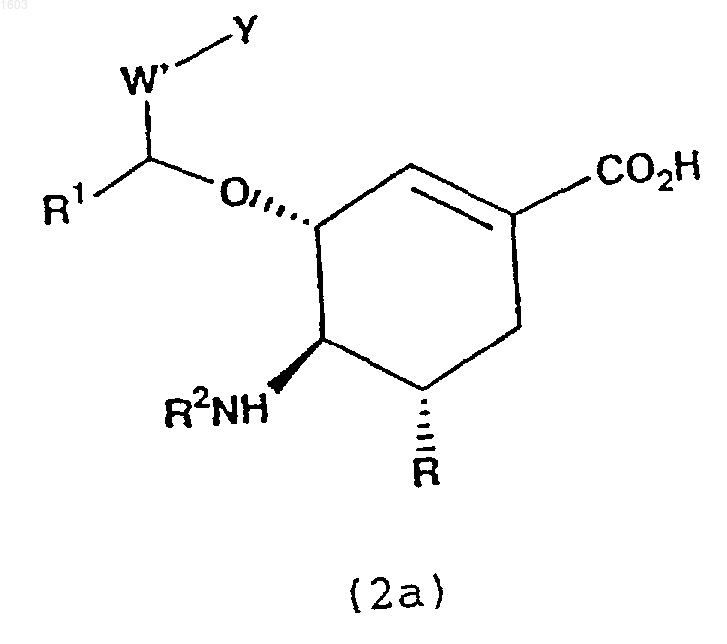
которое соединено посредством боковой эфирной цепи,
R, R2, Y, n и m являются такими, как они определены в п.6, и
R1 и W1 представляют липофильные С1-С12алкильные или алкиленовые группы, которые необязательно замещены одним или несколькими атомами галогена или алкокси, галогеналкокси, или необязательно замещенные арильные группы.
8. Макромолекулярное соединение по п.6 или 7, где Z представляет группу, которая связывает гемагглютинин.
9. Макромолекулярное соединение по п.6 или 7, где Z представляет группу, которая может действовать как детектируемая метка.
10. Макромолекулярное соединение по п.7, в котором Z представляет биотин или флуоресцентную молекулу.
11. Макромолекулярное соединение по п.6 или 7, в котором Z представляет фермент, подходящий для использования в детектирующем анализе.
12. Макромолекулярное соединение по п.6 или 7, где Z представляет группу с концевой функциональностью, которая пригодна для связывания макромолекулы с поверхностью.
13. Макромолекулярное соединение по п.12, в котором Z представляет группу NH2, SH, СO2Н, СНО или СН=СН2.
14. Макромолекулярное соединение по любому из пп.6-13, в котором спейсерную группу Y выбирают из аминоалкильных групп, (поли)аминокислот, линейных пептидов, олигосахаридов и полисахаридов, полиэтиленгликолевых звеньев и аминодиалкилмочевин, каждая из которых может быть использована как отдельно, так и в комбинации друг с другом.
15. Макромолекулярное соединение по п.14, в котором Y имеет концевую аминогруппу.
16. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из белков, ферментов, антител, водорастворимых синтетических полимеров, полисахаридов и полиаминокислот.
17. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из альбумина бычьей сыворотки (BSA), пероксидазы хрена (HRP), авидина, стрептавидина или нейтравидина и иммуноглобулинов.
18. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из полисахаридов, полиакриламидов, полиэтиленгликолей, полимочевин, поликислот, полиэфиров, полиамидов и N-(2-гидроксипропил)метакриламида (НРМА), где указанная макромолекула является фармацевтически приемлeмой.
19. Макромолекулярное соединение по любому из пп.6-18, где R представляет гуанидино- или аминогруппу, замещенную метильной, этильной, аллильной, амино-, циано- или нитрогруппой.
20. Макромолекулярное соединение по п.6, в котором Х представляет соединение формулы (2), где R представляет гуанидин, R2 представляет ацетил, W представляет группу O(=CO)NH, а спейсерная группа Y представляет цепь, состоящую из 6-60 атомов углерода, азота и кислорода.
21. Метод обнаружения вируса гриппа, включающий стадию обработки образца, предположительно содержащего указанный вирус, соединением по любому из пп.1-20, которое способно специфически связываться с активным сайтом нейраминидазы вируса гриппа.
22. Метод по п.21, где соединение соединяют с поверхностью либо путем ковалентной, либо путем неспецифической связи и где спейсерная группа Y имеет достаточную длину, чтобы звенья X, связывающие нейраминидазу, экспонировались на поверхности макромолекулы М и были доступными для вирусной частицы.
23. Метод по п.21 или 22, который представляет собой анализ путем селективного захвата, анализ на селективное обнаружение или объединенный анализ на селективный захват - селективное обнаружение.
24. Фармацевтическая композиция для лечения гриппа А или гриппа В, включающая соединение настоящего изобретения, предпочтительно соединение по любому из пп.1-7, 13, 14 и 18-20, или его фармацевтически приемлемое производное в сочетании с фармацевтически приемлемым носителем, где соединение имеет значение ID50 для нейраминидазы менее 5 мкг/мл.
25. Композиция по п.24, где соединение представляет собой соединение по п.6 или 7.
26. Композиция по п.24 или 25, которая дополнительно включает один или несколько дополнительных терапевтически активных агентов.
27. Композиция по п.26, где дополнительным терапевтически активным агентом является антивирусный агент.
28. Способ лечения вирусного гриппа у млекопитающего, включая человека, включающий введение эффективного количества соединения настоящего изобретения, предпочтительно соединения по любому из пп.1-7, 13, 14 и 18-20, или его фармацевтически приемлемого производного млекопитающему, нуждающемуся в таком лечении, где соединение имеет значение ID50 для нейраминидазы менее 5 мкг/мл.
29. Применение соединения по любому из пп.1-7, 13, 14 и 18-20 для получения медикамента для лечения вирусного гриппа, где указанное соединение имеет значение ID50 для нейраминидазы менее 5 мкг/мл.
Текст
1 Настоящее изобретение относится к новому классу химических соединений и к их применению в медицине. В частности, настоящее изобретение относится к новым соединениям,способам их получения, фармацевтическим композициям, содержащим эти соединения, и к их применению в качестве средств против гриппа. Настоящее изобретение также относится к новому диагностическому методу, который может быть использован для обнаружения всех типов вируса гриппа А и В. Предпосылки создания изобретения Вирусы гриппа А и В являются основной причиной острого респираторного заболевания,которому, по оценкам специалистов, только в США ежегодно подвергаются 30-50 миллионов человек. Вирус гриппа А ответственен за массовые эпидемии, такие как эпидемия гриппа "испанка", которая в 1919 г. привела к гибели миллионов людей. Грипп остается заболеванием,трудно поддающимся лечению, что приводит к значительной частоте заболеваемости, и смертности, обусловленной, в основном, возникновением вторичной инфекции у пожилых и ослабленных пациентов. Вакцины, которыми продолжают пользоваться, устарели из-за антигенного сдвига и отклонения, а поэтому иммунизация этой вакциной для предупреждения инфекции эффективна примерно лишь на 70%. Лекарственными средствами, одобренными Регулятивной комиссией для лечения гриппа, являются лишь амантидин и римантидин, которые не эффективны против гриппа В, и которые, как известно, имеют серьезные побочные эффекты. Множество вирусных и бактериальных инфекций могут иметь симптомы, сходные с симптомами гриппа. Быстрая идентификация респираторных вирусов должна помочь лечащим врачам использовать наиболее подходящий метод терапии на ранней стадии заболевания. Так, например, ранний и точный диагноз позволит специалисту принять решение об использовании антибактериальной терапии и госпитализации детей и людей пожилого возраста. Для идентификации вирусов в клиническом материале широко используются лабораторные тесты, и существует ряд различных методик обнаружения вирусов. В руководствеDekker 1992, Ed. E.H. Lennette приводятся общие обсуждения методов, используемых для широкого ряда вирусов, включая вирус гриппа. Существует ряд тестов для диагностики гриппа А и В. Традиционный метод идентификации вирусов гриппа предусматривает использование клеточной культуры, и этот метод является в высокой степени чувствительным и специфичным. К сожалению, время, необходимое для культивирования, выделения и идентификации вируса гриппа, может составлять от 2 до 10 дней, что делает этот метод практически бесполезным для выбора подходящего лечения вра 001603 2 чом. Поскольку инфекция вируса гриппа является, обычно, самоограничивающей, то для проведения эффективного лечения, диагноз должен быть быстрым. Помимо методов, предусматривающих культивирование клеток для обнаружения гриппа, недавно стали доступными несколько быстрых прямых тестов, которые являются специфичными для гриппа А. Так, например, был описан моноклональный иммунофлуоресцентный анализ (IFA) (Spada, В. et al., J.Virol.Method, 1991, 33, 305), и, по крайней мере, один быстрый иммуноферментный анализ (EIA)(Ryan-Poirier, К.A. et al., J.Clin.Microbiol., 1992,30, 1072). Был описан ряд сравнений этих быстрых методов обнаружения гриппа А; см., например, Leonardi, G.P. и др. (J.Clin.Microbiol.,1994, 32, 70), которые рекомендуют использовать прямой тест образца вместе с выделением культуры, что позволяет идентифицировать вирус и одновременно назначить лечение и принять меры по борьбе с инфекцией, а также провoдить мониторинг антигенной структуры наиболее широко распространенных штаммов вируса гриппа. Как сообщалось, метод IFA является трудоемким и требует значительной технической экспертизы, результаты которой часто бывает трудно интерпретировать. С другой стороны,метод EIA (Directigen FLU-A; Becton DickinsonMicrobiology Systems) дает высокий уровень ложноположительных результатов, и было предложено, что этот анализ должен быть использован в лабораториях только в качестве дополнения к прямым иммунофлуоресцентным тестам или для их замены (Waner, J.L. et al.,J.Clin. Microbiol., 1991, 29, 479). Помимо вышеуказанных проблем, связанных с современными быстрыми анализами для обнаружения гриппа, у некоторых из этих методов имеются и другие фундаментальные недостатки. Во-первых, ни один из имеющихся анализов не может быть использован для обнаружения гриппа В, а это означает, что даже отрицательный результат теста должен оставлять врача в сомнении относительно вида лечения,которое следует назначить. Во-вторых, если быстрый метод иммуноанализа зависит от использования антител к одному из белков вируса гриппа А, то в этом случае может возникнуть серьезная проблема в обнаружении новых штаммов вируса, которые претерпевают сдвиг или отклонение в структуре антигенных белков. Общеизвестно, что грипп А наиболее подвержен этим изменениям. Другой тип быстрого анализа для обнаружения вирусов гриппа был описан в ряде патентных документов (см., например, Liav А и др., заявка WO92/12256). Этот метод предусматривает использование хромогенного субстрата для фермента нейраминидазы вируса гриппа. Другими словами, этот анализ зависит 3 от визуализации красителя, который образуется в том случае, когда нейраминидаза вируса гриппа расщепляет специфическую молекулу конъюгата "сиаловая кислота - краситель". Очевидно, этот метод имеет ограниченную специфичность, поскольку невозможно легко отличить присутствие вирусной нейраминидазы от присутствия других форм фермента, а в частности,бактериальной нейраминидазы. Этот метод имеет также низкую чувствительность из-за относительно низкой активности вирусной нейраминидазы. Вирус гриппа А и В имеет на своей поверхности два главных гликопротеина, гемагглютинин (НА) и фермент нейраминидазу (NA),оба из которых имеют важное значение для инфекционности вируса. Очевидно, что НА необходим для связывания вируса с клетками, тогда как NA необходим для высвобождения вируса с клеточной поверхности. Обычно на поверхности каждой вирусной частицы присутствует около 600 тримерных НА и около 50 копий тетрамерных звеньев NA. Поэтому как НА, так иNA представляют особый интерес для исследований в целях получения лекарственных средств против гриппа, однако, в настоящее время не существует каких-либо пригодных для клинического использования лекарственных средств против гриппа, которые действовали бы в любом из этих участков. Гемагглютинин вируса гриппа связывается с содержащими сиаловую кислоту гликопротеинами и гликолипидами на поверхности клеточного рецептора, инициируя тем самым процесс связывания вируса с клеткой и последующего инфицирования. Очевидно, что эффективность связывания вирусной частицы с клеточной мембраной зависит от взаимодействия множества копий вируса гриппа НА с множеством групп сиаловой кислоты, присутствующих на клеточной поверхности. С использованием такой идеи о поливалентном взаимодействии,несколько сотрудников описали синтез макромолекул, содержащих два или более производных сиаловой кислоты, которые действуют как ингибиторы гемагглютинина. Хотя были описаны некоторые сильные ингибиторы НА, однако,было показано, что ни одна из этих поливалентных макромолекул не способна предупреждатьin vivo-инфекцию. В последних работах Whitesides и др. (J.Amer.Chem. Soc., 1996, 118, 37893800; J.Medicinal Chem., 1995, 38, 4179-4190) систематизированы различные исследования, в которых этот метод был использован для получения ингибиторов гемагглютинина вируса гриппа. Имеется несколько известных ингибиторовNA, большинство из которых являются близкими аналогами нейраминовой кислоты, природным субстратом фермента, такие как 2-дезокси 2,3-дидегидро-N-ацетилнейраминовая кислота 4 63). В Международной патентной заявкеWO 91/16320 описаны аналоги DANA, которые являются очень активными, как in vitro, так и invivo, против нейраминидазы вируса гриппа А и В. Одно из этих соединений (соединение I, обозначенное GG167 или 4-гуанидино-Nеu5 Ас 2-ен) находится на стадии клинического испытания, и является многообещающим средством для лечения гриппа (Hayden, F.G. et al., J.Amer.Chem. Позже, ароматические соединения с активностью, направленной на ингибирование нейраминидазы, были описаны в патенте США 5453533, Luo et al., и в патенте США 5512596, Gilead Science, Inc., а аналоги соединения (I), а в частности, соединения, в которых боковая группа у углерода 6 связана с эфиром,были описаны в Международной патентной заявке WO96/26933, Gilead Science, Inc., и С.Kim et al., J.Amer.Chem. Soc., 1997, 119, 681. Было проведено несколько групп исследований для обнаружения более простых и более сильнодействующих аналогов соединения (I), но сообщения, имеющиеся на сегодняшний деньTrans. I, 1995, 1181), указывают, что любые изменения в структуре соединения (I), а в частности, в глицериновой боковой цепи приводят, по всей вероятности, к снижению способности к связыванию с нейраминидазой. Кроме того, в отличие от ситуации с НА, очевидно, что не существует каких-либо известных макромолекулярных или полимерных ингибиторов нейраминидазы. Полимеры, содержащие сиаловую кислоту, были описаны в патенте США 5192661 Roy et al., и в патенте США 5571836,Bovin et al., но эти соединения являются синтетическими полисиалозидами, предназначенными для использования в качестве антигенов или агентов связывания с гемагглютинином. Краткое описание изобретения В своем первом аспекте, настоящее изобретение относится к макромолекулярным соединениям, которые присоединяют к себе одну или несколько молекул, связывающихся с активным центром нейраминидазы вируса гриппа; причем, в настоящем описании, эти молекулы именуются "связывающими нейраминидазу агентами". Предпочтительно связывающий нейраминидазу агент связывают с этой молекулой посредством спейсерной группы или линкерной группы так, чтобы этот связывающий нейраминидазу агент не был пространственно затруднен остовом макромолекулы. Этот связывающий нейраминидазу агент может быть любым аген 5 том, который связывается с активным центром нейраминидазы вируса гриппа, при условии, что он не расщепляется этим ферментом. Указанное связывание не должно быть обязательно необратимым, но связывающая группа должна иметь высокую активность связывания, предпочтительно, IC50=10-6 M или менее. Настоящее изобретение, в частности, относится к новому классу химических соединений,и к использованию их в качестве терапевтических и диагностических агентов для лечения и обнаружения гриппа А и В. Более конкретно,настоящее изобретение относится к макромолекулам, которые присоединяют к себе производные нейраминовой кислоты (сиаловую кислоту),связывающиеся с нейраминидазой вируса гриппа А или В, и которые также, но необязательно,имеют функциональность, позволяющую этим соединениям связываться с поверхностью, или которые могут быть использованы в качестве детектируемой метки. Авторами настоящей заявки неожиданно было обнаружено, что в случае, если соединение (I) имеет функциональную группу в 7-ом положении структуры сиаловой кислоты, то оно может быть присоединено к крупным синтетическим или природным полимерам с образованием комплексов, которые ингибируют нейраминидазу вируса гриппа А и В, и которые могут предотвращать или ингибировать инфекцию вируса гриппа. Вместо нарушения способности соединения (I) связываться с нейраминидазой вируса гриппа, заявителями было обнаружено,что в случае, если множество членов этих и аналогичных соединений связывается в своем 7-ом положении посредством подходящей спейсерной группы с рядом макромолекул, то средняя величина их связывания на одну группу сиаловой кислоты, в основном не снижается. Таким образом, посредством связывания с нейраминидазой, эти макромолекулы тесно связываются с вирусом, в результате чего, вероятно, из-за размера и стерических эффектов этих комплексов,инфекционность вириона гриппа снижается. Такие макромолекулярные соединения могут быть также использованы для обнаружения вируса гриппа А и В, благодаря их способности селективно связываться с вирусом гриппа, и в то же самое время связываться с поверхностью или детектируемой линкерной группой. Биологическая активность макромолекулярных соединений настоящего изобретения и диагностический метод настоящего изобретения основаны на использовании лигандов, присутствующих на макромолекулах, способных специфически связываться с активным центром нейраминидазы вируса гриппа, или функционализированных производных таких соединений в качестве связывающих и/или детектирующих агентов для идентификации вируса гриппа в клинических образцах. Термин "связывающие нейраминидазу агенты", используемый в на 001603 6 стоящем описании, относится к вышеуказанным соединениям и их функционализированным производным. Способ и соединения настоящего изобретения могут действовать либо в присутствии, либо в отсутствие соединений, неспецифически связывающихся с нейраминидазой вируса гриппа. В предпочтительном варианте своего осуществления, настоящее изобретение относится к соединению формулы (II)(II) где Х представляет связывающееся с нейраминидазой производное 2,3-дегидросиаловой кислоты (2), которое присоединяется в 7 положении посредством спейсерной группы Y к макромолекуле М; а Z представляет необязательный дополнительный заместитель на макромолекуле. Связывающаяся с нейраминидазой часть Х представляет производное сиаловой кислоты формулы (2) где спейсерная группа Y соединена с группойW, и где R представляет азидогруппу, незамещенную или замещенную гуанидиногруппу, либо незамещенную или замещенную аминогруппу;m представляет целое число от 0 до 1000; аn представляет целое число от 1 до 1000. Спейсерная группа Y представляет собой необязательно замещенную цепь, состоящую из вплоть до 1000 атомов, выбранных из атомов углерода, азота, кислорода и серы. Макромолекула М представляет синтетический или природный полимер, белок, антитело или фермент с молекулярной массой от 104 вплоть до 107. Группа Y, в основном, ковалентно связана с макромолекулой М, но может быть также присоединена посредством нековалентного связывания, например, в том случае, если М представляет авидин, а Y имеет концевую биотиновую группу. Второй и необязательный заместитель Z может представлять собой группу, которая связывается с гемагглютинином, такую как 2 связанное производное сиаловой кислоты, или группу, которая может действовать в качестве детектируемой метки, такой как биотин или флуоресцентная молекула, либо он может представлять собой антителосвязывающий гаптен. 7 Необязательный заместитель Z может также представлять собой фермент, такой как пероксидаза хрена (HRP) или щелочная фосфатаза(АР), которая может быть использована для обнаружения вируса гриппа. Альтернативно,группа Z может представлять собой группу с концевой функциональной группой, которая может обеспечивать связывание макромолекулы с поверхностью, такой как NH2, SH, СО 2 Н,СНО, или СН=СН 2. В другом предпочтительном варианте настоящее изобретение относится к связывающим нейраминидазу агентам формулы (IIA)(IIA) где X' представляет связывающееся с нейраминидазой циклогексениловое производное формулы (2 а) которое связывается посредством боковой эфирной цепи,R, R2, Y, n и m являются такими, как они определены выше для формулы (2), иR1 и W' представляют липофильные С 1 С 12 алкильные или алкиленовые группы, которые необязательно замещены одним или несколькими атомами галогена или алкокси-, галогеналкокси-, или необязательно замещенными арильными группами. Подходящими спейсерными группами Y являются, но не ограничиваются ими, аминоалкильные группы, (поли)аминокислоты, линейные пептиды, олигосахариды и полисахариды,полиэтиленгликолевые звенья, и аминодиалкилмочевины, каждая из которых может быть использована как отдельно, так и в комбинации друг с другом. Обычно спейсерная группа Y имеет концевую аминогруппу, которая используется для образования амидной связи или связи посредством шиффовых оснований с макромолекулой М. Подходящими заместителями гуанидиноили аминогрупп R являются метил, этил, аллил,амино, циано или нитро. Подходящими макромолекулами М являются белки, ферменты, антитела, водорастворимые синтетические полимеры, такие как полиакриловые кислоты и полиакриламиды, полисахариды и полиаминокислоты. Макромолекулами, которые являются особенно подходящими для использования в диагностических целях,являются альбумин бычьей сыворотки (BSA),пероксидаза хрена (HRP), авидин, и родственные белки, такие как стрептавидин или нейтравидин, и иммуноглобулины. 8 Макромолекулами, которые являются особенно подходящими для использования в соединениях настоящего изобретения, предназначенных для лечения гриппа, являются полисахариды, синтетические полимеры, такие как полиакриламиды, полиэтиленгликоли, полимочевины, поликислоты, полиэфиры, полиамиды и различные сополимеры, такие как N-(2 гидроксипропил)метакриламид (НМРА), которые, как известно, являются безопасными для введения человеку. Специалистам в этой области должны быть известны и другие фармацевтически приемлемые полимеры. Одна из предпочтительных групп соединений настоящего изобретения включает соединения (II), в которых Х представляет производноеGG167 формулы (2), где R представляет гуанидин, R2 представляет ацетил, W представляет группу O(=CO)NH, а спейсерная группа Y представляет собой цепь, состоящую из 6-60 атомов углерода, азота и кислорода. Макромолекулы формулы (II) являются ингибиторами нейраминидазы вируса гриппа А и В, и обладают активностью против вируса гриппа. Таким образом, во втором своем аспекте, настоящее изобретение относится к фармацевтической композиции для лечения гриппа А или гриппа В, включающей соединение настоящего изобретения, предпочтительно соединение формулы (II) или формулы (IIА), или его фармацевтически приемлемое производное в сочетании с фармацевтически приемлемым носителем. В своем третьем аспекте, настоящее изобретение относится к способу лечения гриппа у млекопитающих, включая человека, предусматривающему осуществление стадии введения эффективного количества соединения настоящего изобретения формулы (II) или формулы(IIА) или его фармацевтически приемлемого производного млекопитающему, нуждающемуся в таком лечении. В своем четвертом аспекте, настоящее изобретение также относится к использованию соединения настоящего изобретения формулы(II) или формулы (IIА) в целях изготовления лекарственного средства для лечения инфекции,вызываемой вирусом гриппа. Соединения настоящего изобретения могут быть использованы в комбинации с другими терапевтическими агентами, например, с противоинфекционными агентами, в частности, с другими противовирусными агентами. Таким образом, в другом своем аспекте, настоящее изобретeние относится к фармацевтической композиции, включающей соединение настоящего изобретения, предпочтительно соединение формулы (II) или формулы (IIА), или его фармацевтически приемлемую соль или фармацевтически приемлемое производное вместе с одним или несколькими дополнительными терапевтически активными агентами, в частности, с противови 9 русными агентами, в сочетании с фармацевтически приемлемым носителем. В другом своем аспекте настоящее изобретение также относится к способу обнаружения вируса гриппа, включающему стадию обработки образца, предположительно содержащего указанный вирус, соединением настоящего изобретения, способным специфически связываться с активным центром нейраминидазы вируса гриппа. Способ настоящего изобретения применим ко всем типам вируса гриппа А и В. Для обнаружения гриппа соединения (II) настоящего изобретения могут быть связаны с поверхностью либо путем ковалентного связывания, либо путем неспецифического связывания. Спейсерная группа Y должна быть достаточно длинной так, чтобы связывающиеся с нейраминидазой звенья Х экспонировались на поверхности макромолекулы М и были доступными для вирусной частицы. Для обнаружения гриппа способом настоящего изобретения может быть использован селективный захват соединения формулы (II), и,тем самым, концентрирование вируса с последующим его обнаружением любым подходящим стандартным методом; причем, этот метод обнаружения, как таковой, не должен быть обязательно селективным. Так, например, связывающий агент (II) может быть связан с материаломносителем, таким как мембрана или полимер,так, чтобы вирусные частицы могли селективно захватываться и концентрироваться при нанесении образца на носитель или при пропускании образца через носитель. Поэтому, в одном из предпочтительных вариантов осуществления изобретения, группа Z завершается функциональной группой, способной связываться с поверхностью. Многие подходящие функциональные группы известны специалистам. Альтернативно, может быть использован метод селективной детекции, где вирусные частицы в образце могут, например, неспецифически захватываться, а затем подвергаться воздействию макромолекулярного агента, связывающегося с нейраминидазой (II), и включающего детектируемую метку Z, в таких условиях, при которых связывающий агент селективно связывается с нейраминидазой на поверхности вирусной частицы. Затем детектируемую метку обнаруживают любым подходящим методом. Для некоторых систем детекции, предпочтительно концентрировать образец на ограниченном участке, например, в виде пятна или линии на поверхности. Это может быть достигнуто рядом методов, например, образец может быть суспендирован или неселективно иммобилизован на фильтре или другом материале-носителе, а затем он может быть подвергнут воздействию меченным связывающим носителем, указанным выше. 10 В другом альтернативном аспекте настоящего изобретения, может быть использована комбинация селективного захвата и селективной детекции, что дает простой и чувствительный двухстадийный способ обнаружения вируса гриппа. Это достигается путем использования того факта, что вирусные частицы гриппа обычно имеют около одной сотни молекул нейраминидазы, распределенных по их сферической поверхности (White, D.O., Curr. Top. Microbiol.Immunol., 1974, 63, 1-148), а поэтому могут связываться с более чем одним связывающим агентом в одно и то же время. Так, например, связывающее нейраминидазу соединение (II) может быть присоединено к носителю, например, в виде узкой полосы поперек длины пористой мембраны. Затем на другой конец мембраны наносят тестируемый образец и делают так, чтобы он стекал через полосу связанного соединения. Любые вирусные частицы гриппа в тестируемом образце будут захватываться связанным с мембраной соединением (II) и, тем самым, оставаться в этой узкой полосе. Во второй стадии испытания делают так, чтобы детектируемая метка, связанная с другим связывающим нейраминидазу агентом (II), стекала по мембране через полосу, связанную с частицами вируса гриппа. Затем присутствие вируса гриппа выявляют по наблюдаемым изменениям в мембране на участке связанного соединения. Считается, что способ и соединения настоящего изобретения являются подходящими для использования в методе оптического иммуноанализа с применением пластины (OAI) Biostar,который описан, inter alia, в патенте США 5418135 Miller и др. Специалистам известно очень большое число подходящих систем для детекции, например, ферментная система "биотин-стрептавидин", такая как пероксидаза хрена или щелочная фосфатаза; флуоресцентные системы; хемилюминесцентные системы, системы с использованием коллоидного золота, радиоактивных меток; и системы агглютинации. Считается, что особенно предпочтительной детектируемой меткой является коллоидное золото, покрытое соединением (II) настоящего изобрeтения. Аналогично предполагается, что соединения настоящего изобретения, где макромолекула М представляет собой пероксидазу хрена, являются идеальными соединениями для обнаружения гриппа. Каждый специалист может легко выбрать подходящую систему детекции и оптимизировать условия детекции с использованием нормальных испытаний и расчетных погрешностей эксперимента. Соединения (II) настоящего изобретения и их фармацевтически приемлемые соли и производные могут быть получены различными методами, включая методы, описанные ниже. Методы получения соединений, описанных ниже, 11 представляют собой другой аспект настоящего изобретения. Подробное описание изобретения Ниже приводится более подробное описание настоящего изобретения со ссылками на нижеследующие неограничивающие примеры. 12 Примерами соединений настоящего изобретения являются соединения формулы (3), в которых М представляет белок и которые перечислены ниже в табл. 1. Другими примерами соединений настоящего изобретения являются соединения формулы (4), где М представляет белок авидин, кото рый нековалентно связывается с группой X-Y, а также имеет нековалентно связанные лигандыZ; и эти соединения указаны ниже в табл. 2. Другими примерами соединений настоящего изобретения, в которых М представляет синтетический полимер, являются соединения формулы (5), представленные ниже в табл. 3,Заместитель Z Биотинамидокапроил Биотинамидокалроил Биотинамидокапроил Биотинамидокапроил где заместителями на группе сиаловой кислоты Другими примерами соединений настоящего изобретения, в которых М представляет декстрановый остов (молекулярная масса 500000), являются соединения, представленные формулой (6), и указанные ниже в табл. 4, где заместителями на группе, связывающей нейраминидазу (2), являются R2=:Ac, R=гуанидин, a звеньев в декстрановом остове, которые замещены конкретными группами, т.е. если сумма n,m и р не доходит до 100, то остальная часть декстранового остова состоит из незамещенных глюкозных звеньев. При этом следует также помнить, что имеются три возможных точки присоединения различных лигандов, связанных с каждым звеном декстранового остова. бензил бензил бензил бензил бензил бензилNH(CH2)6S-2 сиаловая кислота бензил бензил Другими примерами соединений настоящего изобретения являются соединения, где макромолекула М представляет собой декстрановый остов или остов из полиакриловой кислоты; и где заместителями на группе сиаловой кислоты (2) являются R2=Ac, R=гуанидин, a W представляет OCONH; а также, где дополнительным заместителем Z является, например,бензильная группа, молекула биотина или флуоресцеинсодержащая группа. При этом следует отметить, что используемый в настоящем описании термин "лече ние" относится к профилактике, а также к лечению установленных инфекций или симптомов. Лечение предпочтительно начинается до или во время инфицирования и продолжается вплоть до того момента, когда вирус больше не присутствует в дыхательных путях. В основном, подходящая доза соединения настоящего изобретения составляет в пределах от 0,1 до 100 мг/кг/день, а предпочтительно в пределах от 0,2 до 20 мг/кг/день. Подходящее лечение проводят 1-4 раз в день и продолжают в течение 3-7 дней после инфицирования. Желательная доза может быть введена в виде разовой дозы либо она может быть введена в виде дробных доз через соответствующие интервалы времени. Хотя соединение настоящего изобретения,используемое для лечения, может быть введено в качестве исходного химического соединения,однако, предпочтительно, чтобы активный ингредиент присутствовал в фармацевтической композиции. Таким образом, настоящее изобретение относится к фармацевтической композиции, содержащей соединения формулы (II) или его фармацевтически приемлемую соль или производное в сочетании с одним или несколькими фармацевтически приемлемыми носителями, и необязательно с другими терапевтическими и/или профилактическими агентами. Фармацевтические композиции могут быть введены перорально, через нос, или местно, либо они могут быть введены в форме, подходящей для ингаляции или инсуффляции в дыхательные пути. Эти композиции, если это необходимо,могут быть изготовлены в виде дискретных стандартных доз и могут быть получены любым из методов, хорошо известных фармацевтам. В основном, соединения настоящего изобретения могут быть введены в форме раствора,суспензии или сухого порошка. Для введения в дыхательные пути в соответствии со способом настоящего изобретения ингибиторы нейраминидазы могут быть введены любым методом и в виде композиций, обычно используемых для введения в дыхательные пути. Растворы и суспензии являются, обычно,водными, и их получают, например, с использованием одной воды либо с использованием воды и физиологически приемлемого сорастворителя(например, этанола, пропилегликоля, полиэтиленгликолей, таких как ПЭГ 400). Такие растворы или суспензии могут, кроме того, содержать другие наполнители, например, консерванты(такие как, хлорид бензалкония), солюбилизирующие агенты/поверхностно-активные вещества, такие как полисорбаты (например, Твин 80), забуферивающие агенты, агенты, повышающие изотоничность (например, хлорид натрия), агенты, повышающие абсорбцию, и аген 16 ты, повышающие вязкость. Суспензии могут,кроме того, содержать суспендирующие агенты(например, микрокристаллическую целлюлозу,натрийсодержащую карбоксиметилцеллюлозу). Растворы или суспензии вводят в полость носа с использованием стандартных приспособлений, например, с помощью закапывающего устройства, пипетки или аэрозоля. Эти композиции могут быть изготовлены в виде разовой или дробной лекарственной формы. В качестве аэрозоля может быть использован, например,дозирующий мелкокапельный распылитель. Введение в дыхательные пути может быть также осуществлено с помощью аэрозольной композиции, в которой данное соединение присутствует в сосуде под давлением вместе с соответствующим распыляющим агентом, таким как хлорфторуглерод (CFC) или с другим подходящим газом. Альтернативно, эти соединения могут быть изготовлены в форме сухого порошка, например, в виде порошкообразной смеси соединения в подходящей основе, такой как лактоза,крахмал, производные крахмала, и поливинилпирролидин. В результате этого, порошок, введенный в полость носа, будет образовывать гель. В композициях, предназначенных для введения в дыхательные пути, включая композиции для введения через нос, соединение имеет, в основном, малый размер частиц, например, порядка 5 микрон или менее. Такой размер частиц может быть получен известным способом. Соединения настоящего изобретения получают в несколько стадий, где в первой стадии,обычно, осуществляют синтез связывающего нейраминидазу производного сиаловой кислоты формулы X-Y, где Х и Y определены выше. Методы синтеза производных сиаловой кислоты (2), имеющих соответствующую функциональную группу в 7-положении, описаны в заявке на патент Великобритании 9516276.4,и в международной патентной заявкеPCT/AU 97/00190. Примеры подходящих производных сиаловой кислоты X-Y представлены ниже в табл. 5,где группы R2, R и W означают заместители на части X, как описано выше. Таблица 5R2 Ас Ас Ас Ас Ас Ас АсR Гуанидин Гуанидин Гуанидин Гуанидин Гуанидин Гуанидин Гуанидин Второй частью получения соединений настоящего изобретения является присоединение связывающих нейраминидазу звеньев X-Y к(CH2)6NHCO2[CH2CH2O]70CH2CH2NH2 макромолекуле М. Для ковалентного связывания звеньев X-Y с макромолекулой М типа белка конъюгирование может быть, в основном, 17 осуществлено с использованием стандартных методов образования поперечных связей, которые хорошо известны специалистам (см., например, S.S. Wong, "Chemistry of Protein Conjugation and Cross-Linking" CRC Press, 1991; G.T.X-Y могут быть добавлены к предварительно полученному полимерному остову, который имеет подходящие активированные заместители. Так, например, если группа Y имеет концевую функциональную аминогруппу, то она может реагировать с активированными сложноэфирными заместителями на полиакрилатном остове. Альтернативно, звенья X-Y с подходящим полимеризируемым заместителем, таким как концевой олефин, могут быть полимеризованы или предпочтительно сополимеризованы с другим олефином с образованием макромолекулярного остова. См., например, R.Roy, Trends in(2b) (7-(6-Аминокапроил)амино-гексилкарбамоилокси-GG167). 6-(трет-Бутилоксикарбониламино)капроновую кислоту (34 мг, 147 мкмоль) растворяли в смеси ацетона (2,5 мл), воды (100 мкл), Nметилморфолина (4 мкл, 36 мкмоль) и триэтиламина (21 мкл, 147 мкмоль). Раствор охлаждали до -12 С, а затем добавляли изобутилхлорформиат (21 мкл, 161 мкмоль). Раствор перемешивали в течении 12 мин. Соль метил-5-ацетамидо-7-(6'-аминогексил)-карбамоилокси-4-гуанидино-8,9-монокарбонилдиокси-2,3,4,5-тетрадезокси-D-глицеро-Dгалакто-нон-2-енопиранозоната и трифторуксусной кислоты (79 мг, 92 мкмоль) растворяли в воде/ацетоне (1:1, 2 мл), содержащем триэтиламин (40 мкл, 287 мкмоль). Этот основный раствор охлаждали до 0 С, и одной порцией добавляли к полученной ранее реакционной смеси. Смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Растворители удаляли при пониженном давлении. Неочищенный продукт растворяли в метаноле/воде (1:1, 4 мл), а затем добавляли триэтиламин (1 мл). Этот раствор перемешивали в течение ночи в атмосфере аргона. Растворители удаляли на роторном испарителе, а остаток растворяли в метаноле и адсорбировали на силикагеле (1,5 г). После хроматографии на силикагеле (10 г) при элюировании этилацетатом/изопропанолом/водой (100/75/25) получали продукт (53 мг, 77 мкмоль, 84%).H-ЯМР (200 Мгц, СD3 ОD)5,67 (д, J=2,6 Гц, 1 Н); 5,03 (м, 1 Н); 4,62 (м, 1 Н); 4,49 (м, 1 Н); 4,23 (м, 1 Н); 4,12 (м, 1H); 3,77 (м, 1 Н); 3,62 (м,1H); 3,12 (м, 6 Н), 2,22 (т, J=8 Гц, 2 Н); 2,0 (с, 3 Н); 1,5 (м, 23 Н). трет-Вос-защищенный сахар растворяли в этилацетате/толуоле и упаривали досуха. Продукт растворяли в трифторуксусной кислоте (3 мл) и перемешивали в течение 1 ч при комнатной температуре в атмосфере аргона. Растворитель удаляли при пониженном давлении, а остаточную трифторуксусную кислоту удаляли путем совместного выпаривания сначала с дихлорметаном, а затем с 3 порциями воды/метанола. Затем образец растворяли в воде,фильтровали и лиофилизовали с получением продукта (141 мг, 152 мкмоль) в виде трис-ТFАсоли. Масс-спектр (FAB): 588 (М+1) 1 Н-ЯМР (CD3OD, 300 Мгц)5,92 (д, J=2,6 Гц, 1 Н); 5,01 (м, 1 Н); 4,60 (дд, J=10,3 Гц, 1H); 4,44 (дд, J=9,3 Гц, 1 Н); 4,23 (м, 1H); 4,05 (м, 1H); 3,67 (дд, J=13,4 Гц, 1H); 3,52 (дд, J=13,7 Гц, 1H); 3,16 (м, 5 Н); 2,96 (т, J=8 Гц, 2 Н); 2,25 (т, J=8 Гц,2 Н); 2,00 (с, 3 Н); 1,7-1,3 (м, 14 Н).GG167 (2b) - альбумин бычьей сыворотки-(6 аминокапроил-биотин)8". Буфер для связывания с белком: 0,1 н.BSA-(капроил-биотин)8 (3 мг, 43 нмоль,Pierce) растворяли в буфере для связывания (7,5 мл) и слегка перемешивали в течение 30 мин. Бис-(N-гидроксисульфосукцинимид)суберат (12 мг, 21 мкмоль, Pierce) растворяли в буфере для связывания (1 мл) и добавляли непосредственно к основному раствору соединения(2b) примера 1(а) (19,5 мг, 21 мкмоль) в буфере для связывания (1,5 мл). Реакционную смесь перемешивали в течение 7,5 мин. Затем к дериватизированному раствору GG167 по каплям добавляли BSA-биотиновый раствор, и смесь оставляли на 1,5 ч при комнатной температуре для перемешивания. Раствор лиофилизовали,растворяли в воде (3,0 мл), и диализовали против буфера для диализа (31,5 л, целлюлозные трубки, с отсечением Mw 12000). Смесь лиофилизовали, растворяли в воде(2,5 мл) и обессоливали на колонке PD-10(Pharmacia), а затем лиофилизовали с получением продукта (3 а) (2,5 мг). Включение сахара (30 звеньев GG167 на молекулу белка) оценивали с помощью колориметрического анализа на гуанидиновую группу 19 ногексан-6-аминокапроновой кислоты-амид субериновой кислоты)60 (3b). Бычий -глобулин (3 мг, 20 нмоль, Sigma) растворяли в буфере для связывания (1 мл) и перемешивали в течение 30 мин. К раствору белка добавляли N-гидроксисульфосукцинимидил-N-биотинил-6-аминокапроат (1,8 мМ, 280 мкл, 0,5 мкмоль) в буфере для связывания, и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь разбавляли до 7,5 мл путем добавления буфера для связывания и подвергали реакции с бис(N-гидроксисульфосукцинимидил)субератом и конъюгатом'"GG167-амид 7-карбамат-1,6-диаминогексан-6 аминокапроновой кислоты" из примера 1(а) (см. выше) в условиях, идентичных условиям примера 1(b). Выход лиофилизованного конъюгата глобулина (3b) составлял 2,5 мг. Пример 3. Получение конъюгата 3f между соединением 2 с и пероксидазой хрена (HRP). Соединение 2 с связывали с HRP в соответствии с хорошо разработанной методикой окисления периодатом (см., например, G.T. Hermanson, "Bioconjugate Techniques" Academic Press,1996, 472) с получением соединения 3f.HRP (тип IV-A, Sigma Aldrich Р-6782, 5 мг,114 нмоль) растворяли в натрийацетатном/натрийхлоридном буфере (5 мМ/150 мМ,рН 4,5, 500 мкл). К этому раствору добавляли свежеприготовленный раствор периодата натрия (88 мМ в натрийацетатном/натрийхлоридном буфере, 50 мкл, 4,4 ммоль) и оставляли на 20 мин в темноте при комнатной температуре для прохождения реакции. Смесь хроматографировали на колонке PD-10 (PharmaciaBiotech, Sephadex G-25), предварительно уравновешенной натрийацетатным буфером (5 мМ,рН 4,5), и элюат лиофилизовали. Окисленную HRP растворяли в натрийкарбонатном буфере (0,2 М, рН 9,5, 1 мл), содержащем соединение 2 с (3,9 мг, 3,75 мкмоль) при 4 С, и реакционную смесь оставляли на ночь при 4 С. Затем добавляли раствор цианоборогидрида натрия (5 М в 1 н. NaOH, 10 мкл, 50 мкмоль), и реакционную смесь оставляли на ночь при 4 С. Затем добавляли раствор этаноламина (1 М, рН 9,5, 50 мкл, 50 мкмоль) и реакционную смесь оставляли на 30 мин при комнатной температуре, после чего хроматографировали на колонке PD-10, предварительно уравновешенной дистиллированной водой. Элюат лиофилизовали и получали конъюгат "HRPсоединение 2 с" в виде светло-коричневого порошка. Пример 4. Получение конъюгатов '"белокGG167" 3 с, 3d и 3g-3j. Соединения 3 с, 3d и 3g-3j получали путем связывания соответствующего белка либо с соединением 2 с, либо 2g с использованием бис(N 001603 20 гидроксисульфосукцинимид)суберата в соответствии с методикой, описанной в примере 1,часть (b). Пример 5. Получение биотинилированного комплекса (4d), образованного между конъюгатом "GG167-биотин" и авидином.(b) Авидин (3 мг, 0,0445 мкмоль) растворяли в растворе соединения (2 е) (0,5 мг, 0,434 мкмоль) в воде (500 мкл) в течение 2 ч при комнатной температуре. К полученному раствору добавляли сульфо-N-гидроксисукцинимидокапроиламино-биотин (Pierce 21335) (1000 мкг,1,798 мкмоль) и раствор бикарбоната натрия(1000 мкг, 11,9 мкмоль) в воде (240 мкл). Всю смесь оставляли на 45 мин при комнатной температуре, а затем помещали в диализную трубку(с отсечением молекулярной массы 12000). Эту трубку последовательно диализовали против 50 мМ раствора NaНСО 3 (4250 мл) и воды (8250 мл), при этом время погружения в каждом случае составляло 45 мин. И наконец, трубку диализовали против воды (500 мл) в течение ночи при комнатной температуре. Полученный раствор из диализной трубки доводили до рН 6,5-7,0 бикарбонатом натрия, а затем лиофилизовали с получением целевого комплекса (4 с) (3 мг, 89%) в виде белого твердого вещества. Этот комплекс содержал четыре молекулы конъюгата"GGl67-биoтин", связанные посредством четырех авидинсвязывающих участков, и, кроме того, авидиновый остов, замещенный примерно восемью-десятью ковалентно связанными биотиновыми лигандами. Диаграмма этого комплекса показана на фиг. 1, где А обозначает авидин, В обозначает биотин, a S обозначает молекулу сахара GG167. Пример 6. Получение полиакриламидовpNAS соответствовал данным, опубликованным в литературе. Образец партии pNAS превращали в полиакриламид путем обработки концентрированным аммиаком в течение нескольких часов при комнатной температуре, и с помощью вискозиметрии было установлено, что молекулярная масса диализованного полиакриламида составляла приблизительно 50000.(b) Полиакриламиды (5 а)-(5 е), включающие различные производные GG167, получали 21 из одной партии pNAS в соответствии с общим методом, описанным ниже для соединения (5 с). Раствор pNAS (10 мг, 59 мкмоль NAS) в диметилформамиде (ДМФ, 0,5 мл) добавляли,размешивая, к раствору соединения 2f (3,8 мг,6,2 мкмоль) в ДМФ (0,5 мл) при комнатной температуре. Затем добавляли триэтиламин (10 мкл, 70 мкмоль) и прозрачный раствор перемешивали в течение ночи при комнатной температуре, после чего нагревали при 65 С в течение пяти часов и снова перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли разбавленный водный аммиак(6 мл 3%-ного раствора) и прозрачный раствор оставляли на 24 ч при комнатной температуре. Реакционную смесь упаривали досуха при пониженном давлении, а остаток растворяли в воде (3 мл) и помещали в диализные трубки (с отсечением Mw 12000) и диализовали против воды (500 мл, рН 6) в течение 24 ч. Раствор лиофилизовали и получали GG167-содержащий полиакриламид (5 с) в виде белого твердого продукта (5 мг). 1H-ЯМР-спектр (300 МГц) обнаруживал следующие широкие сигналы: (D2O)5,7; 4,4-4,6; 4,1; 3,3-3,7; 3,0; 2,0-2,5; 1,9; 1,1-1,8. Сравнение суммы сигналов протонов для сиаловой кислоты ( 5,7-3,2) с суммой сигналов протонов для полимера и спейсерных цепей ( 1,03,2, минус N-ацетиловый пик при 1,9) показало,что уровень включения звеньев GG167 составляет около 10%. Пример 7. Получение полиакриламида 51,который содержит лиганды GG167 и лиганды биотина. Раствор pNAS (170 мг, 1 ммоль NAS) (Mw около 50000) в ДМФ (3 мл) перемешивали при комнатной температуре и добавляли раствор соединения 2 а (соль TFA, 30 мг, 50 мкмоль) иN-6-аминогексил-биотинамид (7 мг, 20 мкмоль) в ДМФ (2 мл). Затем добавляли триэтиламин (50 мкл) и реакционную смесь перемешивали в течение 24 ч при 20 С. К реакционной смеси добавляли разбавленный аммиак (20 мл, 5%) и перемешивание продолжали еще 24 ч. Реакционную смесь упаривали досуха, а остаток растворяли в 10 мл воды, и диализовали в воде в течение 2 дней (14 л, диализная трубка с отсечением Mw 12000). Цветная реакция Sakaquchi на гуанидин дала положительный результат для жидкости, оставшейся в трубках, но не для концентрированного образца воды последней стадии диализа. Жидкость из диализных трубок лиофилизовали с получением соединения 51 в виде хлопьевидного твердого вещества кремового цвета (71 мг). Уровень лигандов на полимере оценивали путем суммирования ЯМР-сигналов, и этот уровень соответствовал почти полному включению исходных аминов. Пример 8. Получение GG167-содержащих полиакриламидов 5i, 5k, 5m и 5n. 22 Каждое из соединений 5i, 5k, 5m и 5n было получено посредством реакции pNAS с соответствующей смесью производного GG167 (2 а или 2 с) и либо бензиламина, либо N-6-аминогексилфлуоресцеина, либо аминоэтантиола в соответствии с методикой, описанной в примере 7. Для получения соединений 5i, 5k (а также соединений 5n и 5j) использовали pNAS с более высокой молекулярной массой (200 кД). Пример 9. Получение декстрана (Mw 500 кДа) с множеством GG167 (7-оксикарбамоилгексиламино-карбонилокси-4-гуанидиноNеu5 Ас 2-ен) (3,5 моль%) и N-бензилкарбамоилокси-заместителей (16,8 моль%). К раствору декстрана (Mw 500000) [100 мг,0,617 ммоль (на основе звеньев Mw 162)] в ДМСО (5 мл) добавляли п-нитрофенилхлорформиат (510 мг, 2,53 ммоль) и 4 диметиламинопиридин (309 мг, 2,53 ммоль). Смесь перемешивали в атмосфере аргона, сначала при комнатной температуре в течение 1 ч, а затем при 3540 С в течение 3 ч. Полученный раствор объединяли с раствором бензиламина(12,5 мг, 0,117 ммоль) и 4-диметиламинопиридина (40 мг, 0,327 ммоль) в пиридине (5 мл). Реакционную смесь оставляли на 16 ч при комнатной температуре в атмосфере аргона для перемешивания, а затем упаривали досуха в условиях высокого вакуума. Остаток перемешивали в 2% растворе карбоната калия (25 мл) при 50 С в течение 3 ч с получением прозрачного раствора, который затем доводили до рН 7 путем добавления 3 М НСl. Полученный раствор диализовали против воды при комнатной температуре в течение 3 дней и лиофилизовали с получением бензилированного декстрана (95 мг,83,4%) в виде белого твердого вещества, содержащего 16,8 мол.% оксикарбамоилметиленбензола, как показал 1H-ЯMP (D2O). К раствору бензилированного декстрана (5 мг, 0,027 ммоль) в ДМСО (0,25 мл) добавляли пнитрофенилхлорформиат (12,8 мг, 0,063 ммоль) и 4-диметиламинопиридин (7,8 мг, 0,063 ммоль). Раствор перемешивали в атмосфере аргона при комнатной температуре в течение 1 ч, а затем при 3540 С в течение 3 ч. После этого его объединяли с раствором соединения 2 а 23 мл) и ДМСО (0,25 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, а затем упаривали досуха в условиях высокого вакуума. Остаток интенсивно перемешивали в 1% растворе карбоната калия (5 мл) в течение 4,5 ч с получением прозрачного раствора. Затем этот раствор доводили до рН 7,5 путем добавления 3 М НСl, диализовали против воды при комнатной температуре в течение 24 ч и, наконец, лиофилизовали с получением целевого полимера (4,5 мг, 82%) в виде белого твердого вещества. 1 Н-ЯМР (D2O) показал, что полимер содержит 16,8 молекул бензиламина и 3,5 молекул соединения 2 а на 100 глюкозных звеньев носителя. Молекулярная масса (MW) полимера, как было оценено, составляла 623 кДа, а средняя MW одного звена 7 аминогексиламинокарбонилокси-4-гуанидиноNеu5 Ас 2-ена составляла 5770. Пример 10. Получение мультивалентного К раствору декстрана (Mw 500000) [50 мг,0,308 ммоль) (на основе звена с мол. массой 162)] в воде (0,3 мл) в ледяной бане добавляли гидроксид калия (138 мг, 2,46 ммоль) в воде (0,1 мл). Смесь перемешивали в течение 20 мин при 0-5 С, а затем добавляли хлоруксусную кислоту(102 мг, 1,07 ммоль). Полученную смесь перемешивали при 70-80 С в течение 20 мин, а затем при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли метанолом (25 мл),белый осадок собирали путем фильтрации, тщательно промывали свежим метанолом (25 мл) и сушили. Всю процедуру повторяли еще один раз и получали продукт в виде белого твердого вещества, содержащего около 40 мол.% оксиацетатной соли калия (52 мг, 84%), как было определено путем титрования. К раствору полимера уксусной кислоты 24 Смесь перемешивали при комнатной температуре в течение 20 мин, а затем объединяли с раствором бензиламина (12,8 мг, 0,118 ммоль) в метаноле (0,2 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 ч и концентрировали досуха в вакууме. Остаток перемешивали в воде (10 мл), содержащей NaНСО 3 (50 мг) при 50 С, и получали прозрачный раствор, который диализовали против воды в течение 3 дней и лиофилизовали с получением продукта (9 мг, 86%) в виде белого твердого вещества, содержащего 17 мол.% оксиацетамидометиленбензола, как было определено с помощью 1 Н-ЯМР. К раствору полимера (5 мг, 0,0239 ммоль) в воде (0,2 мл) добавляли гидрохлорид 1-этил-3(3-диметиламинопропил)карбодиимида (8 мг,0,04 ммоль) и сульфо-N-гидроксисукцинимид(8,7 мг, 0,04 ммоль). Смесь перемешивали при комнатной температуре в течение 20 мин, а затем объединяли с раствором соединения 2 а (1 мг, 0,0021 ммоль) и 4-диметиламинопиридина(3 мг, 0,024 ммоль) в пиридине (0,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и упаривали досуха. Остаток перемешивали в 1%-ном растворе NaHCO3 (5 мл) и получали прозрачный раствор. После диализа в воде в течение 24 ч раствор лиофилизовали с получением целевого полимера в виде белого твердого вещества (4,5 г, 84%). Титрование кислотой и 1H-ЯМР (D2 О) показали, что полимер содержит 17 мол.% бензиламина, 3 мол.% GG167 (7-аминогексиламинокарбонилокси-4-гуанидино-Nеu5 Ас 2-ен) и 20 мол.% ацетата на 100 глюкозных звеньев носителя. В соответствии с проведенной оценкой,молекулярная масса (Mw) полимера составляла 683 кДа, а средняя Mw одного полимерного 7 аминогексиламинокарбонилокси-4-гуанидиноNеu5 Ас 2-ена составляла 7420. Пример 11. Получение полимерного мультивалентного 1-6'-6"-[6'"-(6-(6"'"-аминокапроил)-аминокапроил)-аминокапроил]-аминокапроиламиногексил-карбамоилокси-4-гуанидино-Nеu5 Ас 2-ена (14 мол.%) на окисленном декстране/500 кДа. К раствору декстрана (Mw 500000) [20 мг,0,123 ммоль) (на основе звена с Mw 162)] в воде(0,4 мл) в ледяной бане по каплям добавляли периодат натрия (15,6 мг, 0,073 ммоль) в воде(0,4 мл). Реакционную смесь перемешивали при 5 С в течение 2 ч, а затем оставляли на 2 ч при комнатной температуре для перемешивания. Полученную смесь разбавляли водой (1,2 мл) и пропускали через колонку с сефадексом G-25(10 мл). Эту колонку элюировали водой (3 мл). Элюат лиофилизовали с получением частично окисленного декстрана (18 мг, 90%) в виде белого твердого вещества. К раствору вышеуказанного окисленного декстрана (3 мг, 0,018 ммоль) в воде (0,6 мл) добавляли бикарбонат натрия (15 мг, 0,178 25 ммоль) и TFA-соль соединения 2 с (6 мг, 0,0057 ммоль). Всю смесь перемешивали в течение 1 ч при комнатной температуре, а затем перемешивали при температуре ледяной бани. К этой холодной смеси порциями добавляли цианоборогидрид натрия (100 мг, 1,59 ммоль). Реакционную смесь перемешивали при температуре ледяной бани в течение 1 ч, оставляли на 16 ч при 5 С, а затем обрабатывали еще 100 мг (1,59 ммоль) цианоборогидрида натрия и перемешивали в течение 1 ч при 5 С, а затем в течение 2 ч при комнатной температуре и, наконец, диализовали против воды в течение 24 ч, лиофилизовали и получали целевой полимер (3 мг) в виде белого твердого вещества. 1H-ЯMP (D2O) показал, что этот полимер содержал около 430 молекул 7-6'-6"-[6"'-(6(6'-аминокапроил)-аминокапроил)-аминокапроил]-аминокапроиламиногексил-карбамоилокси-4-гуанидино-Nеu5 Ас 2-ена (соединения 2 с) на частично окисленную молекулу декстрана. Поэтому, в соответствии с проведенной оценкой, было установлено что Mw полимера составляет 860 кДа, а средняя Mw каждого звена 4-гуанидино-Nеu5 Ас 2-ена составляет 2000. Пример 12. Получение мультивалентного полимерного 7-суберамоил-гексилкарбамоилокси-4-гуанидино-Nеu5 Ас 2-ена (5 мол.%) на полилизине/70 150 кДа. Раствор 7-аминогексил-карбамоилокси-4 гуанидино-Nеu5 Ас 2-ена (соединение 2 а, 6,4 мг,0,0135 ммоль) и дисукцинимидилсуберата (5 мг,0,0135 ммоль) в смеси пиридина (0,1 мл) и ДМФ(0,1 мл) перемешивали в течение 3 ч при 30 С, а затем упаривали досуха в условиях высокого вакуума. Остаток растворяли в эфире (10 мл 3) и сушили с получением активированного сложного эфира. Затем его объединяли с раствором НВr-соли полилизина (Mw 70000150000) (10 мг, 0,0485 ммоль) в смеси воды (0,4 мл), ДМСО(0,25 мл), ДМФ (0,6 мл) и пиридина (0,4 мл). Полученную смесь перемешивали при комнатной температуре в течение 10 ч, а затем диализовали против воды в течение 72 ч. Диализат разбавляли водой (10 мл), нагревали до 50 С, а затем фильтровали. После этого фильтрат лиофилизовали с получением целевого полимера (5 мг) в виде белого твердого вещества. 1H-ЯMP (D2O) указывал на то, что полимер содержал 5 молекул 7-суберамоил-гексилкарбамоилокси-4-гуанидино-Nеu5 Ас 2-ена на 100 лизиновых звеньев носителя. Следовательно, средняя Mw одного полимерного 4 гуанидино-Nеu5 Ас 2-ена составляла 5140. Пример 13. Получение полимерного мультивалентного 7-2'-[2"-(2"'-аминоэтокси)этокси]-этил-карбамоилокси-4-гуанидиноNеu5 Ас 2-ена (3,2 мол.%) на полиглутаминовой кислоте/50100 кДа. К раствору натриевой соли полиглутаминовой кислоты (Mw 50000100000) (10 мг,0,0657 ммоль) в воде (0,6 мл) добавляли гидро 001603 26 хлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (9,6 мг, 0,050 ммоль) и N-гидроксисульфосукцинимид (10,9 мг, 0,050 ммоль). Смесь перемешивали при комнатной температуре в течение 25 мин, а затем объединяли с раствором TFA-соли 7-2'-[2"-(2"'-аминоэтокси)-этокси]-этил-карбамоилокси-4-гуанидиноNеu5 Ас 2-ена (соединение 2d, 4,1 мг, 0,0081 ммоль) в воде (0,1 мл) и пиридине (0,1 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 ч, а затем диализовали против воды в течение 3 дней и, наконец, лиофилизовали с получением целевого полимера(9,5 мг) в виде белого твердого вещества. 1H-ЯМР (D2O) показал, что полимер содержит 3,2 молекулы 7-2'-[2"-(2'"-аминоэтокси)-этокси]-этил-карбамоилокси-4-гуанидиноNеu5 Ас 2-ена на 100 звеньев глутаминовой кислоты носителя. Средняя Mw одного полимерного 4-гуанидино-Nеu5 Ас 2-ена составляла 5250. Пример 14. Получение N-гидроксиэтилполиакриламида, конъюгированного с соединением 2 с и пероксидазой хрена.TFA-соль соединения 2(с) (6 мг, 0,0057 ммоль) добавляли к раствору pNAS (см. пример 6, часть b) (20 мг, 0,118 ммоль NAS) в ДМФ (1 мл). Триэтиламин (20 мкл) добавляли к прозрачному раствору, который перемешивали при комнатной температуре в течение 3 дней. К раствору пероксидазы хрена (17 мг) в воде (4 мл) добавляли половину вышеуказанной реакционной смеси, и смесь оставляли на несколько дней при 4 С. К смеси добавляли этаноламин (0,5 мл 10% раствора в воде) для гашения остаточного сложного эфира, активированного полиакрилатом. Через 2 ч реакционную смесь диализовали против воды в течение 3 дней, а затем диализат лиофилизовали с получением полимерного конъюгата в виде хлопьевидного светлокоричневого порошка. Пример 15. Определение связывания соединений настоящего изобретения с нейраминидазой вируса гриппа. Для испытаний на способность соединений связываться с целой нейраминидазой вируса гриппа использовали два вируса гриппа А и один вирус гриппа В. Выбранными вирусами гриппа А были штаммы либо A/NWS/34tern/Australia/G70c/75(H1N9), либо A/NWS/Tokyo/3/67/HlN2, а штаммом вируса гриппа В был B/Victoria/02/87. Анализ на нейраминидазу проводили методом, описанным в литературе(Potier, М., et al., Anal.Biochem., 1979, 94, 287), и измеренные константы ингибирования (IC50) были систематизированы в табл. 6. Константы ингибирования для макромолекул вычисляли исходя из молекулярной массы на звено связанного производного GG167; так,например, в соответствии с проведенной оценкой было установлено, что молекулярная масса полиакриламида 5 с, который имел происходя 27 щую от GG167 молекулу, связанную с 10% ак 001603 Таблица 6 Константы связывания соединений настоящего изобретения с нейраминидазой вируса гриппа СоединениеDANA 610-6 610-6 Пример 16. Обнаружение вируса гриппа наA NWS/G70C в забуференном фосфатом физиологическом растворе (PBS) добавляли непосредственно в лунки 96-луночного ELISAпланшета (Dynatech) и этот планшет с вирусом оставляли на ночь при 4 С для реакции связывания. После промывки планшеты блокировали РВS-Твином 20 в соответствии со стандартными процедурами, а затем в один ряд ELISAпланшета добавляли серийные разведения соединения 4d, начиная с концентрации 1 мкМ звеньев GG167 и доходя до концентрации 10-10 М. В качестве контроля, в другой рядELISA-планшета добавляли серийные разведения биотинилированного моноклонального антитела против нейраминидазы NC10 (L.C.Gruen, J.Immunological Methods, 1994, 168, 91) . Через 1 ч после инкубирования планшеты промывали для удаления несвязанное соединения, а затем проводили анализ на обнаружение вируса с помощью конъюгата "стрептавидин-HRPO"(Sigma) в качестве хромогенного субстрата и инкубирования в течение около тридцати минут. Концентрации соединения 4d, превышающие 10-9 М, позволяли обнаруживать вирус,и по мере увеличения концентрации соединения наблюдалось усиление сигнала. Так, например,примерно 5106 вирусных частиц на лунку могли быть легко обнаружены с использованием соединения 4d. Биотинилированное антитело, используемое в качестве контроля, давало аналогичный уровень сигнала. Пример 17. Захват и обнаружение комплекса, образованного между вирусом гриппа и соединением 3 а. Для покрытия вирусных частиц конъюгатом "GG167-биотиновое производное", 10 мкл раствора вируса гриппа А NWS/G70C (1108 б.о.е./мл) предварительно инкубировали в течение 1 ч с различными концентрациями соединения 3 а в лунках отдельных рядов ELISAпланшета. Использовали 1/2 lоg10 разведений соединения 3 а, начиная с концентрации 1 мкМ звеньев GG167 и доходя до концентрации 0,00001 мкМ. Затем, комплексы "вируссоединение" переносили на ELISA-планшет,который предварительно сенсибилизировали авидином, и инкубировали в течение 1 ч для осуществления реакции захвата. После этого планшеты промывали в РВS-Твине 20, и "захваченный" вирус обнаруживали с использованием поликлонального кроличьего антитела, направленного против гемагглютинина вируса, в соответствии со стандартными процедурами. Наилучший результат получали с использованием концентрации 0,1 мкМ соединения 3 а, которая позволяла точно обнаруживать вирус при 106 б.о.е. Более высокие концентрации соединения давали более слабый сигнал, что,вероятно, обусловленно блокированием некоторых авидиновых сайтов свободным соединением 3 а, хотя и более низкие концентрации(0,001 мкМ) также давали более слабый сигнал, что, вероятно, обусловлено тем, что имеющееся количество соединения было недостаточным для полного связывания со всеми вирусными частицами. Пример 18. Прямое обнаружение конъюгата "вирус гриппa-GG167-белок-биотин" с использованием конъюгата "стрептавидин-пероксидаза хрена". В соответствии с процедурой, описанной выше в примере 17, и с использованием соединения 4d также осуществляли прямое обнаружение вируса, который был связан с конъюгатом "стрептавидин-пероксидаза хрена", вместо антитела против геммагглютинина. Пример 19. Ингибирование гемагглютинации вируса гриппа макромолекулами настоящего изобретения. Соединения настоящего изобретения тестировали на способность ингибировать гемагглютинацию (HAI) штаммов вируса гриппа Х-31(H3N2), G70C и Tokyo А в соответствии со стандартным методом, описанным в литературе 30 4103, и ссылки, указанные в настоящем описании). HAI-анализ осуществляли с использованием растворов полимерных конъюгатов GG167 вPBS, которые подвергали 2-кратному серийному разведению в 12 лунках планшета для микротитрования. В эти лунки добавляли суспензии вируса,разведенные до 4 единиц НА в PBS. После 2 часового инкубирования при 4 С в каждую лунку добавляли 0,5% суспензию куриных эритроцитов. После 1-часового инкубирования при 4 С определяли наиболее низкую концентрацию ингибитора, который предотвращает агглютинацию эритроцитов. Полученные результаты систематизированы в табл. 7. Таблица 7 Наиболее низкая концентрация (мкМ звеньев GG 167),которая ингибирует агглютинацию Пример 20. Ингибирование репликации вируса гриппа макромолекулами настоящего изобретения. Соединения настоящего изобретения были протестированы на способность ингибировать репликацию вируса гриппа А в соответствии со стандартным методом, который был описан в литературе (см., например, Watanade et al.,J.Virological Methods, 1994, 48, 257). Этот анализ осуществляли с использованием клетокMDCK, и полученные результаты представлены ниже в табл. 8. Эти результаты выражали как минимальную концентрацию, которая ингибирует цитопатический эффект на 50% [ID50(мкг/мл)], и вычисляли с использованием проСоединение (молекулярная масса на звено GG167) граммы регрессионного анализа для построения полулогарифмической кривой. Результаты показали, что все макромолекулы, которые содержали связанные с ними GG167-производные, являются более активными по отношению к вирусу гриппа, чем те же самые макромолекулы с незамещенной главной цепью. Эти результаты также показали, что многие полимерные соединения являются более активными, чем простой мономерный лиганд (соединение 2 с), особенно,при вычислении, исходя из молярной концентрации звеньев GG167. Терапевтический индекс для каждого соединения вычисляли путем деления минимальной концентрации цитотоксического лекарственного средства (МТС) на ID50. Следует отметить, что несмотря на подробное описание настоящего изобретения, в его варианты и методы, описанные в заявке, могут быть внесены различные изменения, не выходящие за пределы первоначального объема и сущности изобретения. Работы, упоминаемые в настоящем описании, включены в него в виде ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Макромолекулярное соединение, имеющее присоединенные к этому соединению одну или несколько молекул (агентов, связывающих нейраминидазу), которые связываются с активным центром нейраминидазы вируса гриппа, но не расщепляются этой нейраминидазой. 2. Макромолекулярное соединение по п.1,в котором агент, связывающий нейраминидазу,присоединен к молекуле через спейсерную или линкерную группу так, чтобы этот агент не был пространственно затруднен главной цепью макромолекулы. 3. Макромолекулярное соединение по п.1 или 2, в котором агент, связывающий нейраминидазу, имеет IC50, равную 10-6 М или менее. 4. Макромолекулярное соединение по любому из пп.1-3, в котором агент связывающий нейраминидазу, является производным сиаловой кислоты. 5. Макромолекулярное соединение по п.4,в котором производое сиаловой кислоты представляет собой соединение (I) соединение (I) GG167 функционализированное в 7-ом положении структуры сиаловой кислоты. 6. Макромолекулярное соединение по любому из пп.1-5 формулы (II)(X-Y)n-M-(Z)m где Х представляет собой связывающееся с нейраминидазой производное 2,3-дегидросиаловой кислоты (2) которое присоединяется в 7-ом положении посредством спейсерной группы Y к макромоле 001603 куле М, и Z представляет собой необязательный дополнительный заместитель на этой макромолекуле, в которой спейсерная группа Y соединена с группой W, и где R представляет азидогруппу, незамещенную или замещенную гуанидиногруппу или незамещенную или замещенную аминогруппу;m представляет целое число от 0 до 1000; иn представляет целое число от 1 до 1000; спейсерная группа Y представляет необязательно замещенную цепь, включающую до 1000 атомов, выбранных из атомов углерода,азота, кислорода и серы; и макромолекула М представляет собой синтетический или природный полимер, белок, антитело или фермент с молекулярным весом от 104 до 107, ковалентно или нековалентно связанный со спейсерной группой Y. 7. Макромолекулярное соединение по любому из пп.1-3 формулы (IIA)(X'-Y)n-M-(Z)m где X' представляет связывающееся с нейраминидазой производное циклогексенила формулы которое соединено посредством боковой эфирной цепи,R, R2, Y, n и m являются такими, как они определены в п.6, иR1 и W1 представляют липофильные С 1 С 12 алкильные или алкиленовые группы, которые необязательно замещены одним или несколькими атомами галогена или алкокси, галогеналкокси, или необязательно замещенные арильные группы. 8. Макромолекулярное соединение по п.6 или 7, где Z представляет группу, которая связывает гемагглютинин. 9. Макромолекулярное соединение по п.6 или 7, где Z представляет группу, которая может действовать как детектируемая метка. 10. Макромолекулярное соединение по п.7,в котором Z представляет биотин или флуоресцентную молекулу. 11. Макромолекулярное соединение по п.6 или 7, в котором Z представляет фермент, подходящий для использования в детектирующем анализе. 12. Макромолекулярное соединение по п.6 или 7, где Z представляет группу с концевой функциональностью, которая пригодна для связывания макромолекулы с поверхностью. 13. Макромолекулярное соединение по п.12, в котором Z представляет группу NH2, SH,СO2 Н, СНО или СН=СН 2. 14. Макромолекулярное соединение по любому из пп.6-13, в котором спейсерную группу Y выбирают из аминоалкильных групп, (поли)аминокислот, линейных пептидов, олигосахаридов и полисахаридов, полиэтиленгликолевых звеньев и аминодиалкилмочевин, каждая из которых может быть использована как отдельно, так и в комбинации друг с другом. 15. Макромолекулярное соединение по п.14, в котором Y имеет концевую аминогруппу. 16. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из белков,ферментов, антител, водорастворимых синтетических полимеров, полисахаридов и полиаминокислот. 17. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из альбумина бычьей сыворотки (BSA), пероксидазы хрена(HRP), авидина, стрептавидина или нейтравидина и иммуноглобулинов. 18. Макромолекулярное соединение по любому из пп.6-15, в котором макромолекулу М выбирают из группы, состоящей из полисахаридов, полиакриламидов, полиэтиленгликолей,полимочевин, поликислот, полиэфиров, полиамидов и N-(2-гидроксипропил)метакриламида(НРМА), где указанная макромолекула является фармацевтически приемлeмой. 19. Макромолекулярное соединение по любому из пп.6-18, где R представляет гуанидино- или аминогруппу, замещенную метильной,этильной, аллильной, амино-, циано- или нитрогруппой. 20. Макромолекулярное соединение по п.6,в котором Х представляет соединение формулы(2), где R представляет гуанидин, R2 представляет ацетил, W представляет группу O(=CO)NH,а спейсерная группа Y представляет цепь, со 34 стоящую из 6-60 атомов углерода, азота и кислорода. 21. Метод обнаружения вируса гриппа,включающий стадию обработки образца, предположительно содержащего указанный вирус,соединением по любому из пп.1-20, которое способно специфически связываться с активным сайтом нейраминидазы вируса гриппа. 22. Метод по п.21, где соединение соединяют с поверхностью либо путем ковалентной,либо путем неспецифической связи и где спейсерная группа Y имеет достаточную длину, чтобы звенья X, связывающие нейраминидазу, экспонировались на поверхности макромолекулы М и были доступными для вирусной частицы. 23. Метод по п.21 или 22, который представляет собой анализ путем селективного захвата, анализ на селективное обнаружение или объединенный анализ на селективный захват селективное обнаружение. 24. Фармацевтическая композиция для лечения гриппа А или гриппа В, включающая соединение настоящего изобретения, предпочтительно соединение по любому из пп.1-7, 13, 14 и 18-20, или его фармацевтически приемлемое производное в сочетании с фармацевтически приемлемым носителем, где соединение имеет значение ID50 для нейраминидазы менее 5 мкг/мл. 25. Композиция по п.24, где соединение представляет собой соединение по п.6 или 7. 26. Композиция по п.24 или 25, которая дополнительно включает один или несколько дополнительных терапевтически активных агентов. 27. Композиция по п.26, где дополнительным терапевтически активным агентом является антивирусный агент. 28. Способ лечения вирусного гриппа у млекопитающего, включая человека, включающий введение эффективного количества соединения настоящего изобретения, предпочтительно соединения по любому из пп.1-7, 13, 14 и 1820, или его фармацевтически приемлемого производного млекопитающему, нуждающемуся в таком лечении, где соединение имеет значениеID50 для нейраминидазы менее 5 мкг/мл. 29. Применение соединения по любому из пп.1-7, 13, 14 и 18-20 для получения медикамента для лечения вирусного гриппа, где указанное соединение имеет значение ID50 для нейраминидазы менее 5 мкг/мл.
МПК / Метки
МПК: A61K 38/38, C07K 14/765, G01N 33/569, A61P 31/16, C08B 37/02, C12Q 1/70, C08F 8/32, C08G 69/48
Метки: соединения, применения, методы, новые
Код ссылки
<a href="https://eas.patents.su/18-1603-novye-soedineniya-i-metody-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения и методы их применения</a>
Предыдущий патент: Способ и устройство для обнаружения факсимильной передачи
Следующий патент: Применение аминоизотиазолов в качестве микробицидов
Случайный патент: Система теплоснабжения (варианты )












