Способ получения мембранных пузырьков
Номер патента: 3235
Опубликовано: 27.02.2003
Авторы: Рамо Филипп, Крузе Жоэль, Деллэн Оливье, Амигорена Себастьян
Формула / Реферат
1. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что отделение пузырьков осуществляют путем анионообменной хроматографии.
2. Способ по п.1, отличающийся тем, что он содержит, по меньшей мере, одну стадию хроматографии, в которой используют сильный анионообменник.
3. Способ по любому из пп.1 и 2, отличающийся тем, что он содержит, по меньшей мере, одну стадию анионообменной и гельпроникающей хроматографии.
4. Способ по любому из пп.1-3, отличающийся тем, что биологическим образцом является образец, выбранный из группы, состоящей из биологической жидкости, культурального супернатанта, клеточного лизата или предварительно очищенного раствора.
5. Способ очистки мембранных пузырьков из биологического образца, отличающийся тем, что он содержит, по меньшей мере,
одну стадию обогащения образца мембранными пузырьками и
одну стадию обработки образца путем анионообменной хроматографии и/или гельпроникающей хроматографии.
6. Способ по п.5, отличающийся тем, что он содержит
культивирование популяции клеток, продуцирующих мембранные пузырьки (например, экзосомы), в условиях, позволяющих пузырькам высвобождаться,
стадию обогащения образца мембранными пузырьками и
стадию обработки образца путем анионообменной хроматографии и/или гельпроникающей хроматографии.
7. Способ по любому из пп.5 или 6, отличающийся тем, что стадия обогащения включает стадию осветления и последующую стадию концентрирования.
8. Способ по любому из пп.5-7, отличающийся тем, что стадия обогащения включает стадию аффинной хроматографии, предпочтительно с красителем.
9. Способ по любому из пп.7 или 8, отличающийся тем, что стадия обогащения включает стадию центрифугирования со слабой скоростью и/или фильтрацию.
10. Способ по любому из пп.7-9, отличающийся тем, что стадия обогащения включает, по меньшей мере, одну стадию ультрафильтрации, в частности тангенциальной ультрафильтрации.
11. Способ получения мембранных пузырьков, отличающийся тем, что он содержит
культивирование популяции клеток, продуцирующих мембранные пузырьки экзосомы, в условиях, позволяющих пузырькам высвобождаться,
обработку культурального супернатанта для получения биологического образца, обогащенного мембранными пузырьками экзосомами, путем, по меньшей мере, одной стадии ультрафильтрации или аффинной хроматографии, при этом отделение пузырьков от биологичeских загрязняющих компонентов осуществляют путем анионообменной и/или гельпроникающей хроматографии.
12. Способ по п.11, отличающийся тем, что он включает стадию фильтрации полученного материала.
13. Способ по любому из пп.1-12, отличающийся тем, что мембранные пузырьки имеют диаметр приблизительно 60-90 нм.
14. Способ по любому из пп.1-13, отличающийся тем, что мембранные пузырьки представляют собой пузырьки, продуцируемые антигенпредставляющими клетками, в частности дендритными клетками, В-лимфоцитами, макрофагами или мастоцитами.
15. Способ по п.14, отличающийся тем, что мембранные пузырьки представляют собой пузырьки, продуцируемые дендритными, в частности человеческими клетками.
16. Способ по любому из пп.1-13, отличающийся тем, что мембранные пузырьки представляют собой пузырьки, продуцируемые опухолевыми, особенно человеческими клетками.
17. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что осуществляют
получение популяции дендритных клеток,
культивирование дендритных клеток в условиях, позволяющих продуцировать мембранные пузырьки, при этом отделение пузырьков от биологически загрязняющих компонентов осуществляют путем, по меньшей мере, одной стадии анионообменной хроматографии.
18. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что осуществляют
получение популяции дендритных клеток,
культивирование дендритных клеток в условиях, позволяющих продуцировать мембранные пузырьки,
обработку культурального супернатанта для получения биологического образца, обогащенного мембранными пузырьками путем, по меньшей мере, одной стадии ультрафильтрации или аффинной хроматографии, при этом отделение пузырьков от биологически загрязняющих компонентов осуществляют путем, по меньшеймере, одной стадии анионообменной и/или гельпроникающей хроматографии.
19. Способ по любому из пп.17 или 18, отличающийся тем, что дендритные клетки получают из биологического образца, происходящего от субъекта - из костного мозга или периферической крови.
20. Способ по любому из пп.17-19, отличающийся тем, что дендритные клетки являются незрелыми.
21.Способ по любому из пп.17-20, отличающийся тем, что дендритные клетки сенсибилизируют антигеном до продуцирования мембранных пузырьков.
22. Способ по любому из пп.17-21, отличающийся тем, что во время культивирования дендритные клетки культивируют в условиях, стимулирующих продуцирование мембранных пузырьков.
Текст
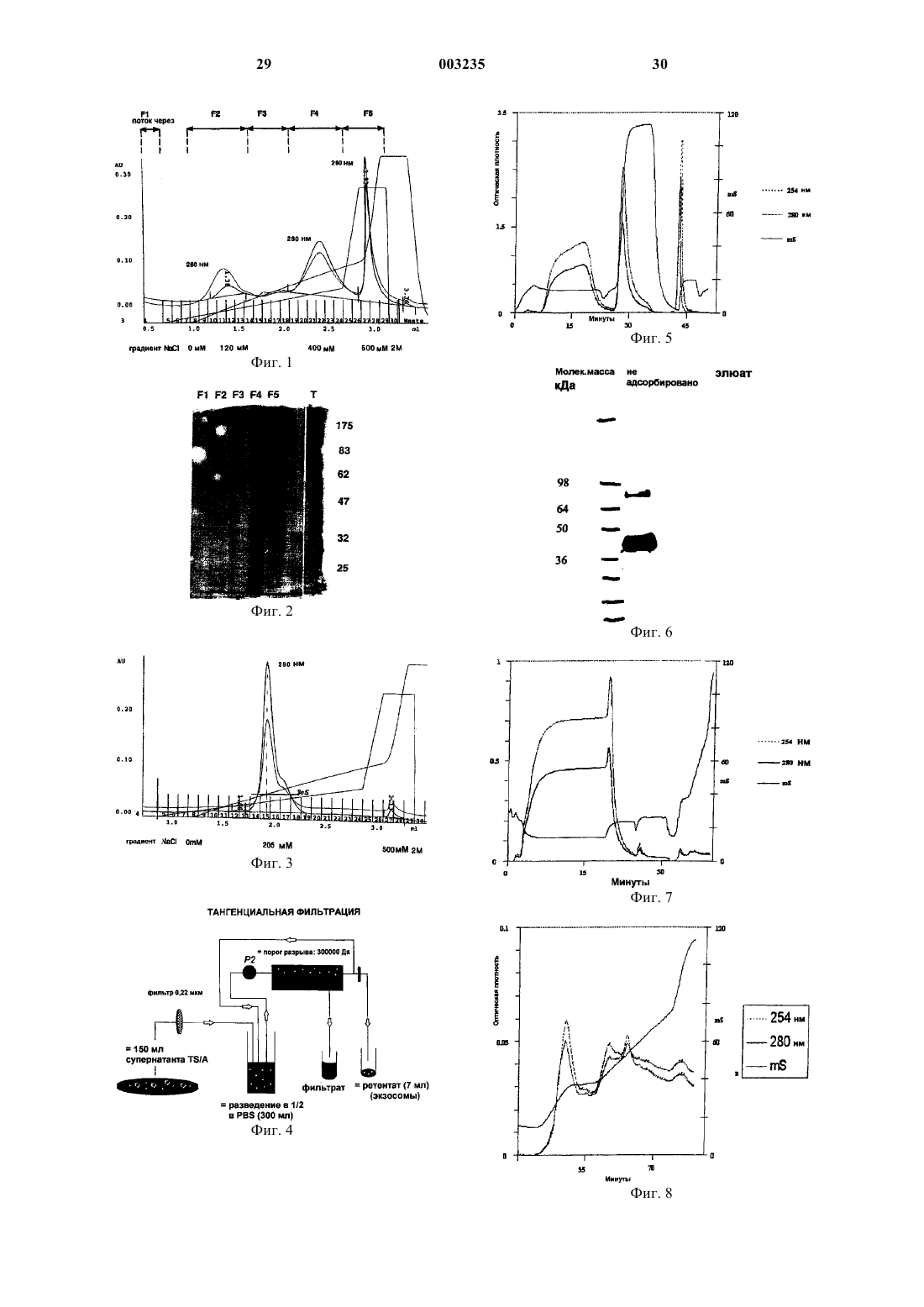
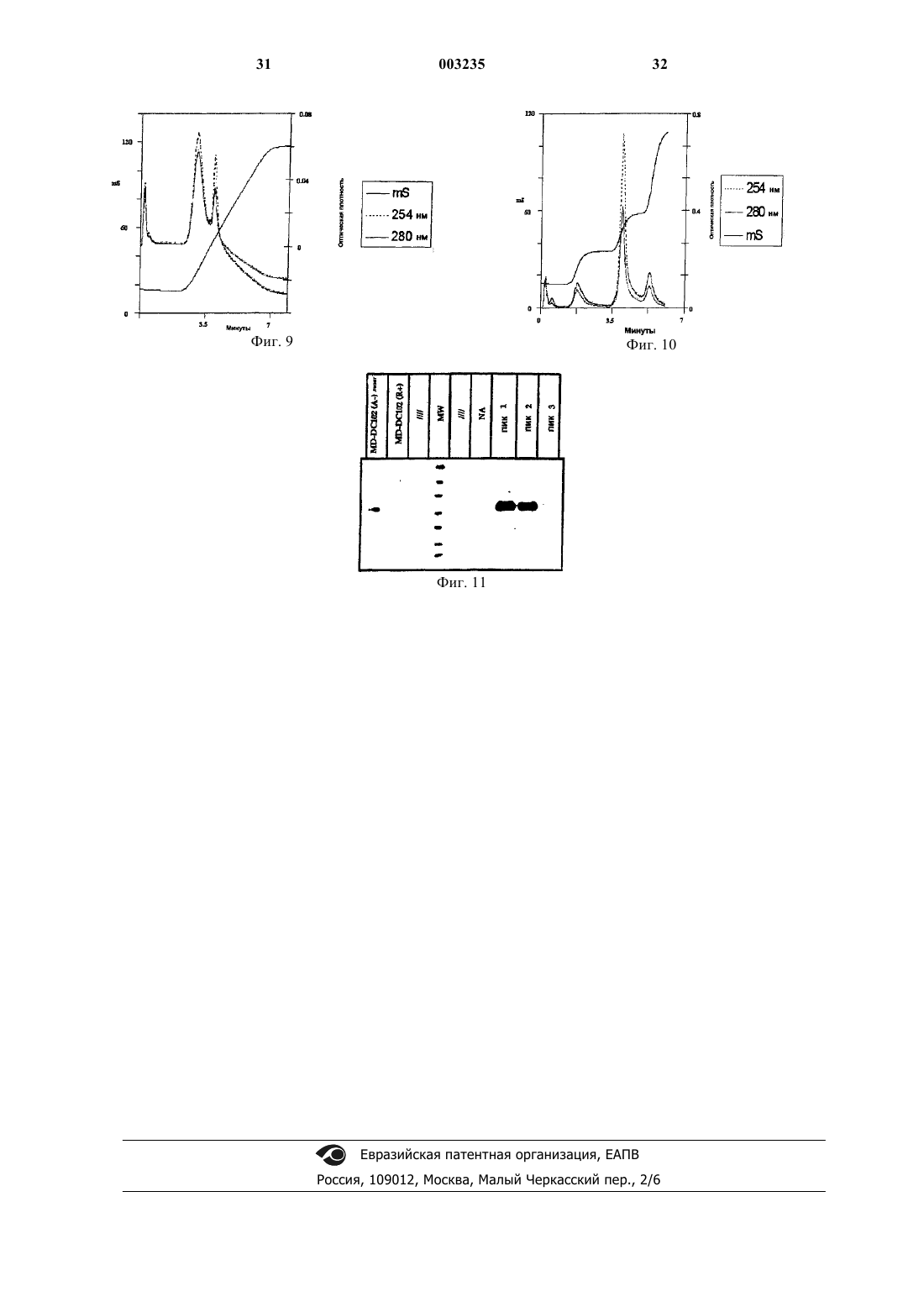
1 Настоящее изобретение относится к новому способу получения (в частности, выделения и/или очистки) мембранных пузырьков. Изобретение относится также к полученным мембранным пузырькам, а также к их применению в области биологии и медицины. Мембранные пузырьки представляют собой пузырьки обычно диаметром меньше 100 нм,образованные липидным биослоем, включающим цитозольную часть. Особые мембранные пузырьки более специфически происходят из внутриклеточных отделов за счет слияния с цитоплазматической мембраной клетки, приводящего к их высвобождению в биологические жидкости или в супернатант культуральных клеток. Такие пузырьки вообще обозначают термином "экзосома". Экзосомы обычно имеют диаметр около 5090 нм, предпочтительно около 60-80 нм и включают преимущественно мембранные протеины, в частности протеины главного комплекса гистосовместимости, которые находятся в той же ориентации, что и в цитоплазматической мембране клеток, из которых они происходят. Кроме того,в зависимости от их происхождения экзосомы включают мембранные протеины, такие какCD40, CD80, HSP70, и лишены эндоплазматического ретикулума и аппарата Гольджи. Выявлено высвобождение экзосом из различных типов клеток в разных физиологических условиях. Так, показано, что В-лимфоциты высвобождают экзосомы, несущие молекулы главного комплекса гистосовместимости класса II,которые играют роль в антигенной презентации(см., например, Raposo и др., J. Exp. Med., 183,1161, 1996). Точно так же показано, что дендритные клетки продуцируют экзосомы, также называемые декзосомами, обладающие особыми структурными и функциональными характеристиками и играющие роль в опосредовании иммунного ответа, в частности в стимуляции цитотоксических Т-лимфоцитов (Zitvogel и др., Nature Medicine, 4, 594, 1998). Также показано, что опухолевые клетки регулярно выделяют особые экзосомы, также называемые текзосомами, несущие опухолевые антигены и способные представлять эти антигены или переносящие их в антигенпредставляющие клетки (международная заявка 99/03499). Также известно, что мастоциты аккумулируют в своих везикулярных внутриклеточных отделах молекулы, которые могут быть выделены под воздействием сигналов (Smith и Weis, Immunology Today, 17, 60,1996). По-видимому, клетки эмиттируют сигналы и сообщаются между собой через посредство высвобождаемых ими мембранных пузырьков,которые могут быть носителями антигенных мотивов, молекул главного комплекса гистосовместимости (СМН), или любого другого сигнала (цитокин, фактор роста и т.д.), которые обладают специфическими структурными и функциональными характеристиками и продуцируются в различных физиологических ситуа 003235 2 циях. Эти пузырьки, и в частности экзосомы,представляют собой продукт, являющийся особенно интересным для диагностических, вакцинальных, терапевтических применений или для транспортировки представляющих интерес молекул. Следовательно, в особенности представляет интерес располагать эффективным и используемым в промышленном масштабе способом получения мембранных пузырьков, приемлемых для использования в области биологии, в частности для фармакологического применения. Согласно классическим способам получения мембранных пузырьков (например, экзосом) осуществляют ряд стадий дифференциального центрифугирования, позволяющего отделять пузырьки от клеток или клеточных остатков, находящихся в культуральной среде. Так, в вышецитированных документах описывается получение пузырьков с помощью ряда центрифугирований при ускорениях 300 g, 10000 g и 70000 g или 100000 g, причем полученный осадок после центрифугирования обрабатывают солевым раствором для получения концентрированного раствора экзосом. Этот препарат может быть проанализирован классическими биохимическими методами, позволяющими оценивать протеиновый состав экзосом. Предпочтительный биохимический метод состоит в электрофорезе в денатурирующей среде, ассоциированном с окрашиванием всех протеинов или с детектированием специфических протеинов с помощью антител согласно методу вестерн-блотирования. Детектирование экзосом в конечном препарате может быть реализовано прямо путем электронной микроскопии после фиксации препарата с помощью 4%-ного раствора глутарового альдегида. Согласно этому способу степени чистоты экзосом являются удовлетворительными в соответствии с тем, что такие препараты позволяют выявлять биологическую активность и противоопухолевые свойства на животных моделях. Тем не менее, известные способы получения путем центрифугирования не позволяют очень тщательно отделять мембранные пузырьки, например экзосомы, от клеточных протеинов, или некоторых макромолекулярных компонентов(ДНК, РНК), или макромолекулярных комплексов. Эти способы, следовательно, не исключают присутствия неидентифицированных загрязняющих биологических факторов, неприемлемых для применения в терапии человека. Кроме того, эти стадии трудноосуществимы в промышленном масштабе, особенно когда должны быть обработаны значительные объемы, или в случае автологичных ex vivo применений (то есть от пациента к пациенту), где способ обычно нужно осуществлять в закрытой системе. Задачей настоящего изобретения является решение этой проблемы. Согласно изобретению описываются новые способы, позволяющие получать, то есть выделять и/или очищать мембранные пузырьки в условиях, приемлемых для 3 промышленного использования и фармакологических применений. Способы согласно изобретению могут быть применимы для индивидуальных приготовлений автологичных экзосом и для приготовления экзосом, получаемых из установленных клеточных линий, для экспериментальных, биологических целей или, например, профилактических или терапевтических вакцинаций. Настоящее изобретение базируется на использовании способов разделения с помощью хроматографии для получения мембранных пузырьков, и в частности для отделения мембранных пузырьков от возможных биологических загрязняющих компонентов. Первым объектом изобретения является способ получения мембранных пузырьков из биологического образца, характеризующийся тем, что он включает, по меньшей мере, одну стадию обработки образца с помощью анионообменной хроматографии. Заявитель показал, что мембранные пузырьки, в частности экзосомы, могут быть очищены путем анионообменной хроматографии. Согласно изобретению неожиданно было обнаружено, что экзосомы разрешаются в виде однородного пика после анионообменной хроматографии. Этот результат оказался совершенно неожиданным в соответствии с тем, что экзосомы представляют собой сложные надмолекулярные объекты, состоящие из мембраны, окружающей внутренний объем, в котором находятся растворимые протеины. Более того, экзосомы содержат мембранные протеины. Более конкретным объектом изобретения является способ получения, точнее очистки,мембранных пузырьков из биологического образца, включающий, по меньшей мере, одну стадию анионообменной хроматографии. В случае осуществления настоящего изобретения речь может идти о сильном или слабом,предпочтительно сильном, обмене анионов. Кроме того, в случае особого варианта осуществления хроматографию реализуют под давлением. Более конкретно речь может также идти о высокоэффективной жидкостной хроматографии (ВЭЖХ). Для осуществления анионообменной хроматографии могут быть использованы различные типы носителей. Более предпочтительно можно назвать целлюлозу, сополимер стирола и дивинилбензола, агарозу, декстран, акриламид,диоксид кремния, сополимер этиленгликоля и метакрилата или смеси, например смеси агарозы с декстраном. В этом отношении в качестве примера можно указать различные материалы для хроматографии, составленные из носителей,таких как указанные выше, и в частности, например гели Source, Poros, сефароза, сефадекс,трисакрил, TSK-гель SW или PW, супердекс,Toyopearl HW и сефакрил, которые пригодны для осуществления настоящего изобретения. Согласно особому варианту осуществления объектом изобретения является способ получения 4 мембранных пузырьков из биологического образца, включающий, по меньшей мере, одну стадию,во время которой биологический образец обрабатывают путем анионообменной хроматографии на носителе, который выбран из группы, состоящей из целлюлозы, сополимера стирола и дивинилбензола, диоксида кремния, акриламида, агарозы, декстрана, сополимера этиленгликоля и метакрилата,используемых индивидуально или в виде смесей, в случае необходимости функционализированных. Кроме того, для улучшения хроматографического разрешения в рамках изобретения предпочтительно используют носители в форме шариков. В идеальном случае речь идет о шариках с однородным и калиброванным диаметром,обладающих достаточно высокой пористостью для возможности проникновения хроматографируемых объектов (то есть экзосом). Так, в расчете на диаметр экзосом, обычно составляющий 50100 нм, для осуществления изобретения предпочтительным является использование гелей повышенной пористости, составляющей в особенности от около 10 нм до около 5 мкм, более предпочтительно от около 20 нм до около 2 мкм, еще более предпочтительно от около 100 нм до около 1 мкм. В случае анионообменной хроматографии используемый носитель долженбыть функционализирован с помощью группы, способной взаимодействовать с анионной молекулой. Обычно эта группа образована амином, который может быть третичным или четвертичным, что определяет соответственно слабый или сильный анионообменник. В рамках настоящего изобретения особенно предпочтительным является использование сильного анионообменника. Согласно изобретению предпочтительно используют хроматографический носитель, указанный выше, функционализированный четвертичными аминами. Согласно более предпочтительному варианту осуществления изобретения анионообменную хроматографию осуществляют на функционализированном четвертичным амином носителе. Еще более предпочтительно речь идет о функционализированном четвертичным амином носителе,выбранном из группы, состоящей из сополимера стирола и дивинилбензола, акриламида, агарозы, декстрана и диоксида кремния, используемых индивидуально или в виде смесей. Из функционализированных четвертичным амином носителей в качестве примеров можно назвать гели Source Q, Mono Q, Q-сефарозу, Poros HQ и Poros QE, гели типа Fractogel TMAE и гели Toyopearl Super Q. Особенно предпочтительный для осуществления анионообменной хроматографии носитель включает сополимер стирола и дивинилбензола. Примером этого типа геля, используемого в рамках изобретения, является гель SourceQ, особенно Source 15Q (Pharmacia). Этот носитель обладает тем преимуществом, что имеет встречающиеся внутренние очень широкие и 5 мало резистентные к циркуляции жидкости через гель поры, позволяя осуществляться полностью быстрой диффузии экзосом к функциональным группам, причем особенно важными параметрами в случае экзосом является их размер. Элюирование биологических соединений в колонке можно осуществлять различным образом, и в частности путем пропускания солевого раствора градиента возрастающей концентрации, например 0-2 М. Можно использовать, в частности, раствор хлорида натрия в концентрациях, изменяющихся в пределах 0-2 М. Детектирование таким образом очищенных различных фракций осуществляют путем измерения их оптической плотности (DO) на выходе из колонки с помощью непрерывного спектрофотометрического определения. Для сведения, в используемых в примерах условиях фракции,включающие мембранные пузырьки, элюировали с ионной силой приблизительно 350-700 мМ в зависимости от типов пузырьков. Для осуществления этой хроматографической стадии могут быть использованы различные типы колонок в зависимости от потребностей и обрабатываемых объемов. В зависимости от препаратов можно использовать колонку объемом от около 100 мкл до около 10 мл или более. Так, имеющиеся в распоряжении носители имеют емкость, способную достигать 25 мг протеинов на мл. В силу этого колонка объемом 100 мкл обладает емкостью порядка 2,5 мг протеинов, что, учитывая рассматриваемые образцы, дает возможность обрабатывать культуральные супернатанты объемом приблизительно 2 л ( которые, после концентрирования, например, в 10-20 раз, дают объемы 100-200 мл на препарат). Само собой разумеется, что также могут быть обработаны гораздо большие объемы, например,за счет увеличения объема колонки. Кроме того, для осуществления настоящего изобретения также можно сочетать стадию анионообменной хроматографии со стадией гельпроникающей хроматографии. Согласно особому варианту осуществления изобретения стадию гельпроникающей хроматографии добавляют к стадии обмена анионов либо перед, либо после стадии анионообменной хроматографии. В случае этого варианта осуществления стадию гельпроникающей хроматографии осуществляют предпочтительно после стадии обмена анионов. Кроме того, согласно особому варианту осуществления стадию анионообменной хроматографии заменяют стадией гельпроникающей хроматографии. В самом деле, в настоящей заявке показано, что мембранные пузырьки также могут быть очищены при использовании жидкостной гельпроникающей хроматографии, в особенности тогда, когда эту стадию сочетают с анионообменной хроматографией или с другой стадией (другими стадиями) обработки биологического образца, как это будет описано подробно дальше. 6 Для осуществления стадии гельпроникающей хроматографии предпочтительно используют носитель, выбранный из группы, состоящей из диоксида кремния, акриламида, агарозы, декстрана, сополимера этиленгликоля и метакрилата или смесей, например смесей агарозы с декстраном. В качестве примера в случае гельпроникающей хроматографии преимущественно используют носитель, такой как супердекс 200 HR (Pharmacia), NSK G6000 (TosoHaas) или еще сефакрил S (Pharmacia). Способ согласно изобретению может быть осуществлен, исходя из различных биологических образцов. В частности, речь может идти о биологической жидкости, происходящей от субъекта (как костный мозг, периферическая кровь и т.д.), культуральном супернатанте, клеточном лизате, предварительно очищенном растворе или о любой другой композиции, включающей мембранные пузырьки. Согласно особому варианту осуществления изобретения биологическим образцом является супернатант культуры клеток, продуцирующих мембранные пузырьки. Кроме того, согласно предпочтительному варианту осуществления изобретения биологический образец до стадии хроматографии обрабатывают с целью обогащения мембранными пузырьками (стадия обогащения). Таким образом, согласно особому варианту осуществления настоящее изобретение относится к способу получения мембранных пузырьков из биологического образца, характеризующемуся тем, что он содержит, по меньшей мере,b) стадию обогащения образца мембранными пузырьками, иc) стадию обработки образца путем анионообменной хроматографии и/или гельпроникающей хроматографии. Согласно предпочтительному варианту осуществления биологическим образцом является культуральный супернатант, обработанный таким образом, чтобы было осуществлено обогащение мембранными пузырьками. В частности, биологический образец может представлять собой предварительно очищенный раствор, получаемый из культурального супернатанта популяции продуцирующих мембранные пузырьки клеток или биологической жидкости путем обработок, таких как центрифугирование, осветление, ультрафильтрация, нанофильтрация и/или аффинная хроматография, в особенности осветление, и/или ультрафильтрация, и/или аффинная хроматография. Предпочтительный способ получения мембранных пузырьков согласно изобретению содержит преимущественно следующие стадии:c) обработкa образца путем анионообменной хроматографии и/или гельпроникающей хроматографии. Как указано выше, стадия обогащения образца (например, супернатанта) может включать одну или несколько стадий центрифугирования,осветления, ультрафильтрации, нанофильтрации и/или аффинной хроматографии супернатанта. Согласно первому варианту осуществления стадия обогащения включает (i) стадию удаления клеток и/или клеточных остатков (стадия осветления), за которой, в случае необходимости,следует (ii) стадия концентрирования и/или аффинной хроматографии. Согласно другому варианту осуществления стадия обогащения включает стадию аффинной хроматографии,которой, в случае необходимости, предшествовала стадия удаления клеток и/или клеточных остатков (стадия осветления). Предпочтительная стадия обогащения согласно изобретению содержит стадию удаления клеток и/или клеточных остатков, концентрирование и аффинную хроматографию. Удаление клеток и/или клеточных остатков может быть осуществлено, например, путем центрифугирования образца с незначительной скоростью, предпочтительно при ускорении ниже 1000 g, например при 100-700 g. Предпочтительными условиями центрифугирования во время этой стадии являются ускорения около 300 или 600 g, например, в течение периода времени 1-15 мин. Удаление клеток и/или клеточных остатков также может быть осуществлено путем фильтрации образца в случае необходимости в сочетании с вышеуказанным центрифугированием. Фильтрация может быть осуществлена путем нескольких последовательных фильтраций при использовании фильтров с уменьшающейся пористостью. В этом отношении предпочтительно используют фильтры с пористостью выше 0,2 мкм, например 0,2-10 мкм. Можно использовать последовательность фильтров с пористостью 10, 1, 0,5, затем 0,22 мкм. Для уменьшения объемов образцов, обрабатываемых во время хроматографических стадий, может быть осуществлено концентрирование. Концентрирования можно достичь путем центрифугирования образца с высокими скоростями, например при ускорениях от 10000 до 100000 g, так, чтобы осадить мембранные пузырьки. В этом отношении речь может идти о ряде дифференциальных центрифугирований,причем последнее центрифугирование осуществляют при ускорении приблизительно 70000 g. Полученные в виде осадка после центрифугирования мембранные пузырьки затем могут быть обработаны более незначительным объемом и соответствующим буферным раствором для последующих стадий способа. 8 Стадия концентрирования также может быть реализована путем ультрафильтрации. Ультрафильтрация позволяет одновременно концентрировать супернатант и осуществить первую очистку пузырьков. Согласно предпочтительному варианту осуществления биологический образец, например супернатант, подвергают ультрафильтрации, предпочтительно тангенциальной ультрафильтрации. Тангенциальная ультрафильтрация состоит в концентрировании и фракционировании раствора между двумя отделами (фильтрат и ретентат), разделенными мембранами с определенными порогами разрыва. Разделение происходит за счет использования потока в отделе ретентата и трансмембранного давления между этим отделом и отделом фильтрата. Для осуществления ультрафильтрации могут быть использованы различные системы, как, например, спиральные мембраны (Millipore, Аmicon), плоские мембраны или мембраны из полых волокон (Amicon,Millipore, Sartorius, Pall, CF, Sepracor). В рамках изобретения преимущественно используют мембраны с порогом разрыва ниже 1000 кДа,предпочтительно 300-1000 кДа, еще более предпочтительно 300-500 кДа. Стадия аффинной хроматографии может быть реализована различным образом, на различных хроматографических материалах и носителях. Речь идет преимущественно о неспецифической аффинной хроматографии, предназначенной для удерживания некоторых загрязнителей, присутствующих в растворе, без удерживания представляющих интерес объектов, т.е. экзосом. Следовательно, речь идет об отрицательной селекции. Хроматографию осуществляют с помощью красителя, позволяющего удалять (то есть удерживать) загрязнители, такие как протеины и ферменты, например альбумин,киназы, дегидрогеназы, факторы коагуляции,интерфероны или липопротеины, или еще кофакторы и т.д. Используемым для этой хроматографии носителем предпочтительно является такой носитель, который применяют для ионообменной хроматографии, функционализированный с помощью красителя. В качестве специфического примера краситель может быть выбран среди синего - сефарозы (Pharmacia),желтого 86 (Yellow 86), зеленого 5 (Green 5) и коричневого 10 (Brown 10) (Sigma). Более предпочтительно носителем является агароза. В рамках настоящего изобретения могут быть использованы любой другой носитель и/или краситель или реакционноспособная группа, позволяющая удерживать некоторые загрязнители обрабатываемого биологического образца. Согласно особому варианту осуществления изобретения биологический образец получают путем обработки супернатанта культуры клеток, продуцирующих мембранные пузырьки,путем, по меньшей мере, одной стадии фильтрации. 9 Согласно другому особому варианту осуществления изобретения биологический образец получают путем обработки супернатанта культуры клеток, продуцирующих мембранные пузырьки, путем, по меньшей мере, одной стадии центрифугирования. Согласно еще одному предпочтительному варианту осуществления изобретения биологический образец получают путем обработки супернатанта культуры клеток, продуцирующих мембранные пузырьки, путем, по меньшей мере,одной стадии ультрафильтрации. Согласно другому предпочтительному варианту осуществления изобретения биологический образец получают путем обработки супернатанта культуры клеток, продуцирующих мембранные пузырьки, путем, по меньшей мере,одной стадии аффинной хроматографии. Предпочтительный способ получения мембранных пузырьков согласно изобретению заключается в том, что осуществляют культивирование популяции клеток, продуцирующих мембранные пузырьки, например экзосомы, в условиях, позволяющих пузырькам высвобождаться,обрабатывают культуральный супернатант для получения биологического образца, обогащенного мембранными пузырьками, например экзосомами, путем, по меньшей мере, одной стадии ультрафильтрации или аффинной хроматографии, и обрабатывают биологический образец путем анионообменной и/или гельпроникающей хроматографии. Согласно предпочтительному варианту осуществления вышеуказанная стадия обработки культурального супернатанта включает фильтрацию культурального супернатанта с последующей, предпочтительно тангенциальной, ультрафильтрацией. Согласно другому предпочтительному варианту осуществления вышеуказанная стадия обработки культурального супернатанта включает осветление с последующей аффинной хроматографией с красителем, особенно на носителе синий-сефароза (Blue Sepharose). Кроме того, после последней стадии полученный материал может быть подвергнут одной или нескольким дополнительным стадиям обработки и/или фильтрации, в частности, с целью стерилизации. В случае этой стадии обработки путем фильтрации предпочтительно используют фильтры, имеющие диаметр пор меньше или равный 0,3 мкм, еще более предпочтительно меньше или равный 0,25 мкм. Такими фильтрами являются, например, фильтры с диаметром пор 0,22 мкм. После последней стадии полученный материал распределяют в соответствующие емкости, такие как флаконы, пробирки, резервуары,шприцы и т.д., в соответствующей среде для хранения. Таким образом полученные очищен 003235 10 ные пузырьки можно хранить на холоде замороженными или немедленно использовать. Особый способ получения согласно изобретению содержит, по меньшей мере, следующие стадии: стадию обработки биологического образца путем анионообменной хроматографии и/или гельпроникающей хроматографии, и стадию фильтрации, в частности стерилизующей фильтрации, полученного материала. Согласно первому варианту осуществления изобретения способ содержит стадию обработки биологического образца путем анионообменной хроматографии, и стадию фильтрации, в частности стерилизующей фильтрации, полученного материала. Согласно другому варианту осуществления изобретения способ содержит стадию обработки биологического образца путем гельпроникающей хроматографии, и стадию фильтрации, в частности стерилизующей фильтрации, полученного после стадии с) материала. Согласно третьему варианту осуществления изобретения способ содержит стадию обработки биологического образца путем анионообменной хроматографии с последующей или предшествующей гельпроникающей хроматографией, и стадию фильтрации, в частности стерилизующей фильтрации, полученного после стадии с) материала. Представленные в примерах результаты показывают, что инжекция препарата экзосом в хроматографическую колонку позволяет получать симметричные пики абсорбции, которые вполне разрешены (фиг. 1). Таким образом выделенные различные фракции можно анализировать классическими методами электрофореза протеинов в денатурирующем геле с последующими способами окрашивания с помощью кумасси синего или способами детектирования специфических протеинов с помощью антител. Таким образом, для текзосом можно показать,что элюированный при анионообменной хроматографии с помощью 400 мМ раствора соли пик обладает протеиновым профилем, идентичным таковому препарата экзосом, полученного классическим путем (фиг. 2). Это позволяет de facto характеризовать пики, элюированные с помощью более слабых или более сильных концентраций соли по отношению к различным биологическим частицам, загрязнителям. Согласно другому эксперименту мембранные пузырьки,полученные из дендритных клеток (декзосомы),или некоторые текзосомы элюируются при ионной силе приблизительно 500-700 мМ, а пузырьки мастоцитов - приблизительно 350 мМ. Кроме того, представленные в примерах результаты также показывают, что способ согласно изобретению позволяет детектировать возможное загрязнение препарата составляю 11 щими большую долю культуральной среды протеинами, такими как бычий сывороточный альбумин. В самом деле, хроматография эталонного раствора бычьего сывороточного альбумина в вышеуказанных условиях показывает, что он дает пик, элюированный при концентрации соли, отличной от таковой для экзосом (фиг. 3). Способ согласно изобретению позволяет: 1) очищать мембранные пузырьки в условиях в отношении качества и количества, приемлемых для фармакологического использования, и 2) обнаруживать наличие различных и загрязнителей в обработанном биологическом образце. Способ согласно изобретению может быть применим для получения мембранных пузырьков различного происхождения. Так, речь может идти, в особенности, об экзосомах, продуцируемых антигенпредставляющими клетками или опухолевыми клетками. Кроме того, речь может идти о первичных клетках, например, в виде культуры, или также об установленных линиях,например иммортализованных линиях клеток,продуцирующих мембранные пузырьки. Речь может идти о клетках, происходящих от млекопитающего, в особенности мыши или человека. Согласно особому варианту осуществления изобретения мембранные пузырьки представляют собой пузырьки, продуцируемые антигенпредставляющими клетками, в частности дендритными клетками, В-лимфоцитами, макрофагами и мастоцитами, в случае необходимости, после их сенсибилизации с помощью одного или нескольких выбранных антигенов. Особенно предпочтительное применение настоящего изобретения заключается в получении мембранных пузырьков, продуцируемых дендритными клетками. Речь может идти о человеческих или животных дендритных клетках, в частности человеческих или мышиных клетках. Эти клетки могут быть первичными, получаемыми из биологических жидкостей субъекта,или получаемыми ex vivo из клетокпредшественников клетками, или также клетками установленных линий, например иммортализованных с помощью канцерогена. Особым объектом настоящего изобретения является способ получения мембранных пузырьков (декзосом), характеризующийся тем,что он содержит получение популяции дендритных клеток,культивирование дендритных клеток в условиях, позволяющих продуцировать мембранные пузырьки-декзосомы, и очистку мембранных пузырьков-декзосом способом, включающим, по меньшей мере, одну стадию анионообменной хроматографии в вышеуказанных условиях. Более предпочтительным вариантом осуществления является способ получения декзосом, характеризующийся тем, что он содержит получение популяции дендритных клеток, 003235 12 культивирование дендритных клеток в условиях, позволяющих продуцировать декзосомы, и обработку культурального супернатанта для получения обогащенного декзосомами биологического образца путем, по меньшей мере,одной стадии ультрафильтрации или аффинной хроматографии, и очистку декзосом способом, включающим,по меньшей мере, одну стадию анионообменной и/или гельпроникающей хроматографии, в вышеуказанных условиях. Для осуществления этого варианта изобретения дендритные клетки предпочтительно получают из биологического образца, происходящего от субъекта, например из костного мозга или периферической крови. В этом отношении способы получения дендритных клеток описаны в уровне техники и могут быть осуществлены специалистом. Дендритные клетки также могут быть получены из клеточных штаммов иммунной системы, из моноцитов-предшественников или еще выделены прямо в дифференцированной форме (Revue parHart, Blood, 90, 3245, 1997). Особенно подходящая методика в рамках настоящего изобретения базируется на получении дендритных клеток из моноцитовпредшественников или костного мозга. Более предпочтительным является использование в рамках настоящего изобретения дендритных клеток, получаемых путем обработки моноцитов-предшественников, содержащихся в крови или мозге, в присутствии комбинации GM-CSF+ IL-4 или GM-CSF + IL-13. Кроме того, для осуществления настоящего изобретения особенно предпочтительно использование популяции дендритных клеток,включающей незрелые дендритные клетки. Преимущественно используют популяцию дендритных клеток, образованную, в основном (то есть, по меньшей мере, 60%, предпочтительно 70%), незрелыми дендритными клетками. Стадия получения дендритных клеток может преимущественно включать получение популяции дендритных клеток, включающей незрелые дендритные клетки, в особенности человека, из моноцитов-предшественников, преимущественно путем обработки с помощью комбинации цитокинов, такой как GM-CSF +IL-4 или GM-CSF + IL-13. Кроме того, в рамках настоящего изобретения также можно использовать популяции иммортализованных дендритных клеток. Речь может идти о линиях иммортализованных дендритных клеток (как, например, линия D1 или любая другая линия, получаемая путем введения канцерогена mуc в дендритные клетки). Речь также может идти о полученных, затем иммортализованных in vitro дендритных клетках. Интерес к иммортализованным дендритным клеткам заключается в составлении банков 13 клеток, сенсибилизированных с помощью данных групп антигенов, используемых в промышленности для получения декзосом, которые могут быть введены целым группам пациентов. Для продуцирования мембранных пузырьков-декзосом дендритные клетки могут быть просто культивированы в обычных условиях,известных специалисту. Тем не менее, преимущественно эти клетки культивируют в условиях,стимулирующих продуцирование декзосом, в особенности в присутствии факторов, способных стимулировать продуцирование декзосом, в частности цитокина, такого как гаммаинтерферон, интерлейкин-10 или интерлейкин 12. Согласно предпочтительному варианту осуществления способа дендритные клетки культивируют в условиях, стимулирующих продуцирование мембранных пузырьков. С другой стороны, согласно особому варианту осуществления дендритные клетки предварительно сенсибилизируют с помощью антигена для продуцирования мембранных пузырьков. Этот вариант осуществления позволяет нагружать дендритные клетки особым антигеном(особыми антигенами) для продуцирования декзосом иммуногенного характера. Сенсибилизация может быть осуществлена с помощью различных известных способов, включающих введение в контакт клеток с антигенными пептидами, антигенами, протеиновыми комплексами,клетками или клеточными мембранами, экспрессирующими антигены, апоптотическими телами, мембранными пузырьками, липосомами, опухолевыми РНК или любой нуклеиновой кислотой, кодирующей один или несколько антигенов, антигенных детерминант или эпитопов(возможно, переносимыми вирусным или невирусным вектором), и т.д. (см., например, международную заявку 99/03499). Согласно предпочтительному варианту сенсибилизацию осуществляют путем инкубации с пептидами, антигенами, РНК или нуклеиновыми кислотами. Настоящее изобретение может быть использовано для получения мембранных пузырьков, продуцируемых опухолевыми, особенно человеческими клетками. Речь может идти о любой клетке, происходящей из твердой или жидкой опухоли, а также из трансформированных или иммортализованных in vitro клеток. Более предпочтительно можно указать солидные, гематопоэтические или асцитные опухоли. Особым применением настоящего изобретения является также возможность получения мембранных пузырьков, включающих одну или несколько гетерологичных, в частности рекомбинантных, молекул. Можно генетически модифицировать клетки, продуцирующие мембранные пузырьки (например, линии мастоцитов), с целью заставить экспрессировать в или на поверхности пузырьков, которые они продуцируют, представляющие интерес молекулы. Согласно настоящему изобретению можно так 003235 14 же очищать такие модифицированные пузырьки. Изобретение может быть использовано для получения мембранных пузырьков, продуцируемых любым типом клеток, в особенности пузырьков экзосомного типа предпочтительно с диаметром меньше приблизительно 100 нм. Речь может идти, в частности, о клетках макрофагов, мастоцитов, ретикулоцитов и т.д. В экспериментальной части авторами настоящей заявки были использованы препараты экзосом,происходящие 1) из линий клеток, таких как линии опухолевых клеток (TS/A), линии мышиных дендритных клеток (DI), линии мастоцитов(RBL), и 2) из линий человеческих дендритных клеток, происходящих от моноцитов. Полученные результаты можно прямо переносить на другие первичные культуры, такие как опухолевые клетки, человеческие дендритные клетки,В-лимфоциты и т.д., культивируемые в приемлемых для промышленности условиях. Способ согласно изобретению также может быть использован для очистки экзосом при их использовании в терапии человека. Таким образом полученные мембранные пузырьки в зависимости от их происхождения представляют собой "инструменты" для изучения раковых заболеваний или регуляции иммунной системы, переноса молекул, продуцирования антител, введения метки, диагностики,составления банков, действующих начал вакцины или лекарственного средства и т.д. Кроме того, способ согласно изобретению может быть также использован в качестве метода контролирования качества в отношении возможного присутствия загрязнителей, в частности загрязняющих протеинов в культуральной среде или в препаратах мембранных пузырьков. Настоящее изобретение может быть также использовано для препаративного способа получения мембранных пузырьков, позволяя в аналитической системе контролировать качество препарата мембранных пузырьков, каков бы ни был способ их получения. Следовательно, настоящее изобретение также относится к способу контроля присутствия загрязнителей, особенно протеинового или нуклеинового происхождения, в препарате мембранных пузырьков, в частности экзосом, включающему обработку фракции вышеуказанного препарата путем, по меньшей мере, одной стадии анионообменной хроматографии и выявление присутствия загрязнителей. Изобретение также относится к анионообменной хроматографии, в особенности типа высокоэффективной жидкостной хроматографии,для получения или очистки мембранных пузырьков. Оно также относится к применению аффинной хроматографии для получения или очистки мембранных пузырьков. Объектом изобретения являются еще мембранные пузырьки, получаемые по способу со 15 гласно изобретению, а также любая композиция,включающая такие пузырьки. Настоящее изобретение более полно описывается с помощью нижеследующих примеров, которые нужно рассматривать как поясняющие и не ограничивающие патентной охраны изобретения. В дальнейшем изобретение поясняется описанием предпочтительных вариантов воплощения со ссылками на сопровождающие чертежи, где фиг. 1 изображает диаграммы элюирования после анионообменной хроматографии образца экзосом, полученных путем дифференциального центрифугирования, согласно изобретению; фиг. 2 - визуализацию протеинового профиля различных элюированных фракций препарата экзосом путем электрофореза в полиакриламидном геле с додецилсульфатом натрия(SDS PAGE), затем окрашивание с помощью кумасси синего согласно изобретению; фиг. 3 - диаграммы элюирования после анионообменной хроматографии эталонного раствора бычьего сывороточного альбумина согласно изобретению; фиг. 4 - схему обработки включающего мембранные пузырьки биологического образца путем тангенциальной ультрафильтрации согласно изобретению; фиг. 5 - общую диаграмму стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 после центрифугирований при ускорениях 600 и 10000 g супернатанта декзосом согласно изобретению; фиг. 6 - вестерн-блотирование, направленное против молекул экзосом СМН класса II, в неадсорбированной фракции и в элюате, из стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 согласно изобретению; фиг. 7 - общую диаграмму стадии с носителем Source 15Q после стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 согласно изобретению; фиг. 8 - подробную диаграмму градиента элюирования для носителя Source 15Q после стадии при использовании быстропроточной колонки с носителем синий-сефароза 6, увеличенное изображение прямоугольной зоны внизу справа на фиг. 7 согласно изобретению; фиг. 9 - диаграмму очистки экзосом, получаемых из линии RBL DR+ (эквивалент 53 мкг протеинов) на колонке с носителем Source 15Q после обработки с помощью дезоксирибонуклеазы и рибонуклеазы, согласно изобретению; фиг. 10 - диаграмму отделения экзосом с помощью дискретного градиента NaCl на носителе Source 15Q согласно изобретению; фиг. 11 - вестерн-блотирование, направленное против молекул человеческого СМН класса II, для каждого пика, выделенного путем 16 ВЭЖХ и подвергнутого ультрацентрифугированию. Положительный контроль: человеческие дендритные клетки, экспрессирующие молекулы СМН II. Отрицательный контроль: подвергнутая ультрацентрифугированию и представляющая собой фон среда. MW=молекулярная масса; NA=неадсорбированная фракция согласно изобретению. Общие методики культивирования клеток и молекулярной биологии 1. Культивирование клеток. Линия клеток TS/A представляет собой установленную линию мышиных клеток из спонтанной грудной карциномы. Эту линию культивировали при температуре 37 С в присутствии 5% CO2 в среде RPMI в присутствии 10% фетальной телячьей сыворотки (DominiqueDutcher). Линии дендритных клеток выдерживали в модифицированной по способу Исков среде Дульбекко (IMDM), содержащей 10% неактивированной фетальной телячьей сыворотки, 2 мМL-глутамина, 50 мкМ 2 МЕ, 100 межд. ед./мл пенициллина и 100 мкг/мл стрептомицина. 2. Анализ протеинов путем электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS PAGE). Образец в количестве 20 мкл разводили в буфере Лэммли (Nature, 227, 680-685, 1970),затем подвергали тепловой денатурации при температуре 95 С в течение 10 мин, после чего помещали на 10% акриламидные гели (Nowex 1 мм х 10 лунок). После миграции гели окрашивали кумасси синим. Примеры 1. Анионообменная хроматография препарата экзосом, продуцируемых опухолевыми клетками (линия TS/A): анализ путем SDSPAGE протеинового профиля различных элюированных фракций. В этом примере поясняется, как стадия анионообменной хроматографии может позволять отделить примеси от препарата экзосом. 1.1. Протокол. В этом эксперименте исходный материал представлял собой концентрат экзосом, полученных путем дифференциального центрифугирования из супернатанта культуры клеток TS/A,позволяющего отделять экзосомы от клеток или клеточных остатков, присутствующих в культуральной среде. Первое центрифугирование осуществляли при низкой скорости (ускорение 300g в течение 5 мин), чтобы осадить суспендированные клетки, находящиеся в культуральном супернатанте. Два других центрифугированияg в течение 30 мин) позволяют осадить клеточные остатки. Таким образом осветленный супернатант подвергали ультрацентрифугированию при высоком ускорении 70000 g в течение 1 ч,позволяющему осадить экзосомы. Этот препарат промывали большим объемом солевого рас 17 твора для повторного центрифугирования в предыдущих условиях. Осадок после центрифугирования затем обрабатывали объемом приблизительно 100 мкл солевого раствора и получали концентрированный раствор экзосом. Количество протеинов определяли по методу Bradford (Biorad, Ivry, Франция). Содержание всех протеинов в этом концентрате составляет 5001000 мкг/мл. 40 мкг этого препарата экзосом, разведенные с помощью 500 мкл 50 мМ буфера трис/HCl, рН=8, инжектировали в колонку, содержащую гель Source 15Q (Pharmacia), уравновешенный с помощью 50 мМ раствора трис/HCl,рН=8. После промывки адсорбированные вещества элюировали с помощью 30 колоночных объемов линейным градиентом NaCl от 0 до 500 мМ, затем 2 М раствором NaCl. Элюированные фракции анализировали путем спектрофотометрии при длине волны 260-280 нм. Элюированные фракции объединяли в виде 5 основных фракций (F1-F5), чтобы можно было анализировать соответствующую протеиновую диаграмму. Протеины каждой фракции подвергали осаждению с помощью 1/10 объема раствора 100%ной трихлоруксусной кислоты, затем промывали раствором ацетона. Протеиновые осадки после центрифугирования обрабатывали с помощью 20 мкл раствора Лэммли и помещали на акриламидный гель SDS PAGE, который затем окрашивали кумасси синим. 1.2. Результаты. Диаграммы элюирования при 260-280 нм представлены на фиг. 1. Диаграммы показывают наличие трех различных симметричных пиков,элюированных с помощью концентраций соли,соответствующих 105 мМ, 400 мМ и 2 М NaCl. Анализ протеиновой диаграммы фракций,соответствующих различным пикам, показывает, что элюированный с помощью 400 мМ раствора NaCl пик имеет протеиновую диаграмму,идентичную препарату экзосом, полученному классически путем центрифугирования (фиг. 2). Соотношение между величинами абсорбции при 260 и 280 нм, составляющее 0,8, сравнимо с описанным для протеинов. Пик (фракция F2), полученный путем элюирования с помощью 105 мМ раствора NaCl,взамен имеет другую протеиновую диаграмму,показывающую только две различные полосы. Измерения абсорбции при 260 и 280 нм дают соотношение 1/6, которое может говорить о наличии ассоциации нуклеиновых кислот и протеинов. Фракция F5, элюированная с помощью 2 М раствора NaCl, соответствует биологическим соединениям, в высокой степени ассоциированным с колонкой. Следовательно, можно отделять экзосомы от примесей путем стадии анионообменной хроматографии. 18 2. Анионообменная хроматография эталонного раствора бычьего сывороточного альбумина. Этот способ анионообменной хроматографии также позволяет оценивать степень загрязнения препарата экзосом протеинами, присутствующими в культуральной среде. При хроматографировании 10 мкг раствора бычьего сывороточного альбумина, соответствующего мажоритарному протеину культуральной среды, было показано, что этот протеин элюируется с помощью 205 мМ раствора NaCl в виде узкого пика,отличимого от вышеописанных пиков для экзосом. 3. Обработка содержащего экзосомы культурального супернатанта путем ультрафильтрации. Этот пример показывает, что можно концентрировать экзосомы путем ультрафильтрации. Кроме того, экзосомальный препарат обеднен загрязняющим протеином, таким как бычий сывороточный альбумин (BSA). 3.1. Протокол: (фиг. 4). 150 мл cупернатанта культуры клеток, полученного после центрифугирования при 300 g клеток TSA, подвергали фильтрации через фильтр с пористостью 0,22 мкм (Millipore). Фильтрат разводили наполовину с помощью забуференного фосфатом физиологического раствора (PBS). Полученные в результате 300 мл раствора фильтровали тангенциально при использовании кассеты для фильтрации (10 см 2 мембраны) с порогом разрыва 300000 Да (Sattorius). 3.2. Результаты. После фильтрации в течение 1 ч получали 7 мл ретентата. Ретентат подвергали ультрацентрифугированию (79000 g) для осаждения и анализа экзосом. Путем анализа с помощьюSDSPAGE с последующим окрашиванием кумасси синим обнаружено, что образец содержал значительно меньше бычьего сывороточного альбумина (BSA), чем подвергнутый ультрафильтрации раствор. Кроме того, наблюдали специфические протеиновые полосы экзосом,полученных из TSA. Ультрафильтрация, следовательно, может быть использована в способе очистки экзосом,чтобы отделить их от загрязняющих протеинов. 4. Очистка с помощью ВЭЖХ человеческих экзосом, продуцируемых происходящими от моноцитов человеческими дендритными клетками (MDDC). 4.1. Материалы и методы. Буферные и маточные растворы Обычно работают при использовании маточных растворов, профильтрованных через фильтр 0,22 мкм, за исключением воды и раствора гидроксида натрия. Первым буферным раствором является 100 мМ раствор бис-триспропана (Sigma; 99% чистоты), забуференный при рН=6; этот буферный раствор использовали 19 на пути А хроматографа (BioCad Sprint, PerkinElmer). Вторым буферным раствором является 100 мМ раствор бис-трис-пропана, забуференный при рН=9; этот буферный раствор использовали на пути В хроматографа. Воду получали при пропускании через смолу с помощью системы Milli-Q с сопротивлением 18 МОмсм; воду использовали на пути С. На пути D использовали маточный 3 М раствор хлорида натрия(NaOH, Prolabo, 98% минимальной чистоты). Путь Е использовали для загрузки культуральных супернатантов в колонки. Все буферные растворы получали при использовании воды, получаемой с помощью системы Milli-Q; буферные растворы не дегазировали. Колонки Быстропроточная колонка с носителем синий-сефароза (Pharmacia) Первую стадию осуществляли при использовании быстропроточной колонки с носителем синий-сефароза 6 (Pharmacia). Матрицей является агароза, связанная с синим 3G (7%); быстропроточная колонка с носителем синийсефароза 6. Размер частиц составляет 45-165 мкм. Максимальная линейная пропускная способность составляет 750 см/ч. Гель является стабильным при значениях рН в диапазоне 4-12. При предельных значениях рН, составляющих 2 и 14, гель может быть поврежден, что вызывает уменьшение фиксирующей способности (нарушение связи с носителем синий-сефароза 6 быстропроточной колонки) и повышение давления(образование "концов"). Носитель быстропроточной колонки синий-сефароза 6 специфичен к таким компонентам, как альбумин, киназы, дегидрогеназы и другие ферменты, содержащие кофакторы, какNAD+, факторы коагуляции, интерфероны и липопротеины. Теоретическая фиксирующая способность носителя синий-сефароза 6 быстропроточной колонки составляет 15-20 мг сывороточного альбумина на мл геля. Используемый объем колонки составляет приблизительно 5,5 мл геля (С 10/10, Pharmacia),или теоретическая фиксирующая способность составляет 80-110 мг сывороточного альбумина. Используемая пропускная способность составляет 2 мл/мин (150 см/ч) на BioCad Sprint и 3,5 мл/мин (260 см/ч) при использовании детектирующей системы Pharmacia. Давление не превышает 2,5 бар и, по существу, обязано кюветам для измерения оптической плотности (DO). Колонка с носителем Source 15Q Вторую стадию осуществляли при использовании колонки с Source 15Q (Pharmacia),сильным анионообменником. Матрицей является сшитый с дивинилбензолом полистирол. Размер шариков составляет 15 мкм и является од 003235 20 нородным. Шарики пропускали через сетку с порами размером, изменяющимся от 20 до 1000 нм. Эти гели очень устойчивы к давлению и обладают значительными линейными пропускными способностями (1800 см/ч и более), полностью сохраняя разрешающую способность и удовлетворительную емкость. Это стало возможным благодаря однородности шариков и их пористости, которые увеличивают доступ молекул к функциональным группам. Гель является стабильным при значениях рН от 2 до 12, за пределами которых гель подвергается опасности значительных повреждений, которые уменьшают его емкости. Теоретическая фиксирующая способность этого ионообменника составляет приблизительно 25 мг протеинов на мл геля. Используют колонку объемом 0,8 мл (PEEK колонка с внутренним диаметром 4,6 мм и длиной 50 мм, Perkin-Elmer), или максимальная емкость составляет 20 мг протеинов. Реальная емкость, которая позволяет сохранять хорошее разрешение, составляет величину порядка 10% от этой максимальной емкости, или 2 мг протеинов. Используемая пропускная способность составляет 5 мл/мин (1880 см/ч) и позволяет осуществлять быстрое разделение. Колонка заполнена с помощью системы Poros self Pacr со скоростью 15 мл/мин и при давлении 150 бар. Хроматограф (BioCad Sprint)BioCad представляет собой систему ВЭЖХ(высокоэффективная жидкостная хроматография), которая позволяет работать при высоких давлениях (максимально 204 бара) и с высокими пропускными способностями, составляющими от 0,2 до 60 мл/мин. Можно использовать вплоть до 6 буферных растворов (на деле использовали 6 путей), и система может быть обработана с помощью 0,1 М раствора гидроксида натрия (рН=12) для депирогенизации фитингов и колонки. Разделения могут быть реализованы при комнатной температуре или при температуре 4 С. Образцы загружали либо доступными путями, либо через инжекционные петли для маленьких объемов от 100 мкл до 5 мл. В системе для детектирования используется УФ-кювета двойного пути определения: при 190-450 нм для УФ-области и 366-700 нм для видимой области. Обычно проводят детектирование при 254 нм для нуклеиновых кислот и детектирование при 280 нм для протеинов. Ими являются аминокислоты с бензольным циклом, такие как тирозины,триптофаны и фенилаланины, которые поглощают. Систему полностью контролировали (программное обеспечение, разработанное фирмойPerspective Biosystem). Для каждого разделения можно контролировать все параметры - давление, расход, удельную электропроводность, оптическую плотность, рН и т.д. Наконец, подвергнутый разделению образец либо улавливали в пробирку Falcon емкостью 50 мл, либо соби 21 рали в силиконизированные пробирки Эппендорфа (коллектор Advantec SF-2120) для минимизации неспецифических взаимодействий. Получение экзосом из дендритных клеток Сначала получали дендритные клетки из моноцитарных предшественников периферической крови. Выделенные моноциты культивировали в присутствии комбинации GM-CSF и IL13 или IL-4. Для получения экзосом предпочтительно использовали популяцию незрелых дендритных клеток. 4.2. Стадия при использовании быстропроточной колонки с носителем синий-сефароза 6. Культуральные супернатанты центрифугировали 2 раза при ускорении 600 g и 1 раз при ускорении 10000 g перед введением в быстропроточную колонку с носителем синийсефароза 6. Используют колонку объемом 5,5 мл, пропускная способность составляет 2 мл/мин, (линейная пропускная способность составляет 150 см/ч; время контакта 2,7 мин), давление составляет величину порядка 2,5 бар (фиг. 5). Колонку уравновешивали буфером 12 мМ ВТР, 10 мМNaCl и рН=7. После уравновешивания в колонку загружали супернатант, затем ее промывали тем же самым буфером для уравновешивания вплоть до снижения снова оптической плотности. Элюирование фиксированных протеинов осуществляли с помощью буфера 12 мМ ВТР,1,5 М NaCl и рН=7 (в количестве 3-4 объемов колонки). Колонку регенерировали путем пропускания воды (в количестве 2-3 объемов колонки), затем пропускали 2 объема 0,1 М раствора гидроксида натрия (рН=12), наконец, колонку уравновешивали с помощью буфера 12 мМ ВТР, 150 мМ NaCl и рН=7. Количественный и качественный аспект стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 Как указано выше, стадия при использовании быстропроточной колонки с носителем синий-сефароза 6 является специфической по отношению к протеинам, как альбумин, который представляет собой основной загрязнитель культурального супернатанта. Определяют концентрацию протеинов в каждой фракции стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 по методике Biorad(измерение оптической плотности при 600 нм). Результаты представлены в табл. 1. Таблица 1 Концентрации протеинов в каждой фракции стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 Супер- Не адсор- Пик элюи- Пик регенатант бировано рования нерации Концентрация протеина, мг/мл Объем, мл 22 Основная часть протеинов находится либо в элюате (72%), либо в регенерированной фракции (32%). Неадсорбированная фракция содержит только 7-10% по отношению к общему количеству протеинов, загруженных в быстропроточную колонку с носителем синий-сефароза 6. Стадия является специфичной к основным загрязнителям супернатанта. Для подтверждения этой специфичности носителя синий-сефароза 6 быстропроточной колонки каждую фракцию помещали на гель SDSPAGE при восстановительном условии и окрашивали с помощью нитрата серебра. Перегрузка колонки (50 мл супернатанта, загруженные в быстропроточную колонку с носителем синий-сефароза 6 объемом 5,5 мл) позволила рассчитать максимальное количество протеинов в культуральном супернатанте, которое можно вводить в колонку на мл геля (табл. 2) . В этом случае процент в неадсорбированной фракции составляет от 7 до более 30% по отношению к количеству загруженного протеина. Эта величина составляет 16-18 мг протеинов на мл геля синий-сефароза 6 быстропроточной колонки. В заключение, 1 мл геля синий-сефароза 6 быстропроточной колонки позволяет очищать около 5-6 мл культурального супернатанта (AIMV 2,5% HSA). Эта величина важна для изучения увеличения масштаба, так как он определяет размер используемой колонки и, следовательно, стоимость этой стадии. Таблица 2 Изучение перегрузки носителя синий-сефароза 6 быстропроточной колонки в первой стадии Супер- Не адсор- Пик элюи- Пик регенатант бировано рования нерации Концентрация протеина, мг/мл Объем, мл Как ожидалось, основным загрязнителем культуральных супернатантов после центрифугирований при 600 и 10000 g является альбумин. Этот загрязнитель после фиксации на носителе синий-сефароза 6 быстропроточной колонки снова обнаруживают во фракциях элюата и регенерации. Кроме этого загрязнителя, снова обнаруживают многочисленные другие загрязнители с низкими и высокими молекулярными массами. Стадия при использовании быстропроточной колонки с носителем синий-сефароза 6 позволяет удалять около 90-95 % загрязнителей из культурального супернатанта. Экзосомы находятся в не адсорбированной на носителе синийсефароза 6 быстропроточной колонки фракции стью 5 мл/мин (линейная пропускная способность 1880 см/ч, время контакта 0,1 мин) при давлении порядка 50 бар. Неадсорбированную на носителе синий-сефароза 6 быстропроточной колонки фракцию загружали прямо в колонку сSource 15Q (фиг. 7) без изменений концентрации соли (NaCl) или рН. После стадии фиксации колонку промывали буферным раствором 12 мМ ВТР, 280 мМNaCl с рН=7 (35 объемов колонки) вплоть до снижения снова оптической плотности до значений, близких к 0. Осуществляли вторую стадию промывки при использовании концентрации соли 150 мМ NaCl (10 объемов колонки) для усиления взаимодействий экзосом с носителем. Реализовывали первый градиент от 150 до 420 мМ NaCl в количестве 7 объемов колонки(фиг. 8), затем градиент прекращали вводить в течение 9 объемов колонки. Второй градиент начинали от 420 мМ NaCl вплоть до 1 М NaCl в 25 объемах колонки. Экзосомы элюировали с помощью второго градиента в виде двух пиков при 550 мМ и 700 мМ NaCl (фиг. 8). Колонку регенерировали путем пропускания воды в количестве 10 объемов колонки, затем 0,1 М раствора гидроксида натрия (рН=12) в количестве 10 объемов колонки и, наконец, путем пропускания 3 М раствора NaCl в количестве 10 объемов колонки. Колонку затем уравновешивали с помощью буфера 12 мМ ВТР, 150 мМ NaCl,рН=7. Количественные и качественные аспекты стадии с Source 15Q Как можно видеть на фиг. 6, основная часть протеинов не адсорбированной на носителе синий-сефароза 6 быстропроточной колонки фракции не была удержана колонкой. Концентрации протеинов измеряли путем теста Biorad (абсорбция при оптической плотности при 600 нм), и они представлены в табл. 3. Таблица 3 Количественные аспекты стадии с Source 15Q после стадии при использовании быстропроточной колонки с носителем синий-сефароза 6 Начало (не адсорНе адсорбировано на носиФракции Фракции бировано теле синий-сефаэлюата элюата на Source 4-6 19-23 роза 6 быстропро 15Q точной колонки) Протеины,мг/мл Объем, мл Общие протеины, мг Выход, %Source 15Q, не удержаны. Объединенные фракции 4-6 и объединенные фракции 19-23 составляют около 1,5%. Фракцию регенерации не анализировали. Выход очень близок к 100%. Все количество загруженных протеинов и пузырьков элюировало из колонки. В отношении на 24 грузки протеинами колонки носитель Source 15Q способен фиксировать около 25 мг протеинов (данные изготовителя), или на 0,8 мл 20 мг протеинов. Ясно, что это очень далеко от максимума колонки и с хорошим разрешением согласуются 5-10%, поскольку эти величины находятся между 1 и 2 мг протеинов. В этих условиях с помощью колонки объемом 0,8 мл с носителем Source 15Q можно очищать 200-400 мл культурального супернатанта. Каждый пик элюирования ультрацентрифугировали (100000 g в течение 1 ч) и объединяли для наблюдения с помощью электронного микроскопа. Первый пик (элюированный между 150 и 420 мМ NaCl) содержит, главным образом, протеины, клеточные остатки и несколько пузырьков, маркированных антителом против СМН II. Второй пик (элюированный с помощью 550 мМ NaCl), обработанный таким же образом,показывает менее значительный фон, намного большее число пузырьков, маркированных антителом против СМН II, имеется также неоднородность по размеру пузырьков. Третий пик (элюированный с помощью 700 мМ NaCl) не имеет больше фона, пузырьки практически все маркированы антителом против СМН II и намного более однородны по размеру. Эти две фракции (пик 2 и пик 3) сравнивали с тем, что получают путем классического способа очистки с помощью ультрацентрифугирования. В этом случае наблюдают значительный фон и большую неоднородность пузырьков по сравнению с пиками, полученными путем хроматографии. Более того, по-видимому, существует разделение между остатками и очищенными с помощью ВЭЖХ экзосомами, что не происходит в случае ультрацентрифугирования. 4.4. Выводы. За счет двух стадий хроматографии, причем в первой используют отрицательную селекцию (стадия при использовании быстропроточной колонки с носителем синий-сефароза 6) экзосом, во второй - положительную селекцию и селективное элюирование экзосом (стадия с носителем Source 15Q), удаляют около 99-99,5% протеинов из культурального супернатанта, полностью сохраняя экзосомы. Способ сохраняет целостность экзосом, как показывает электронная микроскопия. Этот способ, следовательно,является специфическим для очистки экзосом. В качестве примера могут быть использованы другие колонки, удерживающие сывороточные протеины. Кроме того, вместо колонки с носителем Source 15Q могут быть использованы колонки с катионными макропористыми носителями. 5. Очистка путем ВЭЖХ экэосом, получаемых из линии RBL (базофильный лейкоз крысы). Экзосомы получали из линии RBL (базофильный лейкоз крысы), стабильно трансфекти 25 рованной для экспрессирования мембраной экзосом молекул человеческого СМН II. После индукции с помощью ионофора (иономицина) клетки подвергают дегрануляции и высаливают экзосомы в среде без протеинов (RPMI). После удаления клеток путем центрифугирования при 600 g в течение 10 мин супернатанты рекуперировали и обрабатывали с помощью дезоксирибонуклеазы (Sigma) и рибонуклеазы (Sigma). Обработанные супернатанты затем центрифугировали при 10000 g при температуре 37 С в течение 30 мин, затем при 100000 g в течение 1 ч. Осадок после ультрацентрифугирования загружали в ионообменную колонку с носителем Source 15Q, Pharmacia (фиг. 9). Использовали колонку объемом 0,8 мл с пропускной способностью 5 мл/мин (линейная пропускная способность 1880 см/ч, время контакта 0,1 мин). Колонку уравновешивали буфером 12 мМ бис-трис-пропана (ВТР), 150 мМ NaCl и рН=7. После загрузки образца колонку промывали с помощью того же самого буфера для уравновешивания в количестве 15-20 объемов колонки. Элюирование осуществляли с помощью 25 объемов колонки, изменяя концентрацию соли от 150 мМ до 1 М NaCl, значение рН поддерживали постоянным (фиг. 9). Среда очень мало загрязнена протеинами, так как клетки промывали в забуференном фосфатом физиологическом растворе, и индукцию, а также высаливание экзосом осуществляли в одной среде RPMI. Это подтверждено слабой абсорбцией, наблюдаемойSource 15Q фракции. Присутствие экзосом подтверждено путем вестерн-блотирования, направленного против молекул СМН II (фиг. 11),после разделения пиков за счет операций с NaCl(фиг. 10) и ультрацентрифугирования каждого пика. Наблюдают три пика плюс неадсорбированную фракцию: первый пик, элюированный с помощью 350 мМ раствора NaCl; второй пик,элюированный с помощью 700 мМ раствораNaCl; и, наконец, третий пик, элюированный с помощью 1,5 М раствора NaCl. Преобладающим является пик, элюированный с помощью 700 мМ раствора NaCl. В случае вестерн-блотирования,направленного против молекул человеческого СМН II, находят сигнал в пике 1 (350 мМ: NaCl) и в пике 2 (700 мМ NaCl). Нужно заметить, что пик 1, который имеет интенсивность сигнала протеинов в 7-8 раз меньше, чем пик 2, имеет сигнал при вестернблотировании, эквивалентный таковому пика 2. Это может отражать более высокую чистоту пика 1. Для подтверждения этого факта пики ультрацентрифугировали и наблюдали с помощью электронного микроскопа. Пик 1 очень обогащен экзосомами, маркированными антителом против человеческого СМН II, у него незначительный или вообще от 003235 26 сутствует фон. Экзосомы являются неоднородными по размеру, по-видимому, здесь нет разделения экзосом по их размеру, а имеет место специфический механизм конкуренции между элюентом (NaCl) и экзосомами. Фракции, находящиеся между двумя пиками, анализировали с помощью электронной микроскопии. В них находят мало экзосом при более значительном фоне, чем в пике 1. Пик 2 очень похож на фракции, находящиеся между двумя пиками, находят мало экзосом и более значительный фон. Выводы Носитель Source 15Q способен удерживать экзосомы и отделять возможные загрязнители(фиг. 9). Преобладающее большинство экзосом элюировали в одном и том же пике с помощью 350 мМ раствора NaCl. При исследовании с помощью электронной микроскопии экзосомы представляются "нормальными" со специфической маркировкой молекул человеческого СМНII. Неоднородность размера экзосом (пик 1), повидимому, указывает на то, что разделение основано на ионных обменах, а не на просеивании. Носитель Source 15Q может быть использован для стадии очистки экзосом из RBL. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что отделение пузырьков осуществляют путем анионообменной хроматографии. 2. Способ по п.1, отличающийся тем, что он содержит, по меньшей мере, одну стадию хроматографии, в которой используют сильный анионообменник. 3. Способ по любому из пп.1 и 2, отличающийся тем, что он содержит, по меньшей мере, одну стадию анионообменной и гельпроникающей хроматографии. 4. Способ по любому из пп.1-3, отличающийся тем, что биологическим образцом является образец, выбранный из группы, состоящей из биологической жидкости, культурального супернатанта, клеточного лизата или предварительно очищенного раствора. 5. Способ очистки мембранных пузырьков из биологического образца, отличающийся тем,что он содержит, по меньшей мере,одну стадию обогащения образца мембранными пузырьками и одну стадию обработки образца путем анионообменной хроматографии и/или гельпроникающей хроматографии. 6. Способ по п.5, отличающийся тем, что он содержит культивирование популяции клеток, продуцирующих мембранные пузырьки (например, 27 экзосомы), в условиях, позволяющих пузырькам высвобождаться,стадию обогащения образца мембранными пузырьками и стадию обработки образца путем анионообменной хроматографии и/или гельпроникающей хроматографии. 7. Способ по любому из пп.5 или 6, отличающийся тем, что стадия обогащения включает стадию осветления и последующую стадию концентрирования. 8. Способ по любому из пп.5-7, отличающийся тем, что стадия обогащения включает стадию аффинной хроматографии, предпочтительно с красителем. 9. Способ по любому из пп.7 или 8, отличающийся тем, что стадия обогащения включает стадию центрифугирования со слабой скоростью и/или фильтрацию. 10. Способ по любому из пп.7-9, отличающийся тем, что стадия обогащения включает, по меньшей мере, одну стадию ультрафильтрации,в частности тангенциальной ультрафильтрации. 11. Способ получения мембранных пузырьков, отличающийся тем, что он содержит культивирование популяции клеток, продуцирующих мембранные пузырьки экзосомы, в условиях, позволяющих пузырькам высвобождаться,обработку культурального супернатанта для получения биологического образца, обогащенного мембранными пузырьками экзосомами, путем, по меньшей мере, одной стадии ультрафильтрации или аффинной хроматографии, при этом отделение пузырьков от биологичeских загрязняющих компонентов осуществляют путем анионообменной и/или гельпроникающей хроматографии. 12. Способ по п.11, отличающийся тем, что он включает стадию фильтрации полученного материала. 13. Способ по любому из пп.1-12, отличающийся тем, что мембранные пузырьки имеют диаметр приблизительно 60-90 нм. 14. Способ по любому из пп.1-13, отличающийся тем, что мембранные пузырьки представляют собой пузырьки, продуцируемые антигенпредставляющими клетками, в частности дендритными клетками, В-лимфоцитами, макрофагами или мастоцитами. 15. Способ по п.14, отличающийся тем, что мембранные пузырьки представляют собой пу 003235 28 зырьки, продуцируемые дендритными, в частности человеческими клетками. 16. Способ по любому из пп.1-13, отличающийся тем, что мембранные пузырьки представляют собой пузырьки, продуцируемые опухолевыми, особенно человеческими клетками. 17. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что осуществляют получение популяции дендритных клеток,культивирование дендритных клеток в условиях, позволяющих продуцировать мембранные пузырьки, при этом отделение пузырьков от биологически загрязняющих компонентов осуществляют путем, по меньшей мере, одной стадии анионообменной хроматографии. 18. Способ получения мембранных пузырьков из биологического образца, включающий отделение пузырьков от биологических загрязняющих компонентов, отличающийся тем, что осуществляют получение популяции дендритных клеток,культивирование дендритных клеток в условиях, позволяющих продуцировать мембранные пузырьки,обработку культурального супернатанта для получения биологического образца, обогащенного мембранными пузырьками путем, по меньшей мере, одной стадии ультрафильтрации или аффинной хроматографии, при этом отделение пузырьков от биологически загрязняющих компонентов осуществляют путем, по меньшей мере, одной стадии анионообменной и/или гельпроникающей хроматографии. 19. Способ по любому из пп.17 или 18, отличающийся тем, что дендритные клетки получают из биологического образца, происходящего от субъекта - из костного мозга или периферической крови. 20. Способ по любому из пп.17-19, отличающийся тем, что дендритные клетки являются незрелыми. 21.Способ по любому из пп.17-20, отличающийся тем, что дендритные клетки сенсибилизируют антигеном до продуцирования мембранных пузырьков. 22. Способ по любому из пп.17-21, отличающийся тем, что во время культивирования дендритные клетки культивируют в условиях,стимулирующих продуцирование мембранных пузырьков.
МПК / Метки
МПК: A61K 35/12, A61K 39/00, C12N 5/00
Метки: мембранных, получения, пузырьков, способ
Код ссылки
<a href="https://eas.patents.su/17-3235-sposob-polucheniya-membrannyh-puzyrkov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения мембранных пузырьков</a>
Предыдущий патент: Способ извлечения меди из водного раствора
Следующий патент: Способ просмотра в поисках дефектов диска для записи и записывающее устройство для записи информации на носитель записи, имеющий форму диска
Случайный патент: Фунгицидная смесь на базе амидных соединений и производных морфолина, способ борьбы с фитопатогенными грибами