Тетрациклические соединения, способ их получения и содержащие их фармацевтические композиции
Номер патента: 13406
Опубликовано: 30.04.2010
Авторы: Пеглион Жан-Луи, Брокко Морисетт, Пуатевен Кристоф, Миллан Марк
Формула / Реферат
1. Соединения формулы I трансотносительной конфигурации
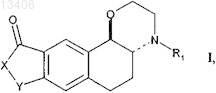
в которых X представляет собой атом кислорода или группу NR2,
Y представляет собой группу, выбранную из -СН2-, -(CH2)2- и -СН=СН-,
R1 и R2, которые могут быть одинаковыми или различными, каждый, представляют собой атом водорода или группу, выбранную из линейного или разветвленного С1-С6алкила, C3-С8циклоалкила и циклоалкилалкила, где алкильный остаток представляет собой C1-C6 и является линейным или разветвленным, а циклоалкильный остаток представляет собой C3-C8,
в рацемической форме или в форме оптических изомеров,
а также их соли присоединения фармацевтически приемлемой кислоты и их гидраты.
2. Соединения формулы I по п.1, в которых R1 представляет собой алкильную группу.
3. Соединения формулы I по п.1 или 2, в которых X представляет собой группу NR2.
4. Соединения формулы I по любому из пп.1-3, в которых Y представляет собой группу CH2.
5. Соединение формулы I по п.1, которое является выбранным из
(4aRS,11bRS)-4-пропил-3,4,4а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин-10(2H)-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;
(4aR,11bR)-4-пропил-2,3,4,4а,5,6,8,11b-октагидро-10H-фуро[3',4':6,7]нафто[1,2-b][1,4]оксазин-10-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;
(4aR,12bR)-4-пропил-3,4,4а,5,6,8,9,12b-октагидро-2H,11H-пирано[4',3':6,7]нафто[1,2-b][1,4]оксазин-11-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;
(4aR,12bR)-4-пропил-2,3,4,4а,5,6,8,9,10,12b-декагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты и
(4aR,12bR)-4-пропил-2,3,4,4а,5,6,10,12b-октагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты.
6. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение в соответствии с любым из пп.1-5 в комбинации с одним или более инертными, нетоксическими, фармацевтически приемлемыми наполнителями или носителями.
7. Применение соединений формулы I в соответствии с п.1 в получении лекарственных средств для использования при лечении расстройств центральной нервной системы, которые вовлекают допаминергическую систему.
8. Применение соединений формулы I в соответствии с п.1 в получении лекарственных средств для использования при осуществлении нейропротективного воздействия или лечении болезни Паркинсона, гиперпролактинемии, половой дисфункции, депрессии, беспокойства, болезни Альцгеймера или других нейродегенеративных расстройств, таких как церебральные приступы.
9. Фармацевтическая композиция по п.6 для применения при лечении расстройств центральной нервной системы, которые вовлекают допаминергическую систему.
10. Фармацевтическая композиция по п.6 для применения при осуществлении нейропротективного воздействия или лечении болезни Паркинсона, гиперпролактинемии, половой дисфункции, депрессии, беспокойства, болезни Альцгеймера или других нейродегенеративных расстройств, таких как церебральные приступы.
Текст
013406 Настоящее изобретение относится к новым тетрациклическим соединениям, к способу их получения и к содержащим их фармацевтическим композициям. В частности, изобретение относится к соединениям формулы I, трансотносительной конфигурации в которых X представляет собой атом кислорода или группу NR2,Y представляет собой группу, выбранную из -CH2-, -(CH2)2- и -СН=СН-,R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или группу, выбранную из линейного или разветвленного С 1-С 6 алкила, С 3-С 8 циклоалкила и циклоалкилалкила, где алкильный остаток представляет собой C1-C6 и является линейным или разветвленным,а циклоалкильный остаток представляет собой C3-C8,в рацемической форме или в форме оптических изомеров,а также их соли присоединения фармацевтически приемлемой кислоты и их гидраты. С 3-С 8 Циклоалкильная группа понимается как такая, которая представляет собой 3-8-членную моноциклическую насыщенную углеводородную группу. Среди фармацевтически приемлемых кислот в качестве неограничивающего примера могут быть упомянуты хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, виннокаменная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота, щавелевая кислота, метансульфоновая кислота, бензолсульфоновая кислота, камфорная кислота и дибензоилвиннокаменная кислота. Один аспект настоящего изобретения относится к соединениям формулы I, в которых R1 представляет собой алкильную группу, в частности пропильную группу. Другой аспект настоящего изобретения относится к соединениям формулы I, в которых X представляет собой группу NR2, в частности группу NH. Другой аспект настоящего изобретения относится к соединениям формулы I, в которых Y представляет собой группу CH2. Другой аспект настоящего изобретения относится к следующим соединениям формулы I:(4aRS,11bRS)-4-пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин-10(2H)-ону, а также к его энантиомерам и солям присоединения фармацевтически приемлемой кислоты;(4aR,11bR)-4-пропил-2,3,4,4 а,5,6,8,11b-октагидро-10H-фуро[3',4':6,7]нафто[1,2-b][1,4]оксазин-10 ону, а также к его энантиомерам и солям присоединения фармацевтически приемлемой кислоты;(4aR,12bR)-4-пропил-3,4,4 а,5,6,8,9,12b-октагидро-2H,11H-пирано[4',3':6,7]нафто[1,2-b][1,4]оксазин 11-ону, а также к его энантиомерам и солям присоединения фармацевтически приемлемой кислоты;(4aR,12bR)-4-пропил-2,3,4,4 а,5,6,8,9,10,12b-декагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-ону,а также к его энантиомерам и солям присоединения фармацевтически приемлемой кислоты и(4aR,12bR)-4-пропил-2,3,4,4 а,5,6,10,12b-октагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-ону,а также к его энантиомерам и солям присоединения фармацевтически приемлемой кислоты. Соединения формулы I действуют как мощные допаминергические лиганды. Допаминергические соединения широко используются в терапии благодаря своим благоприятным эффектам при лечении психиатрических и неврологических расстройств и, во вторую очередь, сердечнососудистых расстройств. На сегодняшний день было клонировано и охарактеризовано пять подтипов допаминергического рецептора (от D1 до D5). Большинство лекарственных средств в этом классе в настоящее время влияют на допаминергическую систему путем их воздействия на подтип D2 либо в качестве блокаторов (или антагонистов), либо в качестве активаторов (или агонистов). Эти лекарственные средства имеют многочисленные вторичные эффекты: дискинезию, гиперпролактинемию и аменорею в первом случае и эметические эффекты в случае последних. В противовес D2 рецепторам концентрация D3 рецепторов является чрезвычайно низкой в нигростриарных ядрах и лактотрофных клетках Pharmacol Ther. 2001, 90(2-3), 231-59; CNS Neurol Disord DrugTargets 2006, 5(1), 25-43). С другой стороны, подобно D2 рецепторам, концентрация D3 рецепторов является очень высокой в лимбической системе (Pharmacol Ther. 2001, 90(2-3), 231-59; CNS Neurol DisordDrug Targets 2006, 5(1), 25-43). Это существенное различие в расположении этих двух подтипов рецепторов побуждает к поиску новых лекарственных средств, которые предпочтительно воздействуют на D3 подтип, что сопровождалось бы минимизацией вторичных эффектов, типично ассоциированных с подтипом D2, как упомянуто в данной заявке выше (Pharmacol Ther. 2001, 90(2-3), 231-59; J Pharmacol Exp Ther. 2004, 309(3), 936-50; J Pharmacol Exp Ther. 2004, 309(3), 921-35; CNS Neurol Disord Drug Targets 2006,5(1), 25-43).-1 013406 Дизамещенные транс-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b]-1,4-оксазины были описаны в качестве допаминергических лигандов в описании к патенту ЕР 0899267. Соединения в соответствии с настоящим изобретением ведут себя как предпочтительные лигандыD3 рецепторов, которые имеют меньшую аффинность по отношению к D2 рецептору. Эта характеристика делает соединения настоящего изобретения особенно ценными благодаря тому факту, что они демонстрируют низкий уровень вторичных эффектов. Ряд исследований подтвердил механизм их влияния и ценность их применения при лечении многочисленных расстройств центральной нервной системы. В частности, соединения в соответствии с изобретением демонстрируют свою активность в тесте активации пресимпатического допаминергического ауторецептора, в тесте принудительного плавания, в тесте ультразвуковой вокализации и во вращательном тесте на крысах с 6-ОН-DA-повреждением. Эти результаты позволяют предложить использовать продукты в соответствии с изобретением для нейропротективного воздействия и для лечения расстройств центральной нервной системы, которые вовлекают допаминергическую систему, таких как болезнь Паркинсона (Pharmacol Ther. 2001, 90(2-3), 23159; J Pharmacol Exp Ther. 2004, 309(3), 936-50; CNS Neurol Disord Drug Targets 2006, 5(1), 25-43), гиперпролактинемия (Pharmacol Ther. 2001, 90(2-3), 231-59; Curr Opin Obstet Gynecol 1993, 5(3), 360-7), половая дисфункция (Physiol Behav. 2004, т. 83, 291-307; J Neurosci. 1999, т. 19, 456-463), депрессия (Pharmacol Ther. 2006, 110(2), 135-370; J Pharmacol Exp Ther. 2004, 309(3), 936-50), беспокойство (Prog Neurobiol. 2003, 70(2), 83-244; J Pharmacol Exp Ther. 2004, 309(3), 936-50), болезнь Альцгеймера и других нейродегенеративных расстройств, таких как церебральные приступы (Eur J Neurosci. 2005, 22(10), 2422-30; Glia. 2005, 52(4), 336-43; J Neurosci. 2006, 26(27), 7272-80; Brain 1999, 122(Pt8), 1449-68; J Neurosci Res. 2002,67(4), 494-500). Настоящее изобретение относится также к способу получения соединений формулы I, исходя из соединения формулы II, трансотносительной конфигурации где R1 является таким, как определено для формулы I,которое подвергают реакции с трифторметансульфоновым ангидридом в присутствии пиридина с получением соединения формулы III где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с цианидом цинка и тетракис(трифенилфосфин)паладием(0) в диметилформамиде в горячем состоянии с получением соединения формулы IV где R1 является таким, как определено в данной заявке выше,которое обрабатывают смесью хлористо-водородной кислоты и уксусной кислоты при кипении с получением соединения формулы V где R1 является таким, как определено в данной заявке выше,-2 013406 которое потом превращают в соединение формулы I при использовании традиционных для органической химии реакций. В качестве примера соединения формулы I, в которых X представляет собой NH, a Y представляет собой CH2, может быть получено путем реакции соединения формулы V с диэтиламином в традиционных условиях проведения амидификации с получением соединения формулы VI где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с фенилцианатом в условиях ортометаллирования с получением соединения формулы VII где R1 является таким, как определено в данной заявке выше,которое восстанавливают при использовании традиционного восстанавливающего агента, такого как никель Ренея, с получением соединенияформулы VIII где R1 является таким, как определено в данной заявке выше,которое подвергают циклизации в присутствии органического соединения лития, такого как третбутиллитий, с получением соединений формулы Ia, в частном случае, соединений формулы I в которых R1 является таким, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой О, a Y представляет собой CH2, могут быть получены путем реакции соединения формулы VI с диметилформамидом в условиях ортометаллирования с получением соединения формулы IX где R1 является таким, как определено в данной заявке выше,которое восстанавливают с помощью селективного восстанавливающего агента, такого как борогидрид натрия, с получением соединения формулы X где R1 является таким, как определено в данной заявке выше,которое подвергают циклизации в присутствии органической или неорганической кислоты, такой как хлористо-водородная кислота, с получением соединений формулы Ib, в частном случае, соединений формулы I в которых R1 является таким, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой группу NR'2, где R'2 представляет собой группу, выбранную из линейного или разветвленного С 1-С 6 алкила, С 3-С 8 циклоалкила и циклоалкилалкила, где алкильный остаток представляет собой C1-C6 и является линейным или разветвленным, циклоалкильный остаток представляет собой C3-C8, a Y представляет собой группу CH2, могут быть получены путем реакции соединения формулы Ib с первичным амином формулы NH2R'2 с получением соединений формулы Ic, в частном случае, соединений формулы I где R1 и R'2 являются такими, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой NH, a Y представляет собой -(СН 2)2-, могут быть получены путем реакции соединения формулы X с галогенирующим агентом, таким как тионилхлорид или тионилбромид, или соединением формулы CG4 в присутствии PPh3, где G представляет собой атом хлора, брома или йода, с получением соединения формулы XI где R1 является таким, как определено в данной заявке выше, a G представляет собой атом хлора, брома или йода,которое подвергают реакции с цианирующим агентом, таким как цианид тетрабутиламмония, цианид натрия или цианид калия, с получением соединения формулы XII где R1 является таким, как определено в данной заявке выше,-4 013406 которое восстанавливают при использовании традиционного восстанавливающего агента, такого как никель Ренея, с получением соединения формулы XIII где R1 является таким, как определено в данной заявке выше,которое подвергают циклизации с помощью органического соединения лития, такого как третбутиллитий, с получением соединения формулы Id, в частном случае, соединений формулы I в которых R1 является таким, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой О, a Y представляет собой -(CH2)2-, могут быть получены путем реакции соединения формулы VI с бромэтанолом в присутствии н-бутиллития в условиях ортометаллирования с получением соединения формулы XIV где R1 является таким, как определено в данной заявке выше,которое подвергают циклизации с помощью неорганической кислоты, такой как хлористоводородная кислота, с получением соединений формулы Ie, в частном случае, соединений формулы I в которых R1 является таким, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой группу NR'2, где R'2 представляет собой группу, выбранную из линейного или разветвленного С 1-С 6 алкила, С 3-С 8 циклоалкила и циклоалкилалкила, где алкильный остаток представляет собой C1-C6 и является линейным или разветвленным, циклоалкильный остаток представляет собой C3-C8, a Y представляет собой группу -(CH2)2-, могут быть получены путем реакции соединения формулы Ie с первичным амином формулы NH2R2 с получением соединений формулы If, в частном случае, соединений формулы I в которых R1 и R'2 являются такими, как определено в данной заявке выше. Соединения формулы I, в которых X представляет собой NH, a Y представляет собой СН=СН, мо-5 013406 гут быть получены путем реакции соединения формулы V с хлорирующим агентом, таким как тионилхлорид, с получением соединения формулы XV где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с гидрохлоридом метоксиламина в присутствии основания, такого как карбонат натрия или карбонат калия, с получением соединения формулы XVI где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с метилиодидом в условиях ортометаллирования с получением соединения формулы XVII где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с диметилформамидом в присутствии органического соединения лития, такого как втор-бутиллитий, с получением соединения формулы XVIII где R1 является таким, как определено в данной заявке выше,которое подвергают реакции с хлоридом титана (III) с получением соединений формулы Ig, в частном случае, соединений формулы I где R1 является таким, как определено в данной заявке выше. Исходные соединения формулы II получают в соответствии с процедурами, описанными в литературе, исходя из известных веществ. Под (4aRS,11bRS) или (4aRS,10bRS) понимают рацемическую смесь энантиомеров, которые обладают абсолютными конфигурациями (4aR,11bR) и (4aS,11bS) или (4aR,10bR) и (4aS,10bS) соответственно. Оптически активные формы соединений формулы I получают либо исходя из оптически активных форм соединений формулы II, либо путем разделения рацемических форм соединений формулы I в соответствии со способами, известными из литературы. Соединения в соответствии с настоящим изобретением представляют собой допаминергические лиганды. Они являются полезными в качестве лекарственных средств при лечении расстройств центральной нервной системы, таких как болезнь Паркинсона, гиперпролактинемия, половая дисфункция, де-6 013406 прессия, беспокойство, болезнь Альцгеймера и других нейродегенеративных расстройств, таких как церебральный приступ. Настоящее изобретение относится к фармацевтическим композициям, включающим активный ингредиент - соединение формулы I или его соль присоединения фармацевтически приемлемой кислоты в комбинации с одним или более инертных, нетоксических, фармацевтически приемлемых наполнителей или носителей. Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты, в частности, те, которые являются приемлемыми для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрезкожного, назального, ректального, чрезъязычного, окулярного или респираторного введения, в частности таблетки или драже, подъязычные таблетки, желатиновые капсулы, капсулы, суппозитории, кремы, мази, дермальные гели, инъецируемые препараты или пригодные для питья препараты, аэрозоли, глазные капли или носовые капли. Полезная дозировка варьирует в зависимости от возраста и веса пациента, способа введения, природы и тяжести расстройства, а также от применения каких-либо ассоциированных лечений и колеблется в пределах от 0,5 до 500 мг в сутки в виде одного или более введений. Приведенные ниже примеры иллюстрируют настоящее изобретение. Структуры соединений, описанных в примерах, определяли в соответствии с обычными спектрофотометрическими методиками (инфракрасная спектрофотометрия, ядерный магнитный резонанс, масс-спектрометрия). Пример 1. (4aRS,11bRS)-4-Пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин 10(2H)-он и его гидрохлорид. Этап A. (4aRS,10bRS)-N,N-Диэтил-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4]оксазин 9-карбоксамид. К 51 г (163 ммоль) гидрохлорида транс-(4aRS,10bRS)-4-пропил-3,4,4 а,5,6,10b-гексагидро-2Hнафто[1,2-b][1,4]оксазин-9-карбоновой кислоты (полученному в соответствии с процедурой, описанной в описании к патенту ЕР 0899267), суспендированному в метиленхлориде (815 мл), прибавляли последовательно диэтиламин (18,3 мл, 177 ммоль, 1,09 экв.), О-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний тетрафторборат (TBTU) (57 г, 177 ммоль, 1,07 экв.), а потом триэтиламин (56 мл, 402 ммоль, 2,4 экв.). Полученный раствор перемешивали при комнатной температуре в течение 20 ч, а потом реакционную смесь обрабатывали 1N раствором гидроокиси натрия (425 мл). Отделяли органическую фазу, промывали насыщенным раствором NaCl, высушивали над сульфатом магния, а потом концентрировали в вакууме. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (90/5). Ожидаемый продукт собирали в форме масла.IR: 1629 см-1. ЯМР 1 Н 300 МГц (CDCl3) 7,60; 7,25; 7,10; 4,30; 4,10; 3,15; 3,7-3,15; 3,00-2,75; 2,50; 2,4-2,2; 1,7-1,4; 1,35-1,00; 0,95. Этап B. (4aRS,10bRS)-N,N-Диэтил-8-циано-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4] оксазин-9-карбоксамид. Амид, полученный на предыдущем этапе (12 г, 36 ммоль), растворенный в тетрагидрофуране (220 мл), прибавляли к раствору, охлажденному до -78 С, втор-BuLi (1,3 М) в гексане (40 мл) и N,N,N',N'тетраметилэтилендиамин (TMEDA) (8,2 мл) в тетрагидрофуране (240 мл) в то время, как поддерживали внутреннюю температуру на уровне -65 С. Полученную смесь перемешивали в течение 1 ч 30 мин при температуре -70 С. Прибавляли фенилцианат (PhOCN) (12 г), при этом поддерживали внутреннюю температуру ниже -65 С. Смесь перемешивали в течение 5 мин при -65 С и потом реакционную смесь снова переносили в условия комнатной температуры на 1 ч 30 мин, после чего перемешивали при комнатной температуре в течение 1 ч. Смесь подвергали гидролизу при использовании 10% раствора воды в тетрагидрофуране, экстрагировали этиловым этером, высушивали и концентрировали. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (95/5). Ожидаемый продукт получали в форме масла.IR: 2228 см-1; 1632 см-1. ЯМР 1H 300 МГц (CDCl3): 7,65; 7,40; 4,30; 4,05; 3,10; 3,60; 3,25; 3,05-2,75; 2,50-2,15; 1,8-1,4; 1,15; 0,95. Этап С. (4aRS,10bRS)-8-(Аминоэтил)-N,N-диэтил-4-пропил-3,4,4a,5,6,10b-гексагидро-2 Н-нафто[1,2b][1,4]оксазин-9-карбоксамид. Нитрил, полученный на предыдущем этапе (0,61 г, 1,7 ммоль) растворенный в метаноле (60 мл), обрабатывали водородом при давлении 4 бар в присутствии Никеля Ренея (1 г), при температуре 60 С в течение 4 ч. После возвращения к условиям комнатной температуры отфильтровывали катализатор, а потом концентрировали фильтрат. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола/аммония (90/10/1). Ожидаемый продукт получали в форме аморфного твердого вещества.(4aRS,11bRS)-4-Пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин 10(2 Н)-он и его гидрохлорид. Раствор трет-бутиллития (1,5 М в пентане) (10 мл) прибавляли к раствору амина, полученного на предыдущем этапе (1,8 г), в тетрагидрофуране (200 мл). Полученную смесь перемешивали в течение 15 мин при температуре -75 С и в течение 20 мин при -40 С, а потом подвергали гидролизу при использовании 10% раствора воды в тетрагидрофуране. После разделения в присутствии метиленхлорида высушивали, концентрировали в условиях сниженного давления, ожидаемый продукт изолировали в форме белого твердого вещества, гидрохлорид которого выкристаллизовывали из метанола.(4aR,11bR)-4-Пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин 10(2H)-он и его гидрохлорид. 700 мг продукта, полученного на этапе D примера 1, помещали на Chiralcel OD колонку и разделяли с помощью ВЭЖХ при использовании 200:1 смеси изопропанола и трифторуксусной кислоты в качестве мобильной фазы. Ожидаемый продукт был первым, который элюировали. После обработки гидроокисью натрия, а потом с помощью 2 М эфирного раствора хлористого водорода получали ожидаемый продукт. Точка плавления: 287-291 С. Оптическое вращение: растворитель = метанол конц. = 1% темп. = 20C= 589 нм(4aS,11bS)-4-Пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин 10(2H)-он и его гидрохлорид. Второй продукт примера 2 соответствует ожидаемому продукту. После обработки гидроокисью натрия, а потом с помощью 2 М эфирного раствора хлористого водорода получали ожидаемый продукт. Точка плавления: 302-308 С. Оптическое вращение: растворитель= метанол конц. = 1% темп. = 20C= 589 нм(4aR,11bR)-4-Пропил-2,3,4,4 а,5,6,8,11b-октагидро-10H-фуро[3'4':6,7]нафто[1,2b][1,4]оксазин-10-он и его гидрохлорид. Этап A. (4aR,10bR)-N,N-Диэтил-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4]оксазин-9 карбоксамид. Гидрохлорид (4aR,11bR)-N,N-диэтил-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4]оксазин-9-карбоновой кислоты (D = +90,6, при 20 С, 1% концентрирование в метаноле) обрабатывали так,как на этапе А примера 1 с получением ожидаемого продукта. Этап B. (4aR,10bR)-N,N-Диэтил-8-формил-4-пропил-3,4,4a,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4] оксазин-9-карбоксамид. Амид, полученный на описанном выше этапе (2 г, 6,05 ммоль), растворенный в тетрагидрофуране(10 мл), прибавляли к раствору, охлажденному до -78 С, втор-BuLi (1,3 M, 7,86 мл) и N,N,N',N'тетраметилэтилендиамина (TMEDA) (1,2 мл, 7,1 ммоль) в тетрагидрофуране (25 мл), в то время как температуру по всему объему поддерживали на уровне ниже -65 С. Полученную смесь перемешивали в течение 1 ч 30 мин, а потом прибавляли N,N,N',N'-диметилформамид (1 мл), в то время как внутреннюю температуру поддерживали на уровне ниже -65 С. Смесь перемешивали в течение 5 мин при -65 С; реакционную смесь переносили обратно в условия комнатной температуры на 1 ч 30 мин и перемешивали в течение 1 ч при этой температуре. После гидролиза с использованием 10% раствора воды в тетрагидрофуране осуществляли экстракцию с помощью этилового этера, высушивали и концентрировали, полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси (метиленхлорид/этанол: 95/5). Ожидаемый продукт собирали в форме масла.-8 013406 3,45, q, 2 Н; 3,00, q, 2 Н; 3,00-2,70, m, 4 Н; 2,35-2,05, m, 4 Н; 1,45, m, 3H; 1,20, t, 3H; 0,10, t, 3H; 0,85, t, 3H. Этап С. (4aR,11bR)-4-Пропил-2,3,4,4 а,5,6,8,11b-октагидро-10 Н-фуро[3'4':6,7]нафто[1,2-b][1,4]оксазин-10-он и его гидрохлорид. Альдегид, полученный на этапе, описанном выше (3,5 г), растворяли в метаноле (35 мл). Раствор,охлажденный до 0 С, обрабатывали с помощью борогидрида натрия (0,45 г). Реакционную смесь перемешивали в течение 20 ч, что сопровождалось возвращением в условия комнатной температуры. Реакционную смесь охлаждали до 0 С; а потом прибавляли 6N раствор хлористо-водородной кислоты (7 мл). Полученную смесь нагревали при температуре кипения в течение 20 ч. После возвращения к условиям комнатной температуры гидрохлорид ожидаемого продукта изолировали и перекристаллизовывали из метанола. Точка плавления: 268-271 С.[1,2-b][1,4]оксазин-9-карбоксамид. Амид, полученный на этапе А примера 4 (5 г, 15 мМ), растворяли в тетрагидрофуране (60 мл), прибавляли к раствору, охлажденному до -78 С, втор-BuLi (1,3 М) в гексане (14,7 мл) и N,N,N',N'тетраметилэтилендиамина (TMEDA) (3 мл) в тетрагидрофуране (65 мл), поддерживая в это время внутреннюю температуру ниже -65 С. Полученную смесь перемешивали в течение 30 мин при температуре-70 С. Раствор литиированного бромэтанола [полученный из бромэтанола и n-BuLi (2,5 М в гексане) в тетрагидрофуране] переносили в канюлю, поддерживая в это время внутреннюю температуру ниже-65 С. Смесь перемешивали в течение 5 мин при -65 С; реакционную смесь переносили обратно в условия комнатной температуры на 1 ч 30 мин и перемешивание продолжали в течение более 1 ч. Проводили гидролиз при использовании 10% раствора воды в тетрагидрофуране, экстракцию с помощью метиленхлорида, высушивание и концентрирование. Полученный остаток очищали с помощью флэшхроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (90/10). Ожидаемый продукт изолировали в форме масла.[1,4]оксазин-11-он и его гидрохлорид. 6N Раствор хлористо-водородной кислоты (2,1 мл) прибавляли при комнатной температуре к раствору продукта, полученного на предыдущем этапе (1,08 г, 2,88 ммоль), в метаноле (9 мл). Полученную смесь нагревали при температуре кипения в течение 20 ч. После возвращения к условиям комнатной температуры фильтрование образовавшегося преципитата позволяло получить гидрохлорид ожидаемого продукта. Точка плавления: 275-279 С.IR: 2401 см-1, 1712 см-1, 1620 см-1. ЯМР 1H 300 МГц (ДМСО-d6): 11,50, m, 1H; 8,00, s, 1H; 7,21, s, 1H; 4,15, dd, 1 Н; 4,50, t, 2 Н; 4,25, d,2 Н; 3,60, m, 1 Н; 3,28, m, 3H; 3,05, m, 5 Н; 2,50, m, 1 Н; 2,00, m, 1H; 1,75, m, 2 Н; 1,00, t, 3H. Пример 6. (4aR,12bR)-4-Пропил-2,3,4,4 а,5,6,8,9,10,12b-декагидро-11 Н-изохино-[6,7-h][1,4]бензоксазин-11-он и его гидрохлорид. Этап A. (4aR,10bR)-8-Гидроксиметил-N,N-диэтил-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2b][1,4]оксазин-9-карбоксамид. Альдегид, полученный на этапе В примера 4 (0,85 г, 2,4 ммоль), растворяли в метаноле (10 мл). Раствор, охлажденный до 0 С, обрабатывали с помощью борогидрида натрия (0,16 г, 4,23 ммоль). Реакционную смесь перемешивали в течение 20 ч, что сопровождалось возвращением в условия комнатной температуры. Метанол выпаривали в вакууме. Остаток изымали из воды и метиленхлорида. После разделения, высушивания и концентрирования полученный остаток очищали с помощью флэшхроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (95/5). Ожидаемый продукт получали в форме масла.-9 013406 Спирт, полученный на предыдущем этапе, растворенный в толуоле, обрабатывали с помощью тионилхлорида (0,4 мл). Смесь перемешивали при комнатной температуре в течение 20 ч. Толуол выпаривали в вакууме. Остаток изымали из воды и метиленхлорида. После разделения, промывания с помощью водного раствора бикарбоната натрия и высушивания ожидаемый продукт получали в форме масла.IR: 1627 см-1. ЯМР 1H 300 МГц (ДМСО-d6): 7,25, s, 1H; 7,20, s, 1H; 4,65, d, 1H; 4,20, d, 1H; 4,00, dd, 1H; 3,80, td,1H; 3,45, q, 2H; 3,10, q, 2H; 2,10-2,70, m, 4H; 2,40-2,05, m, 4 Н; 1,6-1,35, m, 3H; 1,25, t, 3H; 1,00, t, 3H; 0,90,t, 3H. Этап С. (4aR,10bR)-8-Цианометил-N,N-диэтил-4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2b][1,4]оксазин-9-карбоксамид. Соединение, полученное на предыдущем этапе (0,64 г, 1,68 ммоль), растворяли в тетрагидрофуране(15 мл), обрабатывали с помощью цианида тетрабутиламмония (0,8 г, 2,18 ммоль) в течение 20 ч. Смесь концентрировали в вакууме. Остаток изымали из воды и метиленхлорида. После разделения, высушивания и концентрирования ожидаемый нитрил получали в форме масла.IR: 1628 см-1. ЯМР 1 Н 300 МГц (ДМСО-d6): 7,20, 2s, 2H; 4,20, d, 1H; 4,00, dd, 1H; 3,80, m+s, 3H; 3,45, q, 2H; 3,10,q, 2H; 2,10-2,70, m, 4H; 2,35-2,05, m, 4H; 1,55-1,35, m, 3H; 1,15, t, 3H; 1,00, t, 3H; 0,85, t, 3H. Этап D. (4aR,10bR)-8-(2-Аминоэтил)-N,N-диэтил-4-пропил-3,4,4a,5,6,10b-гексагидро-2 Н-нафто[1,2b][1,4]оксазин-9-карбоксамид. Соединение, полученное на предыдущем этапе (2,7 г, 7,3 ммоль), растворенное в метаноле (250 мл),обрабатывали водородом при давлении 4 бар в присутствии никеля Ренея (1 г), при 60 С, в течение 4 ч. После возвращения к условиям комнатной температуры отфильтровывали катализатор и после этого концентрировали фильтрат. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола/аммония (90/10/1). Ожидаемый продукт изолировали в форме аморфного твердого вещества.IR: 3360-3310 см-1, 1626 см-1. ЯМР 1 Н 300 МГц (ДМСО-d6): 7,10, s, 1H; 7,00, s, 1H; 4,20, d, 1H; 4,00, m, 1H; 3,80, m, 1H; 3,45, q, 2H; 3,10, q, 2H; 2,1-2,7, m, 4H; 2,50, m, 2H; 2,4-2,05, m, 4H; 1,6-1,3, m, 3H; 1,20, t, 3H; 1,00, t, 3H; 0,90, t, 3H. Этап E. (4aR,12bR)-4-Пропил-2,3,4,4a,5,6,8,9,10,12b-декагидро-11 Н-изохино[6,7-h][1,4]бензоксазин 11-он и его гидрохлорид. 1,5 М Раствор трет-бутиллития в пентане (1,1 мл, 3,21 ммоль) прибавляли к раствору амина, полученного на предыдущем этапе (0,40 г), в тетрагидрофуране (45 мл). Полученную смесь перемешивали в течение 10 мин при -78 С, а потом в течение 20 мин при -40 С. Смесь подвергали гидролизу при использовании 10% раствора воды в тетрагидрофуране. После разделения в присутствии метиленхлорида, высушивания и концентрирования в условиях пониженного давления полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (90/10). Ожидаемый продукт изолировали в форме аморфного твердого вещества, гидрохлорид которого выкристаллизовывали из этилацетата. Точка плавления: 263-265 С.IR: 1666 см-1. ЯМР 1H (ДМСО-d6): 7,10, s, 1H; 7,10, s, 1H; 5,00, d, 1H; 4,25, m, 2H; 3,60, m, 1 Н; 3,4-3,15, m, 5 Н; 3,00, m, 3H; 2,85, m, 2 Н; 2,50, m, 2 Н; 2,00, m, 1 Н; 1,75, m, 2 Н; 1,00, t, 3H. Пример 7. (4aR,11bR)-9-Метил-4-пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин-10(2H)-он и его гидрохлорид. Продукт примера 4 (1 г, 3,08 ммоль), растворенный в 40% водном растворе метиламина (10 мл), нагревали в автоклаве в течение 16 ч при температуре 120 С. После возвращения к условиям комнатной температуры смесь экстрагировали метиленхлоридом; органическую фазу высушивали над MgSO4. Процесс концентрирования обеспечивал получение остатка, который очищали с помощью флэшхроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (95/5). Ожидаемый продукт получали в форме белого твердого вещества, гидрохлорид которого выкристаллизовывали из ацетонитрила. Точка плавления: 240-245 С.IR: 1692 см-1. ЯМР 1H 300 МГц (ДМСО-d6): 8,00, s, 1 Н; 7,10, s, 1H; 4,35, d, 1H; 4,30, s, 2H; 4,10, m, 1H; 3,15, m, 1H; 3,20, s, 3H; 3,00, m, 2H; 2,10, m, 1H; 2,85, m, 1H; 2,50, m, 1H; 2,30, m, 3H; 1,7-1,4, m, 3H; 0,90, t, 3H. Пример 8. (4aR,12bR)-4-Пропил-2,3,4,4 а,5,6,10,12b-октагидро-11H-изохино[6,7-h][1,4]бензоксазин 11-он и его гидрохлорид. Этап А. Хлорид (4aR,10bR)-9-(4-пропил-3,4,4 а,5,6,10b-гексагидро-2 Н-нафто[1,2-b][1,4]оксазин) карбоновой кислоты. 3,6 мл (41,7 ммоль) тионилхлорида прибавляли по каплям к (4aR,10bR)-4-пропил-3,4,4 а,5,6,10bгексагидро-2 Н-нафто[1,2-b][1,4]оксазин-9-карбоновой кислоте (10 г, 32 ммоль), суспендированной в безводном толуоле (100 мл) и диметилформамиде (0,15 мл). Полученную смесь нагревали при температуре- 10013406 кипения в течение 1 ч. После возвращения к условиям комнатной температуры смесь фильтровали, а твердый остаток промывали толуолом. Твердое вещество высушивали до постоянного веса в печи в вакууме в присутствии Р 2 О 5 с получением ожидаемого продукта.IR: 2457 см-1; 1753 см-1; 814-775 см-1. ЯМР 1H 300 МГц (ДМСО-d6): 8,05 (s) 1H; 7,80 (dd) 1H; 7,30 (d) 1H; 5,05 (d) 1H; 4,30 (m) 2H; 3,60 (d) 1H; 3,50 (NH) 1H; 3,30 (m) 3H; 3,00 (m) 3H; 2,50 (m) 1H; 2,10 (m) 1 Н; 1,75 (m) 2 Н; 0,95 (t) 3H. Этап В. Метоксиметиламид (4aR,10bR)-9-(4-пропил-3,4,4a,5,6,10b-гексагидро-2 Н-нафто[1,2b][1,4]оксазин)карбоновой кислоты. 2,62 г (31,3 ммоль) гидрохлорида метоксиламина прибавляли к смеси карбоната калия (13 г, 94 ммоль) в воде (31 мл) и этилацетате (62 мл). К смеси, охлажденной до 0 С, прибавляли порциями кислый хлорид этапа А (10,35 г, 31,3 ммоль), в то время как температуру поддерживали ниже 5 С. Смесь перемешивали в течение 2 ч при 0 С. После прибавления этилацетата и воды и возвращения к условиям комнатной температуры смесь разделяли, а органическую фазу промывали водой, высушивали над сульфатом магния, а потом концентрировали в вакууме с получением ожидаемого продукта в форме твердого вещества. Точка плавления: 147-152 С.(dd) 1H; 3,80 (td) 1H; 2,7-3,00 (m) 3H; 2,30 (m) 2H; 2,05-2,2 (m) 2H; 1,45 (m) 3H; 0,88 (t) 3H. Этап С. (4aR,12bR)-10-метокси-4-пропил-2,3,4,4a,5,6,10,12b-октагидро-11 Н-изохино[6,7-h][1,4]бензоксазин-11-он. Раствор амида, полученного на этапе В (4 г, 13,14 ммоль), в тетрагидрофуране (40 мл) прибавляли к раствору, охлажденному до -78 С, втор-BuLi (24 мл, 31,53 мМ) и N,N,N',N'-тетраметилэтилендиамина(TMEDA) (4,8 мл, 31,53 ммоль) в тетрагидрофуране (90 мл), в то время как температуру поддерживали ниже -70 С. Реакционную смесь переносили обратно в условия температуры -20 С, а потом перемешивали в течение 45 мин при средней температуре -10 С. Смесь вновь охлаждали до -78 С и прибавляли метилиодид (0,1 мл, 14,45 мл). Температуру вновь поднимали до 0 С, а потом до комнатной температуры. Гидролиз осуществляли при использовании насыщенного раствора хлорида аммония. После прибавления этилового этера смесь разделяли, органическую фазу промывали водой, высушивали над сульфатом магния, а потом концентрировали в вакууме. Раствор втор-BuLi (21,4 мл, 27,8 ммоль) прибавляли к раствору полученного остатка (4,04 г) в тетрагидрофуране (83 мл). Осуществляли охлаждение до -78 С и перемешивание в течение 2 ч при этой температуре. В то время как температуру поддерживали ниже -70 С,прибавляли диметилформамид к смеси (1,13 мл, 14,6 ммоль), которую перемешивали в течение 10 мин,при этом указанную выше температуру опять повышали до комнатной температуры. Гидролиз осуществляли при использовании насыщенного раствора хлорида аммония. После прибавления этилового этера смесь разделяли; органическую фазу промывали водой, высушивали над сульфатом магния, а потом концентрировали в вакууме. Остаток переносили в тетрагидрофуран (330 мл), прибавляли концентрированную хлористо-водородную кислоту (13,5 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. После обработки концентрированным раствором гидроокиси натрия, экстракции этилацетатом и промывания водой и раствором хлорида натрия органическую фазу высушивали над сульфатом магния, а потом концентрировали в вакууме. Полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (95/5). Ожидаемый продукт изолировали в форме бежевого твердого вещества. Точка плавления: 142-145 С. ЯМР 1H 400 МГц (CDCl3): 8,65, 7,25, 7,22, 6,35, 4,47, 4,12-4,03, 4,05, 3,00 ч. на млн. Этап D. (4aR,12bR)-4-Пропил-2,3,4,4 а,5,6,10,12b-октагидро-11 Н-изохино[6,7-h][1,4]бензоксазин-11 он и его гидрохлорид. 15% Раствор TiCl3 в воде (7,6 мл) прибавляли к раствору соединения этапа С (1,1 г, 3,35 ммоль) в этаноле (3,3 мл). Реакционную смесь нагревали при 45 С в течение 24 ч. Нагревание продолжали в течение 6 дней с ежедневными добавлениями 15% раствора TiCl3 (3,5 мл). После возвращения к условиям комнатной температуры смесь обрабатывали с помощью воды (30 мл) и льда (30 г), а затем подщелачивали до значения рН 13-14 при использовании 35% раствора гидроокиси натрия. Черную суспензию обрабатывали с помощью потока сжатого воздуха до тех пор, пока суспензия полностью не обесцвечивалась. После экстракции с помощью метиленхлорида, высушивания и концентрирования полученный остаток очищали с помощью флэш-хроматографии на силикагеле при использовании элюентной смеси метиленхлорида/этанола (95/5). Ожидаемый продукт изолировали в форме белого твердого вещества, гидрохлорид которого выкристаллизовывали из ацетонитрила. Точка плавления: 200-203 С.- 11013406 Фармакологическое исследование Пример 9. Изучение связывания человеческих рецепторов D2 и D3. Культура клеток. Клетки СНО (яичника китайского хомячка) стабильно трансфицировали с помощью гена, кодирующего человеческий допаминовый рецептор D2 или D3 в соответствии со способами, известными из литературы. Нативные клетки являются дефицитными по ферменту DHFR (дигидрофолат редуктаза). Клетки культивировали в термостате при 37 С во влажной атмосфере 5% СО 2, 95% воздуха. Трансфекции осуществляли при использовании липофектина (Gibco). Клетки СНО, котрансфицированные геном человеческого рецептора D2 и геном резистентности к плеомицину, подвергали отбору на их устойчивость к этому антибиотику в культуральной среде. Отбирали клетки, трансфицированные геном человеческого рецептора D3, в среде без гипоксантина/тимидина, в присутствии метотрексата. Используемые композиции культуральной среды представляли собой для CHO-D2 - DMEM (среда Игла, модифицированная Дюльбекко) с добавкой 10% фетальной телячьей сыворотки и гипоксантина/тимидина; для CHOD3 - DMEM с добавкой 10% диализированной фетальной телячьей сыворотки. Клетки отбирали при слиянии, после чего получали мембраны. Получение мембран. Через несколько минут в присутствии 0,2% трипсина клетки собирали и центрифугировали при 2,000 g в течение 5 мин. Клеточную массу, которую ресуспендировали в 10 мМ Трис-HCl буфера рН 7,5,содержащего 5 мМ MgSO4, после этого гомогенизировали при использовании Polytron. Потом гомогенат центрифугировали при 50,000 g в течение 15 мин и осадок повторно ресуспендировали при использовании осторожной ультразвуковой обработки в буфере для инкубации, который имеет следующий состав: 50 мМ Трис-HCl рН 7,5, содержащий 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 5 мМ MgCl2. Потом мембраны разделяли на аликвоты и хранили при температуре -80 С до дня проведения эксперимента. Эксперименты по связыванию. Инкубацию осуществляли в полипропиленовых пробирках при заключительном объеме 400 мкл,который содержал 100 мкл [125I]-йодсульприда (Amersham) при 0,1 и 0,2 нМ для D2 и D3 рецепторов соотвественно,100 мкл буфера (общие пробирки), или 100 мкл 10 мкМ раклоприда (неспецифическое связывание), или 100 мкл соединения 200 мкл мембранного препарата, содержащего D2 или D3 рецепторы, к которому прибавляли % БСА(бычий сывороточный альбумин). Интервалы концентраций каждого соединения включали по крайней мере семь точек, определяемых в трехкратной повторности. Каждый эксперимент повторяли по крайней мере дважды. Инкубацию, которая длилась 30 мин при 30 С, останавливали путем быстрой фильтрации через аппарат Брендла, после чего осуществляли три последовательных промывания с помощью Трис-HCl буфера с рН 7,4, который содержал 120 мМ NaCl. Фильтры собирали и потом подвергали подсчету при использовании гамма-счетчика. Анализ результатов.IC50, которое представляет собой концентрацию, вызывающую 50% ингибирование связывания радиолиганда, подсчитывали с помощью нелинейной регрессии (метод Prism Graph). Значение Ki получали из формулы Ki = IC50/(1 + L/Kd), где L представляет собой концентрацию[125I]-йодсульприда, используемую в эксперименте, a Kd является его константой диссоциации. Результаты выражали в форме pKi (pKi = -logKi). Для человеческих рецепторов D2 и D3 значения Kd были 0,5 и 1,31 нМ соответственно. Результаты. Пример 10. Предсинаптическая допаминергическая ауторецепторная активация. Тест, который регистрирует единичную экстрацеллюлярную электрическую активность участка вентральной покрышки крыс. Принцип. Введение допаминергического агониста снижает нейронную частоту разрядки зависимым от дозы- 12013406 образом. Этот эффект инвертируется с помощью допаминергического антагониста. Способ. Крыс подвергали анестезии при использовании хлоралгидрата (400 мг/кг, интраперитонеально) и помещали в стереотаксическое устройство (Unimecanique, France) после катетеризации бедренной вены. Уровень анестезии поддерживали с помощью интраперитонеального введения хлоралгидрата каждый час; ректальная температура поддерживалась на уровне 371 С с помощью термостатически контролируемого покрывала с подогревом. Вводили вольфрамовый микроэлектрод (10 М, 1 мкм) при использовании электронного микропривода (Unimecanique, France) в область вентральной покрышки (АР: -5,5/ брегма; L: 0,7; Н: 7,0-8,5/твердая мозговая оболочка; атлас Paxinos и Watson, 1986). Потенциал допаминергических клеток оценивали по их морфологии (трифазные потенциалы +/-/+, длительность больше 3 мс), их ритму разрядки либо регулярному, либо в виде импульсов снижающейся амплитуды, а также их частоте разрядки, которая составляла от 2 до 8 Гц. Для регистрации использовали одну клетку на животное. После периода 5 мин (основная активность) и начальной инъекции носителя (дистиллированная вода, к которой прибавляли несколько капель молочной кислоты, значение рН доводили до 5 при использовании 1N NaOH), продукты в соответствии с изобретением вводили внутривенно в кумулятивно увеличивающихся дозах с интервалами 2-3 мин. Анализ результатов. Анализ данных осуществляли при использовании пакета программного обеспечения Spike2 (Cambridge Electronic Design, England). Частоту разрядки измеряли в течение 1 мин при максимальном изменении между каждой инъекцией и выражали в виде процентного изменения в отношении основной активности (усредненная в течение 5 мин, которые предшествовали первой обработке), которую определяли как 100%. Эффект продуктов в соответствии с изобретением статистически оценивали с помощью анализа отклонения на протяжении повторяемых измерений, после чего проводили анализ Даннетта для сравнения эффектов различных доз с эффектом носителя (дистиллированная вода). Результаты. В качестве примера, приведенная ниже таблица показывает эффекты продукта в соответствии с примером 2. Индивидуальные значения (n = 5) = значениестандартная ошибка значения.р 0,05 против носителя Пример 11. Антидепрессивные свойства: тест насильственного плавания у крыс. Принцип. Тест насильственного плавания (Porsolt R. и др., Eur. J. Pharmacol, 1978, 47, 379-91) представляет собой поведенческий анализ, который включает индукцию состояния отчаяния у крысы путем помещения не подвергнутого какому-либо воздействию животного в пространство, заполненное водой, из которого оно не в состоянии выбраться, в течение периода времени, равного 15 мин. В течение первых 510 мин крыса борется энергично, но, в конечном счете, принимает неподвижную позу во время последней части теста. Животное, помещенное в то же самое пространство на следующий день, остается неподвижным на протяжении большей части теста (длительностью 5 мин). Антидепрессанты уменьшают длительность неподвижности у крысы во время проведения теста. Экспериментальная процедура. Эксперимент проводят в течение двух дней, с 24-часовым интервалом, на крысах, которые имеют средний вес 170 г, которых за день до этого поместили в индивидуальные клетки со свободным доступом к еде и питью. В первый день каждую крысу помещали на 15 мин в стеклянный цилиндр (диаметр 20 см высота 40 см), наполненный на высоту 15 см водой при температуре 25 С. На второй день животных вновь помещали в цилиндр на период времени 5 мин; измеряли общий период неподвижности крысы (в секундах). Продукт или растворитель вводили животному за 3 мин перед началом эксперимента. Эффект- 13013406 продуктов статистически оценивали с помощью анализа отклонения при повторяемых измерениях, после чего осуществляли тест Даннетта для сравнения эффектов различных доз с эффектом носителя (дистиллированная вода). Результаты. В качестве примера и для иллюстрации активности продуктов в соответствии с изобретением эффекты продукта в соответствии с примером 2 приведены в следующей таблице. р 0,05 против носителя - с.о.с. = стандартная ошибка по отношению к среднему значению Продукт примера 2 уменьшает период неподвижности животного зависимым от дозы образом и,соответственно, демонстрирует отличный антидепрессантный эффект. Пример 12. Вращения, индуцированные допаминергическими агонистами, у крыс, которые имеют одностороннее повреждение черного вещества Substantia nigra). Принцип. Односторонняя инъекция нейротоксина 6-гидроксидопамина (6-OH-DA) в Substantia nigra вызывает дегенерацию восходящих нигростриарных путей с гиперчувствительностью к постсинаптическим допаминергическим рецепторам на той же, что и повреждение, стороне. У крысы, подвергшейся такому повреждению, систематическое введение непосредственно агонистических продуктов (апоморфина) индуцирует контралатеральные вращения (вращения в сторону, противоположную повреждению). Этот тест позволяет продемонстрировать агонистические допаминергические свойства продуктов, предназначенных для терапии болезни Паркинсона. Способы. Повреждение: повреждение осуществляют у самцов крыс Wistar с весом от 280 до 330 г, которых подвергали анестезии с использованием пентобарбитала (40-50 мг/кг, интраперитонеально) и которые получали дозу дезипрамина (25 г/кг, интраперитонеально). Животное помещали в KOPF стереотаксическое устройство с ориентацией черепа в соответствии с атласом Pellegrino и Cushman (1979). Медленно вводили объем 4 мкл раствора 6-OH-DA (2 мкг/мкл) при использовании устройства для микроперфузии в левую часть Substantia nigra, (A = 2,4 мм; L = 2,0 мм; V = 3,1 мм, относительно интераурального нуля) (U.Ungerstedt, Acta Physiol. Scandi. Suppl, 1971, 367, 69-93). Устройство: регистрацию меры и направления вращения осуществляли автоматически с помощью компьютера при использовании системы ROTACOUNT (Columbus Co, USA). Животное помещали в цилиндр с плоским дном, имеющий 30 см в диаметре и 50 см в высоту. Тонкий, полужесткий трос пропускали вокруг животного под передними лапами и соединяли с оптической камерой для подсчета, которая расположена выше цилиндра и соединена с компьютером. Отбор животных с повреждением: через месяц после индукции повреждения с помощью 6-OH-DA отбирали животных с правильно проведенным повреждением в соответствии с критерием, предусматривающим по крайней мере 150 контралатеральных вращений, осуществленных в течение 1 ч после введения допаминергического агониста апоморфина (0,04 мг/кг, подкожно). Экспериментальная процедура: животных тестировали один раз в неделю, продукты в соответствии с изобретением вводили попеременно с допаминергическим агонистом. Регистрация контралатеральных вращений начиналась от момента инъекции допаминергического агониста (Т 0) и продолжалась в течение 1 ч. Эффект продуктов статистически оценивали с помощью анализа отклонения при повторяемых измерениях, после чего осуществляли тест Даннетта для сравнения эффектов различных доз с эффектом носителя (дистиллированная вода). Результаты. В качестве примера приведенная ниже таблица показывает эффект продукта примера 2, который вводили подкожно. р 0,05 против носителя (n) = число крыс с.о.с. = стандартная ошибка по отношению к среднему значению- 14013406 Продукт примера 2 является активным в этом тесте от дозы, составляющей 0,0025 мг/кг. Пример 13. Анксиолитические свойства. Тест ультразвуковой вокализации у крыс. Принцип. Когда крысу помещают в обстановку, которая ранее ассоциировалась у нее с неприятным экспериментом (удары электрическим током по лапам), ее беспокойство проявляется в испускании неслышимых криков (или ультразвуковых вокализациях). Анксиолитическая активность продукта демонстрируется снижением длительности вокализаций. Устройство. Стандартные боксы (Coulbourn Instruments), помещенные в вентилируемые камеры, ослабляющие звук, оснащали полом, состоящим из электризующихся металлических блоков (генератор электрического удара и скремблер для расшифровки, Med Associates Inc.) и микрофоном, расположенным в центре потолка. Ультразвук конвертировали в звук слышимого диапазона (детектор летучих мышей, Buitenbedrijf). Сигналы, модифицированные таким образом, фильтровали, а потом обрабатывали (RTS программное обеспечение, Engineering Design). Полученные спектрограммы регистрировали на DAT лентах. Способ. Самцов крыс породы Wistar весом 180-200 г по их прибытию помещали в клетки по четыре со свободным доступом к корму и воде за пять дней до начала исследования и до его окончания. Используемую процедуру подразделяли на три последовательных этапа, разделенных 24-часовыми интервалами и называли их тренировка, отбор и тест. Во время тренировки животных помещали по одному в боксы, где они получали шесть ударов электрическим током (0,8 мА, 8 с), произвольным образом распределенных в течение периода времени 7 мин. Отбор включал помещение каждого животного в бокс на 2 мин, где они получали по одному удару, и возвращение их обратно в бокс через 30 мин для десятиминутного периода регистрации ультразвуковых вокализаций; тех животных, у которых вокализации длились менее чем 90 с, исключали из предстоящего эксперимента. Тестовая фаза осуществлялась подобным образом, что и стадия отбора, с продуктами или с носителем, которые дополнительно вводились в конце двухминутного периода. Эффект продуктов статистически оценивали с помощью анализа отклонения при повторяемых измерениях, после чего осуществляли тест Даннетта для сравнения эффектов различных доз с эффектом носителя (дистиллированная вода). Результаты. В качестве примера приведенная ниже таблица показывает эффекты продукта примера 2, который вводили подкожно в объеме 1 мл/кг. с.о.с: стандартная ошибка среднего значения - n: число крыср 0,05 против носителя При дозах 0,04 и 0,63 мг/кг продукт вызывал существенное снижение длительности вокализаций,что отражает его анксиолитическую активность. Пример 14. Фармацевтическая композиция. Формула для получения 1000 таблеток, каждая из которых содержит 10 мг активного ингредиента: в которых X представляет собой атом кислорода или группу NR2,- 15013406Y представляет собой группу, выбранную из -СН 2-, -(CH2)2- и -СН=СН-,R1 и R2, которые могут быть одинаковыми или различными, каждый, представляют собой атом водорода или группу, выбранную из линейного или разветвленного С 1-С 6 алкила, C3-С 8 циклоалкила и циклоалкилалкила, где алкильный остаток представляет собой C1-C6 и является линейным или разветвленным, а циклоалкильный остаток представляет собой C3-C8,в рацемической форме или в форме оптических изомеров,а также их соли присоединения фармацевтически приемлемой кислоты и их гидраты. 2. Соединения формулы I по п.1, в которых R1 представляет собой алкильную группу. 3. Соединения формулы I по п.1 или 2, в которых X представляет собой группу NR2. 4. Соединения формулы I по любому из пп.1-3, в которых Y представляет собой группу CH2. 5. Соединение формулы I по п.1, которое является выбранным из(4aRS,11bRS)-4-пропил-3,4,4 а,5,6,8,9,11b-октагидроизоиндол[5,6-h][1,4]бензоксазин-10(2H)-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;(4aR,11bR)-4-пропил-2,3,4,4 а,5,6,8,11b-октагидро-10H-фуро[3',4':6,7]нафто[1,2-b][1,4]оксазин-10 она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;(4aR,12bR)-4-пропил-3,4,4 а,5,6,8,9,12b-октагидро-2H,11H-пирано[4',3':6,7]нафто[1,2-b][1,4]оксазин 11-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты;(4aR,12bR)-4-пропил-2,3,4,4 а,5,6,8,9,10,12b-декагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-она, а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты и(4aR,12bR)-4-пропил-2,3,4,4 а,5,6,10,12b-октагидро-11H-изохино[6,7-h][1,4]бензоксазин-11-она,а также его энантиомеров и солей присоединения фармацевтически приемлемой кислоты. 6. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение в соответствии с любым из пп.1-5 в комбинации с одним или более инертными, нетоксическими, фармацевтически приемлемыми наполнителями или носителями. 7. Применение соединений формулы I в соответствии с п.1 в получении лекарственных средств для использования при лечении расстройств центральной нервной системы, которые вовлекают допаминергическую систему. 8. Применение соединений формулы I в соответствии с п.1 в получении лекарственных средств для использования при осуществлении нейропротективного воздействия или лечении болезни Паркинсона,гиперпролактинемии, половой дисфункции, депрессии, беспокойства, болезни Альцгеймера или других нейродегенеративных расстройств, таких как церебральные приступы. 9. Фармацевтическая композиция по п.6 для применения при лечении расстройств центральной нервной системы, которые вовлекают допаминергическую систему. 10. Фармацевтическая композиция по п.6 для применения при осуществлении нейропротективного воздействия или лечении болезни Паркинсона, гиперпролактинемии, половой дисфункции, депрессии,беспокойства, болезни Альцгеймера или других нейродегенеративных расстройств, таких как церебральные приступы.
МПК / Метки
МПК: A61K 31/5383, A61P 15/00, A61P 25/16, C07D 498/04, A61P 25/28
Метки: тетрациклические, соединения, способ, получения, фармацевтические, композиции, содержащие
Код ссылки
<a href="https://eas.patents.su/17-13406-tetraciklicheskie-soedineniya-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрациклические соединения, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Состав аэрозоля для дозирующих ингаляторов под давлением
Следующий патент: Отделение загрязнений от полиэфирных материалов
Случайный патент: Позиционирующее устройство и устройство для горячей обработки заготовки, содержащее это позиционирующее устройство












