Способ одновременного выявления и идентификации антибиотиков различных классов in vitro и соответствующий диагностический набор
Формула / Реферат
1. Диагностический набор для одновременного определения антибиотиков различных классов, по меньшей мере, b-лактамов и тетрациклинов, отличающийся тем, что он включает
во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор, специфически распознающий b-лактамы, второй рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, причем оба рецептора предпочтительно являются мечеными частицами коллоидного золота либо напрямую, либо с помощью антитела или антитела в сочетании с белком А;
во-вторых, регенерационную систему в виде твёрдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплены антибиотик с b-лактамным ядром и авидин, в указанном порядке или наоборот;
таким образом, чтобы интенсивность метки, выявляемая в регенерационной системе в обеих тестовых зонах независимо, являлась бы результатом конкурентного распознания каждого антибиотика своим меченым рецептором.
2. Диагностический набор по п.1, отличающийся тем, что антибиотик с b-лактамным ядром и авидин, закреплённый на нитроцеллюлозной мембране, представляют собой, соответственно, пенициллин или цефалоспорин, предпочтительно ампициллин, имобилизованный на b-лактоглобулине, и авидин яичного белка.
3. Диагностический набор для одновременного определения антибиотиков различных классов, по меньшей мере, b-лактамов и сульфамидов, отличающийся тем, что он включает
во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор, специфически распознающий b-лактамы, меченый напрямую или не напрямую предпочтительно частицами коллоидного золота; биотинилированные антитела против сульфамидов и аналог сульфамида, меченый напрямую или не напрямую коллоидным золотом;
во-вторых, регенерационную систему в виде твёрдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплены антибиотик с b-лактамным ядром и авидин, в указанном порядке или наоборот;
таким образом, чтобы интенсивность метки, выявляемая на регенерационной системе в обеих тестовых зонах независимо, являлась бы результатом конкурентного распознания каждого антибиотика.
4. Диагностический набор для одновременного определения анализируемых веществ, соответствующих антибиотикам различных классов, по меньшей мере, тетрациклинов и сульфамидов, отличающийся тем, что он включает
во-первых, единственную реакционную смесь, включающую, по меньшей мере, рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, где рецептор является меченым предпочтительно частицами коллоидного золота, напрямую или не напрямую с помощью антитела, а также антитело против сульфамида и аналог сульфамида, меченый либо напрямую, либо не напрямую предпочтительно коллоидным золотом;
во-вторых, регенерационную систему в виде твёрдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплено соответственно антитело, специфически направленное либо против рецептора тетрациклина, либо против специфического антитела против рецептора тетрациклина, и антитело, специфически направленное против антитела к сульфамиду, в указанном порядке или наоборот.
5. Диагностический набор по любому из пп.1-4, отличающийся тем, что специфические антитела против рецепторов, добавляемые в реакционную смесь, являются либо моноклональными, либо поликлональными антителами, модифицированными или немодифицированными химически или рекомбинантно, очищенными или неочищенными, конъюгированными или неконъюгированными напрямую или не напрямую с мечеными частицами, предпочтительно с частицами коллоидного золота.
6. Диагностический набор по любому из пп.1-5, отличающийся тем, что нитроцеллюлозная мембрана, нанесённая на подложку диагностической полоски, одним концом соприкасается с мембраной, а другим концом с впитывающей бумагой и имеет две различные тестовые зоны, одну за другой в направлении движения жидкости, и контрольную зону, которая может разделять две тестовые зоны.
7. Диагностический набор по п.6, отличающийся тем, что контрольная зона получена с помощью какого-либо белкового препарата, меченого предпочтительно частицами коллоидного золота, более предпочтительно с помощью бычьего сывороточного альбумина (БСА), конъюгированного с частицами коллоидного золота.
8. Диагностический набор для одновременного определения b-лактамов, тетрациклинов и сульфамидов по п.1 или 2, отличающийся тем, что реакционная смесь также содержит специфическое антитело, распознающее сульфамиды, меченое предпочтительно частицами коллоидного золота, напрямую или не напрямую; и тем, что регенерационная система дополнительно включает препарат белка, конъюгированного с сульфамидами, иммобилизованный на нитроцеллюлозной мембране.
9. Диагностический набор для одновременного определения b-лактамов, тетрациклинов и сульфамидов по п.8, отличающийся тем, что нитроцеллюлозная мембрана, нанесённая на подложку диагностической полоски, одним концом соприкасается с мембраной, а другим концом с впитывающей бумагой и несёт три различные тестовые зоны и контрольную зону, расположенные последовательно одна за другой по направлению движения жидкости, или две контрольные зоны, каждая из которых альтернативно расположена между двумя тестовыми зонами.
10. Диагностический набор для одновременного определения анализируемых веществ, соответствующих антибиотикам различных классов, по меньшей мере, b-лактамов, тетрациклинов и сульфамидов, отличающийся тем, что он включает
во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор, специфически распознающий b-лактамы, второй рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, при этом оба рецептора предпочтительно являются мечеными частицами коллоидного золота, либо напрямую, либо не напрямую с помощью антитела, либо антитела в сочетании с белком А, или антитела против сульфамида, а также аналог свободного сульфамида, меченый напрямую или не напрямую коллоидным золотом;
во-вторых, регенерационную систему в виде твёрдой подложки, включающую нитроцеллюлозную мембрану, на которой в трёх известных и различных участках закреплены, соответственно, антибиотик с b-лактамным ядром, авидин и антитело, направленное против антитела к сульфамиду;
таким образом, чтобы интенсивность метки, выявляемая на регенерационной системе независимо в трёх тестовых зонах, являлась бы результатом конкурентного распознания каждого антибиотика.
11. Диагностический набор по любому из пп.1-10, отличающийся тем, что проба является, по существу, жидкой, и ее получают из молока, мёда, мяса, яиц или биологических жидкостей.
12. Диагностический набор по любому из пп.1-11, отличающийся тем, что рецепторы, использующиеся для определения b-лактамов или тетрациклинов, представляют собой, соответственно, рецепторы BlaR и TetR, выделенные из известных классов микроорганизмов, предпочтительно из Staphylococcus aureus для BlaR и из плазмиды pSClOl E. coli 600 для TetR соответственно.
13. Способ применения диагностического набора по любому из пп.1-12, отличающийся тем, что он включает следующие стадии:
вышеупомянутую реакционную смесь приводят в контакт с пробой, которую требуется классифицировать, с получением раствора, который выдерживают при температуре от 30 до 50шС в течение от 3 до 15 мин;
диагностическую полоску, несущую вышеупомянутую регенерационную систему, погружают в полученный раствор и выдерживают в течение от 3 до 15 мин;
результат, полученный на диагностической полоске, оценивают либо визуально, либо при помощи оптического устройства, считывающего изображение с полосок.
Текст
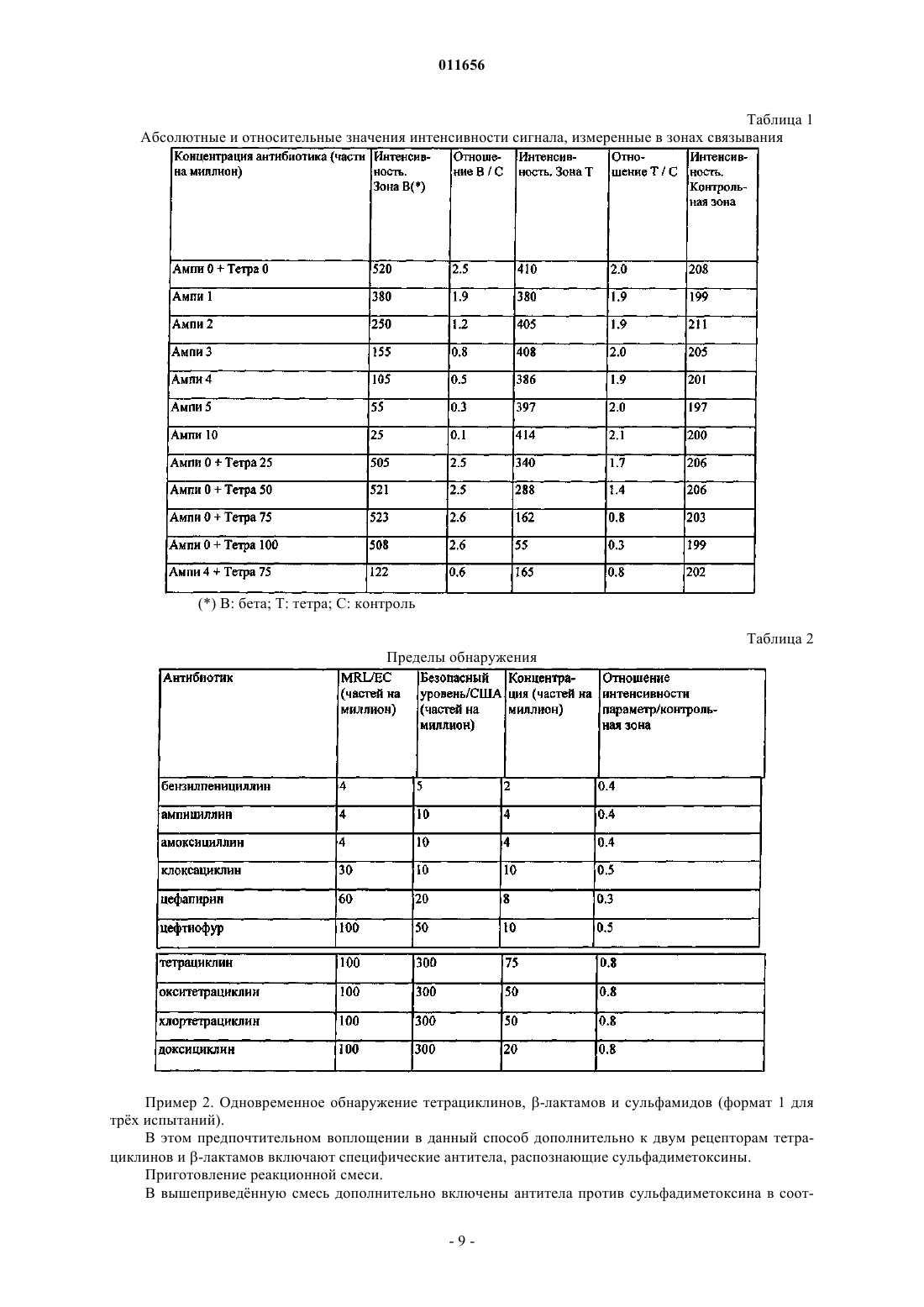
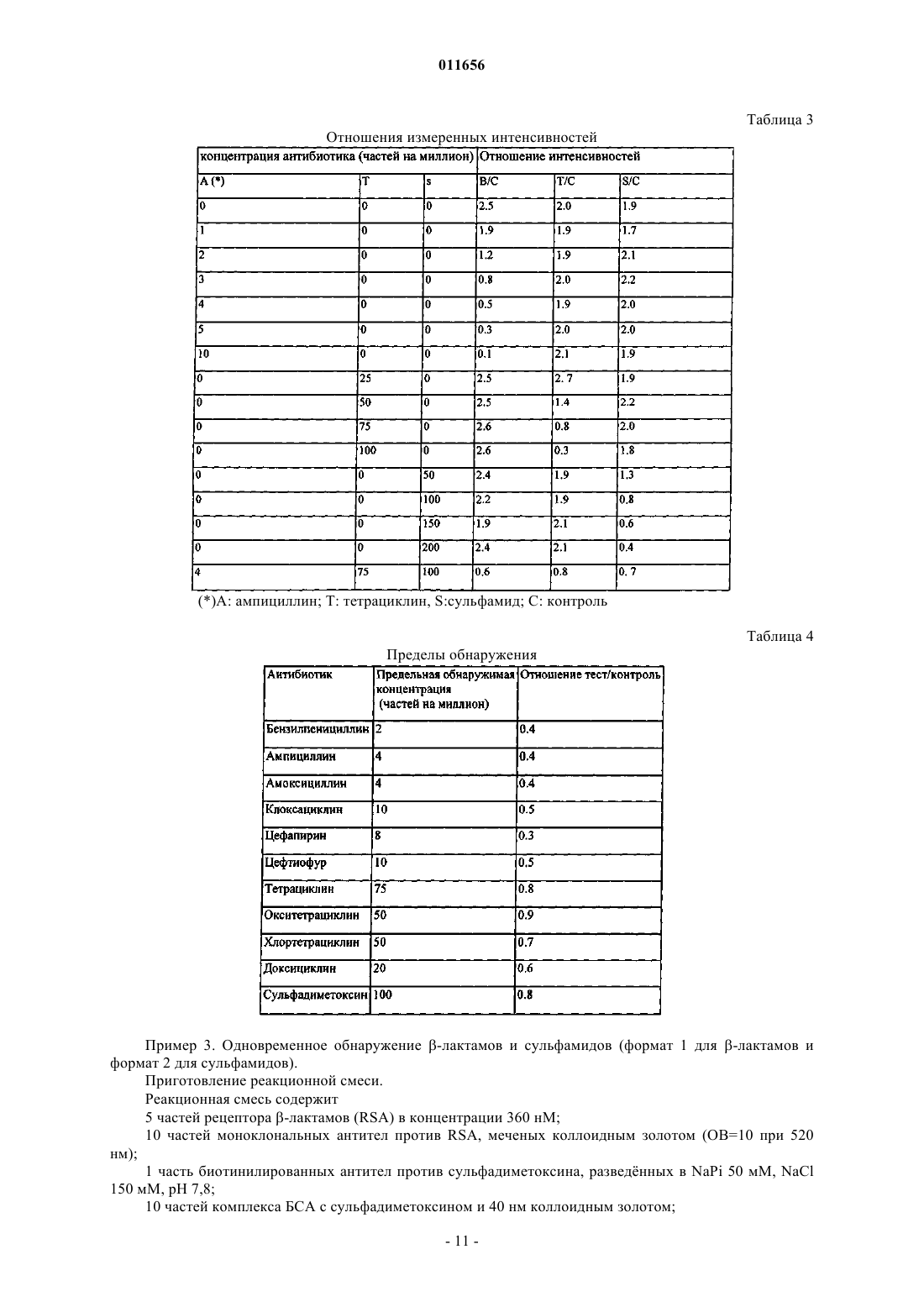
011656 Область изобретения Настоящее изобретение относится к способу, вызывающему в коллекции различных биологических распознающих молекул, способных специфически выявлять некоторые анализируемые вещества с высокой чувствительностью, одновременную реакцию в одной реакционной смеси, а также распознавание класса анализируемых веществ, к которому принадлежит каждое из выявляемых соединений, при условии, что принцип распознания, специфичный для одного данного класса анализируемых веществ, не создает помех принципу распознавания, специфичному для другого класса анализируемых веществ. Настоящее изобретение также относится к диагностическому набору, специально разработанному для осуществления указанного способа. Предпосылки изобретения Фундаментальный принцип, лежащий в основе надлежащего контроля над пищевой цепью, предписывает проводить контрольные тесты на возможно более ранних стадиях производства, чтобы как можно скорее выявить и отбраковать пищевые продукты, которые могут оказаться загрязненными. Как правило, при осуществлении выявляющих тестов, часто называемых скрининговые тесты,проба, определнная как положительная по итогам первого пробного анализа, только предполагается положительной и должна обязательно пройти второй тест, называемый подтверждающим. В противном случае, если первоначальный скрининговый тест дат отрицательный ответ, этого достаточно, и не нужно проводить никакого дополнительного анализа для подтверждения отрицательного ответа(1). Первым следствием такой практики является то, что первый способ скрининга должен обеспечивать выявление возможно большего количества соединений. Следовательно, скрининговые тесты, предпочтительным и логичным образом должны быть тестами на несколько анализируемых веществ. Другим следствием из этого правила является то, что важным оказывается знать класс, к которому принадлежит соединение, обнаруженное в положительной пробе на этапе скринингового теста, для того,чтобы иметь возможность точно выбрать способ подтверждения, который, как правило, является весьма узкоспецифичным, поскольку для подтверждения рекомендуется выделить и распознать соответствующее соединение. Третьим следствием из этого правила является то, что скрининговый тест не может давать "ложноотрицательных" результатов, поскольку такие результаты затем избегнут анализа на данной предварительной стадии и не подтвердятся в дальнейшем. В настоящее время известны различные способы выявления антибиотиков: микробиологические тесты, в которых измеряется подавляющее действие пробы на рост штамма бактерий. Тесты такого типа требуют сравнительно длительного времени инкубации (от 3 до 16 ч) перед получением результата. В целом, такие тестовые системы (Delvotest SP, BRT Test, Copan, Eclipse,Valio) обладают способностью распознавать несколько классов антибиотиков одновременно, поскольку используемые в них штаммы бактерий часто чувствительны ко многим соединениям различных классов. В то же время, тесты такого типа не позволяют выяснить, к какому именно классу принадлежит выявляемый антибиотик; тесты in vitro для выявления низкомолекулярных соединений, основаны на принципе конкуренции между искомым соединением, присутствующим в пробе, и меченым конкурентом, намеренно вносимым в пробу, за один и тот же участок распознавания, который может представлять собой рецептор или молекулу антитела. В тестовых системах типа ELISA (Enzyme Linked Iiamuno Sorbent Assay - твердофазный иммуноферментный анализ) или RIA (Radio Immuno Assay - радиоиммунный анализ)/RRA (Radio Receptor Assay - радиорецепторный анализ) время, необходимое для анализа, составляет от 2 до 6 ч. Некоторые из этих способов, например лабораторные способы с использованием RRA, позволяют одновременно выявлять несколько соединений различных классов. Однако таким способом нельзя определить, к какому классу относится соединение, давшее положительный ответ; более сложные физико-химические способы, позволяющие выделить и распознать искомое соединение, с недавнего времени представляют собой, главным образом, способы, в которых система хроматографического разделения сопряжена с масс-спектрометрической системой регистрации (GC/MS - GaseChromatography/Mass Spectrometry (газовая хроматография/массовая спектрометрия. Эти способы требуют в каждом случае выбора особого режима работы для распознания конкретных различных соединений. В некоторых случаях таким способом можно выявлять одно соединение или одновременно несколько соединений одного и того же класса, иногда можно даже выявлять все соединения какого-либо одного класса, но это неприменимо к соединениям, принадлежащим к различным классам. Фактически, принцип хроматографического разделения зависит от физико-химических свойств данного соединения, которые различны у соединений различных классов. В случае если исследователю неизвестен тип соединения,которое нужно выявить, ему приходится опробовать столько методик, сколько существует классов соединений. В течение последних лет появились более быстрые способы. Эти способы, известные как экспресстесты ("rapid tests"), используют для быстрого скрининга большого числа проб. Обыкновенно эти спосо-1 011656 бы основаны на распознавании исследуемых соединений биологическими молекулами по конкурентному принципу. Чтобы способ был быстрым и практичным, тестовые системы такого типа работают при помощи мембранных устройств с радиальным растеканием (Tetrasensor, SNAP, Beta-STAR, ROSA). Такие тестовые системы классифицируют в зависимости от различных вариантов антибиотиков, однако,в настоящее время не известно систем, позволяющих за одну операцию распознать соединения, принадлежащие к различным классам. Если целесообразно планировать и применять первичный скининг в сельскохозяйственном и продовольственном секторе, то в данном секторе требуется проведение как можно более полного анализа, с помощью которого предпочтительно можно было бы распознать возможно большее количество предполагаемых соединений. Действительно, практичнее и экономичнее провести один поливалентный тест на одном образце, нежели выявлять каждое отдельное соединение при помощи отдельного теста. Такая практика требует значительных затрат времени, требует большой работы с образцами и связана с большими денежными затратами. Это является препятствием эффективному контролю продуктов питания. Таким образом, на этой стадии имеют место существенные ограничения эффективности проверки,вызванные отсутствием поливалентных тестовых систем, которые позволяли бы за одну операцию и, к примеру, меньше, чем за 10 мин, выявить совокупность соединений, принадлежащих к различным классам. В частности, сельскохозяйственный и продовольственный сектор заинтересован в новом способе,позволяющем в ходе одной аналитической операции выявить соединения, принадлежащие по меньшей мере к двум различным классам антибиотиков. Типы антибиотиков, которые могут вводить животным, могут быть различными в зависимости от того, с профилактической или с лечебной целью их вводят; от вида животных, от патогена, против которого они направлены; от ветеринарной практики, действующего законодательства, доступных средств, и даже от географического положения. В некоторых специфических случаях лечения животных применяют смеси лекарств. Как правило, ветеринаром используются антибиотические средства, которые выбираются из всей совокупности соединений, доступных в продаже, из соображений наибольшей эффективности. Основными используемыми классами антибиотиков и противобактериальных средств являются пенициллины и цефалоспорины, тетрациклины, сульфамиды, аминогликозиды и аминоциклитолы, макролиды, хлорамфениколы или другие пептиды, ионофоры, нитрофураны, хинолоны, карбадокс и др. Все эти классы составляют весьма широкую совокупность различных в химическом отношении соединений. Полагается, что в некоторых случаях интенсивное использование антибиотиков в ветеринарной практике и растениеводстве может быть причиной возникновения бактериальных штаммов, ставших устойчивыми к антибиотикам. С целью охраны человеческого здоровья и законодательного регулирования данной области многие страны (Европейский Союз, США, Канада и др.) установили максимальные значения остаточного содержания (MRL - maximum residue level) антибиотиков в пищевых продуктах(2). Эти значения MRL служат своего рода границей между положительной и отрицательной пробами, иными словами, между приемлемой пробой и пробой, которая подлежит отбраковке. С другой стороны, решение Комиссии от 12 августа 2002 г. устанавливает пределы минимального приемлемого разрешения применительно к способам анализа, используемым для изучения проб, и определяет общие критерии оценки результатов(3). Очевидно, что для скрининга в соответствии с Директивой 96/23/ЕС должны применяться только такие аналитические методы, для которых на основании достоверных данных можно доказать, что они являются достоверными, и что частота возникновения ошибок в них составляет менее 5% на рассматриваемом уровне значений. В 1995 г. в среднем 1% всех проб, проверенных на содержание в них антибиотиков, в количествах,превосходящих MRL, давали положительный ответ. В тех случаях, когда эти положительные результаты подтверждались, чаще всего обнаруживали такие вещества, как пенициллины и тетрациклины(4). Уровень техники Система обнаружения тетрациклина описана в поданной настоящим заявителем заявке WO-A03/048770, озаглавленной "Способ осуществления диагностики in vitro при помощи механизмов генетической регуляции и соответствующий диагностический набор" ("Procede pour effectuer un diagnostic invitro au moyen de mecanismes de regulation genetique et trousse de diagnostic correspondante"). Этот способ позволяет выявлять только тетрациклины. В предпочтительном составе реагенты включают рецепторtetR, выделенный из механизма генетической регуляции E.coli, для устойчивости к тетрациклину; антитела, способные распознавать этот рецептор, и препарат белка А, конъюгированного с коллоидными частицами золота. Помимо этого, регенерационная система включает биотинилированный специфический фрагмент ДНК, который может быть иммобилизован на молекуле авидина, закреплнной на нитроцеллюлозной мембране. В ходе инкубации в присутствии испытуемой пробы взаимодействие рецептора и фрагмента ДНК происходит только при отсутствии тетрациклина. В этом случае фрагмент ДНК образует комплекс с рецептором, и частицы золота, прикрепленные к рецептору, образуют сигнал. В противном случае рецептор, предварительно распознавший молекулу тетрациклина, становится неспособен связы-2 011656 ваться с фрагментом ДНК, вследствие чего сигнал не появляется. Система выявления -лактамов описана в патенте WO-A-99/67416, озаглавленном "Способ определения антибиотиков с -лактамным ядром в биологической жидкости" ("Procede pour la determinationd'antibiotiques a noyaux -lactame dans un liquide biologique"). Этим способом можно выявлять только лактамы. В качестве предпочтительного состава изобретатели описывают, во-первых, изолированный рецептор Bacillus licheniformis, очищенный и химически связанный с молекулами биотина, ассоциированный с препаратом антител против биотина, конъюгированных с коллоидными частицами золота и, вовторых, конъюгат цефалоспорина с человеческим иммуноглобулином, закреплнным на нитроцеллюлозной мембране. В случае, если проба не содержит -лактама, рецептор прикрепляется к антибиотику, иммобилизованному на мембране, и частицы золота, закрепляясь на комплексе рецептор-биотин с помощью антител против биотина, связанных с золотом, образуют сигнал, который детектируют. В противном случае, если рецептор ингибируется в ходе предварительной инкубации с испытуемой пробой, он теряет способность связываться с иммобилизованным антибиотиком, вследствие чего сигнал не появляется. Известна также система быстрого распознавания сульфамидов, описанная Р. Верхейен и др. (5) под заглавием "Разработка одностадийного теста в форме полоски для выявления остатков сульфадимидина"("Development of a one step strip test for the detection of sulfadimidine residues"). В этой системе используется принцип, сходный с тем, что описан выше для выявления -лактамов. С одной стороны, специфические антитела к сульфадимидинам конъюгированы с коллоидными частицами золота, с другой стороны,сульфадимидин конъюгирован с альбумином яичного белка и закреплн на нитроцеллюлозной мембране. Если проба содержит сульфадимидины, распознаваемые антителами, образуется комплекс, неспособный в дальнейшем связаться с иммобилизованным антигеном. В противном случае, в отсутствие сульфадимидина в пробе, конъюгированные антитела могут распознавать иммобилизованный сульфадимидин,и появляется цветной сигнал. Цитируемая статья не указывает, насколько такая тестовая система избирательна. Все быстрые способы и способы использования радиального растекания, известные сегодня, применяются лишь для выявления одного единственного класса соединений, и в настоящее время не существует способа, позволяющего выявить за одну единственную операцию все соединения, принадлежащие хотя бы к двум различным классам антибиотиков. Основными причинами этого являются техническая невозможность включить в один и тот же способ независимым образом и без взаимодействия друг с другом все реагенты, необходимые для выявления каждого из классов. Другая трудность заключается в осуществлении распознавания класса, к которому относится выявленное соединение. Вкратце, известные системы быстрого выявления низкомолекулярных соединений (молекулярная масса 2000) действуют на основе принципа конкуренции, который требует использования двух элементов: во-первых, молекулы, которая могла бы специфически распознать искомое соединение, которая представляет собой обычно бактериальный рецептор или иммуноглобулин (молекулу антител); а вовторых, конкурента за участок связывания. В зависимости от выбранного способа, один из элементов закрепляют на подложке, а другой элемент является меченым. В некоторых случаях (формат 1, см. ниже) метят именно распознающую молекулу, а иммобилизуют аналог анализируемого вещества; в других же случаях (формат 2, см. ниже) метят аналог анализируемого вещества, а распознающая молекула связана с нерастворимой фракцией. Оригинальность системы выявления тетрациклинов состоит в том, что на рецепторе имеется два независимых участка распознавания, вследствие чего конкурент является не аналогом искомого вещества,а фрагментом ДНК, способным связываться с другим участком распознавания того же самого рецептора. Во всех способах, называемых экспресс-анализами ("RAPID TESTS"), оценку осуществляют посредством сравнения интенсивности сигнала, полученного в "тестовой" зоне, то есть там, где иммобилизован регенерационный элемент активного рецептора, с интенсивностью сигнала, полученного в контрольной зоне, то есть там, где связаны другие реагенты (или избыток реагентов). Как правило, в случае,если интенсивность сигнала в тестовой зоне более выражена, чем в контрольной зоне, результат является отрицательным в отношении искомого вещества. Во всех случаях, связанных с анализом -лактамов, распознающую молекулу получают из Bacillus,и во всех случаях эту молекулу метят после очистки. Для осуществления такого мечения следует химически модифицировать поверхность. Например, она может быть химически связана с ферментом, как,например, в случае с рецептором Bacillus stearothermophillus, связанным с пероксидазой (ЕР-А-0593112 и(WO-A-99/67416 и US-A-6524804), или же с рецептором Bacillus stearothermophillus, непосредственно конъюгированным с коллоидным золотом (US-A-6475805). За исключением методики Tetrasensor, в остальных известных на сегодня случаях необходимо химически модифицировать распознающую молекулу для получения окрашенного комплекса. Для этого распознающую молекулу необходимо выделить в чистом виде и затем модифицировать некоторые из заместителей на е поверхности, рискуя при этом нежелательным образом изменить и такие важные свойства, как функциональность или устойчивость.-3 011656 Таким образом, в большинстве известных на сегодня случаев, как правило, невозможно работать с неочищенными экстрактами, либо с рецепторами, не модифицированными химически. В то же время, тип мечения, который используют при анализе "тетрациклина", не совместим с анализом -лактамов, поскольку в последнем случае во всех известных методиках в "контрольной" зоне иммобилизуется иммуноглобулин. В документе WO-99/67416 белком для заякоривания конкурента в "тестовой" зоне также служит иммуноглобулин. Применение белка А, как при анализе тетрациклинов, неизбежно вызвало бы неспецифическое окрашивание одной или обеих линий связывания, необходимых для выявления -лактамов. Во-вторых, если нужно прибегнуть к использованию комбинации авидин-биотин для облегчения закрепления на подложке либо мечения, такая комбинация авидин-биотин может использоваться в данном конкретном методе для одного специфического распознавания. В самом деле, если авидин представляет собой точку прикрепления, то все биотинилированные молекулы смогут на нм закрепиться. В этом случае, разумеется, невозможно создать испытательную систему для совместного обнаружения лактамов и тетрациклинов, на основе, например, объединения аналитических принципов, описанных в документах WO-A-99/67416 и WO-A-03/048770. В самом деле, в первом случае рецептор биотинилирован, и затем его метит конъюгат антител против биотина с золотом, а во втором случае авидин иммобилизован для захвата биотинилированного фрагмента ДНК. Объединение этих двух принципов приведт и к конфликту между двумя независимыми системами, в которых применяются комбинации авидинбиотин. При объединении двух существующих систем биотинилированный рецептор системы определения -лактамов закрепился бы на авидине, необходимом для выделения ДНК из тетрациклиновой системы и, как следствие, явился бы причиной неспецифического мечения, независимого от содержания в пробе тетрациклина. Сверх того, присутствие в подвижной фазе комплекса антител против биотина с золотом препятствовало бы биотинилированной ДНК связываться с авидином, необходимым для е захвата, что привело бы к дополнительному конфликту. В-третьих, объединение двух независимых систем потребовало бы довольно сложной системы регистрации и оценки результата, где бы каждая из меток оценивалась бы на основе отношения интенсивности метки к интенсивности внутреннего контроля. Соответственно, при этом должны присутствовать две тестовые полосы ("бета" и "тетра") и две "контрольные" полосы. Такая аналитическая методика непроста и непрактична. При объединении двух тестовых систем было бы удобнее оценивать интенсивность каждого ответа путм сравнения между собой. В таком случае "тестовая зона" для анализируемого вещества 1 стала бы "контрольной" зоной для анализируемого вещества 2 и наоборот. В том случае,если бы оба класса анализируемых веществ одновременно присутствовали в одной и той же пробе, при таком подходе система не давала бы вообще или почти не давала бы сигнала. Такое встречается редко,однако, если встречается, то во избежание затруднения в оценке результата при двойном загрязнении как-лактамами, так и тетрациклинами, следовало бы предусмотреть дополнительный контроль в виде одной единственной контрольной линии, позволяющей проще определять относительную интенсивность обоих тестовых сигналов. Очевидно, что эта контрольная линия становится необходимой в том случае,если один и тот же аналитический способ объединяет более двух тестовых систем. В-четвертых, материалы, специально и предпочтительно выбранные для того, чтобы формировать из них диагностическую полоску диагностического набора, должны быть совместимы с проведением одновременного анализа двух классов веществ. В самом деле, в предпочтительном варианте осуществления, описанном в WO 99/67416, рекомендуется использовать мембрану типа "Leukosorb", которая несовместима с подходом, который предлагают авторы изобретения для выявления тетрациклинов, что не соответствует нуждам поливалентного анализа. В самом деле, что весьма странно, в составе, где оба рецептора выявляются при помощи соответствующих антител, невозможно получить точной границы раздела при добавлении -лактамов, поскольку реагенты встречаются с мембраной Leukosorb, прежде чем достигнут участка связывания. Эта мембрана, эффективность которой показана для очистки молока и при использовании в тестовых системах с радиальным растеканием, является причиной неспецифических ответов, когда выявление анализируемых веществ производится при помощи антител и белка А,меченого коллоидным золотом. В-пятых, важен выбор рецепторов, использующихся для распознавания совокупности соединений каждого из классов. Этот выбор определяется не только из соображений распознания соединений, но и из соображений устойчивости, структуры, антигенной реактивности, аминокислотного состава и т.п. Итак, априори представляется невозможным, исходя из известных способов, объединить в одном способе две или более независимых тестовых системы, например, для выявления при помощи рецепторов -лактамов и тетрациклина, не сталкиваясь с необходимостью существенных изменений, позволяющих объединить все необходимые элементы, при том, чтобы система обнаружения одного соединения не влияла бы нежелательным образом на систему выявления другого соединения. Цели изобретения Целью настоящего изобретения является создание нового диагностического способа, позволяющего одновременно выявлять совокупность, теоретически неограниченную, соединений, которые могут при-4 011656 надлежать по меньшей мере к двум различным классам веществ, и определять класс, к которому принадлежит выявленное соединение. В частности, целью настоящего изобретения является демонстрация технической и практической возможности объединения в рамках одного способа по меньшей мере двух разных механизмов детекции так, чтобы при этом работа какого-либо из этих механизмов не влияла бы нежелательным образом на работу другого механизма. Дополнительной целью настоящего изобретения является демонстрация технической осуществимости поливалентного анализа, который мог бы осуществляться быстро, например менее чем за 30 мин, в одну стадию и с помощью одной пробы. Дополнительной целью настоящего изобретения является создание способа и набора для диагностики in vitro, служащих одновременно для выявления и количественного определения по меньшей мере двух классов анализируемых веществ. Основные признаки изобретения Первая цель настоящего изобретения, согласно пп.1, 3, 4 и 10 формулы изобретения, относится к диагностическому набору для одновременного и специфического выявления или количественного определения по меньшей мере двух анализируемых веществ, принадлежащих к различным классам антибиотиков, а именно по меньшей мере к двум классам, выбранным из -лактамов, тетрациклинов и сульфамидов, отличающемуся тем, что он в общем случае включает, например,во-первых, единственную реакционную смесь предпочтительно в виде раствора или лиофилизата,содержащую по меньшей мере две различные биологические молекулы, каждая из которых способна распознать, соответственно, одновременно и специфично, конкретное анализируемое вещество, присутствующее в пробе, которая может содержать вещества, принадлежащие к вышеупомянутым различным классам; и, во-вторых, регенерационную систему в виде единственной тврдой подложки, на которой в различных известных положениях в пространстве закреплены соответствующие лиганды, способные специфически, избирательно и исключительно регенерировать каждую из названных разновидностей биологических молекул, содержащихся в названной реакционной смеси, так, чтобы по месту закрепления последних на указаной подложке можно было бы определить класс, к которому принадлежит каждое из анализируемых веществ, присутствующих в пробе. В каждом конкретном случае либо иммобилизированный регенерационный элемент является конкурентным аналогом выявляемого вещества, а рецептор, находящийся в растворе, является меченым,либо конкурентный аналог, находящийся в растворе, является меченым, а иммобилизованным регенерационным элементом является рецептор. Согласно настоящему изобретению также могут сосуществовать смешанные системы. Предпочтительные варианты осуществления настоящего изобретения описаны в зависимых пп.2, 59 и 11-12. Другая цель изобретения, согласно в п.13 формулы изобретения, относится к способу применения диагностического набора, соответствующего любому из пп.1-12, отличающемуся наличием следующих этапов: вышеупомянутую реакционную смесь приводят в контакт с пробой, которую требуется классифицировать, с получением раствора, который выдерживают при температуре от 30 до 50 С в течение от 3 до 15 мин; в полученный раствор погружают диагностическую полоску, несущую вышеупомянутую регенерационную систему, и выдерживают в течение от 3 до 15 мин; результат, полученный на диагностической полоске, оценивают либо визуально, либо при помощи оптического устройства, считывающего изображение с полосок. В предпочтительных воплощениях настоящего изобретения рекомендуется избегать, с одной стороны, очистки, а с другой стороны, химической модификации рецептора, например, путем использования антител против рецептора, меченых либо непосредственно коллоидным золотом, либо предпочтительно белком А, конъюгированным с коллоидным золотом. С другой стороны, в рамках концепции множественности выявляемых веществ, белок А, меченый коллоидным золотом, мог бы служить общей меткой для всех антител, внеснных в раствор. Одним из принципов, применяемых с целью наилучшего сохранения функциональных возможностей рецепторов и антител, используемых в настоящем изобретении, является то, что мечения посредством химических модификаций не происходит. Следовательно, настоящее изобретение задействует бактериальные рецепторы в их возможно более естественном состоянии. Эти рецепторы метят при помощи антител, которые, в свою очередь, распознаются белком А, конъюгированным с коллоидным золотом. В таком случае, исключительно маркирующий белок является связанным с золотом, а не чувствительные молекулы, служащие для распознавания анализируемых веществ. При таком подходе сохраняются все функциональные группировки чувствительных распознающих молекул. Это преимущество используется в полном объеме, когда требуется задействовать активность рецепторов, механизм распознавания которых зависит от некоторых боковых цепей, таких, например,-5 011656 как остатки лизина. Это тем более важно, что когда имеет место химическая модификация, эта модифкация в большинстве описанных случаев затрагивает группы NH3+ боковых цепей лизина. Следовательно,химическая сшивка по лизину может вывести из строя остатки лизина в активном центре и, таким образом, частично инактивировать препарат. Мечение с помощью антител характеризуется гибкостью нефиксированного мечения. В самом деле,химическое мечение задействует необратимую ковалентную связь, тогда как прикрепление антител является обратимым и находится в равновесии, которое может быть смещено под влиянием действующих на него сил. Другим преимуществом является возможность видоизменять этап мечения на второй стадии. В самом деле, только после фазы распознания анализируемого вещества рецептором, будь то свободное анализируемое вещество в составе пробы или вещество, иммобилизованное для регенерации, рецептор распознатся антителами. Исходя из различных соображений, связанных с ценой и стабильностью, а также по причине совершенной интеграции в поливалентную тестовую систему, согласно настоящему изобретением предпочтительно рекомендуется использование рецептора р-лактамов, выделенного из Staphylococcusaureus(6). В самом деле, этот рецептор, происходящий из бактериального штамма, наиболее эффективного в отношении борьбы с антибиотиками и, в частности, с -лактамами, будучи испытан in vitro, проявил исключительные свойства в отношении распознавания всех -лактамов, как пенициллинов, так и цефалоспоринов (см. ссылку(6) и результаты, приведнные в примере). Другое преимущество этого рецептора состоит в том, что он имеет щелочную изоэлектрическую точку (pI). Это дат возможность легко выделить его в чистом виде из неочищенного клеточного экстракта для получения антител к нему. К тому же выбор авторов настоящего изобретения был обусловлен и очень хорошим иммунным ответом у кролика, который был весьма специфичным и не вызывал какого-либо неспецифического ответа в присутствии остальных реагентов, используемых в поливалентном анализе. В соответствии с настоящим изобретением был успешно разработан способ, при котором возможно объединить в одну операцию все элементы, необходимые для совместного выявления множества соединений различных классов с применением совершенно разных механизмов распознания. Настоящее изобретение дополнительно обладает тем преимуществом, что предлагает достоверную и экономичную поливалентную тестовую систему. В самом деле, отсутствует необходимость очистки рецепторов или препаратов антител, помимо этого рецепторы не подвергаются химическим модификациям, что должно приводить к сохранению их реакционной способности, а также их стабильности. Краткое описание фигур На фиг. 1 схематически представлен пример расположения регенерационных элементов, соответствующих настоящему изобретению, на тврдой нитроцеллюлозной подложке в случае одновременного анализа только двух антибиотиков, при котором также присутствует иммобилизованная контрольная зона. На фиг. 2 схематически представлен пример расположения регенерационных элементов, соответствующих настоящему изобретению, на тврдой нитроцеллюлозной подложке в случае одновременного анализа тетрациклинов, -лактамов и сульфамидов, при котором также присутствует иммобилизованная контрольная зона. Описание предпочтительных воплощений изобретения Предварительное замечание. Как отмечено в "Уровне техники", конкурентная тестовая система, предлагаемая в соответствии с настоящим изобретением, может, в частности, быть представлена в двух различных форматах. В первом случае (формат 1) с коллоидными частицами золота конъюгированы рецепторы, а соединенияконкуренты, аналоги искомого вещества, выступают в качестве регенерационного элемента, будучи иммобилизоваными в зоне специфического связывания. В другом случае (формат 2) с коллоидными частицами золота конъюгированы соединения-конкуренты, аналоги искомого вещества, в качестве регенерационного элемента выступают рецепторы, являясь иммобилизованными в зоне специфического связывания. В некоторых случаях поливалентного анализа система может быть и смешанной (присутствуют формат 1 и формат 2). Пример 1. Одновременный анализ тетрациклинов и -лактамов при помощи специфических рецепторов (формат 1 для обоих определений). В этом способе используют реакционную смесь, содержащую оба рецептора, соответствующих лактамам и тетрациклинам, а также реагенты к ним и регенерационный элемент, на котором иммобилизованы в определнных и различных участках специфические лиганды к этим рецепторам. Приготовление реакционной смеси. Реакционная смесь для выявления -лактамов содержит специфический рецептор, распознающий лактамы, специфические антитела к нему и препарат белка А, конъюгированного с коллоидным золотом. Для выявления тетрациклинов реакционная смесь содержит рецептор тетрациклинов, специфические-6 011656 антитела к нему, специфический фрагмент ДНК, конъюгированный с биотином, и препарат белка А,конъюгированного с коллоидным золотом. Рецептор -лактамов получают способом, описанным у Големи-Котра и др.(6). Неочищенный препарат, содержащий рецептор, фильтруют через мембрану Millex HV (Millipore, Inc, USA) и хранят при 4 С в присутствии 50% глицерина (об./об.). Рецептор тетрациклинов получают способом, описанным в патентной заявке WO-A-03/048770. Оба препарата антител получают способом, описанным у Кахаб и др.(7). Эти препараты антител получали путм инъекции препарата рецептора, очищенного до белковой гомогенности согласно Големи-Котра и др.(6) в случае рецептора -лактамов и согласно заявке WO-A03/048770 в случае рецептора тетрациклинов. Оба препарата антител предпочтительно используют в неочищенном виде, что означает, что неочищенную сыворотку непосредственно добавляют в реакционную смесь. В соответствии с другим предпочтительным воплощением, специфические антитела поликлонального или моноклонального типа подвергают очистке способами, известными специалистам, для осуществления в дальнейшем их конъюгирования напрямую или ненапрямую с коллоидными частицами золота способом Френса(8). Фрагмент ДНК приобретают в компании Eurogentec SA (Бельгия), последовательность и приготовление описаны в патентной заявке WO-A-03/048770. В этом конкретном случае фрагмент ДНК не иммобилизуют в зоне связывания на нитроцеллюлозной мембране, а непосредственно включают в реакционную смесь. Этот фрагмент будет регенерирован в ходе испытания благодаря своему биотинилированному концу на авидине, иммобилизованному в зоне связывания (см. далее). Совокупность необходимых реагентов вносят без какой-либо химической модификации или замещения с целью сохранения всех свойств активности и стабильности. Эти молекулы могут быть очищенными или неочищенными, что представляет очевидное экономическое преимущество. В этом конкретном примере реакционная смесь содержит 5 частей рецептора -лактама (RSA) в концентрации 360 нМ; 5 частей рецептора тетрациклина (TetR) в концентрации 4,2 мкМ; 1 часть сыворотки против RSA, разведнной в 4 раза в буфере NaPi 50 мМ, NaCl 150 мМ, рН 7,8; 1 часть сыворотки против TetR, разведнной в 4 раза в том же самом буфере; 1 часть нуклеиновой кислоты в концентрации 25 мкМ в NaCl 690 мМ; 15 частей комплекса белка А с 40 нм коллоидным золотом с OD=10 при 520 нм; 22 части буфера Hepes 120 мМ, рН 8, БСА 2%, декстран 1%, сахароза 5%. Эту смесь либо готовят перед употреблением, либо лиофилизируют в течение 20 ч. Регенерационная система. Регенерационная система состоит из нитроцеллюлозной мембраны, на которой в различных местах закреплены элементы, способные образовать комплекс с распознающими молекулами реакционной смеси. Такими элементами являются для сигнала "бета" (-лактамы) - антибиотик, предпочтительно типа пенициллина или цефалоспорина, иммобилизованный на молекуле, не проявляющей никакой определенной активности в отношении белка А, биотина или авидина. В предпочтительном воплощении настоящего изобретения используют ампициллин, иммобилизованный на -лактоглобулине; для сигнала "тетра" (тетрациклины) - авидин, способный распознавать фрагмент ДНК, несущий на конце молекулу биотина. Предпочтительно используют авидин яичного белка. Зоны связывания "бета" и "тетра" могут располагаться последовательно, одна перед другой, или наоборот, без особых предпочтений в отношении того или другого расположения, достаточно, чтобы они располагались в разнесенных в пространстве и притом известных зонах. Фактически, именно раздельное расположение позволит далее выявить тип антибиотика, присутствующего в анализируемом растворе. Если бы обе системы связывания располагались в одном и том же месте, это не повлияло бы на аналитический процесс, однако, при этом не было бы возможным определить, какой тип соединений присутствует в испытуемом образце. Приготовление -лактоглобулина, конъюгированного с ампициллином. Был выбран -лактоглобулин, поскольку он является молочным белком, который содержит много лизиновых остатков (10%), и его трхмерная структура показывает, что большинство остатков лизина обращены боковыми аминогруппами наружу (Pubmed, структура, 1GXA). 100 мг -лактоглобулина и 15 мг 2-иминотиолана выдерживают в Na-фосфатном буфере, рН 8,5, в реакционном объме 4 мл в течение 60 мин при 25 С. Далее смесь наносят на колонку PD10 (AmershamBiosciences, Великобритания), предварительно уравновешенную ФБР (фосфатным буферным раствором) рН 7, ЭДТК (этилендиаминтетрауксусной кислотой) 5 мМ и элюируемую тем же буфером. Белковые фракции собирают хорошо известными способами. Помимо этого, 2 мл ДМСО (диметилсульфоксида), содержащие 100 мг SICC выдерживают с 2 мл раствора натриевой соли ампициллина (50 мг/мл) в буфере NaPi 25 мМ, рН 8, в течение 60 мин при 25 С,после чего смесь выдерживают в присутствии 50 мг белкового раствора в течение 4 ч при 4 С и, наконец,-7 011656 раствор диализуют два раза по 6 ч в 100 объмов буфера NaPi 25 мМ, рН 7,5. Приготовление раствора нейтрализованного авидина. Раствор 5 мг/мл авидина яичного белка, производимого компанией Pierce Inc. (США), готовят на буфере NaPi 50 мМ, рН 7,5. Приготовление контрольного раствора БСА-золото. Согласно настоящему изобретению рекомендуется использование контрольной линии, имеющей постоянную интенсивность окрашивания, видимую до и после проведения испытания. Предпочтительно эта линия имеет цвет, сходный с окрашиванием, проявляющимся на тестовых линиях, и ее готовят, как описано ниже. К 27 мл препарата 40 нм коллоидного золота, полученного способом Френса(8), оптическая плотность (optical density) которого OD max составляет 3, добавляют 3 мл 10% раствора БСА (бычьего сывороточного альбумина) (Sigma) на 10 мМ боратном буфере, рН 6,5. смесь выдерживают 60 мин при 20 С,а затем центрифугируют 45 мин при 10000 об./мин в роторе SS34 (Sorvall). Осадок затем разводят в буфере NaPi 50 мМ, NaCl 150 мМ до достижения OD max = 45. Раствор, который будет нанесн на нитроцеллюлозную мембрану, дополнительно разводят в 15 раз тем же буфером до достижения конечной OD max = 3. Иммунохроматографическая процедура. Иммунохроматографическая процедура известна и описана в литературе (Developing Immunochromatographic Test Strips: A short Guide, Millipore, Lit. No. TB500 Printed in USA 11/96, 96-204). В рамках настоящего изобретения препараты, полученные выше, наносят на конкретные отдельные зоны нитроцеллюлозной мембраны, предпочтительно последовательно один за другим по направлению движения лиганда. Далее нитроцеллюлозную мембрану одним концом приводят в соприкосновение с мембраной,например, типа 142, выпускаемой компанией Ahlstrom, Inc. (США), или типа GFDVA (Whatman, Великобритания), но не типа Leukosorb (Pall, Великобритания), а другим концом - с какой-либо фильтровальной бумагой, например, типа 17CHR (Whatman, Великобритания). Нанесение регенерационных элементов на нитроцеллюлозную подложку. Именно расположение регенерационных элементов позволит распознать тип нежелательной примеси, обнаруженной в пробе. Растворы наносят "распределителем" Biodot (Великобритания) из расчта 1 пл/см. В случае выявления двух параметров препараты -лактоглобулина и авидина наносят по разные стороны от контрольной линии. Например, приготовленный, как описано выше, конъюгат лактоглобулина наносят под контрольной линией, а раствор нейтрализованного авидина - над контрольной линией (фиг. 1). Соответственно, наличие соединения -лактама проявится в отсутствии мечения на-лактоглобулине, то есть на тестовой линии, расположенной под контрольной линией, а присутствие тетрациклина проявится в отсутствии мечения на тестовой линии, расположенной над контрольной линией. В случае, если в пробе в достаточном количестве присутствуют оба класса веществ, ни с одной стороны от контрольной линии сигнал не появится (см. фиг. 1). Одновременное определение -лактамов и тетрациклинов в образце молока. 200 мкл холодного молока выдерживают при 50 С в присутствии 50 мкл реактивов, приготовленных и/или лиофилизированных, как описано выше. 3 мин спустя описанный выше регенерационный элемент погружают в раствор. Окончательную оценку результата проводят после трехминутной инкубации при помощи оптического устройства, считывающего результат с полосок, выпускаемого компаниейMatest (Германия). Результаты приведены в табл. 1. Способ позволяет считать положительной пробу молока, содержащую 4 ч. на миллион ампициллина или 75 ч. на миллион тетрациклина. В табл. 2 приведены пределы обнаружения настоящим способом различных -лактамов и тетрациклинов. Вообще говоря, когда отношение интенсивности тестовых сигналов к контролю меньше или равно 1, проба рассматривается как положительная по соответствующему параметру (соединению).-8 011656 Таблица 1 Абсолютные и относительные значения интенсивности сигнала, измеренные в зонах связывания Пример 2. Одновременное обнаружение тетрациклинов, -лактамов и сульфамидов (формат 1 для трх испытаний). В этом предпочтительном воплощении в данный способ дополнительно к двум рецепторам тетрациклинов и -лактамов включают специфические антитела, распознающие сульфадиметоксины. Приготовление реакционной смеси. В вышеприведнную смесь дополнительно включены антитела против сульфадиметоксина в соот-9 011656 ветствии со следующим протоколом: 5 частей рецептора -лактама (RSA) в концентрации 360 нМ; 5 частей рецептора тетрациклина (TetR) в концентрации 4,2 мкМ; 1 часть сыворотки против RSA, разведнной в 4 раза в буфере NaPi 50 мМ, NaCl 150 мМ, рН 7,8; 1 часть сыворотки против TetR, разведнной в 4 раза в том же самом буфере; 1 часть сыворотки против сульфадиметоксина, разведнной в 2 раза в том же самом буфере; 1 часть нуклеиновой кислоты в концентрации 50 мкМ; 20 частей комплекса белка А с 40 нм золотом с OD = 10 при 520 нм; 16 частей буфера Hepes 120 мМ, рН 8, БСА 2%, декстран 1%, сахароза 5%. Эту смесь либо готовят перед употреблением, либо лиофилизируют в течение 20 ч. Регенерационная система. Регенерационная система аналогична таковой из примера 1, куда включена четвртая линия, специфично связывающая молекулы антител против сульфадиметоксина (3-я тестовая линия). Остальные зоны связывания те же, что в примере 1, но расположены иначе, в соответствии с фиг. 2. Приготовление БСА, конъюгированного с сульфадиметоксином. Приготовление осуществляют в соответствии с протоколом, описанным у Диксон-Холланд и Катц(9). 100 мг сульфадиметоксина и 200 мг БСА растворяют в 25 мл смеси, содержащей 2 части 50 мМ фосфатного буфера рН 7,2 и 1 части диоксана, выдерживают в присутствии 120 мл 25% глутарового альдегида в течение 3 ч при перемешивании при 25 С. Затем раствор диализуют 6 дней при 4 С в 100 объмах буфера NaPi 50 мМ, рН 7,2 со сменой буфера каждые 12 ч. Нанесение регенерационных элементов на нитроцеллюлозную подложку. В случае определения трх параметров линии связывания располагают в конкретных отдельных зонах нитроцеллюлозной мембраны, предпочтительно последовательно, одну за другой в направлении движения жидкости. В соответствии с предпочтительным воплощением зоны связывания -лактама, тетрациклина, сульфадиметоксина и контрольная зона расположены, соответственно, на первом, на втором,на третьем и, наконец, на четвртом уровне по направлению движения жидкости (фиг. 2). Одна единственная зона служит контролем для всех трх маркеров. Другое расположение зон, как и в предыдущем примере, состоит во включении двух контрольных зон, то есть по одной контрольной зоне после первой и после второй тестовых зон. Следует отметить, что в соответствии с настоящим изобретением общим правилом является то, что тестовые и контрольные линии не обязательно должны быть непременно расположены в одно и том же порядке по направлению движения жидкости. Так, диагностический набор работает одинаково хорошо, в порядке ли бета-тетра расположены линии или же в порядке тетра-бета, бета-сульфа или же сульфа-бета (см. пример ниже), бета-тетра-сульфа или же сульфа-тетра-бета и т.п. Одновременное определение -лактамов, тетрациклинов и сульфадиметоксинов в образце молока. 200 мкл холодного молока выдерживают при 50 С в присутствии 50 мкл реактивов, приготовленных и/или лиофилизированных, как описано выше. После инкубации в течение 3 мин при 50 С в раствор погружают регенерационный элемент, приготовленный, как описано выше. Окончательную оценку проводят по окончании трехминутной выдержки при помощи оптического устройства для считывания с полосок (Matest, Германия). Полученные результаты приведены в табл. 3. Способ позволяет считать положительной пробу молока, содержащую 4 ч. на миллион ампициллина, и/или 45 ч. на миллион тетрациклина, и/или 100 ч. на миллион сульфадиметоксина. В табл. 4 приведены границы обнаружения различных -лактамов, тетрациклинов и сульфадиметоксина способом по настоящему изобретению. Вообще говоря, когда отношение интенсивности тестовых сигналов к контролю меньше или равно 1, пробу рассматривают как положительную по соответствующему параметру (соединению). Пример 3. Одновременное обнаружение -лактамов и сульфамидов (формат 1 для -лактамов и формат 2 для сульфамидов). Приготовление реакционной смеси. Реакционная смесь содержит 5 частей рецептора -лактамов (RSA) в концентрации 360 нМ; 10 частей моноклональных антител против RSA, меченых коллоидным золотом (ОВ=10 при 520 нм); 1 часть биотинилированных антител против сульфадиметоксина, разведнных в NaPi 50 мМ, NaCl 150 мМ, pH 7,8; 10 частей комплекса БСА с сульфадиметоксином и 40 нм коллоидным золотом;- 11011656 24 части буфера Hepes 120 мМ, рН 8, БСА 2%, Декстран 1%, сахароза 5%. Эту смесь либо готовят перед употреблением, либо лиофилизируют в течение 20 ч. Биотинилирование антител против сульфадиметоксина. 825 мкл раствора, содержащего 5 мг/мл антител против сульфадиметоксина, диализованных в 100 мМ карбонатного буфера с рН 9,2, выдерживают в присутствии 165 мкл раствора биотин-LC-NHS в концентрации 1,5 мг/мл (Perbio, Inc.) в течение 2 ч при 25 С в темноте. Реакция останавливается добавлением 10 мкл буфера 1 М трис рН 8 на 30 мин с последующим диализом 2 раза по 10 ч против буфера NaPi 50 мМ, NaCl 150 мМ, рН 7,8. Приготовление комплекса БСА с сульфадиметоксином, конъюгированного с частицами золота. Препарат комплекса БСА с сульфадиметоксином, описанный в примере 2, используют для конъюгирования с частицами коллоидного золота по прописи, аналогичной той, которая описана в примере 1,для приготовления контрольного раствора комплекса БСА с золотом. Регенерационная система. Регенерационная система аналогична описанной в примере 1, однако, в данном случае на авидине,иммобилизованном во второй зоне связывания (над контрольной зоной), иммобилизируют биотинилированные антитела против сульфамида. Одновременное определение -лактамов и сульфадиметоксина в пробе молока. 200 мкл холодного молока выдерживают 15 мин при 30 С в присутствии 50 мкл реагентов, приготовленных, как описано выше. После этого в раствор погружают регенерационный элемент, приготовленный, как описано выше. Окончательную оценку проводят после дополнительной 15-минутной выдержки. Результаты приведены в табл. 5. Таблица 5 Отношения измеренных интенсивностей В: -лактам; S: сульфамид; С: контроль Пример 4. Одновременное определение тетрациклинов и сульфамидов (формат 2 для обоих определений). Приготовление реакционной смеси. Реакционная смесь содержит 5 частей рецептора тетрациклина (TetR) в концентрации 4,2 мкМ; 1 часть мышиных моноклональных антител против TetR, разведнных в буфере NaPi 50 мМ, NaCl 150 мМ, рН 7,8; 1 часть кроличьих антител против сульфамида, разведнных в том же буфере; 10 частей раствора комплекса БСА с сульфадиметоксином и 40 нм золотом; 1 часть биотинилиованной нуклеиновой кислоты в концентрации 50 мкМ; 10 частей комплекса 40 нм антител против биотина с золотом (ОД=10 при 520 нм); 22 части буфера Hepes 120 мМ, рН 8, БСА 2%, декстран 1%, сахароза 5%.- 12011656 Эту смесь либо готовят перед употреблением, либо лиофилизируют в течение 20 ч. Регенерационная система. Регенерационная система аналогична описанной в примере 1, однако, в настоящем случае первую зону связывания, где будут иммобилизованы моноклональные антитела против TetR, составляют антитела против мыши, а вторую зону связывания, где будут иммобилизованы антитела против сульфамида,составляют антитела цыплнка против кролика. Одновременное определение тетрациклинов и сульфамидов в пробе мяса. К 10 г свиной мышцы добавляют 30 мл буфера NaPi 50 мМ, рН 8 и полученную смесь измельчают при помощи блендера MiniMix (Interscience, Франция) в течение 2 мин. Затем смесь, заключнную в пробирку типа Эппендорф, центрифугируют 1 мин при 6000 об./мин и надосадочную жидкость собирают. 200 мкл надосадочной жидкости инкубируют 15 мин при 25 С в присутствии 50 мкл реагентов, приготовленных, как описано выше. Затем в полученный раствор на 15 мин погружают вышеуказанный регенерационный элемент, после чего проводят окончательную оценку результатов. Результаты приведены в табл. 6. Таблица 6 Отношение измеренных интенсивностей Т: тетрациклин; S: сульфамид ; С: контроль Пример 5. Одновременное определение -лактамов, тетрациклинов и сульфамидов (формат 1 для лактамов и тетрациклинов и формат 2 для сульфамидов). Приготовление реакционной смеси. Реакционная смесь содержит 5 частей рецептора -лактамов (RSA) в концентрации 360 нМ; 1 часть мышиных моноклональных антител против RSA, разведнных буфером NaPi 50 мМ, NaCl 150 мМ, рН 7,8; 5 частей рецептора тетрациклина (tetR) в концентрации 4,2 мкМ; 1 часть мышиных моноклональных антител против TetR, разведнных буфером NaPi 50 мМ, NaCl 150 мМ, рН 7,8; 1 часть биотинилированной нуклеиновой кислоты в концентрации 50 мкМ; 1 часть кроличьих поликлональных антител против сульфамида, разведнных буфером NaPi 50 мМ,NaCl 150 мМ, рН 7,8; 5 частей 40 нМ разведения комплекса БСА с сульфадиметоксином и золотом; 13 частей противомышиных антител, конъюгированных с 40 нм коллоидным золотом (ОД=10 при 520 нм); 16 частей буфера Hepes 120 мМ, рН 8, БСА 2%, декстран 1%, сахароза 5%. Эту смесь либо готовят перед употреблением, либо лиофилизируют в течение 20 ч. В другом предпочтительном варианте и моноклональные антитела против RSA, и моноклональные антитела против TetR напрямую конъюгированы с коллоидным золотом. Регенерационная система.- 13011656 Регенерационная система аналогична описанной в примере 1, однако, в данном случае первую зону связывания, где будет иммобилизован рецептор RSA, образует комплекс лактоглобулина с ампициллином, во второй зоне связывания, где будет иммобилизован рецептор TetR, находится авидин, а третью зону связывания, где будут иммобилизованы кроличьи антитела против сульфамида, составляют антитела цыплнка против кролика. Одновременное определение -лактамов, тетрациклинов и сульфамидов в образце молока. 200 мкл холодного молока выдерживают в течение 15 мин при 30 С в присутствии 50 мкл реактивов, приготовленных, как описано выше. Затем в раствор погружают регенерационный элемент, приготовленный, как описано выше, и выдерживают 15 мин, после чего проводят окончательную оценку результатов. Результаты приведены в табл. 7. Таблица 7 Отношение измеренных интенсивностей В: -лактам; Т: тетрациклин; S: сульфамид; С: контроль Литература Директива Совета ЕС 96/23/ЕС от 29 апреля 1996 г. о мерах по определению некоторых веществ и их остатков в живых животных и в продуктах животноводства, отменяющая Директивы 85/358/СЕЕ и 86/469/СЕЕ и Решения 89/187/СЕЕ и 91/664/СЕЕ.(2) Регламент Совета Европейского Экономического Сообщества 2377/90 от 26 июня 1990 г., устанавливающий для Европейского Экономического Сообщества порядок определения максимальных уровней остаточного содержания в продуктах ветеринарной медицины и пищевых продуктах животного происхождения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Диагностический набор для одновременного определения антибиотиков различных классов, по меньшей мере, -лактамов и тетрациклинов, отличающийся тем, что он включает во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор,специфически распознающий -лактамы, второй рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, причем оба рецептора предпочтительно являются мечеными частицами коллоидного золота либо напрямую, либо с помощью антитела или антитела в сочетании с белком А; во-вторых, регенерационную систему в виде тврдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплены антибиотик с -лактамным ядром и авидин, в указанном порядке или наоборот; таким образом, чтобы интенсивность метки, выявляемая в регенерационной системе в обеих тесто- 14011656 вых зонах независимо, являлась бы результатом конкурентного распознания каждого антибиотика своим меченым рецептором. 2. Диагностический набор по п.1, отличающийся тем, что антибиотик с -лактамным ядром и авидин, закреплнный на нитроцеллюлозной мембране, представляют собой, соответственно, пенициллин или цефалоспорин, предпочтительно ампициллин, имобилизованный на -лактоглобулине, и авидин яичного белка. 3. Диагностический набор для одновременного определения антибиотиков различных классов, по меньшей мере, -лактамов и сульфамидов, отличающийся тем, что он включает во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор,специфически распознающий -лактамы, меченый напрямую или не напрямую предпочтительно частицами коллоидного золота; биотинилированные антитела против сульфамидов и аналог сульфамида, меченый напрямую или не напрямую коллоидным золотом; во-вторых, регенерационную систему в виде тврдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплены антибиотик с -лактамным ядром и авидин, в указанном порядке или наоборот; таким образом, чтобы интенсивность метки, выявляемая на регенерационной системе в обеих тестовых зонах независимо, являлась бы результатом конкурентного распознания каждого антибиотика. 4. Диагностический набор для одновременного определения анализируемых веществ, соответствующих антибиотикам различных классов, по меньшей мере, тетрациклинов и сульфамидов, отличающийся тем, что он включает во-первых, единственную реакционную смесь, включающую, по меньшей мере, рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, где рецептор является меченым предпочтительно частицами коллоидного золота, напрямую или не напрямую с помощью антитела, а также антитело против сульфамида и аналог сульфамида, меченый либо напрямую, либо не напрямую предпочтительно коллоидным золотом; во-вторых, регенерационную систему в виде тврдой подложки, включающую нитроцеллюлозную мембрану, на которой в двух известных и различных участках, называемых тестовыми зонами, закреплено соответственно антитело, специфически направленное либо против рецептора тетрациклина, либо против специфического антитела против рецептора тетрациклина, и антитело, специфически направленное против антитела к сульфамиду, в указанном порядке или наоборот. 5. Диагностический набор по любому из пп.1-4, отличающийся тем, что специфические антитела против рецепторов, добавляемые в реакционную смесь, являются либо моноклональными, либо поликлональными антителами, модифицированными или немодифицированными химически или рекомбинантно, очищенными или неочищенными, конъюгированными или неконъюгированными напрямую или не напрямую с мечеными частицами, предпочтительно с частицами коллоидного золота. 6. Диагностический набор по любому из пп.1-5, отличающийся тем, что нитроцеллюлозная мембрана, нанеснная на подложку диагностической полоски, одним концом соприкасается с мембраной, а другим концом с впитывающей бумагой и имеет две различные тестовые зоны, одну за другой в направлении движения жидкости, и контрольную зону, которая может разделять две тестовые зоны. 7. Диагностический набор по п.6, отличающийся тем, что контрольная зона получена с помощью какого-либо белкового препарата, меченого предпочтительно частицами коллоидного золота, более предпочтительно с помощью бычьего сывороточного альбумина (БСА), конъюгированного с частицами коллоидного золота. 8. Диагностический набор для одновременного определения -лактамов, тетрациклинов и сульфамидов по п.1 или 2, отличающийся тем, что реакционная смесь также содержит специфическое антитело,распознающее сульфамиды, меченое предпочтительно частицами коллоидного золота, напрямую или не напрямую; и тем, что регенерационная система дополнительно включает препарат белка, конъюгированного с сульфамидами, иммобилизованный на нитроцеллюлозной мембране. 9. Диагностический набор для одновременного определения -лактамов, тетрациклинов и сульфамидов по п.8, отличающийся тем, что нитроцеллюлозная мембрана, нанеснная на подложку диагностической полоски, одним концом соприкасается с мембраной, а другим концом с впитывающей бумагой и нест три различные тестовые зоны и контрольную зону, расположенные последовательно одна за другой по направлению движения жидкости, или две контрольные зоны, каждая из которых альтернативно расположена между двумя тестовыми зонами. 10. Диагностический набор для одновременного определения анализируемых веществ, соответствующих антибиотикам различных классов, по меньшей мере, -лактамов, тетрациклинов и сульфамидов,отличающийся тем, что он включает во-первых, единственную реакционную смесь, включающую, по меньшей мере, первый рецептор,специфически распознающий -лактамы, второй рецептор, специфическим и конкурентным образом распознающий тетрациклин и биотинилированный фрагмент нуклеиновой кислоты, при этом оба рецептора предпочтительно являются мечеными частицами коллоидного золота, либо напрямую, либо не на- 15011656 прямую с помощью антитела, либо антитела в сочетании с белком А, или антитела против сульфамида, а также аналог свободного сульфамида, меченый напрямую или не напрямую коллоидным золотом; во-вторых, регенерационную систему в виде тврдой подложки, включающую нитроцеллюлозную мембрану, на которой в трх известных и различных участках закреплены, соответственно, антибиотик с-лактамным ядром, авидин и антитело, направленное против антитела к сульфамиду; таким образом, чтобы интенсивность метки, выявляемая на регенерационной системе независимо в трх тестовых зонах, являлась бы результатом конкурентного распознания каждого антибиотика. 11. Диагностический набор по любому из пп.1-10, отличающийся тем, что проба является, по существу, жидкой, и ее получают из молока, мда, мяса, яиц или биологических жидкостей. 12. Диагностический набор по любому из пп.1-11, отличающийся тем, что рецепторы, использующиеся для определения -лактамов или тетрациклинов, представляют собой, соответственно, рецепторыBlaR и TetR, выделенные из известных классов микроорганизмов, предпочтительно из Staphylococcusaureus для BlaR и из плазмиды pSClOl E. coli 600 для TetR соответственно. 13. Способ применения диагностического набора по любому из пп.1-12, отличающийся тем, что он включает следующие стадии: вышеупомянутую реакционную смесь приводят в контакт с пробой, которую требуется классифицировать, с получением раствора, который выдерживают при температуре от 30 до 50 С в течение от 3 до 15 мин; диагностическую полоску, несущую вышеупомянутую регенерационную систему, погружают в полученный раствор и выдерживают в течение от 3 до 15 мин; результат, полученный на диагностической полоске, оценивают либо визуально, либо при помощи оптического устройства, считывающего изображение с полосок.
МПК / Метки
МПК: G01N 33/94, G01N 33/558
Метки: vitro, набор, выявления, идентификации, соответствующий, диагностический, классов, антибиотиков, одновременного, различных, способ
Код ссылки
<a href="https://eas.patents.su/17-11656-sposob-odnovremennogo-vyyavleniya-i-identifikacii-antibiotikov-razlichnyh-klassov-in-vitro-i-sootvetstvuyushhijj-diagnosticheskijj-nabor.html" rel="bookmark" title="База патентов Евразийского Союза">Способ одновременного выявления и идентификации антибиотиков различных классов in vitro и соответствующий диагностический набор</a>
Предыдущий патент: Применение производного пиразола для получения лекарственных средств, подходящих для профилактики и лечения заболеваний почек
Следующий патент: Композитный конструкционный элемент
Случайный патент: Профилированный ключ для цилиндрового замка