Способ получения карбапенемовых антибиотиков
Формула / Реферат
1. Способ получения соединения формулы I
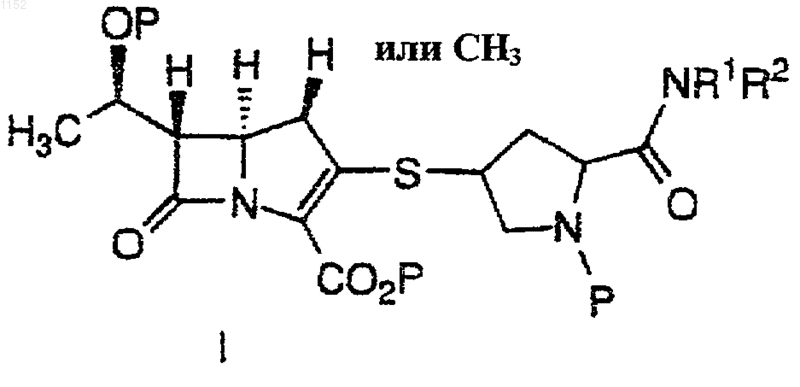
или его фармацевтически приемлемой соли или сложного эфира, где каждый Р независимо обозначает Н или защитную группу для карбоксила или гидроксила и R1 и R2 независимо друг от друга обозначают Н, C1-10алкил, арил или гетероарил или C1-10алкил, арил или гетероарил, замещенный 1-3 группами, выбранными из группы, состоящей из галогена, гидрокси, циано, ацила, ациламино, аралкокси, алкилсульфонила, арилсульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, алкила, алкокси, арила, арилокси, аралкокси, амино, алкиламино, диалкиламино, карбокси и сульфониламино, включающий взаимодействие соединения

или его фармацевтически приемлемой соли или сложного эфира и соединения
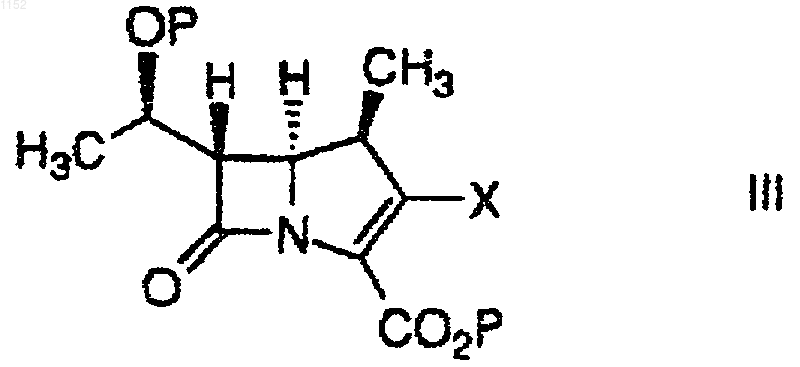
или его фармацевтически приемлемой соли или сложного эфиpa, где X обозначает ОР(O)(ОR)2 или OSO2R, где R обозначает C1-6алкил, C1-6алкарил, арил или перфтор C1-6алкил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина (ТМП), 1,1,3,3-тетраметилгуанидина (ТМГ), 1,8-диазабицикло-[4.3.0]ундец-7-ена (ДБУ) и 1,5-диазабицикло[4.3.0]нон-5-ена (ДБН) с получением соединения формулы I.
2. Способ получения соединения формулы Iа
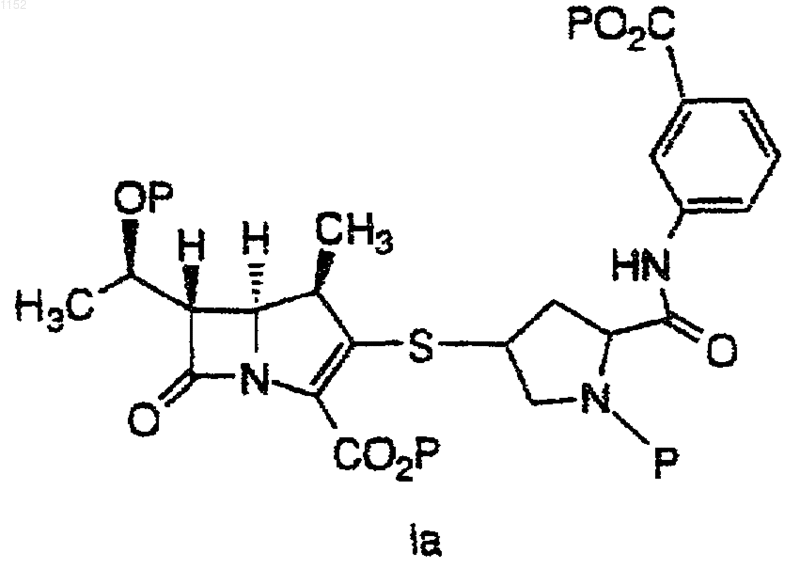
или его фармацевтически приемлемой соли или сложного эфира, где каждый Р независимо обозначает Н или защищающую группу для карбоксила или гидроксила, включающий взаимодействие соединения
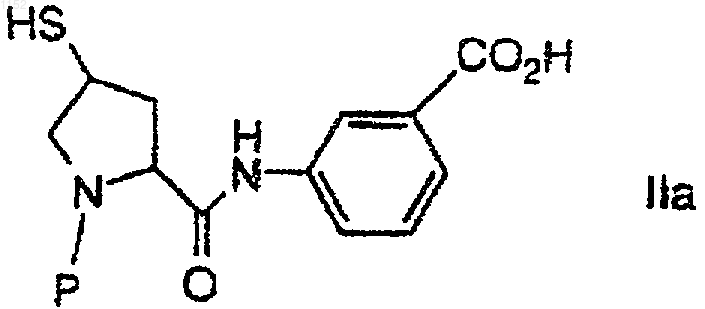
или его фармацевтически приемлемой соли или сложного эфира и соединения
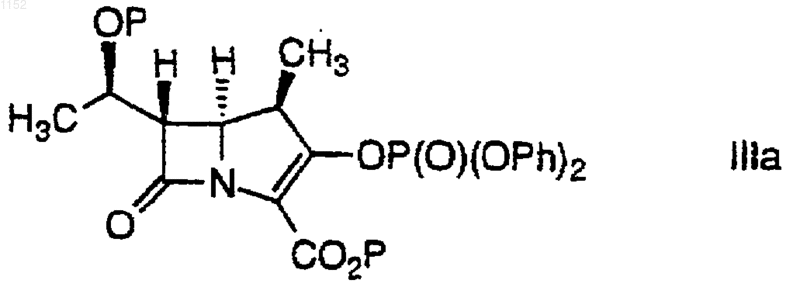
или его фармацевтически приемлемой соли или сложного эфира, где Ph обозначает фенил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина (ТМП), 1,1,3,3-тетраметилгуанидина (ТМГ), 1,8-диазабицикло[4.3.0]ундец-7-ена (ДБУ) и 1,5-диазабицикло[4.3.0]нон-5-ена (ДБН), с получением соединения формулы Iа.
3. Способ по п.1, отличающийся тем, что вторичный амин выбирают из группы, состоящей из диизопропиламина (ДИПА) и дициклогексиламина (ДЦГА).
4. Способ по п.3, отличающийся тем, что синтез осуществляют в полярном апротонном растворителе.
5. Способ по п.4, отличающийся тем, что полярный апротонный растворитель выбирают из группы, состоящей из диметилформамида, N-этилпирролидинона и ацетонитрила.
Текст
1 Настоящее изобретение относится к синтезу карбапенемовых антибиотиков. Было обнаружено, что включение вторичного амина в реакции сочетания, описываемые в настоящей заявке, приводит к неожиданному и значительному повышению скорости реакции, позволяя осуществить относительно полное превращение,за более короткое время реакции и при сравнительно более низких температурах, чем при использовании в этой реакции третичных аминов. Имеются данные об использовании в этих реакциях триэтил- и диизопропилэтиламинов,однако, с коммерческой точки зрения в этом случае неприемлемы время реакции и условия ее проведения. Так, например, Международная публикация WO 93/15078 от 5 августа 1993 г. относится к аналогичным реакциям, осуществляемым в присутствии третичного амина, такого как дизопропилэтиламин, или неорганического основания, такого как карбонат щелочного металла, например, карбонат калия. Указанные реакции проводятся при температурах от -25 С до температуры окружающей среды. В одном аспекте настоящее изобретение относится к взаимодействию между молекулой карбапенемового основания и вторым положением боковой цепи так, чтобы она стала достаточно быстрой и эффективной с точки зрения минимизации образования побочных продуктов и с тем, чтобы избежать высоких и низких температур, а также других неподходящих условий реакции. В другом своем аспекте изобретение ставит своей целью избежать использования катализаторов и других компонентов реакции, которые могут потребовать введения отдельной стадии для их удаления, если их следы будут обнаруживаться в конечном продукте. Эти и другие аспекты настоящего изобретения станут очевидны из приведенного описания. Предложен способ получения соединения формулы I или его фармацевтически приемлемой соли или сложного эфира,где каждый Р независимо обозначает Н или защитную группу и R1 и R2 независимо друг от друга обозначают Н, C1-10 алкил, арил или гетероарил или замещенный C1-10 алкил, арил или гетероарил, который включает взаимодействие соединений 2 или его фармацевтически приемлемой соли или сложного эфира и или его фармацевтически приемлемой соли или сложного эфира, где Х обозначает ОР(О)(ОR)2 или OSO2R, где R обозначает C1-6 алкил, C16 алкарил, арил или перфтор C1-6 алкил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина(ТМП), 1,1,3,3-тетраметилгуанидина (ТМГ), 1,8 диазабицикло[4.3.0]ундец-7-ена (ДБУ) и 1,5 диазабицикло[4.3.0]нон-5-ена (ДБН) с получением соединения формулы I. Было обнаружено, что приведенные в настоящем описании амины способствуют реакции между соединениями формул II и III. Что касается соединений формул II и III, то они могут быть получены по методикам, описанным,например, в патентах США 5034384 от 23 июля 1991 г., и 4994568 от 19 февраля 1991 г., которые включены в настоящее описание в качестве ссылок. Соединения, такие как соединения формулIIа и IIIa, могут быть также получены по методу из патента США 5478820, от 26 декабря 1995 г., который также включен в настоящее описание в качестве ссылки. Приводимые в настоящем описании реакции проводят в полярном апротонном растворителе. Предпочтительные примеры полярных апротонных растворителей включают диметилформамид, N-этилпирролидинон и ацетонитрил. Предпочтительный вариант изобретения включает способ получения соединения формулы Iа или его фармацевтически приемлемой соли или сложного эфира,где каждый Р независимо обозначает Н или защищающую группу, который включает взаимодействие соединения или его фармацевтически приемлемoй соли или сложного эфира и или его фармацевтически приемлемой соли или сложного эфира, где Ph обозначает фенил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина (ТМП), 1,1,3,3-тетраметилгуанидина(ДБУ) и 1,5-диазабицикло[4.3.0]нон-5-ена (ДБН) с получением соединения формулы Iа. Подробное описание настоящего изобретения включает использование терминов, значение которых, если не указано особо, приведено ниже. Термин алкил относится к радикалу,производному от одновалентного алкана (углеводорода), содержащему от 1 до 15 атомов углерода, если не указано иное. Он может быть прямым или разветвленным и при условии достаточной длины, например, как С 3-15, быть циклическим. Предпочтительные прямые или разветвленные алкильные группы включают метил,этил, пропил, изопропил, бутил и т-бутил. Предпочтительные циклоалкильные группы включают циклопропил, циклопентил и циклогексил. Алкил также включает алкильную группу,замещенную циклоалкильной группой, такую как циклопропилметил. Алкил также включает прямую или разветвленную алкильную группу, которая содержит или прерывается циклоалкиленовым фрагментом. Примеры их включают следующие: где: х' и у' принимают значения от 0 до 10; и w иz принимают значения от 0 до 9. Алкиленовый и одновалентный алкильный фрагмент(ы) алкильной группы могут быть присоединены в любой доступной для такого присоединения точке к циклоалкиленовой части. В случае, если имеется замещенный алкил,он относится к определенной выше прямой разветвленной или циклической алкильной группе,замещенной 1-3 группами, определенными относительно каждой переменной. Термин гетероалкил относится к алкильной группе, содержащей 2-15 атомов углерода, которая прерывается 1-4 гетероатомами,выбранными из О, S и N. Термин алкенил относится к углеводородному радикалу, прямому, разветвленному или циклическому, содержащему от 2 до 15 атомов углерода и, по меньшей мере, одну,двойную углерод-углеродную связь. Предпочтительно, имеется одна углерод-углеродная двойная связь и может быть до четырех неароматических (не резонирующих) двойных угле 001152 4 род-углеродных связей. Предпочтительные алкенильные группы включают этенил, пропенил,бутенил и циклогексенил. Аналогично тому, что было отмечено в отношении алкила, прямая,разветвленная или циклическая часть алкенильной группы может содержать двойные связи и может быть замещена, образуя замещенную алкенильную группу. Термин алкинил относится к углеводородному радикалу, прямому, разветвленному или циклическому, содержащему от 2 до 15 атомов углерода и, по меньшей мере, одну,тройную углерод-углеродную связь. Может присутствовать до трех тройных углеродуглеродных связей. Предпочтительные алкинильные группы включают этинил, пропинил и бутинил. Аналогично тому, что было отмечено в отношении алкила, прямая, разветвленная или циклическая часть алкинильной группы может содержать тройные связи и может быть замещена, образуя замещенную алкинильную группу. Термин арил обозначает ароматические кольца, например, фенильную, замещенную фенильную и подобные группы, а также конденсированные кольца, например, нафтил и др. Арил, таким образом, содержит, по крайней мере, одно кольцо, включающее, по меньшей мере,6 атомов, при этом может присутствовать до двух таких колец, содержащих до 10 атомов, с наличием чередующихся(резонирующих) двойных связей между смежными атомами углерода. Предпочтительными арильными группами являются фенил и нафтил. Арильные группы могут быть также замещены, как было определено выше. Предпочтительные замещенные арильные группы включают фенил и нафтил, замещенные одной-тремя группами, выбранными, например, из галогена, алкила и трифторметила. Термин гетероарил относится к моноциклической углеводородной группе, включающей 5 или 6 атомов, или бициклической ароматической группе, включающей от 8 до 10 атомов, которые содержат, по меньшей мере,один гетероатом: О, S или N и в которых точкой прикрепления является атом углерода или азота,а один дополнительный атом углерода не обязательно может быть замещен гетероатомом, выбранным из О или S, и в которых также от 1 до 3 дополнительных атомов углерода могут быть не обязательно замещены гетероатомами азота. Гетероарильная группа не обязательно может в качестве заместителей содержать до трех групп. Гетероарил включает ароматические и частично ароматические группы, которые могут содержать один или более гетероатомов. Примеры групп первого типа включают тиофен,пурин, имидазопиридин, пиридин, оксазол, тиазол, оксазин, пиразол, тетразол, имидазол, пиридин, пиримидин, пиразин и триазин. Примерами частично замещенных ароматических групп являются тетрагидроимидазо[4,5-с]пири 5 дин, фталидил и сахаринил, как определено выше. Замещенные алкил, арил и гетероарил, а также замещенные части аралкила, аралкокси,гетероаралкила, гетероаралкокси и других групп замещаются 1-3 группами, выбранными из группы, состоящей из галогена, гидрокси, циано, ацила, ациламино, аралкокси, алкилсульфонила, арилсульфонила, алкилсульфониламино,арилсульфониламино,алкиламинокарбонила,алкила, алкокси, арила, арилокси, аралкокси,амино, алкиламино, диалкиламино, карбокси и сульфониламино. Термины гетероциклоалкил и гетероциклил относятся к циклоалкильной группе(неароматической), в которой один из атомов углерода в кольце замещается гетероатомом,выбранным из О, S(O)у или N, и в которой до трех дополнительных атомов углерода могут быть замещены указанными гетероатомами. Когда в гетероцикле присутствуют три гетероатома, они не связаны вместе. Примерами гетероциклилов являются пиперидинил, морфолинил, азетидинил, пирролидинил, тетрагидрофуранил, имидазолинил, пиперазинил, пирролидин-2-он, пиперидин-2-он и др. Используемый в контексте настоящего описания ацил относится к -C(O)C1-6 алкилу и-NНSО 3 Н. Галоген означает Cl, F, Вr и I, которые выбираются независимо друг от друга. Соединения по настоящему изобретению используются в виде различных фармацевтически приемлемых солей. Термин фармацевтически приемлемая соль относится к тем солевым формам, выбор которых очевиден для любого химика-фармацевта, т.е. это соли, которые по существу являются нетоксичными и обладают нужными фармакокинетическими свойствами,приятным вкусом, определенными параметрами абсорбции, распределения, метаболизма и выведения. Другими факторами, более практичными по своей природе, которые также играют важную роль при выборе, является стоимость сырь 001152 6 евых материалов, легкость кристаллизации, выход, стабильность, гигроскопичность и текучесть получаемой массы лекарственного средства. Для удобства использования фармацевтические композиции могут быть получены при сочетании активных ингредиентов с фармацевтически приемлемыми носителями. Фармацевтически приемлемые соли соединений формулы I включают традиционные не токсичные соли и четвертичные аммониевые соли образованных соединений формулы I, например, в сочетании с неорганической или органической катионной группами. Эти соли могут включать, например, нагрузку из компенсирующих катионов, присутствующих по необходимости в сочетании с соединением для придания ему в целом нейтральных свойств нейтральности. В типичном случае такие нагрузки могут относиться к типу фармацевтически приемлемого солеобразующего иона, такого как натрий, калий, магний и др. Когда противоион относится к типу бис катиона, например, Са+2,он в типичном случае присутствует в соответствующем количестве относительно группировки карбапенема для целей поддержания общей нейтральности заряда. Так, половина молярного эквивалента Са+2 может быть включена для целей поддержания общей нейтральности заряда. Все указанные варианты включены в рамки настоящего изобретения. В работе Berge, S.M., et al. J. Pharm. Sci. 66(1): 1-16(1977), которая указана в качестве ссылки, приведены различные солеобразующие ионы. Предпочтительный тип солеобразующих ионов выбирают из группы, состоящей из натрия, калия, кальция и магния. Более предпочтительно катион обозначает представителя группы, состоящей из Na+, Ca+2 и К+. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы с помощью традиционных химических методов. В основном, соли получают в ходе реакции свободных основания или кислоты со стехиометрическими количествами или с избытком желательных солеобразующих неорганических или органических кислоты или основания, в подходящем растворителе или в сочетании растворителей. Одна предпочтительная для использования по настоящему изобретению группа аминов включает диизопропиламин и дициклогексиламин. Эти амины образуют кристаллические соли с дифенилфосфорной кислотой, которая кристаллизуется из смеси в реакции сочетания,что дает возможность удалять фосфорную кислоту как побочный продукт реакции. При использовании указанных выше аминов скорость реакции неожиданно возрастает. Получаемые по настоящему изобретению соединения имеют асимметрические центры и 7 могут иметь вид как рацематов, рацемических смесей, так и индивидуальных диастереомеров. Способы синтеза всех таких изомеров, включая оптические изомеры, также включены в настоящее изобретение. Карбоксильная группа в третьем положении и гидроксильная группа в восьмом положении карбапенема, азот пирролидинила и, если имеется, м-карбофенильная группировка могут оставаться в блокированном состоянии вплоть до получения готового продукта. Указанные блокирующие группы легко удаляются, например, они могут быть удалены, если желательно,с применением процедур, которые не вызывают расщепления или других нарушений оставшихся частей молекулы. Такие процедуры включают химический и энзиматический гидролиз,обработку в мягких условиях химическими восстановителями или окислителями, обработку ионами фтора, обработку катализатором переходного металла и нуклеофилом и каталитическую гидрогенизацию. Примеры подходящих защищающих групп для гидроксила включают т-бутилметоксифенилсилил, т-бутоксидифенилсилил, триметилсилил, триэтилсилил, о-нитробензилоксикарбонил, п-нитробензилоксикарбонил, бензилоксикарбонил, т-бутилоксикарбонил, 2,2,2 трихлорэтилоксикарбонил и аллилоксикарбонил. Предпочтительными защищающими гидроксил группами являются триметилсилил и триэтилсилил. Примерами подходящих защищающих групп для карбоксила являются бензилгидрил,о-нитробензил, п-нитробензил, 2-нафтилметил,аллил, 2-хлораллил, бензил, 2,2,2-трихлорэтил,триметилсилил,т-бутилдиметилсилил,тбутилдифенилсилил,2-(триметилсилил)этил,фенацил, п-метоксибензил, ацетонил, пметоксифенил, 4-пиридилметил и т-бутил. Предпочтительной защищающей карбоксил группой является п-нитробензил. В технике известно много других групп,подходящих для защиты гидроксила и карбоксила (см., например, T.W. Greene, ProtectiveGroups in Organic Synthesis, John WileySons,Inc., 1981 (Chapters 2 and 5). Настоящее изобретение иллюстрируется следующими не ограничивающими его примерами. Препаративный пример 1. 8 ПНЗ гидроксипролин (15 г) перемешивают в смеси ТГФ (225 мл) и толуола (75 мл) и смесь охлаждают до -10 С. Добавляют диизопропилэтиламин (13,4 г) и затем раствор 12,1 г хлорида дифенилфосфиновой кислоты в 15 мл толуола. Смесь выдерживают 2 ч при -10 С и добавляют 4,1 г пиридина в 4 мл толуола и затем 6,29 г метансульфонилхлорида в 4 мл толуола. Через 4 ч добавляют раствор тригидрата сульфида натрия(7,0 г) в 75 мл воды и смесь нагревают до 20 С и выдерживают в течение 14 ч. Разделяют слои и органический слой экстрагируют НСl (150 мл,1,0 N), бикарбонатом натрия (280 мл, 5%, 4045 С) и водным NaCl (150 мл, насыщенный, 2025 С). В колбу объемом 1 л вносят 540 мл экстракта 6,6 г м-аминобензойной кислоты и 1,0 мл трибутилфосфина. Смесь дегазируют и концентрируют до 200 мл перегонкой под атмосферным давлением. В ходе перегонки добавляют толуол и продолжают ее до тех пор, пока температура дистиллята не достигнет 110 С. Затем добавляют уксусную кислоту (200 мл) и 1 пропанол (200 мл), охлаждают полученную смесь до 15-20 С и выдерживают при этой температуре 18 ч. Продукт отделяют фильтрованием, осуществляя промывание 1-пропанолом и высушивание под вакуумом при 80 С с получением 15,4 г сидекаинтиола. Пример 1. Объединяют соединение А (594 мг, 1,0 ммоль) и соединение В (454 мг, 1,02 ммоль) и добавляют ДМФ (2,0 мл). Дегазируют смесь. Полученный раствор охлаждают до температуры от -50 С до -30 С. Добавляют диизопропиламин (204 мг, 0,28 мл). Через 2-3 ч реакция завершается с уровнем конверсии 98%. Сравнительный пример. Осуществляют процедуру примера 1, за исключением того, что в данной реакции диизопропиламин заменяют равным молярным количеством диизопропилэтиламина. Через 18 ч реакция завершается (степень конверсии 98%). Пример 2. Используя в основном процедуру, описанную в примере 1, заменяют диизопропиламин,взятый в качестве основания диизопропилэтиламином (ДИПЭА). Скорость реакции между А и В', которая приводит к получению С', значительно выше в случае ДИПА и других приведенных в описании аминов, чем при использование ДИПЭА. Таблица 1 Время, необходимое Выход для 98% конверсии в% ДБУ (DBU) ДИПА (DIРА) ТМГ (TMG) ТМП (ТМР) ДИПЭА (DIРЕА) В реакциях используют эквимолярные количества А и В' при 0,1 М концентрации и наличии 1,1 эквив. основания при -20 С. а примерно 90% конверсия за 4 ч;b выход за 4 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы 10 или его фармацевтически приемлемой соли или сложного эфиpa, где X обозначает ОР(O)(ОR)2 или OSO2R, где R обозначает C1-6 алкил,C1-6 алкарил, арил или перфтор C1-6 алкил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина (ТМП), 1,1,3,3-тетраметилгуанидина(ДБУ) и 1,5-диазабицикло[4.3.0]нон-5-ена (ДБН) с получением соединения формулы I. 2. Способ получения соединения формулы Iа или его фармацевтически приемлемой соли или сложного эфира, где каждый Р независимо обозначает Н или защищающую группу для карбоксила или гидроксила, включающий взаимодействие соединения или его фармацевтически приемлемой соли или сложного эфира и соединения или его фармацевтически приемлемой соли или сложного эфира, где каждый Р независимо обозначает Н или защитную группу для карбоксила или гидроксила и R1 и R2 независимо друг от друга обозначают Н, C1-10 алкил, арил или гетероарил или C1-10 алкил, арил или гетероарил,замещенный 1-3 группами, выбранными из группы, состоящей из галогена, гидрокси, циано, ацила, ациламино, аралкокси, алкилсульфонила, арилсульфонила, алкилсульфониламино,арилсульфониламино,алкиламинокарбонила,алкила, алкокси, арила, арилокси, аралкокси,амино, алкиламино, диалкиламино, карбокси и сульфониламино, включающий взаимодействие соединения или его фармацевтически приемлемой соли или сложного эфира и соединения или его фармацевтически приемлемой соли или сложного эфира, где Ph обозначает фенил, в присутствии амина, выбранного из группы, состоящей из диизопропиламина (ДИПА), дициклогексиламина (ДЦГА), 2,2,6,6-тетраметилпиперидина (ТМП), 1,1,3,3-тетраметилгуанидина(ДБН), с получением соединения формулы Iа. 3. Способ по п.1, отличающийся тем, что вторичный амин выбирают из группы, состоящей из диизопропиламина (ДИПА) и дициклогексиламина (ДЦГА). 4. Способ по п.3, отличающийся тем, что синтез осуществляют в полярном апротонном растворителе. 5. Способ по п.4, отличающийся тем, что полярный апротонный растворитель выбирают из группы, состоящей из диметилформамида, Nэтилпирролидинона и ацетонитрила.
МПК / Метки
МПК: C07D 477/08
Метки: антибиотиков, получения, карбапенемовых, способ
Код ссылки
<a href="https://eas.patents.su/6-1152-sposob-polucheniya-karbapenemovyh-antibiotikov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения карбапенемовых антибиотиков</a>
Предыдущий патент: Контактное устройство.
Следующий патент: Способ производства пиццы и устройство для его осуществления.
Случайный патент: Теплообменный аппарат










