Способ и устройство для одновременного определения количества различных радионуклидов на поверхности биологического микропланшета
Номер патента: 6014
Опубликовано: 25.08.2005
Авторы: Ховиг Эйвинд, Ёшиока Коки, Брейстёл Кнут, Нигорд Эйнар, Скреттинг Арне, Квиннсланд Ингве
Формула / Реферат
1. Способ одновременного количественного определения содержания одного или нескольких радиоактивных нуклидов в произвольных участках на подлежащей исследованию поверхности, где эти нуклиды были помещены, адсорбированы или зафиксированы, причём каждый из радиоактивных нуклидов является маркером на соединениях, которые были включены в целевые участки ткани, целевые химические соединения или биологические целевые молекулы, которые были нанесены, адсорбированы или связаны с химическими зондовыми веществами на поверхности для исследования, характеризующийся тем, что
регистрируют как координаты, так и энергию частиц и/или фотонов, испускаемых из каждого участка подлежащей исследованию поверхности, и
данные регистрации хранят и регистрирование продолжают для формирования энергетического спектра зарегистрированных событий на каждом участке, и
регистрируемую информацию с каждого участка применяют для определения в абсолютных количественных значениях количества и/или активности каждого радионуклида, присутствующего в этом участке, путём статистической обработки информации.
2. Способ по п.1, отличающийся тем, что данные и о зарегистрированном положении, и об энергии испущенных из каждого участка подлежащей исследованию поверхности частиц и/или фотонов хранятся и накапливаются в виде изображения спектральных линий энергетического спектра, то есть хранятся как распределение по kmax каналов энергии для каждого участка r по всей подлежащей исследованию поверхности, где kmax - это число дискретных каналов энергии, на которое разделен весь интервал энергий испускаемых частиц и/или фотонов.
3. Способ по п.2, отличающийся тем, что статистическая обработка включает метод наименьших квадратов, причём линейную комбинацию предварительно зарегистрированных спектров энергий для всех радиоактивных маркеров, где неизвестные коэффициенты являются вкладами каждого из радионуклидов, сопоставляют с данными от элемента изображения или области изображения спектральных линий энергетического спектра, представляющими собой измеренную составную гистограмму энергий или распределение энергий, и/или применяют метод максимальной вероятности, причём измеренный спектр энергий для каждого радиоактивного маркера используют, чтобы найти наиболее вероятное число попаданий от каждого радиоактивного маркера в каждом канале энергий, что даёт зарегистрированную гистограмму или распределение энергий, и приводит, таким образом, к полному числу событий, ведущих происхождение от каждого из радионуклидов.
4. Способ по п.2 или 3, отличающийся тем, что способ применяют для биологических микропланшетов, где предназначенные для исследования участки обычно имеют диаметр менее 200 мкм, и для макропланшетов, где предназначенные для исследования участки обычно имеют диаметр более 300 мкм.
5. Способ по пп.1-4, отличающийся тем, что способ применяют для количественного определения содержания одного или нескольких радиоактивных нуклидов, которые испускают альфа, бета, гамма или позитронные частицы и/или фотоны, и внедрены в целевые молекулы таким образом, что радиоактивность от каждого подлежащего исследованию участка на подлежащей исследованию поверхности находится в пределах от 1 до 100 Бк.
6. Способ по п.5, отличающийся тем, что способ применяется для немоноэнергетических радиоактивных меток, включая b -излучающие нуклиды, которые дают полностью и/или частично перекрывающиеся спектры энергий.
7. Способ по п.6, отличающийся тем, что b -излучающие нуклиды включают 33P и 35S.
8. Способ по п.7, отличающийся тем, что способ применяют для мониторинга всей популяции мРНК в образце из типа/линии клеток путём сравнения с образцом из стандартного типа/линии клеток, причём
в культуральную среду параллельных культур клеток добавляют в момент времени 0 [a -35S]UTP и [a -33P]UTP в подходящей концентрации,
в момент времени 1 одну из параллелей подвергают химической обработке, чтобы остановить синтез РНК, и
в момент времени 2 обе культуры собирают, выделяют РНК и смешивают равные количества РНК из обеих культур, после чего
смесь обрабатывают как объединённую пробу кДНК и гибридизируют на биологическом микропланшете, на котором можно определить общие количества обоих радиоактивных маркеров.
9. Способ по любому из пп.1-6, отличающийся тем, что способ применяют для одновременного мониторинга в различных наборах степени фосфорилирования белков путём введения в питательную среду радиоактивно меченных аминокислотных ярлыков и затем адсорбирования их на биологических микропланшетах, содержащих структурированные наборы антител.
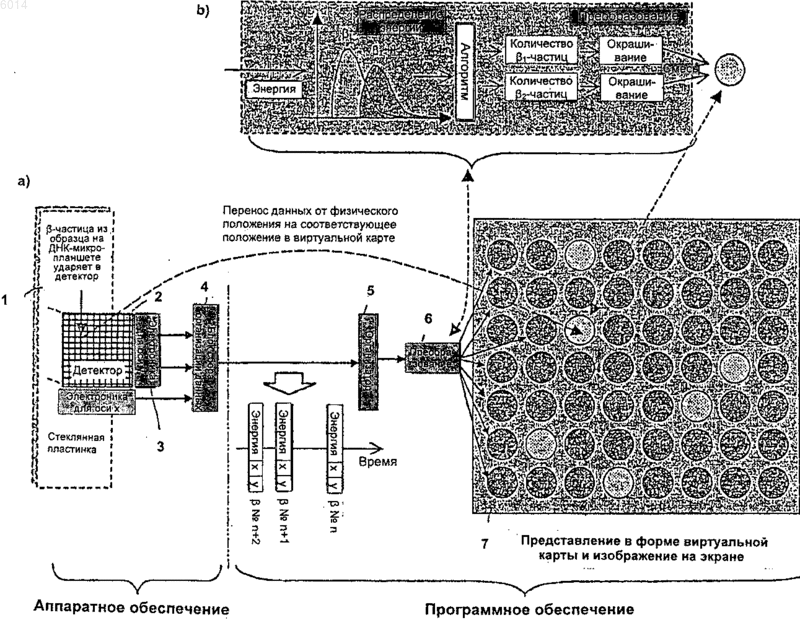
10. Устройство для осуществления одновременного количественного определения содержания одного или нескольких радиоактивных нуклидов в произвольных подлежащих исследованию участках на подлежащей исследованию поверхности, где эти нуклиды были помещены, адсорбированы или зафиксированы, характеризующееся тем, что устройство содержит
электронную систему для определения в режиме реального времени мест соударения и привнесённых энергий радиоактивных частиц и/или фотонов, испускаемых из подлежащих исследованию участков на подлежащей исследованию поверхности, которая содержит полупроводниковый детектор из множества полосок с ортогональными полосками соответственно p-типа и n-типа на противоположных сторонах, и средства детектирования мест соударения в координатах x и y для каждого радиоактивного события, а также привнесённую энергию частицы и/или фотона, механизм наложения, позволяющий задавать положение подлежащей исследованию поверхности в контакте с полупроводниковым детектором по всей его поверхности, отделённой тонкой плёнкой из майлара для защиты полупроводникового детектора,
модуль организации данных в режиме реального времени, который воспринимает след частицы и хранит данные о положении и энергии каждого зарегистрированного радиоактивного события, и который размещает зарегистрированные события для каждой точки в координатах x и y полупроводникового детектора в распределение по k каналам энергии, образуя таким образом изображение спектральных линий энергетического спектра,
компьютерный модуль, содержащий аппаратное и программное обеспечение, который способен загружать изображение спектральных линий энергетического спектра, чтобы определить в абсолютных значениях количество или активность каждой присутствующей радиоактивной метки в каждой точке или конденсированной области полупроводниковой сенсорной пластины, и
модуль для визуализации распределения активности каждого радиоактивного маркера по всем точкам полупроводниковой пластины или, по желанию, в выбранных подлежащих исследованию участках на подлежащей исследованию поверхности.
11. Устройство по п.10, отличающееся тем, что средства для измерений в режиме реального времени мест соударения и привнесённых энергий радиоактивных частиц/фотонов содержат
один усилительный канал, состоящий для каждой полоски из предусилителя и фильтра и соединённых параллельно триггерной ячейки и ячейки хранения данных, и
систему накопления данных, соединённую с усилительными каналами, которая способна хранить информацию о положении в координатах x и y и об энергии всех зарегистрированных радиоактивных событий, достигающих чувствительной части полупроводниковой сенсорной пластины.
12. Устройство по п.10 или 11, отличающееся тем, что полупроводниковый детектор представляет собой квадратную пластину из монолитного полупроводникового материала, которая имеет типичный размер порядка десяти квадратных сантиметров и толщину приблизительно 300 мкм и содержит чувствительную область размером 64_ 32 мм2, причём расстояние между полосками для чувствительных полосок n-типа и ориентированных ортогонально полосок р-типа на противоположной стороне полупроводниковой пластины равно 50 мкм, что даёт в общей сложности 1280_ 640 полосок или двумерную решётку из 820000 точхъ.
13. Устройство по любому из пп.10-12, отличающееся тем, что механизм наложения и полупроводниковый детектор сконструированы таким образом, что полупроводниковая пластина может быть снята и заменена другой полупроводниковой пластиной с такими же расположением точек и размерами, но из другого полупроводникового материала, чтобы устройство могло детектировать другие типы радиоактивности.
14. Устройство по п.13, отличающееся тем, что полупроводниковая пластина представляет собой монолитную пластину, содержащую один из следующих материалов: Si, GaAs, CdTe или CdZnTe.
15. Устройство по любому из пп.10-14, отличающееся тем, что компьютерный модуль устройства содержит программное обеспечение, использующее информацию о зарегистрированных распределениях по k каналам энергии для каждой точки для разделения/определения, в абсолютных величинах, вклада каждого радиоактивного маркера в зарегистрированный энергетический спектр для каждой точки полупроводниковой сенсорной пластины путёмприменения метода наименьших квадратов, в котором линейная комбинация предварительно зарегистрированного ожидаемого спектра энергий каждого радиоактивного маркера сопоставляется с измеренным составным спектром энергий, и/или метода максимальной вероятности, в котором ожидаемый спектр энергий для каждого радиоактивного маркера применяется для определения наиболее вероятного числа соударений от каждого радиоактивного маркера в каждом канале энергии, что дает зарегистрированную гистограмму энергий.
16. Устройство по любому из пп.10-15, отличающееся тем, что модуль организации данных в режиме реального времени, который воспринимает след частицы и хранит данные о положении и энергии каждого зарегистрированного радиоактивного события и который размещает зарегистрированные события для каждой точки в координатах x и y полупроводникового детектора в распределение по k каналам энергии, способен конденсировать зарегистрированные и сохраняемые данные путём добавления информации из распределений для всех соседних точек в распределение для центральной точки в целях экономии компьютерного времени, привести виртуальное разрешение цифровой карты в удобное соответствие с физическим плоскостным разрешением на подлежащей исследованию поверхности и/или повысить статистическую точность оцениваемых вкладов.
17. Устройство по п.16, отличающееся тем, что модуль организации данных в режиме реального времени может суммировать любое число окружающих рядов точек, чтобы привести виртуальное разрешение в удобное соответствие с грубым распределением на подлежащей исследованию поверхности, то есть в случае добавления одного ряда к данным для центральной точки добавляются данные для всех 8 соседних точек, окружающих центральную точку, в случае добавления двух рядов к данным для центральной точки добавляются данные для всех 8 точек первого ряда и 16 точек окружающего второго ряда и так далее.
18. Устройство по любому из пп.10-17, отличающееся тем, что модуль для представления определённой активности каждой радиоактивной метки в каждом подлежащем исследованию участке подлежащей исследованию области представляет собой графическое приспособление для представления данных в форме виртуальной карты, отражающей подлежащую исследованию поверхность, где каждый радиоактивный нуклид представлен своим цветом и где определённое количество каждой радиоактивной метки в каждом подлежащем исследованию участке подлежащей исследованию области изображается интенсивностью соответствующей окраски таким образом, что на виртуальной карте биологического планшета создаётся шкала цветности, которая прямо сопоставима с результатом применения известного способа с применением флуорофоров.
19. Устройство по любому из пп.10-17, отличающееся тем, что модуль для представления определённой активности каждого радиоактивного нуклида представляет собой приспособление для представления данных в форме гистограмм, изображающих в абсолютных величинах количества каждого радиоактивного нуклида в каждом подлежащем исследованию участке подлежащей исследованию области.
20. Устройство по любому из пп.10-19, отличающееся тем, что устройство оборудовано приспособлением для определения физической протяжённости ячейки посредством крайнего верхнего, крайнего нижнего, крайнего левого и крайнего правого положений каждой подлежащей исследованию ячейки путём добавления всех линий изображений спектральных линий энергетического спектра в единое суммарное изображение, вычисления проекций суммарного изображения на ось x и ось y, повторения процесса при повороте изображения биологического планшета с шагом 0,1ш и определения такого поворота, который по вариациям проекций суммарного изображения на ось y выстраивает ряды ячеек параллельно оси x, и тем, что проекции используются для локализации рядов и колонок ячеек в изображении.
Текст
006014 Область техники Настоящее изобретение относится к способу и устройству для одновременного количественного определения содержания одного или нескольких радиоактивных нуклидов в произвольных участках на поверхности, где эти нуклиды были помещены, адсорбированы или зафиксированы. Эти радиоактивные нуклиды служат маркерами на соединениях, которые обычно были включены в участки ткани или в более крупные биологические молекулы, которые с помощью различных механизмов были связаны с химическими веществами на этой поверхности. Способ в особенности пригоден для определений на ДНКмикропланшете с помощью использования нуклеотидов, меченных различными -излучающими радионуклидами. Предшествующий уровень техники Широко распространено мнение, что в живом организме тысячи генов и их продуктов, т.е. РНК и белков, функционируют сложным и согласованным способом, что составляет тайну жизни. Однако в молекулярной биологии традиционные методы применяются, как правило, на уровне один ген в одном эксперименте, что делает трудно достижимой общую картину функционирования генов. Поэтому биологические микропланшеты (biological microarrays) - это наиболее многообещающие, разработанные в последние годы новые приспособления в биологических исследованиях, поскольку они предоставляют возможность одновременно изучать полный набор генов и их продуктов. Микропланшет представляет собой упорядоченное расположение биологических молекул, иммобилизованных в местах для проб (ячейках) на предназначенной для анализа (тестовой) пластине, что обеспечивает сопоставление известных и неизвестных образцов биологических молекул. Иммобилизованные молекулы на тестовой пластине часто обозначаются как зондовые (probe) молекулы, а биологические молекулы из испытуемых образцов обозначаются как целевые молекулы. В том случае, когда зондовые молекулы и целевые молекулы образуют специфические комплементарные пары биологических молекул, можно применить упорядоченное расположение ячеек - для идентификации специфических биологических молекул в подлежащем исследованию образце из организма и также для определения относительного содержания этих молекул. Типичными примерами комплементарных биологических молекул являются гибридизационные пары ДНК, ген-антиген и т.д. В микропланшетах ячейки для образцов обычно имеют диаметр менее 200 мкм, но были описаны также макропланшеты с диаметром ячеек для образцов, как правило, 300 мкм и выше. Техника биологических микропланшетов может иметь многочисленные применения, такие как диагноз, идентификация/открытие новых генов и белков, создание лекарств, фармакологические и токсикологические исследования и т.д. Эту технику можно также применить для тестов сравнения, когда на одном и том же планшете адсорбированы биологические компоненты из различных источников, например из здоровой клетки и из опухолевой клетки. Из биологических микропланшетов в последние годы особенное внимание привлекает один из типов, а именно ДНК-микропланшет. Эта технология обещает обеспечить мониторинг всего генома на одном чипе и делает таким образом возможным получить одновременно более полную картину взаимодействий тысяч генов. Известные решения В общем виде обычный способ определения биологической активности с помощью ДНКмикропланшетов может быть описан следующим образом. Нити зондовой комплементарной ДНК(кДНК) (обычно длиной 500-5000 нуклеотидов) иммобилизуют, располагая их специфически и упорядоченно, на тврдой подложке (обычно на стеклянной пластинке). Затем зондовую ДНК подвергают воздействию одной или нескольких целевых молекул (меченых кДНК из подлежащих исследованию образцов), либо поодиночке, либо в смеси. Целевые молекулы (меченые кДНК) получают ферментативным способом с помощью обратной транкриптазы по образцам РНК, выделенным из подлежащих исследованию образцов, и метят специфическими маркерными молекулами. Полученные с помощью обратной транскриптазы транскрипты РНК из испытуемых образцов гибридизируют на микропланшетах с зондовой кДНК. Таким образом, количество и тип каждой целевой кДНК можно определить, измеряя расположение и концентрацию каждой маркерной молекулы в каждой ячейке на микропланшете, так как сигнал от маркера в каждой ячейке соответствует относительным количествам транскрипта для каждого специфического транскрипта в каждой ячейке микропланшета. Чтобы уменьшить разброс, предпочтительно измерять отношение сигналов для двух конкурирующих проб. Флуоресцентно-меченые нуклеотиды Обычно определение сигналов с помощью этой технологии было основано на включении in vitro нуклеотидов, меченных подходящими флуорофорами. Это означает, что в РНК, выделенную из каждого образца, вводят специфические флуорофоры (флуоресцирующие молекулы) соответственно своего характерного цвета. Так нуклеотиды, меченные флуорофорами характерного цвета, включаются в целевую кДНК, которая гибридизируется с зондовой кДНК. Возбуждение флуорофоров может быть осуществлено при различных длинах волн, и они также могут излучать свет при различных длинах волн. Это может быть осуществлено, вообще говоря, с помощью лазерного излучения и подходящих фильтров для разделения сигналов от одной или нескольких популяций кДНК.-1 006014 Однако обычно необходимое количество исходного материала составляет около 50 мкг общей РНК или приблизительно 5107 клеточных эквивалентов. Это относительно высокое количество необходимого материала делает невозможным применение стандартной технологии во многих очень важных областях, включая клиническую диагностику. Очень существенным фактором в такой низкой чувствительности является малая эффективность включения существующих меченных флурофорами нуклеотидов при обратной транскрипции кДНК по РНК. Из-за этого в каждую синтезируемую кДНК включается относительно малое число флуоресцирующих молекул. Кроме того, невозможны применения, требующие включения флуоресцентной метки в культуре клеток, так как обычно клеточные системы не включают меченые флуорофорами нуклеотиды. Появляющиеся способы повышения интенсивности сигнала включают ферментативную амплификацию (увеличение количества) материала образца и химическое усиление сигнала. Такие способы показывают возможность снижения размера образца. Ранее были опубликованы способы амплификации, позволяющие уменьшить размер образца до 100 нг исходной общей РНК [1]. Это достигается путм одного или нескольких циклов перехода от РНК к кДНК. В такой реакции можно в каждом цикле получить приблизительно 50-кратное увеличение материала введением на одном конце молекулы промотора Т 7 для образования РНК. Для другого конца используется способность некоторых обратных транскриптаз добавлять во все кДНК на самом 5'-конце специфический праймер при первой обратной транскрипции. Это свойство необходимо, чтобы избежать возникновения более коротких кДНК. Альтернативная стратегия состоит в усилении сигнала от испытуемого материала с помощью химических способов. Дающая наибольшее повышение чувствительности стратегия, имеющаяся к настоящему времени, основана на вставленных переплетениях меченых разветвлнных молекул синтетической ДНК [2, 3, 4]. Они могут связываться с хвостами поли(А) у кДНК перед гибридизацией на планшете. Обычно можно достигнуть 250-кратного увеличения интенсивности сигнала. Ни для одной из этих стратегий не были тщательно исследованы ни возможность реального осуществления, ни уровни чувствительности. Вероятно, техника амплификации может привести к отклонению в различной степени от исходного материала из-за ферментативной природы процесса в соединении с большими вариациями в длине мРНК для различных транскриптов. Значительными недостатками известных способов являются необходимость больших количеств испытуемого материала для достижения адекватной интенсивности сигнала, а также проблема того, что имеющиеся флуорофоры с трудом воспринимаются обратной транскриптазой. Радиоактивно-меченые нуклеотиды Известно, что проблема плохой восприимчивости нуклеотидов для обратной транскриптазы может быть разрешена путм применения радиоактивных изотопов для получения меченых нуклеотидов. Радиоактивные изотопы издавна широко применялись для высокочувствительного обнаружения и количественного определения нуклеиновых кислот. Их распространнное применение ограничивалось применением одного единственного, обычно -излучающего, радионуклида, включаемого либо в зонд(детекторную нуклеиновую кислоту), либо прямо in vivo. Детектирование осуществляли с помощью жидко-сцинтилляционных или гамма-счтчиков, а в случае двумерного распределения (например, нозерн- или саузерн-блотов) - плнок для авторадиографии, фосфоресцирующих экранов или систем цифровой авторадиографии. Обычно измерения распределения радиоактивного соединения в тонком срезе ткани или на саузерн- или нозерн-перепечатках (блотах) нуклеиновых кислот осуществляли с помощью плночной авторадиографии, и этот способ вс ещ остатся общепринятым для работ с высокой степенью разрешения. Однако его недостатками являются ограниченный предел применимости (только 1,5-3 порядка величины) и низкая чувствительность, он является трудомким и точность определений невысока. Системы накопительной визуализации с фосфоресцирующим экраном (storage phosphor screen imaging systems) по сравнению с плночной авторадиографией имеют гораздо большую чувствительность. Их чувствительность для 32 Р выше в 250 раз по сравнению с рентгеновской плнкой, а для 14 С и 35S - в 60-100 раз выше по сравнению с прямой плночной авторадиографией. Линейный динамический диапазон индикации у этих систем составляет 4-5 порядков величины, и методы количественного определения с их помощью дают гораздо более точные результаты, чем плночная авторадиография. Однако зоны с радиоактивностью ниже минимального порога не могут быть точно определены количественно, и это неизбежно ограничивает точность определения распределения радиоактивности. Главная практическая проблема двух последних радиографических способов состоит в необходимости точно определить время экспонирования до получения картины, при этом условии можно избежать как недостаточного экспонирования, так и переэкспонирования. Неправильная оценка времени экспонирования, в особенности для плнки, где время экспонирования достигает нескольких месяцев, может привести к значительной потере времени. Проблемы, связанные с двумя последними радиографическими способами, могут быть в значительной степени разрешены применением цифровых систем с прямым детектированием события. Линейность получаемых результатов в этом случае абсолютна, скорость счта ограничивается только быстро-2 006014 действием электроники, и не требуется точной оценки времн экспонирования, поскольку в любой момент времени можно проверить кумулятивную картину. Даже при том, что геометрическое разрешение у имеющихся систем уступает технике плночной авторадиографии, оно сравнимо с разрешением систем накопительной визуализации с фосфоресцирующим экраном. Однако эти способы не могут различить вклад различных нуклидов, не обладающих моноэнергетическим излучением, и поэтому они не могут быть применены для одновременного количественного определения двух или нескольких различных радиоактивных излучателей в одной и той же ячейке на биологическом микропланшете. Очевидно, что это делает невозможными все применения, где необходимо одновременно сравнивать радиоактивность в нескольких образцах, например, из здоровой клетки и из опухолевой клетки. Поэтому преимущества меченных радиоактивными изотопами нуклеотидов и/или других биологических молекул не могут быть использованы в целом классе важных диагностических и исследовательских применений. Кроме того, насколько известно, существующие способы и устройства для осуществления существующих радиографических способов ограничиваются введением во все молекулы на поверхности единовременно только одного радионуклида и небольшим числом радиоизотопов. Поэтому необходимо иметь общий способ осуществления одновременных определений радиоактивности/интенсивности двух или нескольких различных радионуклидов в каждой ячейке биологического микропланшета. Для одновременного измерения распределения на поверхности нескольких гамма-излучающих радионуклидов может быть применена гамма-камера с параллельным коллиматором. Однако эта камера не может различить структуры с пространственным протяжением в пределах субмиллиметровой шкалы. Задачи изобретения Основная задача данного изобретения - предложить способ и устройство для осуществления одновременного количественного определения и/или сравнения содержания одной или нескольких целевых биологических молекул, отличительным способом помеченных радиоактивными изотопами и затем адсорбированных на подлежащем исследованию расположении биологических молекул, нанеснных на субстрат, причм эти способ и устройство существенно ликвидируют или уменьшают указанные выше проблемы. Дополнительная задача данного изобретения - предложить специфический способ и устройство для одновременного определения двух или более кДНК, помеченных бета-излучающими радионуклидами с различными распределениями энергий, которые затем адсорбированы на ДНК-микропланшете. Сущность изобретения Указанные выше задачи решаются благодаря характерным особенностям изобретения, как они приведены далее в нижеследующем описании и прилагаемой формуле. Задачи данного изобретения могут быть решены применением цифровой системы детектирования,способной (а) регистрировать положение и энергию каждой частицы/каждого фотона, которые достигают поверхности детектора, (b) осуществлять в режиме реального времени обработку и преобразование данных и (с) одновременно оценивать на основании преобразованных данных количества двух или более радионуклидов, присутствующих в пределах произвольно выбранной зоны на поверхности пробы, т.е применением способов, ранее опубликованных двумя из авторов настоящего изобретения [5] и предназначенных для разделения вкладов двух радиоактивных нуклидов в авторадиографическом изображении. Система цифрового детектирования или устройство включает электронный блок для детектирования и визуализации малых радиоактивных образцов, способный регистрировать и записывать привносимую энергию и положение каждой радиоактивной частицы, проникающей в сенсорную систему инструмента. Этот блок является дальнейшим развитием устройства, раскрытого в патентах US 5656818 и ЕР 0983705, поэтому оба патента приведены здесь ссылкой на них. Принцип работы устройства по существу тот же, как и у устройства, раскрытого в цитированных выше патентах. Поэтому здесь датся лишь краткое изложение принципа работы заявляемого устройства, которое можно рассматривать как состоящее из двух основных частей. 1. Двусторонний монолитный полупроводниковый сенсор с полосками, сконструированный в виде одиночной пластины. Эта пластина предпочтительно должна иметь по отношению к биологическому микропланшету площадь поверхности большую или, по меньшей мере, равную. Типичные размеры: площадь поверхности порядка десятка квадратных сантиметров, а толщина около 300 мкм. Поверхность полупроводниковой пластины покрыта с одной стороны параллельными линиями или полосками чувствительного материала р-типа, а другая сторона покрыта параллельными линиями или полосками материала n-типа. Линии n-типа перпендикулярны линиям р-типа. Поэтому в каждой точке пересечения образуется pn-диод, и линии образуют матрицу, которая обеспечивает двумерное считывание места попадания радиоактивной частицы. Это означает, что пока рn-диоды сохраняют способность к обратимому переходу, они будут давать импульс тока в двух пересекающихся перпендикулярно (ортогональных) полосках, с которыми они соединены, при каждом проникновении радиоактивной частицы в объм диода. Шаг полосок обычно составляет около 50 мкм. Таким образом, для чувствительной области размером 6432 мм будет 1280640 полосок, что даст для устройства двумерную рештку с 820000 точками (пиксе-3 006014 лями). Полупроводниковую сенсорную пластину можно изготовить чувствительной ко всем типам радиоактивных частиц, в том числе к , ,и позитронному излучению. В зависимости от уровней энергии и типа радиоактивности можно применять монолитные пластины Si, GaAs, CdTe или CdZnTe и т.п. 2. Электронная система для считывания сигналов с сенсора. Система состоит из окружающих сенсорную пластину многочипных модулей (Multi-Chip Modules, MCM), которые содержат несколько параллельных FE-чипов (специализированных интегральных микросхем - applications specific integratedcircuits - ASIC), каждый из которых снабжн блоком с предусилителем и каналы усиления с фильтрацией шумов. Для каждой радиоактивной частицы, соударяющейся с сенсором, интегрируются и фильтруются сигналы заряда от пары х-полоски и у-полоски сенсора, дающей наибольший сигнал, плюс сигналы с двух или нескольких соседних полосок. Сигналы интегрируются и фильтруются в соответствующих каналах соответствующих FE-чипов, что дат значение энергии частицы. Вообще говоря, когда соударяющаяся радиоактивная частица передат свою энергию, ионизируя материал объма сенсорной пластины,энергия частицы пропорциональна сумме амплитуд регистрируемых сигналов в задействованных полосках сенсорной пластины. Усиленный сигнал от х- и у-сторон считывается с МСМ с помощью системы накопления данных Data-Acquisition-System (DAQ), и в компьютер на выходе поступают координаты х и у ударившейся радиоактивной частицы и энергия события (соударения). Применение этой специфической комбинации твердотельной технологии со встроенной считывающей электроникой позволяет получить высокочувствительное, точное и наджное устройство, регистрирующее положение и энергию каждой радиоактивной частицы, проникающей в сенсорную пластину устройства. Поэтому, приводя сенсорную пластину в тесный контакт с биологическим микропланшетом,можно измерять радиоактивность в каждой ячейке на биологическом микропланшете. Чтобы сделать устройство многосторонним и применимым для различных типов радиации, предусматривается, что устройство снабжается заменяемыми сенсорными пластинами одинакового размера, сделанными из различных монолитных полупроводниковых материалов, которые легко могут быть вставлены во встроенную считывающую электронику. Так, например, если используется сенсорная пластина, изготовленная из силикона, хорошо регистрирующая -излучение, а затем необходимо исследовать биологический микропланшет с меткой -излучателями, устройство может быть мгновенно приспособлено для этого заменой силиконовой сенсорной пластины на сенсорную пластину состава кадмий-цинк-теллур, которая хорошо реагирует на -излучение. В процессе регистрации стеклянную пластину микропланшета плотно прижимают лицевой стороной вниз к полупроводниковой пластине устройства, разделяя их плнкой из майлара (полиэтилентерефталата) толщиной 1,3 мкм. В итоге детекторная система, благодаря двумерному расположению е рnдиодов, регистрирует как энергию входящей радиоактивной частицы, так и место на биологическом микропланшете, из которого она вылетает. Это подразумевает, что суммарная интенсивность излучения должна быть достаточно низкой, чтобы устройство могло регистрировать раздельно каждый акт излучения. Максимальная активность поверхности, которую можно наджно измерять, находится в интервале от активности космического излучения (примерно 1 Бк) до 10 МБк, однако, для многих практических приложений предпочтительно ограничение величиной 4-6 МБк. Однако в случае -излучателей имеется общая проблема, касающаяся сравнения и/или одновременного определения активности, так как их излучение имеет несколько уровней энергии и обычно образует непрерывный энергетический спектр. Это означает, что если даже применяются два радиоактивных изотопа, излучающих -частицы с хорошо различающимися средними энергиями, по энергии регистрируемой частицы невозможно прямо определить из которого из двух изотопов происходит регистрируемая частица. Однако спектры энергий двух изотопов могут быть измерены для каждого радионуклида в отдельности, и эти спектры могут быть использованы для разделения вкладов каждого изотопа, если только эти изотопы имеют достаточно различающиеся спектры. В способе согласно настоящему изобретению энергетические спектры изотопов получают, разделяя весь интервал энергий испускаемых -частиц на kmax дискретных каналов энергии, где kmax - целое положительное число, предпочтительно больше 20. Это значит, что для каждого участка r поверхности пробы определяется, к какому каналу энергии принадлежат регистрируемые -частицы. Это означает, что для изотопов в каждом участке подлежащей исследованию поверхности реальный энергетический спектр заменяется представлением в виде дискретного распределения (вектора) В результате обработки данных в режиме реального времени и возможного их последующего преобразования, устройство в конце установленного заранее периода измерения дат визуализационную информацию в форме изображения, содержащего к линий энергии (изображение линий энергии), аналогично цветовому представлению, содержащему эти линии в виде красного, синего, зеленого цвета и т.д. Один элемент изображения каналов энергии, обозначенный как Ei,j,k, содержит число частиц внутриk-го канала энергии, которые зарегистрированы в цифровых координатах i, j. Для каждого участка изображения r регистрируемая гистограмма дискретных значений энергии яв-4 006014 ляется линейной комбинацией известных спектров энергии каждого из реальных радиоактивных изотопов. Далее способ будет иллюстрирован для того случая, когда применены два изотопа, но следует иметь в виду, что способ может быть применн при любом числе изотопов. Если известные энергетические спектры включены с такими же интервалами энергий, как и использованные для получения изображения каналов энергии, и нормированы таким образом, что сумма по всем каналам равна 1, тогда расчты могут быть выполнены следующим образом. Пусть sAk и SBK обозначают значения энергии в канале k, полученные для чистых образцов изотопов соответственно А и В. Далее, пусть аr и br представляют собой неизвестные вклады изотопов А и В (полное число зарегистрированных вылетов частиц) в участке r. Важно, чтобы каналы энергии референтных спектров были идентичны каналам, использованным в ходе обработки данных при реальном измерении,ведущем к получению изображений каналов энергии (Еrk). Тогда(1) Эти соотношения можно применить в одном из упомянутых выше алгоритмов из статьи [5] для определения вкладов аr и br для каждого участка поверхности пробы. В статье предложены два основных алгоритма - метод наименьших квадратов (least square, LS) и метод максимальной вероятности (maximumlikelihood, ML). Оба алгоритма включены в настоящее описание посредством ссылки, и необходимо только сказать, что LS-алгоритм наиболее прост и требует значительно меньшей компьютерной мощности, чем ML-алгоритм, однако, дат несколько большую неточность оценок. В итоге в нижеследующем обсуждении внимание сосредоточено на LS-алгоритме, но подчркивается, что в настоящее изобретение включены оба алгоритма. В принципе LS-алгоритм работает следующим образом. Задача состоит в том, чтобы определить,какие вклады аr и br дают наименьшую суммарную ошибку Sr во всм интервале, где Sr определяется как Минимумы определяются по условию Как уже упоминалось, способ приведн здесь для определения вклада каждого из двух изотопов. Однако способ можно применить для любого числа изотопов, просто добавляя в уравнения член типаSCkcr для каждого добавочного изотопа. На практике способ применяется следующим образом. Для каждой точки (пересечения) ij сенсорной пластины в системе памяти устройства устанавливается распределение (вектор) Eijk с числом каналовkmax. Полный набор данных Eijk первоначально устанавливается равным нулю. Когда точка с координатами х,у регистрирует -частицу, х,у-отсчт с соответствующим номером канала k увеличивается на единицу. Этот процесс продолжается до тех пор, пока не будет зарегистрировано достаточное число событий для статистически достоверного представления спектра энергий, который затем используется в одном из алгоритмов для определения вклада изотопов А и В в зарегистрированную гистограмму распределения энергий в каждом участке r подлежащей исследованию поверхности. Чтобы получить устройство, легко приспосабливаемое для широкого круга применений, устройство снабжают сенсорной пластиной с очень высокой степенью разрешения, содержащей большое число точек. В итоге во многих применениях разрешение биологического микропланшета будет грубее, чем разрешение сенсорной пластины. В этих случаях можно получить значительную экономию компьютерного времени, если сгустить (сжать) зарегистрированные данные от соседних точек, добавляя их к данным центральной точки. Это означает, что добавляя, например, зарегистрированные события в одной точке и во всех окружающих е ближайших соседних точках (всего 9 точек) к событиям в центральной точке,получают уменьшение разрешения и, следовательно, сокращение числа вычислительных операций в 9 раз. Если требуется ещ более грубое разрешение, можно объединить данные всех соседних точек в двух окружающих рядах (всего 25 точек) и так далее. Таким образом имитируется снижение разрешения сенсора и, соответственно, уменьшение числа необходимых вычислительных операций. Пространственное сжатие в объединнные участки дат также важное увеличение числа регистрируемых событий для каждого элемента Erk в полученном конденсированном изображении линий энергии, что приводит к повышению статистической точности оцениваемых вкладов. Кроме того, данный способ требует хорошего знания ожидаемого спектра энергий каждого реального радионуклида. Этого можно достигнуть, калибруя устройство с помощью распределнных по поверхности источников каждого из реальных радионуклидов перед определением неизвестного образца. Процедура калибровки вводится в устройство в виде автоматического процесса, где измеренные спектры получают для каждой из полос на одной стороне (х-стороне) сенсорной пластины. Определяя первое и второе события в этих спектрах, можно получить их начальный наклон и прирост по сравнению с референтной полоской (важно отметить, что для процедуры калибровки энергии, вносимые в соседние полоски, не принимаются во внимание). Эти калибровочные данные затем можно использовать в реаль-5 006014 ном времени для введения поправок в энергию каждого зарегистрированного радиоактивного события. Кроме того, эта калибровочная процедура позволяет избежать проблем, связанных с внешними источниками фотонов (гамма-источниками), где рассеянное излучение изменяет спектры. Поскольку стеклянная пластина, несущая биологический микропланшет, может немного поворачиваться относительно главных осей устройства, угол поворота можно определить так, что ячейки на микропланшете образуют на изображении в точности вертикальные и горизонтальные ряды и колонки. Определить оптимальный угол можно следующим образом. Суммарное изображение получается объединением всех линий в представлениях линий энергии Eijk, т.е. суммированием по всем значениям k. Затем это изображение поворачивают с интервалами в 0,1, и для каждого нового угла рассчитывается проекция изображения на оси соответственно х и у. Оптимальный угол поворота соответствует максимуму отклонения (т.е. максимальному отклонению в противоположные стороны). Проекцию легко использовать для определения самого верхнего, самого нижнего, самого левого и самого правого положений в матрице. Таким образом легко идентифицировать испытуемую ячейку и соответствующую область, этой ячейкой занятую. Вследствие этого можно создать новое изображение линий энергии, где каждая точка соответствует области, занятой одной испытуемой ячейкой. Это существенно повышает статистическую точность конечных результатов. Внешние границы матрицы можно также определить, устанавливая корреляцию между реальной и виртуальной матрицами. Преимущество такой процедуры состоит в отсутствии необходимости участия пользователя. Эти способ и устройство описаны в форме общего подхода, пригодного для одновременных определений вклада более чем одного радиоактивного изотопа в регистрируемый спектр энергий, который является наложением неизвестных количеств каждого изотопа. Очевидно, что этот способ необходим в случае -излучателей, так как они имеют перекрывающиеся спектры энергий, но, как кажется, не нужен для других типов излучения, более моноэнергетических по природе и дающих сильно различающиеся спектры энергий, не перекрывающиеся друг с другом. Однако способ по настоящему изобретению может иметь преимущества даже в таких случаях, так как этот способ позволяет применять радиоактивные изотопы, испускающие фотоны или частицы с малыми различиями в энергиях, так как он разделяет энергетические вклады с возможным перекрыванием. Кроме того, данный способ автоматически решает проблему вторичной регистрации вследствие фонового излучения и неизбежного рассеяния и поэтому обеспечивает высокую точность результатов. Эта особенность является очевидным преимуществом при всех типах излучения. Краткое описание графических материалов Фиг. 1 а дат схематическое изображение сенсорной пластины с полосками и схематическое представление двумерного расположения pn-пересечений (диодов); фиг. 1b является графическим представлением, показывающим типичное распределение измеренной внеснной энергии в полосках в окрестности места соударения на сенсорной пластине. На чертеже радиоактивная частица ударяет сенсорную пластину в точке, обозначенной крестиком, и заканчивает пробег в точке, указанной стрелкой; на фиг. 1 с представлена блок-схема, иллюстрирующая один канал усилителя; на фиг. 1d схематически представлены сенсорная пластина и соединнная с ней электроника для определения места соударения и энергии радиоактивной частицы; на фиг. 2 представлена схематическая иллюстрация предпочтительного применения изобретения в случае одновременного определения двух или нескольких кДНК, которые помечены -излучающими радионуклидами с различными энергетическими распределениями и затем адсорбированы на ДНКмикропланшете; фиг. 3 представляет собой блок-схему, схематически иллюстрирующую преобразование данных для выделения вклада каждого радиоизотопа; фиг. 4 представляет собой диаграмму, показывающую спектры энергий изотопов 33 Р и 35S, измеренные устройством по настоящему изобретению с помощью реального числа интервалов энергии (каналов энергии); фиг. 5 показывает проекцию на ось х результата определения образца спермы лосося с введением меток 33 Р и 35S как раздельно, так и вместе; фиг. 6 показывает виртуальное распределение флуорофора в одновременном определении линий меченной 33 Р и 35S РНК из клеток соответственно остеосаркомы OHS и рака молочной железы MCF-7. Сведения, подтверждающие возможность осуществления изобретения Далее изобретение будет подробно описано со ссылкой на прилагаемые чертежи и пример предпочтительного осуществления данного изобретения. Как указывалось выше, устройство для регистрации места удара и энергии проникающей радиоактивной частицы состоит из двух частей: двусторонней сенсорной пластины с пересекающимися под прямым углом (ортогональными) полосками и окружающей е считывающей электроники, измеряющей поступивший сигнал, генерированный сенсорной пластиной при вхождении радиоактивной частицы. На фиг. 1 а схематически представлена сенсорная пластина 2, где показано расположение ортого-6 006014 нальных полосок на обеих сторонах сенсорной пластины и образование pn-соединений (диодов) внутри сенсорной пластины в точках пересечения полосок. Сенсорная пластина в общем случае представляет собой хорошо известное устройство, применяемое в основном в детекторах для физических исследований. В случае регистрации -излучений это прямоугольный кусок, вырезанный из обработанной силиконовой рельефной пластины (вафли) с высоким электрическим сопротивлением. Обычно она имеет толщину 300 мкм и площадь несколько десятков квадратных сантиметров. На практике более конкретный пример представляет собой пластину размером 6,43,2 см. Через вафлю с обеих сторон вмонтированы узкие полоски с низким электрическим сопротивлением. Полоски на одной стороне ортогональны полоскам на другой стороне, и имплантат на одной стороне представляет собой Р+, тогда как имплантат на другой стороне представляет собой N+. Обычно полоски находятся на расстоянии 50 мкм друг от друга, что при указанных выше размерах пластины даст 1280 полосок на одной стороне и 640 полосок (расположенных ортогонально) на другой стороне. Вследствие имплантирования полосок P+/N+, каждое пересечение полосок представляет собой соединениеP+/N+ (рn-), что означает образование в каждом пересечении небольшого диода. В свою очередь, это означает, что в данном примере устройство будет представлять собой двумерное расположение 1280640 pn-соединений (диодов). Это дат устройство, способное различать местоположение (давать изображение). Чтобы диоды стали активными, необходимо приложить переходную разность потенциалов между полосками на одной стороне и полосками на другой стороне. Переход должен быть отрицательным(негативным) на стороне Р+, чтобы обеспечить в диодах обратный переход. Теперь диоды будут переврнуты в обратном направлении, и будет идти лишь небольшой ток утечки. Когда радиоактивная частица испускается из вещества образца и попадает в сенсорную пластину,она проникает в объм сенсора (между ортогональными полосками) и при прохождении отдат свою энергию внутри кристалла. В большинстве случаев, связанных с практическим применением сенсора,она отдат всю свою энергию и в конце концов останавливается. Отданная энергия вызывает ионизацию объма с расположенными в нм переврнутыми диодами. В зависимости от угла проникновения, движущаяся частица затронет и ионизует объм одного или нескольких диодов. Каждый затронутый диод отреагирует на ионизацию высвобождением заряда, пропорционального энергии, отданной частицей этому диоду. Таким образом, суммируя заряды, высвобожденные всеми задействованными диодами,можно сказать, какую энергию первоначально имела проникшая частица. Следовательно, двусторонние детекторы становятся детектирующим устройством, способным измерять как положение индивидуальных ударяющих частиц, так и их энергию. Большинство частиц будет проникать в сенсор под определнным углом, то есть не перпендикулярно плоскости (см. фиг. 1b). Тогда в общем случае частица имеет достаточную энергию, чтобы пройти некоторое расстояние под некоторым углом, и, следовательно, е путь будет пролегать через объм нескольких диодов. Структура пересекающихся полосок не позволяет точно определить, какие это диоды,поскольку считывание сигналов с полосок дат только проекцию этих диодов на оси х и у. Это значит,что можно идентифицировать прямоугольник, содержащий задействованные диоды. Для настоящего изобретения такая идентификация важна, так как она помогает идентифицировать точку, в которой частица проникает в сенсор, и таким образом повысить качество изображения. Как указывалось, важно также измерить энергию сигнала. Полная энергия находится суммированием сигналов от полосок. Однако распределение энергий по полоскам также важно, так как это необходимо для окончательной идентификации точки вхождения частицы. Вследствие физических свойств, движущаяся в объме частица максимально ионизует материал при остановке. Это значит, что полоски, где измеряется наивысшая энергия, дадут проекцию положения точки остановки и, следовательно, эта информация позволит определить точку вхождения. Силиконовый сенсор бесполезен, если нет возможности считывать в компьютер сигналы зарядов полосок. Это осуществляется окружающей считывающей электроникой, которая создана, чтобы осуществлять определение конкретных свойств описанного выше сенсора. Минимально необходимая конфигурация электроники в применении к сенсору состоит в том, чтобы каждая полоска имела присоединнный усилитель, чтобы преобразовать генерированный в сенсоре сигнал в доступную для измерения разность потенциалов на выходе усилителя. Изменение разности потенциалов на выходе усилителя будет пропорционально величине заряда, высвобожденного диодом (диодами), соединнным (соединнными) с полоской, и, следовательно, пропорционально энергии, отданной частицей в пространство вблизи данной полоски. На фиг. 1b дана иллюстрация того, как усилители измеряют отдачу энергии частицей. Частица вошла в сенсорную пластину в точке, указанной крестиком. Затем она движется вниз, что не указано,однако, обычно она имеет горизонтальную составляющую перемещения, указанную стрелкой. Задействованные полоски дадут на выходе присоединнного усилителя разность потенциалов с амплитудой (V),соответствующей энергии (Е), переданной конкретным полоскам. Амплитуды сигналов от полосок в данном примере представлены вертикальными колонками. Сумма колонок на одной стороне представляет собой полную величину отданной частицей энергии, а наивысшая колонка может быть использована,как указывалось выше, для идентификации конечной точки движения частицы.-7 006014 Следует подчеркнуть, что в примере показано очень немного полосок. На самом деле число полосок велико, но типичное число вовлечнных полосок близко к числу, использованному в данном примере. Это значит, что данный способ можно использовать для резкого улучшения пространственного разрешения, однако, это выгладит иначе, чем представлено в данном примере. Во многих применениях достаточно приемлемо определение лишь одной полоски из затронутых частицей. Чтобы электроника была пригодна для ввода сигналов от полосок в компьютер, за каждым усилителем должны следовать параллельно триггерная ячейка и измеряющая амплитуду ячейка. Это проиллюстрировано на фиг. 1 с. Первая ячейка, содержащая дискриминатор с предварительно заданным порогом,дат системе сигнал о том, что частица была обнаружена. В другой ячейке, содержащей запоминающее устройство (ячейка хранения данных, sample/hold, обозначенная на чертеже S/H), хранится значение амплитуды разности потенциалов, зависящее от энергии частицы. На фиг. 1d показано полное построение окружающей электроники, которая осуществляет перенос в систему точных данных, генерированных частицей. Обе стороны сенсора снабжены электроникой одинакового типа, которая обычно встроена в ASIC. По размеру ASIC может содержать только ограниченное число каналов, поэтому несколько ASIC могут быть расположены друг за другом, чтобы полностью закрыть одну сторону сенсора (все полоски). Показанная вслед за каналами электроника встроена в один чип, как здесь, но устроена таким образом, что если параллельно используется несколько чипов, она будет работать так, как если бы вся она располагалась в одном чипе. Следовательно, пример может трактоваться так, как если бы вся электроника с одной стороны сенсора была встроена в один ASIC. Функция такого ASIC состоит в следующем. Все каналы параллельно воспринимают сигналы от полосок. Когда частица ударяется в сенсор, один из каналов регистрирует это своей триггерной ячейкой. Один и тот же сигнал может в действительности быть обнаружен несколькими каналами, но внутреннее сопоставление обеспечивает то, что только один канал сработает. После такого обнаружения сигнал триггера будет послан во внешнюю систему (не описанную здесь), давая ей инструкцию на считывание данных с чипа. В ходе этого действия чип даст системе положение (адрес) канала, который вызвал срабатывание триггера. Затем он также даст системе амплитуды сигналов от нескольких полосок вблизи центра взаимодействия. Последовательно будут перенесены аналоговые величины, начиная с амплитуды в том канале, который генерировал переход триггера, затем продолжая амплитудой сигнала со следующей полоски в одном из направлений, и так далее. Одновременно со считыванием в одном из направлений и начиная с той же самой точки, производится считывание с полосок в противоположном направлении. Такая концепция обеспечивает быстрое считывание и гибкость. Гибкость обеспечивается тем фактом,что нет необходимости сканировать все полоски, но только расположенные возле запускающей триггер полоски. Как указывалось выше, обычно их очень немного. Система может выбирать, сколько полосок она предпочитает считывать. Часы системы синхронизуют перенос данных. В ходе переноса значений амплитуды адрес позиции может оставаться, а может и не оставаться на шкале позиций. Другая сторона сенсора будет иметь идентичную структуру и функционировать точно таким же образом, как и только что описанная сторона. Чтобы накопить необходимую информацию о расположении,будет необходимо считывание с обеих сторон. Присоединение описанной выше сенсорной пластины и считывающей электроники к блоку накопления данных и компьютерному блоку, загруженному программой, которая способна выполнять один или оба алгоритма, описанных в [5], дат предпочтительное осуществление способа настоящего изобретения для определения на микропланшете вклада каждого радиоактивного изотопа, которое схематически может быть представлено, как на фиг. 2 и 3. Пример приведн для случая определения активности молекул ДНК, помеченных двумя различающимися -излучателями и адсорбированных на ДНКмикропланшете. Как обсуждалось выше, спектры энергий двух радионуклидов будут существенно различаться и иметь соответствующие параметры распада и энергетические уровни, что позволит охарактеризовать -излучения за приемлемый интервал времени. Двумя приемлемыми для этой цели радионуклидами являются 33 Р и 35S. Спектры энергий чистых образцов этих изотопов приведены на фиг. 4. На фиг. 2 стеклянная пластина с ДНК-микропланшетом, содержащим метку неизвестными количествами радиоактивных -излучателей 33 Р и 35S, отмечена цифрой 1. Стеклянная пластина переврнута и прижата к квадратной монолитной полупроводниковой сенсорной пластине 2, выполненной из силикона таким образом, что она покрывает ДНК-микропланшет. Сенсорная пластина 2 и ДНК-микропланшет разделены фольгой из майлара толщиной 1,3 мкм (не показана). Таким образом, когда -частица испущена одним из радионуклидов, она ударит в сенсорную пластину 2 и вызовет небольшой импульс тока вpn-диоде, лежащем практически над радионуклидом, испустившим -частицу. Считывающая электронная система 3 устройства зафиксирует положение (координаты х,у) пересечения полосок и, таким образом) точную ячейку на ДНК-микропланшете, откуда испущена -частица. Электронная система измерит также энергию -частицы и пошлт эту информацию в цифровой форме в блок сбора данных 4, который накапливает все зарегистрированные события и организует их в соответствии с зарегистрированными положением и энергией. Блок сбора данных 4 может представлять собой любой подходящий блок хране-8 006014 ния цифровой информации, такой как чипы памяти RAM, винчестер, гибкий диск, компакт-диск CDROM и т.д. Когда блок сбора данных получит достаточно данных для проведения статистически достоверного анализа, т.е. элементы Eijk будут нести достаточно информации, регистрация событий на сенсорной пластине останавливается. После этого зарегистрированное изображение спектральных линий энергетического спектра представляет собой входную информацию для программного обеспечения, которое путм применения одного из алгоритмов, описанных в [5], определяет количества каждого изотопа для каждого пересечения, или,после описанного ранее объединения событий (конденсации), в каждой ячейке микропланшета. Иными словами, алгоритм определяет, какое количество (с каким числом зарегистрированных событий) каждого радионуклида дат вклад в Еijк, или, в случае большей ячейки, в Erk. Конечно, для точного количественного определения необходимо знание периода полураспада каждого радионуклида, а также чувствительности детектора для данного радионуклида (числа регистрируемых событий на единицу радиоактивности на поверхности). Эта процедура схематически представлена в высветленном прямоугольнике на фиг. 2 и 3. На фигурах представлен случай с двумя -излучающими радионуклидами, определение которых производится с помощью алгоритма наименьших квадратов, и конденсация перекрестий производится с множителем 9 (к центральной точке добавляются все окружающие точки в одном слое). Одно из преимуществ данного способа состоит в том, что количество каждого изотопа в каждой ячейке измеряется в абсолютных величинах. Это дат несколько возможностей для представления информации. Одна возможность в случае двух изотопов состоит в определении соотношения изотопов в каждой ячейке и введении этих значений в виртуальную карту, представляющую биологический микропланшет. Другая возможность состоит в имитации в едином изображении цветов, полученных при применении техники с сочетанием красного и зелного флуорофоров. Отображая интенсивность изображения одного из радионуклидов красным цветом, а интенсивность другого - зелным цветом, получают цветную шкалу смешения красного и зелного цветов в разных соотношениях. Можно также получать распределения в виде гистограмм, показывающие абсолютные количества каждого радионуклида. Определение абсолютных количеств РНК Возможность выполнения предпочтительного осуществления способа и устройства будет далее продемонстрирована для случая определения абсолютных количеств РНК, меченной известными количествами 33 Р и 35S. После калибровки инструмента и до измерений на ДНК-микропланшете измеряли по отдельности спектры 33 Р и 35S следующим образом. Растворы радионуклидов равномерно распределяли по стеклянным пластинкам и высушивали. Изображения множественных линий энергии, полученные от этих пластинок, имели размер шага 15 кэВ, и имелось 20 каналов, начиная с нижнего порога 20 кэВ. Спектры получали, используя одни и те же размеры каналов и число каналов, и предполагали, что спектры не зависят от положения детектора, поэтому изображения полностью давали вклад в спектры. Для каждого пересечения (или точки) неизвестные вклады Р и S соответственно от 33 Р и 35S определяли с помощью регрессионного анализа, а также методом максимальной вероятности (Maximum Likelihood procedure). Полученные изображения Р и S выводились на дисплей как одно изображение способом, обычно применяемым для представления изображений, полученных с флуорофорами. Изображение фосфора (Р) передавалось в красном канале дисплея, а изображение серы передавалось по зелному каналу. Таким образом, равные количества красного и зелного цветов давали жлтый цвет. Во всех примерах ДНК-планшеты получали по следующей процедуре. Покрытие Для отпечатывания были использованы микроскопные предметные сткла от J. Melvin Freed Brand(фирма Sigma, по каталогуS-8902) размером 7525 мм, предварительно отмытые и покрытые поли-Lлизином. Сткла покрывали полилизином следующим образом. Погружали их в раствор NaOH/EtOH (75 г NaOH, 300 мл бидистиллированной воды - ддН 2 О и 450 мл 96% ЕtOН) на 2 ч в орбитальном встряхивателе, затем переносили в воду высокой чистоты (бидистиллированную, ддН 2 О) и окунали их, не менее 10 раз перемещая вверх и вниз, до полной очистки поверхности. Затем сткла несколько раз промывали со встряхиванием в ддН 2 О и вымачивали в растворе поли-L-лизина (40 мл поли-L-лизина, 40 мл забуференного фосфатом солевого раствора PBS и 300 мл ддН 2 О) на орбитальном встряхивателе в течение 1 ч. Наконец, сткла несколько раз промывали ддН 2 О, сушили в центробежной сушилке (500 rcf в течение 5 мин) и выдерживали 1 ч при 55 С. После этого сткла до отпечатывания выдерживали не менее 2 недель при комнатной температуре для созревания. Отпечатывание Для печатания на планшете использовали робот собственной конструкции, изготовленный по описанию P. Meltzer из Национального института здоровья (NIH). Использовали штампы с иглами из расщеплнного графита фирмы Beecher Inc., перепечатывая в одной операции 48 сткол 8 штампами (24). Иглы промывали, погружая их на 2 мин в 1 М NaOH, затем на 2 мин в 2% додецилсульфат натрия (SDS),ополаскивая ддН 2 О. Затем их подвергали кратковременной обработке ультразвуком в течение 10 с, снова-9 006014 промывали ддН 2 О и высушивали сжатым воздухом. ДНК перепечатывали прямо из планшетов на 96 ячеек фирмы Costar (полистирольные планшеты, ячейки с U-образным дном,по каталогу 3367). В ячейках этих планшетов осаждали ДНК - продукты полимеразной цепной реакции (ПЦР) и растворяли их в 25 мл стандартного раствора NaCl с Na-цитратом 3-кратной концентрации (3SSC). Перепечатывание проводили при влажности около 50%. В течение операции перепечатывания температура была приблизительно 27-30 С. Работали с планшетами, содержащими 2200-2700 генов. Последующая обработка Для пришивки ДНК к поли-L-лизину сткла облучали УФ-светом при дозе 100 мДж. Блокирующий раствор готовили, растворяя при перемешивании 6,0 г янтарного ангидрида в смеси 335 мл 1-метил-2 пирролидона и 15 мл 1 М борной кислоты (рН 8,0). Сткла погружали в этот раствор и на 15-20 мин помещали во вращательный встряхиватель. Затем сткла промывали ддН 2 О, погружали на 2 мин в горячую(95 С) воду и переносили на 30 с в холодный 96% ЕtOН. После этого сткла высушивали (500 rcf в течение 5 мин) и хранили готовыми к использованию. Пробы радиоактивных кДНК для всех опытов готовили по нижеследующей прописи. Перевод 2-5 мкг валовой РНК в меченую 33 Р/35S первичную нить кДНК Для включения радиоактивности использовали [-33P]dATP (10 мКи/мл, фирма Amersham Pharmacia Biotech,по каталогу АН 9904) и [-35S]dАТР (10 мКи/мл, фирма Amersham Pharmacia Biotech,по каталогу AG1000). Во льду готовили реакционную смесь для обратной транскрипции (RT) следующего состава. Реакционный буфер 5-кратной концентрации для получения первичной нити 4,0 мкл Однонитевая РНК (RNAsin) 0,5 мкл Дитиотреитол (DTT) 100 мМ 2,0 мкл Закрепленный (anchored) олиго(дТ) 2 мкг/мкл 1,0 мкл 20-кратно разбавленная смесь дА/NTP 4,0 мкл[-33P]dATP/[-35S]dАТР 4,0 мкл Валовая РНК 5 мкг + Н 2 О 6,5 мкл Всего 19,0 мкл Реакционную смесь инкубировали при 65 С в течение 5 мин, затем охлаждали в течение 5 мин до 42 С. Добавляли 1 мкл раствора фермента Superscript II и продолжали инкубацию ещ 30 мин при 42 С. Добавляли ещ 1 мкл раствора фермента Superscript II и инкубировали дополнительно 30 мин при 42 С. Реакцию останавливали добавлением 5 мкл 500 мМ этилендиамин-тетраацетата (EDTA), добавляли 10 мкл 1 М NaOH и инкубировали смесь при 65 С в течение 60 мин, чтобы гидролизовать РНК. После этого смесь охлаждали до комнатной температуры и добавляли 25 мкл 1 М трис-HCl (рН 7,5) для нейтрализации раствора. Полученные пробы хранили во льду до очистки. Очистка и приготовление проб Очистку проб проводили с помощью колонок Microcon. К каждой реакционной смеси RT добавляли 300 мкл буфера ТЕ стандартной концентрации (1 ТЕ). Два образца с различными метками объединяли,переносили в колонку Microcon и центрифугировали при 13000 об./мин, пока не набирался объм 30-50 мкл раствора. После повторных добавлений пробы и центрифугирований получали конечный очищенный раствор объмом 10 мкл. Колонку помещали в переврнутом положении в другую центрифужную пробирку и центрифугировали 1 мин при 13000 об//мин для извлечения пробы. В пробе конечного объма 18 мкл (для размера покровного стекла 2220 мм) содержалось: 1 мкл раствора СОТ-1 ДНК 10 мкг/мкл, 1 мкл раствора поли(А) 8 мкг/мкл, 1 мкл раствора дрожжевой тРНК 4 мкг/мкл, 1 мкл раствора бычьего сывороточного альбумина (BSA) 10 мкг/мкл, 1 мкл раствора Денхардта 50-кратной концентрации, 3,1 мкл 20SSC (конечная концентрация 3,5SSC) и 0,5 мкл 10% SDS (конечная концентрация 0,3%). Пробу затем нагревали в кипящей водяной бане в течение 2 мин и после этого центрифугировали при 13000 об./мин в течение 10 мин. Пример 1. Чтобы продемонстрировать осуществимость способа и устройства настоящего изобретения, был осуществлн модельный опыт с двумя изотопами 33 Р и 35S, разбавленными в образце ДНК спермы лосося и нанеснными в виде пятнышек на стеклянную пластинку так, чтобы каждое пятнышко без разбавления препаратов давало излучение примерно 1 Беккерель (Бк). Дополнительно делали серию разбавлений с диапазоном 5 логарифмов, чтобы продемонстрировать предел применимости способа и устройства настоящего изобретения. Это было сделано как для каждого изотопа в отдельности, так и для их комбинации. Были получены две рештки пятнышек с расстоянием между их центрами 250 мкм и 400 мкм. Результат всех трх опытов представлен на фиг. 5, как в виде распределения флуорофора, так и в форме спектра зарегистрированной энергии и проекции сигнала на ось х, чтобы показать количественное соответствие разбавлению. Пример 2. Чтобы проверить применимость способа и устройства настоящего изобретения в работе с примене- 10006014 нием микропланшетов, был проведн опыт с использованием сниженных количеств РНК из двух линий клеток. Были применены иным образом выполненные стандартные процедуры с микропланшетами. При использовании РНК из двух различных линий клеток - линии клеток остеосаркомы OHS и линии клеток рака молочной железы MCF-7 продемонстрировано успешное разделение нуклидов. Оно представлено как распределение флуорофора в форме перекрывающегося псевдоцветного изображения двух изотопов на фиг. 6. На фигуре ясно видно, что способ и устройство настоящего изобретения обеспечивают получение такого же предела применимости сигналов, какой можно ожидать из подобных опытов с использованием флуорофоров, но со значительно меньшим количеством исходного материала РНК. Как упоминалось, радиоактивно меченные биологические вещества, в отличие от большинства флуоресцирующих веществ, легко включаются в живые клетки. Это можно осуществить, добавляя составляющие питательной среды, такие как нуклеотиды, аминокислоты или другие компоненты, в которые предварительно были введены радиоактивные изотопы. Эта возможность открывает путь для широкого круга новых применений, два из которых описаны здесь. Пример 3. Количество любого белка в клетке частично зависит от стабильности соответствующей ему РНК. Считается, что в основном это связано с размером хвоста поли(А), а частично - с другими специфическими к нуклеотидной последовательности факторами. До настоящего времени имелись способы исследования индивидуальных видов мРНК. Введение двух радиоактивных меток делает возможным мониторинг всех видов мРНК в популяции путм сопоставления со стандартом. Это позволяет, при комбинации с ДНК-микропланшетами, широкое сканирование времн полужизни РНК по всему геному. Вместо использования кДНК с радиоактивностью в ферментативной реакции в бесклеточной системе, добавляют в момент времени 0 в культуральную среду параллельных культур клеток [-35S]UTP и[-33P]UTP в нужной концентрации. Затем клеткам дают расти до момента времени 1, когда включение радиоактивных нуклеотидов достаточно для обнаружения РНК, продуцированных в клетках от момента времени 0. В момент времени 1 одну из параллельных культур подвергают химической обработке для блокирования синтеза РНК. В момент времени 2 клетки обеих культур собирают, выделяют из них РНК и смешивают равные количества РНК из обеих культур. Эту смесь используют для получения объединнной пробы кДНК, как описано в примере 1, и гибридизируют на микропланшете. В конце регистрируют и анализируют сигналы, чтобы найти вклад каждого нуклеотида с целью определить их отношения. Эти данные отражают относительное время полужизни всех видов РНК, доступных для обнаружения в линии клеток. Новый способ позволяет осуществить в сочетании с традиционной информацией, получаемой путм анализа на микропланшетах в стандартном формате, широкий мониторинг в пределах генома важной для клетки регуляторной функции полужизни РНК. Пример 4. Способы, подобные тому, который был описан в примере 3, могут быть применены в развивающейся области протеомики, если использовать аминокислотные ярлыки (метки). Например, вводя радиоактивно меченные ярлыки, добавляемые в питательную среду, можно осуществить, например, мониторинг различных степеней фосфорилирования белков - главного регулирующего явления во всех клетках. Производя перепечатки антител на микропланшеты, можно одновременно проследить за включением меченных фосфором аминокислотных ярлыков в большое число различных белков. Хотя настоящее изобретение было описано как случай примеров тестов сравнения двух веществ ДНК/РНК, каждое из которых помечено своим -испускающим радионуклидом, следует иметь в виду,что способ и устройство настоящего изобретения составляют общий подход к определению количеств радиоактивности, метящей биологические молекулы, которые адсорбированы на биологическом микропланшете. Он применим ко всем типам радиоактивности, включая -, -, - и позитронное излучения и все радиоактивные нуклиды, особенно такие, которые могут быть внедрены в целевые молекулы таким образом, что радиоактивность от каждого пятна на микропланшете задана в пределах 1-100 Беккерелей. Кроме того, даже хотя способ особенно пригоден для случая радиоактивных источников с перекрывающимися спектрами энергий (-излучатели), следует сознавать, что статистическая обработка зарегистрированных радиоактивных событий в данном способе дат преимущества также и для моноэнергетического излучения, особенно когда применяются радионуклиды, испускающие радиацию с малыми различиями в энергии. Эти преимущества включают великолепную фильтрацию/отделение фонового шума (вторичное излучение и т.п.) и очень высокую чувствительность. Способ и устройство разработаны также так, что они могут быть применены для любого числа различных радиоактивных нуклидов, начиная от 1,и выше. Для этого числа не существует теоретических пределов, но на практике предел составляет менее чем приблизительно 20, предпочтительно меньше чем приблизительно 10 и даже ещ более предпочтительно менее чем приблизительно 5 различных радиоактивных нуклидов. Литература 1. Wang E., Miller L.D., Ohnmacht G.A., Liu E.T. "High-fidelity mRNA amplification for geneChem. Soc. 1998. т. 120. с. 8281-8282. 5. Kvinnsland Y., Skretting A. "Methods for separation of contributions from two radionuclides in autoradiography with a silicon strip detector"//Phys. Med. Biol. 2000. т. 45. с. 1183-1193. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ одновременного количественного определения содержания одного или нескольких радиоактивных нуклидов в произвольных участках на подлежащей исследованию поверхности, где эти нуклиды были помещены, адсорбированы или зафиксированы, причм каждый из радиоактивных нуклидов является маркером на соединениях, которые были включены в целевые участки ткани, целевые химические соединения или биологические целевые молекулы, которые были нанесены, адсорбированы или связаны с химическими зондовыми веществами на поверхности для исследования, характеризующийся тем, что регистрируют как координаты, так и энергию частиц и/или фотонов, испускаемых из каждого участка подлежащей исследованию поверхности, и данные регистрации хранят и регистрирование продолжают для формирования энергетического спектра зарегистрированных событий на каждом участке, и регистрируемую информацию с каждого участка применяют для определения в абсолютных количественных значениях количества и/или активности каждого радионуклида, присутствующего в этом участке, путм статистической обработки информации. 2. Способ по п.1, отличающийся тем, что данные и о зарегистрированном положении, и об энергии испущенных из каждого участка подлежащей исследованию поверхности частиц и/или фотонов хранятся и накапливаются в виде изображения спектральных линий энергетического спектра, то есть хранятся как распределение по kmax каналов энергии для каждого участка r по всей подлежащей исследованию поверхности, где kmax - это число дискретных каналов энергии, на которое разделен весь интервал энергий испускаемых частиц и/или фотонов. 3. Способ по п.2, отличающийся тем, что статистическая обработка включает метод наименьших квадратов, причм линейную комбинацию предварительно зарегистрированных спектров энергий для всех радиоактивных маркеров, где неизвестные коэффициенты являются вкладами каждого из радионуклидов, сопоставляют с данными от элемента изображения или области изображения спектральных линий энергетического спектра, представляющими собой измеренную составную гистограмму энергий или распределение энергий, и/или применяют метод максимальной вероятности, причм измеренный спектр энергий для каждого радиоактивного маркера используют, чтобы найти наиболее вероятное число попаданий от каждого радиоактивного маркера в каждом канале энергий, что дат зарегистрированную гистограмму или распределение энергий, и приводит, таким образом, к полному числу событий, ведущих происхождение от каждого из радионуклидов. 4. Способ по п.2 или 3, отличающийся тем, что способ применяют для биологических микропланшетов, где предназначенные для исследования участки обычно имеют диаметр менее 200 мкм, и для макропланшетов, где предназначенные для исследования участки обычно имеют диаметр более 300 мкм. 5. Способ по пп.1-4, отличающийся тем, что способ применяют для количественного определения содержания одного или нескольких радиоактивных нуклидов, которые испускают альфа, бета, гамма или позитронные частицы и/или фотоны, и внедрены в целевые молекулы таким образом, что радиоактивность от каждого подлежащего исследованию участка на подлежащей исследованию поверхности находится в пределах от 1 до 100 Бк. 6. Способ по п.5, отличающийся тем, что способ применяется для немоноэнергетических радиоактивных меток, включая -излучающие нуклиды, которые дают полностью и/или частично перекрывающиеся спектры энергий. 7. Способ по п.6, отличающийся тем, что -излучающие нуклиды включают 33 Р и 35S. 8. Способ по п.7, отличающийся тем, что способ применяют для мониторинга всей популяции мРНК в образце из типа/линии клеток путм сравнения с образцом из стандартного типа/линии клеток,причм в культуральную среду параллельных культур клеток добавляют в момент времени 0 [-35S]UTP и 33[- P]UTP в подходящей концентрации,в момент времени 1 одну из параллелей подвергают химической обработке, чтобы остановить синтез РНК, и в момент времени 2 обе культуры собирают, выделяют РНК и смешивают равные количества РНК из обеих культур, после чего смесь обрабатывают как объединнную пробу кДНК и гибридизируют на биологическом микро- 12006014 планшете, на котором можно определить общие количества обоих радиоактивных маркеров. 9. Способ по любому из пп.1-6, отличающийся тем, что способ применяют для одновременного мониторинга в различных наборах степени фосфорилирования белков путм введения в питательную среду радиоактивно меченных аминокислотных ярлыков и затем адсорбирования их на биологических микропланшетах, содержащих структурированные наборы антител. 10. Устройство для осуществления одновременного количественного определения содержания одного или нескольких радиоактивных нуклидов в произвольных подлежащих исследованию участках на подлежащей исследованию поверхности, где эти нуклиды были помещены, адсорбированы или зафиксированы, характеризующееся тем, что устройство содержит электронную систему для определения в режиме реального времени мест соударения и привнеснных энергий радиоактивных частиц и/или фотонов, испускаемых из подлежащих исследованию участков на подлежащей исследованию поверхности, которая содержит полупроводниковый детектор из множества полосок с ортогональными полосками соответственно р-типа и n-типа на противоположных сторонах, и средства детектирования мест соударения в координатах х и у для каждого радиоактивного события, а также привнеснную энергию частицы и/или фотона, механизм наложения, позволяющий задавать положение подлежащей исследованию поверхности в контакте с полупроводниковым детектором по всей его поверхности, отделнной тонкой плнкой из майлара для защиты полупроводникового детектора,модуль организации данных в режиме реального времени, который воспринимает след частицы и хранит данные о положении и энергии каждого зарегистрированного радиоактивного события, и который размещает зарегистрированные события для каждой точки в координатах х и у полупроводникового детектора в распределение по k каналам энергии, образуя таким образом изображение спектральных линий энергетического спектра,компьютерный модуль, содержащий аппаратное и программное обеспечение, который способен загружать изображение спектральных линий энергетического спектра, чтобы определить в абсолютных значениях количество или активность каждой присутствующей радиоактивной метки в каждой точке или конденсированной области полупроводниковой сенсорной пластины, и модуль для визуализации распределения активности каждого радиоактивного маркера по всем точкам полупроводниковой пластины или, по желанию, в выбранных подлежащих исследованию участках на подлежащей исследованию поверхности. 11. Устройство по п.10, отличающееся тем, что средства для измерений в режиме реального времени мест соударения и привнеснных энергий радиоактивных частиц/фотонов содержат один усилительный канал, состоящий для каждой полоски из предусилителя и фильтра и соединнных параллельно триггерной ячейки и ячейки хранения данных, и систему накопления данных, соединнную с усилительными каналами, которая способна хранить информацию о положении в координатах х и у и об энергии всех зарегистрированных радиоактивных событий, достигающих чувствительной части полупроводниковой сенсорной пластины. 12. Устройство по п.10 или 11, отличающееся тем, что полупроводниковый детектор представляет собой квадратную пластину из монолитного полупроводникового материала, которая имеет типичный размер порядка десяти квадратных сантиметров и толщину приблизительно 300 мкм и содержит чувствительную область размером 6432 мм 2, причм расстояние между полосками для чувствительных полосок n-типа и ориентированных ортогонально полосок р-типа на противоположной стороне полупроводниковой пластины равно 50 мкм, что дат в общей сложности 1280640 полосок или двумерную рештку из 820000 точек. 13. Устройство по любому из пп.10-12, отличающееся тем, что механизм наложения и полупроводниковый детектор сконструированы таким образом, что полупроводниковая пластина может быть снята и заменена другой полупроводниковой пластиной с такими же расположением точек и размерами, но из другого полупроводникового материала, чтобы устройство могло детектировать другие типы радиоактивности. 14. Устройство по п.13, отличающееся тем, что полупроводниковая пластина представляет собой монолитную пластину, содержащую один из следующих материалов: Si, GaAs, CdTe или CdZnTe. 15. Устройство по любому из пп.10-14, отличающееся тем, что компьютерный модуль устройства содержит программное обеспечение, использующее информацию о зарегистрированных распределениях по k каналам энергии для каждой точки для разделения/определения, в абсолютных величинах, вклада каждого радиоактивного маркера в зарегистрированный энергетический спектр для каждой точки полупроводниковой сенсорной пластины путм применения метода наименьших квадратов, в котором линейная комбинация предварительно зарегистрированного ожидаемого спектра энергий каждого радиоактивного маркера сопоставляется с измеренным составным спектром энергий, и/или метода максимальной вероятности, в котором ожидаемый спектр энергий для каждого радиоактивного маркера применяется для определения наиболее вероятного числа соударений от каждого радиоактивного маркера в каждом канале энергии, что дает зарегистрированную гистограмму энергий.- 13006014 16. Устройство по любому из пп.10-15, отличающееся тем, что модуль организации данных в режиме реального времени, который воспринимает след частицы и хранит данные о положении и энергии каждого зарегистрированного радиоактивного события и который размещает зарегистрированные события для каждой точки в координатах х и у полупроводникового детектора в распределение по k каналам энергии, способен конденсировать зарегистрированные и сохраняемые данные путм добавления информации из распределений для всех соседних точек в распределение для центральной точки в целях экономии компьютерного времени, привести виртуальное разрешение цифровой карты в удобное соответствие с физическим плоскостным разрешением на подлежащей исследованию поверхности и/или повысить статистическую точность оцениваемых вкладов. 17. Устройство по п.16, отличающееся тем, что модуль организации данных в режиме реального времени может суммировать любое число окружающих рядов точек, чтобы привести виртуальное разрешение в удобное соответствие с грубым распределением на подлежащей исследованию поверхности,то есть в случае добавления одного ряда к данным для центральной точки добавляются данные для всех 8 соседних точек, окружающих центральную точку, в случае добавления двух рядов к данным для центральной точки добавляются данные для всех 8 точек первого ряда и 16 точек окружающего второго ряда и так далее. 18. Устройство по любому из пп.10-17, отличающееся тем, что модуль для представления определнной активности каждой радиоактивной метки в каждом подлежащем исследованию участке подлежащей исследованию области представляет собой графическое приспособление для представления данных в форме виртуальной карты, отражающей подлежащую исследованию поверхность, где каждый радиоактивный нуклид представлен своим цветом и где определнное количество каждой радиоактивной метки в каждом подлежащем исследованию участке подлежащей исследованию области изображается интенсивностью соответствующей окраски таким образом, что на виртуальной карте биологического планшета создатся шкала цветности, которая прямо сопоставима с результатом применения известного способа с применением флуорофоров. 19. Устройство по любому из пп.10-17, отличающееся тем, что модуль для представления определнной активности каждого радиоактивного нуклида представляет собой приспособление для представления данных в форме гистограмм, изображающих в абсолютных величинах количества каждого радиоактивного нуклида в каждом подлежащем исследованию участке подлежащей исследованию области. 20. Устройство по любому из пп.10-19, отличающееся тем, что устройство оборудовано приспособлением для определения физической протяжнности ячейки посредством крайнего верхнего, крайнего нижнего, крайнего левого и крайнего правого положений каждой подлежащей исследованию ячейки путм добавления всех линий изображений спектральных линий энергетического спектра в единое суммарное изображение, вычисления проекций суммарного изображения на ось х и ось у, повторения процесса при повороте изображения биологического планшета с шагом 0,1 и определения такого поворота, который по вариациям проекций суммарного изображения на ось у выстраивает ряды ячеек параллельно оси х, и тем, что проекции используются для локализации рядов и колонок ячеек в изображении.
МПК / Метки
МПК: G01T 1/164, C12Q 1/68, G01N 33/543
Метки: количества, устройство, способ, определения, микропланшета, биологического, одновременного, радионуклидов, поверхности, различных
Код ссылки
<a href="https://eas.patents.su/18-6014-sposob-i-ustrojjstvo-dlya-odnovremennogo-opredeleniya-kolichestva-razlichnyh-radionuklidov-na-poverhnosti-biologicheskogo-mikroplansheta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и устройство для одновременного определения количества различных радионуклидов на поверхности биологического микропланшета</a>
Предыдущий патент: Способ и установка для переработки зерна
Следующий патент: Содержащая циклезонид фармацевтическая композиция, предназначенная для нанесения на слизистую оболочку
Случайный патент: Материалы на основе железа для наплавки твердым сплавом












