Трициклические имидазопиридины
Номер патента: 7683
Опубликовано: 29.12.2006
Авторы: Кромер Вольфганг, Циммерманн Петер Ян, Постиус Штефан, Зимон Вольфганг-Александер
Формула / Реферат
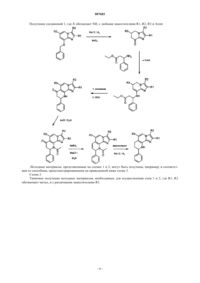
1. Соединение формулы 1

где R1 обозначает водородный атом, C1-C4алкил, С3-С7циклоалкил, С3-С7циклоалкил-C1-C4алкил, С1-С4алкокси, C1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил, фтор-С1-C4алкил,
R2 обозначает водородный атом, C1-C4алкил, С3-С7циклоалкил, С3-С7циклоалкил-C1-C4алкил, C1-C4алкоксикарбонил, атом галогена, фтор-С1-C4алкил или цианометил,
R3 обозначает C1-C4алкокси-C1-C4алкил, C1-C4алкокси-С1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил, фтор-С1-C4алкокси-C1-C4алкил или радикал -CO-NR31R32, где R31 обозначает водородный атом, C1-С7алкил или C1-C4алкокси-C1-C4алкил и R32 обозначает водородный атом, C1-С7алкил или C1-C4алкокси-C1-C4алкил, или где
R31 и R32 совместно и включая атом азота, к которому они присоединены, образуют пирролидиновый, пиперидиновый или морфолиновый радикал,
Arom представляет собой R4-, R5-, R6- и R7-замещенный моно или бициклический ароматический радикал, выбранный из ряда, включающего фенил, нафтил, пирролил, пиразолил, имидазолил, 1,2,3-триазолил, индолил, бензимидазолил, фуранил (фурил), бензофуранил (бензофурил), тиофенил (тиенил), бензотиофенил (бензотиенил), тиазолил, изоксазолил, пиридинил, пиримидинил, хинолинил и изохинолинил, где R4 обозначает водородный атом, C1-C4алкил, C1-C4алкокси, С2-C4алкенилокси, C1-C4алкилкарбонил, карбоксил, C1-C4алкоксикарбонил, карбокси-C1-C4алкил, C1-C4алкоксикарбонил-C1-C4алкил, атом галогена, гидроксил, арил, арил-C1-C4алкил, арилокси, арил-С1-C4алкокси, трифторметил, нитро-, амино-, моно- или ди-C1-C4алкиламино-, C1-C4алкилкарбониламино-, C1-C4алкоксикарбониламино-, С1-C4алкокси-С1-C4алкоксикарбониламиногруппу или сульфонил, R5 обозначает водородный атом, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил, атом галогена, трифторметил или гидроксил, R6 обозначает водородный атом, С1-C4алкил или атом галогена и R7 обозначает водородный атом, C1-C4алкил или атом галогена, где арил представляет собой фенил или замещенный фенил, содержащий один, два или три одинаковых или разных заместителя, выбранных из ряда, включающего C1-C4алкил, С1-C4алкокси, карбоксил, C1-C4алкоксикарбонил, атом галогена, трифторметил, нитрогруппу, трифторметокси, гидроксил и цианогруппу,
Х обозначает О или NH,
и его соли.
2. Соединение формулы 1 по п.1,
где R1 обозначает водородный атом, C1-C4алкил, С3-С7циклоалкил, C1-C4алкокси-С1-C4алкил или фтор-C1-C4алкил,
R2 обозначает водородный атом, С1-C4алкил, атом галогена или фтор-C1-C4алкил,
R3 обозначает C1-C4алкокси-C1-C4алкил, C1-C4алкокси-C1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает водородный атом, C1-С7алкил или C1-C4алкокси-C1-C4алкил и R32 обозначает водородный атом, C1-С7алкил или C1-C4алкокси-C1-C4алкил, или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,
Arom представляет собой R4-, R5-, R6- и R7-замещенный моно или бициклический ароматический радикал, выбранный из ряда, включающего фенил, фуранил (фурил) и тиофенил (тиенил), где R4 обозначает водородный атом, C1-C4алкил, C1-C4алкокси, С1-C4алкилкарбонил, карбоксил, C1-C4алкоксикарбонил, атом галогена, гидроксил, трифторметил, C1-C4алкилкарбониламино-, C1-C4алкоксикарбониламино-, С1-C4алкокси-С1-C4алкоксикарбониламиногруппу или сульфонил, R5 обозначает водородный атом, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил, атом галогена, трифторметил или гидроксил, R6 обозначает водородный атом или C1-C4алкил, a R7 обозначает водородный атом, R7 обозначает водород,
Х обозначает О или NH,
и его соли.
3. Соединение формулы 1 по п.1,
где R1 обозначаетC1-C4алкил,
R2 обозначает C1-C4алкил, атом галогена или фтор-C1-C4алкил,
R3 обозначает C1-C4алкокси-C1-C4алкил, C1-C4алкокси-C1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил или радикал -CO-NR31R32,
где R31 обозначает водородный атом, C1-C4алкил, C1-C4алкокси-C1-C4алкил, а R32 обозначает C1-C4алкил или C1-C4алкокси-C1-C4алкил,
или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,
Arom обозначает R4-, R5-, R6- и R7-замещенный фенил,
где R4 обозначает водородный атом или C1-C4алкил,
R5 обозначает водородный атом или C1-C4алкил,
R6 обозначает водородный атом или C1-C4алкил, а
R7 обозначает водородный атом, Х обозначает О или NH,
и его соли.
4. Соединение формулы 1 по п.1, где R1 обозначает метил,
R2 обозначает метил, атом хлора или дифторметил,
R3 обозначает метоксиметил, метоксиэтоксиметил, C1-C4алкоксикарбонил или радикал -CO-NR31R32,
где R31 обозначает метил или этил и R32 обозначает метил или этил,
или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой морфолиновый радикал,
Arom обозначает фенил, 2-метилфенил, 2-изопропилфенил, 2,6-диметилфенил, 2,6-диизопропилфенил, 2,4,6-триметилфенил или 2,4,6-триизопропилфенил,
а Х обозначает О или NH,
и его соли.
5. Соединение формулы 1 по п.1, где R1 обозначает C1-C4алкил, R2 обозначает C1-C4алкил, R3 обозначает C1-C4алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает C1-C4алкил и R32 обозначает C1-C4алкил, Arom обозначает фенил, а X обозначает О, и его соли.
6. Соединение формулы 1 по п.1, где R1 обозначает C1-C4алкил, R2 обозначает C1-C4алкил, R3 обозначает С1-C4алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает C1-C4алкил и R32 обозначает C1-C4алкил, Arom обозначает фенил или 2-метил-6-этилфенил, а Х обозначает О, и его соли.
7. Лекарственное средство, включающее соединение по п.1 и/или его фармакологически приемлемую соль совместно с обычными фармацевтическими вспомогательными средствами и/или наполнителями.
8. Применение соединения по п.1 и его фармакологически приемлемых солей для профилактики и лечения желудочно-кишечных заболеваний.
Текст
007683 Область техники, к которой относится изобретение Изобретение относится к новым соединениям, которые используют в фармацевтической промышленности в качестве действующих соединений при приготовлении лекарственных средств. Описание известного уровня техники В US 4468400 описаны трициклические имидазо[1,2-а]пиридины, обладающие разными кольцевыми системами, конденсированными с имидазопиридиновым скелетом, которые, как отмечено, приемлемы для лечения пептической язвы. В WO 95/27714, WO 98/42707, WO 98/54188, WO 00/17200, WO 00/26217 и WO 00/63211 описаны трициклические имидазопиридиновые производные, обладающие очень специфической картиной замещения, которые, как сказано, также приемлемы для лечения желудочно-кишечных заболеваний. Kaminski и др. в J.Med.Chem. 1991, 34, 533-541 и 1997, 40, 427-436 описывают синтез имидазо[1,2 а]пиридинов и их применение в качестве противоязвенных средств. Описание изобретения По изобретению предлагаются соединения формулы 1 где R1 обозначает водородный атом, С 1-С 4 алкил, С 3-С 7 циклоалкил, С 3-С 7 циклоалкил-С 1-С 4 алкил, С 1 С 4 алкокси, С 1-С 4 алкокси-С 1-С 4 алкил, C1-С 4 алкоксикарбонил, С 2-С 4 алкенил, С 2-С 4 алкинил, фтор-С 1-С 4 алкил или гидрокси-С 1-С 4 алкил,R2 обозначает водородный атом, С 1-С 4 алкил, С 3-С 7 циклоалкил, С 3-С 7 циклоалкил-С 1-С 4 алкил, С 1 С 4 алкоксикарбонил, гидрокси-С 1-С 4 алкил, атом галогена, С 2-С 4 алкенил, С 2-С 4 алкинил, фтор-С 1-С 4 алкил или цианометил,R3 обозначает гидрокси-С 1-С 4 алкил, С 1-С 4 алкокси-С 1-С 4 алкил, С 1-С 4 алкокси-С 1-С 4 алкокси-С 1 С 4 алкил, С 1-С 4 алкоксикарбонил, фтор-С 1-С 4 алкокси-С 1-С 4 алкил или радикал -CO-NR31R32,где R31 обозначает водородный атом, С 1-С 7 алкил, гидрокси-С 1-С 4 алкил или С 1-С 4 алкокси-С 1-С 4 алкил и R32 обозначает водородный атом, C1-С 7 алкил, гидрокси-С 1-С 4 алкил или С 1-С 4 алкокси-С 1-С 4 алкил, или гдеR31 и R32 совместно и включая атом азота, к которому они присоединены, образуют пирролидиновый, пиперидиновый или морфолиновый радикал,Arom представляет собой R4-, R5-, R6- и R7-замещенный моно- или бициклический ароматический радикал, выбранный из ряда, включающего фенил, нафтил, пирролил, пиразолил, имидазолил, 1,2,3 триазолил, индолил, бензимидазолил, фуранил (фурил), бензофуранил (бензофурил), тиофенил (тиенил),бензотиофенил (бензотиенил), тиазолил, изоксазолил, пиридинил, пиримидинил, хинолинил и изохинолинил, гдеR4 обозначает водородный атом, C1-C4 алкил, гидрокси-C1-C4 алкил, C1-C4 алкокси, С 2-C4 алкенилокси,C1-C4 алкилкарбонил, карбоксил, C1-C4 алкоксикарбонил, карбокси-C1-C4 алкил, C1-C4 алкоксикарбонил-C1C4 алкил, атом галогена, гидроксил, арил, арил-C1-C4 алкил, арилокси, арил-C1-C4 алкокси, трифторметил,нитро-, амино-, моно- или ди-C1-C4 алкиламино-, C1-C4 алкилкарбониламино-, C1-C4 алкоксикарбониламино-,С 1-C4 алкокси-С 1-C4 алкоксикарбониламиногруппу или сульфонил,R5 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси, C1-C4 алкоксикарбонил, атом галогена,трифторметил или гидроксил,R6 обозначает водородный атом, C1-C4 алкил или атом галогена иR7 обозначает водородный атом, C1-C4 алкил или атом галогена,где арил представляет собой фенил или замещенный фенил, содержащий один, два или три одинаковых или разных заместителя, выбранных из ряда, включающего C1-C4 алкил, C1-C4 алкокси, карбоксил, C1C4 алкоксикарбонил, атом галогена, трифторметил, нитрогруппу, трифторметокси, гидроксил и цианогруппу, Х обозначает О (атом кислорода) или NH, и их соли.C1-C4 алкилом обозначают прямоцепочечные или разветвленные алкильные радикалы, содержащие от 1 до 4 углеродных атомов. Примерами, которые могут быть упомянуты, являются бутильный, изобутильный, втор-бутильный, трет-бутильный, пропильный, изопропильный, этильный и метильный радикалы. С 3-С 7 циклоалкилом обозначают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил,среди которых предпочтительны циклопропил, циклобутил и циклопентил. С 3-С 7 циклоалкил-C1-C4 алкилом обозначают один из вышеупомянутых C1-C4 алкильных радикалов, который замещен одним из вышеупомянутых С 3-С 7 циклоалкильных радикалов. Примерами, которые могут быть упомянуты, являются циклопропилметильный, циклогексилметильный и циклогексилэтильный радикалы.C1-C4 алкокси обозначают радикалы, которые, в дополнение к кислородному атому, содержат прямоцепочечный или разветвленный алкильный радикал, содержащий от 1 до 4 углеродных атомов. Примерами,-1 007683 которые могут быть упомянуты, являются бутокси-, изобутокси-, втор-бутокси-, трет-бутокси-, пропокси-,изопропокси-, а предпочтительно этокси- и метоксирадикалы.C1-C4 алкокси-C1-C4 алкилом обозначают один из вышеупомянутых C1-C4 алкильных радикалов, который замещен одним из вышеупомянутых C1-C4 алкоксирадикалов. Примерами, которые могут быть упомянуты, являются метоксиметильный, метоксиэтильный и бутоксиэтильный радикалы.C1-C4 алкоксикарбонилом (-СО-C1-C4 алкокси) обозначают карбонильную группу, к которой присоединен один из вышеупомянутых C1-C4 алкоксирадикалов. Примерами, которые могут быть упомянуты, являются метоксикарбонильный (СН 3 О-С(О)-) и этоксикарбонильный (СН 3 СН 2O-С(O)-) радикалы. С 2-C4 алкенилом обозначают прямоцепочечные или разветвленные алкенильные радикалы, содержащие от 2 до 4 углеродных атомов. Примерами, которые могут быть упомянуты, являются 2-бутенильный, 3 бутенильный, 1-пропенильный и 2-пропенильный (аллильный) радикалы. С 2-C4 алкинилом обозначают прямоцепочечные или разветвленные алкинильные радикалы, содержащие от 2 до 4 углеродных атомов. Примерами, которые могут быть упомянуты, являются 2-бутинильный, 3 бутинильный и, что предпочтительно, 2-пропинильный (пропаргильный) радикалы. Фтор-C1-C4 алкилом обозначают один из вышеупомянутых C1-C4 алкильных радикалов, который замещен одним или несколькими атомами фтора. Примером, который может быть упомянут, является трифторметильный радикал. Гидрокси-C1-C4 алкилом обозначают вышеупомянутые C1-C4 алкильные радикалы, которые замещены гидроксильной группой. Примерами, которые могут быть упомянуты, являются гидроксиметильный, 2 гидроксиэтильный и 3-гидроксипропильный радикалы. Принимая во внимание цели изобретения, под атомом галогена подразумевают атом брома, хлора и фтора.C1-C4 алкокси-C1-C4 алкокси обозначают один из вышеупомянутых C1-C4 алкоксирадикалов, который замещен дополнительным C1-C4 алкоксирадикалом. Примерами, которые могут быть упомянуты, являются радикалы 2-(метокси)этокси (СН 3-О-СН 2-СН 2-О-) и 2-(этокси)этокси (СН 3-СН 2-O-СН 2-СН 2-O-).C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкилом обозначают один из вышеупомянутых C1-C4 алкокси-C1C4 алкильных радикалов, который замещен одним из вышеупомянутых C1-C4 алкоксирадикалов. Примером,который может быть упомянут, является радикал 2-(метокси)этоксиметил (СН 3-О-СН 2-СН 2-О-СН 2-). Фтор-C1-C4 алкокси-C1-C4 алкилом обозначают один из вышеупомянутых C1-C4 алкильных радикалов,который замещен фтор-C1-C4 алкоксирадикалом. В данном случае фтор-C1-C4 алкокси обозначают один из вышеупомянутых C1-C4 алкоксирадикалов, который замещен полностью или преимущественно атомом фтора. Примеры C1-C4 алкокси, замещенных полностью или преимущественно атомом фтора, которые могут быть упомянуты, являются 1,1,1,3,3,3-гексафтор-2-пропокси, 2-трифторметил-2-пропокси, 1,1,1-трифтор-2 пропокси, перфтортрет-бутокси, 2,2,3,3,4,4,4-гептафтор-1-бутокси, 4,4,4-трифтор-1-бутокси, 2,2,3,3,3 пентафторпропокси, перфторэтокси, 1,2,2-трифторэтокси, в частности 1,1,2,2-тетрафторэтокси, 2,2,2 трифторэтокси, трифторметокси, а предпочтительно дифторметоксирадикалы.C1-С 7 алкилом обозначают прямоцепочечные или разветвленные алкильные радикалы, содержащие от 1 до 7 углеродных атомов. Примерами, которые могут быть упомянуты, являются гептильный, изогептил(5 метилгексильный), гексильный, изогексил(4-метилпентильный), неогексил(3,3-диметил-бутильный), пентильный, изопентил(3-метилбутильный), неопентил(2,2-диметилпропильный), бутильный, изобутильный,втор-бутильный, трет-бутильный, пропильный, изопропильный, этильный и метальный радикалы.C1-C4 алкилкарбонилом обозначают радикал, который, в дополнение к карбонильной группе, содержит один из вышеупомянутых C1-C4 алкильных радикалов. Примером, который может быть упомянут, является ацетильный радикал. Карбокси-C1-C4 алкилом обозначают, например, карбоксиметильный (-СН 2 СООН) или карбоксиэтильный (-СН 2 СН 2 СООН) радикал.C1-C4 алкоксикарбонил-C1-C4 алкилом обозначают один из вышеупомянутыхC1-C4 алкильных радикалов, который замещен одним из вышеупомянутых C1-C4 алкоксикарбонильных радикалов. Примером, который может быть упомянут, является этоксикарбонилметильный (СН 3 СН 2-ОС(O)СН 2-) радикал. Ди-C1-C4 алкиламиногруппой обозначают аминогруппу, которая замещена двумя одинаковыми или разными из вышеупомянутых C1-C4 алкильных радикалов. Примерами, которые могут быть упомянуты, являются диметиламино-, диэтиламино- и диизопропиламиногруппы.C1-C4 алкоксикарбониламиногруппой обозначают аминогруппу, которая замещена одним из вышеупомянутых C1-C4 алкоксикарбонильных радикалов. Примерами, которые могут быть упомянуты, являются этоксикарбониламино- и метоксикарбониламиногруппы.C1-C4 алкокси-C1-C4 алкоксикарбонилом обозначают карбонильную группу, к которой присоединен один из вышеупомянутых C1-C4 алкокси-C1-C4 алкоксирадикалов. Примерами, которые могут быть упомянуты, являются 2-(метокси)этоксикарбонильный (СН 3-О-СН 2 СН 2-О-СО-) и 2-(этокси)этоксикарбонильный (СН 3 СН 2-О-СH2 СН 2-О-СО-) радикалы.C1-C4 алкокси-C1-C4 алкоксикарбониламиногруппой обозначают аминогруппу, которая замещена одним из вышеупомянутых C1-C4 алкокси-C1-C4 алкоксикарбонильных радикалов. Примерами, которые могут быть-2 007683 упомянуты,являются 2-(метокси)этоксикарбониламинои 2-(этокси)этоксикарбониламиногруппы. С 2-C4 алкенилокси обозначают радикал, который, в дополнение к кислородному атому, содержит С 2C4 алкенильный радикал. Примером, который может быть упомянут, является аллилоксирадикал. Арил-C1-C4 алкилом обозначают арилзамещенный C1-C4 алкильный радикал. Примером, который может быть упомянут, является бензильный радикал. Арил-C1-C4 алкокси означает арилзамещенный C1-C4 алкоксирадикал. Примером, который может быть упомянут, является бензилоксирадикал. Моно- или ди-C1-C4 алкиламиногруппы содержат, в дополнение к атому азота, один или два из вышеупомянутых C1-C4 алкильных радикала. Предпочтение отдают ди-C1-C4 алкиламиногруппе, в частности диметил-, диэтил- или диизопропиламиногруппе.C1-C4 алкилкарбониламиногруппой обозначают аминогруппу, к которой присоединен C1C4 алкилкарбонильный радикал. Примерами, которые могут быть упомянуты, являются пропиониламино(С 3 Н 7 С(O)NН-) и ацетиламино-(ацетамидная, СН 3 С(О)NН-)группы. Радикалами Arom, которые могут быть упомянуты, являются, например, следующие заместители: 4 ацетоксифенил,4-ацетамидофенил,2-метоксифенил,3-метоксифенил,4-метоксифенил,3 бензилоксифенил, 4-бензилоксифенил, 3-бензилокси-4-метоксифенил, 4-бензилокси-3-метоксифенил, 3,5 бис(трифторметил)фенил, 4-бутоксифенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-хлор-6-фторфенил,3-хлор-4-фторфенил,2-хлор-5-нитрофенил,4-хлор-3-нитрофенил,3-(4-хлорфенокси)фенил,2,4 дихлорфенил,3,4-дифторфенил,2,4-дигидроксифенил,2,6-диметоксифенил,3,4-диметокси-5 гидроксифенил, 2,5-диметилфенил, 3-этокси-4-гидроксифенил, 2-фторфенил, 4-фторфенил, 4 гидроксифенил, 2-гидрокси-5-нитрофенил, 3-метокси-2-нитрофенил, 3-нитрофенил, 2,3,5-трихлорфенил,2,4,6-тригидроксифенил, 2,3,4-триметоксифенил, 2-гидрокси-1-нафтил, 2-метокси-1-нафтил, 4-метокси-1 нафтил, 1-метил-2-пирролил, 2-пирролил, 3-метил-2-пирролил, 3,4-диметил-2-пирролил, 4-(2 метоксикарбонилэтил)-3-метил-2-пирролил, 5-этоксикарбонил-2,4-диметил-3-пирролил, 3,4-дибром-5 метил-2-пирролил, 2,5-диметил-1-фенил-3-пирролил, 5-карбокси-3-этил-4-метил-2-пирролил, 3,5-диметил 2-пирролил, 2,5-диметил-1-(4-трифторметилфенил)-3-пирролил, 1-(2,6-дихлор-4 трифторметилфенил)-2-пирролил, 1-(2-нитробензил)-2-пирролил, 1-(2-фторфенил)-2-пирролил, 1-(4 трифторметоксифенил)-2-пирролил, 1-(2-нитробензил)-2-пирролил, 1-(4-этоксикарбонил)-2,5-диметил-3 пирролил,5-хлор-1,3-диметил-4-пиразолил,5-хлор-1-метил-3-трифторметил-4-пиразолил,1-(4 хлорбензил)-5-пиразолил,1,3-диметил-5-(4-хлорфенокси)-4-пиразолил,1-метил-3-трифторметил-5-(3 трифторметилфенокси)-4-пиразолил, 4-метоксикарбонил-1-(2,6-дихлорфенил)-5-пиразолил, 5-аллилокси-1 метил-3-трифторметил-4-пиразолил, 5-хлор-1-фенил-3-трифторметил-4-пиразолил, 3,5-диметил-1-фенил-4 имидазолил, 4-бром-1-метил-5-имидазолил, 2-бутилимидазолил, 1-фенил-1,2,3-триазол-4-ил, 3-индолил, 4 индолил, 7-индолил, 5-метокси-3-индолил, 5-бензилокси-3-индолил, 1-бензил-3-индолил, 2-(4-хлорфенил)3-индолил, 7-бензилокси-3-индолил, 6-бензилокси-3-индолил, 2-метил-5-нитро-3-индолил, 4,5,6,7 тетрафтор-3-индолил, 1-(3,5-дифторбензил)-3-индолил, 1-метил-2-(4-трифторфенокси)-3 -индолил, 1-метил 2-бензимидазолил, 5-нитро-2-фурил, 5-гидроксиметил-2-фурил, 2-фурил, 3-фурил, 5-(2-нитро-4 трифторметилфенил)-2-фурил, 4-этоксикарбонил-5-метил-2-фурил, 5-(2-трифторметокси-фенил)-2-фурил,5-(4-метокси-2-нитрофенил)-2-фурил, 4-бром-2-фурил, 5-диметиламино-2-фурил, 5-бром-2-фурил, 5 сульфо-2-фурил, 2-бензофурил, 2-тиенил, 3-тиенил, 3-метил-2-тиенил, 4-бром-2-тиенил, 5-бром-2-тиенил,5-нитро-2-тиенил, 5-метил-2-тиенил, 5-(4-метоксифенил)-2-тиенил, 4-метил-2-тиенил, 3-фенокси-2-тиенил,5-карбокси-2-тиенил, 2,5-дихлор-3-тиенил, 3-метокси-2-тиенил, 2-бензотиенил, 3-метил-2-бензотиенил, 2 бром-5-хлор-3-бензотиенил,2-тиазолил,2-амино-4-хлор-5-тиазолил,2,4-дихлор-5-тиазолил,2 диэтиламино-5-тиазолил, 3-метил-4-нитро-5-изоксазолил, 2-пиридил, 3-пиридил, 4-пиридил, 6-метил-2 пиридил, 3-гидрокси-5-гидроксиметил-2-метил-4-пиридил, 2,6-дихлор-4-пиридил, 3-хлор-5-трифторметил 2-пиридил, 4,6-диметил-2-пиридил, 4-(4-хлорфенил)-3-пиридил, 2-хлор-5-метоксикарбонил-6-метил-4 фенил-3-пиридил, 2-хлор-3-пиридил, 6-(3-трифторметилфенокси)-3-пиридил, 2-(4-хлорфенокси)-3-пиридил,2,4-диметокси-5-пиримидин, 2-хинолинил, 3-хинолинил, 4-хинолинил, 2-хлор-3-хинолинил, 2-хлор-6 метокси-3-хинолинил, 8-гидрокси-2-хинолинил и 4-изохинолинил. Приемлемыми солями соединений формулы 1 являются, в частности, в зависимости от заместителей,все кислотно-аддитивные соли. Конкретно можно упомянуть фармакологически приемлемые соли неорганических и органических кислот, которые обычно используют в фармации. Те, которые приемлемы, представляют собой водорастворимые и водонерастворимые кислотно-аддитивные соли с такими кислотами,как, например, соляная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота,лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтойная кислота, причем при получении солей кислоты используют в эквимолярном соотношении или в соотношении, отличном от него, в зависимости от того, является ли кислота моно- или многоосновной кислотой и от того, какая соль требуется.-3 007683 Фармакологически неприемлемые соли, которые могут быть первоначально получены, например, в качестве продуктов процесса получения соединений в соответствии с изобретением в промышленном масштабе, можно превращать в фармакологически приемлемые соли по методам, которые специалисту в данной области техники известны. Специалисту в данной области техники известно, что соединения в соответствии с изобретением и их соли могут включать, например когда их выделяют в кристаллической форме, различные количества растворителей. Изобретение, следовательно, охватывает также все сольваты и, в частности, все гидраты соединений формулы 1,равно как все сольваты и, в частности, все гидраты солей соединений формулы 1. Соединения формулы 1 обладают в скелете по меньшей мере одним центром хиральности. По изобретению, таким образом, предлагаются все возможные энантиомеры в любой пропорции смешения, включая чистые энантиомеры, которые являются предпочтительным объектом изобретения. Особо могут быть упомянуты те из соединений формулы 1, где R1 обозначает водородный атом, C1C4 алкил, С 3-С 7 циклоалкил, C1-C4 алкокси-C1-C4 алкил, С 2-C4 алкинил или фтор-С 1-C4 алкил,R2 обозначает водородный атом, C1-C4 алкил, атом галогена, С 2-C4 алкенил, С 2-C4 алкинил или фторC1-C4 алкил,R3 обозначает гидрокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкокси-C1C4 алкил, C1-C4 алкоксикарбонил или радикал -СО-NR31R32, где R31 обозначает водородный атом, C1 С 7 алкил, гидрокси-C1-C4 алкил илиC1-C4 алкокси-C1-C4 алкил и R32 обозначает водородный атом, C1-С 7 алкил, гидрокси-C1-C4 алкил или С 1-C4 алкокси-С 1-C4 алкил,или где R31 и R32 совместно и включая водородный атом, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,Arom представляет собой R4-, R5-, R6- и R7-замещенный моно- или бициклический ароматический радикал, выбранный из ряда, включающего фенил, фуранил (фурил) и тиофенил (тиенил), гдеR4 обозначает водородный атом, C1-C4 алкил, гидрокси-C1-C4 алкил, C1-C4 алкокси, C1-C4 алкилкарбонил, карбоксил, C1-C4 алкоксикарбонил, атом галогена, гидроксил, трифторметил, C1-C4 алкилкарбониламино-, C1C4 алкоксикарбониламино-, С 1-C4 алкокси-С 1-C4 алкоксикарбониламиногруппу или сульфонил,R5 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси, C1-C4 алкоксикарбонил, атом галогена,трифторметил или гидроксил,R6 обозначает водородный атом или C1-C4 алкил, аR7 обозначает водородный атом, Х обозначает О (атом кислорода) или NH, и их соли. Соединения, которые следует особо выделить, представляют собой те соединения формулы 1, гдеR1 обозначает C1-C4 алкил,R2 обозначает С 1-C4 алкил, атом галогена или фтор-C1-C4 алкил,R3 обозначает гидрокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкокси-C1C4 алкил, C1-C4 алкоксикарбонил или радикал -СО-NR31R32, где R31 обозначает водородный атом, C1C4 алкил, гидрокси-C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил, аR31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,Arom обозначает R4-, R5-, R6- и R7-замещенный фенил,гдеR4 обозначает водородный атом или C1-C4 алкил,R5 обозначает водородный атом или C1-C4 алкил,R6 обозначает водородный атом или C1-C4 алкил, аR7 обозначает водородный атом, Х обозначает О (атом кислорода) или NH, и их соли. Особое предпочтение отдают соединениям формулы 1, гдеR1 обозначает метил,R2 обозначает метил, атом хлора или дифторметил,R3 обозначает гидроксиметил, метоксиметил, метоксиэтоксиметил, C1-C4 алкоксикарбонил или радикал -CO-NR31R32,гдеR31 обозначает метил или этил иR32 обозначает метил или этил,или гдеR31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой морфолиновый радикал,Arom обозначает фенил,2-метилфенил,2-изопропилфенил,2,6-диметилфенил,2,6 диизопропилфенил, 2,4,6-триметилфенил или 2,4,6-триизопропилфенил, а Х обозначает О (атом кислорода) или NH, и их солям. Особое предпочтение отдают также тем соединениям формулы 1, гдеR1 обозначает C1-C4 алкил,R2 обозначает C1-C4 алкил,R3 обозначает C1-C4 алкоксикарбонил или радикал -CO-NR31R32,гдеR32 обозначает C1-C4 алкил,Arom обозначает фенил, а Х обозначает О (атом кислорода), и их солям. Особое предпочтение отдают, кроме того, тем соединениям формулы 1, гдеR1 обозначает C1-C4 алкил,R2 обозначает C1-C4 алкил,R3 обозначает C1-C4 алкоксикарбонил или радикал -CO-NR31R32,гдеR32 обозначает C1-C4 алкил,Arom обозначает фенил или 2-метил-6-этилфенил, а Х обозначает О (атом кислорода), и их солям. Типичные соединения в соответствии с изобретением представляют собой, например,2,3-диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид,2,3-диметил-9-(2-этил-6-метилфенил)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-(N,Nдиметил)карбамид,2,3-диметил-9-(2-этил-6-метилфенил)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-(N,Nдиэтил)карбамид,2,3-диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-(N,N-диэтил)карбамид,этил-2,3-диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-карбоксилат,метил-2,3-диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-карбоксилат,этил-2,3-диметил-9-(2-этил-6-метилфенил)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6 карбоксилат и метил 2,3-диметил-9-(2-этил-6-метилфенил)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6 карбоксилат,а также соли этих соединений. Соединения в соответствии с изобретением могут быть получены так, как изложено в иллюстративном виде в приведенных ниже примерах, или начиная с соответствующих исходных материалов с использованием аналогичных стадий способов (см., например, US 4468400 или WO 95/27714), или так, как в довольно общем виде проиллюстрировано на приведенных ниже схемах. Схема 1. Получение соединений 1, где Х обозначает О, с любыми заместителями R1, R2, R3 и Arom Отдельные стадии способов осуществляют таким путем, который известен специалисту в данной области техники, например так, как более подробно изложено в WO 95/27714. Соединения формулы 1, где Х обозначает NH, могут быть получены в соответствии с приведенной ниже схемой 2: Схема 2. Исходные материалы, представленные на схемах 1 и 2, могут быть получены, например, в соответствии со способами, проиллюстрированными на приведенной ниже схеме 3. Схема 3. Типичное получение исходных материалов, необходимых для осуществления схем 1 и 2, где R1, R2 обозначают метил, и с различными заместителями R3. Процесс получения 8-бензилокси-6-бромимидазопиридинов проводят по методу, который специалисту в данной области техники известен. Превращение атома брома в остаток сложного этилового эфира может быть осуществлено различными путями, например с использованием карбонилирования по Хеку (сPd(II), моноксидом углерода и этанолом) или металлированием в положении 6 (литием или магнием) и последующей реакцией Гриньяра. Металлирование также дает возможность вводить в положение 6 другие целевые группы R3. При наличии остатка сложного эфира существует возможность вводить в положение 6 другие целевые группы R3, например гидрокси-C1-C4 алкильные радикалы (в частности гидроксиметильный радикал) восстановлением остатка сложного эфира алюмогидридом лития, или C1-C4 алкокси-C1C4 алкильные радикалы (в частности C1-C4 алкоксиметильные радикалы) последующей этерификацией так,как проиллюстрировано на схеме 3. Для получения соединений формулы 2 необходимо дебензилировать 8-бензилоксисоединения, полученные в соответствии со схемой 3. Дебензилирование/восстановление этих 8-бензилоксисоединений также проводят по методу, который известен, например с использованием водорода/Рd(0). Если требуются соединения формулы 2, где R3 обозначает -CO-NR31R32, можно проводить соответствующую дериватизацию по методу, который известен (превращение сложного эфира в амид или прямое введение амидного радикала, исходя из 6-бромсодержащего соединения). Исходные материалы с различными заместителями R1 и R2 известны или их можно получить по известному методу, аналогично известным соединениям, например основываясь на схеме 3. По другому варианту процессы дериватизации можно также проводить на стадии соединений 1. Так, например, с использованием соединения, где R2 обозначает Н, можно получить, в частности, соединения, у которых R2 обозначает СН 2 ОН (реакцией Вильсмайера и последующим восстановлением), у которых R2 обозначает Cl или Вr(хлорированием или бромированием), у которых R2 обозначает пропинил (из соответствующего соединения брома проведением реакции Соногашира) или у которых R2 обозначает алкоксикарбонил (из соответствующего соединения брома карбонилированием по Хеку).-7 007683 Приведенные ниже примеры служат для более подробной иллюстрации изобретения, без ограничения его объема. Подобным же образом по аналогичному методу или по методу, который специалисту в данной области техники известен, с использованием обычной технологии, можно получать другие соединения формулы 1, получение которых подробно не описано. Соединения, которые конкретно названы в качестве примеров, и соли этих соединений, составляют предпочтительный объект изобретения. Аббревиатурой мин обозначена минута (минуты), ч обозначен час (часы), а tпл обозначена температура плавления. Примеры Конечные продукты 1. 2,3-Диметил-9-фенил-7H-8,9-дигидропирано-[2,3-с]-N-(диэтил)имидазо[1,2-а]пиридин-6-карбоксамид При 25 С 3 мл эфирата борфторида с перемешиванием по каплям добавляют в раствор 1,00 г (2,53 ммоля) 2,3-диметил-8-гидрокси-7-3-фенил-3-гидрокси)пропанил)-N-(диэтил)имидазо[1,2-а]пиридин-6 карбоксамида в дихлорметане. Реакционную смесь перемешивают при 25 С в течение последующих 4 ч, а затем выливают в насыщенный раствор NаНСО 3 и неоднократно экстрагируют дихлорметаном. Объединенные органические фазы концентрируют под пониженным давлением. Полученный сырой продукт отделяют хроматографией в колонке (дихлорметан/метанол: 13/1) и очищают. В результате в виде бесцветной пены получают 0,90 г (2,38 ммоля) указанного в заглавии соединения. 1H-ЯМР (200 МГц, [D6]-ДМСО,100 С, ): 1,19 (t, 6 Н), 2,17-2,30 (m, 2 Н), 2,35 (s, 3 Н), 2,43 (s, 3 Н), 2,55-2,69 (m, 1 Н), 2,77-2,93 (m, 1 Н),3,42 (dd, 4 Н), 5,35 (dd, 1 Н), 7,43-7,57 (m, 5 Н), 7,73 (s, 1 Н). 2. Этил-2,3-диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-карбоксилат В высушенной над пламенем и продуваемой током аргона колбе раствор этил-2,3-диметил-8 гидрокси-7-(3'-гидрокси-3'-фенилпропил)имидазо[1,2-а]пиридин-6-карбоксилата (250 мг, 0,68 ммоля) в дихлорметане (15 мл) обрабатывают избыточным количеством эфирата борфторида (1,71 мл, 13,6 ммоля). Раствор перемешивают в течение 4 ч при комнатной температуре. Реакцию в реакционной смеси гасят при 0 С добавлением насыщенного раствора аммонийхлорида (20 мл). С использованием 6 н. раствора гидроксида натрия (3 мл) значение рН доводят до 7. Водную фазу экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы промывают 20 мл воды и сушат над сульфатом натрия. После выпаривания растворителя остаток (245 мг бесцветного твердого вещества) очищают экспресс-хроматографией[силикагель, растворительная система: петролейный эфир/этилацетат в объемном соотношении 1:1]. Указанное в заглавии соединение (164 мг, 69%-ный выход) получают в виде бесцветного твердого вещества(температура плавления: 146-147 С); 99,1%-ная чистота, в соответствии с ВЭЖХ анализом. 3. 2,3-Диметил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В наполненной аргоном колбе 2,3-диметил-8-гидрокси-7-(3'-гидрокси-3'-фенилпропил)имидазо[1,2 а]пиридин-6-(N,N-диметил)карбамид (2,00 г, 5,4 ммоля) растворяют в абсолютном дихлорметане (200 мл). Раствор перемешивают при комнатной температуре и добавляют эфирата борфторида (1,4 мл, 11 ммолей). Постепенно образуется бесцветный осадок, покрывающий стенку колбы. По прошествии 1 и 2 ч времени реакции добавляют дополнительные порции эфирата борфторида (2,8 мл, 22 ммоля) и (1,4 мл, 11 ммолей). По истечении в общей сложности 5 ч времени реакции составляющий верхний слой раствор выливают в охлажденный насыщенный раствор аммонийхлорида (10 мл). Образовавшуюся смесь нейтрализуют при 0 С 2 н. раствором гидроксида натрия. Фазы разделяют и водную фазу экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы промывают водой (20 мл) и концентрируют выпариванием в роторном испарителе. Остаточное твердое вещество (800 мг) промывают ацетоном (15 мл) и диэтиловым эфиром. Указанное в заглавии соединение (0,46 г, 24%-ный выход) получают в виде бесцветного твердого вещества с температурой плавления 245-247 С; чистое, как определяют с помощью 1 Н-ЯМРспектроскопии и ВЭЖХ (99,6%). Исходные материалы А. 6,8-Дибром-2,3-диметилимидазо[1,2-а]пиридин Смесь 31,8 г 2-амино-3,5-дибромпиридина, 22 г 3-бром-2-бутанона и 350 мл тетрагидрофурана кипятят с обратным холодильником в течение 9 дней и полученный осадок отфильтровывают и сушат под пониженным давлением. Далее этот осадок суспендируют в 1 л воды и с использованием 6 М водного раствора гидроксида натрия рН суспензии доводят до 8. Полученный осадок отфильтровывают и промывают водой. В результате получают 28 г указанного в заглавии соединения с tпл выше 90 С (спекшийся материал). Б. 8-Бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридин С охлаждением льдом 34,8 мл бензилового спирта по каплям вводят в суспензию 13,5 г гидрида натрия (60%-ная суспензия в парафине) в 510 мл диметилформамида и смесь перемешивают в течение 1 ч, до тех пор, пока не прекращается выделение газа. Далее небольшими порциями добавляют 51,2 г 6,8-дибром 2,3-диметилимидазо[1,2-а]пиридина и смесь перемешивают при комнатной температуре в течение 40 ч. Затем смесь выливают в 1 л смеси воды со льдом и три раза экстрагируют с использованием в каждом случае 100 мл дихлорметана, объединенные органические экстракты промывают насыщенным водным раствором аммонийхлорида и дважды водой и концентрируют досуха под пониженным давлением, а остаток растирают в порошок с небольшим количеством этилацетата. Полученный осадок отфильтровывают и сушат(этилацетат). В. 2,3-Диметил-8-бензилокси-N-(диэтил)имидазо[1,2-а]пиридин-6-карбоксамид 7,50 г (22,6 ммоля) 8-бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридина, 0,75 г (3,34 ммоля) ацетата палладия(II), 2,63 г (10,02 ммоля) трифенилфосфина и 7,50 мл (53,81 ммоля) триэтиламина суспендируют в диэтиламине (120 мл) и при 120 С и под давлением СО 6 бар перемешивают в автоклаве в течение 16 ч. После охлаждения катализатор отфильтровывают и сырой продукт концентрируют под пониженным давлением, а затем выделяют и очищают хроматографией в колонке (дихлорметан/метанол: 100/1). В результате в виде бесцветных кристаллов получают 5,58 г (15,88 ммоля/70%-ный выход) указанного в заглавии соединения с tпл 146-148 С (ацетон/диэтиловый эфир). Г. 2,3-Диметил-8-гидрокси-N-(диэтил)имидазо[1,2-а]пиридин-6-карбоксамид При 78 С 4,30 г (12,2 ммоля) 2,3-диметил-8-бензилокси-N-(диэтил)имидазо[1,2-а]пиридин-6 карбоксамида, 5,00 мл (54,0 ммоля) циклогекса-1,4-диена и 0,43 г (4,04 ммоля) палладия (10%-ный на угле) перемешивают в этаноле (43 мл) в течение 4 ч. Далее катализатор отфильтровывают и концентрируют, остаток растирают в порошок в ацетоне. В результате в виде бесцветных кристаллов получают 2,50 г (9,57 ммоля/78%-ный выход) указанного в заглавии соединения с tпл 215-218C (ацетон/с разложением). Д. 2,3-Диметил-7-диметиламинометил-8-гидрокси-N-(диэтил)имидазо[1,2-а]пиридин-6-карбоксамид С перемешиванием 1,75 г (9,26 ммоля) N,N-диметилметиленаммонийиодида понемногу в течение некоторого времени вводят в раствор 2,20 г (8,42 ммоля) 2,3-диметил-8-гидрокси-N-(диэтил)имидазо[1,2 а]пиридин-6-карбоксамида в дихлорметане (100 мл). Смесь перемешивают в течение последующих 16 ч и затем реакцию останавливают добавлением бикарбоната натрия. Далее смесь неоднократно экстрагируют дихлорметаном. Объединенные органические фазы промывают небольшим количеством воды и концентрируют под пониженным давлением. В результате в виде бесцветной пены получают 2,60 г (8,17 ммоля/97%ный выход) указанного в заглавии соединения. 1 Н-ЯМР (200 МГц, [d6]-ДМСО, ): 1,13 (t, 6 Н), 2,32 (s, 3 Н), 2,37 (s, 3 Н), 3,41 (m, 4 Н), 6,38 (d, 1 Н),7,74 (d, 1 Н). Е. 2,3-Диметил-8-гидрокси-7-3-фенил-3-оксо)пропанил)-N-(диэтил)имидазо[1,2-а]пиридин-6 карбоксамид При 80 С 2,40 г (7,50 ммоля) 2,3-диметил-7-диметиламинометил-8-гидрокси-N-(диэтил)имидазо[1,2 а]пиридин-6-карбоксамида, растворенного в толуоле (35,0 мл), по каплям с перемешиванием вводят в раствор 4,50 г (10,0 ммоля) 1-фенил-1-N-морфолиноэтилена в толуоле (35,0 мл), а затем смесь перемешивают при 90 С в течение последующего 1 ч. Охлажденную реакционную смесь концентрируют под пониженным давлением и сырой продукт выделяют и очищают хроматографией в колонке (дихлорметан/метанол: 13/1). В результате в виде бесцветных кристаллов получают 1,60 г (4,07 ммоля/54%-ный выход) указанного в заглавии соединения с tпл 218-220 С (ацетон/разложение). Ж. 2,3-Диметил-8-гидрокси-7-3-фенил-3-гидрокси)пропанил)-N-(диэтил)имидазо[1,2-а]пиридин-6 карбоксамид 0,31 г (8,20 ммоля) боргидрида натрия понемногу и с перемешиванием в течение некоторого времени вводят в 1,40 г (3,55 ммоля) 2,3-диметил-8-гидрокси-7-3-фенил-3-оксо)пропанил)-N-(диэтил)имидазо[1,2 а]пиридин-6-карбоксамида, растворенного в дихлорметане (30 мл). Реакционную смесь перемешивают в течение последующих 30 мин, а затем концентрируют под пониженным давлением и добавляют насыщенного раствора аммонийхлорида. Затем смесь неоднократно экстрагируют дихлорметаном. Объединенные органические фазы концентрируют под пониженным давлением. Полученный сырой продукт выделяют и очищают хроматографией в колонке (дихлорметан/метанол: 13/1). В результате в виде бесцветных кристаллов получают 1,23 г (3,10 ммоля/88%-ный выход) указанного в заглавии соединения с tпл 210-213C (дихлорметан/с разложением). 3. Этил-8-O-бензил-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилат В плакированном тефлоном стальном автоклаве 8-бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридин(4,0 г, 12 ммолей), ацетат палладия (400 мг, 1,78 ммоля), трифенилфосфин (1,33 г, 5,1 ммоля) и триэтиламин (10 мл) растворяют в этаноле (50 мл). Автоклав продувают монооксидом углерода, сжатым до давления 5 бар, и выдерживают при 100 С в течение 16 ч. Реакционную смесь концентрируют выпариванием в роторном испарителе и очищают экспресс-хроматографией (силикагель, растворительная система: этилацетат). Далее кристаллическое твердое вещество очищают промывкой диэтиловым эфиром. Получают бесцветные игольчатые кристаллы указанного в заглавии соединения (2,37 г, 61%-ный выход), которое проявляет температуру плавления 140-141 С. Концентрированием маточного раствора дополнительно получают 1,1 г (28%-ный выход) указанного в заглавии соединения. И. Этил-2,3-диметил-8-гидроксиимидазо[1,2-а]пиридин-6-карбоксилат В инертной атмосфере этил-8-O-бензил-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилат (8,14 г, 25,1 ммоля) растворяют в 80 мл этанола. Раствор обрабатывают 1,4-циклогексадиеном (11,9 мл, 126 ммолей) и 10%-ным палладием на угле (0,8 г). Реакционную смесь нагревают до 80 С и при этой температуре перемешивают в течение 18 ч. Раствор охлаждают до комнатной температуры, добавляют 10 г силикагеля и выпаривают растворитель. Остаток переносят в колонку, наполненную силикагелем. Элюированием смесью-9 007683 дихлорметана и метанола [в объемном соотношении 15:1] получают указанное в заглавии соединение (4,73 г, 80%-ный выход); чистый продукт, как устанавливают с помощью 1 Н-ЯМР-спектроскопии. Бесцветное твердое вещество проявляет температуру плавления 241 С (с разложением). К. Этил-2,3-диметил-7-(N,N-диметиламинометил)-8-гидроксиимидазо[1,2-а]пиридин-6-карбоксилат В течение 30-минутного периода N,N-диметилметиленаммонийиодид (соль Эшенмозера, 435 мг, 2,35 ммоля) вводят в раствор этил-2,3-диметил-8-гидроксиимидазо[1,2-а]пиридин-6-карбоксилата (500 мг, 2,14 ммоля) в 15 мл дихлорметана. При комнатной температуре реакционную смесь перемешивают в течение 2,5 ч, наблюдая образование бесцветного осадка. В реакционную смесь добавляют 20-миллилитровые порции насыщенного раствора бикарбоната натрия и дихлорметана. Водную фазу экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы промывают водой (20 мл), сушат над сульфатом натрия и выпаривают досуха. Указанное в заглавии соединение выделяют в виде зеленоватой пены, содержащей следы примесей (578 мг, 93%-ный выход). 1H-ЯМР (CDCl3, 200 МГц, ): 1,41 (t, 3 Н), 2,40 (s, 12 Н), 4,19(s, 2 Н), 4,37 (q, 2 Н), 8,04 (s, 1 Н). Л. Этил-2,3-диметил-8-гидрокси-7-(3'-оксо-3'-фенилпропил)имидазо[1,2-а]пиридин-6-карбоксилат В высушенной над пламенем колбе в аргоновой атмосфере в абсолютном толуоле (20 мл) растворяют этил-2,3-диметил-7-(N,N-диметиламинометил)-8-гидроксиимидазо[1,2-а]пиридин-6-карбоксилат (1,17 г, 4,0 ммоля) и пирролидиненамин (1,06 г, 5,2 ммоля, полученный в соответствии с W.A.White, H.Weingarten,J.Org.Chem. 1967, 32, 213-214). Раствор выдерживают при 100 С. По прошествии 40 мин реакционную смесь выпаривают досуха. Сырой продукт (1,89 г красного твердого вещества) очищают экспрессхроматографией [силикагель, растворительная система: дихлорметан/метанол в объемном соотношении 15:1]. Указанное в заглавии соединение (1,23 г, 84%-ный выход) получают в виде коричневатой пены (90%ной чистоты в соответствии с данными 1H-ЯМР-анализа). 1H-ЯМР (CDCl3, 200 МГц, ): 1,39 (t, 3 Н), 2,39 (s,6 Н), 3,46 (mc, 4 Н), 4,39 (q, 2 Н), 7,46 (mc, 3 Н), 8,03 (d, 2 Н), 8,10 (s, 1 Н). М. Этил-2,3-диметил-8-гидрокси-7-(3'-гидрокси-3'-фенилпропил)имидазо[1,2-а]пиридин-6-карбоксилат Раствор этил-2,3-диметил-8-гидрокси-7-(3'-оксо-3'-фенилпропил)имидазо[1,2-а]пиридин-6-карбоксилата(714 мг, 1,95 ммоля) в этаноле (20 мл) обрабатывают боргидридом натрия (74 мг, 1,95 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение 2,75 ч. При 0 С добавляют насыщенного раствора аммонийхлорида (20 мл). Раствор выпаривают до тех пор, пока не удаляют большую часть этанола, и экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы сушат над сульфатом натрия и выпаривают досуха. В виде коричневатой пены получают продукт (692 мг), который очищают экспрессхроматографией [силикагель, растворительная система: дихлорметан/метанол в объемном соотношении 15:1]. Указанное в заглавии соединение (540 мг, 75%-ный выход) выделяют в виде почти бесцветной пены; 90%-ная чистота, в соответствии с данными 1H-ЯМР-анализа. 1 Н-ЯМР (CDCl3, 200 МГц, ): 1,40 (t, 3 Н), 2,13 (mc, 2 Н),2,40 (s, 3 Н), 2,52 (s, 3 Н), 3,26 (mc, 1 Н), 3,50 (mc, 1 Н), 4,39 (q, 2 Н), 4,61 (dd, 1 Н), 7,24 (mc, 5 Н), 7,95 (s, 1 Н). Н. 8-O-Бензил-2,3-диметилимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В автоклав загружают 8-бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридин (13,5 г, 40 ммолей),диметиламин (2 М раствор в ТГФ, 200 мл, 400 ммолей), ацетат палладия (1,4 г, 6 ммолей) и трифенилфосфин (6,2 г, 23 ммоля). В системе создают давление моноксида углерода (6 бар) и ее выдерживают в течение 20 ч при 120 С. Желто-коричневый раствор концентрируют выпариванием в роторном испарителе. К остатку 100-миллилитровыми порциями добавляют воды и дихлорметана. Водную фазу экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы промывают водой (2 порции по 20 мл) и выпаривают досуха. Сырой продукт очищают экспресс-хроматографией (силикагель, растворительная система: дихлорметан). Указанное в заглавии соединение выделяют в виде желто-коричневого твердого вещества, плавящегося при температуре 160-161 С. На 1 Н-ЯМР-спектре видны следы примесей. О. 2,3-Диметил-8-гидроксиимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В инертной атмосфере 8-O-бензил-2,3-диметилимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид (13,0 г, 40 ммолей) растворяют в 200 мл этанола. Раствор обрабатывают 1,4-циклогексадиеном (30,0 мл, 317 ммолей) и 10%-ным палладием на угле (1,3 г). Реакционную смесь нагревают до 80 С и при этой температуре перемешивают в течение 3 ч. Добавляют другую порцию палладиевого катализатора (500 мг) и 1,4 циклогексадиена (10 мл, 106 ммолей) и раствор кипятят с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и осадок растворяют добавлением дихлорметана (150 мл). Фильтрованием удаляют катализатор и фильтрат концентрируют выпариванием в роторном испарителе. Желтый остаток промывают ацетоном и диэтиловым эфиром и сушат. Указанное в заглавии соединение(6,2 г, 66%-ный выход) получают в виде спектроскопически чистого бесцветного твердого вещества. 1HЯМР (ДМСО-d6, 200 МГц, ): 2,31 (s, 3 Н), 2,37 (s, 3 Н), 2,99 (s, 6 Н), 6,42 (d, 1 H), 7,80 (d, 1 H). П. 2,3-Диметил-7-(N,N-диметиламинометил)-8-гидроксиимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В течение 30-минутного периода N,N-диметилметиленаммонийиодид (соль Эшенмозера, 5,6 г, 30 ммолей) вводят в раствор 2,3-диметил-8-гидроксиимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамида (5,5 г,24 ммоля) в 100 мл дихлорметана. Реакционную смесь перемешивают в течение 70 мин при комнатной температуре и наблюдают образование желтого осадка. Затем смесь выливают в 50 мл охлажденного на- 10007683 сыщенного раствора бикарбоната натрия. Водную фазу экстрагируют дихлорметаном (6 порций по 20 мл). Объединенные органические фазы промывают водой (30 мл), сушат над сульфатом натрия и выпаривают досуха. Указанное в заглавии соединение (6,5 г, 95%-ный выход) выделяют в виде спектроскопически чистого бесцветного твердого вещества, плавящегося при температуре 210 С (с разложением). Р. 2,3-Диметил-8-гидрокси-7-(3'-оксо-3'-фенилпропил)имидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В высушенной над пламенем колбе в аргоновой атмосфере в абсолютном толуоле (50 мл) растворяют 2,3 диметил-7-(N,N-диметиламинометил)-8-гидроксиимидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид (3,2 г, 11 ммолей) и пирролидиненамин (3,1 г, 18 ммолей, полученный в соответствии с W.A.White, H.Weingarten,J.Org.Chem. 1967, 32, 213-214). Раствор выдерживают при 105 С. По истечении 15 мин реакционную смесь охлаждают до 0 С и выливают в смесь воды со льдом (50 мл) и дихлорметана (50 мл). Коричневую органическую фазу удаляют, а водную фазу экстрагируют дихлорметаном. Объединенные органические фазы промывают водой (20 мл), сушат над сульфатом натрия и выпаривают досуха. Сырой продукт (5 г коричневого твердого вещества) очищают экспресс-хроматографией [силикагель, растворительная система:дихлорметан]. Указанное в заглавии соединение (3,2 г, 79%-ный выход) получают в виде коричневатой пены. На 1 Н-ЯМР-спектре этого соединения видны следы примесей. 1 Н-ЯМР (ДМСО-d6, 200 МГц, ): 2,32 (s, 3 Н), 2,36 (s, 3 Н), 2,82 (mc, 2 Н), 2,89 (s, 3 Н), 3,01 (s, 3 Н), 3,21 (mc, 2 Н), 7,59 (mc, 3 Н), 7,95 (d, 2 Н), 7,99 (s, 1 Н). С. 2,3-Диметил-8-гидрокси-7-(3'-гидрокси-3'-фенилпропил)имидазо[1,2-а]пиридин-6-(N,N-диметил)карбамид В течение 20-минутного периода в раствор 2,3-диметил-8-гидрокси-7-(3'-оксо-3'фенилпропил)имидазо[1,2-а]пиридин-6-(N,N-диметил)карбамида (3,10 г, 8,5 ммоля) в метаноле (30 мл) добавляют боргидрида натрия (0,40 г, 10,6 ммоля). При комнатной температуре реакционную смесь перемешивают в течение 40 мин. Добавляют другую порцию боргидрида натрия (0,10 г, 2,6 ммоля) и раствор перемешивают в течение последующих 30 мин. Затем реакционную смесь выливают в смесь насыщенного раствора аммонийхлорида (50 мл), льда (20 г) и дихлорметана (100 мл). Фазы разделяют и водную фазу экстрагируют дихлорметаном (3 порции по 20 мл). Объединенные органические фазы промывают насыщенным раствором аммонийхлорида (2 порции по 20 мл) и водой (2 порции по 20 мл), сушат над сульфатом натрия и выпаривают досуха. Остаток обрабатывают ацетоном (12 мл). Образуется бесцветный осадок, который промывают ацетоном и диэтиловым эфиром и сушат. Указанное в заглавии соединение (2,10 г, 67%ный выход) выделяют в виде бесцветного твердого вещества (tпл: 148-150C); чистый продукт, по данным 1H-ЯМР-спектроскопии. Маточный раствор (0,8 г) очищают экспресс-хроматографией [силикагель, растворительная система: дихлорметан/изопропанол в объемном соотношении 20:1], получая дополнительно 0,29 г (9%-ный выход) указанного в заглавии соединения. Промышленная полезность Соединения формулы 1 и их соли обладают ценными фармакологическими свойствами, которые обуславливают их техническую полезность. Так, в частности, они проявляют заметное ингибирование секреции желудочного сока и превосходное защитное воздействие на желудок и кишечник у теплокровных животных, в частности людей. В этом отношении соединения в соответствии с изобретением отличаются высокой селективностью действия, преимуществом продолжительного действия, в частности хорошего тонкокишечного действия, отсутствием заметных побочных эффектов и большим терапевтическим диапазоном. В этой связи понятие "желудочная и кишечная защита" используется в смысле профилактики и лечения желудочно-кишечных заболеваний, в частности желудочно-кишечных заболевания воспалительного характера и патологических изменений (таких как, например, язва желудка, язва двенадцатиперсной кишки,гастрит, функциональная диспепсия, связанная с повышенной кислотностью или лекарственными препаратами), которые могут быть вызваны, например, микроорганизмами (например, Helicobacter pylori), бактериальными токсинами, лекарственными средствами (например, некоторыми противовоспалительными и противоревматическими), химическими соединениями (например, этанолом), желудочным соком или стрессовыми ситуациями. К превосходным свойствам соединений в соответствие с изобретением относится то, что в различных моделях, в которых определяют противоязвенные и антисекреторные свойства, эти соединения показывают явное превосходство по сравнению с уже известными соединениями. Благодаря этим свойствам соединения формулы 1 и их фармакологически приемлемые соли могут быть с успехом использованы в медицине и ветеринарии, где их применяют, в частности, при лечении и/или профилактике заболеваний желудка и/или кишечника. Следовательно, еще один объект изобретения составляют соединения в соответствии с изобретением для применения при лечении и/или профилактике вышеупомянутых заболеваний. Подобным же образом изобретение охватывает применение соединений в соответствии с изобретением при приготовлении лекарственных средств, которые используют для лечения и/или профилактики вышеупомянутых заболеваний. Более того, изобретение включает применение соединений в соответствии с изобретением для лечения и/или профилактики вышеупомянутых заболеваний. Кроме того, объект изобретения составляют лекарственные средства, которые включают одно или несколько соединений формулы 1 и/или их фармакологически приемлемые соли.- 11007683 Лекарственные средства готовят по способам, которые известны и знакомы специалисту в данной области техники. В качестве лекарственных средств фармакологически активные соединения в соответствии с изобретением (т.е. действующие соединения) используют либо самостоятельно, либо, что предпочтительно,в сочетании с приемлемыми фармацевтическими вспомогательными средствами или наполнителями в форме таблеток, таблеток с покрытиями, капсул, суппозиториев, пластырей (например, как TTS), эмульсий,суспензий или растворов, причем целесообразное содержание действующего вещества находится в пределах 0,1 и 95% и благодаря соответствующему выбору вспомогательных средств и наполнителей существует возможность приготовить фармацевтическую препаративную форму для введения в организм, точно адаптированную к действующему веществу и/или к целевому началу, и/или продолжительности действия (например, формы для непрерывного высвобождения или тонкокишечной формы). Если исходить из собственных знаний квалифицированного специалиста в данной области техники, то ему знакомы вспомогательные средства и наполнители, которые приемлемы для приготовления целевых фармацевтических композиций. В дополнение к растворителям, желатинизирующим агентам, основам для суппозиториев, вспомогательным средствам для изготовления таблеток и другим носителям для действующих веществ, можно использовать, например, антиоксиданты, диспергаторы, эмульгаторы, пеногастители,корригенты, консерванты, солюбилизаторы, красители или, в частности, агенты, содействующие проникновению, и комплексообразователи (например, циклодекстрины). Действующие соединения можно вводить перорально, парэнтерально или через кожу. В общем, как было установлено, при лечении человека в случае перорального введения действующего вещества (веществ) для достижения целевого результата ежедневная доза составляет от приблизительно 0,01 до приблизительно 20, предпочтительно от 0,05 до 5, в частности от 0,1 до 1,5, мг/кг массы тела, в виде, если приемлемо, нескольких, предпочтительно от 1 до 4, дробных доз. В случае лечения парентеральным введением можно прибегнуть к аналогичным или (в частности, в случае внутривенного введения действующего вещества) как правило к пониженным дозам. Оптимальные дозы и пути введения действующих веществ, которые необходимы в каждом случае, любой квалифицированный специалист в данной области техники может легко определить, основываясь на своих собственных знаниях. Если соединения в соответствии с изобретением и/или их соли предусмотрены для применения при лечении вышеупомянутых заболеваний, фармацевтические препараты могут также содержать один или несколько фармакологически активных компонентов из лекарственных средств других групп, например транквилизаторов (в частности, группы бензодиазепинов, например диазепам), спазмолитических средств (например, биетамиверин или камилофин), антихолинергических средств (например, оксифенциклимин или фенкарбамид), локальных анестетиков, (например, тетракаин или прокаин) и, если приемлемо, также ферментов, витаминов или аминокислот. В связи с этим необходимо, в частности, особо выделить сочетание соединений в соответствии с изобретением с фармацевтическими препаратами, которые ингибируют секрецию кислоты, такие как, например, Н 2 блокаторы (например, циметидин, ранитидин), ингибиторами Н+/К+ АТФ-азы (например, омепразол, пантопразол) или, кроме того, с так называемыми периферическими антихолинергическими средствами (например, пирензепин, телензепин) и антагонистами гастрина для усиления основного действия в дополнительном или в сверхдополнительном ощущении и/или для устранения или снижения побочного влияния или к тому же сочетание с веществами с антибактериальной активностью (такими как, например, цефалоспорины, тетрациклины, пенициллины, макролиды, нитроимидазолы или, кроме того, соли висмута) для борьбы с Helicobacter pyroli. Приемлемыми антибактериальными сокомпонентами, которые могут быть упомянуты, являются, например, мезлоциллин, ампициллин, амоксициллин, цефалоцин, цефокситин, цефотаксим, имипенем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин,ацитромицин и их сочетания (например, кларитромицин + метронидазол). Фармакология В исследованиях на экспериментальных моделях животных можно продемонстрировать превосходное защитное действие соединений в соответствии с изобретением на желудок и ингибирующее действие на выделение желудочного сока. Соединениям в соответствии с изобретением, исследованным на упомянутых ниже моделях, присваивали номера, которые соответствовали номерам этих соединения в примерах. Испытание ингибирующего действия на секрецию на примере перфузного желудка крыс В таблице А, представленной ниже, показано влияние соединений в соответствии с изобретением на стимулированную пентагастрином секрецию кислоты, выделяемую перфузным желудком крысы после интрадуоденального введения in vivo. Таблица А Методология После трахеотомии брюшную полость анестезированных животных (крыса CD, самки весом 200-250 г, 1,5 г/кг уретана, внутримышечно) вскрывали посредством центрального верхнего чревосечения и через рот в пищеводе фиксировали катетр из ПВХ, а другой - через пилорус так, чтобы концы трубок находились непосредственно в полости желудка. Катетр, шедший от пилоруса, проходил снаружи через боковое отверстие в правую абдоминальную стенку. После тщательной промывки (примерно 50-100 мл) через желудок непрерывно пропускали теплый(37 С) физиологический раствор NaCl (0,5 мл/мин, рН: 6,8-6,9; Braun-Unita I). Каждые 15 мин собирали вытекавшую жидкость, в которой измеряли рН (рН-метр 632, стеклянный электрод ЕА 147, диаметр: 5 мм,Metrohm), а количество секретируемой НCl определяли титрованием этой жидкости свежеприготовленным 0,01 н. раствором NaOH, доводя рН до 7 (Dosimat 665 Metrohm). Примерно через 30 мин после окончания операции (в частности, после определения 2-х предварительных фракций) постоянным введением внутривенно (в левую бедренную вену) пентагастрина в количестве 1 мг/кг (равно 1,65 мл/ч) стимулировали желудочную секрецию. По прошествии 60 мин после начала непрерывного введения пентагастрина интрадуоденально вводили тестируемые вещества в количестве 2,5 мл/кг. Температуру тела животных поддерживали на постоянном уровне 37,8-38 С, используя инфракрасное облучение и нагревательные прокладки (автоматический непрерывный контроль с помощью ректального температурного сенсора). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1C1-C4 алкокси-C1-C4 алкил,C1-C4 алкокси-С 1-C4 алкокси-C1-C4 алкил,C1C4 алкоксикарбонил, фтор-С 1-C4 алкокси-C1-C4 алкил или радикал -CO-NR31R32, где R31 обозначает водородный атом, C1-С 7 алкил или C1-C4 алкокси-C1-C4 алкил и R32 обозначает водородный атом, C1-С 7 алкил илиR31 и R32 совместно и включая атом азота, к которому они присоединены, образуют пирролидиновый, пиперидиновый или морфолиновый радикал,Arom представляет собой R4-, R5-, R6- и R7-замещенный моно или бициклический ароматический радикал, выбранный из ряда, включающего фенил, нафтил, пирролил, пиразолил, имидазолил, 1,2,3 триазолил, индолил, бензимидазолил, фуранил (фурил), бензофуранил (бензофурил), тиофенил (тиенил),бензотиофенил (бензотиенил), тиазолил, изоксазолил, пиридинил, пиримидинил, хинолинил и изохинолинил, где R4 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси, С 2-C4 алкенилокси, C1C4 алкилкарбонил, карбоксил, C1-C4 алкоксикарбонил, карбокси-C1-C4 алкил, C1-C4 алкоксикарбонил-C1C4 алкил, атом галогена, гидроксил, арил, арил-C1-C4 алкил, арилокси, арил-С 1-C4 алкокси, трифторметил,нитро-, амино-, моно- или ди-C1-C4 алкиламино-, C1-C4 алкилкарбониламино-, C1-C4 алкоксикарбониламино-, С 1-C4 алкокси-С 1-C4 алкоксикарбониламиногруппу или сульфонил, R5 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси, C1-C4 алкоксикарбонил, атом галогена, трифторметил или гидроксил,R6 обозначает водородный атом, С 1-C4 алкил или атом галогена и R7 обозначает водородный атом, C1C4 алкил или атом галогена, где арил представляет собой фенил или замещенный фенил, содержащий один,два или три одинаковых или разных заместителя, выбранных из ряда, включающего C1-C4 алкил, С 1C4 алкокси, карбоксил, C1-C4 алкоксикарбонил, атом галогена, трифторметил, нитрогруппу, трифторметокси,гидроксил и цианогруппу,Х обозначает О или NH,и его соли. 2. Соединение формулы 1 по п.1,- 13007683 где R1 обозначает водородный атом, C1-C4 алкил, С 3-С 7 циклоалкил, C1-C4 алкокси-С 1-C4 алкил или фтор-C1-C4 алкил,R2 обозначает водородный атом, С 1-C4 алкил, атом галогена или фтор-C1-C4 алкил,R3 обозначаетC1-C4 алкокси-C1-C4 алкил,C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкил,C1C4 алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает водородный атом, C1-С 7 алкил или C1C4 алкокси-C1-C4 алкил и R32 обозначает водородный атом, C1-С 7 алкил или C1-C4 алкокси-C1-C4 алкил, или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,Arom представляет собой R4-, R5-, R6- и R7-замещенный моно или бициклический ароматический радикал, выбранный из ряда, включающего фенил, фуранил (фурил) и тиофенил (тиенил), где R4 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси, С 1-C4 алкилкарбонил, карбоксил, C1-C4 алкоксикарбонил, атом галогена, гидроксил, трифторметил, C1-C4 алкилкарбониламино-, C1-C4 алкоксикарбониламино-, С 1C4 алкокси-С 1-C4 алкоксикарбониламиногруппу или сульфонил, R5 обозначает водородный атом, C1C4 алкил, C1-C4 алкокси, C1-C4 алкоксикарбонил, атом галогена, трифторметил или гидроксил, R6 обозначает водородный атом или C1-C4 алкил, a R7 обозначает водородный атом, R7 обозначает водород,Х обозначает О или NH,и его соли. 3. Соединение формулы 1 по п.1,где R1 обозначает C1-C4 алкил,R2 обозначает C1-C4 алкил, атом галогена или фтор-C1-C4 алкил,R3 обозначает C1-C4 алкокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкил, C1-C4 алкоксикарбонил или радикал -CO-NR31R32,где R31 обозначает водородный атом, C1-C4 алкил, C1-C4 алкокси-C1-C4 алкил, а R32 обозначает C1C4 алкил или C1-C4 алкокси-C1-C4 алкил,или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой пирролидиновый, пиперидиновый или морфолиновый радикал,Arom обозначает R4-, R5-, R6- и R7-замещенный фенил,где R4 обозначает водородный атом или C1-C4 алкил,R5 обозначает водородный атом или C1-C4 алкил,R6 обозначает водородный атом или C1-C4 алкил, аR7 обозначает водородный атом, Х обозначает О или NH,и его соли. 4. Соединение формулы 1 по п.1, где R1 обозначает метил,R2 обозначает метил, атом хлора или дифторметил,R3 обозначает метоксиметил, метоксиэтоксиметил, C1-C4 алкоксикарбонил или радикал -CO-NR31R32,где R31 обозначает метил или этил и R32 обозначает метил или этил,или где R31 и R32 совместно и включая атом азота, к которому они присоединены, представляют собой морфолиновый радикал,Arom обозначает фенил, 2-метилфенил, 2-изопропилфенил, 2,6-диметилфенил, 2,6-диизопропилфенил,2,4,6-триметилфенил или 2,4,6-триизопропилфенил,а Х обозначает О или NH,и его соли. 5. Соединение формулы 1 по п.1, где R1 обозначает C1-C4 алкил, R2 обозначает C1-C4 алкил, R3 обозначает C1-C4 алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает C1-C4 алкил и R32 обозначаетC1-C4 алкил, Arom обозначает фенил, а X обозначает О, и его соли. 6. Соединение формулы 1 по п.1, где R1 обозначает C1-C4 алкил, R2 обозначает C1-C4 алкил, R3 обозначает С 1-C4 алкоксикарбонил или радикал -CO-NR31R32, где R31 обозначает C1-C4 алкил и R32 обозначаетC1-C4 алкил, Arom обозначает фенил или 2-метил-6-этилфенил, а Х обозначает О, и его соли. 7. Лекарственное средство, включающее соединение по п.1 и/или его фармакологически приемлемую соль совместно с обычными фармацевтическими вспомогательными средствами и/или наполнителями. 8. Применение соединения по п.1 и его фармакологически приемлемых солей для профилактики и лечения желудочно-кишечных заболеваний.
МПК / Метки
МПК: C07D 221/00, C07D 491/14, C07D 491/12, C07D 311/00, A61P 1/04, C07D 235/00
Метки: трициклические, имидазопиридины
Код ссылки
<a href="https://eas.patents.su/16-7683-triciklicheskie-imidazopiridiny.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические имидазопиридины</a>
Предыдущий патент: Стабилизированные водные суспензии для парентерального использования
Следующий патент: Способ получения олефинов из оксигенатов
Случайный патент: Звено трубопровода для транспортирования твердых частиц нагретого материала