Фармацевтическая композиция и способ лечения вич-инфекции
Номер патента: 19893
Опубликовано: 30.07.2014
Авторы: Вивиан Рэндалл У., Десай Маной К., Хонг Аллен Ю., Лю Хонгтао, Хуэй Хонь К., Сюй Ляньхонг
Формула / Реферат
1. Фармацевтическая композиция для лечения ВИЧ-инфекции, включающая модулятор фармакокинетических свойств структурной формулы
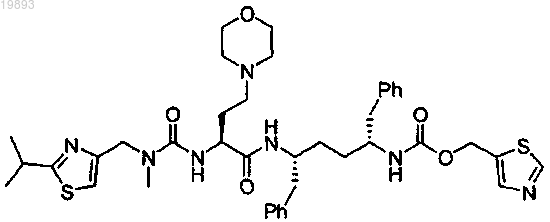
и эмтрицитабин, тенофовир дисопроксил фумарат, элвитегравир и фармацевтически приемлемый носитель или наполнитель.
2. Композиция по п.1, которая представлена в форме для орального введения.
3. Способ лечения ВИЧ-инфекции, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.1.
Текст
Настоящее изобретение относится к фармацевтической композиции для лечения инфекций ВИЧ, содержащей эмтрицитабин, тенофовир дисопроксил фумарат, элвитегравир и модулятор фармакокинетических свойств структурной формулы Согласно другому варианту реализации настоящее изобретение относится к способу лечения инфекции ВИЧ с помощью указанной композиции. Область техники, к которой относится изобретение Заявка на данный патент относится в общем к соединениям-модуляторам и фармацевтическим композициям, которые модифицируют, например улучшают, фармакокинетику совместно вводимого лекарственного препарата, и способам модификации, например улучшения, фармакокинетики лекарственного препарата путем совместного введения модуляторов с лекарственным препаратом. Сведения о предшествующем уровне техники Окислительный метаболизм ферментов цитохрома Р 450 представляет собой один из основных механизмов метаболизма лекарственного препарата. Может быть трудным поддерживать в плазме крови терапевтически эффективные уровни лекарственных препаратов, которые быстро метаболизируются ферментами цитохрома Р 450. Соответственно уровни в плазме крови лекарственных препаратов, которые чувствительны к разложению ферментом цитохрома Р 450, могут поддерживаться или усиливаться ингибиторами цитохрома Р 450, улучшая тем самым фармакокинетику лекарственного препарата. Хотя известно, что ряд лекарственных препаратов ингибирует ферменты цитохрома Р 450, требуются дополнительные и/или усовершенствованные ингибиторы монооксигеназы Р 450. В частности, было бы желательным иметь ингибиторы монооксигеназы Р 450, которые не обладают существенной биологической активностью, отличной от ингибирования цитохрома P450. Данные ингибиторы можно использовать для минимизации нежелательной биологической активности, например побочных эффектов. Кроме того,было бы желательным иметь ингибиторы монооксигеназы Р 450, у которых отсутствует существенный или имеется пониженный уровень активности ингибитора протеазы. Данные ингибиторы можно было бы использовать для повышения эффективности антиретровирусных лекарственных препаратов при минимизации возможности вызывать устойчивость вирусов, особенно в отношении ингибиторов протеазы. Краткое описание изобретения Настоящее изобретение относится к фармацевтической композиции для лечения инфекций ВИЧ,содержащей модулятор фармакокинетических свойств, охватываемый структурной формулой и эмтрицитабин, тенофовир дисопроксил фумарат, элвитегравир и фармацевтически приемлемый носитель или наполнитель. Настоящее изобретение также относится к способу лечения инфекции ВИЧ, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества указанной фармацевтической композиции. Подробное описание изобретения Теперь будет сделана ссылка в деталях на ряд пунктов формулы изобретения, примеры которых иллюстрируют в сопровождающих структурах и формулах. Хотя изобретение будет описано в связи с перечисленными пунктами формулы, следует иметь в виду, что они не предназначены для ограничения изобретения данными пунктами формулы. Напротив, изобретение предназначено для того, чтобы покрывать все альтернативные варианты, модификации и эквивалентные решения, которые могут быть включены в объем настоящего изобретения, как определено в пунктах формулы. Все документы, приведенные в данном контексте, включены в виде ссылки в своей полноте для всех целей. Согласно одному из вариантов реализации настоящее изобретение относится к фармацевтической композиции для лечения инфекций ВИЧ, содержащей в качестве активного компонента модулятор фармакокинетических свойств структурной формулы и эмтрицитабин, тенофовир дисопроксил фумарат, элвитегравир и фармацевтически приемлемый носитель или наполнитель. Согласно другому варианту реализации фармацевтическая композиция может быть в форме, предназначенной для перорального введения, например в форме таблетки. Согласно еще одному варианту реализации настоящее изобретение также относится к способу лечения инфекции ВИЧ, включающему введение пациенту, нуждающемуся в этом, терапевтически эффек-1 019893 тивного количества указанной фармацевтической композиции, состоящей из эмтрицитабина, тенофовир дисопроксил фумарата, элвитегравира и модулятора фармакокинетических свойств структурной формулы Фармацевтические препараты Композиции, соответствующие данному изобретению, получают с принятыми носителями и наполнителями, которые будут выбирать в соответствии с обычной практикой. Таблетки будут содержать наполнители, скользящие агенты, инертные наполнители, связующие компоненты и т.п. Водные препараты готовят в стерильной форме, и, когда они предназначены для доставки, отличной от перорального введения, они, как правило, будут изотоническими. Все препараты будут необязательно включать наполнители, такие как приведенные в Handbook of Pharmaceutical Excipients (Справочник по фармацевтическим наполнителям) (1986), включенной в данном контексте в виде ссылки во всей полноте. Наполнители включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как EDTA (этилендиаминтетрауксусная кислота), углеводы, такие как декстрин, гидроксиалкилцеллюлоза, гидроксиалкилметилцеллюлоза, стеариновая кислота и т.п. рН препаратов лежит в интервале от приблизительно 3 до приблизительно 11, оно обычно составляет приблизительно 7-10. Носитель(и) должен быть "приемлемым(и)" в смысле совместимости с другими ингредиентами препарата и физиологически безвредным(и) для его реципиента. Препараты включают те, которые подходят для вышеупомянутых способов введения. Препараты могут удобно находиться в унифицированной лекарственной форме и могут быть изготовлены любым из способов, хорошо известных в области фармации. Способы и составы, как правило, находят в справочнике Remington's Pharmaceutical Sciences (Фармацевтические науки Ремингтона) (Mack Publishing Co.,Easton, Pa.), включенном в данном контексте в виде ссылки во всей полноте. Данные способы включают стадию соединения активных ингредиентов с носителем, который составляет один или более вспомогательных ингредиентов. В общем препараты получают путем однородного и тесного соединения активных ингредиентов с жидкими носителями или тонко измельченными твердыми носителями или обоими с последующим, при необходимости, формованием продукта. Препараты, соответствующие настоящему изобретению, подходящие для перорального введения,могут быть представлены в виде отдельных элементов, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости или в виде жидкой эмульсии типа масло-в-воде или жидкой эмульсии вода в масле. Активный ингредиент можно также вводить в виде болюса, электуария или пасты. Таблетку изготавливают прессованием или формованием, необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки можно получить прессованием в подходящем устройстве активных ингредиентов в сыпучей форме, такой как порошок или гранулы, необязательно смешанный со связующим агентом, скользящим компонентом, инертным разбавителем, консервантом,поверхностно-активным или разрыхляющим агентом. Формованные таблетки можно изготовить формованием в подходящем устройстве смеси порошка активных ингредиентов, увлажненного инертным жидким разбавителем. Таблетки необязательно могут быть покрытыми или иметь насечки и необязательно изготавливаются так, чтобы обеспечивать медленное или контролируемое высвобождение активного ингредиента. Для введения в глаз или другие наружные ткани, например рот и кожу, предпочтительно, когда препараты применяют в виде мази или крема для местного применения, содержащего активные ингредиенты в количестве, например, 0,075-20% мас./мас. (в том числе активные ингредиенты в интервале от 0,1 до 20% с приращением 0,1% мас./мас., таким как 0,6, 0,7% мас./мас. и т.п.), предпочтительно 0,2-15% мас./мас. и наиболее предпочтительно 0,5-10% мас./мас. При введении в мазь активные ингредиенты можно использовать либо с парафиновой, либо с несмешивающейся с водой мазевой основой. Альтернативно активные ингредиенты можно ввести в состав крема с кремовой основой типа масло-в-воде. При необходимости водная фаза кремовой основы может включать, например, по меньшей мере 30% мас./мас. многоатомного спирта, т.е. спирта, имеющего две или более гидроксильные группы, такого как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. Местные препараты могут при необходимости включать соединение, которое повышает всасывание или проникновение активного ингредиента через кожу или другие пораженные области. Примеры данных агентов, повышающих проницаемость кожи, включают диметилсульфоксид и близкие аналоги. Масляная фаза эмульсий, соответствующих данному изобретению, может быть составлена из известных ингредиентов известным образом. Хотя фаза может включать просто эмульгатор (по-другому известный как эмульгирующий агент), желательно, когда она включает смесь по меньшей мере одного эмульгатора с жиром или маслом либо обоими, жиром и маслом. Предпочтительно, когда гидрофильный эмульгатор включен вместе с липофильным эмульгатором, который действует как стабилизатор. Кроме того, предпочтительно включение как масла, так и жира. Совместно эмульгатор(ы) со стабилизатором(ами) или без него (них) создают так называемый эмульгирующий воск, и воск вместе в маслом и жиром создают так называемую эмульгирующую мазевую основу, которая образует масляную дисперсионную фазу кремовых препаратов. Эмульгаторы и стабилизаторы эмульсии, подходящие для использования в препарате, соответствующем изобретению, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностерат и лаурилсульфат натрия. Выбор подходящих масел или жиров для препарата основан на достижении требуемых косметических свойств. Крем должен быть предпочтительно нежирным, неокрашивающим и смываемым продуктом с подходящей консистенцией, чтобы избежать вытекания из тюбиков или других контейнеров. Можно использовать сложные эфиры одно- или двухосновных алкилов с неразветвленной или разветвленной цепью, такие как диизоадипат, изоцетилстеарат, сложный диэфир пропиленгликоля и жирных кислот кокоса, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известную как Crodamol CAP, причем три последних представляют собой предпочтительные сложные эфиры. Их можно использовать в виде монокомпонента или в комбинации в зависимости от требуемых свойств. Альтернативно используют липиды с высокими температурами плавления, такие как бесцветный мягкий парафин и/или вазелиновое масло либо другие минеральные масла. Фармацевтические препараты, включающие активные ингредиенты, могут быть в форме, подходящей для предназначенного способа применения. При использовании для перорального применения можно получить таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального применения, можно получить согласно любому способу, известному в области изготовления фармацевтических композиций, и данные композиции могут включать один или более агентов, в том числе подсластители, вкусовые добавки, красители и консерванты для получения приятного на вкус препарата. Приемлемы таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым наполнителем, который пригоден для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, лактоза моногидрат, натрий кроскармеллоза, повидон, фосфат кальция или натрия; гранулирующие и разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота; связующие агенты, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или камедь, и скользящие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или могут быть покрыты с помощью известных способов, в том числе микроинкапсуляции,чтобы замедлить распад и всасывание в желудочно-кишечном тракте и, таким образом, обеспечить замедленное действие в течение более длительного периода. Например, может быть использован такой материал для задержки во времени, как глицерилмоностеарат или глицерилдистеарат в виде монокомпонента или с воском. Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой, такой как арахисовое масло, вазелиновое масло или оливковое масло. Водные суспензии, соответствующие изобретению, содержат активные ингредиенты в смеси с наполнителями, подходящими для приготовления водных суспензий. Данные наполнители включают суспендирующий агент, такой как натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации, и разрыхлители или смачивающие агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеаратом), продукт конденсации этиленоксида с алифатическим спиртом с длинной цепью (например, гептадекаэтиленоксиэтанолом), продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты, и гекситоловым ангидридом (например, полиоксиэтиленсорбитмоноолеат). Водная суспензия может также включать один или более консервантов, таких как этил- или н-пропил п-гидроксибензоат, один или более красителей, один или более вкусовых добавок и один или более подсластителей, таких как сахароза или сахарин. Масляные суспензии можно получить суспендированием активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как вазелиновое масло. Пероральные суспензии могут включать загуститель,такой как пчелиный воск, твердый парафин или цетиловый спирт. Можно добавить подсластители, такие как приведены в данном контексте, и вкусовые агенты для получения приятного на вкус перорального препарата. Данные композиции можно законсервировать добавлением антиоксиданта, такого как аскорбиновая кислота. Диспергирующиеся порошки и гранулы, соответствующие изобретению, пригодные для получения водной суспензии путем добавления воды, дают активный ингредиент в смеси с дисперсионным или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты проиллюстрированы вышеописанными. Дополнительные наполнители, например подсластители, вкусовые добавки и красители, также могут присутствовать. Фармацевтические композиции, соответствующие изобретению, могут также находиться в форме эмульсий типа масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как вазелиновое масло, или их смесь. Подходящие эмульгаторы включают природные камеди, такие как камедь акации и камедь трагаканта,природные фосфатиды, такие как соевый лецитин, сложные эфиры или частичные сложные эфиры, полученные из жирных кислот, и гекситоловые ангидриды, такие как сорбитмоноолеат, и продукты конденсации данных частичных сложных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитмоноолеат. Эмульсия может также включать подсластители и вкусовые агенты. Сиропы и эликсиры можно получить с подсластителями, такими как глицерин, сорбит или сахароза. Данные препараты могут также включать средство, уменьшающее раздражение, консервант, вкусовой компонент или краситель. Фармацевтические композиции, соответствующие изобретению, могут находиться в форме стерильного инъекционного препарата, такого как стерильная инъекционная водная или масляная суспензия. Данная суспензия может быть изготовлена согласно известному уровню техники с использованием тех подходящих диспергирующих или смачивающих агентов, которые упомянуты в данном контексте. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, таком как раствор в 1,3-бутандиоле, или быть приготовленном в виде лиофилизированного порошка. В числе приемлемых носителей и растворителей, которые могут быть использованы: вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла могут быть принятым образом использованы в качестве растворителя или суспендирующей среды. Для данной цели можно использовать любую смесь, включая синтетические моно- или диглицериды. Кроме того,жирные кислоты, такие как олеиновая кислота, можно аналогичным образом использовать для получения инъекционных препаратов. Количество активных ингредиентов, которое можно комбинировать с материалом носителя для получения лекарственной формы для однократного введения, будет варьировать в зависимости от хозяина,которого лечат, и конкретного способа введения. Например, препарат с высвобождением в течение времени, предназначенный для перорального введения человеку, может включать приблизительно 1-1000 мг активных ингредиентов в комбинации с соответствующим и удобным количеством материала носителя,которое может варьировать от приблизительно 5 до приблизительно 95% от общих композиций (масса:масса). Можно получить фармацевтическую композицию, чтобы обеспечить легкоизмеряемые количества для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может включать от приблизительно 3 до 500 мкг активных ингредиентов/мл раствора, чтобы можно быть осуществить инфузию подходящего объема со скоростью приблизительно 30 мл/ч. Препараты, подходящие для введения в глаз, включают глазные капли, в которых активные ингредиенты растворены или суспендированы в подходящем носителе, особенно в водном растворителе для активного ингредиента. Предпочтительно, когда активные ингредиенты присутствуют в данных препаратах в концентрации 0,5-20%, преимущественно 0,5-10%, в частности приблизительно 1,5% мас./мас. Препараты, подходящие для местного применения во рту, включают лепешки, содержащие активные ингредиенты в основе с вкусовыми добавками, обычно сахарозой и камедью акации или трагакантом; пастилки, содержащие активные ингредиенты в инертной основе, такой как желатин и глицерин или сахароза и акация, и полоскания для рта, включающие активные ингредиенты в подходящем жидком носителе. Препараты для ректального введения могут быть представлены в виде суппозитория с подходящей основой, включающей, например, масло какао или салицилат. Препараты, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в интервале 0,1-500 мкм (включая размеры частиц в интервале от 0,1 до 500 мкм с таким приращением, как 0,5, 1, 30, 35 мкм и т.п.), которые вводят путем быстрой ингаляции через носовой проход или ингаляцией через рот для достижения альвеолярных мешочков. Подходящие препараты включают водные или масляные растворы активного ингредиента. Препараты, подходящие для введения в виде аэрозоля или сухого порошка, можно изготовить согласно принятым способам, и их можно доставить с другими лечебными факторами, такими как соединения, ранее используемые для лечения и профилактики инфекций, как описано в данном контексте. Препараты, подходящие для вагинального введения, могут быть представлены в виде пессариев,-4 019893 тампонов, кремов, гелей, паст, пен и препаратов в спреях, включающих кроме активных ингредиентов такие носители, которые, как известно в области техники, являются подходящими. Препараты, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают препарат изотоническим с кровью предусматриваемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и сгустители. Препараты представлены в контейнерах на одну или множество доз, например в запечатанных ампулах и флаконах, и могут храниться в сублимационно высушенном (лиофилизированном) состоянии,требующем только добавления стерильного жидкого носителя, например воды для инъекций непосредственно перед использованием. Инъекционные растворы и суспензии для немедленного использования получают из стерильных порошков, гранул и таблеток ранее описанного типа. Предпочтительными унифицированными лекарственными препаратами являются содержащие дневную дозу или унифицированную дневную субдозу, как выше представлено в данном контексте, или ее соответствующую долю активного ингредиента. Следует иметь в виду, что кроме ингредиентов, предусматриваемых настоящим изобретением, препараты, соответствующие данному изобретению, могут включать другие агенты, принятые в области техники, имеющие отношение к типу рассматриваемого препарата, например, подходящие для перорального применения препараты могут включать вкусовые добавки. Кроме того, изобретение предусматривает ветеринарные композиции, включающие активные ингредиенты, например активные ингредиенты, соответствующие настоящему изобретению, вместе с ветеринарным носителем. Ветеринарные носители представляют собой материалы, используемые для цели введения композиции, и могут быть твердыми, жидкими или газообразными материалами, которые в другом отношении являются инертными или приемлемыми для области ветеринарии и совместимыми с активными ингредиентами. Данные ветеринарные композиции можно вводить перорально, парентерально или любым другим желательным путем. Активные ингредиенты, соответствующие изобретению, можно также изготовить с получением контролируемого высвобождения активных ингредиентов, чтобы сделать возможным менее частое дозирование или чтобы улучшить фармакокинетический профиль или профиль токсичности активных ингредиентов. Соответственно, изобретение предусматривает также композиции, включающие одно или более соединений, соответствующих изобретению, изготовленные для замедленного или контролируемого высвобождения. Эффективная доза каждого активного ингредиента зависит, по меньшей мере, от природы состояния, которое лечат, токсичности, от того, используют ли соединение профилактически (более низкие дозы) или в отношении активного заболевания или состояния, от способа доставки и фармацевтического препарата и будет определена клиническим врачом с использованием принятых исследований повышения дозы. Эффективная доза, как можно ожидать, составляет от приблизительно 0,0001 до приблизительно 100 мг/кг массы тела/день. Как правило, от приблизительно 0,01 до приблизительно 10 мг/кг массы тела/день. В более типичном случае от приблизительно 0,01 до приблизительно 5 мг/кг массы тела/день. Более типично от приблизительно 0,05 до приблизительно 0,5 мг/кг массы тела/день. Например,дневная потенциальная доза для взрослого человека с массой тела приблизительно 70 кг будет лежать в интервале от 1 до 1000 мг или от 5 до 500 мг и может находиться в форме одной или множества доз. Пути введения. Активные ингредиенты согласно изобретению вводят любым путем, соответствующим состоянию,которое лечат. Подходящие пути включают пероральный, ректальный, назальный, местный (включая защечный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный,внутривенный, внутрикожный, интратекальный и эпидуральный) и т.п. Следует иметь в виду, что предпочтительный путь может варьировать в зависимости, например, от состояния реципиента. Преимущество соединений, соответствующих данному изобретению, состоит в том, что они перорально биодоступны и могут дозироваться перорально. Примеры Соединение 9. Соединение 9 получают согласно способам, описанным в статье в J. Med. Chem. 1998, 41, 602. Схема 7 Соединение 16. К раствору соединения 15 (полученного коммерчески в фирме Molekula) (17 ммоль) в ДХМ (40 мл) добавляют соединение 14 (19 ммоль), а затем триэтиламин (26 ммоль). Полученную в результате реакционную смесь перемешивают в течение 12 ч и концентрируют при пониженном давлении. Реакционную смесь разбавляют EtOAc и последовательно промывают насыщенным водным Na2CO3, водой и солевым раствором. Растворитель удаляют при пониженном давлении. Очистка остатка колоночной экспрессхроматографией (силикагель, элюент: гексаны/EtOAc=1/1) дает соединение 16 (4,7 г). Схема 8 Соединение 17. Соединение 17 получают согласно способам, описанным в статье в Tetrahedron 1997, 53, 4769,включенной в данном контексте в виде ссылки в своей полноте для всех целей. Соединение 18. Соединение 18 получают согласно способам, описанным в статье в J. Org. Chem. 1987, 52, 3759,включенной в данном контексте в виде ссылки в своей полноте для всех целей. Соединение 19. Суспензию соединения 18 (7,4 ммоль) в ТГФ (200 мл) нагревают с обратным холодильником до получения прозрачного раствора. Раствор охлаждают до -78 С и н-бутиллитий (14,8 ммоль) добавляют по каплям, получая раствор дианиона сульфона 18. К раствору DIBAL-H (7,8 ммоль) при 0 С добавляют раствор МеОН (7,8 ммоль) в ТГФ (5 мл). Смесь перемешивают в течение 5 мин и охлаждают до -78 С. Раствор соединения 17 (6,6 ммоль) в ТГФ(5 мл) добавляют к вышеописанному раствору DIBAL-H/MeOH и полученную в результате реакционную смесь перемешивают еще в течение 5 мин. Полученный в результате раствор альдегидных комплексов переносят в раствор дианиона сульфона 18. Полученную в результате смесь перемешивают при -78 С в течение 30 мин, гасят водным раствором NH4Cl и нагревают до 25 С. Затем смесь экстрагируют EtOAc и концентрируют с получением соединения 19 в виде смеси диастереомеров; m/z 737,3 (M+Na)+. Пример 20. К раствору соединения 19 в ДХМ (20 мл) добавляют Ас 2 О (1,5 мл), затем пиридин (3 мл). Полученную в результате смесь перемешивают в течение 12 ч и концентрируют. Концентрат растворяют в МеОН(6%, 6 г). Полученную в результате смесь нагревают до 25 С и перемешивают в течение 12 ч. Затем добавляют воду (50 мл) и смесь фильтруют и концентрируют. Концентрат разводят EtOAc и промывают солевым раствором. Органическую фазу концентрируют. Очистка колоночной экспресс-хроматографией(силикагель, элюент: гексаны/EtOAc=10/1) дает соединение 20 (1,4 г). Соединение 21. К жидкому аммиаку (25 мл) при -33 С добавляют раствор соединения 20 (1,4 г) в ТГФ (2,5 мл). Натрий медленно добавляют, пока сохраняется синий цвет раствора. Полученную в результате смесь перемешивают в течение 1 ч. Затем медленно добавляют твердый NH4Cl (6 г), смесь нагревают до 25 С и упаривают аммиак. Смесь разводят EtOAc и последовательно промывают водой и солевым раствором. Растворитель удаляют при пониженном давлении. Очистка полученного в результате остатка колоночной экспресс-хроматографией (силикагель, элюент: гексаны/EtOAc=5/1) дает соединение 21 (1,15 г). Соединение 22. Смесь соединения 21 (1,15 г) и 10% Pd/C (160 мг) в МеОН (20 мл) гидрируют в течение 12 ч. Добавляют целит и полученную в результате смесь перемешивают в течение 5 мин. Затем смесь фильтруют и концентрируют с получением промежуточного продукта (1 г). Промежуточный продукт (700 мг) растворяют в ДХМ (20 мл) и ТФА (4 мл) и полученную в результате смесь перемешивают в течение 4 ч,затем концентрируют при пониженном давлении. Концентрированную смесь разводят EtOAc и последовательно промывают насыщенным водным Na2CO3, водой и солевым раствором. Концентрирование промытой EtOAc смеси дает соединение 22 (420 мг). Соединение 8. К раствору соединения 22 (1,57 ммоль) в CH3CN (16 мл) добавляют соединение 16 (1,57 ммоль), затем диизопропилэтиламин (3,14 ммоль). Полученную в результате смесь перемешивают в течение 12 ч. Затем смесь разбавляют EtOAc и последовательно промывают насыщенным водным Na2CO3, водой и солевым раствором. Очистка обращенно-фазовой ВЭЖХ (колонка Phenomenex Synergi Comb-HTS,элюент: 25-100% CH3CN в воде) дает соединение 8 (460 мг). Альтернативное получение соединения 22 Схема 12 Соединение 25. Соединение 25 получают согласно описанному в литературе способу, см. J. Orq. Chem. 1996, 61, 444(включенный в данном контексте в виде ссылки в своей полноте), за исключением того, что получают Lизомер вместо D-изомера. Соединение 26. Смесь соединения 25 (7,4 г) и 1,1'-тиокарбонилдиимидаксола (4,5 г) в ТГФ (260 мл) нагревают при 65 С в течение 54 ч. Растворитель удаляют из смеси при пониженном давлении. Очистка колоночной экспресс-хроматографией (силикагель, гексаны/EtOAc=1/1) дает соединение 26 (7,33 г). Соединение 27. Смесь соединения 26 (7,3 г) и триэтилфосфита (100 мл) нагревают при 160 С в течение 4 ч. Избыток реагентов удаляют при пониженном давлении. Очистка колоночной экспресс-хроматографией (силикагель, гексаны/EtOAc=3/1) дает соединение 27 (5 г). Соединение 22. Смесь соединения 27 (250 мг) в i-PrOH/EtOAc (5 мл/5 мл) гидрируют в течение 14 ч в присутствии 10% Pd/C (75 мг). К смеси добавляют целит и смесь перемешивают в течение 5 мин. Фильтрование и упаривание растворителей дает соединение 22 (116 мг). Соединение 50. Соединение 50 коммерчески доступно в фирме Chem Impex International, и его используют без дальнейшей очистки. Соединение 51. Соединение 50 (7,0 г, 26,0 ммоль) растворяют в CH2Cl2 (330 мл) и добавляют 1,1 карбонилдиимидазол (4,22 г, 26,0 ммоль), затем i-Pr2NEt (19 мл, 104 ммоль). Раствор перемешивают при 25 С в течение 12 ч. Соединение 9 (4,44 г, 26,0 ммоль) растворяют в 20 мл CH2Cl2 и добавляют к реакционной смеси. Раствор перемешивают при 25 С в течение 7 ч. Растворитель удаляют в вакууме и остаток разводят этилацетатом и промывают водой и солевым раствором. Органические слои сушат (Na2SO4),фильтруют и упаривают. Очистка с помощью Combiflash (неподвижная фаза: силикагель; элюент: градиент 66-100% EtOAc/Гексан) дает соединение 51 (7,34 г); m/z: 429,0 (М+Н)+. Соединение 52. Соединение 51 (7,34 г, 17,13 ммоль) растворяют в ТГФ (90 мл) и добавляют 1 М водный LiOH (35 мл). Смесь перемешивают при 25 С в течение 0,5 ч. Реакцию гасят 1 М HCl (51 мл) и рН смесь доводят до 2. Смесь экстрагируют этилацетатом. Органические слои сушат над Na2SO4, фильтруют и упаривают с получением соединения 52 (7,00 г). Выделенное соединение 52 используют на следующей стадии без дальнейшей очистки; m/z: 415,0 (М+Н)+. Пример Q. Соединение 52 (2,57 г, 6,21 ммоль) растворяют в ТГФ (67 мл), добавляют соединение 8 (2,10 г, 5,13 ммоль), затем HOBt (1,04 г, 7,70 ммоль), i-Pr2NEt (3,67 мл, 20,52 ммоль) и EDC (1,82 мл, 10,26 ммоль). Смесь перемешивают при 25 С в течение 12 ч. Растворитель удаляют при пониженном давлении. Остаток разводят этилацетатом и последовательно промывают насыщенным водным Na2CO3, водой и солевым раствором. Органическую фазу сушат над Na2SO4, фильтруют и упаривают. Очистка колоночной(3,02 г); m/z: 806,2 (М+Н)+. Пример R. Пример Q (3,02 г, 3,74 ммоль) суспендируют в 4,0 Н растворе HCl/диоксана (30 мл) и перемешивают при 25 С в течение 3 ч. Растворитель удаляют при пониженном давлении и Et2O выливают в реакционную смесь. Полученную в результате суспензию интенсивно перемешивают в течение 1,5 ч. Твердому веществу дают осесть и декантируют слой эфира. Промывание осадка Et2O повторяют еще два раза. Продукт сушат в вакууме с получением твердого вещества белого цвета (3,18 г, количественный выход). Насыщенный водный раствор Na2CO3 добавляют к вышеуказанному твердому веществу (3,18 г) при перемешивании, пока твердое вещество не исчезнет. Водный раствор экстрагируют этилацетатом. Органические фазы сушат над Na2SO4, фильтруют и упаривают с получением примера R в виде желтой пены(2,44 г, 81%). Выделенный пример R используют без дальнейшей очистки на следующей стадии; m/z: 706,1 (М+Н)+. Пример S. Способ I. Пример R (1,00 г, 1,42 ммоль) растворяют в ДМФА (20 мл) и добавляют по каплям бромэтиловый эфир (196 мкл, 1,56 ммоль), затем NaHCO3 (0,239 г, 2,84 ммоль). Реакционную смесь перемешивают при 25 С в течение 2 ч. Раствор нагревают до 65 С и перемешивают в течение 12 ч. Растворитель удаляют при пониженном давлении. Остаток разводят EtOAc и последовательно промывают водой и солевым раствором. Органическую фазу сушат над Na2SO4, фильтруют и упаривают. Очистка обращенно-фазовой ВЭЖХ (колонка Phenomenex Synergi Comb-HTS, элюент: 5-95% CH3CN/вода) дает соединение 70 (580 мг, 53%). Данные 1 Н ЯМР-спектроскопии (CDCl3)8,98 (s, 1H); 7,90 (s, 1H); 7,75 (m, 1H); 7,40-7,00 (m, 11 Н),6,55 (br s, 1 Н); 5,58 (m, 1 Н); 5,28, 5,19 (dAB, J=14 Гц, 2 Н); 4,70-4,37 (m, 3H); 3,99 (m, 5 Н); 3,76 (br s, 1 Н); 3,65-3,30 (m, 3 Н); 2,97 (m, 5H); 2,90-2,60 (m, 6H); 2,28 (br s, 1H); 1,91 (br s, 1H); 1,60-1,30 (m, 10H); Соединение 54. Соединение 54 получают согласно способу, описанному в J. Med. Chem. 1993, 36, 1384 (включенному в данном контексте в виде ссылки в своей полноте для всех целей). К раствору соединения 53 (0,550 г, 5,28 ммоль) (Sigma-Aldrich) в H2O (8,8 мл) при 0 С добавляютNaIO4 (1,016 г, 4,75 ммоль). Смеси позволяют медленно нагреться до 25 С и перемешивают в течение 12 ч. Твердый NaHCO3 добавляют к реакционной смеси до получения рН 7. Добавляют CHCl3 (16 мл) и смеси позволяют перемешиваться в течение 5 мин. Смесь фильтруют и твердое вещество промываютCHCl3 (6 мл). Объединенный раствор H2O/CHCl3 непосредственно используют на следующей стадии без дальнейшей очистки. Схема 21 Пример S. К раствору примера R (70 мг, 0,1 ммоль) в CH3CN (5 мл) добавляют цианборогидрид натрия (50 мг) в воде (5 мл). К вышеуказанной смеси добавляют раствор диальдегида соединения 54 (0,6 ммоль) вNa2CO3. Смесь экстрагируют EtOAc, органическую фазу промывают водой и солевым раствором и сушат над Na2SO4. Очистка обращенно-фазовой ВЭЖХ (колонка Phenomenex Synergi Comb-HTS) дает пример Соединение 55. Соединение 51 (0,28 г, 0,66 ммоль) растворяют в CH2Cl2 (4 мл) и добавляют по каплям ТФА (1 мл). Реакции позволяют перемешиваться при 25 С в течение 1 ч. Растворитель удаляют при пониженном давлении с получением соединения 55 (0,39 г); m/z: 329,0 (М+Н)+. Соединение 56. К раствору соединения 55 (0,39 г, 0,89 ммоль) в CH3CN (45 мл) добавляют NaBH3CN (0,45 г, 7,12 ммоль) и H2O (45 мл). Добавляют раствор соединения 54 (0,55 г, 5,34 ммоль) в CHCl3/H2O (40 мл). Смесь перемешивают при 25 С в течение 12 ч. Реакционную смесь подщелачивают с помощью насыщенного водного Na2CO3 и последовательно экстрагируют этилацетатом и дихлорметаном. Объединенные органические слои последовательно промывают H2O и солевым раствором, сушат над Na2SO4, фильтруют и упаривают. Очистка с помощью Combiflash (неподвижная фаза: силикагель; элюент: градиент 0-10% МеОН/CH2Cl2) дает соединение 56 (0,17 г); m/z: 399,1 (М+Н)+. Соединение 57. Соединение 56 (377 мг, 0,95 ммоль) растворяют в ТГФ (4 мл) и добавляют 1 М водный LiOH (1,90 мл). Смесь перемешивают при 25 С в течение 1 ч. Реакцию нейтрализуют 1 М HCl. ТГФ удаляют при пониженном давлении и водный раствор лиофилизируют с получением соединения 57 (365 мг). Вещество непосредственно используют на следующей стадии без дальнейшей очистки; m/z: 385,1 (М+Н)+. Пример S. Пример S (185 мг, 57%) получают согласно тому же способу, что описан для примера Q, за исключением того, что соединение 57 (160 мг, 0,42 ммоль) используют вместо соединения 52; m/z: 776,2(М+Н)+. Компетентный практический специалист будет признавать, что способ, приведенный на схеме 22,можно использовать для получения ряда соединений, аналогичных соединениям 55-57: Кроме того, следует признать, что стереохимические конфигурации, отличные от показанных (т.е. энантиомеры или диастереомеры), можно получить путем отбора аналогов соединения 51, обладающих соответствующей стереохимической конфигурацией при хиральном центре. Способ IV. Схема 23 Соединение 59. К раствору соединения 122 (33 г, 112 ммоль) (см. схему 69) в этаноле (366 мл) при 0 С добавляют раствор гидроксида натрия (4,7 г, 117 ммоль) в воде (62 мл). Смесь перемешивают в течение 1 ч при 25 С и растворители удаляют при пониженном давлении. Смесь упаривают совместно с этанолом (3400 мл) и сушат при 60 С в течение 2 ч под высоким вакуумом с получением твердого вещества белого цвета. К раствору вышеуказанного твердого вещества в ДМФА (180 мл) добавляют бензилбромид (16,2 мл, 136 ммоль). Смесь перемешивают в течение 16 ч в темноте и гасят водой (300 мл). Смесь экстрагируютEtOAc (4300 мл). Объединенную органическую фазу промывают водой (5) и солевым раствором и сушат над Na2SO4. Концентрирование дает соединение 59 (48 г), которое используют на следующей стадии без дальнейшей очистки. Соединение 60. Смесь соединения 59 (33 г, 74 ммоль) в ДМСО (225 мл) и Et3N (36 мл) перемешивают в течение 30 мин. Смесь охлаждают до 0-10 С, добавляют SO3-пиридин (45 г) и продолжают перемешивание в течение 60 мин. Добавляют лед (300 г) и смесь перемешивают в течение 30 мин. Добавляют EtOAc (300 мл) и добавляют насыщенный Na2CO3 до тех пор, пока рН не станет 9-10. Органическую фазу отделяют от водной фазы и экстрагируют водную фазу EtOAc (2300 мл). Объединенные органические фазы промывают насыщенным Na2CO3 (2), водой (3) и солевым раствором. Смесь сушат над Na2SO4 и концентрируют, получая соединение 60 (32 г), которое непосредственно используют на следующей стадии без дальнейшей очистки. Соединение 61. К раствору соединения 60 (32 г) в CH3CN (325 мл) добавляют морфолин (12,9 мл, 148 ммоль) с использованием водяной бани вокруг реакционной емкости, затем НОАс (8,9 мл, 148 ммоль) и NaBH(OAc)3(47 г, 222 ммоль). Смесь перемешивают в течение 12 ч. CH3CN удаляют при пониженном давлении и смесь разводят EtOAc (300 мл). Добавляют насыщенный Na2CO3 до тех пор, пока рН не станет 9-10. Органическую фазу отделяют от водной фазы и водную фазу экстрагируют EtOAc (2300 мл). Объединенные органические фазы промывают насыщенным Na2CO3 (2), водой (1) и солевым раствором (1). Смесь сушат над Na2SO4. Полученный в результате остаток концентрируют и очищают колоночной хроматографией на силикагеле (EtOAc-ДХМ/iPrOH=10/1) с получением соединения 61 (30 г). Соединение 57. К раствору соединения 61 (26,5 г, 56 ммоль) в этаноле (160 мл) при 0 С добавляют раствор гидроксида натрия (2,5 г, 62 ммоль) в воде (30 мл). Смесь перемешивают в течение 1 ч при 25 С и удаляют растворители при пониженном давлении. Смесь разводят водой (200 мл) и промывают CH2Cl2 (6100 мл). Водную фазу подкисляют 12 N HCl (5,2 мл) и сушат при пониженном давлении, получая соединение 57 (22 г). Пример S. Соединение 57 превращают в пример S, используя способ, описанный выше в способе III. Схема 69 Соединение 121. Соединение 121 коммерчески доступно в фирме Aldrich и его используют в том виде, как получают. Соединение 122. К суспензии соединения 121 (2,05 г, 11,3 ммоль) в CH2Cl2 (40 мл) добавляют iPr2NEt (5,87 мл, 33,9 ммоль) с последующим добавлением CDI (1,86 г, 11,3 ммоль). Полученную в результате смесь перемешивают при комнатной температуре в течение 6 ч, затем добавляют соединение 9 (2,33 г, 11,3 ммоль). Полученную в результате смесь перемешивают в течение следующих 0 ч перед тем, как ее упаривают досуха. Смесь перерастворяют в CH2Cl2, твердое вещество удаляют фильтрацией. Фильтрат упаривают досуха и очищают с помощью CombiFlash (элюируют 20-80% EtOAc/гексаны), что дает 3,2 г соединения 207 в виде масла бледно-желтого цвета; m/z: 298,0 (М+Н)+. Определения IC50 для цитохрома Р 450 печени человека. Материалы и общие способы. Объединенную (n15 доноров) печеночную микросомную фракцию человека получают из фирмыBD-Gentest (Woburn, MA), которая поставляет также гидрокситерфенадин, 4'-гидроксидиклофенак и систему регенерации NADPH. Ритонавир получают из коммерческого перорального раствора Norvir (Abbott Laboratories, Abbott Park, IL). Другие реагенты получены в фирме Sigma-Aldrich (St. Louis, МО) и включают терфенадин, фексофенадин, BRL 15572, диклофенак и мефенамовую кислоту. Инкубирования проводят в двух повторностях в 50 мМ буфере на основе фосфата калия, рН 7,4 с системой регенерации NADPH, используемой, как описано изготовителем. Предварительно определяют,чтобы конечные концентрации микросомного белка находились в линейном интервале активности и приводили к менее чем 20% расходованию субстрата в процессе инкубирования. Используемые конечные концентрации субстрата равны показанным значениям Km для активностей, определяемых в таких же условиях. Ингибиторы растворяют в ДМСО, и конечная концентрация ДМСО в носителях как субстрата, так и ингибитора составляет 1% (об./об.). Инкубирования проводят при 37 С при встряхивании и начинают с добавления субстрата. Затем отбирают аликвоты в точках 0,7 и 15 мин. Образцы гасят обработкой смесью ацетонитрила, муравьиной кислоты, воды (94,8%/0,2%/5%, об./об./об.), включающей внутренний стандарт. Осажденный белок удаляют центрифугированием при 3000 об./мин в течение 10 мин и затем аликвоты супернатанта подвергают анализу ЖХ-МС. Система ЖХ-МС состоит из жидкостного хроматографа Waters Acquity UPLC с устройством для двух растворителей и устройством для охлажденных (8 С) образцов, а также устройством для управления образцами, интерфейсированного с тандемным масс-спектрометром Micromass Quattro Premier, работающим в режиме электроспрей-ионизации. Используют колонку Waters Acquity UPLC ВЕН CiS 2,150 мм, размер пор 1,7. Подвижные фазы состоят из смесей ацетонитрила, муравьиной кислоты и воды, состав подвижной фазы А представляет собой 1%/0,2%/98,8% (об./об./об.), и состав подвижной фазы В представляет собой 94,8%/0,2%/5% (об./об./об.). Объемы введения составляют 5 мкл, и скорость потока составляет 0,8 мл/мин. Концентрацию метаболитов производят с помощью стандартных кривых, полученных с аутентичными аналитами в тех же условиях, которые используют при инкубированиях. Значения IC50 (концентрации ингибитора, снижающей активность CYP3A на 50%) рассчитывают по нелинейной регрессии с использованием пакета программ GraphPad Prism 4.0 и сигмоидальной модели. Анализ ингибирования CYP3A. Активности соединений как ингибиторов человеческих печеночных цитохромов Р 450 подсемействаCYP3A (особенно CYP3A4) оценивают, используя терфенадиноксидазу, хорошо охарактеризованную избирательную в отношении CYP3A активность, описанную в статьях Ling, K.-H.J., et al. Drug Metab.Dispos. 23, 631-636, (1995) и Jurima-Romet, et al. Drug Metab, Dispos. 22, 849-857 (1994). Конечные концентрации микросомного белка и терфенадинового субстрата составляют 0,25 мг/мл и 3 мкМ соответственно. Метаболические реакции останавливают обработкой семью объемами гасящего раствора, содержащего 0,1 мкМ BRL 15572 в качестве внутреннего стандарта. Дополнительные 8 объемов воды добавляют перед центрифугированием и отбирают аликвоты супернатанта для анализа. При анализе ЖХ-МС хроматографическую оценку получают с помощью серии линейных градиентов, начиная от 20% В и поддерживая в течение 0,1 мин, затем повышая до 80% В в течение 1,5 мин,поддерживая в течение 0,4 мин и затем возвращаясь в исходные условия в течение 0,05 мин. Системе дают возможность повторного уравновешивания в течение по меньшей мере 0,25 мин перед следующим введением. Масс-спектрометр работает в режиме положительного иона и ионные пары "следующий предшественник ([М+Н]+)/продукт" мониторируют и количественно оценивают с использованием пакета программ MassLynx 4.0 (SP4, 525): гидрокситерфенадин 488,7/452,4, фексофенадин 502,7/466,4 и BRL 15572 407,5/209,1. Активность терфенадиноксидазы определяют по сумме метаболитов гидрокситерфенадина и карбокситерфенадина (фексофенадина). Анализ ингибирования CYP2C9. Активности соединений как ингибиторов человеческих печеночных CYP2C9 оценивают, используя диклофенак 4'-гидроксилазу, активность, специфическую для данного фермента, как описано в статьеLeeman, Т., et al. Life Sci. 52, 29-34 (1992). Конечные концентрации микросомного белка и субстрата диклофенака составляют 0,08 мг/мл и 4 мкМ соответственно. Метаболические реакции останавливают обработкой тремя объемами гасящего раствора, содержащего 1 мкМ мефенамовой кислоты в качестве внутреннего стандарта. После центрифугирования добавляют дополнительные 4 объема воды. Аликвоты супернатанта затем подвергают анализу ЖХ-МС. При анализе ЖХ-МС хроматографическую оценку получают с помощью серии линейных градиентов, начиная от 20% В и поддерживая в течение 0,3 мин, затем повышая до 99% В в течение 1,2 мин,поддерживая в течение 0,5 мин и затем возвращаясь в исходные условия в течение 0,25 мин. Системе дают возможность повторного уравновешивания в течение по меньшей мере 0,25 мин перед следующим введением. Масс-спектрометр работает в режиме отрицательного иона, и ионные пары "следующий предшественник ([М-Н]-)/продукт" мониторируют и количественно оценивают: 4'-гидроксидиклофенак 312,4/294,2 и мефенамовая кислота 242,4/224,2. Биологические анализы, используемые для характеризации ингибиторов протеазы ВИЧ. Анализ фермента протеазы ВИЧ-1 (Ki). Анализ основан на флуориметрической детекции расщепления синтетического гексапептидного субстрата протеазой ВИЧ-1 в определенном реакционном буфере, как исходно описано в статье M.V.Toth and G.R. Marshall, Int. T. Peptide Protein Res. 36, 544 (1990) (включенной в данном контексте в виде ссылки в своей полноте для всех целей). В анализе используют (2-аминобензоил)Thr-Ile-Nle-(п-нитро)Phe-Gln-Arg в качестве субстрата и рекомбинантную протеазу ВИЧ-1, экспрессируемую в Е. coli в качестве фермента. Оба реагента поставляет фирма Bachem California, Inc. (Torrance, C.A.;по каталогу Н-2992). Буфер для данной реакции представляет собой 100 мМ ацетат аммония, рН 5,3, 1 М хлорид натрия, 1 мМ этилендиамитетрауксусная кислота, 1 мМ дитиотреитол и 10% диметилсульфоксид. Для определения константы ингибирования Ki получают серию растворов, содержащих одинаковое количество фермента (1-2,5 нМ) и тестируемый ингибитор в различных концентрациях в реакционном буфере. Растворы последовательно переносят в белый 96-луночный планшет (190 мкл каждого) и предварительно инкубируют в течение 15 мин при 37 С. Субстрат солюбилизируют в 100% диметилсульфоксиде при концентрации 800 мкМ и добавляют 10 мкл 800 мкМ субстрата в каждую лунку для достижения конечной концентрации субстрата 40 мкМ. Кинетику реакции в режиме реального времени измеряют при 37 С, используя флуориметр для 96-луночных планшетов Gemini (Molecular Devices, Sunnyvale, CA) при (Ех)=330 нм и (Em)=420 нм. Определяют исходные скорости реакций с различными концентрациями ингибиторов и рассчитывают значение Ki (в пикомолярных единицах концентрации) с использованием программы EnzFitter program (Biosoft, Cambridge, U.K.) согласно алгоритму для тесно связанного конкурентного ингибирования, описанному в статье Ermolieff J., Lin X., and Tang J., Biochemistry 36,12364 (1997). Анализ фермента протеазы ВИЧ-1 (IC50). Как вышеописанный анализ Ki, анализ IC50 основан на флуориметрической детекции расщепления синтетического гексапептидного субстрата протеазой ВИЧ-1 в определенном реакционном буфере, как исходно описано в статье M.V. Toth and G.R. Marshall. Int. J. Peptide Protein Res. 36, 544 (1990). В анализе используют (2-аминобензоил)Thr-Ile-Nle-(п-нитро)Phe-Gln-Arg в качестве субстрата и рекомбинантную протеазу ВИЧ-1, экспрессируемую в Е. coli в качестве фермента. Оба реагента поставляет фирма Bachem California, Inc. (Torrance, C.A.;по каталогу Н-2992 и Н-9040 соответственно). Буфер для данной реакции представляет собой 100 мМ ацетат аммония, рН 5,5, 1 М хлорид натрия, 1 мМ этилендиаминтетрауксусная кислота, 1 мМ дитиотреитол и 10% диметилсульфоксид. Для определения значения IC50 170 мкл реакционного буфера переносят в белый 96-луночный планшет. Получают серию 3-кратных разведений тестируемого ингибитора в ДМСО и 10 мкл полученных в результате разведений переносят в лунки планшета для микротитрования. 10 мкл 20-50 нМ исходного раствора фермента в реакционном буфере добавляют в каждую лунку 96-луночного планшета, чтобы получить конечную концентрацию фермента 1-2,5 нМ. Затем планшеты предварительно инкубируют в течение 10 мин при 37 С. Субстрат солюбилизируют в 100% диметилсульфоксиде при концентрации 400 мкМ и добавляют 10 мкл 400 мкМ субстрата в каждую лунку для достижения конечной концентрации субстрата 20 мкМ. Кинетику реакции в режиме реального времени измеряют, используя флуориметр для 96-луночных планшетов Gemini (Molecular Devices, Sunnyvale, CA) при (Ех)=330 нм и (Em)=420 нм. Определяют исходные скорости реакций с различными концентрациями ингибиторов и рассчитывают значение IC50 (в пикомолярных единицах концентрации) с использованием пакета программ GraphPadPrism по соответствию кривым нелинейной регрессии. Анализ действия на ВИЧ-1 на клеточных культурах (EC50). Анализ основан на количественной оценке ВИЧ-1-ассоциированного цитопатического эффекта посредством колориметрической детекции выживаемости инфицированных вирусом клеток в присутствии и в отсутствие тестируемых ингибиторов. Вызываемую ВИЧ-1 гибель клеток определяют, используя метаболический субстрат 2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-2 Н-тетразолий-5-карбоксанилид(ХТТ), который превращается только интактными клетками в продукт со специфическими характеристиками поглощения, как описано в статье Weislow O.S., Kiser R., Fine D.L., Bader J., Shoemaker R.H. и BoydM.R., J. Natl. Cancer Inst. 81, 577 (1989) (включенной в данном контексте в виде ссылки в своей полноте для всех целей). Клетки МТ 2 (программа реагентов для СПИДА NIH (Национальных институтов здравоохранения),номер по каталогу 237), поддерживаемые в среде RPMI-1640 с добавлением 5% сыворотки телячьих эмбрионов и антибиотиков, инфицируют штаммом HIV ВИЧ-1 дикого типа (Advanced Biotechnologies, Columbia, MD) в течение 3 ч при 37 С, используя вирусный инокулум, соответствующий многочисленности инфекции, равной 0,01. Инфицированные клетки в среде для культивирования распределяют в 96 луночном планшете (20000 клеток в 100 мкл/лунку) и инкубируют в присутствии набора растворов, содержащих 5-кратные серийные разведения тестируемого ингибитора (100 мкл/лунку), в течение 5 дней при 37 С. Образцы с необработанными инфицированными и необработанными ложно инфицированными контрольными клетками также распределяют в 96-луночном планшете и инкубируют в тех же условиях. Для определения антивирусной активности тестируемых ингибиторов раствор субстрата ХТТ (6 мл/планшет для анализов) в концентрации 2 мг/мл в забуференном фосфатом солевом растворе рН 7,4 нагревают на водяной бане в течение 5 мин при 55 С перед добавлением 50 мкл N-метилфеназоний метасульфата (5 мкг/мл)/6 мл раствора ХТТ. После удаления 100 мкл среды из каждой лунки на планшете для анализа в каждую лунку добавляют 100 мкл раствор субстрата ХТТ. Клетки и раствор ХТТ инкубируют при 37 С в течение 45-60 мин в термостате с CO2. Для инкубирования вируса 20 мкл 2% Triton X100 добавляют в каждую лунку. Выживаемость, как определяют по количеству образующихся метаболитов ХТТ, количественно оценивают спектрофотометрически по поглощению при 450 нм (за вычетом фонового поглощения при 650 нм). Данные, полученные при анализе, выражают как процент поглощения относительно необработанного контроля и концентрацию с пятидесятипроцентной эффективностью(EC50) рассчитывают как концентрацию соединения, которая вызывает повышение процента образования метаболита ХТТ в инфицированных/обработанных соединением клетках на 50% от вызываемого неинфицированными не содержащими соединение клетками. Анализ действия на ВИЧ-1 на клеточных культурах (EC50) в присутствии 40% человеческой сыворотки или белков человеческой сыворотки. Данный анализ почти идентичен вышеописанному анализу действия на ВИЧ-1 на клеточных культурах за исключением того, что инфекцию осуществляют в присутствии или в отсутствие 40% человеческой сыворотки (мужская типа АВ, Cambrex 14-498E) или белков человеческой сыворотки (человеческий гликопротеин альфа-кислоты, Sigma G-9885; человеческий сывороточный альбумин, Sigma A1653, 9699%) в физиологической концентрации. Гибель клеток, вызываемую ВИЧ-1, определяют, как описано выше, за исключением того, что инфицированные клетки, распределенные в 96-луночных планшетах,инкубируют в 80% человеческой сыворотке (2 Х концентрация) или в 2 мг/мл человеческого гликопротеина альфа-кислоты + 70 мг/мл HSA (2X концентрация), а не в средах для культивирования. Анализ цитотоксичности на клеточных культурах (CC50). Анализ основан на оценке цитотоксического эффекта тестируемых соединений с использованием метаболического субстрата 2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-2 Н-тетразолий-5 карбоксанилида (ХТТ), как описано в статье Weislow O.S., Kiser R., Fine D.L., Bader J., Shoemaker R.H. иBoyd M.R., J. Natl. Cancer Inst. 81, 577 (1989). Данный анализ почти идентичен описанному предшествующему анализу (Анализ действия на ВИЧ-1 на клеточных культурах) за исключением того, что клетки не инфицируют. Соединение, вызывающее гибель клеток (или снижение роста) определяют, как описано ранее. Клетки МТ-2, поддерживаемые в среде RPMI-1640 с добавлением 5% сыворотки телячьих эмбрионов и антибиотиков, распределяют в 96-луночном планшете (20000 клеток в 100 мкл/лунку) и инкубируют в присутствии или в отсутствие 5-кратных серийных разведений тестируемого ингибитора (100 мкл/лунку) в течение 5 дней при 37 С. Контроли включают необработанные инфицированные клетки и инфицированные клетки, защищенные 1 мкМ Р 4405 (подофиллотоксин, Sigma, No по каталогу Р 4405). Для определения цитотоксичности раствор ХТТ (6 мл/планшет для анализа) в концентрации 2 мг/мл в забуференном фосфатом солевом растворе рН 7,4 нагревают в темноте в водяной бане в течение 5 мин при 55 С перед добавлением 50 мкл N-метилфеназонийметасульфата (5 мкг/мл)/6 мл раствора ХТТ. После удаления 100 мкл сред из каждой лунки на планшете для анализа в каждую лунку добавляют 100 мкл раствора субстрата ХТТ. Клетки и раствор ХТТ инкубируют при 37 С в течение 45-60 мин в термостате с CO2. Для инактивации вируса в каждую лунку добавляют 20 мкл 2% Triton Х-100. Выживаемость, как определяют по количеству образующихся метаболитов ХТТ, количественно оценивают спектрофотометрически по поглощению при 450 нм (за вычетом фонового поглощения при 650 нм). Данные, полученные при анализе, выражают как процент поглощения относительно необработанного контроля и концентрацию с пятидесятипроцентной цитотоксичностью (EC50) рассчитывают как концентрацию соединения, которая вызывает повышение процента клеточного роста в обработанных соединением клетках до 50% от клеточного роста, представляемого неинфицированными не содержащими соединение клетками. Экспериментальные данные, основанные на репрезентативных примерах, демонстрируют, что соединения модуляторов, соответствующие настоящему изобретению, могут иметь активность ингибирования CYP450 3 А 4 в интервале, представленном IC50, от приблизительно 100 нМ до приблизительно 4700 нМ, и активность ингибирования CYP450 2 С 9 в интервале, представленном IC50 от приблизительно 100 нМ до приблизительно 10000 нМ. Экспериментальные данные, основанные на репрезентативных примерах, демонстрируют, что соединения модуляторов, соответствующие настоящему изобретению, могут иметь активность ингибирования протеазы в интервале, представленном EC50 ВИЧ, от приблизительно 140 нМ до больше чем приблизительно 30000 нМ. Экспериментальные данные, основанные на репрезентативных примерах S, имеют активность ингибирования CYP450 3 А 4 в интервале, представленном IC50, от приблизительно 80 до 150 нМ, активность ингибирования CYP450 2 С 9 в интервале, представленном IC50, от приблизительно 1000 до 10000 нМ, и активность ингибирования протеазы в интервале, представленном EC50, больше чем приблизительно 30000 нМ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для лечения ВИЧ-инфекции, включающая модулятор фармакокинетических свойств структурной формулы и эмтрицитабин, тенофовир дисопроксил фумарат, элвитегравир и фармацевтически приемлемый носитель или наполнитель. 2. Композиция по п.1, которая представлена в форме для орального введения. 3. Способ лечения ВИЧ-инфекции, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества композиции по п.1.
МПК / Метки
МПК: C07D 417/14, C07D 277/28
Метки: способ, вич-инфекции, композиция, фармацевтическая, лечения
Код ссылки
<a href="https://eas.patents.su/16-19893-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-vich-infekcii.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция и способ лечения вич-инфекции</a>
Предыдущий патент: Ингибиторы bace
Следующий патент: Применение соединений для снижения температуры фильтруемости углеводородных дистиллятов
Случайный патент: Фотоэлектрический элемент




















