Способ химиопрофилактики рака предстательной железы
Формула / Реферат
1. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для лечения предраковых предшественников аденокарциномы предстательной железы.
2. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для уменьшения количества предраковых предшественников аденокарциномы предстательной железы.
3. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для ингибирования или супрессии предраковых предшественников аденокарциномы предстательной железы.
4. Применение по пп.1-3, в котором предшественниками аденокарциномы предстательной железы является внутриэпителиальная неоплазия предстательной железы (PIN).
5. Применение по пп.1-3, в котором фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель.
6. Применение по п.5, в котором носитель выбирают из группы, состоящей из смолы, крахмала, сахара, целлюлозного материала и их смесей.
7. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде гранул для подкожной имплантации.
8. Применение по п.5, в котором гранулы обеспечивают регулируемое высвобождение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси в течение определенного периода времени.
9. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде жидкости для внутривенной, внутриартериальной или внутримышечной инъекции.
10. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде жидкого или твердого препарата для перорального введения.
11. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде формы, подходящей для местного применения.
12. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде гранул, таблеток, капсул, раствора, суспензии, эмульсии, эликсира, геля, крема или суппозитория.
13. Применение по п.12, в котором суппозиторием является ректальный или уретральный суппозиторий.
14. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде формы, подходящей для парентерального введения.
15. Применение по п.14, в котором парентеральной формой являются липосомы, включающие комплекс ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси с циклодекстриновым соединением.
16. Применение по п.5, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку от примерно 0,5 до примерно 80 мг на 1 кг веса субъекта в сутки.
17. Применение по п.16, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку от примерно 20 до примерно 60 мг на 1 кг веса субъекта в сутки.
18. Применение по п.16, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку 20 мг на 1 кг веса субъекта в сутки.
Текст
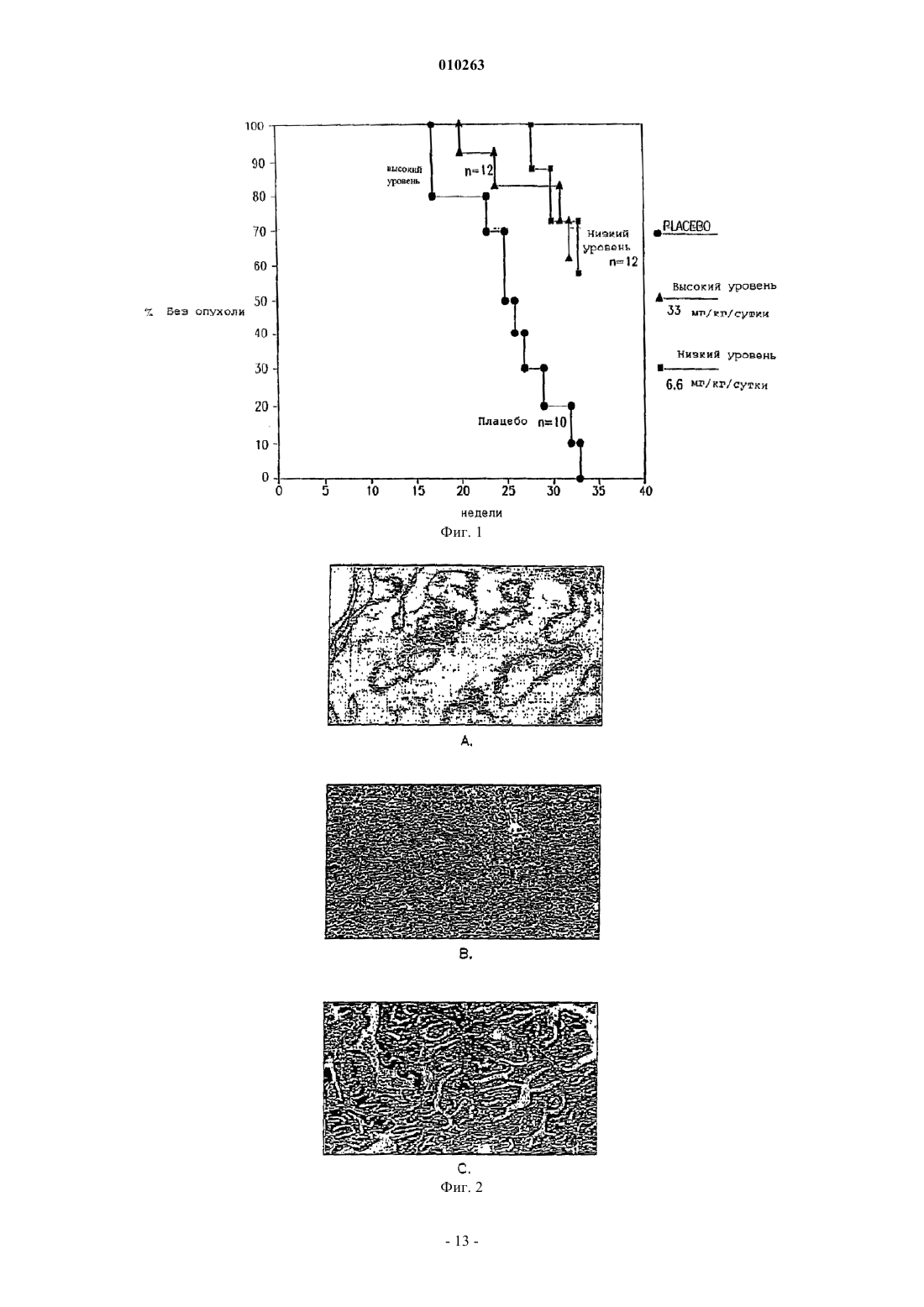
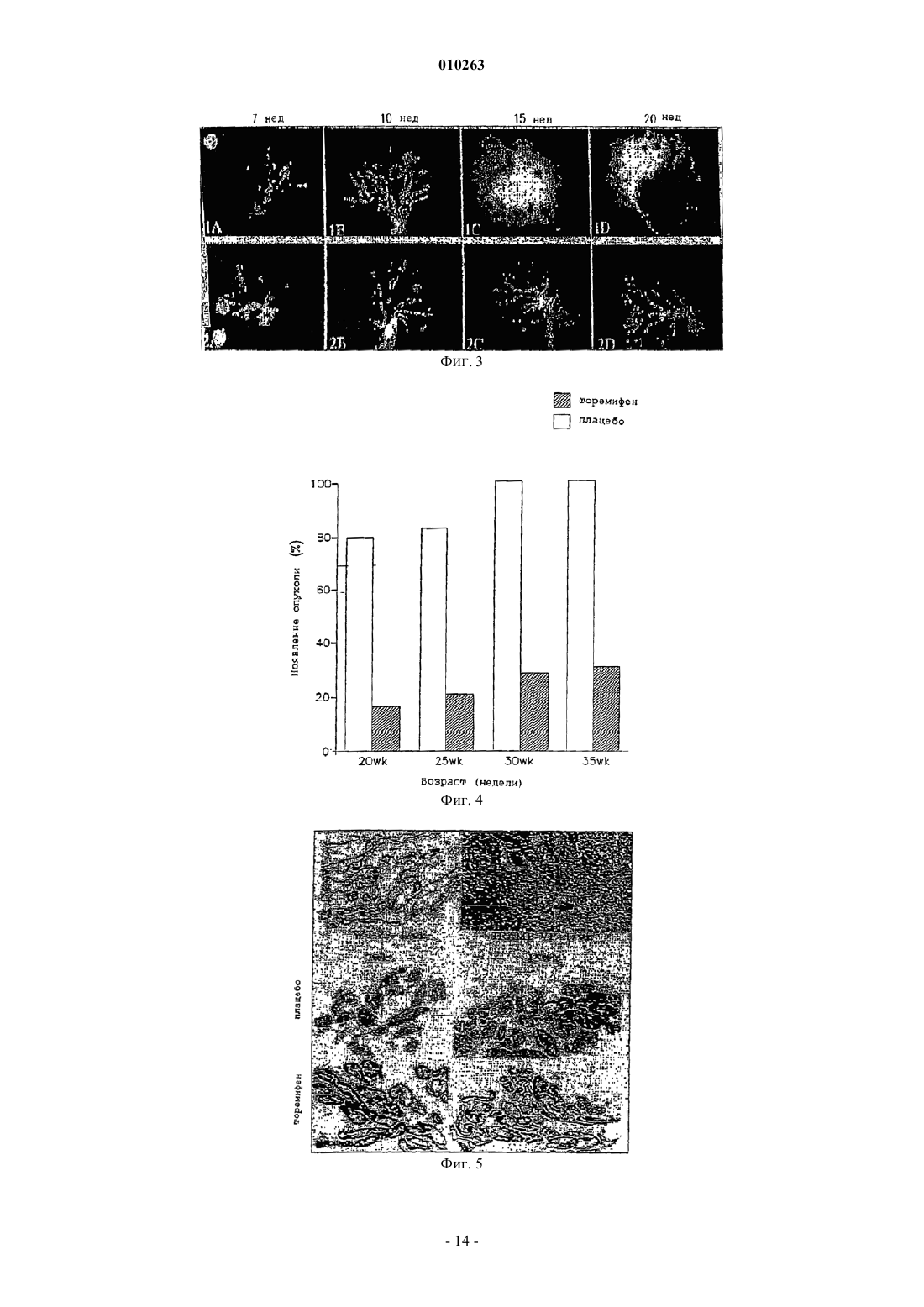
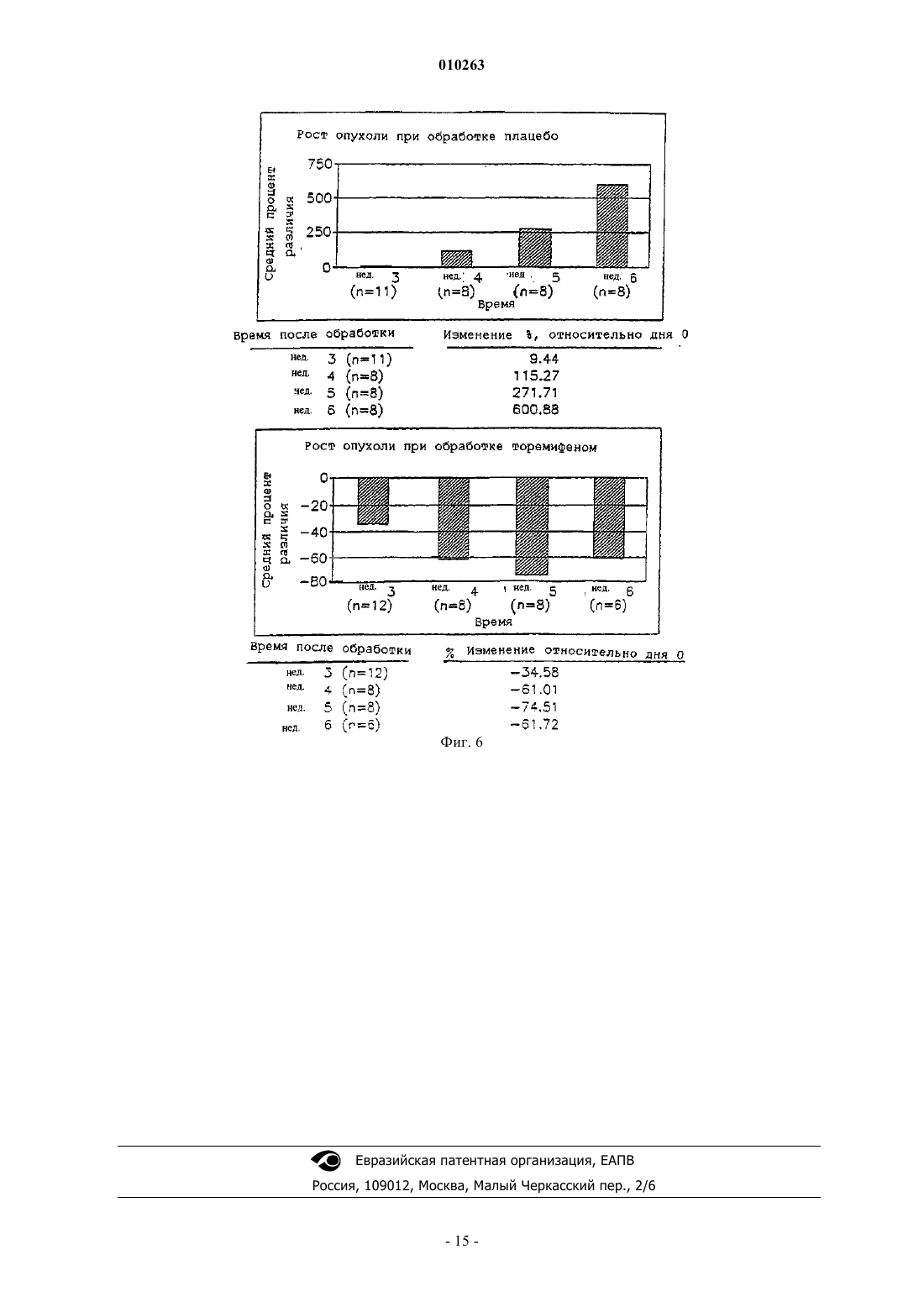
010263 Область техники, к которой относится изобретение Изобретение относится к химиопрофилактике рака предстательной железы и, конкретнее, к способу подавления или ингибирования латентного рака предстательной железы, включающему введение млекопитающему химиопрофилактического средства и его аналогов и метаболитов. Химиопрофилактическое средство предупреждает рецидив или подавляет или ингибирует карциногенез предстательной железы и лечит рак предстательной железы. Предпосылки создания изобретения Рак предстательной железы является одним из наиболее часто встречающихся раковых заболеваний среди мужчин в Соединенных Штатах, где каждый год диагностируют сотни тысяч новых случаев. К несчастью, обнаруживается, что в более чем 60% вновь установленных случаев рак предстательной железы патологически прогрессирует и не лечится, и прогноз является неутешительным. Один из подходов к такой проблеме состоит в обнаружении рака предстательной железы на более ранней стадии с помощью программ скрининга, чтобы таким образом снизить число пациентов с прогрессирующим раком предстательной железы. Однако другая стратегия заключается в разработке лекарственных средств для предупреждения рака предстательной железы. Каждый третий мужчина в возрасте старше 50 лет имеет латентную форму рака предстательной железы, которая может активизироваться до опасной для жизни клинической формы рака предстательной железы. Показано, что частота латентных опухолей предстательной железы существенно повышается с каждым десятилетием на протяжении жизни от 50 лет (5,314%) до 90 лет (40-80%). Число людей с латентным раком предстательной железы одинаково для всех культур, этнических групп и рас, но частота клинически агрессивного рака заметно различается. Это наводит на мысль о том, что в активации латентного рака предстательной железы могут играть роль факторы окружающей среды. Таким образом, разработка стратегии химиопрофилактики против рака предстательной железы может являться сильнейшим общим ударом как в медицинском, так и в экономическом смысле по раку предстательной железы. Торемифен является примером трифенилакенового соединения, описанного в патентах США 4696949 и 5491173, Toivola et al., включенных в данное описание в качестве ссылок. Парентеральное и местное введение млекопитающим композиций, содержащих торемифен, описывается в патенте США 5571534, Jalonen el al., и в патенте США 5605700, DeGregorio et al., включенных в данное описание в качестве ссылок. В патенте США 5595985, Labrie, включенном в данное описание в качестве ссылки, также описывается способ лечения доброкачественной гиперплазии предстательной железы с использованием сочетания ингибитора 5-редуктазы и соединения, связывающего андрогенные рецепторы и блокирующего доступ к ним. Одним из примеров соединений, блокирующих андрогенные рецепторы, является флутамид. В патентах США 4329364 и 4474813, Neri et al., включенных в данное описание в качестве ссылок, описываются фармацевтические препараты, содержащие флутамид, для задержки и/или предупреждения начала рака предстательной железы. Препарат может находиться в форме капсулы, таблетки, суппозитория или эликсира. Несмотря на указанные разработки, сохраняется потребность в средствах и способах, эффективных для предупреждения рака предстательной железы. Из-за высокой частоты случаев заболевания и смертности от рака предстательной железы требуется разработать стратегии химиопрофилактики против этой разрушительной болезни. Понимание факторов,вносящих вклад в карциногенез предстательной железы, включая инициацию, промотирование и развитие рака предстательной железы, обеспечит молекулярные механистические критерии относительно соответствующих моментов вмешательства для предупреждения или остановки карциногенного процесса. Новые подходы крайне необходимы как на научном, так и на клиническом уровне для снижения частоты заболевания раком предстательной железы, а также для остановки или вызывания регрессии латентного рака предстательной железы. Так как частота случаев рака предстательной железы повышается драматически в том возрасте, когда мужчины противостоят другим конкурирующим причинам смертности, простое замедление развития аденокарциномы предстательной железы может являться как более подходящей, так и эффективной по стоимости стратегией здоровья. Настоящее изобретение направлено на удовлетворение такой потребности. Кроме того, так как внутриэпителиальная неоплазия предстательной железы находится на прямом причинном пути к раку предстательной железы, и ее наличие специфически указывает на возросшую опасность развития рака предстательной железы, у мужчин с диагнозом внутриэпителиальной неоплазии предстательной железы происходят резкие изменения в качестве их жизни. Единственным способом установления диагноза внутриэпителиальной неоплазии предстательной железы является биопсия предстательной железы. Однако, когда диагноз внутриэпителиальной неоплазии предстательной железы установлен, обычное медицинское наблюдение состоит в том, что пациент должен чаще подвергаться биопсии и наведываться к врачу. Кроме того, пациент и врач испытывают большое беспокойство, поскольку неминуем диагноз рака предстательной железы. В настоящее время не существует лечения, доступного для пациентов, у которых имеется внутриэпителиальная неоплазия предстательной железы.-1 010263 Краткое описание изобретения Изобретение относится к способу предупреждения карциногенеза предстательной железы у субъекта, включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен, или его аналог, производное, изомер и их фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к способу подавления или ингибирования латентного рака предстательной железы у субъекта, включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен, или его аналог, производное, изомер и их фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к способу снижения опасности развития рака предстательной железы у субъекта, включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен, или его аналог, производное, изомер и их фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к способу повышения степени выживания субъекта, имеющего рак предстательной железы, включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен, или его аналог, производное, изомер и их фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к способу лечения субъекта, имеющего рак предстательной железы,включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен, или его аналог, производное, изомер и их фармацевтически приемлемые соли,сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к способу снижения количества предраковых предшественников патологических изменений аденокарциномы предстательной железы у субъекта, включающему введение субъекту-млекопитающему фармацевтического препарата, содержащего ралоксифен, или тамоксифен,или его аналог, производное, изомер, а также их фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси. В одном из вариантов предраковым предшественником аденокарциномы предстательной железы является внутриэпителиальная неоплазия предстательной железы (PIN). В одном из вариантов предраковым предшественником аденокарциномы предстательной железы является внутриэпителиальная неоплазия предстательной железы высокой степени (PIN). Настоящее изобретение относится к безопасному и эффективному способу предупреждения карциногенеза предстательной железы, подавления или ингибирования латентного рака предстательной железы и особенно полезно для лечения субъектов с повышенной опасностью развития рака предстательной железы, например, субъектов с доброкачественной гиперплазией предстательной железы, внутриэпителиальной неоплазией предстательной железы (PIN) или с аномально высоким уровнем циркулирующих специфических для предстательной железы антител (PSA), или у субъектов, имеющих семейный анамнез рака предстательной железы. Краткое описание чертежей Фиг. 1. График, иллюстрирующий химиопрофилактическое действие торенифена на моделиTRAMP. Фиг. 2 А-С. Срезы НЕ, показывающие клетки вентральной доли предстательной железы у здоровых мышей и рака предстательной железы у TRAMP-мышей, участвующих в исследовании. Фиг. 3. Действие торенифена на развитие вентральной доли предстательной железы у TRAMPмышей. Фиг. 4. Действие торенифена на появление опухоли у TRAMP-мышей. Фиг. 5. Действие торенифена на развитие опухоли на модели TRAMP. Фиг. 6 А-В. Сравнение действия торенифена относительно плацебо на рост опухоли. Подробное описание изобретения Данное изобретение относится к следующим способам: 1) способ предупреждения карциногенеза предстательной железы; 2) способ подавления или ингибирования рака предстательной железы; 3) способ снижения опасности развития рака предстательной железы; 4) способ повышения степени выживания субъекта; 5) способ лечения рака предстательной железы; 6) способ регрессии внутриэпителиальной неоплазии предстательной железы и способам снижения количества паталогических изменений при внутриэпителиальной неоплазии предстательной железы высокой степени путем введения химиопрофилактического средства, описываемого в данном описании. В одном из вариантов воплощения изобретения химиопрофилактическое средство представляет собой ралоксифен или тамоксифен, его аналог, производное, изомер и их метаболиты. Как показано в данном описании, тамоксифен, фаслодекс и ралоксифен, являющиеся примерами антиэстрогенов, являются химиопрофилактическими средствами для предстательной железы и средствами против внутриэпителиальной неоплазии предстательной железы.-2 010263 Промежуточные целевые биомаркеры являются поддающимися измерению биологическими изменениями в ткани, происходящими в промежутке между инициацией и развитием явной неоплазии. Биомаркер утверждают, если конечная цель - сфера распространения рака, также уменьшается под действием предполагаемого химиопрофилактического средства. Промежуточные биомаркеры при раке можно классифицировать по следующим группам: гистологические маркеры, маркеры пролиферации и дифференциации и биохимические маркеры. При любой стратегии химиопрофилактики доступность гистологически узнаваемых и признанных предраковых паталогических изменений составляет важный отправной момент. Для предстательной железы гистологическим маркером является предраковый предшественник аденокарциномы предстательной железы, примером которого является внутриэпителиальная неоплазия предстательной железы (PIN). PIN проявляется как аномальная пролиферация в предстательных проточках предракового очага клеточной дисплазии и карцинома in situ без стромальной инвазии. PIN и гистологический рак предстательной железы морфометрически и по фенотипу являются подобными. Таким образом, развитие PIN высокой степени представляет важную стадию пути развития, посредством которого в нормальной предстательной железе развивается PIN, гистологический рак предстательной железы, инвазивный клинический рак предстательной железы и метастазы. Показано, что внутриэпителиальная неоплазия предстательной железы является предраковым патологическим изменением или предшественником аденокарциномы предстательной железы. Внутриэпителиальная неоплазия предстательной железы представляет собой аномальную пролиферацию в предстательных проточках предзлокачественных очагов клеточной дисплазии и карциномы in situ без стромальной инвазии. Внутриэпителиальная неоплазия предстательной железы является наиболее точным и надежным маркером карциногенеза предстательной железы и может использоваться в качестве подходящей цели при испытании химиопрофилактических средств для предстательной железы. Внутриэпителиальная неоплазия предстательной железы как маркер имеет важное значение для предсказания аденокарциномы, и ее идентификация служит основанием для повторной биопсии на одновременную или последующую инвазивную карциному. Большинство исследований наводят на мысль, что у большинства пациентов с внутриэпителиальной неоплазией предстательной железы будет развиваться рак в течение 10 лет. Представляет интерес тот факт, что внутриэпителиальная неоплазия предстательной железы не вносит вклад в содержание PSA в сыворотке, что неудивительно, так как в отличие от рака предстательной железы, внутриэпителиальная неоплазия предстательной железы еще не посягает на сосудистую сеть предстательной железы для пропуска PSA в кровоток. Таким образом, внутриэпителиальная неоплазия предстательной железы может превосходить по важности даже рак предстательной железы относительно повышения PSA в сыворотке. Данное изобретение относится к применению композиции и фармацевтической композиции для предупреждения карциногенеза предстательной железы, подавления или ингибирования рака предстательной железы, уменьшения опасности развития рака предстательной железы, повышения степени выживания субъекта, лечения рака предстательной железы, регрессии внутриэпителиальной неоплазии предстательной железы и снижения количества патологических изменений внутриэпителиальной неоплазии предстательной железы высокой степени путем введения химиопрофилактических средств, указанных выше, и носителя или разбавителя, и/или фармацевтически приемлемого носителя для них, разбавителей, их солей, эфиров или N-оксидов и их смесей. Настоящее изобретение относится к безопасному и эффективному способу предупреждения карциногенеза, подавления или ингибирования латентного рака предстательной железы и особенно полезно для лечения субъектов с повышенной опасностью развития рака предстательной железы, например,субъектов с доброкачественной гиперплазией предстательной железы, внутриэпителиальной неоплазией предстательной железы (PIN) или аномально высоким уровнем циркулирующих антител, специфических для предстательной железы, или имеющих семейный анамнез рака предстательной железы. В одном из вариантов воплощения изобретения субъект является млекопитающим. В другом варианте субъект является человеком. Изобретение охватывает чистые (Z)- и (Е)-изомеры соединений и их смеси, а также пары чистых (RR,SS)- и (RS,SR)-энантиомеров и их смеси. Изобретение включает фармацевтически приемлемые соли аминозамещенных соединений с органическими и неорганическими кислотами, например, лимонной кислотой и хлороводородной кислотой. Изобретение также включает N-оксиды аминозамещенных соединений формулы (I). Фармацевтически приемлемые соли также можно получить из фенольных соединений путем обработки неорганическими основаниями, например, гидроксидом натрия. Также можно получить эфиры фенольных соединений с алифатическими и ароматическими карбоновыми кислотами, например, эфиры уксусной кислоты и бензойной кислоты. Используемый в данном описании термин "фармацевтическая композиция" обозначает терапевтически эффективное количество средства вместе с подходящими разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантом и/или носителями. Используемый в данном описании термин"терапевтически эффективное количество" относится к количеству, обеспечивающему лечебное действие для данного состояния и режима введения. Такие композиции представляют собой жидкости или лиофилизованные или высушенные иным образом составы и включают разбавители с различным содержанием-3 010263 буферного вещества (например, трис-HCl, ацетатного, фосфатного), pH и ионной силой, добавки, такие как альбумин или желатин, для предупреждения прилипания к поверхностям, детергенты (например,твин 20 или твин 80, плюроник F68, соли желчных кислот), солюбилизаторы (например, глицерин, полиэтиленгликоль), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия), консерванты(например, тимеросаль, бензиловый спирт, парабены), наполнители или модификаторы тоничности (например, лактозу, маннит), полимеры, такие как полиэтиленгликоль, ковалентно присоединенные к белку,комплексы с ионами металлов или вещества, включенные в или присоединенные к частицам полимеров,таких как полиакриловая кислота, полигликолевая кислота, гидрогели и т.п., или включенные в липосомы, микроэмульсии, мицеллы, моноламеллярные или мультиламеллярные везикулы, гемолизированные эритроциты или сферопласты. Подобные композиции будут влиять на физическое состояние, растворимость, стабильность, степень высвобождения in vivo, и степень очистки in vivo. Композиции с регулируемым или отсроченным высвобождением включают композицию в липофильных депо (например,жирных кислотах, восках, маслах). Изобретение также охватывает композиции в виде частиц с полимерным покрытием (например, из полоксамеров и полоксаминов). Другие варианты композиций изобретения включают формы частиц с защитными покрытиями, ингибиторами протеаз или усилителями проникания для различных способов введения, включая парентеральный, легочный, назальный и пероральный. В одном из вариантов фармацевтическую композицию вводят парентерально, параканцерально, трансмукозально, трансдермально, внутримышечно, внутривенно, интрадермально, подкожно, интраперитонеально, интравентрикулярно, интракраниально и в опухоль. Дозировка может находиться в интервале 580 мг/сутки. В другом варианте дозировка находится в интервале 35-66 мг/сутки. В другом варианте дозировка находится в интервале 40-60 мг/сутки. В другом варианте дозировка находится в интервале 4560 мг/сутки. В другом варианте дозировка находится в интервале 15-25 мг/сутки. В другом варианте дозировка находится в интервале 55-65 мг/сутки. Дозировка может составлять 60 мг/сутки. Дозировка может составлять 20 мг/сутки. Дозировка может составлять 45 мг/сутки. Таблетка для перорального введения содержит 88,5 мг химиопрофилактического средства, что эквивалентно 60 мг химиопрофилактического средства. Кроме того, используемый в данном случае фармацевтически приемлемый носитель хорошо известен специалистам в данной области техники и включает, но не ограничивается указанным, 0,01-0,1 М,предпочтительно 0,05 М, фосфатный буфер или 0,8% физиологический раствор. Кроме того, такие фармацевтически приемлемые носители могут представлять собой водные или неводные растворы, суспензии и эмульсии. Примерами неводных носителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и органические эфиры для инъекций, такие как этилолеат. К водным носителям относятся вода, спиртово-водные растворы, эмульсии или суспензии, в том числе физиологический раствор и забуферированные среды. К носителям для парентерального введения относятся раствор хлорида натрия, декстроза Рингера, декстроза и хлорид натрия, лактат Рингера или нелетучие масла. К носителям для внутривенного введения относятся жидкие и питательные добавки, электролиты,такие как на основе декстрозы Рингера, и т.п. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, collating agents, инертные газы и т.п. Термин "адъювант" относится к соединению или смеси, которые усиливают иммунный ответ на антиген. Адъювант может служить в качестве тканевого депо, постепенно высвобождающего антиген, и также в качестве активатора лимфоидной системы, неспецифически усиливающего иммунный ответ(Hood et al., Immunology, Second Ed., 1984, Benjamin/Cummings: Menlo Park, California, p. 384). Часто первичного заражения одним антигеном в отсутствие адъюванта не хватает для выявления гуморального или клеточного иммунного ответа. К адъювантам относятся полный адъювант Фрейнда, неполный адъювант Фрейнда, сапонин, минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы-плюроники, полианионы, пептиды, масляные или углеводородные эмульсии, гемоцианины лимфы улитки, динитрофенол и потенциально полезный для человека адъювант, такой как БЦЖ (bacille Galmette-Guerin) и Corynobacterium parvum, и другие вещества. Предпочтительно, адъювант является фармацевтически приемлемым. Композиции с регулируемым или отсроченным высвобождением включают композицию в липофильном депо (например, жирных кислотах, восках, маслах). Изобретение также охватывает композиции в виде частиц с полимерным покрытием (например, из полоксамеров и полоксаминов) и соединение в сочетании с антителами, направленными против тканеспецифических рецепторов, лигандами или антигенами, или в сочетании с лигандами тканеспецифических рецепторов. Другие варианты композиций изобретения включают формы частиц с защитными покрытиями, ингибиторами протеаз или усилителями проникания для различных способов введения, включая парентеральный, легочный, назальный и пероральный. Известно, что соединения, модифицированные посредством ковалентного присоединения водорастворимых полимеров, таких как полиэтиленгликоль, сополимеры полиэтиленгликоля и полипропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон или полипролин, после внутривенной инъекции обнаруживают существенно более продолжительное время полужизни в кровотоке, чем соответствующие немодифицированные соединения (Abuchowski et al.,1981, Newmark et al., 1982 и Katre et al., 1987). Такие модификации также могут повысить растворимость-4 010263 соединений в водных растворах, устранить агрегацию, усилить физическую и химическую устойчивость соединения и существенно снизить иммунногенность и реактивность соединения. В результате нужнойin vivo биологической активности можно достичь путем менее частого введения таких аддуктов полимеров и соединения или путем введения меньших доз, чем в случае немодифицированного соединения. В еще одном варианте воплощения изобретения фармацевтическая композиция может доставляться в системе с регулируемым высвобождением. Например, средство можно вводить с использованием внутривенной инфузии, имплантируемого осмотического насоса, трансдермального пэтча, липосом или другими способами. В одном из вариантов можно использовать насос (см. Langer, цит. выше; Sefton, CRCCrit. Ref. Biomed., 14:201 (1987); Buchwald et al., Surgery, 88:507 (1980); Saudek et al., N. Engl. J. Med., 321: 574 (1989. В другом варианте можно использовать полимерные материалы. Еще в одном варианте система с регулируемым высвобождением может быть помещена вблизи лечебной мишени, т.е. головного мозга, причем в таком случае требуется только часть системной дозы (см., например, Goodson, в MedicalApplications of Controlled Release, цит. выше, vol. 2, p. 115-138 (1984. Предпочтительно устройство для регулируемого высвобождения вводят субъекту вблизи места неподходящей иммунной активации или опухоли. Другие системы с регулируемым высвобождением описываются в обзоре Langer (Science,249:1527-1533 (1990. Способ настоящего изобретения предупреждения карциногенеза предстательной железы включает введение млекопитающему фармацевтического препарата, содержащего химиопрофилактическое средство, или его соль, или метаболит. Фармацевтический препарат может содержать одно химиопрофилактическое средство или также может содержать фармацевтически приемлемый носитель, и может находиться в твердой или жидкой форме, такой как таблетки, порошки, капсулы, пилюли, растворы, суспензии, эликсиры, эмульсии, гели, кремы или суппозитории, в том числе, ректальные и уретральные суппозитории. Фармацевтически приемлемыми носителями являются смолы, крахмалы, сахара, целлюлозные материалы и их смеси. Фармацевтический препарат, содержащий химиопрофилактическое средство,можно вводить субъекту, например, подкожной имплантацией гранулы; в другом варианте гранула обеспечивает регулируемое высвобождение химиопрофилактического средства в течение некоторого времени. Препарат также можно вводить путем внутривенной, внутриартериальной или внутримышечной инъекции жидкого препарата, пероральным введением жидкого или твердого препарата или местным введением. Введение также можно осуществить, применяя ректальный суппозиторий или уретральный суппозиторий. Фармацевтический препарат также может представлять собой композицию для парентерального введения; в одном из вариантов композиция содержит липосомы, включающие комплекс химиопрофилактического средства, такого как, например, торемифен, и циклодекстрина, как описывается в цитированном ранее патенте США 5571534, Jalonen et al. Фармацевтические препараты изобретения можно получить известными способами растворения,смешивания, гранулирования или таблетирования. Для перорального введения химиопрофилактические средства или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и т.п., смешивают с добавками, обычными для такой цели, такими как наполнители, стабилизаторы, или инертными разбавителями и превращают обычными способами в подходящую форму для введения, такую как таблетки, таблетки с покрытием, твердые или мягкие желатиновые капсулы, водные, спиртовые или масляные растворы. Примерами подходящих инертных наполнителей являются обычные основы для таблеток, такие как лактоза, сахароза или кукурузный крахмал, в сочетании со связующими веществами,подобными аравийской камеди, кукурузному крахмалу, желатину, или с веществами, способствующими рассыпанию, такими как кукурузный крахмал, картофельный крахмал, альгиновая кислота, или со смазывающими веществами, подобными стеариновой кислоте или стеарату магния. Примерами подходящих масляных наполнителей или растворителей являются растительные или животные масла, такие как подсолнечное масло или жир печени рыбы. Препараты могут быть эффективными как в виде сухих, так и увлажненных гранул. Для парентерального введения (подкожная, внутривенная, интраартериальная или внутримышечная инъекция) химиопрофилактические средства или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и т.п., переводят в раствор, суспензию или эмульсию, при необходимости, с веществами, обычными и подходящими для такой цели, например, солюбилизаторами или другими вспомогательными веществами. Примерами являются стерильные жидкости, такие как вода и масла, с добавлением или без добавления поверхностно-активного вещества и других фармацевтически приемлемых адъювантов. Примерами масел являются масла, полученные из нефти,животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло или минеральное масло. Вообще, вода, физиологический раствор, водная декстроза и растворы родственных сахаров, и гликоли, такие как пропиленгликоли или полиэтиленгликоли, являются предпочтительными жидкими носителями, в частности, для растворов для инъекций. Получение фармацевтических композиций, содержащих активный компонент, хорошо известно в технике. Как правило, такие композиции получают в виде аэрозоля полипептида, доставляемого в носовые пазухи, или в виде препаратов для инъекций, или в виде жидких растворов или суспензий, однако также можно получить твердые формы, подходящие для получения раствора или суспензии перед инъекцией. Препарат также можно эмульгировать. Активный лечебный ингредиент часто смешивают с экс-5 010263 ципиентами, являющимися фармацевтически приемлемыми и соместимыми с активным ингредиентом. Подходящими эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин,этанол или подобное вещество и их сочетания. Кроме того, при необходимости композиция может содержать небольшие количества вспомогательных веществ, таких как смачиватели или эмульгаторы, буферные вещества для стабилизации pH, усиливающие эффективность активного ингредиента. Активный компонент можно ввести в композицию в нейтрализованных формах фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают аддитивные соли (образованные свободными аминогруппами молекулы полипептида или антитела), образованные с неорганическими кислотами, такими как, например, хлороводородная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и т.п. Соли, образованные свободными гидроксильными группами, также можно получить с неорганическими основаниями, такими как, например,гидроксиды натрия, калия, аммония, кальция или железа, и такими органическими основаниями, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п. Для местного введения на поверхности тела с использованием, например, кремов, гелей, капель и т.п. получают химиопрофилактические средства или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и т.п., и применяют в виде растворов, суспензий или эмульсий в физиологически приемлемом разбавителе с фармацевтическим носителем или без него. В другом варианте активное соединение можно доставить в везикуле, в частности, липосоме (см.Langer, Science, 249:1527-1533 (1990); Treat et al., в Liposomes in Therapy of Infectious Disease and Cancer,Lopez-Berestein and Fidler (eds.). Liss. New York, p. 353-365 (1989); Lopez-Berestein, там же, p. 317-327; см. там же вообще). Фармацевтические композиции настоящего изобретения особенно полезны для лечения субъекта с повышенной опасностью развития рака предстательной железы. К субъектам с высокой степенью риска относятся, например, лица с доброкачественной гиперплазией предстательной железы, внутриэпителиальной неоплазией предстательной железы (PIN) или аномально высоким уровнем циркулирующих антител, специфических для предстательной железы (PSA), или лица с семейным анемнезом рака предстательной железы. Кроме того, химиопрофилактическое средство для предстательной железы можно вводить в сочетании с другими цитокинами или факторами роста, в том числе, IFN- или IFN-, IFN-; интерлейкином(IL) 1, IL-2, IL-4, IL-6, IL-7, IL-12, фактором некроза опухоли TNF-, TNF-, гранулоцитколониестимулирующим фактором (G-CSF), грунолоцит-макрофаг CSF (GM-CSF) и другими; добавочными молекулами, включая членов суперсемейства интегринов и членов суперсемейства Ig, таких какLFA-1, LFA-3, CD22 и B7-1, B7-2, и другими, и кофакторами стимуляции T-клеток ICAM-1. Химиопрофилактическое средство может предшествовать или следовать за обработкой повреждающим ДНК средством с интервалами от минут до недель. Схемы применения и способы известны специалистам в данной области техники. Средства или факторы, повреждающие ДНК, известны специалистам в данной области техники и обозначают любое химическое соединение или способ обработки, которые индуцируют повреждение ДНК, когда применяются к клетке. Такие средства и факторы включают излучение и волны, индуцирующие повреждение ДНК, такие как гамма-излучение, рентгеновское излучение, УФ-излучение, микроволны, электронная эмиссия и т.п. Различные химические соединения, также описываемые как "химиопрофилактические средства", функционируют как индуцирующие повреждение ДНК, и предполагается, что все они применяются в комбинированных способах лечения, описываемых в данном описании. Химиопрофилактические средства, предполагаемые для применения, включают, например, адриамицин, 5-флуороурацил (5FU), этопозид (YP-16), камптотецин, актиномицин-D,митомицин C, цисплатин (CDDP) и даже пероксид водорода. Изобретение также охватывает применение сочетания одного или нескольких средств, повреждающих ДНК, основаны ли они на излучении или действительных соединениях, таких как применение рентгеновского излучения с цисплатином или применение цисплатина с этопозидом. В другом варианте воплощения изобретения можно облучать локализованное место опухоли излучением, повреждающим ДНК, таким как рентгеновское излучение, УФ-свет, гамма-лучи или даже микроволны. С другой стороны, опухолевые клетки можно ввести в контакт со средством, повреждающим ДНК, путем введения субъекту терапевтически эффективного количества фармацевтической композиции, содержащей соединение, повреждающее ДНК, такое как адримицин, 5-флуороурацил, этопозид,камптотецин, актиномицин-D, митомицин C или, предпочтительнее, цисплатин. Средства, повреждающие ДНК, также включают соединения, влияющие на репликацию ДНК, митоз и хромосомную сегрегацию. К таким химиотерапевтическим средствам относятся адримицин, также известный как доксорубицин, этопозид, верапамил, подофиллотоксин и т.п. К другими факторам, вызывающим повреждение ДНК и интенсивно применяемым, относятся такие широко известные факторы, как гамма-излучение, рентгеновское излучение и/или направленная доставка радиоактивных изотопов в опухолевые клетки. Также предполагаются другие формы факторов, повреждающих ДНК, такие как микроволны и УФ-излучение. Наиболее вероятно, что все указанные факторы-6 010263 действуют в широком интервале повреждения ДНК на предшественников ДНК, репликацию и репарацию ДНК и на сборку и сохранение хромосом. Как легко может представить рядовой специалист в данной области техники, способы и фармацевтические композиции настоящего изобретения особенно подходят для введения млекопитающему, предпочтительно - человеку. Аденокарцинома предстательной железы трансгенной мыши Исследованию химиопрофилактики рака предстательной железы препятствовало отсутствие подходящих животных моделей. Недавняя разработка аденокарциномы предстательной железы трансгенной мыши (TRAMP) дает возможность исследовать химиопрофилактику. В модели TRAMP, описанной вGreenberg et al., Prostate cancer in a transgenic mouse, Proc. Natl. Acad. Sci. USA, 1995,vol.92, p. 3439-3443,трансген большого Т-антигена PB-SV40 (PB-Tag) экспрессируется специфически в эпителиальных клетках предстательной железы мыши. В результате такая модель имеет несколько преимуществ перед моделями, существующими в настоящее время: 1) у мышей рано развиваются прогрессирующие формы эпителиальной гиперплазии предстательной железы - в возрасте 10 недель и инвазивная карцинома примерно в 18 недель; 2) картина метастатического рассеивания рака предстательной железы напоминает рак предстательной железы у человека, причем обычными областями метастаз являются лимфоузел, легкое, почка,надпочечник и кость; 3) развитие, как и продвижение рака предстательной железы, может последовать в пределах относительно короткого периода в 10-30 недель; 4) опухоли появляются с частотой 100% и 5) животных можно скринировать на наличие трансгена рака предстательной железы до начала клинического рака предстательной железы в прямом испытании при обработке торемифеном, что может изменить карциногенез предстательной железы. Трансгенная мышиная модель TRAMP является превосходной моделью in vivo для определения механизмов инициации и промотирования рака предстательной железы и для испытания эффективности потенциального торемифена. У указанных мышей за короткий период (17 недель) прогрессирующе развивается эпителиальная гиперплазия предстательной железы, PIN и затем рак предстательной железы. Химиопрофилактическую обработку гибридной мыши TRAMP начинают постнатально через 30 дней с использованием торемифена на уровне примерно 0,5-50 мг на 1 кг массы субъекта в сутки, предпочтительно примерно 6-30 мг на 1 кг массы субъекта в сутки. Торемифен удобно вырабатывается в 21 дневных и 90-дневных гранулах (изготовляемых Research of America, Сарасота, Флорида) и доставляется в виде подкожных имплантатов. Контрольные животные получают имплантаты плацебо. В каждой группе, обрабатываемой лекарственным средством, животных умерщвляют в возрасте 5, 7, 10, 15, 20, 25, 30,40 и 50 недель, пока не развилась пальпируемая опухоль. Кровь собирают по времени обработки для оценки изменений в содержании тестостерона и эстрадиола в сыворотке. Ткани предстательной железы собирают для морфометрических, гистологических и молекулярных исследований. Используют следующие процедуры испытаний: 1) периодически осуществляют анализ wholemount предстательной железы для обнаружения изменений в морфологии предстательных проточков со временем с и без обработки; примеры приводятся на фиг. 2. Тканевые срезы оценивают гистологически методом НЕ и стандартного окрашиванияMasson-trichome. Появление PIN оценивают и распределяют по степеням (I - умеренная, III - тяжелая); 2) измеряют содержание эстрадиола в сыворотке и общего тестостерона (RIA) для каждого возрастного интервала и оценивают любые изменения содержания указанных гормонов как результат действия торемифена. Результаты иммунно-гистохимического анализа Изображения в микроскопе каждого среза ткани оценивают, применяя количественную оценку изображений с помощью компьютера (компьютер и монитор Mac 9500-I 32), с использованием камеры Kodak DCS 460 на микроскопе Nikon Microphot-FX, и количественную оценку проводят, используя систему количественного анализа изображений с помощью цвета (IPLab Spectrum 3.1, Scanalytics, Inc., VA), которая различает различия в окрашивании срезов ткани. Устанавливают пороги идентификации различных компонентов ткани предстательной железы. Фотографические плотности участков, соответствующие каждому из таких компонентов ткани, вычисляют для каждого полного экрана цветного монитора. Усредняют в целом данные для срезов предстательной железы по 5 экранам. Иммуногистохимические изображения можно дитализировать и оценить количественно, чтобы иметь возможность для статистической оценки путем определения коэффициентов корреляции образцов и вероятности (2-очередная). Исследование химиопрофилактической активности Предпринимают исследования для испытания эффективности торемифена на трансгенных животных TRAMP (PBTag X FVBwt) (предоставленных д-ром Normann Greenberg, Baylor College of Medicine,TX). У таких мышей предварительные признаки рака появляются рано - в 10 недель. Самцов в потомстве трансгенных TRAMP скринируют на трансген большого Т-антигена, и при исследовании используют положительных самцов. Антиэстроген торемифен, который испытывают на его возможное химиопрофи-7 010263 лактическое действие, вводят в подготовленные гранулы (Innovative Research of America, Сарасота, Флорида), и начинают химиопрофилактическую обработку мышей постнатально на 30 день (средняя масса мыши 14 г). Мышам каждой из четырех групп по 10-12 животных делают подкожную имплантацию гранул, содержащих торемифен, с 90-дневным высвобождением. Дозировку диффундирующего лекарственного средства, подогнанную для роста, связанного с изменениями массы, создают для доставки или низкой дозы (6 мг/кг) или высокой дозы (30 мг/кг) торемифена. Контрольные животные (n=10) получают имплантаты плацебо. Эффективность обработки оценивают по отсутствию образования пальпируемой опухоли. Опухоли предстательных желез мышей собирают и оценивают молекулярными и гистологическими методами. С использованием трансгенной модели TRAMP рака предстательной железы, на которой у каждого животного, наследующего ген рака предстательной железы, развивается рак предстательной железы, показано, что торемифен как повышает латентный период, так и снижает частоту заболевания раком предстательной железы. Как видно на фиг. 1, действие торемифена эффективно как при низкой, так и при высокой дозе. Образование опухоли вентральной доли предстательной железы у мыши TRAMP отмечается на 17 неделе в группе с плацебо (n=10), на 19 неделе в группе, обработанной высокой дозой торемифена (n=12), и на 28 неделе в группе, обработанной низкой дозой торемифена (n=12). Так, в случае 5 обработок торемифеном,период латентности для развития рака вентральной доли предстательной железы у мышей TRAMP повышается, по существу, на 11 недель. Так как за период исследования развитие опухоли у 50% животных, обработанных торемифеном, не достигалось, сравнение между группами проводится по времени, за которое 25% животных имело опухоли. Опухоли пальпируются у 25% животных из 10 на 23 неделе в группе с плацебо и на 30-31 неделе в группах с высокой и низкой дозой торемифена, с отсрочкой на 7-8 недель. Как низкая, так и высокая доза торемифена, против плацебо, значимы согласно анализу log-ранга и статистическому анализу по Вилкоксону, как показано ниже в табл. 1. Таблица 1 Статистический анализ На 33 неделе - на момент, когда у всех контрольных животных развились опухоли, у 72% животных, получивших низкую дозу торемифена, и у 60% животных, получивших высокую дозу, опухолей еще не было. Таким образом, обработка торемифеном как при низкой, так и при высокой дозировке приводит к существенному снижению частоты появления опухолей в вентральной доле предстательной железы у мышей TRAMP. Такие результаты показывают, что частота заболевания раком предстательной железы существенно снижается и увеличивается период латентности. Как уже указывалось, введение торемифена производит существенное химиопрофилактическое действие против опухолей в вентральной доле предстательной железы у мышей TRAMP. Такой результат вселяет надежду на подобное благоприятное действие на людей, у которых предстательная железа содержит сегмент, соответствующий вентральной доле предстательной железы грызунов. Гистологическая проверка ткани предстательной железы Опухоли, взятые на момент пальпации в группах с плацебо и получивших высокую и низкую дозу торемифена, оценивают гистологически. Фиг. 2 А представляет срез НЕ вентральной доли предстательной железы у 17-недельной здоровой взрослой мыши. Фиг. 2 В - срез вентральной доли предстательной железы обработанной плацебо 16-недельной мыши TRAMP показывает, что в отличие от структуры здоровой предстательной железы, изображенной на фиг. 2 А, вентральная доля предстательной железы мыши TRAMP характеризуется пластами недифференцированных анапластических клеток с высоким митотическим индексом. Напротив, как видно на фиг. 2 С, предстательная железа обработанной торемифеном 30-недельной мыши TRAMP сохраняет многое от нормальной зернистой структуры и имеет опухоли с более дифференцированной структурой, причем митотический индекс значительно ниже, чем у животных, обработанных плацебо. Такие результаты показывают, что торемифен, даже при низкой дозировке,способен подавлять карциногенез предстательной железы на модели TRAMP. Вестерн-блоттинг. Ткани предстательной железы (дорсола-теральной и вентральной долей) собирают при возрасте 10 недель, быстро замораживают в жидком N2 и хранят при -80 С. Лизаты тканей получают с использованием буфера RIPA (150 мМ NaCl, 1% NP40, 0,5% дезоксихолата, 0,1% SDS и 50 мМ трис, pH 7,5), содержащего смесь ингибиторов протеаз (пефаблок, апротинин, бестаин, лейпептин и пепстаин) и ингибитор фосфатазы Na3VO4 (10 мМ). Гомогенат центрифугируют при 14000g при 4 С в течение 10 мин, и лизаты хранят при -80 С.-8 010263 Определяют концентрации белка с использованием анализа белка по Брэдфорду (Bio-Rad). Лизаты тканей нагружают на 7,5% полиакриламидные гели, белки (40 мкг/дорожку) разделяют методом SDSPAGE и элетрофоретически переносят на нитроцеллюлозные мембраны (0,2 мкм, Bio-Rad, Геркулес, Калифорния) в буфере для переноса (192 мМ глицина, 25 мМ трис-HCl и 20% метанола). Ткань опухоли предстательной железы TRAMP используют в качестве положительного контроля. В качестве стандартов молекулярной массы используют хемилюминисцентные маркеры Cruz (Santa Cruz Biotechnology, СнтаКруз, Калифорния). Блоты блокируют в течение ночи при 4 С в BLOTTO (6% обезжиренного сухого молока в 1X TBS) и инкубируют с первичными антителами к большому Т-антигену (моноклональные мышиные Pab 101, 1:200, Santa Cruz Biotechnology) в течение 2 ч при комнатной температуре. Блоты промывают (3) TTBS (0,05% твина 20, 50 мМ трис-HCl, 200 мМ NaCl) и инкубируют со вторичными антителами, конъюгированными с пероксидазой хрена (HPR) (1:5000), в течение 1 ч при 25 С. Иммуннореактивные белки визуализируют на пленке для аутографии с использованием системы усиленной хемилюминесценции (ECL) (АРВ, Пискатавей, Нью-Джерси). Экспрессию белка актина используют для нормализации результатов Tag. С этой целью вышеуказанные мембраны погружают в буфер для снятия(100 мМ 2-меркаптоэтанола, 2% SDS, 62,5 мМ трис-HCl, pH 6,7) и инкубируют при 50 С в течение 30 мин, периодически перемешивая. После блокирования мембрану повторно зондируют первичными антителами к актину (1:2500, Chemicon, Темекула, Калифорния) и затем вторичными антителами, конъюгированными с HPR (1:10000). После детекции методом ECL интенсивность полос оценивают количественно с использованием систем сбора данных Adobe Photoshop 5.0 и анализа ImageQuant (MolecularDynamics). Применение химиопрофилактического действия торемифена против рака предстательной железы наTRAMP-мышиной модели Данный эксперимент подтверждает и демонстрирует химиопрофилактическую эффективность торемифена. Данное исследование сосредотачивается на гистологических и молекулярных изменениях,связанных с развитием опухоли предстательной железы у контрольных животных и механизма действия торемифена на животных TRAMP, которых размножают, скринируют и обрабатывают гранулами с отсроченным высвобождением лекарственного средства. В заранее установленные моменты времени животных группами по 5 особей умерщвляют и извлекают их предстательные железы для анализа. Предстательные железы оценивают на наличие опухоли гистологически, рассечениями wholemount и иммуннохимически с большим Т-антигеном. Для получения данных проводят обработку плацебо и торемифеном в моменты 7, 10, 15 и 20 недель, и результаты обсуждаются ниже. Результаты. Wholemount завершают на 7, 10, 15 и 20 неделях для разных групп мышей. АнализWholemount показывает, что у мышей, обработанных плацебо, опухоли предстательной железы развиваются в возрасте 15-20 недель, как и в предыдущих пилотных исследованиях. Кроме того, у животных,обработанных торемифеном, происходит задержка в появлении рака предстательной железы до 20 недель (фиг. 3). Кроме 20 недель, в группе животных, обработанных торемифеном, имеется впечатляющая задержка в появлении опухоли до 35 недель (фиг. 4). Такие результаты подтверждают, что даже при более чувствительной оценке онкогенности торемифен обнаруживает химиопрофилактическую активность. Для гистологической оценки образцы тканей фиксируют, обрабатывают и заключают в парафин. Получают срезы (толщина 5 пм) и окрашивают обычным методом НЕ. Торемифен ингибирует развитие проточков и дифференциацию ткани (сравнивают на 17 неделе опухоль предстательной железы мыши TRAMP и дикого типа (фиг. 4; гистологию предстательной железы, обработанной торемифином и плацебо, на 15 неделе (фиг. 5). Качественно, иммуногистохимия тканей, обработанных плацебо и торемифеном, показывает присутствие Т-антигена в вентральной области предстательной железы. Таким образом, на модели TRAMP представляется, что химиопрофилактическая активность, демонстрируемая торемифеном, проявляется не за счет подавления пробазинового (probasin) промотора. Выводы. Способность торемифена предупреждать появление рака предстательной железы на модели TRAMP подтверждается с использованием более чувствительных методов оценки образования опухоли. Выясняется, что механизм химиопрофилактического действия торемифена не представляет собой потери трансгена для белка большого Т-антигена. Торемифен индуцирует регрессию выявленного рака предстательной железы человека на модели голых мышей В настоящее время рак предстательной железы является наиболее часто диагностируемым раковым заболеванием у американцев. Однако остаются вопросы этиологии и лечения болезни, особенно в прогрессирующих формах. Обычным способом лечения рецидивирующего и прогрессирующего рака предстательной железы остается гормональная терапия, несмотря на частое развитие болезни, неподдающейся лечению гормонами. Следовательно, необходимы новые подходы к предупреждению и лечению рака предстательной железы, которые помогли бы возрастающему числу мужчин с диагнозом такого заболевания. Эксперименты и результаты, приведенные ниже, показывают, что торемифен подавляет рост опухоли LNCaP, чувствительной к гормонам, у атимичных голых мышей. Материалы и методы. Один миллион клеток LNCaP в матригеле инъецируют подкожно атимичным голым мышам в каждый бок. В целом делают инъекции 40 мышам. Спустя приблизительно 3-4 недели-9 010263 развиваются видимые опухоли. После регистрации размеров опухолей по двум измерениям мышей делят на группы плацебо и обработки на основе эквивалентной опухолевой нагрузки. Отдельную гранулу(плацебо против 35 мг торимифена) имплантируют подкожно каждой мыши между лопатками. Регистрируют еженедельные наблюдения за размером опухоли. Вычисляют объем опухоли (объем опухоли=0,5(L+W)LW0,5236, где L=длина опухоли и W=масса). Объем опухоли в момент имплантации гранулы служит в качестве отправного момента для будущего сравнения изменений размера опухоли. Еженедельные изменения объема каждой опухоли регистрируют в виде различия, в процентах, с исходным измерением при имплантации гранулы. Результаты. Из 78 участков с инъецированными опухолями в 55 (70%) получены опухоли для оценки, адекватные по объему. Для оценки доступно всего 50 опухолей (24 животных с плацебо и 26 животных, обработанных торемифеном). Средние объемы опухолей на момент имплантации гранул подобные для групп, обработанных торемифеном и плацебо (1,90 мм 3 и 1,72 мм 3 соответственно). В группе с торемифеном средний объем уменьшается до 1,68 мм 3 (-0,22 мм 3), в то время как средний объем опухоли в группе с плацебо возрастает до 2,33 мм 3 (+0,61 мм 3). Средний уровень PSA в сыворотке выше в группе с плацебо (3,80 нг/мл), чем в группе с торемифеном (2,80 нг/мл), но статистически это не значимо(р=0,755). Общий уровень тестостерона составляет 2,18 нг/мл для группы с плацебо (n=17) и 2,96 нг/мл для группы с торемифеном (n=19). Две мыши погибли вскоре после имплантации гранулы из-за укусов других мышей. Одну мышь,обработанную торемифеном, исключили из исследования из-за кровоизлияния в опухоли и развития гематомы. У всех мышей развивались односторонние или билатеральные опухоли. Продолжали независимое исследование каждой опухоли. 24 опухоли обрабатывали плацебо и 28 опухолей обрабатывали торемифеном. Результаты приводятся в табл. 2 и на фиг. 6 А и 6 В. Таблица 2 Последующие интервалы для данной популяции будут расширены, и в настоящее время собираются данные по другим животным. Выводы. Торемифен ингибирует и индуцирует регрессию выявленных опухолей LNCaP. Хотя механизм, по которому торемифен проявляет свое действие, неизвестен, способность оказывать такое действие является доводом в пользу применения торемифена как способа лечения рака предстательной железы и предупреждения регрессии рака предстательной железы у пациентов группы риска с выявленными микрометастазами рака предстательной железы. Торемифен вызывает регрессию HGPIN при клинических испытаниях на людях, имеющих рак предстательной железы в фазе IIa. Химиопрофилактическое действие торемифена против рака предстательной железы воспроизводимо демонстрируется в данном описании на общепризнанной животной модели спонтанного рака предстательной железы. Торемифен является первым соединением, демонстрирующим химиопрофилактическую активность против рака предстательной железы. Кроме того, устанавливают внутриэпителиальную неоплазию высокой степени (HGPIN) и время испытаний как патологическое изменение предшественника рака предстательной железы человека, также известное, как латентный рак предстательной железы. Затем HGPIN используют в качестве промежуточной цели или суррогатной цели в случае рака предстательной железы. Действительно, NCI теперь рекомендуется, что PIN следует использовать в качестве промежуточной цели или суррогатной цели в случае рака предстательной железы. В фазе IIa проводили отдельное нерандомизированное исследование с открытым лечением с 17 пациентами. По данной схеме пациентов с PIN, доказанной биопсией, лечат торемифеном по 60 мг ежедневно в течение 4 месяцев. Через 4 месяца пациентам делают повторную биопсию (8 биопсий) и переоценивают статус PIN. Двадцать один пациент вступил в исследование, и завершили исследование шест- 10010263 надцать пациентов. Сумма паталогических изменений по биопсии предстательной железы у этих 16 пациентов показывает, что 12 пациентов имеют регрессию PIN до доброкачественной или атрофической ткани предстательной железы; таким образом, 12 из 16 (75%) пациентов имеют полный ответ. Из остальных 4 пациентов у 3 имеется рак предстательной железы, но количество PIN уменьшается, и у 1 пациента стабильное заболевание, но эпителий в области PIN показывает атрофические и дегенеративные изменения. Оценка на патологию показывает полное разложение PIN с атрофическими изменениями в эпителии предстательной железы. Пациент не испытывает ни острой, ни хронической токсичности, когда принимает торемифен. Сывороточный PSA, сывороточный свободный тестостерон, сывороточный общий тестостерон и сывороточный эстрадиол остаются в нормальных интервалах. Качество жизни не изменяется, включая отсутствие влияния на потенцию и либидо. Следовательно, приведенные результаты показывают химиопрофилактическую роль торемифена для предстательной железы. Результаты показывают, что торемифен ослабляет PIN, что в итоге преобразуется в снижение частоты заболевания и пролонгацию латентности рака предстательной железы и предупреждение карциногенеза предстательной железы. Наконец, обнаружено, что торемифен существенно индуцирует синтезTGF в стромальных фибробластах человека. Пример 1. Применение тамоксифена цитрата и ралоксифена (SERM) и фаслодекса (чистый антиэстроген ICI 182,780) в предупреждении карциногенеза предстательной железы. Построение эксперимента. Химиотерапевтическую обработку мышей начинают постнатально на 30 день. Три группы по 50 самцов гибридных мышей TRAMP в каждой обрабатывают или антиэстрогенами тамоксифеном цитратом, или ралоксифеном (SERM), или фаслодексом (чистый антиэстроген ICI 182,780). Лекарственные средства получают в виде гранул, подготовленных к отсроченному высвобождению лекарственного средства (Innovative Research of America, Сарасота, Флорида) и доставляют в виде подкожных имплантатов (см. предварительные результаты). Контрольные животные получают имплантаты плацебо без фармакологической активности. Животных (n=10) умерщвляют периодически в возрасте 10, 15, 20, 25 и 30 недель и оценивают эффективность обработки, приводящую или к отсутствию образования опухоли, или уменьшению размеров опухоли, если она есть, сравнивая с контрольными животными, получившими плацебо. Собирают кровь для оценки изменений содержания в сыворотке андрогенов и эстрогенов при каждой обработке. Ткани предстательной железы сохраняют для а) морфометрических исследований; b) для гистологических исследований ткань должна быть зафиксирована в 10% забуференном формалине, обработана и заключена в парафин; с) для молекулярных исследований ткань замораживают в жидком азоте и хранят при -70 С. Также регистрируют данные аутопсии и по выживанию. Результаты эксперимента показывают относительную химиопрофилактическую эффективность различных антиэстрогенов в отношении отсрочки или предупреждения рака предстательной железы на модели TRAMP. Морфологические исследования показывают значительные изменения, если они есть, в развитии размера предстательной железы и картины проточков в результате каждой обработки. Парафинизированные срезы тканей окрашивают с использованием стандартного метода НЕ на гистологические изменения, такие как PIN, что будет оцениваться по появлению на мониторе предраковых паталогических изменений как предшественника аденокарциномы предстательной железы. Измеряют содержание эстрадиола и общего тетстостерона в сыворотке для каждого возрастного интервала и оценивают изменения содержания указанных гормонов и коррелируют ли они или нет с изменениями в PIN, количественно определяют содержание пептидных факторов роста TGF, TGF 1, TGF 3 и bFGF в образцах предстательных желез, взятых в каждом интервале. Также оценивают соответствующие рецепторы пептидных факторов роста EGFR и TGF RI и RII. Таблица 3- 11010263 Животных умерщвляют на 20 неделе, и предстательные железы оценивают методом анализаwholemount и гистологически. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для лечения предраковых предшественников аденокарциномы предстательной железы. 2. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для уменьшения количества предраковых предшественников аденокарциномы предстательной железы. 3. Применение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси для приготовления фармацевтической композиции для ингибирования или супрессии предраковых предшественников аденокарциномы предстательной железы. 4. Применение по пп.1-3, в котором предшественниками аденокарциномы предстательной железы является внутриэпителиальная неоплазия предстательной железы (PIN). 5. Применение по пп.1-3, в котором фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель. 6. Применение по п.5, в котором носитель выбирают из группы, состоящей из смолы, крахмала, сахара, целлюлозного материала и их смесей. 7. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде гранул для подкожной имплантации. 8. Применение по п.5, в котором гранулы обеспечивают регулируемое высвобождение ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси в течение определенного периода времени. 9. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде жидкости для внутривенной, внутриартериальной или внутримышечной инъекции. 10. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде жидкого или твердого препарата для перорального введения. 11. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде формы, подходящей для местного применения. 12. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде гранул, таблеток, капсул, раствора, суспензии, эмульсии, эликсира, геля, крема или суппозитория. 13. Применение по п.12, в котором суппозиторием является ректальный или уретральный суппозиторий. 14. Применение по п.5, в котором фармацевтическая композиция изготовлена в виде формы, подходящей для парентерального введения. 15. Применение по п.14, в котором парентеральной формой являются липосомы, включающие комплекс ралоксифена, или тамоксифена, или его производного, изомера, или фармацевтически приемлемой соли, сложного эфира, N-оксида, или их смеси с циклодекстриновым соединением. 16. Применение по п.5, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку от примерно 0,5 до примерно 80 мг на 1 кг веса субъекта в сутки. 17. Применение по п.16, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку от примерно 20 до примерно 60 мг на 1 кг веса субъекта в сутки. 18. Применение по п.16, в котором ралоксифен, или тамоксифен, или его производное, изомер или метаболит, или фармацевтически приемлемая соль, сложный эфир, N-оксид, или их смесь изготовлены в форме, обеспечивающей дозировку 20 мг на 1 кг веса субъекта в сутки.
МПК / Метки
МПК: A61K 31/138, A61K 31/015, A61K 31/381, A61P 35/00
Метки: железы, предстательной, химиопрофилактики, способ, рака
Код ссылки
<a href="https://eas.patents.su/16-10263-sposob-himioprofilaktiki-raka-predstatelnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ химиопрофилактики рака предстательной железы</a>
Предыдущий патент: Способ получения жиро-медовой биологически активной добавки к пище
Следующий патент: Гетероциклокарбоксамидные производные
Случайный патент: Устройство для нагрева воды, предназначенное для водопроводящего бытового прибора, и бытовой прибор с таким устройством