Способ химиопрофилактики рака предстательной железы
Формула / Реферат
1. Способ предупреждения канцерогенеза предстательной железы, предусматривающий введение субъекту-млекопитающему фармацевтического препарата, содержащего химиопрофилактический агент, имеющий формулу
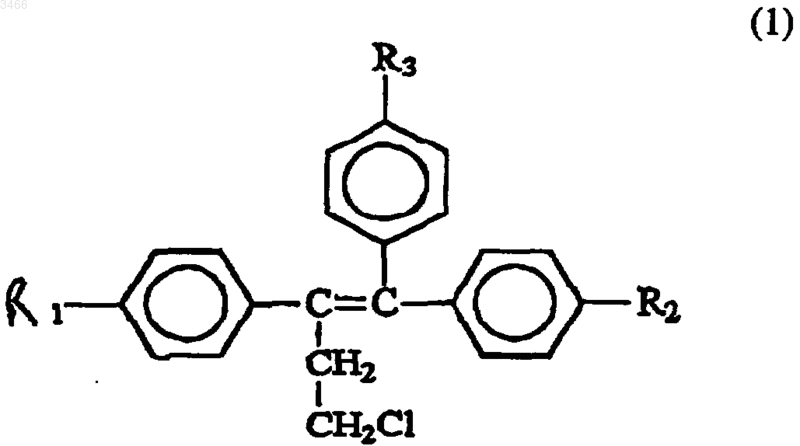
где R1 и R2 могут быть одинаковыми или различными, обозначают H или OH, R3 обозначает OCH2CH2NR4R5, где R4 и R5, которые могут быть одинаковыми или различными и обозначают H или алкильную группу из ~1-4 атомов углерода;
и его фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси.
2. Способ по п.1, где вышеупомянутый фармацевтический препарат дополнительно содержит фармацевтически приемлемый носитель.
3. Способ по п.2, где вышеупомянутый носитель выбран из группы, состоящей из камеди, крахмала, сахара, целлюлозного материала и их смесей.
4. Способ по п.1, где вышеупомянутое введение предусматривает подкожную имплантацию указанному субъекту гранулы, содержащей вышеупомянутый фармацевтический препарат.
5. Способ по п.4, где вышеупомянутая гранула обеспечивает регулируемое высвобождение вышеупомянутого фармацевтического препарата на протяжении некоторого периода времени.
6. Способ по п.1, где вышеупомянутое введение предусматривает внутривенную, внутриартериальную или внутримышечную инъекцию в указанного субъекта вышеупомянутого фармацевтического препарата в жидкой форме.
7. Способ по п.1, где вышеупомянутое введение предусматривает пероральное введение указанному субъекту жидкого или твердого препарата, содержащего вышеупомянутый фармацевтический препарат.
8. Способ по п.1, где вышеупомянутое введение предусматривает локальное нанесение на поверхность кожи указанного субъекта вышеупомянутого фармацевтического препарата.
9. Способ по п.1, где вышеупомянутый фармацевтический препарат выбран из группы, состоящей из гранулы, таблетки, капсулы, раствора, суспензии, эмульсии, эликсира, геля, крема и суппозитория.
10. Способ по п.9, где вышеупомянутый суппозиторий является ректальным суппозиторием или уретральным суппозиторием.
11. Способ по п.1, где вышеупомянутый фармацевтический препарат является парентеральной композицией.
12. Способ по п.11, где вышеупомянутая парентеральная композиция содержит липосому, содержащую комплекс вышеупомянутого химиопрофилактического агента и соединения циклодекстрина.
13. Способ по п.1, где вышеупомянутый химиопрофилактический агент содержит торемифен, его N-оксид, фармацевтически приемлемые соли и их смеси.
14. Способ по п.1, где вышеупомянутое введение проводят в дозе примерно 0,5-50 мг/кг веса субъекта/день вышеупомянутого химиопрофилактического агента.
15. Способ по п.14, где вышеупомянутое введение проводят в дозе примерно 6-30 мг/кг веса субъекта/день вышеупомянутого химиопрофилактического агента.
16. Способ по п.1, где вышеупомянутый субъект имеет повышенный риск развития рака предстательной железы.
17. Способ по п.16, где вышеупомянутый субъект имеет доброкачественную гиперплазию предстательной железы, внутриэпителиальную неоплазию предстательной железы (PIN) или отклоняющийся от нормы высокий уровень циркулирующего в кровотоке специфического для предстательной железы антитела (PSA).
18. Способ предупреждения рецидива, подавления или ингибирования канцерогенеза предстательной железы или увеличения коэффициента выживания субъекта, имеющего рак предстательной железы, предусматривающий введение субъекту-млекопитающему фармацевтического препарата, содержащего химиопрофилактический агент, имеющий формулу
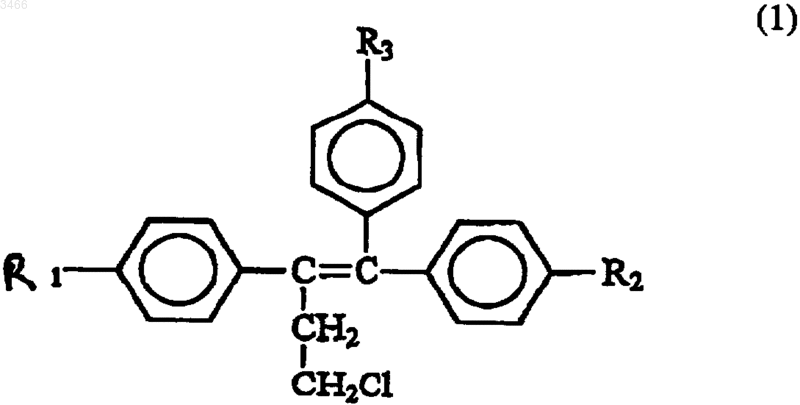
где R1 и R2 могут быть одинаковыми или различными, обозначают H или OH, R3 обозначает OCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают H или алкильную группу из ~1-4 атомов углерода;
и его фармацевтически приемлемые соли, сложные эфиры или N-оксиды и их смеси.
19. Применение соединения общей формулы (I)
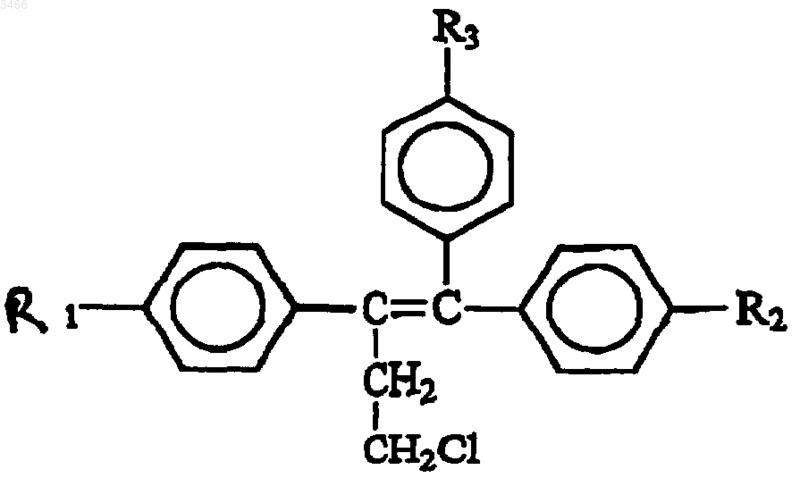
где R1 и R2 могут быть одинаковыми или различными, обозначают H или OH, R3 обозначает OCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают H или алкильную группу из ~1-4 атомов углерода;
и его фармацевтически приемлемых солей, сложных эфиров или N-оксидов и их смесей в производстве фармацевтической композиции для использования в способе подавления или ингибирования предраковых предшественников аденокарциномы предстательной железы.
20. Применение по п.19, где предраковый предшественник или аденокарцинома предстательной железы представляет собой внутриэпителиальную неоплазию предстательной железы (PIN).
21. Применение по п.20, где внутриэпителиальная неоплазия предстательной железы представляет собой тяжелую внутриэпителиальную неоплазию предстательной железы (HPIN).
22. Применение соединения общей формулы (I)
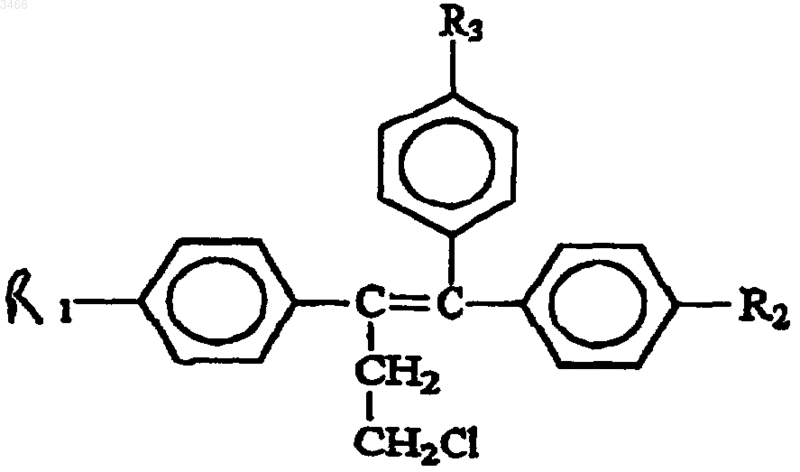
где R1 и R2 могут быть одинаковыми или различными, обозначают H или OH, R3 обозначает OCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают H или алкильную группу из ~1-4 атомов углерода;
и его фармацевтически приемлемых солей, сложных эфиров или N-оксидов и их смесей в производстве фармацевтической композиции для использования в способе лечения или ингибирования предраковых предшественников аденокарциномы предстательной железы.
23. Применение по п.22, где предраковый предшественник или аденокарцинома предстательной железы представляет собой внутриэпителиальную неоплазию предстательной железы (PIN).
24. Применение по п.22, где внутриэпителиальная неоплазия предстательной железы представляет собой тяжелую внутриэпителиальную неоплазию предстательной железы (HPIN).
Текст
1 Область техники, к которой относится изобретение Данное изобретение относится к химиопрофилактике рака предстательной железы и,более конкретно, к способу введения субъекту эффективной дозы агента для предупреждения рецидива, подавления или ингибирования канцерогенеза предстательной железы. Уровень техники Рак предстательной железы является одним из наиболее часто встречающихся раковых заболеваний среди мужчин в Соединенных Штатах, причем каждый год диагностируются сотни тысяч новых случаев рака предстательной железы. К сожалению, было обнаружено, что более 60% вновь диагностируемых случаев рака предстательной железы являются патологически запущенными, с невозможностью излечения и печальным прогнозом. Один из подходов к этой проблеме заключается в более раннем обнаружении рака предстательной железы с использованием программ скрининга (исследования групп бессимптомных больных обычно недорогими диагностическими тестами для выявления лиц с высокой вероятностью наличия рака предстательной железы) и, следовательно, уменьшении числа пациентов с запущенным раком предстательной железы. Другая стратегия состоит в разработке лекарственных средств для предупреждения рака предстательной железы. Одна треть всех мужчин в возрасте старше 50 лет имеет латентную (скрытую) форму рака предстательной железы, которая может быть активирована в угрожающую жизни клиническую форму рака предстательной железы. Было показано, что частота латентных опухолей предстательной железы существенно увеличивается с каждым десятилетием жизни от 50 лет (5,3-14%) до 90 лет (40-80%). Число людей с латентным раком предстательной железы является одинаковым во всех культурах, этнических группах и расах, однако, частота встречаемости клинически агрессивного рака является заметно различной. Это предполагает, что факторы окружающей среды могут играть роль в активации латентного (скрытого) рака предстательной железы. Таким образом, разработка методов химиопрофилактики против рака предстательной железы может иметь наибольшее общее влияние как в медицинском, так и экономическом плане против рака предстательной железы. Вследствие высокой частоты заболеваний и летальности рака предстательной железы настоятельно необходима разработка способов химиопрофилактики против этого разрушительного заболевания. Понимание факторов, которые способствуют канцерогенезу предстательной железы, в том числе инициации, активации и прогрессированию рака предстательной железы, обеспечит молекулярно-механистические ключи в отношении подходящих моментов вмешательства для предупреждения или оста 003466 2 новки канцерогенного процесса. Новые новаторские подходы настоятельно требуются как на уровне фундаментальной науки, так и на клиническом уровне для уменьшения частоты заболеваний раком предстательной железы, а также для остановки или индукции регресса латентного рака предстательной железы. Поскольку частота заболеваний раком предстательной железы усиливается драматично в одном и том же возрасте при противостоянии людей другим конкурирующим причинам смертности, просто замедление прогрессирования аденокарциномы предстательной железы может быть как более подходящей, так и затратосберегающей стратегией здравоохранения. Были предприняты различные подходы для химиопрофилактики рака предстательной железы. В статье Greenwald, "Expanding Horizons in Breast and Prostate Cancer Prevention andEarly Detection", J. Cancer Education, 1993, Vol. 8, No. 2, pages 91-107 обсуждается испытание ингибиторов 5-редуктазы, таких как финастерид, для предупреждения рака предстательной железы. В статье Brawley et al., "Chemoprevention of Prostate Cancer", Urology, 1994, Vol. 43,No. 5 также упоминаются ингибиторы 5 редуктазы, а также дифторметилорнитин и ретиноиды в качестве потенциальных химиопрофилактических агентов. В работе Kelloff et al., "Introductory Remarks: Development of Chemopreventive Agentsfor Prostate Cancer", Journal of Cellular Biochemistry, 1992, Supplement 16H: 1-8 описаны преклинические исследования семи агентов: аллотранс-N-(4-гидроксифенил)ретинамида,дифторметилорнитина, дегидроэпиандростерона,лиарозола, ловестатина, олтипраза и финастерида. В работе Lucia et al., "Chemopreventive Activity of Tamoxifen, N-(4-Hydroxyphenyl)retinamide, and the Vitamin D Analogue Ro24-553 1 forAndrogen-promoted Carcinomas of the Rat Seminal Vesicle and Prostate", Cancer Research, 1995,Vol. 55, pages 5621-5627 сообщается о химиопрофилактике карцином предстательной железы у крыс Lobund-Wistar тамоксифеном, модификатором эстрогенной ответной реакции. Как обсуждается в Potter et al., "A mechanistic hypothesis for DNA adduct formation by(онкогенность) у крыс, которая связана с образованием ковалентных ДНК-аддуктов. Эта статья сообщает также, что аналог тамоксифена,торемифен, который обнаруживает гораздо более низкий уровень образования ДНК-аддукта в печени, чем тамоксифен, является неканцерогенным. Торемифен является примером трифенилалкенового соединения, описанного в патентах 3 Соединенных Штатов 4 696 949 и 5 491 173, Toivola et al., описания которых включены здесь в качестве ссылки. Парентеральное и локальное(местное) введение субъектаммлекопитающим композиций, содержащих торемифен, описаны в патенте Соединенных Штатов 5 571 534, Jalonen et al. и в патенте Соединенных Штатов 5 605 700, DeGregorio etal., описания которых включены здесь в качестве ссылки. Содержащие торемифен композиции,предназначенные для реверсии (обращения) множественной устойчивости раковых клеток к цитотоксическим лекарственным средствам описаны в патенте Соединенных Штатов 4 990 538, Harris et al., описание которого включено здесь в качестве ссылки. Патенты Соединенных Штатов 5 595 722 и 5 599 844,Grainger et al., описания которых включены здесь в качестве ссылки, описывают способы идентификации агентов, которые увеличивают уровни TGFP, и перорального введения композиций, содержащих активаторы TGFP и стимуляторы продуцирования TGFP, для предупреждения или лечения состояний, характеризующихся отклоняющейся от нормы пролиферацией клеток гладких мышц, например, травмы сосудов. Описанные агенты для увеличения уровней TGFP включают в себя тамоксифен и его аналог торемифен. Патенты Соединенных Штатов с 5629007 и 5635197, Audia et al., описания которых включены здесь в качестве ссылки, описывают способ предупреждения развития рака предстательной железы в случае риска развития этого рака, например, у пациента, имеющего доброкачественную гиперплазию простаты, путем введения этому пациенту соединения октагидробензо[f]хинолин-3-она. Патент Соединенных Штатов 5 595 985,Labrie, описание которого включено здесь в качестве ссылки, также описывает способ лечения доброкачественной гиперплазии предстательной железы с использованием ингибитора 5 редуктазы и соединения, которое связывается с рецепторами андрогена и блокирует доступ к ним. Одним из примеров соединений, блокирующих рецепторы андрогена, является флутамид. Патенты Соединенных Штатов с 4 329 364 и 4 474 813, Neri et al., описания которых включены здесь в качестве ссылки, описывают фармацевтические препараты, содержащие флутамид, для задержки и/или предупреждения возникновения рака предстательной железы. Такой препарат может быть в форме капсулы,таблетки, суппозитория или элексира. Несмотря на эти разработки, существует настоятельная потребность в агентах и способах, эффективных для предупреждения рака предстательной железы. Данное изобретение направлено на удовлетворение этой потребности. 4 Сущность изобретения Данное изобретение относится к химиопрофилактике рака предстательной железы и,более конкретно, к способу введения субъекту эффективной дозы химиопрофилактического агента, торемифена, и его аналогов или метаболитов для предупреждения рецидива, лечения,подавления или ингибирования канцерогенеза(онкогенеза) предстательной железы. Данное изобретение относится к способу предупреждения канцерогенеза предстательной железы. Данное изобретение включает в себя введение субъекту-млекопитающему фармацевтического препарата химиопрофилактического агента, имеющего формулу где R1 и R2 могут быть одинаковыми или различными и обозначают Н или ОН, R3 обозначаетOCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными и обозначают Н или алкильную группу из примерно 1-4 атомов углерода; и его фармацевтически приемлемых носителя, разбавителей, солей, сложных эфиров илиN-оксидов и их смесей. Данное изобретение обеспечивает безопасный и эффективный способ подавления или ингибирования латентного рака предстательной железы и, в частности, применимо для лечения субъектов, имеющих повышенный риск развития рака предстательной железы, например,субъектов, имеющих доброкачественную гиперплазию предстательной железы, внутриэпителиальную неоплазию (PIN) или отклоняющийся от нормы высокий уровень циркулирующего в кровотоке специфического для предстательной железы антитела (PSA), или субъектов, имеющих в семейном анамнезе рак предстательной железы. Краткое описание рисунков Фиг. 1: График, иллюстрирующий химиопрофилактические эффекты торемифена в модели TRAMP. Фиг. 2 А-2 С: НЕ-срезы, иллюстрирующие клетки вентральной предстательной железы у здоровых мышей и карциномы предстательной железы у мышей TRAMP, включенных в это исследование. Фиг. 3: Действие торемифена на развитие вентральной предстательной железы в мышахTRAMP. Фиг. 4: Действие торемифена на возникновение опухоли у мышей TRAMP. Фиг. 5: Действие торемифена на развитие опухоли на модели TRAMP. 5 Фиг. 6 А-6 В: Сравнение действия плацебо с действием торемифена на рост опухоли. Подробное описание изобретения Данное изобретение относится к 1) способу предупреждения канцерогенеза предстательной железы; 2) способам подавления или ингибирования рака предстательной железы; 3) способам уменьшения риска развития рака предстательной железы и 4) способам увеличения коэффициента выживания субъекта с использованием химиопрофилактического агента для предстательной железы, торемифена, его аналогов и метаболитов. Как показано здесь, торемифен является химиопрофилактическим агентом предстательной железы. В приведенных здесь экспериментах предстательные железы фактически иссекали и оценивали как гистологически, так и посредством анализа тотального препарата. Торемифен тестировали также в отношении лечения рака предстательной железы путем обработки ксенотрансплантатов LNCaP в "голых" мышах(бестимусных мышах с мутацией nude). Как показано, эти данные являются очень драматичными: торемифен не только ингибировал рост,но фактически был способен вызывать регресс(обратное развитие) опухолей. Данное изобретение относится к способу предупреждения канцерогенеза предстательной железы. Данное изобретение включает в себя введение субъекту-млекопитающему фармацевтического препарата химиопрофилактического агента, имеющего формулу где R1 и R2 могут быть одинаковыми или различными и обозначают Н или ОН, R3 обозначаетOC2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают Н или алкильную группу из примерно 1-4 атомов углерода; и его фармацевтически приемлемых носителя, разбавителей, солей, сложных эфиров илиN-оксидов и их смесей. Данное изобретение относится к применению фармацевтической композиции для предупреждения рецидива, подавления или ингибирования канцерогенеза предстательной железы или увеличения коэффициента выживания субъекта, имеющего рак предстательной железы, содержащей химиопрофилактический агент,имеющий формулу где R1 и R2 могут быть одинаковыми или различными, обозначают Н или ОН, R3 обозначаетOCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают Н или алкильную группу из примерно 1-4 атомов углерода; и его фармацевтически приемлемые носитель, разбавители, соли, сложные эфиры или N-оксиды и их смеси. Данное изобретение относится к безопасному и эффективному способу подавления или ингибирования латентного рака предстательной железы и, в частности, применимо для лечения субъектов, имеющих повышенный риск развития рака предстательной железы, например,субъектов, имеющих доброкачественную гиперплазию предстательной железы, внутриэпителиальную неоплазию (PIN) или отклоняющийся от нормы высокий уровень циркулирующего в кровотоке специфического для предстательной железы антитела (PSA), или субъектов, имеющих в семейном анамнезе рак предстательной железы. Соединение 4-хлор-1,2-дифенил-1-[4-[2(N,N-диметиламино)этокси]фенил]-1-бутен формулы (1), где R1 и R2, каждый, обозначают Н и R4 и R5, каждый, обозначают метил, называемое торемифеном. Было показано, что торемифен является безопасным и эффективным в качестве противоопухолевого соединения и проявляет гормональные действия в качестве эстрогенного или в качестве антиэстрогенного агента в зависимости от используемой дозы. При введении торемифен имеет несколько метаболитов,которые также являются биологически активными. Данное изобретение также относится к применению аналогов торемифена или их метаболитов, которые хорошо известны специалистам в данной области. Другими примерами химиопрофилактических агентов формулы (1) являются следующие: 4-хлор-1,2-дифенил-1-[4-[2-(N-метиламино)этокси]фенил]-1-бутен; 4-хлор-1,2-дифенил-1-[4-[2-(N,N-диэтиламино)этокси]фенил]-1-бутен; 4-хлор-1,2-дифенил-1-[4-(аминоэтокси)фенил]-1-бутен; 4-хлор-1-(4-гидроксифенил)-1-[4-[2-(N,Nдиметиламино)этокси]фенил]-2-фенил-1-бутен; 4-хлор-1-(4-гидроксифенил)-1-[4-[2-(N-метиламино)этокси]фенил]-2-фенил-1-бутен и 4-хлор-1,2-бис(4-гидроксифенил)-1-[4-[2(N,N-диметиламино)этокси]фенил]-1-бутен. Данное изобретение включает в себя чистые (Z)- и (Е)-изомеры этих соединений и их 7 смеси, а также чистые (RR,SS)- и (RS,SR)-пары энантиомеров и их смеси. Соединения-агенты формулы (1) могут быть получены в соответствии с процедурами,описанными в цитированных выше патентах Соединенных Штатов 4 696 949 и 5 491 173, Toivola et al. Данное изобретение включает в себя фармацевтически приемлемые соли аминозамещенных соединений с органическими и неорганическими кислотами, например, лимонной кислотой и хлористоводородной кислотой. Данное изобретение включает в себя также N-оксиды аминозаместителей соединений формулы (1). Фармацевтически приемлемые соли могут быть также получены из этих фенольных соединений обработкой неорганическими основаниями, например, гидроксидом натрия. Могут быть получены также эфиры этих фенольных соединений с алифатическими и ароматическими карбоновыми кислотами, например, эфиры уксусной кислоты и бензойной кислоты. Применяемый здесь, термин "фармацевтическая композиция" обозначает терапевтически эффективные количества этого агента вместе с подходящими разбавителями, консервантами,солюбилизаторами, эмульгаторами, адъювантом и/или носителями. "Терапевтически эффективным количеством" называют здесь количество,которое обеспечивает терапевтический эффект для конкретного состояния и схемы введения. Такие композиции являются жидкими или лиофилизированными или другим образом высушенными композициями и включают в себя разбавители, содержащие различные буферы(например, Трис-HCl, ацетатный, фосфатный), с различными рН и ионной силой, добавки, такие как альбумин или желатин, для предотвращения абсорбции на поверхностях, детергенты (например, Твин 20, Твин 80, Плуроник F68, соли желчных кислот), солюбилизирующие агенты(например, тимерозал, бензиловый спирт, парабены), наполнители или модификаторы тоничности (например, лактозу, маннит), и предусматривают ковалентное присоединение полимеров, таких как полиэтиленгликоль, к белку,комплексообразование с ионами металлов или включение этого материала в препараты или на препараты, состоящие из частиц полимерных соединений, таких как полимолочная кислота,полигликолевая кислота, гидрогели и т.д., или в липосомы, микроэмульсии, мицеллы, однослойные или многослойные везикулы, "тени" эритроцитов или сферобласты. Такие композиции будут влиять на физическое состояние, растворимость, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo. Композиции регулируемого или пролонгированного высвобождения включают в себя композицию в 8 липофильных депо (например, жирных кислотах, восках, маслах). Это изобретение охватывает также композиции из частиц, покрытые полимерами (например, полоксамерами или полоксаминами). Другие варианты композиций данного изобретения включают в себя в частности формы защитных покрытий, ингибиторы протеаз или усилители проницаемости для различных путей введения, в том числе парентерального, легочного, интраназального и перорального. В одном варианте фармацетическую композицию вводят парентерально, параканцерально (вблизи раковой опухоли), через слизистую оболочку, чрескожно, внутримышечно,внутривенно, интрадермально, подкожно, внутрибрюшинно, интравентрикулярно, интракраниально и внутрь опухоли. Далее, применяемый здесь термин "фармацевтически приемлемый носитель" хорошо известен специалистам в данной обасти и включает в себя, но не ограничивается ими, 0,01-0,1 М и предпочтительно 0,05 М фосфатный буфер или 0,8% солевой раствор. Кроме того, такие фармацевтически приемлемые носители могут быть водными или неводными растворами, суспензиями и эмульсиями. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. К водным носителям относятся вода, водноспиртовые растворы, эмульсии или суспензии, в том числе солевой раствор и забуференные среды. Парентеральные носители включают в себя раствор хлорида натрия, раствор Рингера с декстрозой,декстрозу и хлорид натрия, содержащий лактат раствор Рингера или нелетучие масла. Внутривенные носители включают в себя средства для пополнения жидкостью и питательными веществами, средства для пополнения электролитами, такие как средства на основе декстрозы Рингера, и т.п. Могут присутствовать консерванты и другие добавки, такие как, например,антимикробные агенты, антиоксиданты, collating агенты, инертные газы и т.п. Термин "адъювант" относится к соединению или смеси, которые усиливают иммунный ответ на антиген. Адъювант может служить в качестве тканевого депо, которое медленно высвобождает антиген, а также в качестве активатора лимфоидной системы, которая неспецифически усиливает иммунный ответ (Hood et al.,Immunology, Second Ed., 1984,Benjamin/Cummings: Menlo Park, California, p. 384). Часто первичная стимуляция одним только антигеном, в отсутствие адъюванта, не вызывает гуморального или клеточного иммунного ответа. Адъюванты включают, но не ограничиваются ими, полный адъювант Фрейнда, неполный адъювант Фрейнда, сапонин, минеральные гели,такие как гидроксид алюминия, поверхностноактивные вещества, такие как лизолецитин, по 9 лиолы плуроников, полианионы, пептиды, масляные или углеводородные эмульсии, гемоцианины фиссуреллы, динитрофенол и потенциально применимый адъювант человека, такой какparvum. Предпочтительно адъювант является фармацевтически приемлемым. Композиции регулируемого или пpолонгированного высвобождения включают в себя композицию в липофильных депо (например, жирных кислотах, восках, маслах). Этим изобретением охватываются также композиции из частиц, покрытых полимерами (например,полоксамерами или полоксаминами), и соединение, связанное с антителами против тканеспецифических рецепторов, лигандов или антигенов или связанное с лигандами тканеспецифических рецепторов. Другие варианты композиций этого изобретения включают в себя частицы состоящих из защитных покрытий, ингибиторов протеаз или усилителей проницаемости для различных путей введения, в том числе парентерального,легочного, интраназального и перорального. Известно, что соединения, модифицированные ковалентным присоединением водорастворимых полимеров, таких как полиэтиленгликоль,сополимеры полиэтиленгликоля и полипропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон или полипролин, проявляют существенно более длительные периоды полувыведения из крови после внутривенной инъекции, чем соответствующие немодифицированные соединенияKatre et al., 1987. Такие модификации могут также увеличивать растворимость этого соединения в водном растворе, устранять агрегацию,увеличивать физическую и химическую стабильность соединения и сильно уменьшать иммуногенность и реактивность соединения. В результате желательная биологическая активность in vivo может быть достигнута введением таких аддуктов полимерного соединения менее часто или в более низких дозах, чем в случае немодифицированного соединения. Еще в одном варианте фармацевтическая композиция может быть доставлена в системе регулируемого высвобождения (пролонгированного действия). Например, агент может быть введен при помощи внутривенной инфузии, имплантируемого осмотического насоса (помпы),трансдермального пластыря, липосом или другими способами введения. В одном варианте может быть использован насос (см. Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201Saudek et al., N. Engl. J. Med. 321:574 (1989). В другом варианте могут быть использованы полимерные материалы. Еще в одном варианте система регулируемого высвобождения может быть помещена вблизи терапевтической мише 003466 10 ни, а именно, мозга, что требует, следовательно,поставки только части системной дозы (см., например, Goodson, Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984. Предпочтительно средство регулируемого высвобождения вводят в субъект вблизи места нежелательной иммунной активации или опухоли. Другие системы пролонгированного действия обсуждаются в обзоре Langer (Science 249: 15271533 (1990. Способ данного изобретения для предупреждения канцерогенеза предстательной железы предусматривает введение субъектумлекопитающему фармацевтического препарата, содержащего химиопрофилактический агент или его метаболит или соль. Фармацевтический препарат может содержать только химиопрофилактический агент или может дополнительно содержать фармацевтически приемлемый носитель и может быть в твердой или жидкой форме,такой как таблетки, порошки, капсулы, гранулы(шарики), растворы, суспензии, эликсиры,эмульсии, гели, кремы или суппозитории, в том числе ректальные и уретральные суппозитории. Фармацевтически приемлемые носители включают камеди, крахмалы, сахара, целлюлозные материалы и их смеси. Фармацевтический препарат, содержащий химиопрофилактический агент, может быть введен субъекту, например,подкожной имплантацией гранулы; в другом варианте эта гранула обеспечивает пролонгированное высвобождение химиопрофилактического агента на протяжении некоторого периода времени. Этот препарат может быть также введен внутривенной, внутриартериальной или внутримышечной инъекцией жидкого препарата, пероральным введением жидкого или твердого препарата или локальным (местным) нанесением. Введение может также осуществляться с использованием ректального суппозитория или уретрального суппозитория. Фармацевтический препарат может быть также парентеральной композицией; в одном варианте эта композиция содержит липосому, включающую в себя комплекс химиопрофилактического агента, такого как, например, торемифен, и соединения циклодекстрира, как описано в цитированном выше патенте Соединенных Штатов 5 571 534, Jalonen et al. Фармацевтические препараты этого изобретения могут быть приготовлены известными способами растворения, смешивания, гранулирования или таблетирования. Для перорального введения химиопрофилактические агенты или их физиологически переносимые производные,такие как соли, сложные эфиры, N-оксиды и т.п., смешивают с добавками, обычными для этой цели, такими как носители, стабилизаторы или инертные разбавители, и превращают общепринятыми способами в подходящую для введения форму, такую как, например, таблетки,таблетки с покрытием, твердые или мягкие же 11 латиновые капсулы, водные, спиртовые или масляные растворы. Примерами подходящих инертных носителей являются общепринятые основы для таблеток, такие как лактоза, сахароза или кукурузный крахмал, в комбинации со связующими веществами, такими как аравийская камедь, кукурузный крахмал, желатин, или с дезинтегрирующими агентами, такими как кукурузный крахмал, картофельный крахмал,альгиновая кислота, или со смазывающим веществом, таким как стеариновая кислота или стеарат магния. Примерами подходящих масляных носителей являются растительные или животные масла, такие как подсолнечное масло или жир печени рыбы. Препараты могут быть приготовлены в виде как сухих, так и увлажненных гранул. Для парентерального введения (подкожной, внутривенной, внутриартериальной или внутримышечной инъекции) химиопрофилактические агенты или их физиологически переносимые производные, такие как соли, сложные эфиры, N-оксиды и т.п., превращают в раствор,суспензию или эмульсию, если желательно, с веществами, обычными и пригодными для этой цели, например, солюбилизаторами или другими вспомогательными веществами. Примерами являются: стерильные жидкости, такие как вода и масла, с добавлением или без добавления поверхностно-активного вещества и других фармацевтически приемлемых адъювантов. Примерами масел являются масла нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло или минеральное (вазелиновое) масло. В общем, вода, солевой раствор, водный раствор декстрозы и подобные растворы cахаров и гликоли, такие как пропиленгликоли или полиэтиленгликоль, являются предпочтительными жидкими носителями, в частности, для инъекционных растворов. Приготовление фармацевтических композиций, содержащих активный компонент, хорошо известно в этой области. Обычно такие композиции готовят в виде аэрозоля полипептида,доставляемого в носоглотку, или в виде инъекционных жидкостей, либо в виде жидких растворов, либо в виде суспензий, но могут быть также приготовлены твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией. Препарат может быть также эмульгирован. Активный терапевтический ингредиент часто смешивают с наполнителями, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящими наполнителями являются, например, вода, солевой раствор, декстроза,глицерин, этанол или т.п. и их комбинации. Кроме того, если желательно, композиция может содержать минорные (небольшие) количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, буфе 003466 12 рящие рН агенты, которые повышают эффективность активного ингредиента. Активный компонент может быть приготовлен в качестве композиции в нейтрализованных фармацевтически активных формах солей. Фармацевтически приемлемые соли включают в себя кислотно-аддитивные соли (образованные со свободными аминогруппами молекулы полипептида или антитела), которые образуются с неорганическими кислотами, такими как, например, хлористо-водородная или фосфорная кислота, или такими органическими кислотами,как уксусная, щавелевая, винная, миндальная кислоты, и т.п. Соли, образованные из свободных карбоксильных групп, могут быть также образованы из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа (III), и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п. Для локального введения на поверхности тела с использованием, например, кремов, гелей, капель и т.п., химиопрофилактические агенты или их физиологически переносимые производные, такие как соли, сложные эфиры,N-оксиды и т.п., готовят и наносят в виде растворов, суспензий или эмульсий в физиологически приемлемом разбавителе с фармацевтически приемлемым носителем или без носителя. В другом варианте активное соединение может доставляться в везикуле, в частности,липосоме (см. Langer, Science 249:1527-1533(1989); Lopez-Berestein, ibid., pp. 317-327; см. в целом ibid). Фармацевтические композиции данного изобретения применимы, в частности, для лечения субъекта, имеющего повышенный риск развития рака предстательной железы. К субъектам высокого риска относятся, например, субъекты,имеющие доброкачественную гиперплазию простаты, внутриэпителиальную неоплазию(PIN) или отклоняющийся от нормы высокий уровень циркулирующего в кровотоке специфического для предстательной железы антитела(PSA), или субъектов, имеющих в семейном анамнезе рак предстательной железы. Далее, химиопрофилактический агент для предстательной железы может вводиться в комбинации с другими цитокинами или факторами роста, которые включают в себя, но не ограничиваются ими: IFNили , IFN-; интерлейкины IL-1, IL-2, IL-4, IL-6, IL-7, IL-12, фактор некроза опухолей (TNF) , TNF-, гранулоцитарный колониестимулирующий фактор (G-CSF),гранулоцитарно-макрофагальный CSF (GMCSF); дополнительные молекулы, в том числе члены суперсемейства интегринов и члены су 13 персемейства Ig, такие как, но не ограничивающиеся ими, костимулирующие Т-клетки молекулы LFA-1, LFA-3, CD22 и В 7-1, В 7-2 и ICAM1. Химиопрофилактический агент может вводиться до или после введения повреждающего ДНК агента с интервалами от минут до недель. Протоколы и способы известны специалистам в этой области. Повреждающие ДНК агенты или факторы известны специалистам в этой области и они являются любым химическим соединением или способом обработки, которые индуцируют повреждение ДНК при применении к клетке. Такие агенты или факторы включают в себя радиацию и волны, индуцирующие повреждение ДНК, такие как гамма-излучение, рентгеновские лучи, УФ-излучение, микроволны,электронные эмиссии и т.п. Разнообразные химические соединения, также описанные как"химиотерапевтические агенты", функционируют, индуцируя повреждение ДНК, и все они, как подразумевается, применимы в описанных здесь комбинированных способах лечения. Предполагается, что могут быть использованы химиотерапевтические агенты, такие как, например, адриамицин, 5-фторурацил (5FU), этопозид (VP16) , камптотецин, актиномицин-D, митомицин С, цисплатина (CDDP) и даже пероксид водорода. Изобретение включает в себя также применение комбинации одного или нескольких повреждающих ДНК агентов, агентов на основе радиации или действительных соединений, такой как применение рентгеновского облучения с цисплатиной или применение цисплатины с этопозидом. В другом варианте можно облучать локализованное место опухоли повреждающим ДНК излучением, таким как рентгеновское излучение, УФ-излучение, гамма-лучи или даже микроволны. Альтернативно, опухолевые клетки могут быть приведены в контакт с повреждающим ДНК агентом путем введения субъекту терапевтически эффективного количества фармацевтической композиции, содержащей повреждающее ДНК соединение, такое как, например, адриамицин, 5-фторурацил, этопозид,камптотецин, актиномицин-D, митомицин С или, более предпочтительно, цисплатина. Агенты, повреждающие ДНК, включают в себя также соединения, которые препятствуют репликации ДНК, митозу и сегрегации хромосом. Такие химиотерапевтические соединения включают в себя адриамицин, также известный как доксорубицин, этопозид, верапамил, подофиллотоксин и т.п. Другие факторы, которые вызывают повреждение ДНК и были широко использованы,включают в себя факторы, которые обычно известны как гамма-облучение, рентгеновское облучение и/или направленная доставка радиоизотопов к опухолевым клеткам. Предполагаются также другие формы повреждающих ДНК 14 факторов, такие как микроволны и УФоблучение. Наиболее вероятно, что все эти факторы осуществляют широкий диапазон повреждения ДНК, на уровне предшественников ДНК,репликации и репарации ДНК и сборки и поддержания хромосом. Как может быть легко понято специалистом с обычной квалификацией в данной области, способы и фармацевтические композиции данного изобретения пригодны, в частности, для введения млекопитающему, предпочтительно человеку. Биомаркерами промежуточных конечных точек являются измеримые биологические изменения в ткани, которые имеют место между инициацией и развитием явной неоплазии. Высказывается гипотеза, что модулирование одного или нескольких биомаркеров промежуточных конечных точек химиопрофилактическим агентом может отражать истинное ингибирование канцерогенеза. Биомаркер был бы подтвержден,если окончательная конечная точка, частота заболевания раком, была бы также уменьшена предполагаемым химиопрофилактическим агентом. Промежуточные биомаркеры в раковом заболевании могут быть классифицированы в следующие группы: гистологические маркеры,маркеры пролиферации, дифференцировки и биохимические маркеры. В любой стратегии химиопрофилактики важной исходной точкой является доступность гистологически узнаваемых и признанных предраковых повреждений. Для предстательной железы возможным гистологическим маркером является внутриэпителиальная неоплазия предстательной железы (PIN),которая является предраковым предшественником аденокарциномы предстательной железы.PIN появляется в виде отклоняющейся от нормы пролиферации в протоках предстательной железы предраковых очагов клеточной дисплазии и карциномы in situ без инвазии стромы. PIN и гистологический рак предстательной железы являются морфометрически и фенотипически одинаковыми. Таким образом, развитие высокой степени PIN может представлять собой важную стадию в пути прогрессирования, посредством которого здоровая предстательная железа развивает PIN, гистологический рак предстательной железы, инвазивный клинический рак предстательной железы и метастазы. Следующие ниже примеры представлены для более полной иллюстрации предпочтительных вариантов этого изобретения. Однако они ни в коем случае не должны быть истолкованы как ограничивающие широкий объем изобретения. Примеры, подтверждающие возможность осуществления изобретения Пример 1. Аденокарцинома предстательной железы трансгенных мышей. Исследование химиопрофилактики рака предстательной железы тормозилось отсутстви 15 ем подходящих моделей животных. Недавнее развитие модели аденокарциномы предстательной железы трансгенных мышей (TRAMP) делает возможным исследование химиопрофилактики. В модели TRAMP, которая описана в работе Greenberg et al., "Prostate cancer in transgenic mouse", Proc. Natl. Acad. Sci. USA, 1995,Vol. 92, pages 3439-3443, трансген большого Тантигена (РВ-Tag) PB-SV40 экспрессируется специфически в эпителиальных клетках мышиной простаты. В результате, эта модель имеет несколько преимуществ в сравнении с существующими в настоящее время моделями: 1) мыши развивают прогрессирующие формы эпителиальной гиперплазии предстательной железы уже в возрасте 10 недель и инвазивную аденокарциному примерно в возрасте 18 недель; 2) метастатическое распространение картины рака предстательной железы имитирует рак предстательной железы человека, причем общими местами метастазов являются лимфатический узел,легкое, почка, надпочечник и кость; 3) развитие,а также прогрессирование рака предстательной железы может быть прослежено в пределах относительно короткого периода 10-30 недель; 4) опухоли возникают со 100% частотой и 5) животные могут быть подвергнуты скринингу на присутствие трансгена рака предстательной железы перед появлением клинического рака предстательной железы для прямой тестобработки (лечения) химиопрофилактическими агентами, которые могут изменять канцерогенез предстательной железы. Модель трансгенных мышей TRAMP является превосходной моделью in vivo для определения механизмов инициации и активации рака предстательной железы и для тестирования эффективности потенциальных химиопрофилактических агентов. Эти мыши прогрессирующим образом развивают эпителиальную гиперплазию предстательной железы, PIN, и затем рак предстательной железы в пределах короткого периода времени (17 недель). Химиопрофилактическую обработку гибридных мышей TRAMP начинают через 30 дней после рождения с использованием химиопрофилактических агентов при уровне приблизительно 0,5-50 мг/кг веса субъекта/день, предпочтительно приблизительно 6-30 мг/кг веса субъекта/день. Химиопрофилактические агенты удобным образом готовят в виде гранул с 21 дневным и 90-дневным высвобождением (приготовленных Innovative Research of America,Sarasota, FL) и доставляют в виде подкожных имплантатов. Контрольные животные получают имплантаты плацебо. В каждой группе обработки лекарственным средством животных умерщвляют при возрасте 5, 7, 10, 15, 20, 25, 30, 40 и 50 недель до развития прощупываемой (пальпируемой) опухоли. Берут кровь и объединяют по временным точкам обработки для оценки изменений в содержании тестостерона и эстрадиола 16 в сыворотке. Ткани предстательной железы берут для морфометрического, гистологического и молекулярного исследований. Используют следующие тест-процедуры: 1) Последовательно выполняют анализ тотального (полного) препарата предстательной железы для обнаружения изменений в морфологии протоков предстательной железы во времени с обработкой и без обработки; примеры показаны на фиг. 2. Срезы тканей оценивают гистологически при помощи стандартного окрашивания НЕ (гематоксилином и эозином) и Masson-thrichome. Появление PIN оценивают и располагают по степеням (I - умереннаяIII тяжелая). 2) Уровни эстрадиола и общего тестостерона в сыворотке измеряют радиоиммуноанализом (RIA) для каждого возрастного интервала для оценки любых изменений в этих гормонах под действием химиопрофилактических агентов. Пример 2. Анализ данных иммуногистохимии. Микроскопические изображения каждого среза ткани оценивают посредством компьютерной (компьютер и монитор Маc 9500-132) количественной обработки изображений (NIHImage 1.6 РРС) с использованием камеры KodakDCS 460 на микроскопе Nikon Microphot-FX и количественно оценивают с использованием анализа изображения с применением количественной системы с использованием красителей(IPLab Spectrum 3.1, Scanalytics, Inc., VA) , который отмечает различия в цвете окрашенных срезов тканей. Устанавливают пороги для идентификации различных тканевых компонентов предстательной железы. Площадь плотностей элементов изображения, соответствующую каждому из этих тканевых компонентов, рассчитывают для каждого полного экрана цветного монитора. В целом усредняют 5 экранов на один срез предстательной железы. Иммуногистохимические изображения могут быть преобразованы в цифровую форму и оценены количественно для статистической оценки путем определения коэффициентов корреляции и вероятности (по 2 параметрам распределения). Пример 3. Исследование химиопрофилактической активности. Это исследование было предпринято для испытания эффективности химиопрофилактических агентов в трансгенных животных TRAMP(PBTag X FVBwt) (предоставленных доктором Норманом, Greenberg, Baylor College of Medicine, TX). Эти мыши обнаружили предварительные симптомы рака уже в 10 недель. Самцов приплодов трансгенных мышей TRAMP подвергали скринингу на трансген большого Тантигена и позитивных самцов использовали в этом исследовании. Антиэстроген торемифен,который должен был испытываться на его возможные химиопрофилактические эффекты, 17 включали в продажные гранулы (Innovative Research, Sarasota, FL) и химиопрофилактическую обработку начинали постнатально в возрасте 30 дней (средний вес мыши 14 г). Четыре группы из 10-12 животных, каждая, получали подкожные имплантации гранул, содержащих торемифен, с 90-дневным высвобождением. Доза диффундируемого лекарственного средства, корректирующая с ростом в весе, была подобрана для доставки либо низкой дозы (6 мг/кг), либо высокой дозы (30 мг/кг) торемифена. Контрольные животные (n=10) получали плацебо. Эффективность обработки измеряли по отсутствию образования пальпируемой опухоли. Опухоли предстательной железы мышей собирали и оценивали молекулярными и гистологическими способами. С использованием трансгенной моделиTRAMP рака предстательной железы, в которой каждое животное, наследующее ген рака предстательной железы, развивает рак предстательной железы, было показано, что торемифен как увеличивает латентность, так и уменьшает частоту заболеваемости раком предстательной железы. Как показано на фиг. 1, действия низкой и высокой дозы торемифена были эффективными. Образование опухоли в вентральной предстательной железе мышей TRAMP отмечали в возраст 17 недель для группы плацебо (n=10), в 19 недель для группы, обработанной высокой дозой торемифена (n=12), и в 28 недель для группы, обработанной низкой дозой торемифена(n=12). Таким образом, 5 обработок торемифеном, по существу, увеличивали латентный период на период до 11 недель развития рака в вентральной предстательной железе мышейTRAMP. Поскольку обработанные торемифеном животные не достигают точки 50% развития опухоли во время периода этого исследования,сравнивали время между группами, при котором 25% животных имели опухоли. Опухоли были пальпируемыми у 25% из 10 животных в 23 недели в группе плацебо и в 30-31 неделю в группах с высокой и низкой дозами торемифена, с задержкой 7-8 недель. Результаты как низкой дозы, так и высокой дозы торемифена в сравнении с плацебо были значимыми согласно статистическому log-ранговому анализу и статистическому анализу по Уилкоксону, как показано в табл. 1 ниже. Таблица 1 Статистический анализP Низкая доза торемифена 0,0003 0,0004 в сравнении с плацебо Высокая доза торемифена 0,0017 0,0071 в сравнении с плацебоЗначимость Р 0,05 18 В 33 недели, точке, когда все контрольные животные развили опухоли, 72% животных,обработанных низкой дозой торемифена, и 60% животных, обработанных высокой дозой торемифена, все еще не имели опухолей. Таким образом, обработка как низкой, так и высокой дозой торемифена приводила к существенно пониженной частоте возникновения опухолей в вентральной предстательной железе мышейTRAMP. Эти результаты, полученные в соответствии с данным изобретением, не могли бы быть предсказаны на основании результатов, сообщенных в вышеупомянутой статье Lucia et аl.,которая описывает введение двух доз тамоксифена, близкого структурного аналога торемифена, крысам Lobund-Wistar, имеющим карциномы предстательной железы, индуцированные обработкой комбинацией инициатора и активатора. В этой ссылке Lucia et al. сообщается, что только 22-26% животных, получающих более низкую дозу, и только 32-50% животных, получающих более высокую дозу тамоксифена, не имели опухоли в передней предстательной железе. Следует отметить, что передняя предстательная железа грызуна, в противоположность его вентральной предстательной железе, не имеет соответствующего сегмента в предстательной железе субъекта-человека. В статье Lucia et al. дополнительно утверждается, что комбинация инициатор-активатор,используемая в описанных процедурах, хотя и эффективная в индуцировании рака в передней предстательной железе испытуемых животных,не могла индуцировать карциномы в вентральной предстательной железе. Таким образом, нет основания для того, чтобы ожидать химиопрофилактическое действие на опухолях в вентральной предстательной железе при введении тамоксифена крысам Lobund-Wistar или людям. Как уже обсуждалось, введение торемифена производит значимое химиопрофилактическое действие против опухолей в вентральной предстательной железе мышей TRAMP. Этот результат является обнадеживающим в отношении благоприятного действия на человека,предстательная железа которого действительно содержит сегмент, соответствующий вентральной предстательной железе грызунов. Пример 4. Гистологическое исследование ткани предстательной железы. Опухоли из групп, обработанных плацебо и высокой дозой торемифена, взятые в момент пальпирования, оценивали гистологически. Фиг. 2 А представляет собой НЕ-срез вентральной предстательной железы здоровой мыши в возрасте 17 недель. Фиг. 2 В, срез вентральной предстательной железы мыши в возрасте 16 недель, обработанной плацебо, показывает, что, в противоположность структуре здоровой предстательной железы, изображенной на фиг. 2 А,вентральная предстательная железа мышиTRAMP характеризуется слоями недифференцированных анапластических клеток с высоким митотическим индексом. В противоположность этому, как показано на фиг. 2 С, предстательная железа мышей TRAMP в возрасте 30 недель,обработанных торемифеном, сохраняет большую часть архитектуры здоровой железы и имеет опухоли с более дифференцированной структурой, причем митотический индекс является гораздо более низким, чем митотический индекс для обработаннного плацебо животного. Эти результаты показывают, что торемифен,даже в низкой дозе, способен подавлять канцерогенез предстательной железы в моделиTRAMP. Пример 5. Использование химиопрофилактической эффективности торемифена против рака предстательной железы в модели мышейTRAMP. Этот эксперимент подтверждает и демонстрирует химиопрофилактическую эффективность торемифена. Данное исследование фокусируется на гистологических и молекулярных изменениях, связанных с развитием опухоли предстательной железы в контрольных животных, и механизме химиопрофилактического действия торемифена с животными TRAMP,которых размножали, подвергали скринингу и обрабатывали лекарственными гранулами пролонгированного действия. В определенных временных точках группы из 5 животных умерщвляли и их предстательные железы извлекали для анализа. Предстательные железы оценивали на присутствие опухоли при помощи гистологии,диссекций тотального препарата и иммуногистохимии большого Т-антигена. К настоящему времени были выполнены обработки плацебо и торемифеном для 7-, 10-, 15- и 20-недельных временных точек и эти результаты описаны ниже. Результаты. Готовили полные препараты предстательной железы для 7, 10, 15 и 20 недель для различных групп. Анализ этих препаратов выявил,что обработанные плацебо мыши развивали опухоли предстательной железы в возрасте 1520 недель, так же, как в предварительном поисковом исследовании. Кроме того, обработанные торемифеном животные имели задержку в появлении рака предстательной железы до 20 недель(фиг. 3). В 20 недель имеется поразительная задержка в появлении опухоли в обработанной торемифеном группе до 35 недель (фиг. 4). Эти данные подтверждают, что даже с более чувствительной оценкой онкогенности торемифен проявлял химиопрофилактическую активность. Для гистологической оценки пробы ткани фиксировали, обрабатывали и заливали в парафин. Делали срезы (толщиной 5 пм) и окрашивали их рутинным НЕ-способом (гематоксилином и эозином). Торемифен ингибировал развитие протоков и дифференцировку тканей (сравните 20 а) опухоль предстательной железы мышейTRAMP в возрасте 17 недель в сравнении с диким типом (фиг. 4); b) гистологию обработанной торемифеном предстательной железы в сравнении с плацебо при 15 неделях (фиг. 5. Количественно, иммуногистохимия обработанных плацебо и торемифеном тканей обнаружила присутствие Т-антигена в вентральной предстательной железе. Таким образом, химиопрофилактическая активность, наблюдаемая с торемифеном, по-видимому, не объясняется подавлением пробазинового активатора в моделиTRAMP. Выводы. Способность торемифена предупреждать появление рака предстательной железы в модели TRAMP была подтверждена с использованием более чувствительных способов оценки опухолеобразования. По-видимому, механизм химиопрофилактических действий торемифена не связан с потерей трансгена для белка большого Т-антигена. Пример 6. Торемифен индуцирует регресс установленных опухолей предстательной железы человека в модели голой мыши. Рак предстательной железы остается в настоящее время наиболее обычно диагностируемым раком у мужчин Америки. Однако остаются вопросы относительно этиологии и лечения этого заболевания, особенно в его запущенных формах. Гормональная терапия остается стандартным способом лечения рецидивирующего и запущенного рака предстательной железы несмотря на обычное развитие гормонрезистентного заболевания. Таким образом, необходимы новые подходы к профилактике и лечению рака предстательной железы для обеспечения лечением увеличивающегося числа мужчин, диагностированных как имеющих это заболевание. Приведенные ниже эксперименты и результаты демонстрируют, что торемифен подавляет чувствительный к гормонам рост опухоли LNCaP в бестимусной голой мыши. Материалы и способы. Один миллион клеток LNCaP в Матригеле инъецировали подкожно в каждый бок бестимусной голой мыши. Всего были инъецированы 40 мышей. После приблизительно 3-4 недель развивались видимые опухоли. После регистрации размера опухолей в двух измерениях мышей делили на группы плацебо и обработки (лечения) на основе равноценной опухолевой нагрузки. Одну гранулу (плацебо или торемифен 35 мг) имплантировали подкожно между лопатками каждой мыши. Регистрировали еженедельные измерения размера опухоли. Рассчитывали объем опухоли (объем опухоли= 0,5(L+W)xLхWх 0,5236, где L=длина опухоли иW=ширина опухоли). Объем опухоли во время имплантации гранулы служил точкой отсчета для последующего сравнения изменения размера опухоли. Еженедельные изменения объема опухоли регистрировали в виде процентного 21 приращения от исходного измерения при имплантации гранулы. Результаты. Две мыши умерли вскоре после имплантации из-за летальных ран, нанесенных другими мышами. Одна мышь, обработанная торемифеном, была исключена из исследования из-за избыточного кровотечения опухоли и развития гематомы. Все мыши развили видимые опухоли на одной стороне или на двух сторонах тела. Каждую опухоль прослеживали независимо на протяжении исследования. 24 опухоли обрабатывали плацебо и 28 опухолей обрабатывали торемифеном. Результаты показаны в табл. 2 и на фиг. 6 А и 6 В. Таблица 2 Группа плацебо% изменение в объеме отноНеделя Число сительно дня 0 обработки 3 11 9,44 4 8 115,27 5 8 271,71 6 8 600,88% изменение в объеме отноЧисло сительно дня 0 обработки 11 Эксперимент продолжается и интервал будет продлен. В настоящее время собираются данные на дополнительных животных. Выводы. Торемифен ингибирует развитие опухолей LNCaP и индуцирует регресс установленных опухолей LNCaP. Хотя механизм, посредством которого торемифен проявляет это действие, является неизвестным, способность производить эти эффекты подтверждает пользу применения торемифена для лечения рака предстательной железы и для предупреждения рецидива рака предстательной железы у пациентов с высоким риском с установленными микрометастазами рака предстательной железы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ предупреждения канцерогенеза предстательной железы, предусматривающий введение субъекту-млекопитающему фармацевтического препарата, содержащего химиопрофилактический агент, имеющий формулу где R1 и R2 могут быть одинаковыми или различными, обозначают Н или ОН, R3 обозначаетOCH2CH2NR4R5, где R4 и R5, которые могут быть одинаковыми или различными и обозначают Н или алкильную группу из 1-4 атомов углерода; и его фармацевтически приемлемые соли,сложные эфиры или N-оксиды и их смеси. 2. Способ по п.1, где вышеупомянутый фармацевтический препарат дополнительно содержит фармацевтически приемлемый носитель. 3. Способ по п.2, где вышеупомянутый носитель выбран из группы, состоящей из камеди,крахмала, сахара, целлюлозного материала и их смесей. 4. Способ по п.1, где вышеупомянутое введение предусматривает подкожную имплантацию указанному субъекту гранулы, содержащей вышеупомянутый фармацевтический препарат. 5. Способ по п.4, где вышеупомянутая гранула обеспечивает регулируемое высвобождение вышеупомянутого фармацевтического препарата на протяжении некоторого периода времени. 6. Способ по п.1, где вышеупомянутое введение предусматривает внутривенную, внутриартериальную или внутримышечную инъекцию в указанного субъекта вышеупомянутого фармацевтического препарата в жидкой форме. 7. Способ по п.1, где вышеупомянутое введение предусматривает пероральное введение указанному субъекту жидкого или твердого препарата, содержащего вышеупомянутый фармацевтический препарат. 8. Способ по п.1, где вышеупомянутое введение предусматривает локальное нанесение на поверхность кожи указанного субъекта вышеупомянутого фармацевтического препарата. 9. Способ по п.1, где вышеупомянутый фармацевтический препарат выбран из группы,состоящей из гранулы, таблетки, капсулы, раствора, суспензии, эмульсии, эликсира, геля,крема и суппозитория. 10. Способ по п.9, где вышеупомянутый суппозиторий является ректальным суппозиторием или уретральным суппозиторием. 11. Способ по п.1, где вышеупомянутый фармацевтический препарат является парентеральной композицией. 12. Способ по п.11, где вышеупомянутая парентеральная композиция содержит липосому, содержащую комплекс вышеупомянутого химиопрофилактического агента и соединения циклодекстрина. 13. Способ по п.1, где вышеупомянутый химиопрофилактический агент содержит торемифен, его N-оксид, фармацевтически приемлемые соли и их смеси. 14. Способ по п.1, где вышеупомянутое введение проводят в дозе, примерно, 0,5-50 мг/кг веса субъекта/день вышеупомянутого химиопрофилактического агента. 23 15. Способ по п.14, где вышеупомянутое введение проводят в дозе, примерно, 6-30 мг/кг веса субъекта/день вышеупомянутого химиопрофилактического агента. 16. Способ по п.1, где вышеупомянутый субъект имеет повышенный риск развития рака предстательной железы. 17. Способ по п.16, где вышеупомянутый субъект имеет доброкачественную гиперплазию предстательной железы, внутриэпителиальную неоплазию предстательной железы (PIN) или отклоняющийся от нормы высокий уровень циркулирующего в кровотоке специфического для предстательной железы антитела (PSA). 18. Способ предупреждения рецидива, подавления или ингибирования канцерогенеза предстательной железы или увеличения коэффициента выживания субъекта, имеющего рак предстательной железы, предусматривающий введение субъекту-млекопитающему фармацевтического препарата, содержащего химиопрофилактический агент, имеющий формулу где R1 и R2 могут быть одинаковыми или различными, обозначают Н или ОН, R3 обозначает ОСН 2 СН 2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают Н или алкильную группу из 1-4 атомов углерода; и его фармацевтически приемлемые соли,сложные эфиры или N-оксиды и их смеси. 19. Применение соединения общей формулы (I) где R1 и R2 могут быть одинаковыми или различными, обозначают Н или ОН, R3 обозначаетOCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают Н или алкильную группу из 1-4 атомов углерода; и его фармацевтически приемлемых солей,сложных эфиров или N-оксидов и их смесей в производстве фармацевтической композиции для использования в способе подавления или ингибирования предраковых предшественников аденокарциномы предстательной железы. 20. Применение по п.19, где предраковый предшественник или аденокарцинома предстательной железы представляет собой внутриэпителиальную неоплазию предстательной железы(PIN). 21. Применение по п.20, где внутриэпителиальная неоплазия предстательной железы 24 представляет собой тяжелую внутриэпителиальную неоплазию предстательной железы(HPIN). 22. Применение соединения общей формулы (I) где R1 и R2 могут быть одинаковыми или различными, обозначают Н или ОН, R3 обозначаетOCH2CH2NR4R5, где R4 и R5 могут быть одинаковыми или различными, обозначают Н или алкильную группу из 1-4 атомов углерода; и его фармацевтически приемлемых солей,сложных эфиров или N-оксидов и их смесей в производстве фармацевтической композиции для использования в способе лечения или ингибирования предраковых предшественников аденокарциномы предстательной железы. 23. Применение по п.22, где предраковый предшественник или аденокарцинома предстательной железы представляет собой внутриэпителиальную неоплазию предстательной железы(PIN). 24. Применение по п.22, где внутриэпителиальная неоплазия предстательной железы представляет собой тяжелую внутриэпителиальную неоплазию предстательной железы
МПК / Метки
МПК: A61P 13/08, A61K 31/135
Метки: рака, железы, химиопрофилактики, способ, предстательной
Код ссылки
<a href="https://eas.patents.su/14-3466-sposob-himioprofilaktiki-raka-predstatelnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ химиопрофилактики рака предстательной железы</a>
Предыдущий патент: Образующие пузырьки моющие композиции на водной основе, содержащие поверхностно-активные вещества, способ их получения и применение
Следующий патент: Водный глифозатный концентрат и способ повреждения или уничтожения нежелательных растений
Случайный патент: Чистящий блок, самоклеящийся на твердые поверхности












