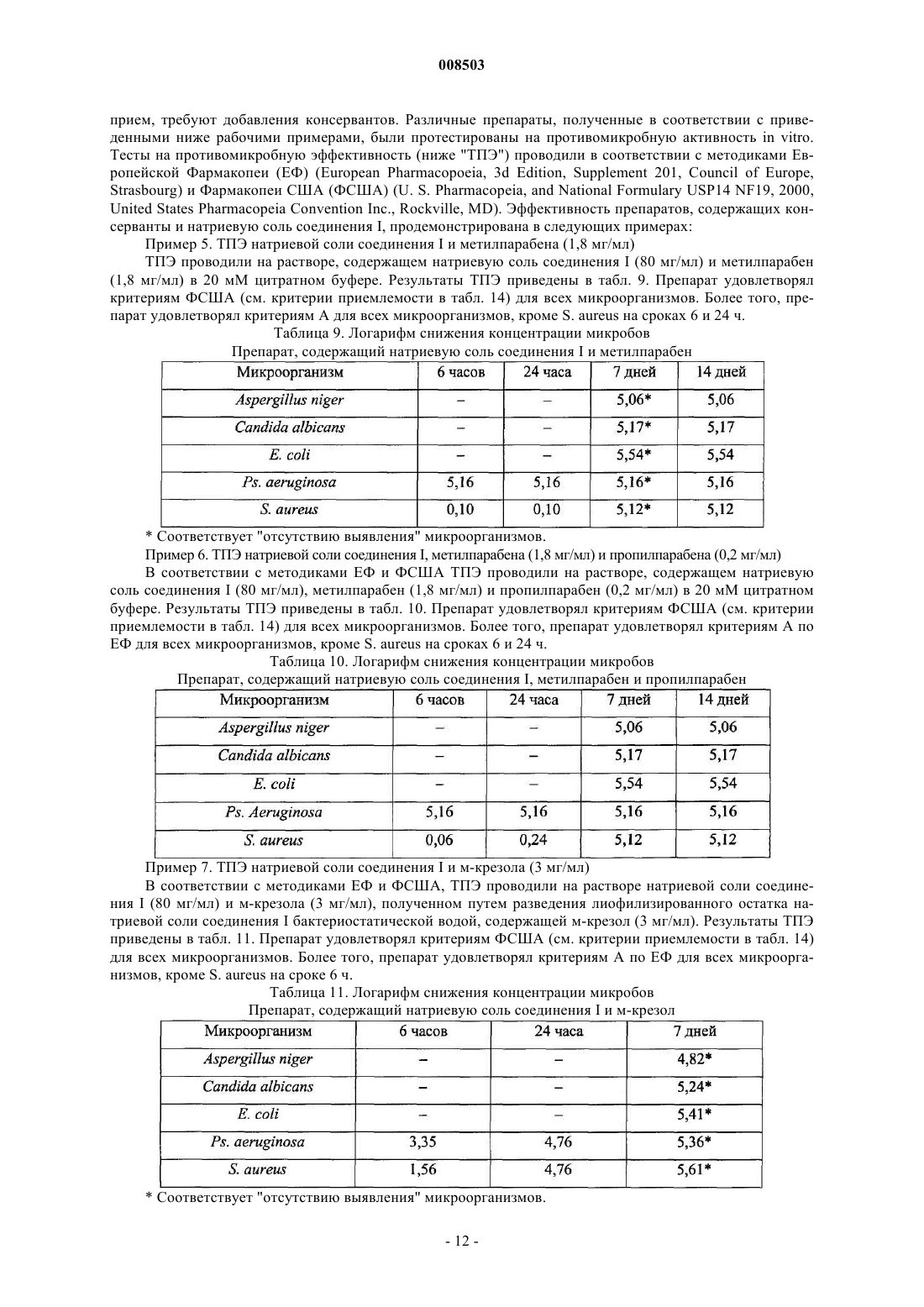
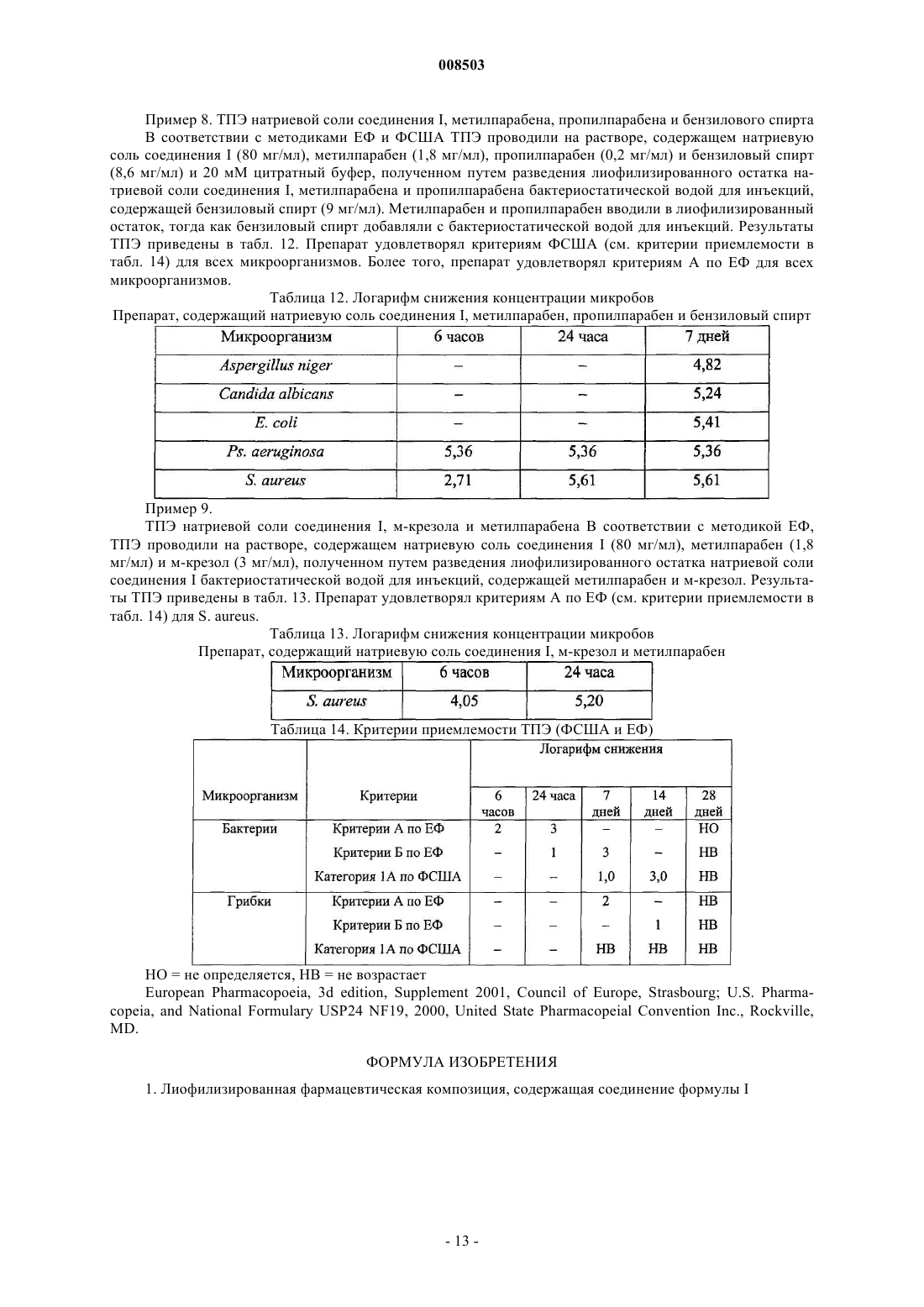
Препараты, содержащие цефалоспориновое соединение, и их применение в лечении бактериальных инфекций у кошек и собак
Номер патента: 8503
Опубликовано: 29.06.2007
Авторы: Бронк Брайан Скотт, Шалаев Евгений Юрьевич, Редди Ренука Деви, Бланчфлауэр Саймон Эдвард, Кимболл Роджер Нельсон
Формула / Реферат
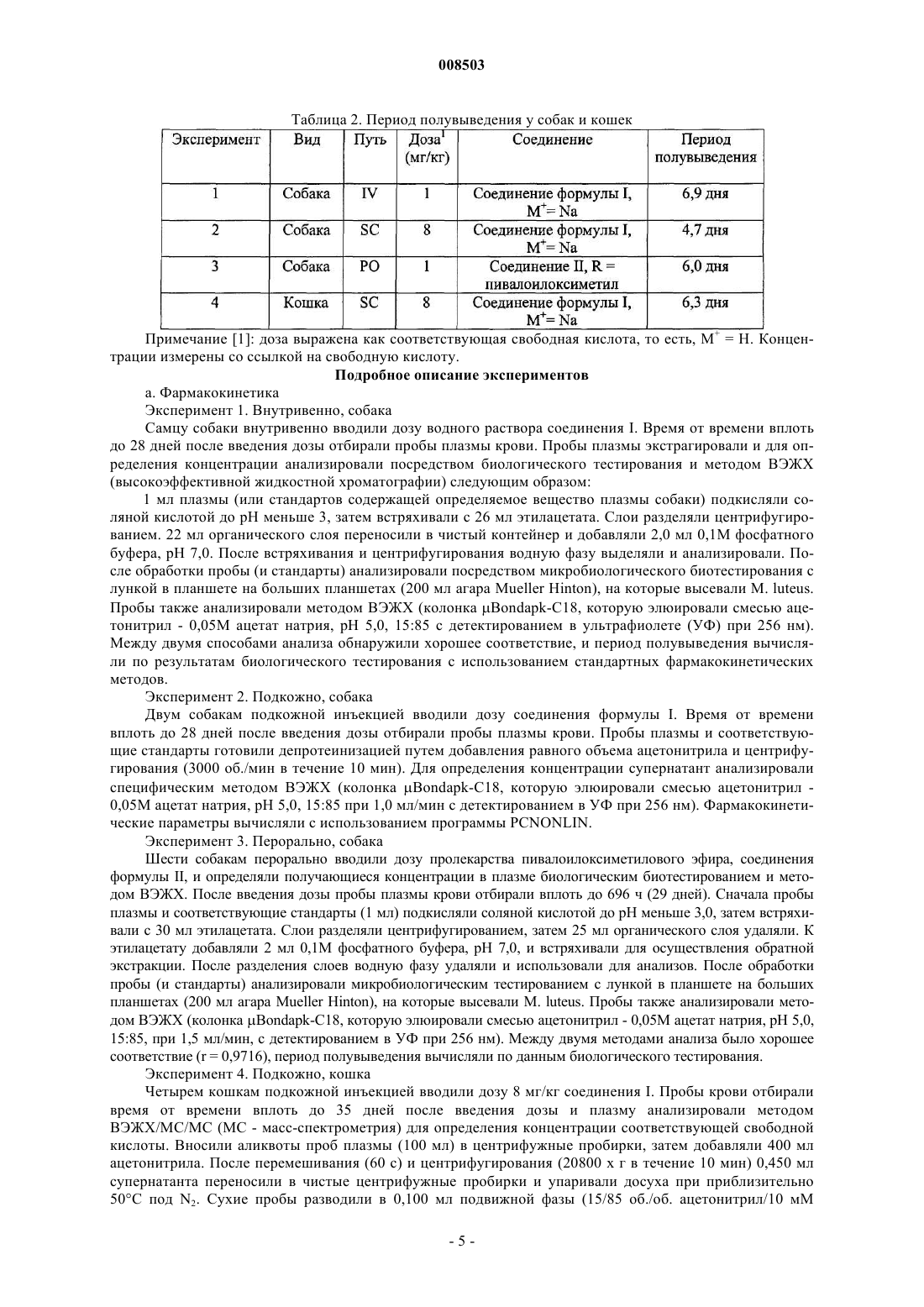
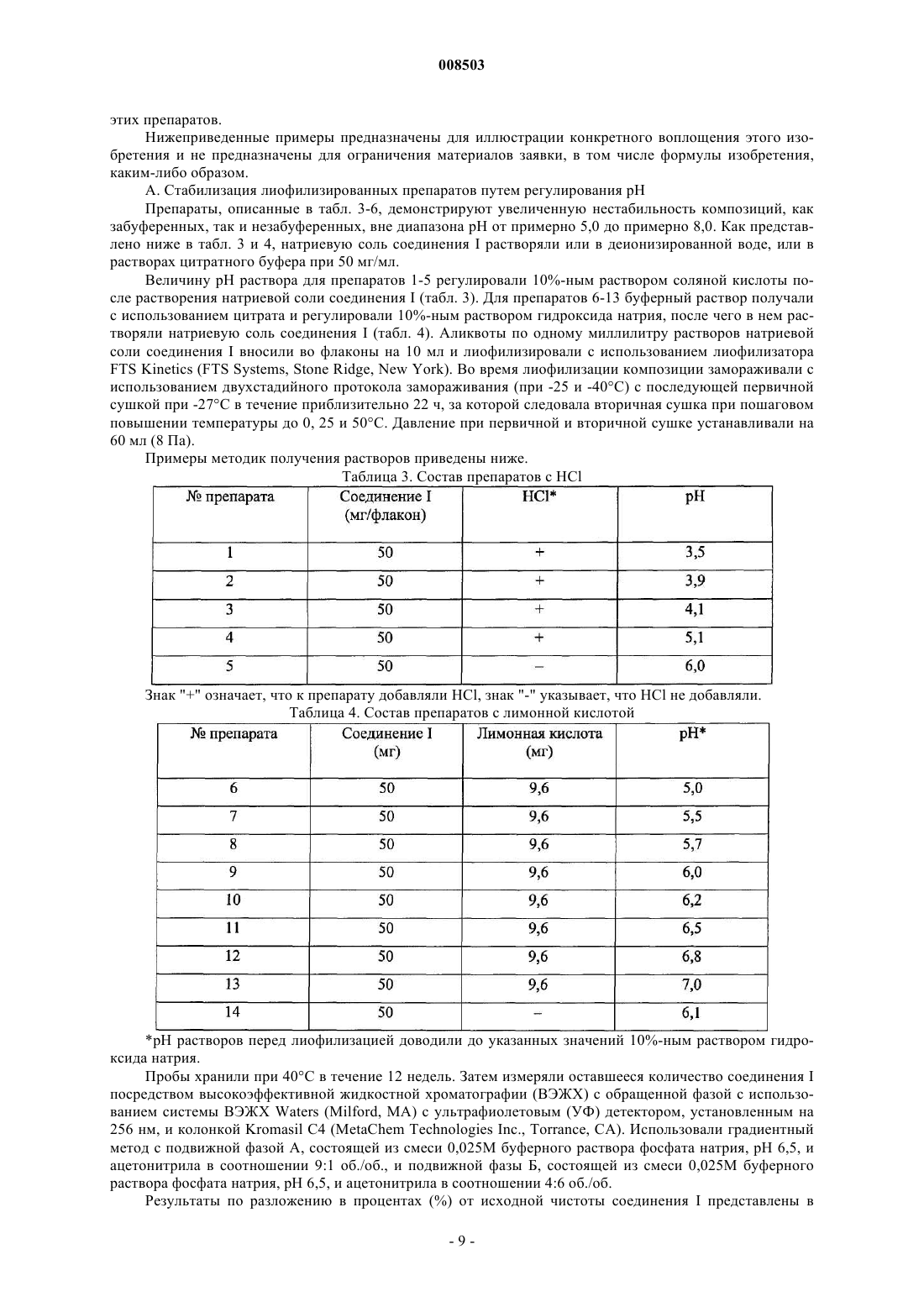
1. Лиофилизированная фармацевтическая композиция, содержащая соединение формулы I

где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5.
2. Фармацевтическая композиция по п.1, где М+ представляет собой Na+.
3. Фармацевтическая композиция по п.1 или 2, где соединение формулы I представляет собой аморфную мононатриевую соль (6R,7R)-7-[[(2Z)-(2-амино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-3-[(2S)-тетрагидро-2-фуранил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты.
4. Фармацевтическая композиция по любому из пп.1-3, где буфер представляет собой цитрат.
5. Фармацевтическая композиция по любому из пп.1-4, дополнительно содержащая фармацевтически приемлемый наполнитель.
6. Фармацевтическая композиция по п.5, где наполнитель выбран из сахаров, полиспиртов, аминокислот, полимеров, полисахаридов или неорганических солей.
7. Фармацевтическая композиция по п.6, где сахара выбраны из глюкозы, мальтозы, сахарозы или лактозы, полиспиртами являются сорбит или маннит, аминокислотой является глицин, полимером является поливинилпирролидон, полисахаридом является декстран, и неорганическими солями являются фосфаты натрия или калия или хлорид натрия.
8. Фармацевтическая композиция по любому из пп.1-7, где фармацевтически приемлемый консервант представляет собой комбинацию метил- и пропилпарабенов.
9. Набор, содержащий:
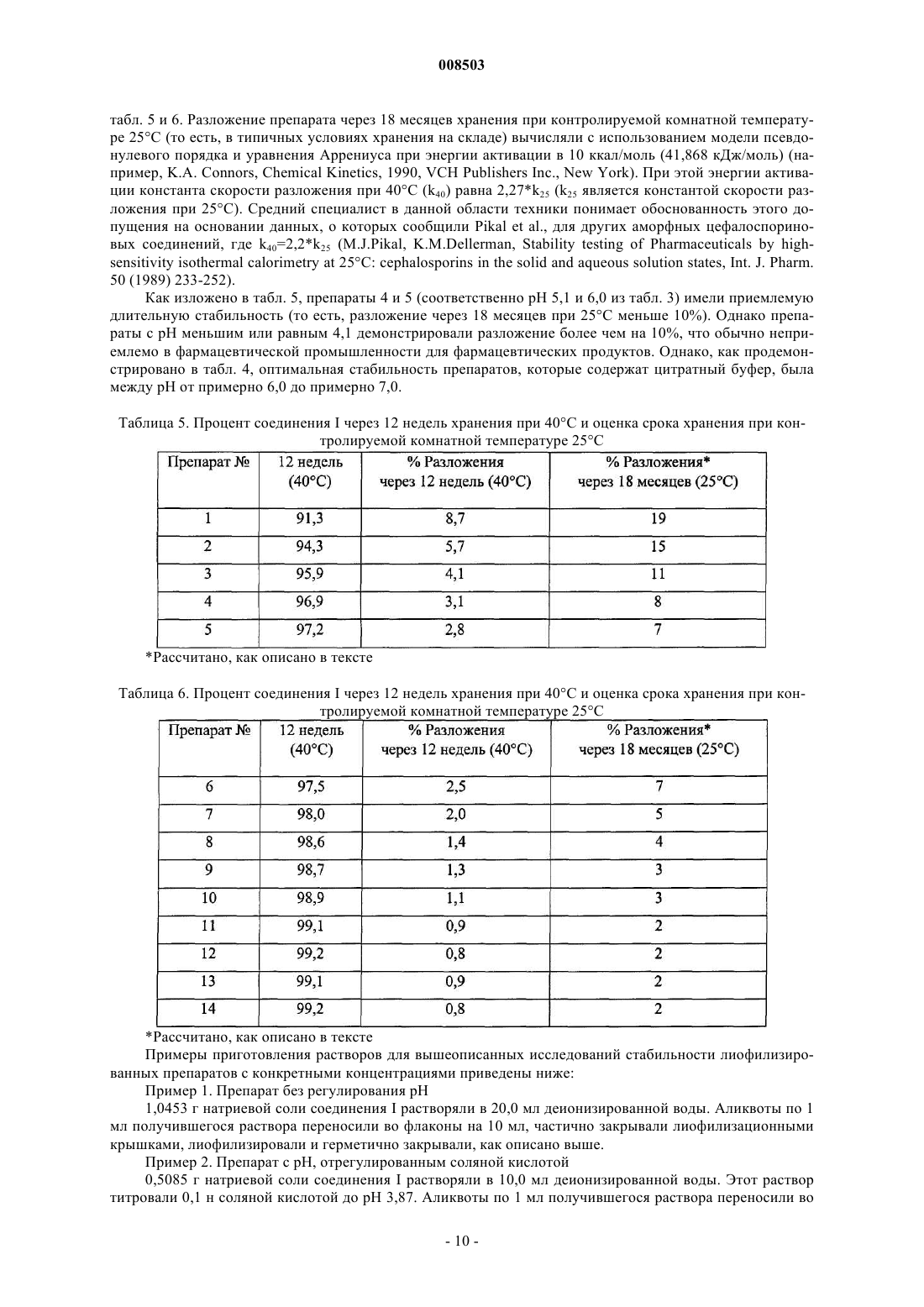
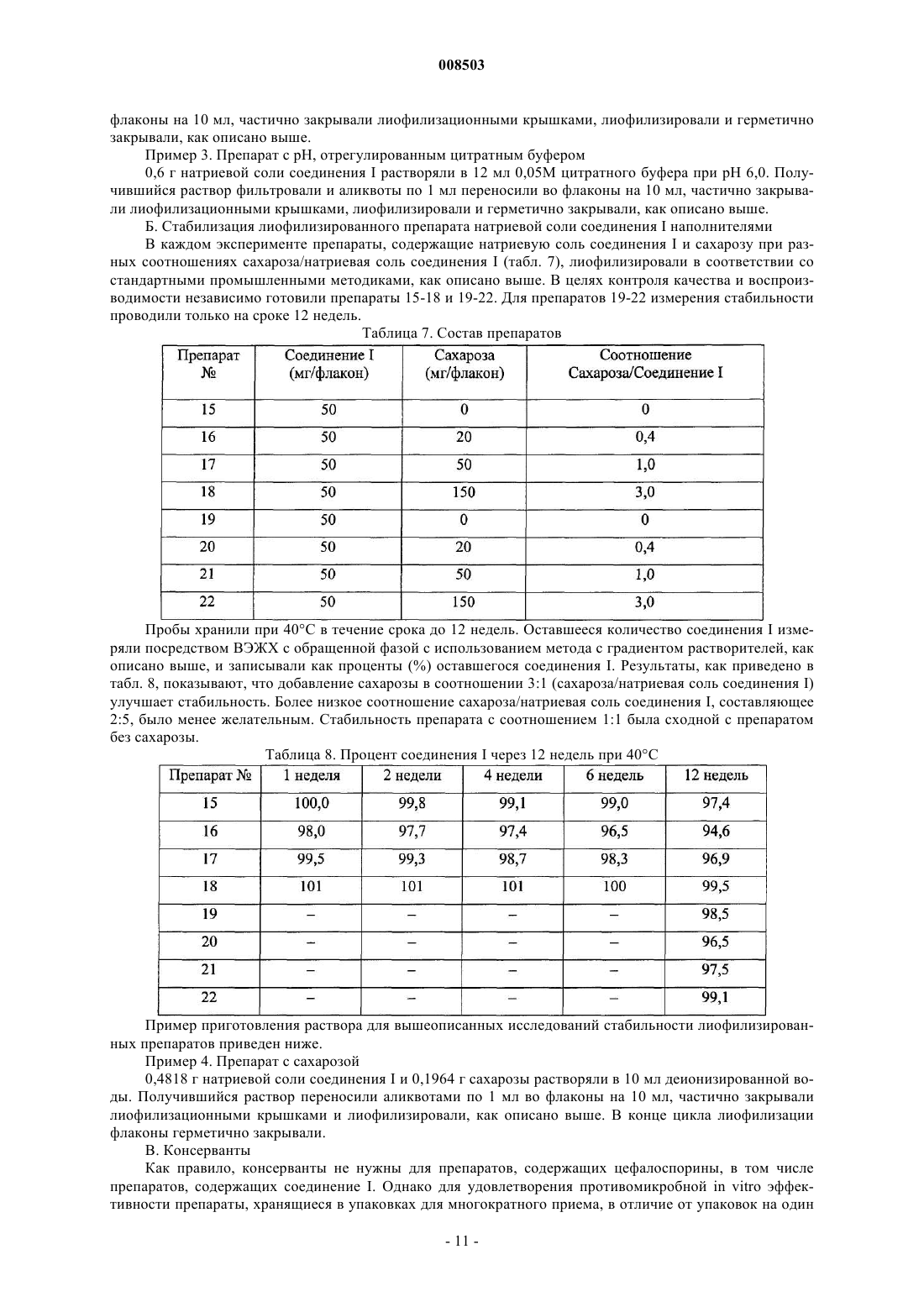
а) терапевтически эффективное количество лиофилизированной фармацевтической композиции, содержащей соединение формулы I
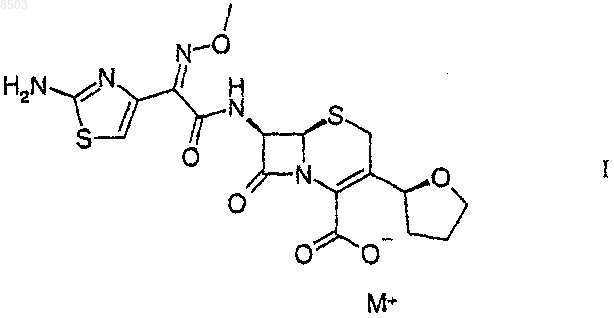
где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5;
б) водный фармацевтически приемлемый разбавитель и
в) первый и второй контейнер для вмещения композиции (а) и разбавителя (б), причем первый контейнер выполнен с возможностью получения разбавителя из второго контейнера.
10. Набор по п.9, где М+ представляет собой Na+.
11. Способ лечения или предотвращения состояния, вызванного бактериальной инфекцией у собак и кошек, при котором собаке или кошке вводят терапевтически эффективное количество фармацевтической композиции по пп.1-8.
12. Способ по п.11, где состояние представляет собой бактериальную инфекцию кожи, мягких тканей или мочевыводящих путей.
13. Способ по п.11 или 12, где состояние или инфекция вызваны или осложнены грамположительными или грамотрицательными бактериями.
Текст
008503 Данное изобретение относится к стабильным лиофилизированным препаратам, содержащим антибактериальную соль щелочного металла и цефалоспоринового соединения, соединение I, где М+ представляет собой катион, Na+, K+ или Li+ (ниже "соединение I"). В частности, это изобретение относится к стабильным лиофилизированным препаратам соединения I, где М+ представляет собой Na+, мононатриевой соли (6R,7R)-7-(2Z)-(2-aмино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-3-[(2S)-тетрагидро 2-фуранил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты. Это изобретение также относится к водным препаратам соединения I. Это изобретение также направлено на способы лечения бактериальных инфекций у собак и кошек путем введения соединения формулы I. Предшествующий уровень техники Цефалоспорины являются широко используемыми и терапевтически важными антибиотиками. Соединения формулы I являются цефалоспориновыми антибактериальными средствами широкого спектра действия и поэтому полезны в лечении бактериальных инфекций у животных (US 6020329, колонка 1,стр. 13-14). В частности, соединение I предназначено для собак и кошек, имеющих показания к лечению бактериальных инфекций кожи, мягких тканей, периодонта и мочевыводящих путей. Соединение I, где М представляет собой Na+, и его получение раскрыты в патентах США 6001997, 6020329 и 6077952. Текст указанных патентов и все ссылки, цитированные в этом описании,включены в данное описание посредством ссылки. Однако препараты цефалоспоринов обычно нестабильны, и существует множество различных способов увеличения стабильности, включающих в себя, среди прочего, регулирование рН, кристаллизацию,лиофилизацию и добавление стабилизаторов, таких как сахара. Цефалоспорины могут быть до некоторой степени стабилизированы в определенном диапазоне рН. Оптимальный диапазон рН колеблется в широких пределах и непредсказуем для разных классов цефалоспоринов, что требует экспериментирования и проверок стабильности. Например, Nassar et al., патент США 5401842, раскрывают препараты кристаллической соли цефепима, забуференной ортофосфатом натрия, бикарбонатом натрия, цитратом натрия, N-метилглюкамином и L(+)-аргинином до рН от 3,5 до 7,0.K.А. Conners et al. раскрывают, что цефалотин имеет широкий диапазон стабильности от рН между 2 и 8. Однако цефарадин (cepharadine) стабилизируется при более кислых рН от 1 до 5. Стабильности цефотаксима достигают в диапазоне рН от 3 до 7 (K.А. Connors et al., Chemical Stability of Pharmaceuticals, John WileySons, New York, 1986, p. 305). В некоторых случаях препараты цефалоспоринов стабилизировали кристаллизацией и лиофилизацией. Например, Gotschi, патент США 5138066, описывает препараты для парентерального введения как лиофилизаты или сухие порошки для разведения фармацевтическими носителями, такими как вода или изотонический раствор.Bornstein et al., патент США 4002748, раскрывает способы получения, по существу, аморфного цефазолина путем использования определенных методик лиофилизации, тогда как Daugherty, ЕР 0327364, описывает способ лиофилизации для получения препаратов кристаллического сольвата 1 карбацефалоспорина. Некоторые цефалоспорины можно стабилизировать путем добавления множества различных сахаров. Однако невозможно предсказать, будет ли определенный сахар стабилизировать определенный цефалоспорин. Более того, соотношение сахара и цефалоспорина для достижения оптимальной стабильности также непредсказуемо. Например, Shamblin et al. раскрывают, что стабильность аморфной натриевой соли цефокситина можно увеличить в два раза путем совместной лиофилизации с сахарозой. Однако на стабильность цефокситина не влияла совместная лиофилизация с трегалозой. S.L. Shamblin, B.C. Hancock, M.J. Pikal, The Chemical Stability of Amorphous Cefoxitin Sodium in the Presence of Glassy Stabilizers,AAPS Pharm. Sci. Vol. I, Issue 4, 1999. Аналогично, Shima et al., ЕР 0134568 В 1, раскрывают, что сахар (глюкоза, фруктоза или мальтоза) или соль щелочного металла и минеральной кислоты или карбоновой кислоты стабилизировали конкретный лиофилизированный цефалоспорин при массовом соотношении стабилизатор/цефалоспорин от 0,01:1 до 0,5:1. Однако маннит не был эффективен в отношении стабилизации раскрытого цефалоспори-1 008503 нового соединения. Также, Almarsson et al., Tetrahedron 56 (2000) 6877-6885 раскрывают, что сахароза увеличивает химическую стабильность бета-лактамного соединения при соотношении сахароза/лекарственное средство от 0,1:1 до 0,5:1.Yoshioka, Y. et al., Pharm. Res. 17 (2000), 925-929, описывают стабильность цефалотина в присутствии декстрана при соотношении декстран/цефалотин, составляющем 200:1. Напротив, Hirai et al., патент США 4418058, раскрывают, что избыточное количество, больше 1:1, множества различных сахаров или сахарных спиртов оказывало неблагоприятное воздействие на химическую стабильность цефалоспоринов. Однако хорошие результаты по стабилизации были получены, когда количество добавленного сахара или сахарного спирта составило 0,1 к 1 сахар/цефалоспорин. Следовательно, средний специалист в данной области техники в целом не сможет предсказать, приведет ли к стабильности добавление конкретного сахара к какому-либо конкретному цефалоспорину. Более того, оптимальное соотношение сахар:цефалоспорин также сильно варьирует и непредсказуемо в отсутствие экспериментирования. Более того, как обсуждалось выше, оптимальный диапазон рН для стабильности конкретного цефалоспорина также непредсказуем. Способом введения соединения I является парентеральное введение. Другие пути введения включают в себя пероральное и местное введение. US 6020329, колонка 15, стр. 1-2: соединение I нестабильно как в виде твердого вещества, так и в виде водного раствора. Более того, соединение I гигроскопично. Следовательно, препарат и способ стабилизации соединения I будет полезным дополнением к уровню техники. Краткое изложение сущности изобретения Согласно первому аспекту этого изобретения предложена лиофилизированная фармацевтическая композиция, содержащая соединение формулы I где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5. В предпочтительном воплощении М+ представляет собой Na+. В предпочтительном воплощении соединение формулы I представляет собой аморфную мононатриевую соль(6R,7R)-7-(2Z)-(2-амино-4-тиазолил)-(метоксиимино)ацетил]амино]-8-оксо-3-[(2S)тетрагидро-2-фуранил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты. В предпочтительном воплощении буфер представляет собой цитрат. В предпочтительном воплощении эта фармацевтическая композиция дополнительно содержит фармацевтически приемлемый наполнитель. В более предпочтительном воплощении этот наполнитель выбран из сахаров, полиспиртов, аминокислот, полимеров, полисахаридов или неорганических солей. В предпочтительном воплощении эти сахара выбраны из глюкозы, мальтозы, сахарозы или лактозы,полиспиртами являются сорбит или маннит, аминокислотой является глицин, полимером является поливинилпирролидон, полисахаридом является декстран, и неорганическими солями являются фосфаты натрия или калия или хлорид натрия. В более предпочтительном воплощении фармацевтически приемлемым консервантом является комбинация метил- и пропилпарабенов. Согласно еще одному аспекту это изобретение направлено на набор, содержащий: а) терапевтически эффективное количество лиофилизированной фармацевтической композиции,содержащей соединение формулы I где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5; б) водный фармацевтически приемлемый разбавитель и в) первый и второй контейнер для вмещения композиции (а) и разбавителя (б), причем первый контейнер выполнен с возможностью получения разбавителя из второго контейнера. В предпочтительном воплощении М+ представляет собой Na+. Согласно еще одному аспекту это изобретение направлено на способ лечения или предотвращения состояния, вызванного бактериальной инфекцией, у собак и кошек, при котором собаке или кошке вводят терапевтически эффективное количество фармацевтической композиции, описанной выше. Согласно одному воплощению этим состоянием является бактериальная инфекция кожи, мягких тканей или мочевыводящих путей. Согласно еще одному воплощению это состояние или эту инфекцию вызывают или осложняют грамположительные или грамотрицательные бактерии. Термин "водный фармацевтически приемлемый разбавитель" означает воду или другие фармацевтически приемлемые водные растворы, содержащие один или более чем один фармацевтически приемлемый эксципиент для использования в приготовлении композиций по этому изобретению (например,изотонический раствор хлорида натрия, вода для инъекций с этанолом или фосфатным, ацетатным или цитратным буфером и вода для инъекций с бензиловым спиртом). Термин "Na+" при использовании здесь определен как катион натрия. Термин "K+" при использовании здесь определен как катион калия. Термин "Li+" при использовании здесь определен как катион лития. Термин "соединение I" ограничен фармацевтически приемлемыми солями щелочных металлов и соединения I, где М+ представляет собой Na+, K+ или Li+, и, в частности, включает в себя соединение I(мононатриевую соль (6R,7R)-7-(2Z)-(2-амино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-3[(25)-тетрагидро-2-фуранил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты), где М+ представляет собой Na+. Термин "лиофилизация" означает процесс сушки сублимацией композиции, как это известно в данной области техники. "Лиофилизированный" или "высушенный сублимацией" используются здесь как синонимы. Термины "фармацевтический" и "фармацевтически" и тому подобные предназначены для обозначения применений в областях, имеющих отношение как к людям, так и животным. Подробное описание изобретения Соединение I представляет собой цефалоспориновое антибактериальное средство широкого спектра действия, предназначенное для млекопитающих, в частности, собак и кошек. Получение соединения I,где М+ представляет собой Na+ (ниже "натриевая соль"), описано в патентах США 6001997, 6020329,6077952, а также в ЕР 1178049 А 1, которые включены сюда посредством ссылки. Соли К+ и Li+ с соединением I могут быть получены средним специалистом в данной области техники, как описано в получении натриевой соли соединения I, но с замещением на надлежащую соль К+ или Li+. Антибиотические соединения по настоящему изобретению активны в отношении широкого диапазона микроорганизмов, в том числе грамотрицательных микроорганизмов (например, Е. coli) и грамположительных организмов (например, S. aureus) (US 6020329, колонка 17, стр. 28-31). Соединение I можно использовать для лечения, среди прочего, бактериальных инфекций кожи, мягкой ткани и мочевыводящих путей. Например, состояниями или инфекциями, вызванными или осложненными грамположительными и/или грамотрицательными бактериями, являются пневмония собак, пневмония кошек, пиодермия собак, пиодермия кошек, пастереллез, пневмония, средний отит, синусит, бронхит, тонзиллит и мастоидит, ассоциированные с инфекцией, Staphylococcus spp. (Staphylococcus intermedius, Staphylococcusaureus), Escherichia coli, Streptococcus spp. (бета-гемолитических Streptococcus spp.), Pasteurella multocida,Bacteriodes spp., Fusobacterium spp., Porphyromonas spp., Prevotella spp., Peptostreptococcus spp. и Clostridium spp., неосложненные инфекции кожи и мягких тканей, абсцессы, остеомиелиты и послеродовой сепсис, ассоциированные с инфекцией Staphylococcus aureus, S. intermedius, коагулазоположительных стафилококков S. epidermidis, S. hemolyticus, Streptococcus ssp, групп стрептококков C-F (стрептококки, об-3 008503 разующие мелкие колонии), зеленящих стрептококков, неосложненные острые инфекции мочевыводящих путей, ассоциированные с инфекцией Staphylococcus ssp или Е. coli, одонтогенная инфекция, ассоциированная с инфекцией зеленящих стрептококков, инфекция мочевыводящих путей у собак и кошек,ассоциированная с инфекцией Е. coli, инфекции кожи и мягких тканей у собак и кошек, ассоциированные с инфекцией Staph. epidermidis, Staph. intermedius, коагулазоотрицательного стафилококка или P.multocida, инфекции ротовой полости у собак и кошек, ассоциированные с инфекцией Alcaligenes spp.,Bacteroides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas илиPrevotella. Было установлено, что соединения формулы I, а также сходные соединения, раскрытые в патентах США 6001997, 6020329 и 6077952, проявляют неожиданно длительный период полувыведения и собак и кошек, особенно с учетом сопоставимых антибиотиков. Например, в табл. 1 перечислены хорошо известные антибиотики и их соответствующие периоды полувыведения у разных млекопитающих, таких как мыши, крысы, собаки и кошки. Таблица 1. Период полувыведения известных антибиотиков(Данные по цефподоксиму из "Abstracts of the 1996 ICAAC"; Abstract 593. Все другие данные из: "CRCL. Craigmill, Stephen F. Sundlof CRC Press 1991; Пути введения: "IV" - внутривенный; "IM" внутримышечный; "РО" - пероральный; "SC" - подкожный Ряд цефалоспориновых производных, в том числе соединения формулы I, раскрыты в публикации международной патентной заявки WO 92/01696 и в Bateson et al., The Journal of Antibiotics, Feb. 1994, vol. 47,2, p. 253-256. В последней статье также раскрыты разные данные по мышам. Обе эти публикации включены сюда во всей их полноте. В частности, после введения соединения формулы II период полувыведения у мыши и крысы составил 2,2 и 3,9 ч при пероральном введении, соответственно. Однако неожиданно оказалось, что у собак и кошек период полувыведения в обоих случаях разительно возрос, как показано ниже в табл. 2. Примечание [1]: доза выражена как соответствующая свободная кислота, то есть, М+ = Н. Концентрации измерены со ссылкой на свободную кислоту. Подробное описание экспериментов а. Фармакокинетика Эксперимент 1. Внутривенно, собака Самцу собаки внутривенно вводили дозу водного раствора соединения I. Время от времени вплоть до 28 дней после введения дозы отбирали пробы плазмы крови. Пробы плазмы экстрагировали и для определения концентрации анализировали посредством биологического тестирования и методом ВЭЖХ(высокоэффективной жидкостной хроматографии) следующим образом: 1 мл плазмы (или стандартов содержащей определяемое вещество плазмы собаки) подкисляли соляной кислотой до рН меньше 3, затем встряхивали с 26 мл этилацетата. Слои разделяли центрифугированием. 22 мл органического слоя переносили в чистый контейнер и добавляли 2,0 мл 0,1 М фосфатного буфера, рН 7,0. После встряхивания и центрифугирования водную фазу выделяли и анализировали. После обработки пробы (и стандарты) анализировали посредством микробиологического биотестирования с лункой в планшете на больших планшетах (200 мл агара Mueller Hinton), на которые высевали М. luteus. Пробы также анализировали методом ВЭЖХ (колонка Bondapk-C18, которую элюировали смесью ацетонитрил - 0,05 М ацетат натрия, рН 5,0, 15:85 с детектированием в ультрафиолете (УФ) при 256 нм). Между двумя способами анализа обнаружили хорошее соответствие, и период полувыведения вычисляли по результатам биологического тестирования с использованием стандартных фармакокинетических методов. Эксперимент 2. Подкожно, собака Двум собакам подкожной инъекцией вводили дозу соединения формулы I. Время от времени вплоть до 28 дней после введения дозы отбирали пробы плазмы крови. Пробы плазмы и соответствующие стандарты готовили депротеинизацией путем добавления равного объема ацетонитрила и центрифугирования (3000 об./мин в течение 10 мин). Для определения концентрации супернатант анализировали специфическим методом ВЭЖХ (колонка Bondapk-C18, которую элюировали смесью ацетонитрил 0,05 М ацетат натрия, рН 5,0, 15:85 при 1,0 мл/мин с детектированием в УФ при 256 нм). Фармакокинетические параметры вычисляли с использованием программы PCNONLIN. Эксперимент 3. Перорально, собака Шести собакам перорально вводили дозу пролекарства пивалоилоксиметилового эфира, соединения формулы II, и определяли получающиеся концентрации в плазме биологическим биотестированием и методом ВЭЖХ. После введения дозы пробы плазмы крови отбирали вплоть до 696 ч (29 дней). Сначала пробы плазмы и соответствующие стандарты (1 мл) подкисляли соляной кислотой до рН меньше 3,0, затем встряхивали с 30 мл этилацетата. Слои разделяли центрифугированием, затем 25 мл органического слоя удаляли. К этилацетату добавляли 2 мл 0,1 М фосфатного буфера, рН 7,0, и встряхивали для осуществления обратной экстракции. После разделения слоев водную фазу удаляли и использовали для анализов. После обработки пробы (и стандарты) анализировали микробиологическим тестированием с лункой в планшете на больших планшетах (200 мл агара Mueller Hinton), на которые высевали М. luteus. Пробы также анализировали методом ВЭЖХ (колонка Bondapk-C18, которую элюировали смесью ацетонитрил - 0,05 М ацетат натрия, рН 5,0,15:85, при 1,5 мл/мин, с детектированием в УФ при 256 нм). Между двумя методами анализа было хорошее соответствие (r = 0,9716), период полувыведения вычисляли по данным биологического тестирования. Эксперимент 4. Подкожно, кошка Четырем кошкам подкожной инъекцией вводили дозу 8 мг/кг соединения I. Пробы крови отбирали время от времени вплоть до 35 дней после введения дозы и плазму анализировали методом ВЭЖХ/МС/МС (МС - масс-спектрометрия) для определения концентрации соответствующей свободной кислоты. Вносили аликвоты проб плазмы (100 мл) в центрифужные пробирки, затем добавляли 400 мл ацетонитрила. После перемешивания (60 с) и центрифугирования (20800 х г в течение 10 мин) 0,450 мл супернатанта переносили в чистые центрифужные пробирки и упаривали досуха при приблизительно 50 С под N2. Сухие пробы разводили в 0,100 мл подвижной фазы (15/85 об./об. ацетонитрил/10 мМHCO2NH4, рН 3,0), перемешивали в течение 1 мин, центрифугировали при 3000 об./мин в течение 2 мин и переносили во флакон автоматического пробоотборника. С помощью метода жидкостная хроматография - масс-спектрометрия/масс-спектрометрия анализировали по одному образцу плазмы на концентрацию соединения. Анализ проб выполняли на системе SCIEX API 365 или 3000 HPLC/MS/MS. Элюат подводили к источнику Turbo-ionspray, установленному на 4500 В. Столкновительный газ установили на значение 3. В источнике генерировали положительные ионы и подавали через диафрагму на квадрупольный фильтр масс. Масс-спектрометр был настроен для мониторирования ионов предшественника и продукта следующим образом: m/z 454.0 - 241.0. Период полувыведения вычислили с использованием фармакокинетической программы WINNONLIN v2.1 и определили как 8,390,97 дней. б. Эффективность В исследовании на модели экспериментально вызванной кожной инфекции Staphylococcus intermedius был полностью удален через 15 дней после однократного введения 8 мг/кг соединения I у пяти собак из шести. В отдельном исследовании после однократного введения 8 мг/кг соединения I здоровым собакам в течение четырех недель имело место значительное уменьшение популяций патогенных стафилококков при сравнении с не подвергнутыми воздействию контрольными животными. В исследовании на модели экспериментально вызванного абсцесса у кошек имело место значительное уменьшение количества бактерий Pasteurella multocida, Clostridium perfringens и Bacteroides fragilis через 14 дней после однократного введения 8 мг/кг соединения I. Вышеприведенные результаты по периодам полувыведения вместе с эффективностью соединений формулы I показывают, что одно введение эквивалента примерно 4-12 мг/кг соединения I (например,натриевой соли соединения формулы I) инъекцией (например, внутримышечно, подкожно или внутривенно) кошке или собаке преимущественно обеспечивают эффективную концентрацию в течение 7-21 дня. Это представляет собой новую и очень удобную схему лечения для практикующих ветеринаров и, в равной мере, для владельцев кошек и собак. Однако было установлено, что соединение I нестабильно как в твердом, так и в жидком виде. При оценке возможных препаратов были проведены эксперименты по стабильности. При использовании здесь "стабильный" или "стабилизированный" означает разложение соединения I, меньшее или равное примерно 10%. В то время как многие цефалоспорины можно стабилизировать кристаллизацией, было показано,что соединение I не особенно поддается методикам кристаллизации в промышленном масштабе. Следовательно, соединение I находится в аморфном состоянии и гигроскопично. Было установлено, что оптимальной длительной стабильности соединения I можно достичь при низком содержании остаточной воды. Соответственно, предпочтительную стабильность обеспечивает лиофилизация препаратов соединения I. Что касается настоящего изобретения, то были разработаны стабильные препараты соединения I,преодолевающие присущие проблемы со стабильностью, которые прежде препятствовали длительному хранению. Было установлено, что соединение I можно стабилизировать и приготовить в виде инъекционных препаратов путем приготовления препарата соединения I с водным фармацевтически приемлемым разбавителем так, чтобы рН находился в диапазоне от примерно 5,0 до примерно 8,0. Например, препараты приготавливают путем растворения терапевтически эффективного количества натриевой соли соединения I в водном фармацевтически приемлемом разбавителе и регулирования рН,если это необходимо, до значений в диапазоне от примерно 5,0 до примерно 8,0. Альтернативно, в качестве исходного вещества можно использовать свободную кислотную форму соединения I (то есть, карбоксилат вместо соли). Суспензию или раствор этой свободной кислоты можно титровать, например,гидроксидом натрия с образованием натриевой соли соединения I. Регулирование рН можно проводить,как описано выше. Аликвоты полученного раствора, количество которого зависит от конечной желаемой концентрации соединения I после восстановления влагосодержания, осветляют и стерилизуют фильтрацией, в асептических условиях переносят в контейнеры, подходящие для лиофилизации (например, флаконы), и частично закрывают лиофилизационными пробками. Как описано ниже, препарат охлаждают до замерзания, подвергают лиофилизации способом, который сам по себе общепринят в данной области техники,и герметично закрывают с образованием стабильного сухого лиофильного препарата. В предпочтительном воплощении эта композиция имеет низкое содержание остаточной воды, меньшее 1 мас.%, исходя из массы лиофилизата. В более предпочтительном воплощении эта композиция имеет уровень содержания остаточной воды меньше 0,5 мас.%. При использовании здесь "терапевтически эффективное количество" для единицы дозировки типично составляет от примерно 50 до примерно 500 мг активного ингредиента (US 6020329, колонка 16,стр. 3). Однако эта доза может варьировать в зависимости от рода, вида и других характеристик животного, подлежащего лечению, тяжести и типа инфекции и массы тела животного. Соответственно, исходя из массы тела, типичные диапазоны доз активного ингредиента могут быть от примерно 0,01 до пример-6 008503 но 100 мг на кг массы тела животного. Предпочтительно этот диапазон составляет от примерно 1 до примерно 20 мг на кг массы тела и более предпочтительно от примерно 4 до примерно 12 мг на кг массы тела (PCS10965, с. 7, стр. 7-11). Практикующий ветеринар или специалист в данной области техники сможет определить дозировку,пригодную для конкретного индивидуального пациента, которая может варьировать в зависимости от рода, возраста, массы и реакции этого конкретного пациента, а также от вовлеченного рода бактерий. Вышеуказанные дозировки являются примерами для среднего случая. Соответственно, могут быть обоснованы более высокие или более низкие диапазоны дозировок в зависимости от вышеуказанных факторов, и такие дозировки входят в объем настоящего изобретения. Соединения формулы I можно вводить либо отдельно, либо в комбинации с одним или более чем одним агентом, используемым в лечении и профилактике заболевания или в уменьшении или подавлении симптомов. Примеры таких агентов (которые даны для иллюстрации и не должны истолковываться как ограничивающие) включают в себя противопаразитарные средства, например арилпиразолы, такие как фипронил, люфенурон, имидаклоприд, авермектины (например, абамектин, ивермектин, дорамектин,селамектин), милбемицины, фосфорорганические соединения, пиретроиды; антигистаминные средства,например хлорфенирамин, тримепразин, дифенгидрамин, доксиламин; противогрибковые средства, например флюконазол, кетоконазол, итраконазол, гризеофульвин, амфотерицин В; антибактериальные средства, например энрофлаксацин, марбофлоксацин (marbofloxacin), ампициллин, амоксициллин; противовоспалительные средства, например преднизолон, бетаметазон, дексаметазон, карпрофен, кетопрофен; стероиды или другие противозудные агенты; диетические добавки, например гамма-линолевую кислоту, и смягчающие вещества. Следовательно, согласно данному изобретению дополнительно предложены применение соединений формулы I и одного или более чем одного соединения, выбранного из вышеприведенного списка, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении заболеваний или состояний по этому изобретению, и подобные объекты. В состав этих препаратов могут возможно входить вспомогательные ингредиенты, как это известно в данной области техники, такие как буферы, наполнители, разбавители, сорастворители, растворители,консерванты, хелатирующие агенты, антиоксиданты, регуляторы осмотического давления, присутствие которых может способствовать предоставлению быстрорастворимого высушенного сублимацией продукта или продлить время хранения препарата. Примером возможного растворителя и сорастворителя является этанол. Примером хелатирующего агента является этилендиаминтетрауксусная кислота. Примером антиоксиданта является аскорбиновая кислота. Примером регулятора осмотического давления является декстроза. Более того, соединение формулы I может быть единственным терапевтическим агентом в композициях по изобретению, или можно использовать комбинацию с другими антибиотиками или с ингибитором (-лактамазы (US 6020329, колонка 16, стр. 15-18). Было показано, что в отличие от большинства цефалоспоринов с типичными более широкими рНдиапазонами стабильности препараты соединения I с разными буферами или без них имеют относительно узкий диапазон стабильности при рН от примерно 5,0 до примерно 8,0. В частности, в предпочтительном воплощении оптимальной стабильности в состоянии раствора или твердом состоянии достигают при рН от примерно 6,0 до примерно 7,5. Регулирование рН можно осуществить либо титрованием до желаемого диапазона рН, например 10%-ным раствором гидроксида натрия или соляной кислотой, или использованием подходящего буфера. Типичные буферы включают в себя фосфат, ацетат, цитрат, карбонат и глицин. В предпочтительном воплощении в качестве буфера используют фосфат. В более предпочтительном воплощении в качестве буфера используют цитрат. Водорастворимым наполнителем, пригодным для использования по настоящему изобретению, может быть любой из фармацевтически приемлемых инертных твердых веществ, обычно используемых для лиофилизации. Наполнители могут улучшать стабильность и/или обеспечивать получение более быстрорастворимого высушенного сублимацией продукта. Такие наполнители включают в себя, например, сахара, такие как глюкоза, мальтоза, сахароза и лактоза, полиспирты, такие как сорбит и маннит, аминокислоты, такие как глицин, полимеры, такие как поливинилпирролидон, полисахариды, такие как декстран, некоторые неорганические соли, такие как фосфаты натрия или калия или хлорид натрия. Соотношение массы наполнителя и массы соединения I, используемое в композициях по настоящему изобретению, обычно должно быть в диапазоне от примерно 0,01 до примерно 100 в зависимости от используемого наполнителя. В предпочтительном воплощении предпочтительным наполнителем являются полигидроксильные соединения. В более предпочтительном воплощении наполнителем является сахароза, и было обнаружно, что она стабилизирует натриевую соль соединения I при совместной с ним лиофилизации. Однако оптимальное соотношение сахароза/соединение I непредсказуемо в отсутствие экспериментирования. Например, установили, что в сравнении с препаратами без добавления сахарозы относительно небольшое количество сахарозы (например, соотношение сахароза/натриевая соль соединения I составляет 0,4) увеличивало степень разложения натриевой соли соединения I. С другой стороны, соотно-7 008503 шение сахароза/натриевая соль соединения I, составляющее 1, проявляло такую же стабильность, как препараты,в которые сахарозу не добавляли. Однако соотношения больше 1,0 увеличивали стабильность препаратов натриевой соли соединения I. В предпочтительном воплощении соотношение сахароза/натриевая соль соединенияI находится в диапазоне от более чем 1,0 до примерно 10. В еще более предпочтительном воплощении соотношение сахароза/натриевая соль соединения I составляет примерно 3. Можно использовать более высокие соотношения сахароза/соединение. Однако высокая концентрация сахарозы ограничена практическими соображениями, связанными с вязкостью раствора высокой концентрации, влияющей на работу шприцами с раствором, получаемым при восстановлении влагосодержания. Более того, высокие концентрации сахарозы могут вызывать непереносимость инъекционных препаратов в месте инъекции. Как правило, верхним пределом для инъекционных препаратов в фармацевтической промышленности можно считать вязкость в 25-30 мПас (миллиПаскальсекунда), где определено как "помножить на". Это соответствует примерно максимум 60%-ному раствору сахарозы при 40 С (М. Mathlouthi, J. Genotelle в "М. Mathlouthi, Sucrose. Properties and Applications, Blackie AcademicProfessional, London, 1995, p. 137). Например, если концентрация соединения I в растворе составляет 6 мас.%, приемлемое соотношение сахароза/соединение I будет 10:1. Если концентрация соединения I составляет 3%, приемлемое соотношение сахароза/соединение I будет 20:1. Это только два примера многих возможных соотношений. Чтобы предотвратить микробное загрязнение, к фармацевтическим препаратам часто добавляют противомикробные консерванты. При использовании здесь слово "консервант" означает соединение или комбинацию соединений, которые добавляют для предотвращения или ингибирования роста микроорганизмов, которые могут создавать риск инфекции или разложения лекарственного средства. В общем,достигаемый уровень эффективности варьирует в зависимости от химической структуры консерванта,его концентрации и физических и химических свойств лекарственного средства (особенно рН). Конструкция упаковки и температура хранения продукта также влияют на уровень активности любого присутствующего противомикробного консерванта. Полезные консерванты могут включать в себя м-бензойную кислоту и ее соли, сорбиновую кислоту и ее соли, алкиловые эфиры парагидроксибензойной кислоты,фенол, хлорбутанол, бензиловый спирт, тимеросал, хлорид бензалкония, хлорид бензетония, хлорид цетилпиридиния, м-крезол и хлоркрезол. Также можно использовать смеси вышеуказанных консервантов. В настоящем изобретении препараты соединения I, содержащие противомикробные консерванты,полностью соответствовали критериям Фармакопеи США (ниже ФСША) для противомикробной эффективности. В частности, было обнаружено, что критериям ФСША удовлетворяют различные препараты с нижеследующими консервантами: например, метилпарабен, пропилпарабен, м-крезол и бензиловый спирт. Однако для того чтобы удовлетворять критериям Европейской Фармакопеи (ниже ЕФ) для противомикробной эффективности, более подходящими были другие консерванты (например, хлорид бензетония и комбинации нескольких консервантов, таких как метилпарабен, пропилпарабен и бензиловый спирт, в одной комбинации, и метилпарабен и м-крезол в другой комбинации). Препараты соединения I можно выделять путем сушки, предпочтительно путем лиофилизации, как известно в данной области техники. Обычно лиофилизированные препараты получают лиофилизацией в ампулах, лиофилизацией во флаконах, лиофилизацией в лотках и подобными общепринятыми способами путем охлаждения препаратов при температуре ниже нуля до замерзания. Затем замороженный материал сушат под вакуумом сублимацией водного компонента, исходно содержащегося в растворе в качестве растворителя, оставляя, таким образом, твердый лиофилизированный остаток. Так, например, в подходящем количестве воды для инъекций при перемешивании последовательно растворяют вышеописанные эксципиенты, соединение I или фармацевтически приемлемую соль соединения I. Затем добавляют дополнительное количество воды для достижения желаемого конечного объема. Получившийся раствор осветляют, стерилизуют фильтрацией и асептических условиях распределяют по стерильным контейнерам (например флаконам) с требуемой емкостью. Затем осуществляют сушку раствора сублимацией и флаконы герметично закрывают в соответствии с общепринятыми методиками. Лиофилизированная лекарственная форма представляет собой аморфное соединение I и более предпочтительно его натриевую соль. Когда требуется раствор лекарственного средства, его можно приготовить путем растворения сухого препарата в воде для инъекций, бактериостатической воде для инъекций или другом фармацевтически приемлемом разбавителе (например, изотоническом растворе хлорида натрия, воде для инъекций с этанолом или цитратным буфером и бактериостатической воде для инъекций с бензиловым спиртом) в количестве, достаточном для получения раствора с требуемой концентрацией для парентерального введения пациентам. Можно вводить такое количество соединения I, что композиция обеспечивает желаемый терапевтический эффект, как раскрыто в патентах США 6001997, 6020329 и 6077952. Инъекционные растворы, полученные путем растворения сухого препарата, по изобретению можно вводить в соответствии со многими возможными схемами применения. Примеры Для подтверждения благоприятных эффектов по настоящему изобретению натриевую соль соединения I приготавливали в виде лиофилизированных инъекционных препаратов и измеряли стабильность-8 008503 этих препаратов. Нижеприведенные примеры предназначены для иллюстрации конкретного воплощения этого изобретения и не предназначены для ограничения материалов заявки, в том числе формулы изобретения,каким-либо образом. А. Стабилизация лиофилизированных препаратов путем регулирования рН Препараты, описанные в табл. 3-6, демонстрируют увеличенную нестабильность композиций, как забуференных, так и незабуференных, вне диапазона рН от примерно 5,0 до примерно 8,0. Как представлено ниже в табл. 3 и 4, натриевую соль соединения I растворяли или в деионизированной воде, или в растворах цитратного буфера при 50 мг/мл. Величину рН раствора для препаратов 1-5 регулировали 10%-ным раствором соляной кислоты после растворения натриевой соли соединения I (табл. 3). Для препаратов 6-13 буферный раствор получали с использованием цитрата и регулировали 10%-ным раствором гидроксида натрия, после чего в нем растворяли натриевую соль соединения I (табл. 4). Аликвоты по одному миллилитру растворов натриевой соли соединения I вносили во флаконы на 10 мл и лиофилизировали с использованием лиофилизатораFTS Kinetics (FTS Systems, Stone Ridge, New York). Во время лиофилизации композиции замораживали с использованием двухстадийного протокола замораживания (при -25 и -40 С) с последующей первичной сушкой при -27 С в течение приблизительно 22 ч, за которой следовала вторичная сушка при пошаговом повышении температуры до 0, 25 и 50 С. Давление при первичной и вторичной сушке устанавливали на 60 мл (8 Па). Примеры методик получения растворов приведены ниже. Таблица 3. Состав препаратов с НСl рН растворов перед лиофилизацией доводили до указанных значений 10%-ным раствором гидроксида натрия. Пробы хранили при 40 С в течение 12 недель. Затем измеряли оставшееся количество соединения I посредством высокоэффективной жидкостной хроматографии (ВЭЖХ) с обращенной фазой с использованием системы ВЭЖХ Waters (Milford, MA) с ультрафиолетовым (УФ) детектором, установленным на 256 нм, и колонкой Kromasil С 4 (MetaChem Technologies Inc., Torrance, CA). Использовали градиентный метод с подвижной фазой А, состоящей из смеси 0,025 М буферного раствора фосфата натрия, рН 6,5, и ацетонитрила в соотношении 9:1 об./об., и подвижной фазы Б, состоящей из смеси 0,025 М буферного раствора фосфата натрия, рН 6,5, и ацетонитрила в соотношении 4:6 об./об. Результаты по разложению в процентах (%) от исходной чистоты соединения I представлены в-9 008503 табл. 5 и 6. Разложение препарата через 18 месяцев хранения при контролируемой комнатной температуре 25 С (то есть, в типичных условиях хранения на складе) вычисляли с использованием модели псевдонулевого порядка и уравнения Аррениуса при энергии активации в 10 ккал/моль (41,868 кДж/моль) (например, K.А. Connors, Chemical Kinetics, 1990, VCH Publishers Inc., New York). При этой энергии активации константа скорости разложения при 40 С (k40) равна 2,27k25 (k25 является константой скорости разложения при 25 С). Средний специалист в данной области техники понимает обоснованность этого допущения на основании данных, о которых сообщили Pikal et al., для других аморфных цефалоспориновых соединений, где k40=2,2k25 (M.J.Pikal, K.M.Dellerman, Stability testing of Pharmaceuticals by highsensitivity isothermal calorimetry at 25C: cephalosporins in the solid and aqueous solution states, Int. J. Pharm. 50 (1989) 233-252). Как изложено в табл. 5, препараты 4 и 5 (соответственно рН 5,1 и 6,0 из табл. 3) имели приемлемую длительную стабильность (то есть, разложение через 18 месяцев при 25 С меньше 10%). Однако препараты с рН меньшим или равным 4,1 демонстрировали разложение более чем на 10%, что обычно неприемлемо в фармацевтической промышленности для фармацевтических продуктов. Однако, как продемонстрировано в табл. 4, оптимальная стабильность препаратов, которые содержат цитратный буфер, была между рН от примерно 6,0 до примерно 7,0. Таблица 5. Процент соединения I через 12 недель хранения при 40 С и оценка срока хранения при контролируемой комнатной температуре 25 С Рассчитано, как описано в тексте Таблица 6. Процент соединения I через 12 недель хранения при 40 С и оценка срока хранения при контролируемой комнатной температуре 25 С Рассчитано, как описано в тексте Примеры приготовления растворов для вышеописанных исследований стабильности лиофилизированных препаратов с конкретными концентрациями приведены ниже: Пример 1. Препарат без регулирования рН 1,0453 г натриевой соли соединения I растворяли в 20,0 мл деионизированной воды. Аликвоты по 1 мл получившегося раствора переносили во флаконы на 10 мл, частично закрывали лиофилизационными крышками, лиофилизировали и герметично закрывали, как описано выше. Пример 2. Препарат с рН, отрегулированным соляной кислотой 0,5085 г натриевой соли соединения I растворяли в 10,0 мл деионизированной воды. Этот раствор титровали 0,1 н соляной кислотой до рН 3,87. Аликвоты по 1 мл получившегося раствора переносили во- 10008503 флаконы на 10 мл, частично закрывали лиофилизационными крышками, лиофилизировали и герметично закрывали, как описано выше. Пример 3. Препарат с рН, отрегулированным цитратным буфером 0,6 г натриевой соли соединения I растворяли в 12 мл 0,05 М цитратного буфера при рН 6,0. Получившийся раствор фильтровали и аликвоты по 1 мл переносили во флаконы на 10 мл, частично закрывали лиофилизационными крышками, лиофилизировали и герметично закрывали, как описано выше. Б. Стабилизация лиофилизированного препарата натриевой соли соединения I наполнителями В каждом эксперименте препараты, содержащие натриевую соль соединения I и сахарозу при разных соотношениях сахароза/натриевая соль соединения I (табл. 7), лиофилизировали в соответствии со стандартными промышленными методиками, как описано выше. В целях контроля качества и воспроизводимости независимо готовили препараты 15-18 и 19-22. Для препаратов 19-22 измерения стабильности проводили только на сроке 12 недель. Таблица 7. Состав препаратов Пробы хранили при 40 С в течение срока до 12 недель. Оставшееся количество соединения I измеряли посредством ВЭЖХ с обращенной фазой с использованием метода с градиентом растворителей, как описано выше, и записывали как проценты (%) оставшегося соединения I. Результаты, как приведено в табл. 8, показывают, что добавление сахарозы в соотношении 3:1 (сахароза/натриевая соль соединения I) улучшает стабильность. Более низкое соотношение сахароза/натриевая соль соединения I, составляющее 2:5, было менее желательным. Стабильность препарата с соотношением 1:1 была сходной с препаратом без сахарозы. Таблица 8. Процент соединения I через 12 недель при 40 С Пример приготовления раствора для вышеописанных исследований стабильности лиофилизированных препаратов приведен ниже. Пример 4. Препарат с сахарозой 0,4818 г натриевой соли соединения I и 0,1964 г сахарозы растворяли в 10 мл деионизированной воды. Получившийся раствор переносили аликвотами по 1 мл во флаконы на 10 мл, частично закрывали лиофилизационными крышками и лиофилизировали, как описано выше. В конце цикла лиофилизации флаконы герметично закрывали. В. Консерванты Как правило, консерванты не нужны для препаратов, содержащих цефалоспорины, в том числе препаратов, содержащих соединение I. Однако для удовлетворения противомикробной in vitro эффективности препараты, хранящиеся в упаковках для многократного приема, в отличие от упаковок на один- 11008503 прием, требуют добавления консервантов. Различные препараты, полученные в соответствии с приведенными ниже рабочими примерами, были протестированы на противомикробную активность in vitro. Тесты на противомикробную эффективность (ниже "ТПЭ") проводили в соответствии с методиками Европейской Фармакопеи (ЕФ) (European Pharmacopoeia, 3d Edition, Supplement 201, Council of Europe,Strasbourg) и Фармакопеи США (ФСША) (U. S. Pharmacopeia, and National Formulary USP14 NF19, 2000,United States Pharmacopeia Convention Inc., Rockville, MD). Эффективность препаратов, содержащих консерванты и натриевую соль соединения I, продемонстрирована в следующих примерах: Пример 5. ТПЭ натриевой соли соединения I и метилпарабена (1,8 мг/мл) ТПЭ проводили на растворе, содержащем натриевую соль соединения I (80 мг/мл) и метилпарабен(1,8 мг/мл) в 20 мМ цитратном буфере. Результаты ТПЭ приведены в табл. 9. Препарат удовлетворял критериям ФСША (см. критерии приемлемости в табл. 14) для всех микроорганизмов. Более того, препарат удовлетворял критериям А для всех микроорганизмов, кроме S. aureus на сроках 6 и 24 ч. Таблица 9. Логарифм снижения концентрации микробов Препарат, содержащий натриевую соль соединения I и метилпарабен Соответствует "отсутствию выявления" микроорганизмов. Пример 6. ТПЭ натриевой соли соединения I, метилпарабена (1,8 мг/мл) и пропилпарабена (0,2 мг/мл) В соответствии с методиками ЕФ и ФСША ТПЭ проводили на растворе, содержащем натриевую соль соединения I (80 мг/мл), метилпарабен (1,8 мг/мл) и пропилпарабен (0,2 мг/мл) в 20 мМ цитратном буфере. Результаты ТПЭ приведены в табл. 10. Препарат удовлетворял критериям ФСША (см. критерии приемлемости в табл. 14) для всех микроорганизмов. Более того, препарат удовлетворял критериям А по ЕФ для всех микроорганизмов, кроме S. aureus на сроках 6 и 24 ч. Таблица 10. Логарифм снижения концентрации микробов Препарат, содержащий натриевую соль соединения I, метилпарабен и пропилпарабен Пример 7. ТПЭ натриевой соли соединения I и м-крезола (3 мг/мл) В соответствии с методиками ЕФ и ФСША, ТПЭ проводили на растворе натриевой соли соединения I (80 мг/мл) и м-крезола (3 мг/мл), полученном путем разведения лиофилизированного остатка натриевой соли соединения I бактериостатической водой, содержащей м-крезол (3 мг/мл). Результаты ТПЭ приведены в табл. 11. Препарат удовлетворял критериям ФСША (см. критерии приемлемости в табл. 14) для всех микроорганизмов. Более того, препарат удовлетворял критериям А по ЕФ для всех микроорганизмов, кроме S. aureus на сроке 6 ч. Таблица 11. Логарифм снижения концентрации микробов Препарат, содержащий натриевую соль соединения I и м-крезол- 12008503 Пример 8. ТПЭ натриевой соли соединения I, метилпарабена, пропилпарабена и бензилового спирта В соответствии с методиками ЕФ и ФСША ТПЭ проводили на растворе, содержащем натриевую соль соединения I (80 мг/мл), метилпарабен (1,8 мг/мл), пропилпарабен (0,2 мг/мл) и бензиловый спирт(8,6 мг/мл) и 20 мМ цитратный буфер, полученном путем разведения лиофилизированного остатка натриевой соли соединения I, метилпарабена и пропилпарабена бактериостатической водой для инъекций,содержащей бензиловый спирт (9 мг/мл). Метилпарабен и пропилпарабен вводили в лиофилизированный остаток, тогда как бензиловый спирт добавляли с бактериостатической водой для инъекций. Результаты ТПЭ приведены в табл. 12. Препарат удовлетворял критериям ФСША (см. критерии приемлемости в табл. 14) для всех микроорганизмов. Более того, препарат удовлетворял критериям А по ЕФ для всех микроорганизмов. Таблица 12. Логарифм снижения концентрации микробов Препарат, содержащий натриевую соль соединения I, метилпарабен, пропилпарабен и бензиловый спирт Пример 9. ТПЭ натриевой соли соединения I, м-крезола и метилпарабена В соответствии с методикой ЕФ,ТПЭ проводили на растворе, содержащем натриевую соль соединения I (80 мг/мл), метилпарабен (1,8 мг/мл) и м-крезол (3 мг/мл), полученном путем разведения лиофилизированного остатка натриевой соли соединения I бактериостатической водой для инъекций, содержащей метилпарабен и м-крезол. Результаты ТПЭ приведены в табл. 13. Препарат удовлетворял критериям А по ЕФ (см. критерии приемлемости в табл. 14) для S. aureus. Таблица 13. Логарифм снижения концентрации микробов Препарат, содержащий натриевую соль соединения I, м-крезол и метилпарабен Таблица 14. Критерии приемлемости ТПЭ (ФСША и ЕФ)European Pharmacopoeia, 3d edition, Supplement 2001, Council of Europe, Strasbourg; U.S. Pharmacopeia, and National Formulary USP24 NF19, 2000, United State Pharmacopeial Convention Inc., Rockville,MD. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лиофилизированная фармацевтическая композиция, содержащая соединение формулы I где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5. 2. Фармацевтическая композиция по п.1, где М+ представляет собой Na+. 3. Фармацевтическая композиция по п.1 или 2, где соединение формулы I представляет собой аморфную мононатриевую соль (6R,7R)-7-(2Z)-(2-амино-4-тиазолил)(метоксиимино)ацетил]амино]-8 оксо-3-[(2S)-тетрагидро-2-фуранил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты. 4. Фармацевтическая композиция по любому из пп.1-3, где буфер представляет собой цитрат. 5. Фармацевтическая композиция по любому из пп.1-4, дополнительно содержащая фармацевтически приемлемый наполнитель. 6. Фармацевтическая композиция по п.5, где наполнитель выбран из сахаров, полиспиртов, аминокислот, полимеров, полисахаридов или неорганических солей. 7. Фармацевтическая композиция по п.6, где сахара выбраны из глюкозы, мальтозы, сахарозы или лактозы, полиспиртами являются сорбит или маннит, аминокислотой является глицин, полимером является поливинилпирролидон, полисахаридом является декстран, и неорганическими солями являются фосфаты натрия или калия или хлорид натрия. 8. Фармацевтическая композиция по любому из пп.1-7, где фармацевтически приемлемый консервант представляет собой комбинацию метил- и пропилпарабенов. 9. Набор, содержащий: а) терапевтически эффективное количество лиофилизированной фармацевтической композиции,содержащей соединение формулы I где М+ представляет собой Na+, K+ или Li+, возможный фармацевтически приемлемый буфер и консервант, выбранный из метилпарабена, пропилпарабена и смеси метил- и пропилпарабенов, причем эта композиция имеет рН раствора в диапазоне от 6,0 до 7,5; б) водный фармацевтически приемлемый разбавитель и в) первый и второй контейнер для вмещения композиции (а) и разбавителя (б), причем первый контейнер выполнен с возможностью получения разбавителя из второго контейнера. 10. Набор по п.9, где М+ представляет собой Na+. 11. Способ лечения или предотвращения состояния, вызванного бактериальной инфекцией у собак и кошек, при котором собаке или кошке вводят терапевтически эффективное количество фармацевтической композиции по пп.1-8. 12. Способ по п.11, где состояние представляет собой бактериальную инфекцию кожи, мягких тканей или мочевыводящих путей. 13. Способ по п.11 или 12, где состояние или инфекция вызваны или осложнены грамположительными или грамотрицательными бактериями.
МПК / Метки
МПК: A61K 31/546, A61K 9/19, A61K 47/00
Метки: содержащие, собак, инфекций, применение, бактериальных, лечении, кошек, препараты, цефалоспориновое, соединение
Код ссылки
<a href="https://eas.patents.su/15-8503-preparaty-soderzhashhie-cefalosporinovoe-soedinenie-i-ih-primenenie-v-lechenii-bakterialnyh-infekcijj-u-koshek-i-sobak.html" rel="bookmark" title="База патентов Евразийского Союза">Препараты, содержащие цефалоспориновое соединение, и их применение в лечении бактериальных инфекций у кошек и собак</a>