Тетрагидропиридо-соединения
Номер патента: 2402
Опубликовано: 25.04.2002
Авторы: Постиус Штефан, Зимон Вольфганг-Александер, Ридель Рихард
Формула / Реферат
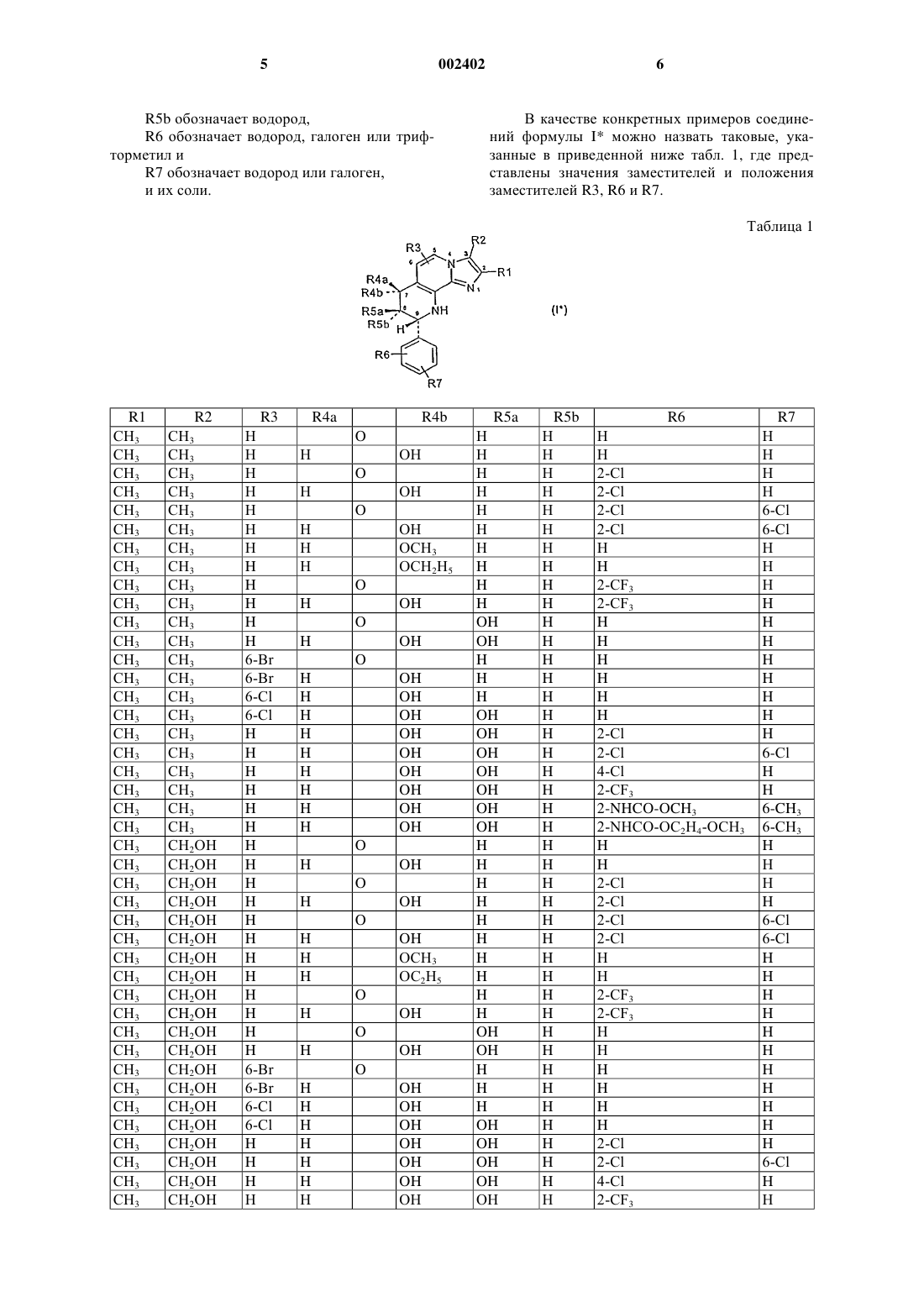
1. Соединение формулы I
в которой
R1 обозначает С1-С4алкил,
R2 обозначает С1-С4алкил или гидрокси-С1-С4алкил,
R3 обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил, С1-С4алкокси-, С1-С4алкокси-С1-С4алкокси- или R4a и R4b вместе обозначают О (кислород),
один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил, С1-С4алкокси- или R5a и R5b вместе обозначают О (кислород),
или в которой
один из заместителей R4a и R4b, с одной стороны, и один из заместителей R5a и R5b, с другой стороны, обозначают в каждом случае водород, а другие заместители в каждом случае вместе образуют метилендиоксигруппу (-О-СН2-O-) или этилендиоксигруппу (-О-СН2-СН2-О-),
причем R4a, R4b, R5a и R5b одновременно не обозначают водород,
R6 обозначает водород или галогентрифторметил,
R7 обозначает водород или галоген,
или его соли,
предпочтительно этим соединением может служить (7S,8R,9R)-7,8-изопропилидендиокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин или его соль.
2. Соединение формулы I по п.1, в котором
R1 обозначает С1-С4алкил,
R2 обозначает С1-С4алкил или гидрокси-С1-С4алкил,
R3 обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С1-С4алкоксигруппу, или в котором R4a и R4b вместе обозначают О (кислород),
один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил или С1-С4алкоксигруппу, или в котором R5a и R5b вместе обозначают О (кислород),
причем R4a, R4b, R5a и R5b не обозначают одновременно водород,
R6 обозначает водород, галоген или трифторметил и
R7 обозначает водород или галоген,
и его соли.
3. Соединение по п.1, имеющее формулу I*
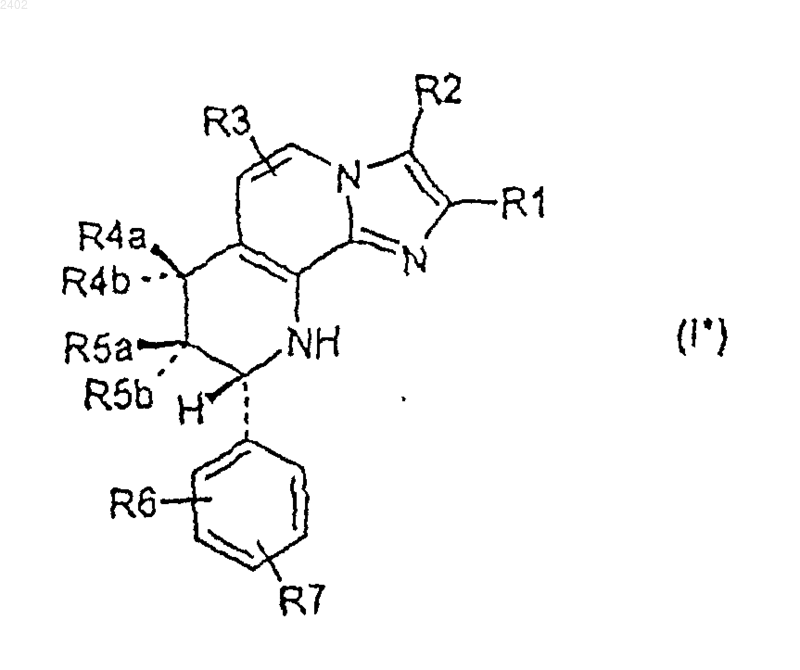
в которой
R1 обозначает С1-С4алкил,
R2 обозначает С1-С4алкил,
R3 обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С1-С4алкоксигруппу,
один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил или С1-С4алкоксигруппу,
причем R4a, R4b, R5a и R5b не обозначают одновременно водород,
R6 обозначает водород, галоген или трифторметил и
R7 обозначает водород или галоген,
и его соли.
4. Соединение формулы I* по п.3, в которой
R1 обозначает С1-С4алкил,
R2 обозначает С1-С4алкил,
R3 обозначает водород,
R4a обозначает водород,
R4b обозначает гидроксил или С1-С4алкоксигруппу,
R5a обозначает водород, гидроксил или С1-С4алкоксигруппу,
R5b обозначает водород,
R6 обозначает водород, галоген или трифторметил и
R7 обозначает водород или галоген,
и его соли.
5. Соединение формулы I* по п.3, в которой
R1 обозначает С1-С4алкил,
R2 обозначает С1-С4алкил,
R3 обозначает водород,
R4a обозначает водород,
R4b обозначает гидроксил,
R5a обозначает гидроксил,
R5b обозначает водород,
R6 обозначает водород, галоген или трифторметил и
R7 обозначает водород или галоген,
и его соли.
6. Соединение по п.1, выбранное из группы, включающей
7,8-дигидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,
9-(2-хлорфенил)-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,
9-(2,6-дихлорфенил)-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,
9-(2-трифторметилфенил)-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,
7-гидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
9-(2-хлорфенил)-7-гидрокси-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
9-(2,6-дихлорфенил)-7-гидрокси-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
9-(2-трифторметилфенил)-7-гидрокси-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
8-гидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,
(7S,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
(8R,9R)-3-формил-8-гидрокси-2-метил-7-оксо-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,
(7R,8R,9R)-3-гидроксиметил-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин или их соли.
7. Соединение по п.6, имеющее 9R-конфигурацию, или его соль.
8. Соединение по п.1, представляющее собой (7R,8R,9R)-7,8-дигидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин, или его соль.
9. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически переносимую соль вместе с обычными фармацевтическими вспомогательными веществами и/или эксципиентами.
10. Применение соединений по п.1 и их фармакологически переносимых солей для приготовления лекарственных средств, предназначенных для предупреждения и лечения желудочно-кишечных заболеваний, обусловленных повышенной секрецией желудочного сока.
Текст
1 Область техники Настоящее изобретение относится к новым соединениям, которые используются в фармацевтической промышленности в качестве действующих веществ для приготовления лекарственных средств. Предшествующий уровень техники В патенте US 4468400 описаны трициклические имидазо[1,2-а]пиридины, которые имеют различные кольцевые системы, сконденсированные с имидазопиридиновым скелетом, и которые пригодны для лечения пептических язвенных болезней. Описание изобретения Изобретение относится к соединениям формулы IR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиС 1 С 4 алкил,R3 обозначает водород или галоген,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил,С 1-С 4 алкокси-,С 1-С 4 алкокси-С 1 С 4 алкокси- или C1-С 4 алкилкарбонилоксигруппу,или R4a и R4b вместе обозначают О (кислород),один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил,С 1-С 4 алкокси-,С 1-С 4 алкоксиС 1-С 4 алкокси- или С 1-С 4 алкилкарбонилоксигруппу,или R5a и R5b вместе обозначают О (кислород),или в которой один из заместителей R4a и R4b,с одной стороны, и один из заместителей R5a иR5b, с другой стороны, обозначают в каждом случае водород, а другие заместители в каждом случае вместе образуют метилендиоксигруппу(-O-СН 2-O-) или этилендиоксигруппу (-О-СН 2 СН 2-О-), причем R4a, R4b, R5a и R5b одновременно не обозначают водород,R6 обозначает водород, галоген, С 1 С 4 алкил, С 1-С 4 алкокси-, С 1-С 4 алкоксикарбониламино-,С 1-С 4 алкоксиС 1-С 4 алкоксикарбониламиногруппу или трифторметил иR7 обозначает водород, галоген, С 1 С 4 алкил или С 1-С 4 алкоксигруппу,и к их солям. С 1-С 4 алкил обозначает алкильные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода. В качестве примеров можно назвать бутильный радикал, изобутильный радикал, втор-бутильный радикал,трет-бутильный радикал, пропильный радикал,изопропильный радикал, этильный радикал и метильный радикал. Предпочтительным является метильный радикал. 2 ГидроксиС 1-С 4 алкил обозначает указанные выше С 1-С 4 алкильные радикалы, замещенные гидроксигруппой. В качестве примеров можно назвать гидроксиметильный радикал,2 гидроксиэтильный радикал и 3-гидроксипропильный радикал. Предпочтительным является гидроксиметильный радикал. В контексте настоящего описания галоген обозначает бром, хлор или фтор. С 1-С 4 алкоксигруппа обозначает радикалы,которые помимо атома кислорода содержат алкильный радикал с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода. В качестве примеров можно назвать бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу,пропоксигруппу, изопропоксигруппу и предпочтительно этоксигруппу и метоксигруппу. С 1-С 4 алкокси-С 1-С 4 алкоксигруппа обозначает одну из вышеуказанных С 1 С 4 алкоксигрупп, которая замещена еще одной С 1-С 4 алкоксигруппой. В качестве примеров можно назвать 2-(метокси)этоксигруппу (CH3O-CH2-CH2-О) и 2-(этокси)этоксигруппу (СН 3 СН 2-О-СН 2-СН 2-О). С 1-С 4 алкилкарбонилоксигруппа обозначает карбонилоксигруппу, присоединенную к одному из вышеуказанных С 1-С 4 алкильных радикалов. В качестве примера можно назвать ацетоксигруппу (СН 3 СО-O-). С 1-С 4 алкоксикарбонил обозначает карбонильную группу, к которой присоединена одна из вышеуказанных С 1-С 4 алкоксигрупп. В качестве примеров можно назвать метоксикарбонильный радикал (СН 3 О-С(О)-) и этоксикарбонильный радикал (СН 3 СН 2 О-С(O)-). С 1-С 4 алкоксикарбониламиногруппа обозначает аминогруппу, замещенную одним из вышеуказанных С 1-С 4 алкоксикарбонильных радикалов. В качестве примеров можно назвать этоксикарбониламиногруппу и метоксикарбониламиногруппу. С 1-С 4 алкокси-С 1-С 4 алкоксикарбонил обозначает карбонильную группу, к которой присоединена одна из вышеуказанных С 1 С 4 алкокси-С 1-С 4 алкоксигрупп. В качестве примеров можно назвать 2-(метокси)этоксикарбонильный радикал (СН 3-О-СН 2 СН 2-О-СО-) и 2(этокси)этоксикарбонильный радикал (CH3CH2O-CH2CH2-O-CO-). С 1-С 4 алкокси-С 1-С 4 алкоксикарбониламиногруппа обозначает аминогруппу, замещенную одним из вышеуказанных С 1-С 4 алкокси-С 1 С 4 алкоксикарбонильных радикалов. В качестве примеров можно назвать 2-(метокси)этоксикарбониламиногруппу и 2-(этокси)этоксикарбониламиногруппу. Приемлемые соли соединений формулы I в зависимости от замещений главным образом представляют собой кислотно-аддитивные соли. Особо следует отметить фармакологически переносимые соли неорганических и органических кислот, обычно применяемые в фармации. Та 3 кие приемлемые соли представляют собой водорастворимые и водонерастворимые кислотноаддитивные соли таких кислот, как, например,соляная кислота, бромисто-водородная кислота,фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота,D-глюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота,щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3 гидрокси-2-нафтойная кислота, причем при получении солей кислоты применяются в эквимолярном или в отличном от него количественном соотношении в зависимости от того, используется одно- или многоосновная кислота, и от того, какую соль требуется получить. Фармакологически непереносимые соли,которые могут быть сначала получены в качестве промежуточных продуктов, например, при получении соединений по изобретению в промышленном масштабе, превращают в фармакологически переносимые соли способами, известными специалистам в данной области. Согласно экспертным данным соединения по изобретению, а также их соли, например,когда их можно выделить в кристаллической форме, могут содержать различные количества растворителей. Поэтому под объем изобретения подпадают все сольваты и, в частности, все гидраты соединений формулы I, a также все сольваты и, прежде всего, все гидраты солей соединений формулы I. Соединения формулы I имеют три хиральных центра. Изобретение относится ко всем восьми возможным стереоизомерам и их смесям в любом требуемом соотношении друг с другом,в том числе к чистым энантиомерам, которые составляют предпочтительный объект изобретения. Если один из заместителей R4a и R4b, с одной стороны, и один из заместителей R5a иR5b, с другой стороны, вместе образуют метилендиоксигруппу или этилендиоксигруппу, то два заместителя, которые образуют метилендиоксигруппу или этилендиоксигруппу, предпочтительно находятся в цис-положении относительно друг друга. Следует выделить те соединения формулыI, в которых R1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиС 1-С 4 алкил,R3 обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу, или R4a и R4b вместе обозначают О (кислород),один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гид 002402 4 роксил или С 1-С 4 алкоксигруппу или R5a и R5b вместе обозначают О (кислород), причем R4a,R4b, R5a и R5b не обозначают одновременно водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и их соли. Особо следует отметить предлагаемые согласно одному из вариантов осуществления изобретения соединения формулы IR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиС 1-С 4 алкил,R3 обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу,один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу, причем R4a,R4b, R5a и R5b не обозначают одновременно водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и их соли. Следует также особо отметить предлагаемые согласно еще одному варианту осуществления изобретения соединения формулы I в которойR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиметил,R3 обозначает водород,R4a обозначает водород,R4b обозначает гидроксил или С 1 С 4 алкоксигруппу,R5a обозначает водород, гидроксил или С 1 С 4 алкоксигруппу,R5b обозначает водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и их соли. Предпочтительными являются соединения формулы Iв которойR5b обозначает водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и их соли. 6 В качестве конкретных примеров соединений формулы I можно назвать таковые, указанные в приведенной ниже табл. 1, где представлены значения заместителей и положения заместителей R3, R6 и R7. Таблица 1 К примерам таких соединений относятся также соли соединений, указанных в табл. 1,при этом буква "О" (кислород) в столбце табл. 1 между столбцами, соответствующими R4a иR4b, обозначает 7-оксосоединение. Соединения по изобретению могут быть получены способами, проиллюстрированными в приведенных ниже примерах, или с помощью аналогичных способов с использованием соответствующих исходных соединений. Исходные соединения являются известными или могут быть получены аналогично известным соединениям. В зависимости от схемы замещения в положениях 7 и 8 (R4a/R4b или R5a/R5b) соединения по изобретению могут быть получены с использованием в качестве исходных продуктовN-защищенных 8-аминоимидазо[1,2-а]пиридинов, которые являются известными или могут быть получены известным способом (см. ЕР-А 0299470 или Kaminski и др., J. Med. Chem. 1985,28, 876-892) согласно следующим реакционным схемам. Схема 1N-защищенный (на этой и на следующих схемах Piv обозначает обычно применяемую защитную группу, предпочтительно пивалоильную группу) 8-аминоимидазо[1,2-а]пиридин,депротонированный в положении 7, подвергают взаимодействию с коричным альдегидом. Продукт присоединения сначала окисляют (например, с помощью двуокиси марганца), а затем эпоксидируют (например, с помощью перекиси водорода). Удаление защитной группы и замыкание кольца осуществляют в сильных щелочных и соответственно в сильных кислых условиях. Восстановление кетогруппы, которое при необходимости проводят после этого, может Вместо эпоксидирования согласно схеме 1 удаляют защитную группу и замыкают кольцо в сильных кислых условиях. Восстановление до спирта, которое при необходимости проводят после этого, осуществляют с помощью борогидрида натрия. Схема 3 Вышеприведенная схема представляет собой пример энантиоселективного синтеза, при этом в качестве исходных продуктов используют те же N-защищенные имидазо[1,2-а] пиридины, что и в схеме 1. Взаимодействие этих имидазо[1,2-а]пиридинов в депротонированной форме с энантиомерно чистыми диоксоланами сначала приводит к получению продукта конденсации, который может быть подвергнут циклизации в сильных кислых условиях с удалением защитных групп. Последующее восстановление кетогруппы с использованием борогидрида натрия (см. также схему 1) приводит к получению конечного указанного продукта,содержащего 90% требуемого энантиомера. Соединения с замещенной 8-аминогруппой получают либо с использованием в качестве исходных продуктов вышеуказанные 8 аминоимидазо[1,2-а]пиридины, либо путем алкилирования пригодными алкилирующими агентами, имеющими замещения (например,R8a обозначает водород, R8b обозначает галоген), либо путем восстановительных алкилирований с использованием соответствующим образом замещенных кетонов [R8a и R8b вместе обозначают О (кислород)] с помощью восстановителей, таких как цианборогидрид натрия, и последующего замыкания кольца с помощью основного или кислотного катализа с получением циклических кетонов, которые в свою очередь могут быть превращены в требуемые конечные соединения с помощью соответствующих химических превращений (см., например,схемы 1 и 2). При необходимости группа CO2R также может быть сначала восстановлена (стадия альдегида) до циклизации, после чего получают 7-гидроксизамещенные производные, которые в свою очередь могут быть превращены в требуемые конечные соединения путем окисления/восстановления. Схема 5 10 В варианте способа, представленного выше на схеме 4, где R5a и R8a обозначают Н (водород), a R5b и R8b вместе обозначают О (кислород), 8-аминоимидазо[1,2-а]пиридин сначала подвергают взаимодействию с производными эфира эпоксикоричной кислоты с региоселективным разрывом эпоксидной связи (А). Образовавшиеся продукты подвергают циклизации в апротонных основных условиях (В). В альтернативном варианте смесь может быть гидролизована и свободное производное карбоновой кислоты подвергнуто циклизации в кислых условиях (Е). В обоих случаях кетогруппа может быть затем восстановлена до спирта (Ж), как показано на схеме 1, например, с использованием борогидрида натрия. Если 8-аминоимидазо[1,2-а]пиридин подвергают взаимодействию с защищенными производными эпоксикоричного альдегида (Б), образовавшиеся продукты могут быть подвергнуты замыканию кольца в кислых условиях после удаления ацетальной защитной группы (Е). Также возможно восстановление реакционноспособной эфирной группы до альдегида и циклизация в кислых условиях (Д). Восстановление реакционноспособной кетогруппы, равно как и замыкание кольца на стадии альдегида, может быть осуществлено энантиоселективным способом, так что при использовании соответствующих энантиомерно чистых эпоксидных производных возможен энантиоселективный синтез. Схема 6Pr обозначает защитную группу,Lg обозначает уходящую группу,Y обозначает Н, OR, NR2, галоген и т.д. Выше еще в одном варианте схемы 4 представлен энантиоселективный синтез. Бензиль 11 ный фрагмент производного дигидроксикоричной кислоты активируют либо непосредственно,либо после введения защитной группы во вторую гидроксильную группу. Полученные таким путем продукты подвергают взаимодействию с 8-аминоимидазо[1,2-а]пиридином. Затем осуществляют замыкание кольца, например, в основных условиях. Последующую стадию (восстановление) при необходимости проводят аналогично схеме 3. Схема 7 8-Галоидимидазо[1,2-а]пиридины (X обозначает галоген) подвергают взаимодействию с соответствующим образом замещенными фениламинокислотами с использованием в качестве катализатора тяжелого металла (предпочтительно Pd) с получением замещенных аминов, которые в свою очередь подвергают циклизации согласно схеме 4. Вместо COORгруппы при необходимости также может быть использована альдегидная группа (как было уже указано на схеме 4) в форме ацеталя. Y обозначает Н (водород) или защитную группу, которая может быть удалена до или после замыкания кольца. Схема 8 12 При использовании в качестве исходного продукта имидазола, который является известным или может быть получен известным способом, замыканию кольца, которое требуется осуществить (необязательно с защитой гидроксигруппы), способствует присутствие енаминовой группы (равновесие). После введения двойной связи путем окисления может быть осуществлено восстановление кетогруппы до спирта, как указано на схеме 1. В приведенных выше схемах "R" обозначает С 1-С 4 алкил. В эфирных группах, указанных в качестве примера (-COOR или -CO2R) вместо радикала -OR могут присутствовать другие уходящие группы, или вместо эфирной группы также может присутствовать другая группа, обладающая нужной реакционной способностью. Соединения формулы I, в которых R4a/R4b или R5a/R5b обозначают С 1-С 4 алкокси-, С 1C4 алкокси-С 1-C4 алкокси- или С 1-C4 алкилкарбонилоксигруппу, могут быть получены общепринятыми способами дериватизации, такими,которые известны специалистам в данной области (например, алкилированием или ацилированием), соответствующих соединений, в которых R4a/R4b или R5a/R5b обозначают гидроксил. Соединения формулы I, в которых R2 обозначает гидрокси-С 1-C4 алкил, или соответствующие исходные соединения в схемах 1-8 могут быть получены из соответствующих сложных эфиров и альдегидов общепринятым способом (см. WO 94/18199) путем восстановления,например, борогидридом натрия или алюмогидридом лития. При необходимости восстановление с получением гидрокси-С 1-C4 алкильной группы может быть осуществлено одновременно с восстановлением кетогруппы в положении 8 и прежде всего в положении 7 (R4a и R4b вместе обозначают О). Соединения по изобретению выделяют и очищают хорошо известным способом, например, отгонкой растворителя в вакууме и перекристаллизацией полученного остатка из пригодного растворителя, или подвергают его одному из общепринятых способов очистки, такому как, например, хроматография на колонках с использованием пригодного носителя. Соли получают путем растворения свободного соединения в пригодном растворителе,например, в хлорированном углеводороде, таком как метилхлорид или хлороформ, или алифатический спирт с низкой молекулярной массой (этанол, изопропанол), который содержит требуемую кислоту или к которому затем добавляют требуемую кислоту. Соли получают путем фильтрации, повторного осаждения, осаждения с осадителем для кислотно-аддитивной соли или путем выпаривания растворителя. Полученные соли могут быть превращены с помощью подщелачивания или подкисления в свободные соединения, которые в свою очередь 13 могут быть превращены в соли. Таким путем фармакологически неприемлемые соли могут быть превращены в фармакологически приемлемые соли. Чистые энантиомеры, в частности чистые энантиомеры формулы I, являющиеся предпочтительным объектом изобретения, могут быть получены способом, известным специалистам в данной области, например, путем энантиоселективного синтеза (см., например, схему 3), путем хроматографического разделения на хиральных разделительных колонках, путем дериватизации с использованием хиральных вспомогательных реагентов, последующего разделения диастереомеров и удаления хиральных вспомогательных групп, путем получения солей с хиральными кислотами, последующего разделения солей и выделения требуемого соединения из соли или путем (фракционной) кристаллизации из пригодного растворителя. Кроме того, изобретение относится к способам и промежуточным продуктам, получаемым в способах, представленных на вышеприведенных схемах, в частности к тем промежуточным продуктам, которые получают способами, представленными на схемах 1, 2, 3, 4, 5, 6 и 7 и которые могут быть выделены до стадии кристаллизации. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Более того, другие соединения формулы I, способ получения которых не описан явным образом, могут быть получены аналогичными способами или способами, известными специалистам в данной области, с использованием общепринятых методов обработки. Сокращение мин обозначает минуту(ы), ч обозначает час(ы), эи обозначает энантиомерный избыток. Примеры Конечные продукты 1. 2,3-Диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Раствор, содержащий 4,5 г 2,3-диметил-7(3-фенил-1-оксо-2-пропенил)-8-пивалоиламиноимидазо[1,2-а]пиридина в 30 мл диоксана, обрабатывают 20 мл конц. соляной кислоты, выдерживают при температуре дефлегмации в течение 8 ч, значение рН доводят при охлаждении до 7,0 с помощью 2 н. раствора гидроксида натрия и трижды экстрагируют 50 мл этилацетата. Объединенные экстракты промывают водой,сушат над карбонатом калия и концентрируют досуха под вакуумом. Остаток в виде вязкого масла хроматографируют на силикагеле с использованием в качестве элюента смеси этилацетат/петролейный эфир (1:1). Таким путем получают 2,6 г указанного в заголовке соединения с tпл 138-140 С. 2. 9-(2-Хлорфенил)-2,3-диметил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Работая аналогично примеру 1 и используя в качестве исходного продукта 7-[3-(2-хлор 002402 14 фенил)-1-оксо-2-пропенил]-8-пивалоиламино 2,3-диметилимидазо[1,2-а]пиридин, получают указанное в заголовке соединение (выход 73%) с tпл 80-82 С. 3. 9-(2,6-Дихлорфенил)-2,3-диметил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Работая аналогично примеру 1 и используя в качестве исходного продукта 7-[3-(2,6 дихлорфенил)-1-оксо-2-пропенил]-8-пивалоиламино-2,3-диметилимидазо[1,2-а]пиридин, получают указанное в заголовке соединение (выход 41%) с tпл 248-249C. 4. 9-(2-Трифторметилфенил)-2,3-диметил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Работая аналогично примеру 1 и используя в качестве исходного продукта 7-[3-(2 трифторметилфенил)-1-оксо-2-пропенил]-8 пивалоиламино-2,3-диметилимидазо[1,2-а]пиридин, получают указанное в заголовке соединение (выход 41%) с tпл 184-185 С. 5. 7-Гидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Суспензию, содержащую 1 г 2,3-диметил 9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин-7-она в 15 мл метанола, обрабатывают при комнатной температуре 450 мг борогидрида натрия, добавляемого небольшими порциями. Образовавшийся желтоватый раствор перемешивают в течение 2 ч и затем разбавляют ледяной водой. Выпавший осадок отфильтровывают под вакуумом и промывают небольшим количеством 2-пропанола. Таким путем получают 800 мг указанного в заголовке соединения с tпл 210-212 С. 6. 9-(2-Хлорфенил)-7-гидрокси-2,3-диметил-7,8,9,10-тетрагидроимидазo[1,2-h][1,7]нафтиридин. Работая аналогично примеру 5 и используя в качестве исходного продукта 9-(2-хлорфенил)2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он, получают указанное в заголовке соединение (выход 73%) с tпл 150152 С. 7. 9-(2,6-Дихлорфенил)-7-гидрокси-2,3 диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Работая аналогично примеру 5 и используя в качестве исходного продукта 9-(2,6 дихлорфенил)-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он, получают указанное в заголовке соединение (выход 72%) с tпл 155-157 С. 8. 9-(2-Трифторметилфенил)-7-гидрокси 2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Работая аналогично примеру 5 и используя в качестве исходного продукта 9-(2 трифторметилфенил)-2,3-диметил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он, 15 получают указанное в заголовке соединение(выход 72%) с tпл 145-147 С. 9. 8-Гидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7 он. Раствор, содержащий 500 мг 2,3-диметил 7-(2,3-эпокси-1-оксо-3-фенилпропил)-8-пивалоиламиноимидазо[1,2-а]пиридина в 5 мл безводного этанола, обрабатывают при интенсивном перемешивании 95 мг гидроксида лития и после перемешивания в течение 2 ч при комнатной температуре охлаждают до 0 С в ледяной бане. Выпавшие кристаллы отфильтровывают под вакуумом и промывают небольшим количеством холодного этанола. После сушки в глубоком вакууме твердый продукт добавляют при комнатной температуре к 5 мл серной кислоты 90%-ной крепости и перемешивают в течение 1 ч. Затем раствор при охлаждении на льду нейтрализуют с помощью охлажденного раствора гидроксида натрия 40%-ной крепости. Выпавший при этом осадок отфильтровывают и сушат в вакууме. Таким путем получают 145 мг указанного в заголовке соединения с tпл 232-234 С. 10. 7,8-Дигидрокси-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазo[1,2-h][1,7]нафтиридин. 700 мг 8-гидрокси-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-она суспендируют в 15 мл метанола и при комнатной температуре и при перемешивании добавляют порциями 200 мг борогидрида натрия. После перемешивания в течение 2 ч смесь сливают на 100 мл ледяной воды. Выпавший осадок отфильтровывают, быстро сушат в вакууме и перекристаллизовывают из небольшого количества 2-пропанола. Таким путем получают 500 мг указанного в заголовке соединения с tпл 150-152 С. 11.(эи 95%, ЖХВР с использованием сорбента типа Daicel Chiracel) добавляют в течение 4 мин при охлаждении на льду к 50 мл серной кислоты 70%-ной крепости. В процессе этого добавления образуется суспензия, которая через 30 мин превращается в оранжевый раствор. После завершения добавления ледяную баню удаляют и смесь перемешивают при комнатной температуре. Через 50 ч реакционный раствор добавляют к ледяной воде, добавляют дихлорметан, после чего значение рН смеси доводят до 8 с помощью 6 н. раствора гидроксида натрия и насыщенного раствора бикарбоната натрия. Отделяют органическую фазу. Водную фазу дважды экстрагируют дихлорметаном. Органические фазы объединяют и промывают небольшим количеством дистиллированной воды. Затем органический 16 слой сушат над безводным сульфатом натрия,фильтруют и концентрируют в вакууме на роторном испарителе. Концентрированный остаток хроматографируют на силикагеле (элюент: дихлорметан/метанол в соотношении 100:1). Основную фракцию концентрируют и обрабатывают этилацетатом, в процессе чего кристаллизуется указанное в заголовке соединение в виде твердого вещества желтого цвета. Этот осадок отфильтровывают под вакуумом и сушат до постоянного веса в вакуумной сушильной печи при 50 С. В результате получают 4,22 г(57%, эи 95%, ЖХВР с использованием сорбента типа Daicel Chiracel) указанного в заголовке соединения с tпл 231-234 С. 12. (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,2-h][1,7]нафтиридин-7-она (эи 90%, ЖХВР с использованием сорбента типа Daicel Chiracel) суспендируют в 60 мл метанола и охлаждают до температуры в диапазоне от -5 до 0 С в бане метанол-лед. При этой температуре шпателем в течение 0,5 ч добавляют борогидрид натрия(0,81 г, 21,47 ммоля) (выделяется газ). После завершения добавления смесь перемешивают еще в течение 10 мин и затем концентрируют в вакууме на роторном испарителе при температуре бани 40 С. Полученный маслянистый остаток растворяют в дистиллированной воде и трижды экстрагируют хлороформом. Органические фазы объединяют и промывают небольшим количеством воды, затем сушат с использованием безводного сульфата натрия и фильтруют. Фильтрат концентрируют в вакууме на роторном испарителе и совместно упаривают с ацетоном, при этом кристаллизуется указанное в заголовке соединение. Осадок отфильтровывают,промывают ацетоном и сушат до постоянного веса при 50 С в вакуумной сушильной печи. Таким путем получают 5,15 г (85,3%, эи 90%,ЖХВР с использованием сорбента типа DaicelChiracel) указанного в заголовке соединения в виде бесцветных кристаллов с tпл 206-209 С. 13. (7S,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2 г маточного раствора из примера 12 хроматографируют на силикагеле (элюент: этилацетат/метанол в соотношении 19:1), получая 0,35 г указанного в заголовке соединения в виде масла, которое кристаллизуется после добавления этилацетата. tпл 199-200 С (этилацетат). 14. (8R,9R)-3-формил-8-гидрокси-2-метил 7-оксо-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7] нафтиридин.(8R,9R)-8-гидрокси-2,3-диметил-7-оксо-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин (1 г) растворяют в 20 мл безводного хлороформа и добавляют 5 г марганцeвокислого 17 калия. После перемешивания реакционной смеси в течение 40 дней при комнатной температуре отфильтровывают твердые частицы. Фильтрат дважды хроматографируют на силикагеле(элюенты: дихлорметан/метанол в соотношении 13/1), получая 0,07 г указанного в заголовке соединения в виде полутвердого продукта. 15. (7R,8R,9R)-3-гидроксиметил-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 0,07 г (8R,9R)-3-формил-8-гидрокси-2 метил-7-оксо-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина растворяют в 5 мл безводного метанола и добавляют 0,1 г борогидрида натрия. Смесь перемешивают в течение 30 мин и концентрируют в вакууме. Маслянистый остаток распределяют между водой и хлороформом. Отделяют органический слой, сушат над безводным сульфатом натрия и концентрируют. Продукт очищают экспресс-хроматографией на силикагеле (элюент: дихлорметан/метанол в соотношении 9/1), получая 0,05 г указанного в заголовке соединение в виде полутвердого продукта. 1[1,7]нафтиридина растворяют в 5 мл безводного ацетона и 10 мл безводного N,N-диметилформамида. Добавляют 2,2-диметоксипропан(20 мл) и моногидрат паратолуолсульфоновой кислоты (0,68 г) и смесь перемешивают в течение 20 ч при комнатной температуре. Реакционную смесь распределяют между водой и дихлорметаном. Отделяют органический слой,промывают водой и сушат над безводным сульфатом натрия. После выпаривания растворителя остаток хроматографируют на силикагеле (элюент: этилацетат/метанол в соотношении 20/1),получая 0,2 г указанного в заголовке соединения в виде бесцветных игольчатых кристаллов,tпл 231-232 С (с разлож., диэтиловый эфир). Исходные продукты А. 2,3-Диметил-7-(3-фенил-1-оксо-2 пропенил)-8-пивалоиламиноимидазо[1,2-а] пиридин. Метод А. а) 7-Трибутилолово-2,3-диметил-8-пивалоиламиноимидазо[1,2-а]пиридин. Раствор, содержащий 1 г 2,3-диметил-8 пивалоиламиноимидазо[1,2-а]пиридина в 40 мл диэтилового эфира, обрабатывают, добавляя по каплям при -78 С 8 мл 1,5 М раствора трет 002402 18 бутиллития в н-гексане. Смесь перемешивают в течение 15 мин и затем обрабатывают 3,3 мл хлорида три-н-бутилолова. Затем внутренней температуре дают подняться до комнатной температуры, смесь сливают на ледяную воду и трижды экстрагируют этилацетатом, объединенные экстракты промывают небольшим количеством воды и сушат над карбонатом калия,растворитель отгоняют в вакууме и полученное масло хроматографируют на силикагеле, используя в качестве элюента смесь этилацетат/петролейный эфир (1:3). Таким путем получают 1,3 г 7-трибутилолово-2,3-диметил-8 пивалоиламиноимидазо[1,2-а]пиридина в виде вязкого масла. б) 2,3-Диметил-7-(3-фенил-1-оксо-2-пропенил)-8-пивалоиламиноимидазо[1,2-а]пиридин. Раствор, содержащий 1 г 7-трибутилолово 2,3-диметил-8-пивалоиламиноимидазо[1,2-а] пиридина в 15 мл тетрагидрофурана, последовательно обрабатывают 85 мг хлорида лития, 60 мг хлорида бис(ацетонитрил)палладия (II) и 340 мг циннамоилхлорида. Смесь перемешивают при 60 С в течение 3 ч. После охлаждения до 0 С отфильтровывают под вакуумом желтоватый осадок и промывают небольшим количеством тетрагидрофурана и диэтилового эфира. После сушки в вакууме получают 720 мг указанного в заголовке соединения в виде гидрохлорида с tпл 263-265 С (разл.). Метод Б. а) 2,3-Диметил-7-(3-фенил-1-гидрокси-2 пропенил)-8-пивалоиламиноимидазо[1,2-а] пиридин. К раствору, содержащему 41 г 8 пивалоиламино-2,3-диметилимидазо[1,2-а]пиридина, при интенсивном перемешивании добавляют по каплям в атмосфере аргона как защитного газа 320 мл имеющегося в продаже 1,5 М раствора трет-бутиллития в н-пентане таким образом, чтобы температура не превышала-70 С. После перемешивания при -78 С в течение еще 15 мин по каплям добавляют раствор,содержащий 61 г коричного альдегида в 50 мл безводного диэтилового эфира (внутренняя температура -68 С). Затем смеси дают нагреться до комнатной температуры, осторожно сливают на ледяную воду и трижды экстрагируют этилацетатом общим объемом 500 мл, красновато-окрашенную органическую фазу промывают дистиллированной водой, сушат над сульфатом натрия и растворитель отгоняют под вакуумом. Оставшуюся желтоватую суспензию обрабатывают диэтиловым эфиром. Полученные кристаллы отфильтровывают под вакуумом. В результате получают 30 г 2,3-диметил-7-(3-фенил 1-гидрокси-2-пропенил)-8-пивалоиламиноимидазо[1,2-а]пиридина с tпл 194-195 С. б) 2,3-Диметил-7-(3-фенил-1-оксо-2-пропенил)-8-пивалоиламиноимидазо[1,2-а]пиридин. Раствор, содержащий 35,5 г 2,3-диметил-7(3-фенил-1-гидрокси-2-пропенил)-8-пивалоил 19 аминоимидазо[1,2-а]пиридина в 900 мл трихлорметана, обрабатывают 60 г двуокиси марганца и интенсивно перемешивают в течение 20 ч при комнатной температуре. Затем смесь фильтруют, фильтрат концентрируют под вакуумом досуха и полученное масло обрабатывают небольшим количеством диизопропилового эфира. Образовавшиеся при этом кристаллы отфильтровывают под вакуумом. В результате получают 31,5 г указанного в заголовке соединения с tпл 108-110 С. Б. 7-[3-(2-Хлорфенил)-1-оксо-2-пропенил]8-пивалоиламино-2,3-диметилимидазо[1,2-а] пиридин. Работая аналогично примеру А метод А и используя 2-хлорциннамоилхлорид, получают указанное в заголовке соединение (выход 42%) в виде гидрохлорида с tпл 158 -160 С. В. 7-[3-(2,6-Дихлорфенил)-1-оксо-2-пропенил]-8-пивалоиламино-2,3-диметилимидазо[1,2 а]пиридин. Работая аналогично примеру А метод А и используя 2,6-дихлорциннамоилхлорид, получают указанное в заголовке соединение (выход 51%) в виде гидрохлорида с tпл 218-219 С. Г. 7-[3-(2-Трифторметилфенил)-1-оксо-2 пропенил]-8-пивалоиламино-2,3-диметилимидазо[1,2-a]пиридин. Работая аналогично примеру А метод А и используя 2-трифторметилциннамоилхлорид,получают указанное в заголовке соединение(выход 12%) в виде гидрохлорида с tпл 206208 С. Д. 2,3-Диметил-7-(2,3-эпокси-1-оксо-3 фенилпропил)-8-пивалоиламиноимидазо[1,2-а] пиридин. Смесь, содержащую 4 г 2,3-диметил-7-(3 фенил-1-оксо-2-пропенил)-8-пивалоиламиноимидазо[1,2-а]пиридина в 60 мл ацетона и 400 мг гидроксида натрия в 12 мл воды, обрабатывают по каплям при интенсивном перемешивании в течение 20 мин при 30 С 5,6 мл имеющегося в продаже водного раствора перекиси водорода 30%-ной крепости. После перемешивания при 30 С еще в течение 30 мин смесь охлаждают до 0 С и обрабатывают смесью, содержащей 60 мл воды, 13 г тиосульфата натрия и 30 мл этилацетата. После разделения фаз водную фазу экстрагируют 20 мл этилацетата. Органические фазы объединяют, промывают небольшим количеством воды и сушат над карбонатом калия. После отгонки растворителя под вакуумом остаток в виде масла сушат в глубоком вакууме. В результате получают 4 г указанного в заголовке соединения в виде аморфной массы. Е. 2,3-Диметил-7-[(2S,3R)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-8-пивалоиламиноимидазо[1,2-а]пиридин. 60 г (0,245 моля) 2,3-диметил-8-пивалоиламиноимидазо[1,2-а]пиридина растворяют в 1,5 л безводного диэтилового эфира в атмосфере аргона без доступа влаги и охлаждают до -75 С. 20 С помощью гибкой иглы в течение 30 мин по каплям добавляют 408 мл (0,612 моля) раствора трет-бутиллития (1,5 М в н-пентане) таким образом, чтобы температура не превышала -65 С. Образуется суспензия красного цвета. После завершения добавления суспензию перемешивают при -75 С еще в течение 30 мин. Затем в течение 30 мин при -65 С медленно добавляют по каплям 1/3 раствора, содержащего 145 г метил-(2S,3R)-2,3-O-изопропилиден-3-фенилпропионата (эи 99,05%, ЖХВР с использованием сорбента типа Daicel Chiracel) в 150 мл абсолютного ТГФ. Затем быстро (5 мин) по каплям добавляют оставшееся количество, при этом происходит температура повышается до -60 С. После завершения добавления удаляют охлаждающую баню. После того как внутренняя температура достигнет -30 С, добавляют 20 мл метанола, а после повышения внутренней температуры до 0 С добавляют 200 мл дистиллированной воды. Водную фазу отделяют с помощью делительной воронки, органическую фазу промывают пять раз дистиллированной водой порциями по 100 мл, а затем органическую фазу трижды экстрагируют серной кислотой 10%-ной крепости (200 мл, 50 мл, 50 мл). Фазы, экстрагированные серной кислотой, объединяют, обрабатывают 200 мл дихлорметана и при охлаждении на льду и интенсивном перемешивании значение рН доводят до 2,3 с помощью 10 н. раствора гидроксида натрия. Отделяют органическую фазу. Водную фазу экстрагируют 30 мл дихлорметана. Объединенные дихлорметановые фазы дважды промывают небольшим количеством дистиллированной воды. Затем органическую фазу сушат над безводным сульфатом натрия и растворитель полностью отгоняют под вакуумом. Образуется продукт в виде масла коричневого цвета, который обрабатывают 50 мл диэтилового эфира. После внесения затравки образуются кристаллы, которые отфильтровывают после выстаивания в течение ночи и промывают диэтиловым эфиром. После сушки в вакууме получают 57,7 г (выход 52,5%, эи 99,ЖХВР с использованием сорбента типа DaicelChiracel) указанного в заголовке соединения в виде порошка светло-желтого цвета с tпл 7680 С. Промышленная применимость Соединения формулы I и их соли обладают ценными фармакологическими свойствами, которые обусловливают их практическую применимость. В частности, они обладают выраженным ингибирующим действием в отношении секреции желудочных кислот и высокой защитной активностью в отношении желудка и кишечника теплокровных животных, прежде всего человека. В этом отношении соединения по изобретению отличаются высокой избирательностью действия, большой продолжительностью действия, очень хорошей активностью в отношении тонкого кишечника, отсутствием 21 значительных побочных действий и широким спектром терапевтического действия. В контексте настоящего изобретения понятие "защита желудка и кишечника" означает предупреждение и лечение желудочнокишечных заболеваний, в частности воспалительных болезней и повреждений желудочнокишечного тракта (например, таких как язвы желудка, язвы двенадцатиперстной кишки, гастриты, функциональная гастропатия, вызванная повышенной кислотностью или лекарственными средствами), которые могут быть вызваны, например, микроорганизмами (например,Helicobacter pylory), бактериальными токсинами, лекарственными средствами (например, определенными противовоспалительными и противоревматическими средствами), химическими веществами (например, этанолом), желудочной кислотой или стрессовыми ситуациями. С использованием различных моделей, на которых определяли характеристики противоязвенного действия и ингибирования секреции,неожиданно было установлено, что благодаря своим исключительно эффективным свойствам соединения по изобретению существенно превосходят известные в данной области соединения. Принимая во внимание эти свойства, соединения формулы I и их фармакологически переносимые соли являются чрезвычайно ценными для применения в терапии человека и ветеринарии, где их применяют, в частности для лечения и/или профилактики заболеваний желудка и/или кишечника. Поэтому изобретение также относится к соединениям по изобретению, предназначенным для применения при лечении и/или профилактике вышеуказанных заболеваний. Объектом изобретения также является применение соединений по изобретению для приготовления лекарственных средств, которые применяют при лечении и/или профилактике вышеуказанных заболеваний. Кроме того, объектом изобретения является применение соединений по изобретению для лечения и/или профилактики вышеуказанных болезней. Изобретение относится также к лекарственным средствам, которые содержат одно или несколько соединений формулы I и/или их фармакологически приемлемых солей. Лекарственные средства получают хорошо известными способами, которые известны специалистам в данной области. В качестве лекарственных средств фармакологически активные соединения по изобретению (активные вещества) применяют либо индивидуально, либо предпочтительно в сочетании с пригодными фармацевтическими вспомогательными веществами или эксципиентами в форме таблеток, таблеток с покрытием, капсул, суппозиториев, бляшек(например, в виде чрескожно действующих терапевтических систем (ЧТC, эмульсий, сус 002402 22 пензий или растворов, в которых содержание активного вещества предпочтительно составляет от 0,1 до 95%, и при этом соответствующим выбором вспомогательных веществ и эксципиентов можно изготовить фармацевтическую форму для введения (например, форму с замедленным высвобождением или форму, предназначенную для всасывания в области тонкого кишечника), которая обеспечит оптимальную эффективность и/или требуемое начало действия активного вещества. Специалистам в данной области известны вспомогательные вещества или эксципиенты,которые пригодны для требуемой фармацевтической композиции. Помимо растворителей,гелеобразующих агентов, основ для суппозиториев, вспомогательных веществ для таблеток и других носителей для действующего вещества,можно использовать, например, антиоксиданты,диспергаторы, эмульгаторы, пеногасители, корригенты, консерванты, солюбилизаторы, красители или, в частности, вещества, усиливающие проникающую способность, и комплексобразующие агенты (например, циклодекстрины). Активные вещества могут вводиться орально, парэнтерально или чрескожно. В целом, в терапии человека для достижения требуемого результата в случае орального введения предпочтительно вводить активное(ые) вещество(а) в суточной дозе приблизительно от 0,01 до приблизительно 20, предпочтительно от 0,05 до 5, в частности от 0,1 до 1,5 мг/кг массы тела, при необходимости в виде нескольких, предпочтительно от 1 до 4 разделенных доз. В случае парэнтерального введения могут быть использованы аналогичные или(прежде всего в случае внутривенного введения активных веществ), как правило, меньшие дозы. Оптимальная доза и метод введения действующих веществ, требуемые в каждом случае, легко могут быть определены специалистом в данной области на основе его практического опыта. Если соединения по изобретению и/или их соли применяют для лечения вышеуказанных болезней, то фармацевтические композиции также могут содержать один или несколько фармакологически активных компонентов из других фармацевтических групп. В качестве примеров можно назвать транквилизаторы (например, из группы бензодиазапинов, например диазепам), спазмолитические средства (например, биетамиверин или камилофин), антихолинергетические средства (например, оксифенциклимин или фенкарбамид), местные анестетики (например, тетракаин или прокаин) и при необходимости также ферменты, витамины или аминокислоты. В этой связи, в частности, предпочтительной является комбинация соединений по изобретению с лекарственными средствами, которые ингибируют секрецию кислоты, такими как,например, Н 2-блокаторы (например, циметидин, 23 ранитидин), ингибиторы Н+/K+-АТФазы (например, омепразол, пантопразол), а также с так называемыми периферическими антихолинергетическими средствами (такими как, например,пирензепин, телензепин) и с антагонистами гастрина с целью аддитивного или сверхаддитивного увеличения основного действия и/или устранения или уменьшения побочных действий,или же комбинация с веществами, обладающими антибактериальной активностью (такими как, например, цефалоспорины, тетрациклины,пенициллины, макролиды, нитроимидазолы или в альтернативном варианте соли висмута) для борьбы с Helicobacter pylori. В качестве примеров таких компонентов, используемых в сочетании с активными веществами по изобретению и обладающими антибактериальной активностью,можно назвать мезлоциллин, ампициллин,амоксициллин, цефалотин, цефокситин, цефотаксим, имипенем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин, азитромицин и их комбинации(например, кларитромицин + метронидазол). Фармакология Исключительно высокое защитное действие в отношении желудка и ингибирующее действие в отношении секреции желудочных кислот соединений по изобретению может быть подтверждено в экспериментах на животныхмоделях. Номера соединений по изобретению,исследованных в приведенных ниже экспериментах, соответствуют номерам этих соединений в примерах. Исследование ингибирующего секрецию действия с помощью перфузии желудка крысы В приведенной ниже таблице А представлены результаты действия in vivo соединений по изобретению после внутривенного введения на стимулируемую пентагастрином секрецию кислоты в подвергнутом перфузии желудке крысы. Методика Брюшную полость крыс, подвергнутых анестезии (крыса линии CD, самка, 200-250 г; уретан 1,5 г/кг, в.м.), вскрывали после трахеотомии путем срединного разреза верхней части брюшной полости и трансорально вводили и фиксировали в пищеводе один катетер из ПВХ,а другой вводили через привратник таким образом, чтобы концы трубки проходили в просвет желудка. Катетер, выходящий из привратника,выводили наружу через боковое отверстие в правой стенке брюшной полости. 24 После тщательного промывания (приблизительно 50-100 мл) через желудок непрерывно пропускали теплый физиологический растворNaCl при 37 С (0,5 мл/мин, рН 6,8-6,9; BraunUnita I). Для вытекающей жидкости, которую в каждом случае собирали каждые 15 мин, определяли значение рН (pH-meter 632, стеклянный электрод ЕА 147; =5 мм, Metrohm) и путем титрования свежеприготовленным 0,01 н. раствором NaCl до значения рН, равного 7 (Dosimat 665, Metrohm), определяли концентрацию НСl. Желудочную секрецию стимулировали путем непрерывной внутривенной инфузии 1 мкг/кг (т.е. 1,65 мл/ч) пентагастрина (в левую бедренную вену) приблизительно через 30 мин после окончания операции (т.е. после анализа двух предварительных фракций). Тестируемые соединения вводили внутривенно в виде жидкости объемами 1 мл/кг через 60 мин после начала непрерывной инфузии пентагастрина. Температуру тела животных поддерживали на постоянном уровне в 37-38 С с помощью инфракрасного облучения и обогревающих подушек (автоматический непрерывный контроль с помощью ректального датчика температуры). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиС 1-С 4 алкил,R3 обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил, С 1-С 4 алкокси-, С 1-С 4 алкокси-С 1-С 4 алкокси- или R4a и R4b вместе обозначают О (кислород),один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил, С 1-С 4 алкокси- или R5a и R5b вместе обозначают О (кислород),или в которой один из заместителей R4a и R4b, с одной стороны, и один из заместителей R5a и R5b, с другой стороны, обозначают в каждом случае водород, а другие заместители в каждом случае вместе образуют метилендиоксигруппу (-ОСН 2-O-) или этилендиоксигруппу (-О-СН 2-СН 2 О-),причем R4a, R4b, R5a и R5b одновременно не обозначают водород, 25R6 обозначает водород или галогентрифторметил,R7 обозначает водород или галоген,или его соли,предпочтительно этим соединением может служить (7S,8R,9R)-7,8-изопропилидендиокси 2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин или его соль. 2. Соединение формулы I по п.1, в которомR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или гидроксиС 1-С 4 алкил,R3 обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу, или в которомR5a и R5b вместе обозначают О (кислород),причем R4a, R4b, R5a и R5b не обозначают одновременно водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и его соли. 3. Соединение по п.1, имеющее формулу IR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил,R3 обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу,один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил или С 1-С 4 алкоксигруппу,причем R4a, R4b, R5a и R5b не обозначают одновременно водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и его соли. 4. Соединение формулы I по п.3, в которойR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил,R3 обозначает водород,R4a обозначает водород,R4b обозначает гидроксил или С 1 С 4 алкоксигруппу, 002402R5a обозначает водород, гидроксил или С 1 С 4 алкоксигруппу,R5b обозначает водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и его соли. 5. Соединение формулы I по п.3, в которойR1 обозначает С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил,R3 обозначает водород,R4a обозначает водород,R4b обозначает гидроксил,R5a обозначает гидроксил,R5b обозначает водород,R6 обозначает водород, галоген или трифторметил иR7 обозначает водород или галоген,и его соли. 6. Соединение по п.1, выбранное из группы, включающей 7,8-дигидрокси-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,9-(2-хлорфенил)-2,3-диметил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,9-(2,6-дихлорфенил)-2,3-диметил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,9-(2-трифторметилфенил)-2,3-диметил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,7-гидрокси-2,3-диметил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин,9-(2-хлорфенил)-7-гидрокси-2,3-диметил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин,9-(2,6-дихлорфенил)-7-гидрокси-2,3 диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин,9-(2-трифторметилфенил)-7-гидрокси-2,3 диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин,8-гидрокси-2,3-диметил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он,(7S,8R,9R)-2,3-диметил-7,8-дигидрокси-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин,(8R,9R)-3-формил-8-гидрокси-2-метил-7 оксо-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h] 9. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически переносимую соль вместе с обычными фармацевтическими вспомогательными веществами и/или эксципиентами. 10. Применение соединений по п.1 и их фармакологически переносимых солей для при 28 готовления лекарственных средств, предназначенных для предупреждения и лечения желудочно-кишечных заболеваний, обусловленных повышенной секрецией желудочного сока.
МПК / Метки
МПК: A61K 31/435, C07D 471/14, A61P 1/04
Метки: тетрагидропиридо-соединения
Код ссылки
<a href="https://eas.patents.su/15-2402-tetragidropirido-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрагидропиридо-соединения</a>
Предыдущий патент: N-связанные мочевины и карбаматы сложных гетероциклических тиоэфиров
Следующий патент: Лаборатория на диске
Случайный патент: Катализатор