Хроменовые соединения, способ их получения и фармацевтические композиции на их основе
Номер патента: 17774
Опубликовано: 29.03.2013
Авторы: Симетьер Бернар, Де-Нантой Гийом, Миллан Марк, Декен Анне
Формула / Реферат
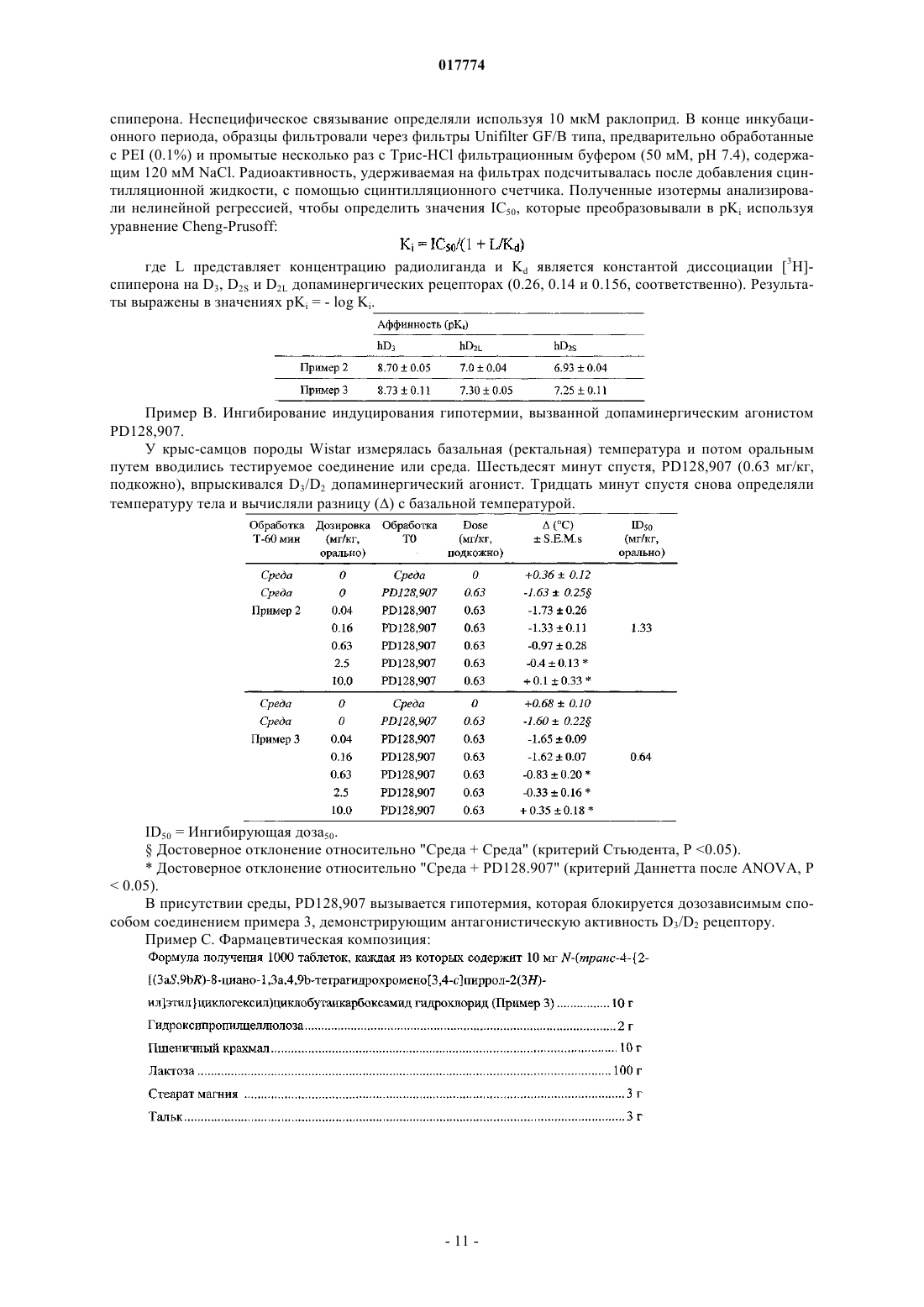
1. Соединения формулы (I)
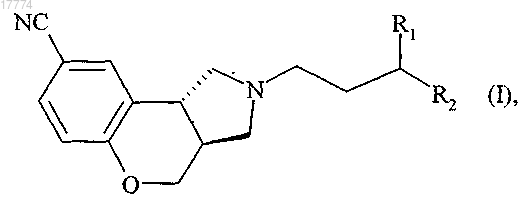
в которой R1 и R2 вместе образуют следующую углеродсодержащую цепь:
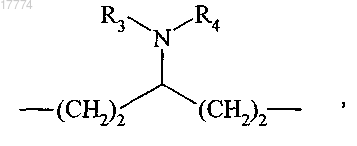
где R3 представляет собой атом водорода или линейную или разветвленную (C1-С6)алкильную группу,
R4 представляет собой
атом водорода,
линейную или разветвленную (C1-С6)алкильную, арильную, гетероарильную или 3,4-диоксоциклобутенильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С6)алкила; линейного или разветвленного (C1-С6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (C1-С6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (C1-С6)алкильными группами,
группу -COR5,
группу -SO2R5,
R5 представляет собой линейную или разветвленную (C1-С6)алкильную, (С3-С8)циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С6)алкила; линейного или разветвленного (С1-С6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (С1-С6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (С1-С6)алкильными группами, или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют 5-8-членное кольцо, необязательно замещенное одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С6)алкила; гидроксигруппы; оксогруппы и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (С1-С6)алкильными группами,
где арильная группа означает фенильную или нафтильную группу,
гетероарильная группа означает моноциклическую или бициклическую группу, в которой по меньшей мере одно кольцо является ароматическим, содержащую от 5 до 11 членов кольца и от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, и
гетероциклоалкильная группа относится к моно- или бициклической неароматической группе, содержащей от 4 до 11 членов кольца и имеющей от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы,
их энантиомеры, их диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотами или основаниями.
2. Соединения формулы (I) по п.1, отличающиеся тем, что группа R3 представляет собой атом водорода или метильную группу.
3. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой атом водорода или линейную или разветвленную (C1-С6)алкильную группу.
4. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой группу -COR5, где R5 определено в п.1.
5. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой группу -SO2R5, где R5 определено в п.1.
6. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой линейную или разветвленную (С1-С6)алкильную группу.
7. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную (С3-С8)циклоалкильную группу.
8. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную арильную группу.
9. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную гетероарильную группу.
10. Соединения формулы (I) по п.1, отличающиеся тем, что R3 и R4 вместе с атомом азота, с которым они связаны, образуют необязательно замещенное 5-членное кольцо.
11. Соединения формулы (I) по п.1, которые представляют собой:
(3aS,9bR)-2-[2-(транс-4-аминоциклогексил)этил]-1,2,3,3a,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил;
(3aS,9bR)-2-{2-[транс-4-(метиламино)циклогексил]этил}-1,2,3,3a,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил;
(3aS,9bR)-2-{2-[транс-4-(диметиламино)циклогексил]этил}-1,2,3,3а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)ацетамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3a,4,9b-тетрагидрохромено[3,4-c]пиррол-2(3H)-ил]этил}циклогексил)-2,2-диметилпропанамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)-N-метилацетамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)циклобутанкарбоксамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3a,4,9b-тетрагидрохромено[3,4-c]пиррол-2(3H)-ил]этил}циклогексил)циклопропанкарбоксамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)-3,3-дифторциклобутанкарбоксамид;
цис-N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)-3-гидроксициклобутанкарбоксамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)-N-метилциклобутанкарбоксамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)бензамид;
4-хлор-N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)бензамид;
N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3a,4,9b-тетрагидрохромено[3,4-c]пиррол-2(3H)-ил]этил}циклогексил)-4-фторбензолсульфонамид;
4-хлор-N-(транс-4-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)бензолсульфонамид;
N-(транс-А-{2-[(3aS,9bR)-8-циано-1,3а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил]этил}циклогексил)-3-пиридинсульфонамид;
(3aS,9bR)-2-{2-[транс-4-(2-оксопирролидин-1-ил)циклогексил]этил}-1,2,3,3а,4,9b-гексагидрохромено[3,4-с] пиррол-8-карбонитрил.
12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II)
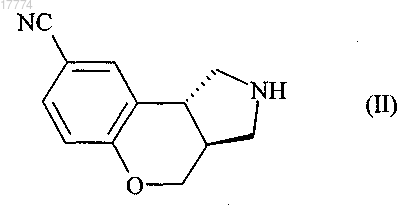
подвергают реакции восстановительного аминирования в присутствии восстановительного агента, выбранного из триацетоксиборогидрида натрия или цианоборогидрида натрия, с соединением формулы (III)
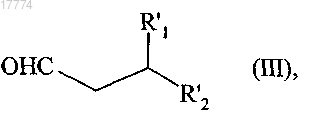
в которой R'1 и R'2 вместе образуют следующую углеродсодержащую цепь
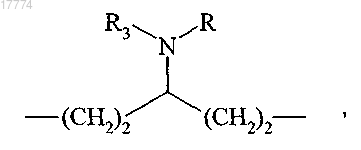
в которой R3 определено в п.1 и R представляет собой защитную группу для аминной функции, представляющую собой трет-бутилоксикарбонильную группу, с получением соединения формулы (IV)
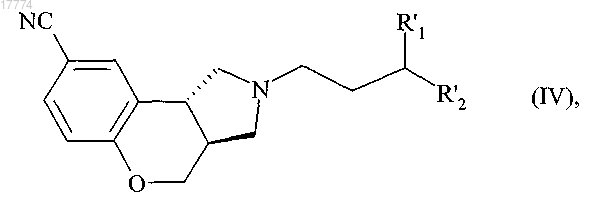
в которой R'1 и R'2 определены выше,
которое после этого подвергают реакции снятия защиты с аминной группы, в присутствии трифторуксусной кислоты, с получением соединения формулы (I/a), в конкретном случае соединений формулы (I)
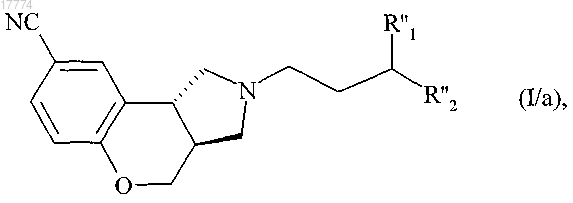
в которой R''1 и R''2 вместе образуют следующую углеродсодержащую цепь
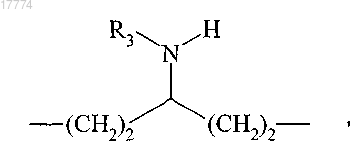
в которой R3 определено выше,
где соединение формулы (I/a) после этого подвергают, в случае необходимости,
или реакции восстановительного аминирования с восстанавливающим агентом, выбранным из триацетоксиборогидрида натрия или цианоборогидрида натрия, в присутствии соединения формулы (V)
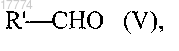
в которой R' представляет собой атом водорода или линейную или разветвленную (С1-С5)алкильную группу;
или действию соединения формулы (VI)
где Y представляет собой атом галогена или гидроксигруппу или линейную или разветвленную (С1-С6)алкоксигруппу, и R" представляет собой арильную, гетероарильную, 3,4-диоксоциклобутенильную,
-COR5 или -SO2R5 группу, где R5 определено в п.1,
с получением соединения формулы (I/b), в конкретном случае соединений формулы (I)
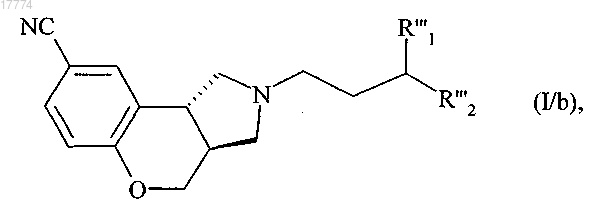
в которой R'"1 и R'''2 вместе образуют следующую углеродсодержащую цепь:
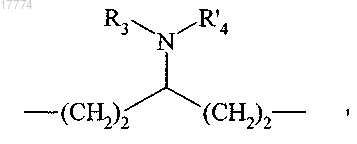
в которой R3 определено выше и R'4 представляет собой линейную или разветвленную (С1-С6)алкильную, арильную, гетероарильную, 3,4-диоксоциклобутенильную, -COR5 или -SO2R5 группу, где R5 определено выше, для соединений формул (I/a) и (I/b), возможна их дальнейшая очистка, превращение, если желательно, в их соли присоединения с фармацевтически приемлемыми кислотами или основаниями и разделение, когда это целесообразно, на их изомеры, если они существуют.
13. Фармацевтическая композиция, обладающая активностью в отношении дофаминергических рецепторов, содержащая в качестве активного компонента соединение по любому из пп.1-11, отдельно или в комбинации с одним или более инертными, нетоксичными и фармацевтически приемлемыми вспомогательными средствами или носителями.
14. Фармацевтическая композиция по п.13, предназначенная для лечения или предупреждения шизофрении и психозов, неправильного употребления лекарств, заболеваний, вызванных стрессами, возбужденных состояний, токсикомании, лечения униполярных и биполярных депрессивных состояний, импульсивных поведений, обсессивно-компульсивных заболеваний, агрессивности, лечении болезни Паркинсона, эссенциального дрожания, заболеваний памяти и нарушений познавательных способностей, связанных с психиатрическими и неврологическими заболеваниями, деменции, болезни Альцгеймера, нарушения развития у детей или подростков, лечения боли, тошноты, преждевременной эякуляции, а также для почечной защиты.
15. Применение соединений формулы (I) по любому из пп.1-11 в производстве лекарственных средств для лечения или предупреждения шизофрении и психозов, неправильного употребления лекарств, заболеваний, вызванных стрессами, возбужденных состояний, токсикомании, лечения униполярных и биполярных депрессивных состояний, импульсивных поведений, обсессивно-компульсивных заболеваний, агрессивности, лечения болезни Паркинсона, эссенциального дрожания, заболеваний памяти и нарушений познавательных способностей, связанных с психиатрическими и неврологическими заболеваниями, деменции, болезни Альцгеймера, нарушения развития у детей или подростков, лечения боли, тошноты, преждевременной эякуляции, а также для почечной защиты.
Текст
ХРОМЕНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ в которой R1 и R2 вместе образуют следующую углеродсодержащую цепь где R3 представляет собой атом водорода или алкильную группу, R4 представляет собой атом водорода или алкильную, арильную, гетероарильную, 3,4-диоксоциклобутенильную,алкилкарбонильную, циклоалкилкарбонильную, гетероциклоалкилкарбонильную, бензоильную,арилсульфонильную или гетероарилсульфонильную группу, каждая из этих групп необязательно замещена, или R3 и R4 вместе с атомом азота, который их несет, образуют 5-8-членное кольцо,образованное таким образом кольцо необязательно замещено.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Изобретение относится к новым хроменовым соединениям, к способу их получения и к фармацевтическим композициям, содержащим их. Хорошо установлено, что проектирование дофаминергических путей к лимбическим структурам и лобной коре играет важные роли в контроле настроения, в подкреплении симптомов, в моторной функции и восприятии. D3 дофаминергические рецепторы присутствуют в высоких концентрациях в этих кортикальных и лимбических структурах, таких как центр удовольствия, бледный шар, таламус и лобная кора, до тех пор пока их плотность является относительно низкой в стриатуме. Как следствие, они являются предпочтительной мишенью для психотропных лекарственных средств (Psychopharmacology, 1998,135, 1-16; CNS Neural. Disord. Drag Targets, 2006, 5, 25-43). Блокирование D2 рецепторов приводит к улучшению позитивных симптомов, но только в объединении с каталепсией, с уменьшением когнитивной функции и с эффектами, которые могут вызвать депрессию (CNS Drug Discov., 2006, 1, 271-88; Drug Discov. Today, 2005, 10, 917-25). Блокирование D3 рецепторов, однако, несмотря на то что их влияние на позитивные симптомы точно не продемонстрировано, имеет благоприятное влияние на настроение, улучшает когнитивную функцию и противодействует каталепсии (Therapie 2008, 63, 187-229). Эти исследования указывают, что соединение, имеющее оптимизированный профиль, с целью предпочтительной антагонистической активности по отношению к D3 рецепторам и адекватной антагонистической активности по отношению к D2 рецепторам, должно находиться в пределах идеального "терапевтического окна" для оптимального контроля всех симптомов шизофрении пока освобождаются собственно экстрапирамидальные побочные явления (каталепсия) и другие недостатки, объединенные с высокоселективным блокированием каждого из дофаминергических рецепторов (Drug Discov. Today,2005, 10, 917-25; Therapie 2008, 63, 187-229). На базе этих исследований и различных результатов, задокументированных в литературе будет подразумеваться, что преимущество для D3 над D2 рецепторами обеспечат соединения изобретения с главным значением в применении в качестве лекарственных средств в лечении шизофрении и других психозов (Drug Discov. Today, 2005, 10, 917-25; Neurosci. Behav. Rev., 2001, 25, 427-43), и неправильного использования лекарств, включая "рецидивизм" (Brain Res. Rev., 2005, 49, 77-105; J. Med. Chem., 2005,48, 3664-79): например, с психостимулированием кокаином и амфетамином (Int. J. Neuropsychopharmacol., 2007, 10, 167-81; J. Pharmacol. Exp. Then, 2007, 321, 573-82), никотином (Neuropsychopharmacol.,2003, 28, 1272-80; Int. J. Neuropsychopharmacol., 2006, 9, 585-602), опиатами (Synapse, 2003, 48, 154-6;J., 2007, 20, 2223-33). Продукты изобретения также применимы в лечении нарушений, вызванных стрессом, таким как состояния страха и токсикомания (Psychopharmacology, 2004, 176, 57-65; Prog. Neurobiol.,2003, 70, 83-244), лечении униполярного и биполярного депрессивных состояний (Eur. Neuropsychopharmacol., 2008, 18, 271-7; Mol. Interv., 2008, 8, 230-41), лечении импульсивных поведений, таких как обсессивно-компульсивные растройства (Psychiatry Res., 2003, 119, 1-10; Am. J. Med. Genet. В Neuropsychiatr.Genet., 2006, 141B, 409-13), и агрессивность (J. Neural. Transm., 2003, 110, 561-72), лечении болезни Паркинсона, когда их вводят самостоятельно или в сочетании с дофаминергическими агонистами или LDOPA (Neurobiol. Dis., 2009, in press; Exp. Neurol., 2004, 188, 128-38), лечении эссенциального тремора(PNAS, 2006, 103, 10753-8; Brain, 2007, 130, 1456-64), заболевания памяти и других когнитивных заболеваний, связанных с психиатрическими и неврологическими болезнями такими как деменция и болезнь Альцгеймера (Psychopharmacology, 2005, 179, 567-75; J. Neurochem., 2007, 100, 1047-61), нарушения развития у детей или подростков, таких как алекситимия и синдром дефицита внимания с гиперактивностью(Biol. Psychiatry, 2008, 65, 625-30), лечении боли, например в объединении с опиатами (Psychopharmacology, 1999, 144, 239-47; Prog. Neurobiol., 2002, 66, 355-474), или также тошноты вызванной, например,цитотоксическими средствами и дофаминергическими агонистами (J. Neural Transm., 1999, 105, 1045-61;Eur. J. Pharmacol., 1996, 301, 143-9). Соединения изобретения являются также полезными в лечении преждевременной эякуляции (J. Sex. Med. 2009, 6, 980-8; Br. J. Pharmacol. 2008, 154, 1150-9) и также в почечной защите, например в объединении с диабетом или с постоянным лечением с нейролептическим средством, разрушающим метаболизм (Lab. Investigation, 2006, 86, 262-74; Naunyn Schmiedebergs Arch.Pharmacol., 2005, 371, 420-7). Соединения изобретения, кроме того, что являются новыми, обладают особенно ценными свойствами, вследствие которых они сильно и предпочтительно связываются с D3 дофаминергическими рецепторами. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой R1 и R2 вместе образуют следующую углеродсодержащую цепь: где R3 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу,R4 представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную, арильную, гетероарильную или 3,4-диоксоциклобутенильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного(C1-С 6)алкила; линейного или разветвленного (C1-С 6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (C1-С 6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (C1-С 6)алкильными группами,группу -COR5,группу -SO2R5,R5 представляет собой линейную или разветвленную (C1-С 6)алкильную, (С 3-С 8)циклоалкильную,гетероциклоалкильную, арильную или гетероарильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С 6)алкила; линейного или разветвленного (C1-С 6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (C1-С 6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (C1-С 6)алкильными группами, илиR3 и R4, вместе с атомом азота, который их несет, образуют 5-8-членное кольцо, определенное таким образом кольцо необязательно замещено одной или более одинаковыми или различными группами,выбранными из галогена; линейного или разветвленного (C1-С 6)алкила; гидроксигруппы; оксогруппы; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (C1-С 6)алкильными группами, к их позиционным изомерам,к их энантиомерам, к их диастереоизомерам, а также к их солям присоединения с фармацевтически приемлемыми кислотами или основаниями. Среди фармацевтически приемлемых кислот здесь могут быть отмечены, не подразумевая какиелибо ограничения, соляная кислота, бромисто-водородная кислота, серная кислота, уксусная кислота,трифторуксусная кислота, молочная кислота, малоновая кислота, янтарная кислота, глутаминовая кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, щавелевая кислота, метансульфокислота,бензолсульфокислота, камфорная кислота и т. п. Среди фармацевтически приемлемых оснований здесь могут быть отмечены, не подразумевая какие-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т. п. Арильная группа подразумевает фенильную или нафтильную группу. Гетероарильная группа подразумевает моноциклическую или бициклическую группу, в которой по меньшей мере одно кольцо является ароматическим, содержащую от 5 до 11 членов кольца и от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы. Термин гетероциклоалкил относится к моно- или би-циклической, неароматической группе, содержащей от 4 до 11 членов кольца и имеющей от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы. Предпочтительной арильной группой является фенильная группа. Предпочтительными гетероарильными группами являются пиридильная и пиримидинильная группы. Предпочтительной гетероциклоалкильной группой является азетидинильная группа. В соединениях формулы (I), R3 предпочтительно представляет собой атом водорода или метальную группу. Соединения формулы (I) являются предпочтительно соединениями, в которых R4 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу. Предпочтительными соединениями изобретения являются такие, в которых R4 представляет собой группу -COR5 где R5 является таким, как определено выше. Другими предпочтительными соединениями изобретения являются такие, в которых R4 представляет собой группу -SO2R5, где R5 является таким, как определено выше. Группа R5 предпочтительно представляет собой линейную или разветвленную (C1-С 6)алкильную группу, (С 3-С 8)циклоалкильную группу, арильную группу или гетероарильную группу. Более конкретно, предпочтительными соединениями формулы (I) являются соединения, в которыхR4 представляет собой -COR5, где R5 означает линейную или разветвленную (C1-С 6)алкильную группу. Другая предпочтительная возможность для соединений формулы (I) состоит из R4 отображения-COR5, где R5 означает необязательно замещенную (С 3-С 8)циклоалкильную группу. Соединения формулы (I) предпочтительно являются соединения, в которых R4 представляет собой-COR5, где R5 означает необязательно замещенную арильную группу. Более конкретно, соединения формулы (I) являются соединениями, в которых R4 представляет собой -SO2R5, где R5 означает необязательно замещенные арильную или гетероарильную группы. Другая предпочтительная возможность состоит из R3 и R4, вместе с атомом азота, который их несет,формирующих 5-членное кольцо, образованное таким образом кольцо необязательно замещено. Предпочтительными соединениями изобретения являются:(3aS,9bR)-2-2-[транс-4-(2-оксопирролидин-1-ил)циклогексил]этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил. Соли присоединения предпочтительных соединений изобретения с фармацевтически приемлемыми кислотами или основаниями формируют неотъемлемую часть изобретения. Изобретение относится также к способу получения соединений формулы (I), отличающегося тем,что в качестве исходного материала применяется соединение формулы (II) которое подвергают реакции восстановительного аминирования в присутствии восстановительного агента, такого как триацетоксиборогидрид натрия или цианоборогидрид натрия, и соединение формулы в которой R'1 и R'2 вместе образуют следующую углеродсодержащую цепь: в которой R3 является таким, как определено выше и R представляет собой защитную группу для аминной функции, такую как, например, трет-бутилоксикарбонильная группа, с получением соединения формулы (IV) в которой R'1 и R'2 являются такими, как определено выше,которое после этого подвергают реакции снятия защиты с аминной функции, например в присутствии трифторуксусной кислоты, с получением соединения формулы (I/a), в конкретном случае соединений формулы (I) в которой R"1 и R2 вместе образуют следующую углеродсодержащую цепь в которой R3 является таким, как определено выше,которое соединение формулы (I/a) после этого, в случае необходимости, подвергают или реакции восстановительного аминирования с восстанавливающим агентом, таким как триацетоксиборогидрид натрия или цианоборогидрид натрия, в присутствии соединения формулы (V) в которой R' представляет собой атом водорода или линейную или разветвленную (С 1-С 5)алкильную группу; или действию соединения формулы (VI) где Y представляет собой атом галогена или гидроксигруппу или линейную или разветвленную (C1 С 6)алкоксигруппу, и R" представляет собой арильную, гетероарильную, 3,4-диоксоциклобутенильную,-COR5 или -SO2R5 группу, где R5 является таким, как определено выше,с получением соединения формулы (I/b), в конкретном случае соединений формулы (I) в которой R'"1 и R2 вместе образуют следующую углеродсодержащую цепь в которой R3 является таким, как определено выше и R'4 представляет собой линейную или разветвленную (С 1-С 6)алкильную, арильную, гетероарильную, 3,4-диоксоциклобутенильную, -COR5 или -SO2R5 группу, где R5 является таким, как определено выше,в случае способа получения соединения формулы (I/b,) заключающегося в использовании обычных химических реакций, осуществляют стадию сочетания с соединением формулы (I/a), с целью последовательной модификации заместителей соединения формулы (VI),для соединений формул (I/a) и (I/b), которые составляют целостность соединений формулы (I), возможна их дальнейшая очистка согласно общепринятым методам разделения, превращение, если желательно, в их соли присоединения с фармацевтически приемлемыми кислотами или основаниями и разделение, когда это целесообразно, на их изомеры, если они существуют, согласно общепринятым методам разделения. Соединения формул (II), (III), (V) и (VI) коммерчески доступны или легко доступны для специалиста в данной области техники при помощи проведения обычных химических реакций или химических реакций, описанных в литературе. Изобретение относится также к фармацевтическим композициям, включающим в качестве активного компонента по меньшей мере одно соединение формулы (I) отдельно или в комбинации с одним или больше инертными, нетоксичными вспомогательными средствами или носителями. Среди фармацевтических композиций согласно изобретению здесь могут быть отмечены более конкретно такие, которые являются подходящими для перорального, парентерального (внутривенного или подкожного) или назального введения, таблеток или драже, сублингвальных таблеток, капсул, пастилок, суппозиториев,кремов, мазей, дермальных гелей, инъецируемых препаратов и питьевых суспензий. Пригодные дозировки изменяются в зависимости от возраста и массы пациента, природы и тяжести заболевания и пути введения, которые могут назальным, ректальным, парентеральным или оральным. Как правило, однократная доза находятся в диапазоне от 1 до 500 мг на 24 ч для лечения в от 1 до 3 введений. Примеры, которые приведены далее, иллюстрируют изобретение и ни в коей мере не ограничивают его. Структуры описанных соединений подтверждены обычными спектроскопическими методами. Способы получения, описанные в данном документе ниже, дают исходные материалы, которые применяются в синтезе соединений изобретения. Способ получения 1. Метил транс-4-[(трет-бутоксикарбонил)амино]-циклогексилацетат. К смеси 3.03 г этил транс-(4-амино-циклогексил)ацетата (17.7 ммоль), полученного в 7 стадий, начиная с бицикло[2.2.2]окт-5-ен-2-карбонитрила, и 4.25 г ди-трет-бутилдикарбоната (19.54 ммоль) в 60 мл дихлорметана прибавляли 6.2 мл триэтиламина. Смесь перемешивали 2 часа при температуре окружающей среды. Прибавляли 50 мл насыщенного раствора бикарбоната натрия. Раствор экстрагировали 320 мл дихлорметана, промывали рассолом, сушили (MgSO4) и выпаривали с получением названного продукта в виде белого порошка. Способ получения 2. транс-4-[(трет-Бутоксикарбонил)амино]циклогексилацетальдегид. К раствору 1.78 г соединения способа получения 1 (6.6 ммоль) в 35 мл толуола, по каплям прибавляли, при -78 С, 11 мл 1N раствора DIBAL-H в гексане. Смесь перемешивали 10 мин при -78 С и после этого обрабатывали 1.08 мл метанола в 2 мл толуола (по каплям). Смесь оставляли нагреваться до температуры окружающей среды и быстро прибавляли, по каплям, 47 мл насыщенного водного раствора двойного калий натрия тартрата (Сегнетова соль). После перемешивания в течение 1 ч, раствор экстрагировали эфиром, промывали водой, сушили (MgSO4) и выпаривали с получением названного продукта в виде белого твердого вещества. Температура плавления: 61-63 С. Способ получения 3. Метил транс-4-[(трет-бутоксикарбонил)(метил)амино]циклогексилацетат. К раствору 4.28 г соединения способа получения 1 (15.8 ммоль) в 45 мл DMF прибавляли 1.38 мл метилйодида и потом 884 мг гидрида натрия. После перемешивания в течение 18 ч, смесь разбавляли эфиром и водой и потом прибавляли 0.1N раствор HCl до рН = 3. Раствор экстрагировали эфиром, промывали водой, сушили (MgSO4) и затем выпаривали. Очистка хроматографией на колонке с силикагелем,используя смесь циклогексан/этилацетат (90 /10) в качестве элюента дает названный продукт в виде бесцветного масла. Способ получения 4. транс-4-[(трет-Бутоксикарбонил)(метил)амино]циклогексилацетальдегид. Получали названный продукт согласно способу, описанному в способе получения 2, используя продукт, описанный в способе получения 3 в качестве исходного материала. Способ получения 5. трет-Бутил(транс-4-2-[(3aS,9bR)-8-циано-1,3a,4,9b-тетрагидрохромено[3,4-с] пиррол-2(3H)-ил]этилциклогексил)карбамат. К 30 мл дихлорметана последовательно прибавляли 1.08 г (3aS,9bR)-1,2,3,3a,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрила (синтезированного в соответствии с Bioorg. Med. Chem. Lett. 1999, 9,2059-2064) (5.42 ммоль), 1.58 г соединения способа получения 2 (6.5 ммоль) и 1.61 г триацетоксиборогидрида натрия (7.59 ммоль). Реакционную смесь перемешивали всю ночь при температуре окружающей среды. Раствор после этого промывали 1N раствором гидроксида натрия и потом рассолом, сушили(MgSO4) и выпаривали. Очистка на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (99/1/0.1) в качестве элюента дает названный продукт в виде белого порошка. Способ получения 6. трет-Бутил(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с] пиррол-2(3H)-ил]этилциклогексил)метилкарбамат. Получали названный продукт согласно способу, описанному в способе получения 5, используя в качестве исходного материала соединение, описанное в способе получения 4, вместо продукта, описанного в способе получения 2. Способ получения 7. Монометиловый эфир фталевой кислоты. Диметилфталат (15.73 ммоль) перемешивали в течение 24 ч при температуре окружающей среды в 60 мл этанола с 15.73 мл 1N раствора гидроксида натрия. Растворитель выпаривали при пониженном давлении при 40 С и реакционную смесь после этого разводили водой перед доведением рН до 3. Смесь экстрагировали этилацетатом, сушили (MgSO4) и выпаривали с получением названного продукта в виде масла. Пример 1. (3aS,9bR)-2-[2-(транс-4-Аминоциклогексил)этил]-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с] пиррол-8-карбонитрил дигидрохлорид. К раствору 1.5 г соединения способа получения 5 (3.5 ммоль) в 30 мл дихлорметана прибавляли 2.9 мл трифторуксусной кислоты. Смесь перемешивали в течение 4.5 ч при температуре окружающей среды и растворитель выпаривали. Остаток распределяли между водным раствором карбоната натрия и дихлорметаном. Раствор экстрагировали дихлорметаном, промывали водой, сушили (K2CO3) и выпаривали с получением, после превращения в соль с использованием 2 эквивалентов 1N эфирного HCl, названного продукта в виде белого порошка. Пример 2. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)ацетамид гидрохлорид. К раствору 699 мг (2.1 ммоль) соединения примера 1 в 15 мл дихлорметана прибавляли, при температуре окружающей среды, 354 мкл триэтиламина (1.2 эквив.) и потом 164 мкл ацетилхлорида (1.1 эквив.). После перемешивания в течение 2 ч при температуре окружающей среды, смесь промывали водой и сушили (MgSO4). Выпаривание растворителя с последующей очисткой на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (97/3/0.3) в качестве элюента дает, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названный продукт в виде белого порошка. Температура плавления: 293 С. Элементный микроанализ: Пример 3. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)циклобутанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя циклобутанкарбонилхлорид вместо ацетилхлорида. Температура плавления: 291 С. Элементный микроанализ: Пример 4. N-транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)циклопропанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя циклопропанкарбонилхлорид вместо ацетилхлорида. Температура плавления: 284 С. Элементный микроанализ: Пример 5. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)бензамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя бензоилхлорид вместо ацетилхлорида. Температура плавления: 284 С. Элементный микроанализ: Пример 6. 4-Хлор-N-(транс-4-2-[(3aS,9bR)-8-циано-1,3a,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)бензамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя 4 хлорбензоилхлорид вместо ацетилхлорида. Температура плавления: 288 С. Элементный микроанализ: Пример 7. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-2,2-диметилпропанамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя пивалоилхлорид вместо ацетилхлорида. Температура плавления: 314-317 С. Элементный микроанализ: этилциклогексил)циклопентанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя циклопентанкарбонилхлорид вместо ацетилхлорида. Температура плавления: 288 С. Элементный микроанализ: Пример 9. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-3-пиридинсульфонамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя пиридин-3 сульфонилхлорид (синтезированного в соответствии с J. Org. Chem. 1989, 54, 389-393) вместо ацетилхлорида. Температура плавления: 272 С. Элементный микроанализ: Пример 10. N-(транс-4-2-[(3aS9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-4-фторбензолсульфонамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя 4 фторбензолсульфонилхлорид вместо ацетилхлорида. Температура плавления: 300 С. Элементный микроанализ: Пример 11. 4-Хлор-N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)бензолсульфонамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя 4 хлорбензолсульфонилхлорид вместо ацетилхлорида. Температура плавления: 285 С. Элементный микроанализ: Пример 12. 4-[(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)карбамоил]бензойная кислота гидрохлорид. Стадия А. Метил 4-[(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этил)циклогексил)карбамоил]бензоат. Получали названный продукт согласно способу, описанному в примере 2, используя метил 4 хлоркарбамоилбензоат вместо ацетилхлорида. Стадия В. 4-[(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этил циклогексил)карбамоил]бензойная кислота гидрохлорид. 0.737 г продукта, полученного на стадии выше (1.68 ммоль), растворяли в 15 мл этанола и нагревали при кипении с 1.79 мл 1N раствора гидроксида натрия в течение 1.5 ч. Этанол после этого выпаривали, реакционную смесь выливали в воду, и потом прибавляли 3.6 мл 1N соляной кислоты при 0 С. Полученный осадок отфильтровывали и сушили в сушильном шкафу. Температура плавления: 298 С. Элементный микроанализ: Пример 13. 2-[(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3 Н)ил]этилциклогексил)карбамоил]бензойная кислота гидрохлорид. Стадия А. Метил 4-[(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)карбамоил]бензоат. Раствор 1.21 г соединения примера 1 (в виде основания) (3.72 ммоль), 0.8 г соединения способа получения 7 (1.2 эквив.), 0.78 г 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорида (1.1 эквив.) и 50 мг гидроксибензотриазола в 80 мл дихлорметана перемешивали в течение 18 ч при температуре окружающей среды. Прибавляли 37 мл насыщенного водного раствора бикарбоната натрия, и смесь после этого перемешивали в течение 15 мин. После экстракции дихлорметаном, осушки (MgSO4) и выпаривания, остаток очищали хроматографией на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (97/3/0.3) в качестве элюента с получением названного продукта в виде масла. Стадия В. 2-[(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)карбамоил]бензойная кислота гидрохлорид. Получали названный продукт согласно способу, описанному на стадии В примера 12, использую соединение, полученное на стадии А выше в качестве исходного материала. Температура плавления: 303 С. Элементный микроанализ: Пример 14. 3-[(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)карбамоил]бензойная кислота гидрохлорид. Получали названный продукт согласно способу, описанному в примере 13, использую коммерчески доступный монометилизофталат вместо способа получения 7. Температура плавления: 257 С. Элементный микроанализ: Пример 15. N-(транс-4-2-[(3aS,9bR)-8-Циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)азетидин-3-карбоксамид дигидрохлорид. Стадия А. трет-Бутил 3-[(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)карбамоил]азетидин-1-карбоксилат. Получали названный продукт согласно способу, описанному на стадии А примера 13, используя 1(трет-бутоксикарбонил)азетидин-3-карбоновую кислоту (синтезированною в соответствии сBiochemistry, 2001, 40, 5226-5232) вместо способа получения 7. Стадия В. N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)азетидин-3-карбоксамид дигидрохлорид. 2.82 г продукта, полученного на стадии выше (5.56 ммоль), перемешивали при температуре окружающей среды в смеси с 56 мл дихлорметана и 5.6 мл трифторуксусной кислоты в течение 3 ч. Растворители затем выпаривали; после этого прибавляли концентрированный раствор гидроксида натрия и раствор после этого экстрагировали этилацетатом, промывали 1N раствором гидроксида натрия и рассолом,сушили (MgSO4) и выпаривали. После превращения в соль в теплом этаноле с использованием 1N эфирного HCl, получали названный продукт в виде порошка. Температура плавления: 283 С. Элементный микроанализ: Пример 16. 1-Ацетил-N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)азетидин-3-карбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя в качестве исходного материала соединение примера 15 вместо соединения примера 1. Температура плавления: 251 С. Элементный микроанализ: Пример 17. N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-3,3-дифторциклобутанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному на стадии А примера 13, используя 3,3-дифторциклобутанкарбоновую кислоту (синтезированную в соответствии с Synthetic Communications, 2005, 35, 657-662) вместо способа получения 7. Температура плавления: 288 С. Элементный микроанализ: Пример 18. цис-N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)ил]этилциклогексил)-3-гидроксициклобутанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному на стадии А примера 13, используя 3 цис-гидроксициклобутанкарбоновую кислоту (синтезированную в соответствии с описанием патента US 2005/0020645) вместо способа получения 7. Температура плавления: 269 С.(3aS,9bR)-2-2-[транс-4-(2-Оксопирролидин-1-ил)циклогексил]этил-1,2,3,3 а,4,9bгексагидрохромено[3,4-с]пиррол-8-карбонитрил гидрохлорид. Стадия A. 4-Хлор-N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол 2(3H)-ил]этилциклогексил)бутанамид Получали названный продукт согласно способу, описанному в примере 2, используя 4 хлорбутирилхлорид вместо ацетилхлорида. Стадия В:(3aS,9bR)-2-2-[транс-4-(2-Оксопирролидин-1-ил)циклогексил]этил-1,2,3,3 а,4,9bгексагидрохромено[3,4-с]пиррол-8-карбонитрил гидрохлорид 1.77 г продукта, полученного на стадии выше (4.12 ммоль), суспендировали в 3 мл THF с 165 мг гидрида натрия, и после этого нагревали при кипении в течение 18 ч. После этого охлажденную смесь выливали в водный насыщенный раствор хлорида аммония. Полученный осадок очищали хроматографией на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (98/2/0.2) в качестве элюента с получением, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названного продукта. Температура плавления: 260-262 С. Пример 20. 2-[(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)амино]-3,4-диоксоциклобутен-1-олеат натрия. Стадия A. (3aS,9bR)-2-(2-транс-4-[(2-Этокси-3,4-диоксоциклобутен-1-ил)амино]циклогексил этил)-1,2,3, 3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил. 2 г соединения примера 1 (6.15 ммоль) и 0.9 мл диэтилскварата перемешивали при температуре окружающей среды в течение 2 ч в 15 мл этанола. После прибавления воды, полученные кристаллы отфильтровывали и сушили в сушильном шкафу с получением названного продукта в виде белого порошка. Стадия В. 2-[(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)амино]-3,4-диоксоциклобутен-1-олеат натрия. 1.3 г продукта, полученного на стадии выше суспендировали в растворе 29 мл воды и 6 мл этанола с 289 мг гранул гидроксида натрия при 90 С. К охлажденному раствору прибавляли ацетон, и полученный осадок, представляющий собой названный продукт, отфильтровывали. Масс-спектрометрия: [M+Н]+ = 421. Пример 21. (3aS,9bR)-2-2-[транс-4-[(2-Амино-3,4-диоксоциклобутен-1-ил)амино]циклогексил] этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил гидрохлорид. Раствор 1.17 г соединения, полученного на стадии А примера 20 (2.61 ммоль), в 13 мл этанола обрабатывали 13 мл насыщенного раствора аммиака в ацетонитриле в течение 16 ч. Полученный осадок отфильтровывали и потом промывали этилацетатом, в конечном итоге давая, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названный продукт. Температура плавления: 325 С. Элементный микроанализ: Пример 22. (3aS,9bR)-2-2-[транс-4-(Метиламино)циклогексил]этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил дигидрохлорид. Получали названный продукт согласно способу, описанному в примере 1, используя соединение,полученное в способе получения 4 в качестве исходного материала. Температура плавления: 320 С. Элементный микроанализ: Пример 23. N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-N-метилацетамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 2, используя в качестве исходного материала соединение примера 22 вместо соединения примера 1. Температура плавления: 248 С. Элементный микроанализ: Пример 24. N-(транс-4-2-[(3aS,9bR)-8-циано-1,3 а,4,9b-тетрагидрохромено[3,4-с]пиррол-2(3H)-ил] этилциклогексил)-N-метилциклобутанкарбоксамид гидрохлорид. Получали названный продукт согласно способу, описанному в примере 3, используя в качестве исходного материала соединение примера 22 вместо соединения примера 1. Температура плавления: 244 С. Элементный микроанализ: Пример 25. (3aS,9bR)-2-2-[транс-4-(Диметиламино)циклогексил]этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил дигидрохлорид. К раствору 0.685 г соединения примера 1 (1.95 ммоль) в 18 мл метанола прибавляли, при 0 С, 0.245 г цианоборогидрида натрия, 0.56 мл уксусной кислоты и потом, по каплям, 0.4 мл 37% раствора формальдегида в воде. После перемешивания в течение 4 ч, прибавляли 2 мл насыщенного водного раствора карбоната калия. После выпаривания растворителей и потом разведения водой, смесь экстрагировали этилацетатом, сушили (MgSO4) и выпаривали. Полученный остаток очищали хроматографией на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (80/20/2) в качестве элюента с получением, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названного продукта. Температура плавления: 305 С. Элементный микроанализ: Пример 26. (3aS,9bR)-2-2-[транс-4-(Пиридин-2-иламино)циклогексил]этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с]пиррол-8-карбонитрил дигидрохлорид. Смесь 0.482 г соединения примера 1 (1.48 ммоль) и 0.245 мл диизопропилэтиламина в 5 мл 2 фторпиридина нагревали при кипении в течение 24 ч. После выпаривания растворителей и потом разведения водой, смесь экстрагировали этилацетатом, сушили (MgSO4) и выпаривали. Полученный остаток очищали хроматографией на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (97/3/0.3) в качестве элюента с получением, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названного продукта. Температура плавления: 305 С. Элементный микроанализ:(3aS,9bR)-2-2-[транс-4-(Пиримидин-2-иламино)циклогексил]этил-1,2,3,3 а,4,9bгексагидрохромено[3,4-с]пиррол-8-карбонитрил дигидрохлорид. Суспензию 0.715 г соединения примера 1 (2.2 ммоль), 0.303 мг 2-хлорпиримидина и 0.47 г карбоната натрия в 45 мл этанола нагревали при кипении в течение 72 часов. После фильтрования, растворители затем выпаривали. После экстракции этилацетатом и осушки (MgSO4), выпаривание дает масло, которое очищали хроматографией на колонке с силикагелем, используя смесь дихлорметан/метанол/гидроксид аммония (98/2/0.2) в качестве элюента с получением, после превращения в соль в теплом этаноле с использованием 1N эфирного HCl, названного продукта. Температура плавления: 234 С. Элементный микроанализ: Фармакологическое исследование Пример А. Определение аффинности для D3, D2S и D2L рецепторов человека, стабильно экспрессированных в клетках яичника китайского хомячка (СНО). Аффинность соединений для D3, D2S и D2L допаминергических рецепторов человека оценивали конкурирующими экспериментами используя спиперон, меченый тритием ([3H]-spiperone), на СНО клеточных мембранах, стабильно экспрессированных этими 3 подтипами рецептора. Различные клеточные линии культивировали слиянием и потом клетки отделяли и гомогенизировали используя Polytron в трисHCl буфере (50 мМ, рН 7.4), содержащем 5 мМ MgCl2. Клеточный детрит потом центрифугировали (15 минут при 4 С) и осадок поглощали в соответствующем объеме HEPES буфера (20 мМ), содержащем 150 мМ NaCl, и замораживали при t -80 С. В день эксперимента, мембраны поглощали инкубационным буфером, содержащим 50 мМ Трис (рН 7.4), 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 5 мМ MgCl2. Мембраны потом инкубировали на протяжение 1 ч при 30 С с изучаемым соединением, в присутствии 0.5 нМ [3 Н]- 10017774 спиперона. Неспецифическое связывание определяли используя 10 мкМ раклоприд. В конце инкубационного периода, образцы фильтровали через фильтры Unifilter GF/B типа, предварительно обработанные с PEI (0.1%) и промытые несколько раз с Трис-HCl фильтрационным буфером (50 мМ, рН 7.4), содержащим 120 мМ NaCl. Радиоактивность, удерживаемая на фильтрах подсчитывалась после добавления сцинтилляционной жидкости, с помощью сцинтилляционного счетчика. Полученные изотермы анализировали нелинейной регрессией, чтобы определить значения IC50, которые преобразовывали в pKi используя уравнение Cheng-Prusoff: где L представляет концентрацию радиолиганда и Kd является константой диссоциации [3 Н]спиперона на D3, D2S и D2L допаминергических рецепторах (0.26, 0.14 и 0.156, соответственно). Результаты выражены в значениях pKi = - log Ki.PD128,907. У крыс-самцов породы Wistar измерялась базальная (ректальная) температура и потом оральным путем вводились тестируемое соединение или среда. Шестьдесят минут спустя, PD128,907 (0.63 мг/кг,подкожно), впрыскивался D3/D2 допаминергический агонист. Тридцать минут спустя снова определяли температуру тела и вычисляли разницус базальной температурой.ID50 = Ингибирующая доза 50.Достоверное отклонение относительно "Среда + Среда" (критерий Стьюдента, Р 0.05).Достоверное отклонение относительно "Среда + PD128.907" (критерий Даннетта после ANOVA, Р 0.05). В присутствии среды, PD128,907 вызывается гипотермия, которая блокируется дозозависимым способом соединением примера 3, демонстрирующим антагонистическую активность D3/D2 рецептору. Пример С. Фармацевтическая композиция: в которой R1 и R2 вместе образуют следующую углеродсодержащую цепь: где R3 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу,R4 представляет собой атом водорода,линейную или разветвленную (C1-С 6)алкильную, арильную, гетероарильную или 3,4-диоксоциклобутенильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С 6)алкила; линейного или разветвленного (C1-С 6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (C1-С 6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (C1-С 6)алкильными группами,группу -COR5,группу -SO2R5,R5 представляет собой линейную или разветвленную (C1-С 6)алкильную, (С 3-С 8)циклоалкильную,гетероциклоалкильную, арильную или гетероарильную группу, каждая из этих групп необязательно замещена одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С 6)алкила; линейного или разветвленного (С 1-С 6)алкилкарбонила; карбоксигруппы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонила, который является незамещенным или замещенным одной или более линейными или разветвленными (С 1-С 6)алкильными группами; и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами, илиR3 и R4, вместе с атомом азота, с которым они связаны, образуют 5-8-членное кольцо, необязательно замещенное одной или более одинаковыми или различными группами, выбранными из галогена; линейного или разветвленного (C1-С 6)алкила; гидроксигруппы; оксогруппы и аминогруппы, которая является незамещенной или замещенной одной или двумя линейными или разветвленными (С 1-С 6)алкильными группами,где арильная группа означает фенильную или нафтильную группу,гетероарильная группа означает моноциклическую или бициклическую группу, в которой по меньшей мере одно кольцо является ароматическим, содержащую от 5 до 11 членов кольца и от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, и гетероциклоалкильная группа относится к моно- или бициклической неароматической группе, содержащей от 4 до 11 членов кольца и имеющей от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы,их энантиомеры, их диастереоизомеры, а также их соли присоединения с фармацевтически приемлемыми кислотами или основаниями. 2. Соединения формулы (I) по п.1, отличающиеся тем, что группа R3 представляет собой атом водорода или метильную группу. 3. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу. 4. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой группу -COR5, где R5 определено в п.1. 5. Соединения формулы (I) согласно п.1 или 2, отличающиеся тем, что группа R4 представляет собой группу -SO2R5, где R5 определено в п.1. 6. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу. 7. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную (С 3-С 8)циклоалкильную группу. 8. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную арильную группу. 9. Соединения формулы (I) по пп.1, 2, 4 или 5, отличающиеся тем, что группа R5 представляет собой необязательно замещенную гетероарильную группу. 10. Соединения формулы (I) по п.1, отличающиеся тем, что R3 и R4 вместе с атомом азота, с которым они связаны, образуют необязательно замещенное 5-членное кольцо. 11. Соединения формулы (I) по п.1, которые представляют собой:(3aS,9bR)-2-2-[транс-4-(2-оксопирролидин-1-ил)циклогексил]этил-1,2,3,3 а,4,9b-гексагидрохромено[3,4-с] пиррол-8-карбонитрил. 12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (II) подвергают реакции восстановительного аминирования в присутствии восстановительного агента,выбранного из триацетоксиборогидрида натрия или цианоборогидрида натрия, с соединением формулы (III) в которой R'1 и R'2 вместе образуют следующую углеродсодержащую цепь в которой R3 определено в п.1 и R представляет собой защитную группу для аминной функции,представляющую собой трет-бутилоксикарбонильную группу, с получением соединения формулы (IV) которое после этого подвергают реакции снятия защиты с аминной группы, в присутствии трифторуксусной кислоты, с получением соединения формулы (I/a), в конкретном случае соединений формулы (I) в которой R1 и R2 вместе образуют следующую углеродсодержащую цепь в которой R3 определено выше,где соединение формулы (I/a) после этого подвергают, в случае необходимости,или реакции восстановительного аминирования с восстанавливающим агентом, выбранным из триацетоксиборогидрида натрия или цианоборогидрида натрия, в присутствии соединения формулы (V) в которой R' представляет собой атом водорода или линейную или разветвленную (С 1-С 5)алкильную группу; или действию соединения формулы (VI) где Y представляет собой атом галогена или гидроксигруппу или линейную или разветвленную(С 1-С 6)алкоксигруппу, и R" представляет собой арильную, гетероарильную, 3,4-диоксоциклобутенильную, -COR5 или -SO2R5 группу, где R5 определено в п.1,с получением соединения формулы (I/b), в конкретном случае соединений формулы (I) в которой R'"1 и R2 вместе образуют следующую углеродсодержащую цепь: в которой R3 определено выше и R'4 представляет собой линейную или разветвленную (С 1-С 6)алкильную, арильную, гетероарильную, 3,4-диоксоциклобутенильную, -COR5 или -SO2R5 группу, где R5 определено выше, для соединений формул (I/a) и (I/b), возможна их дальнейшая очистка, превращение,если желательно, в их соли присоединения с фармацевтически приемлемыми кислотами или основаниями и разделение, когда это целесообразно, на их изомеры, если они существуют. 13. Фармацевтическая композиция, обладающая активностью в отношении дофаминергических рецепторов, содержащая в качестве активного компонента соединение по любому из пп.1-11, отдельно или в комбинации с одним или более инертными, нетоксичными и фармацевтически приемлемыми вспомогательными средствами или носителями. 14. Фармацевтическая композиция по п.13, предназначенная для лечения или предупреждения шизофрении и психозов, неправильного употребления лекарств, заболеваний, вызванных стрессами, возбужденных состояний, токсикомании, лечения униполярных и биполярных депрессивных состояний, импульсивных поведений, обсессивно-компульсивных заболеваний, агрессивности, лечения болезни Паркинсона, эссенциального дрожания, заболеваний памяти и нарушений познавательных способностей,связанных с психиатрическими и неврологическими заболеваниями, деменции, болезни Альцгеймера,нарушения развития у детей или подростков, лечения боли, тошноты, преждевременной эякуляции, а также для почечной защиты. 15. Применение соединений формулы (I) по любому из пп.1-11 в производстве лекарственных средств для лечения или предупреждения шизофрении и психозов, неправильного употребления лекарств, заболеваний, вызванных стрессами, возбужденных состояний, токсикомании, лечения униполярных и биполярных депрессивных состояний, импульсивных поведений, обсессивно-компульсивных заболеваний, агрессивности, лечения болезни Паркинсона, эссенциального дрожания, заболеваний памяти и нарушений познавательных способностей, связанных с психиатрическими и неврологическими заболеваниями, деменции, болезни Альцгеймера, нарушения развития у детей или подростков, лечения боли,тошноты, преждевременной эякуляции, а также для почечной защиты. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/407, A61P 25/18, A61P 25/36, A61P 25/30, C07D 491/052, A61P 25/32, A61P 25/16, A61P 25/34
Метки: основе, соединения, способ, композиции, хроменовые, получения, фармацевтические
Код ссылки
<a href="https://eas.patents.su/15-17774-hromenovye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Хроменовые соединения, способ их получения и фармацевтические композиции на их основе</a>
Предыдущий патент: Способ получения функционального продукта питания на основе яичного желтка и получаемые с его помощью продукты
Следующий патент: Производные β-аминокислот для лечения диабета
Случайный патент: Способ и устройство для непрерывного гравиметрического дозирования текучих продуктов для топочных установок