Рн-чувствительные полимерные конъюгаты антрациклиновых канцеростатических активных агентов для терапии направленного действия
Номер патента: 7353
Опубликовано: 27.10.2006
Авторы: Елинкова Маркета, Этрих Томаш, Коварж Марек, Ульбрих Карел, Ржигова Бланка
Формула / Реферат
1. Конъюгаты, состоящие из полимерного носителя, содержащего 30-3000 связанных мономерных единиц, формирующих полимерную цепь, включающих
60-99% N-(2-гидроксипропил)метакриламидных единиц,
1-25% единиц метакрилоилированных гидразонов a-аминокислот, e-аминокислот, ароматических аминокислот или олигопептидов, заканчивающихся молекулой антрациклинового канцеростатика,
0,5-15% единиц метакрилоилированных a-аминокислот, e-аминокислот, ароматических аминокислот, олигопептидов или их натриевых солей; и при необходимости
0,5-10% единиц метакрилоилированных гидразидов a-аминокислот, e-аминокислот, ароматических аминокислот или олигопептидов.
2. Конъюгаты по п.1, дополнительно содержащие 0,5-5% метакрилоилированных a-аминокислот, e-аминокислот, ароматических аминокислот, олигопептидов, заканчивающихся молекулой иммуноглобулина или специфического моно- либо поликлонального антитела.
3. Конъюгаты по п.1 или 2, дополнительно содержащие 0,1-5% единиц ферментативно расщепляемых метакрилоилированных олигопептидов, соединенных алкилендиаминами, образующих связующие звенья между полимерными цепями с образованием поперечно-сшитой структуры конъюгата.
4. Конъюгаты по любому из пп.1-3, где антрациклиновым канцеростатиком является доксорубицин.
5. Конъюгаты по п.1, имеющие общую формулу
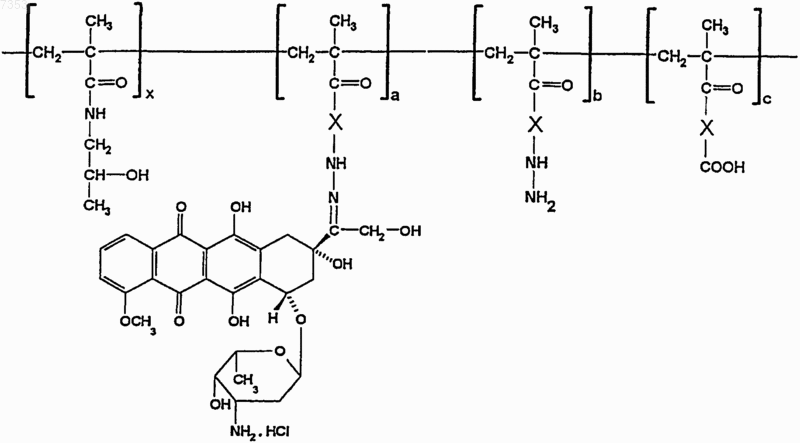
где отдельные структурные единицы распределены в цепи произвольным образом, Х представляет собой звено, образованное остатком a-аминокислоты, e-аминокислоты или олигопептида, и х имеет значения от 20 до 3000, а - от 1 до 750, каждый из b и с имеет значения от 1 до 450.
6. Конъюгаты по п.2, имеющие общую формулу
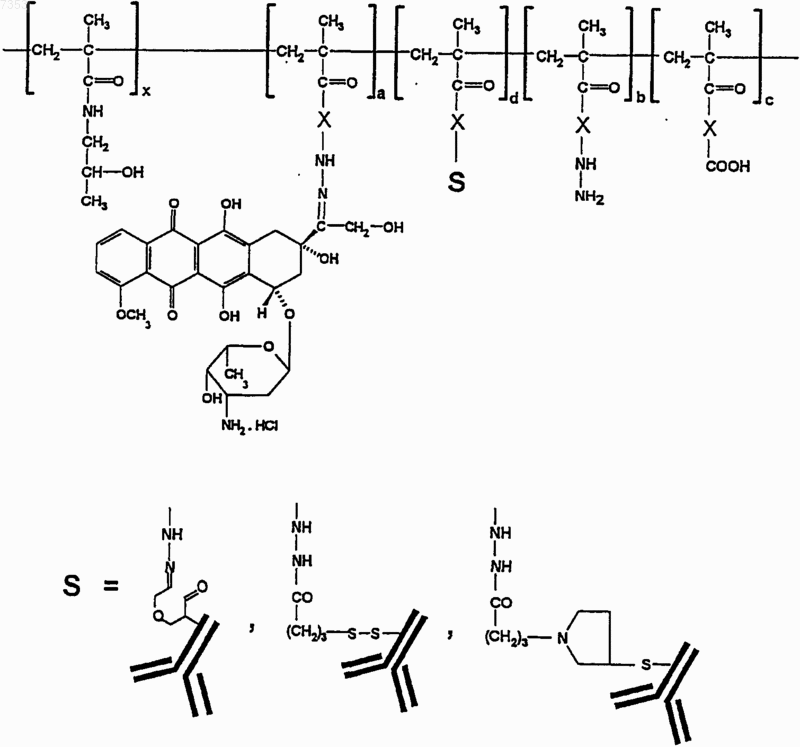
где X, х, a, b и с такие, как указано выше, d имеет значения от 1 до 150, S представляет собой антитело, выбранное из группы, включающей g-глобулин для внутривенного введения, аутологические антитела, антитела анти-17-1-A, анти-СА 15-3 и аналогичные, присоединенные к полимерной цепи, либо S представляет собой биологически расщепляемое олигопептидное звено, соединяющее другие аналогичные цепи.
7. Конъюгаты по пп.1-6, где аминокислоты или олигопептиды выбраны из группы, включающей Gly, Ala, Leu, GlyGly, GlyLeuGly, GlyPheGly, GlyPheLeuGly, b-аланин, g-аминомасляную кислоту, e-аминокапроновую кислоту (АКар), парааминобензойную кислоту (АВ).
8. Конъюгаты по п.2 или 6, где антитела выбраны из группы, включающей g-глобулин для внутривенного введения, аутологические антитела, антитела анти-17-1-A, анти-СА 15-3 и другие опухолеспецифические и опухолеассоциированные антитела.
9. Конъюгаты по п.3, где связующие звенья, соединяющие полимерные цепи, выбраны из группы, включающей GlyPheLeuGly, GlyLeuGly, GlyPheGly, GlyLeuPheGly.
10. Фармацевтическая композиция для лечения опухолей, характеризующаяся тем, что содержит в качестве активного агента конъюгат, охарактеризованный в любом из пп.1-9.
11. Фармацевтическая композиция по п.10, предназначенная для лечения опухолей, таких как рак молочной железы или колоректальная опухоль.
Текст
007353 Область техники Изобретение относится к полимерным противораковым препаратам, которые способны целенаправленно транспортироваться в организме и фокусироваться на определенных мишенях при терапии рака. Предпосылки изобретения Развитие новых лекарственных препаратов и их форм все чаще фокусируется на использовании полимерных веществ, особенно водорастворимых полимеров, как носителей этих препаратов. Был синтезирован и изучен ряд полимерных конъюгатов канцеростатических препаратов и растворимых полимеров,в которых противоопухолевый агент был связан с полимером нерасщепляемой ковалентной связью, гидролитически нестабильной ионной связью или ковалентной связью, подверженной ферментному или обычному гидролизу. Эта попытка была предпринята для того, чтобы синтезировать препараты с усовершенствованными фармакокинетическими и фармакодинамическими характеристиками, применяющимися в целенаправленной терапии рака. Полимерные препараты, синтезированные на основе сополимеров гидроксипропилметакриламида (НРМА), образуют важную группу. Противораковый агент в таких соединениях связан с полимерным N-(2-гидроксипропил)метакриламидным носителем посредством олигопептидной последовательности, расщепляемой под воздействием ферментов, синтезированной как субстрат для лизосомных энзимов (ферментов, представленных в клетках млекопитающих). Структура,синтез и свойства таких конъюгатов описаны в патенте [Duncan, 1985]. Основные результаты в данной области обобщены Kopeek с соавторами [Kopeek et al., 2000]. Вышеуказанные полимерные препараты эффективны при воздействии на ряд опухолей у мышей и крыс. В настоящее время два полимерных конъюгата даже были испытаны клинически [Vasey 1999 et al., Julyan et al., 1999, Thomson et al., 1999]. Результаты таких клинических тестирований продемонстрировали, что конъюгаты доксорубицина обладают более низкой неспецифической токсичностью, чем несвязанный активный агент. Его максимально допустимое количество - 320 мг/м 2, что в 4-5 раз превышает количество обычно использующегося в клинике несвязанного доксорубицина (60-80 мг/м 2). Не отмечалось существенного влияния полимерного препарата на сердечные функции, хотя индивидуальное общее количество достигало 1680 мг/м 2. Все другие виды токсичности, сопряженные с применением несвязанных антрациклиновых антибиотиков ненаправленного действия, были существенно ниже. Одним из недостатков клинически исследованных полимерных конъюгатных препаратов является относительно низкая специфичность воздействия, так как такие конъюгаты либо вообще не содержат мишень, как, например, РК 1, либо содержат углевод с относительно низкой специфичностью (галактозамин в РК 2 конъюгате, где тестировалaсь способность направлять полимерный препарат к печени). Следовательно, разрабатываются конъюгаты, в которых достигают направленного специфического действия благодаря присоединению специфической молекулымишени (например, антитела, лектин, гормон роста, трансферин и т.д.) к молекуле-носителю. Другим недостатком клинически тестированных конъюгатов, включая поли(НРМА) и доксорубицин, является тот факт, что препарат в его фармакологически активной форме высвобождается из таких конъюгатов только в клетках благодаря ферментной реакции, происходящей в лизосомах. Это означает,что препарат эффективен только в клетках с высокой концентрацией лизосомных ферментов - пептидаз. Еще один недостаток - сравнительно сложная структура конъюгата, требующая включения последовательности, от которой препарат отделяется с помощью пептидаз, как правило, тетрапептидного звенаGlyPheLeuGly, что делает синтез более дорогостоящим и сложным. На сегодняшний день достаточно информации о приготовлении и изучении свойств полимеров, к которым канцеростатик присоединен посредством связи, подвергающейся гидролизу в водной среде. Результаты обобщены Kratz [Kratz et al., 1999]. Природные макромолекулы, такие как альбумин, декстраны, трансферин, альгинаты или антитела, наиболее часто использовались как носители канцеростатических активных агентов. Синтетические полимерные носители полиэтиленгликоль и полиглютамины использовались в некоторых случаях. Препараты были присоединены к носителю посредством связей,обеспечивающих гидролитическое высвобождение активного агента во внеклеточное пространство и внутрь клеток. В случае доксорубицина (Dox) связь наиболее часто была образована эфирами цис-аконитовой кислоты или гидразоном. Однако in vivo тестирования всех вышеупомянутых рН-чувствительных конъюгатов на животных не привели к убедительным результатам. Следовательно, ни один из полимерных конъюгатов не использовался и клинически не испытывался для лечения опухолей. Полимерные канцеростатики, разработанные авторами настоящего изобретения и синтезированные на основе сополимеров НРМА и канцеростатических агентов, присоединенных рН-чувствительной гидразоновой связью, как было показано в тестах in vivo и in vitro на мышах, обладают большей эффективностью в отношении ряда опухолевых линий, чем конъюгаты с активным агентом, который связан с полимерным носителем с помощью связи, расщепляемой под действием ферментов, посредством олигопептидного звена. Синтез таких конъюгатов по сравнению с синтезом конъюгатов с поли(НРМА), разработанных ранее, более прост и легок и менее дорогостоящий, поскольку в качестве связующего звена можно использовать только одну аминокислоту вместо олигопептидной последовательности, способной расщепляться под действием ферментов, и присоединеие активного агента к полимеру представляет собой простую реакцию. Активный агент высвобождается в результате изменения рН среды, и, следова-1 007353 тельно, присутствие лизосомных ферментов не является существенным. Скорость такого высвобождения(и, следовательно, мгновенная концентрация цитостатика) существенно выше, чем у конъюгатов, содержащих последовательности, разрушаемые ферментами [hov et al., 2001, Etrych et al., 2001]. Сущность изобретения В соответствии с изобретением получены линейные и разветвленные полимерные конъюгаты доксорубицина, дауномицина, фарморубицина и других антрациклиновых канцеростатических активных агентов, содержащих карбонильную группу с сополимерами, синтезированными на основе N-(2-гидроксипропил)метакриламида (НРМА), и в ряде случаев с антителами, их фрагментами или неспецифическими иммуноглобулинами (фиг. 3). Характерным для этих конъюгатов является то, что полимерный носитель вместе с антителом (иммуноглобулином) обеспечивает продолжительную циркуляцию полимерного препарата в кровеносных сосудах и последующее пассивное или активное накопление препарата в опухоли. Противораковый агент соединен с носителем связью, устойчивой в кровеносных сосудах (при рН=7,4). После того как препарат соединен с полимером, канцеростатик теряет свое биологическое действие и в неактивной форме транспортируется по кровеносным сосудам. Цитотоксический препарат активируется лишь внутриклеточно, в органеллах клеток-мишеней, так как рН уменьшается и связь между препаратом и полимером гидролизуется. Конъюгаты состоят из полимерного носителя, содержащего 303000 связанных мономерных единиц, формирующих полимерную цепь, включающих 60-99% N-(2-гидроксипропил)метакриламидных единиц, 1-25% единиц метакрилоилированных гидразонов -аминокислот, -аминокислот, ароматических аминокислот или олигопептидов, заканчивающихся молекулой антрациклинового канцеростатика (предпочтительно доксорубицина), и 0,5-15% единиц метакрилоилированных -аминокислот, -аминокислот, ароматических аминокислот, олигопептидов или их натриевых солей, также полимерный носитель может включать 0,5-10% единиц метакрилоилированных гидразидов-аминокислот, -аминокислот, ароматических аминокислот или олигопептидов, а также конъюгат может содержать 0,5-5% метакрилоилированных -аминокислот, -аминокислот, ароматических аминокислот, олигопептидов, заканчивающихся молекулой иммуноглобулина или специфического моно- либо поликлонального антитела. Помимо вышеуказанных единиц, разветвленные макромолекулярные структуры также содержат 0,1-5% единиц, образующих звенья, соединяющие отдельные полимерные цепи в разветвленную макромолекулярную структуру, эти звенья представляют собой ферментативно расщепляемые метакрилоилированные олигопептиды, преимущественно трипептиды GlyPheGly, GlyLeuGly либо тетрапептидGlyPheLeuGly, связанные диаминами (этилендиамином, гексаметалендиамином). Характерной особенностью полимерных конъюгатов с направленным противоопухолевым действием согласно изобретению является связь между активным агентом - цитостатиком - и полимерным носителем посредством гидразоновой группы, которая образуется в результате реакции между карбонильной группой молекулы активного агента и гидразидной группой полимера. Присоединение активного агента к полимерному носителю существенно увеличивает молекулярный вес препарата, что приводит к увеличению времени циркуляции в крови и продлевает присутствие активного агента в организме. Связь между активным агентом и полимером относительно устойчива во время транспортировки препарата по кровеносным сосудам и гидролитически расщепляется в слабокислой среде внутри клеток, в частности в клеточных органеллах, характеризующихся кислым рН. Это означает, что активный агент, связанный с полимером, транспортируется по кровеносным сосудам в неактивной форме, а высвобождается и активируется лишь после проникновения в опухолевые клетки-мишени. Активация препарата в клеткахмишенях устраняет побочные эффекты токсичных цитостатиков и фокусирует их воздействие преимущественно на опухолевых клетках. Полимерный носитель на основе сополимеров НРМА отвечает за целенаправленный транспорт к опухоли либо опухолевым клеткам. Когда используется разветвленный высокомолекулярный поли(НРМА)-носитель, полимерный препарат накапливается в ткани опухоли, что обусловлено пассивной направленной доставкой препарата и эффектом повышенной проницаемости и удерживания (EPR). Полимер может быть выведен из организма благодаря последующему ферментному расщеплению олигопептидных звеньев в виде более коротких полимерных цепочек, например, с помощью гломерулярной фильтрации. В носителях, содержащих антитела (иммуноглобулин), антитело связано с носителем через гидразоновую связь, которая образуется в реакции между альдегидными группами,введенными в Fc фрагмент антитела с помощью окисления периодатом натрия, и гидразоновыми группами носителя. Антитело (иммуноглобулин) может также быть соединено с цепочкой полимерного носителя с помощью бифункциональных агентов. В этом случае молекулу антитела модифицируют реакцией с 2-иминотиоланом (введение -SH групп), малеимидные группы вводят в полимер с помощью реакций гидразидных групп полимера с сукцинимидным эфиром 3-малеимидпропионовой кислоты, затем происходит конъюгация благодаря взаимодействию -SH группы антитела с двойной связью малеимидной группы полимера. Аналогично, конъюгация может также быть инициирована другими бифункциональными агентами, такими как N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)пропионовой кислоты(SPDP), которые могут быть использованы для конъюгирования антитела (иммуноглобулина). содержащего -SH группу, непосредственно с гидразидными группами полимерного носителя.-2 007353 Конъюгат с антителом (иммуноглобулином) накапливается в органах/тканях-мишенях пассивно и активно. Пассивное накопление обусловлено высоким молекулярным весом конъюгата и так называемым эффектом "повышенной проницаемости и удерживания", активное накопление обеспечивается процессом, в котором связывающий сайт антитела взаимодействует с соответствующими рецепторами на поверхности клеток-мишеней. В последнем случае сополимер НРМА играет роль носителя и защитной оболочки, существенно уменьшая иммуногенность гликопротеина в конъюгате. Полимерный препарат согласно этому изобретению может быть использован в трех формах, различающихся по структуре. Первая структура представлена линейным полимерным конъюгатом с активным агентом без антитела (иммуноглобулина) и изображена на фиг. 1, где для биологических экспериментов предпочтительно использовали конъюгат, где х=94 мол.%, а=3 мол.%, b=2 мол.%, с=1 мол.%, Х=АВ или АК при использовании аминокислот и GlyPheLeuGly при использовании олигопептида. В представленной на фиг. 1 структуре Х=-аминокислота, -аминокислота, ароматическая аминокислота, олигопептид. Вторая структура является высокомолекулярной и представляет собой разветвленною полимерную структуру с олигопептидными звеньями, расщепляемыми под действием биологических агентов, как показано на фиг. 2, где предпочтительный молекулярный вес конъюгата - 120000 г/моль. Содержание сшивки, доксорубицина (DOX), гидразоновых и карбоксильных групп - 0,5, 9, 2 и 2 мол.% соответственно. Третья структура включает также молекулу направленного действия на мишень (иммуноглобулин)(фиг. 3). Для биологических экспериментов предпочтительно использовали конъюгат, где х=92 мол.%,а=3 мол.%, b=0,7 мол.%, с=2 мол.%, d=2,3 мол.%, Х=АВ или АК при использовани аминокислоты в качестве спейсера и GlyPheLeuGly при использовании олигопептида. В представленной на фиг. 3 структуре Х=-аминокислота, -аминокислота, ароматическая аминокислота, олигопептид, S для макромолекулярного полимера является биорасщепляемым олигопептидным звеном, представляющим собой GlyLeuGly,GlyPheGly, GlyPheLeuGly или аналогичную последовательность и соединяющим другие полимерные цепи. Получение линейных полимерных препаратов без антител осуществляется посредством нескольких реакционных стадий. Первая стадия включает получение полимерного предшественника I, как показано на фиг. 4 (Х=-аминокислота, -аминокислота, ароматическая аминокислота, олигопептид), являющегося сополимером НРМА и метакрилоилированных химически активных эфиров (4-нитрофениловых эфиров, N-гидроксисукцинимидных эфиров и т.д.) аминокислот или олигопептидов, вторая стадия, ведущая к получению полимерного предшественника II, включает гидразинолитическую трансформацию концевых эфирных групп в гидразиды. На третьей стадии канцеростатик, содержащий кетоновую группу, присоединяют к гидразидным группам посредством гидразоновой связи. Получение разветвленного полимерного препарата начинают с получения полимерного предшественника I, содержащего ферментативно расщепляемый олигопептид в боковой цепи, преимущественноGlyPheGly, GlyLeuGly, GlyPheLeuGly, GlyLeuPheGly. На второй стадии осуществляют легкое разветвление полимера с помощью реакции полимерного предшественника I и алкилендиамина (этил, бутил, гексил) и последующий гидразинолиз гидразингидратом, как описано в предыдущем случае. Препараты с антителами (иммуноглобулином) могут быть приготовлены из двух предыдущих типов препаратов последующей реакцией с антителом (иммуноглобулином), в структуру которого предварительно были введены альдегидные группы посредством мягкого окисления с помощью KIO4 илиNaIO4, либо путем их конъюгации с антителом (иммуноглобулпном) с использованием бифункциональных агентов, как описывалось выше. Это изобретение может быть использовано для получения полимерных препаратов для лечения различных типов опухолей у людей. Краткое описание фигур На фиг. 1 показана структура полимерного конъюгата с активным агентом без антител. На фиг. 2 представлена схема получения и структура разветвленных макромолекулярных конъюгатов с биорасшепляемыми олигопептидными звеньями. На фиг. 3 показана общая структура полимерного конъюгата с активным агентом с антителом. На фиг. 4 показаны структуры полимерных предшественников. Фиг. 5 демонстрирует измерение скорости высвобождения доксорубицина из полимеров, отличающихся составом спейсера, А) при моделировании рН среды эндосом (рН 5); В) при моделировании рН крови (рН 7,4). Содержание активного агента в конъюгата - 10 вес.%. Фиг. 6 демонстрирует результат сравнения in vitro ингибирующей активности конъюгатов, содержащих активный агент, присоединенный посредством различных звеньев; протестирована лейкемическая линия мыши EL4 (Т-клеточная лимфома EL4). Фиг. 7 демонстрирует результат сравнения in vivo ингибирующей активности конъюгатов, содержащих активный агент, присоединенный посредством различных звеньев; протестирована лейкемическая линия К 562.-3 007353 Фиг. 8 демонстрирует результаты исследования противоопухолевой активности in vivo конъюгатов,содержащих гидролитически высвобождаемый доксорубицин (защитный режим); Т-клеточная лимфомаEL4: 105 клеток/мышь. Примеры Пример 1. Получение линейного полимерного препарата, не содержащего антител, на основе доксорубицина. Синтез полимерного препарата осуществляют за четыре этапа. На первом этапе получают мономеры, N-(2-гидроксипропил)метакриламид (НРМА) и 4-нитрофениловые эфиры метакрилоилированной аминокислоты или олигопептида (MA-X-ONp). Вторым этапом было получение полимерного предшественника I радикальной сополимеризацией НРМА и MA-X-ONp. На третьем этапе получают полимерный предшественник II путем гидразинолиза полимерного предшественника I и на последнем этапе осуществляют присоединение доксорубицина (Dox) к этому полимерному предшественнику. Получение мономеров. НРМА получают методом, описанным ранее [Ulbrich, 2000]. Метакрилоилированные реакционноспособные сложные эфиры получают метакрилоилированием соответствующей аминокислоты или олигопептида (X=Gly, ди-Gly, GlyLeuGly, GlyPheGly, GlyPheLeuGly, -аланина, -аминокапроновой кислоты(АКар), парааминобензойной кислоты (АВ) и т.д.) реакцией Шоттена-Баумана и последующей реакцией полученного производного метакриловой кислоты с 4-нитрофенолом в присутствии дициклогексилкарбодиимида (DCCI). Протокол получения 4-нитрофениловых эфиров метакрилоилированных -аминокислот. Способ получения мономеров MA-Gly-ONp, MA-GlyGly-ONp и MA-AB-ONp одинаков для всех трех случаев. Способ получения MA-AB-ONp описан ниже.MA-AB-ONp. 0,024 моля (3,34 г) парааминобензойной кислоты растворяют в трехгорлой колбе в 15 мл раствора из 0,024 молей (0,97 г) гидроксида натрия. 0,024 моля (2,55 г) хлорангидрида метакриловой кислоты и 0,024 молей (0,97 г) раствора гидроксида натрия в 10 мл воды одновременно добавляют по каплям к водному раствору натриевой соли аминокислоты при перемешивании и охлаждении (5 С). В процессе реакции рН реакционной смеси не должен превысить рН 9. Реакционную смесь перемешивают в течение 1 ч, а затем подкисляют до рН 2, получившийся белый осадок фильтруют на стеклянном фильтре S4. Продукт очищают кристаллизацией из смеси воды с этиловым спиртом. 4-Нитрофениловый эфир получают путем реакции 0,014 молей (2,85 г) N-метакрилоила 4 аминобензойной кислоты с 0,014 молями (1,93 г) 4-нитрофенола в диметилформамиде при -10 С в присутствии 0,0153 молей (3,16 г) дициклогексилкарбодиимида. Реакция длится 10 ч, после чего осажденную дициклогексилмочевину фильтруют и продукт очищают кристаллизацией из смеси ацетона с водой. Другие два 4-нитрофениловых эфира (MA-X-ONp) получают аналогичным способом. Метакрилоилированные производные GlyLeuGly, GlyPheGly, GlyPheLeuGly, -аланина и -аминокапроновой кислоты также получают метакрилоилированием олигопептидов или кислоты, однако, во время подкисления водной фазы, производные метакриловой кислоты следует экстрагировать в этилацетат и выделить кристаллизацией. Соответствующие реакционноспособные сложные эфиры (ONp сложные эфиры) получают аналогично MA-AB-ONp, за исключением того, что реакционной средой для этерификации МА-GlyLeuGly-OH и MA-GlyPheLeuGly-OH является тетрагидрофуран. Получение полимерного предшественника I. 1 г смеси НРМА (95 мол.%, 0,89 г) и МА-AB-ONp (5 мол.%, 0,11 г) и 0,048 г азобисизобутиронитрила растворяют в 6,95 г ацетона и раствор помещают в ампулу для полимеризации. После продувания полимеризационной смеси азотом ампулу герметизируют и проводят полимеризацию при 50 С в течение 24 ч. Осажденный полимер фильтруют, трижды промывают ацетоном и диэтиловым эфиром и сушат в вакууме. Структура боковых цепей, заканчивающихся реактивными -ONp группами (строение сополимера), зависит от состава исходных продуктов для полимеризации (соотношения мономеров). Тот же процесс используют для приготовления всех полимерных промежуточных продуктов, различающихся по составу боковых цепей. Получение полимерного предшественника II. Сополимер поли(НРМА-со-МА-АВ-NНNН 2) получают путем реакции полимерного предшественника I с гидратом гидразина. 300 мг полимерного предшественника I (1,3 х 10-4 моля ONp) растворяют в 2 мл метанола и раствор 69 мг NH2NH2H2O в 1 мл метанола (1,3 х 10-3 моля, 10-кратный избыток по сравнению с ONp) добавляют при интенсивном перемешивании. Реакционную смесь выдерживают в течение 3 ч, чтобы прошла реакция, после чего раствор в метаноле разбавляют дистиллированной водой до 30 мл и продукт очищают от низкомолекулярных примесей, используя диализ против дистиллированной воды(в течение 2 дней). Конечный продукт выделяют из водного раствора лиофильной сушкой. Молекулярную массу (MW) и полидисперсность полимера определяют гель-хроматографией со светодисперсионным детектором. Количество гидразидных групп определяют спектроскопией с последующей реакцией гидразидных групп с TNBS (тринитробензолсульфоновой кислотой). Промежуточные продукты, содер-4 007353 жащие другие аминокислоты и олигопептиды, получают таким же образом. Полимерные промежуточные продукты II также получают радикальной осадительной сополимеризацией соответствующего метакрилоилированного олигопептида N-трет-бутилоксикарбонилгидразида или соединения аминокислота(поли(НРМА-со-МА-Х-NHNН-ВОС с НРМА при условиях, описанных выше. После удаления защитной ВОС группы из поли(НРМА-со-МА-Х-NHNH-BOC) трифторуксусной кислотой полимерные промежуточные продукты II осаждают в смесь ацетона и диэтилового эфира, растворяют в воде, диализуют против воды и подвергают лиофильной сушке. Присоединение доксорубицина к полимерному предшественнику. 250 мг полимерного предшественника II (поли(HPMA-CO-MA-AB-NHNH2) (0,1 ммоль NHNH2) растворяют в 3 мл метанола. Этот раствор полимера добавляют к 23 мг Dox. HCl (40 мкмоль). К реакционной смеси добавляют 2 капли уксусной кислоты и неоднородный раствор перемешивают при комнатной температуре (в темноте). После реакции в течение 48 ч однородный раствор дважды очищают гельфильтрацией для отделения свободного Dox в колонке, заполненной Sephadex LH-20 в метаноле. Полимерную фракцию выделяют и концентрируют в вакуумном испарителе. Продукт повторно осаждают из метанола диэтиловым эфиром и сушат до постоянного веса. Содержание Dox и гидразидных групп определяют спектроскопией (=480 нм, =11500 л моль-1 см-1, вода) и методом TNBS, соответственно. MW и распределение молекулярной массы определяют жидкостной хроматографией (колонка(DAWN-DSP-F, Wyatt Technology, США) и ультрафиолетовый детектор (280 и 488 нм). Вышеописанный метод используют для получения всех остальных полимерных конъюгатов доксорубицина. Пример 2. Получение разветвленного макромолекулярного конъюгата. 400 мг полимерного предшественника I, содержащего олигопептидные последовательностиGlyPheGly, GlyLeuGly или GlyPheLeuGly (0,19 ммоль ONp) растворяют в 1,1 мл диметилсульфоксида. 105 мкл 0,2 М раствора 1,2 этилендиамина в диметилсульфоксиде (21 мкмоль EDA) добавляют при энергичном перемешивании и реакционную смесь оставляют для прохождения реакции при комнатной температуре в течение 1 ч. Добавляют раствор 100 мг гидрата гидразина (2 ммоль) в 0,3 мл диметилсульфоксида при интенсивном перемешивании раствора полимера и в течение последующих 3 ч реакционную смесь продолжают энергично перемешивать. Затем реакционную смесь разбавляют дистиллированной водой до 30 мл и очищают продукт диализом против дистиллированной воды (2 дня). Высокомолекулярный предшественник подвергают лиофильной сушке. МW и распределение молекулярной массы определяют жидкостной хроматографией, содержание гидразидных групп определяют спектроскопически и методом TNBS. Доксорубицин присоединяют к полимеру и характеристики конъюгата определяют при тех же условиях, которые описаны в примере 1. Пример 3. Получение конъюгата I с антителом (иммуноглобулином). Сополимер, содержащий гидразидные и малеимидные группы (MI) (поли(НРМА-co-MA-X-NHNH2CO-MA-X-NHNH-MI в боковых цепях, получают частичной модификацией гидразидных групп полимерного предшественника II, содержащего от 10 до 15 мол.% гидразидных групп, с использованием Nгидроксисукцинимидильного эфира малеимидилпропионовой кислоты (SMP). 250 мг предшественника II поли(НРМА-со-МА-ди-Glу-NНNН 2) (125 ммоль гидразидных групп) растворяют в 1,2 мл диметилсульфоксида и добавляют раствор 16,6 мг SMP (62,5 ммоль) в 0,6 мл диметилсульфоксида. Реакционную смесь перемешивают при комнатной температуре в течение 8 ч. После очистки на колонке PD-10 (элюент - дистиллированная вода) определяют MW и распределение молекулярной массы жидкостной хроматографией, определяют количество малеимидных групп модифицированным тестом Эллмана и определяют содержание оставшихся гидразидных групп методом TNBS. Доксорубицин связывают с этим сополимером таким же способом, как описано в примере 1. Введение -SH групп в молекулу антитела (иммуноглобулина). 15 мг антител (поликлонального антитимоцита IgG) (0,1 мкмоль) помещают в 1 мл фосфатного буфера (0,05 М NaH2PO4/Na2HPO4; 0,1 М NaCl; 0,01 М EDTA; pH 7,4) в колонку PD-10. 0,67 мг 2-иминотиолана (4 мкмоль) растворяют в 50 мкл диметилформамида и добавляют к раствору антител при сильном перемешивании. Через 2,5 ч перемешивания при комнатной температуре продукт выделяют гельфильтрацией в колонке PD-10 (фосфатный буфер, pH 7,4). Уровень модификации антитела (иммуноглобулина) определяют методом с использованием реакции -SH групп с реактивом Эллмана. Конъюгацию 60 мг поли(HPMA-co-MA-ди-Gly-NHN=Dox-co-MA-X-NHNH2-co-MA-X-NHNH-M), содержащего доксорубицин, гидразидные и малеимидные группы, с 20 мг модифицированных антител проводят в фосфатном буфере при pH 7,4 (см. выше) при комнатной температуре. Конечный продукт очищают гельфильтрацией и его характеристики определяют ультрафиолетовой спектроскопией (содержание Dox),аминокислотным анализом (содержание антител и иммуноглобулина) и электрофорезом с использованием Phastsystem - Pharmacia LKB (наличие свободного белка или активного агента).-5 007353 Пример 4. Получение конъюгата II c антителом (иммуноглобулином). На первом этапе синтеза полимерный предшественник II модифицируют SPDP (бифункциональный кросслинкер) при условиях, сходных с теми, при которых в примере 3 проводят модификацию полимера(с содержанием 3,3 мкмоль пиридилтио-(РD) групп) в 0,6 мл буфера добавляют 14 мг антител, иммуноглобулина (см. выше), модифицированного -SH группами, содержащих 0,68 мкмоль -SH групп, растворенных при перемешивании в 1,7 мл фосфатного буфера (0,05 М NaH2PO4/Na2HPO4; 0,1 М NaCl; 0,01 МEDTA; pH 7,4). Реакционную смесь перемешивают при комнатной температуре в течение 7 ч, после чего низкомолекулярные вещества и несвязанный полимер удаляют гель-фильтрацией. Затем конъюгат концентрируют ультрафильтрацией и определяют его характеристики способом, аналогичным описанному в примере 3. Пример 5. Получение конъюгата III с антителом (иммуноглобулином). Эти конъюгаты получают взаимодействием антител с молекулами, в которые были введены альдегидные группы мягким окислением периодатом натрия гидразидных групп, оставшихся после реакции полимерного предшественника II с доксорубицином. Получение окисленных антител. 40 мг антител (поликлональный антитимоцит IgG) помещают в ацетатный буфер (0,02 М СН 3 СООNа/ СН 3 СООН; 0,15 М NaCl; pH 5) с помощью колонки PD-10. 0,1 М раствор NaIO4 готовят в том же буфере в темноте. Растворы антител и периодата смешивают в отношении 4:1 для получения конечных концентрацийNaIO4 и антител 0,02 моль/л и 9 мг/л, соответственно. Реакционную смесь перемешивают при комнатной температуре в темноте в течение 2 ч, после чего добавляют 25 мкл этиленгликоля на каждый мл реакционной смеси. Через 20 мин окисленные антитела (иммуноглобулин) очищают и выделяют жидкостной хроматографией на колонке PD-10. Концентрацию антител (иммуноглобулина) в растворе определяют спектрофотометрией. Количество альдегидных групп определяют методом, использующим реакцию альдегидных групп с красителем Lucifer Yellow CH. Пример приготовления пробы конъюгата. 36,5 мг окисленных антител в 5 мл ацетатного буфера (0,02 М СН 3 СОONа/СН 3 СООН; 0,15 М NaCl;pH 5) после охлаждения до 15 С смешивают с раствором 73 мг полимерного предшественника II со связанным Dox, поли(MA-co-MA-ди-Gly-NHN=Dox-co-MA-ди-Gly-NHNH2), растворенного в 1 мл буфера. Реакционную смесь перемешивают при 15 С в темноте в течение 16 ч. Через 16 ч доводят pH реакционной смеси до 7,2 с помощью 0,1 М NaOH. Низкомолекулярные вещества и несвязанный полимер удаляют гель-фильтрацией. Затем конъюгат концентрируют и определяют его характеристики тем же способом, как характеристики других конъюгатов с антителами (иммуноглобулином). Для конъюгации с полимерами используют неспецифический иммуноглобулин человека и кролика(IgG), поликлональные антитимоцитные антитела (ATG), моноклональные антитела анти-Thy 1.2, антиСD4, анти-CD71, анти-ВСL1, анти-СD4, анти-CD8, анти-CD14 и другие антитела против опухолеспецифических антигенов (анти-ТАА). Пример 6. Высвобождение доксорубицина из полимерного конъюгата in vitro. Гидролитическую стабильность конъюгатов и скорость высвобождения активного агента из полимера измеряют в модельных системах при различных рН и температурах. На фиг. 5 показаны результаты измерения скорости высвобождения доксорубицина из полимеров, различающихся составом спейсера,при кислотности среды, соответствующей рН крови (7,4), и при кислотности среды, соответствующей рН среды эндосом или лизосом (рН 5-6). Концентрация связанного Dox (0,5 ммоль/л) в ацетатном буфере 0,1 М в экспериментах является постоянной (СН 3 СООМа/СН 3 СООН, 0,05 М NaCl). Образцы инкубируют при 37 С в темноте и порции по 0,1 мл забирают через заданные интервалы и анализируют методом ВЭЖХ после экстракции Dox из раствора. Результаты показывают, что структура связующего звена между лекарственным средством и полимерным носителем влияет на скорость отделения активного агента от носителя. Скорость высвобождения является относительно низкой при рН крови и более чем в 10 раз выше при рН, соответствующем клеточной среде. Принимая во внимание факт, что период задержки активного агента в кровеносных сосудах является относительно коротким, эксперимент подтверждает относительную устойчивость полимерных конъюгатов во время транспортировки и их способность к высвобождению активного агента сразу после его проникновения в клетки. Пример 7. Цитотоксическая активность in vitro полимерных конъюгатов, содержащих доксорубицин, гидролитически высвобождаемый в клетках с нормальным содержанием лизосом (фиг. 6). Способность полимерных конъюгатов снижать деление клеток или пролиферацию клеток-мишеней называют цитотоксической или цитостатической активностью. Цитотоксическую активность определяютin vitro путем ингибирования инкорпорации 3H-тимидина в ядра клетки-мишени [hov и др., 2000]. Инкорпорация тимидина и активность конъюгатов обратно пропорциональны. Низкая инкорпорация тимидина означает высокую цитотоксическую активность тестируемых веществ. Клетки отобранных линий опухоли (Т-лейкемическая линия мыши EL4, клеточная В-лейкемия мыши BCL1, В-клеточная лимфома-6 007353 мыши 38 С 13, первичная колоректальная карцинома человека SW480, метастазирующая колоректальная карцинома человека SW620, колоректальная карцинома человека SW620, генетически модифицированная геном мыши для Thy 1.2 SW620/T) и спленоцитов мыши, стимулированных Т-клеточным митогеном,то есть конканавалином А, и периферические лимфоциты человека закапывают из пипетки в количествах 1 х 104 - 5 х 105 (в зависимости от тестируемых клеточных систем) в среду для выращивания RPMI 1640 в 96-луночный FB-культуральный планшет (NUNC, Дания). Последующее культивирование проводят или без дополнительной стимуляции (все линии опухоли и необработанные мышиные и человеческие лимфоциты), или когда изучают влияние на нормальные, быстроразмножающиеся Т-лимфоциты, в присутствии Т-клеточного митогена конканавалина А. Концентрация митогена конканавалина А, при которой выращивают клетки, составляет 1,25 мкг на лунку. Образцы для тестирования или свободный доксорубицин в конечных концентрациях 0,0016-80 мкг/мл добавляют в каждую лунку планшета, содержащего тестируемые клетки в питательной среде с митогеном конканавалином А или без него. Общий объем лунок составляет 250 мкл. Каждую концентрацию тестируют параллельно для одного образца и одной линии по 3-5 раз. Титрационные микрокультуральные планшеты инкубируют при 37 С в атмосфере 5% СО 2 в течение 24-72 ч. После завершения культивирования в каждую лунку добавляют 1 мкКи 3Hтимидина. Через 5-6 ч после этого (в зависимости от тестируемой системы) клетки собирают (коллектор клеток Tomtec) на стекловолоконный фильтр (Filtermat, Wallac), сушат и проверяют уровень их радиоактивности (MicroBeta Trilux, Wallac). IC50 для конъюгатов без антител, содержащих гидролитически высвобождаемый доксорубицин, составляет от 0,01 до 1,41 мкг доксорубицина/мл в зависимости от устойчивости (чувствительности к обработке используемой линии клеток-мишеней) и от типа конъюгата. Подтверждается, что цитотоксичность - исключительное свойство конъюгатов, содержащих гидролитически высвобождаемый доксорубицин, так как конъюгаты без активного агента не являются цитотоксичными. Испытания in vitro доказали, что а) активность конъюгатов с гидролитически высвобождаемым активным агентом не зависит от ферментативного разрушения ковалентной связи между этим агентом и олигопептидным звеном и б) конъюгаты, где связующее звено между основной полимерной цепью и активным агентом представляет собой только -аминокапроновую кислоту или парааминобензойную кислоту, так же эффективны, как те, которые содержат ди- или тетрапептидное звено. Пример 8. Цитотоксическая активность in vitro полимерных конъюгатов, содержащих гидролитически высвобождаемый доксорубицин, в клетках с низким содержанием лизосом. Испытание цитотоксической активности in vitro проводят таким же образом, как описано в примере 7. В качестве клеток-мишеней выбирают клетки эритролейкемической линии К 562 с низким содержанием лизосом. Доказано, что конъюгаты, содержащие гидролитически высвобождаемый доксорубицин,являются значительно более цитотоксичными даже в этой линии, в которой конъюгаты с ферментативно высвобождаемым доксорубицином являются цитотоксичными в очень ограниченной степени (фиг. 7). Эти результаты показывают, что конъюгаты с гидролитически высвобождаемым доксорубицином эффективны даже в клеточных системах, бедных лизосомами. Пример 9. Противоопухолевая активность in vivo полимерных конъюгатов, содержащих гидролитически высвобождаемый доксорубицин (фиг. 8). Мышам линии C57BL/10 подкожно трансплантируют клетки Т-клеточной лимфомы (EL4). Опухолевые клетки вводят подопытным животным в нижнюю половину спины в количестве 1 х 10 клеток на мышь. День трансплантации клеток отмечают как день 0. Затем полимерные конъюгаты с гидролитически высвобождаемым доксорубицином вводят интраперитонеально или в дни 1, 3, 5, 7 и 9 (защитный режим), или в дни 10, 12, 14, 16 и 18, или в дни 12, 14, 16, 18 и 20 (терапевтический режим). Суточная доза доксорубицина составляет 50 мкг/мышь. Конъюгаты значительно замедляют рост опухоли и увеличивают количество подопытных животных, выживающих в течение длительного времени. В то время как полимерный конъюгат без активного агента вообще не оказывает никакого эффекта и классический, то есть немодифицированный, доксорубицин оказывает очень ограниченный эффект (максимальный период выживания подопытных животных составляет 40 дней по сравнению с 35 днями в контрольной группе), назначение полимерных конъюгатов с гидролитически высвобождаемым доксорубицином приводит к долговременному выживанию, то есть больше чем 80 дней, 40 и 20% мышей в защитном режиме и терапевтическом режиме, соответственно. Мышам линии Balb/c внутрибрюшинно вводят клетки мышиной В-клеточной лейкемии BCL1. Опухолевые клетки вводят в количестве 5 х 105 клеток на мышь. День трансплантации клеток отмечают как день 0. Затем полимерные конъюгаты с гидролитически высвобождаемым доксорубицином внутривенно вводят в дни 11, 13 и 17 (терапевтический режим). Суточная доза доксорубицина составляет 100 мкг/мышь. Тестируемые конъюгаты имеют значительную антиопухолевую активность. В то время как мыши контрольной группы живут не дольше чем 40 дней, 20% мышей, пролеченных тестируемыми конъюгатами,живут дольше чем 100 дней, а 10% - дольше чем 140 дней. ЛитератураRel. 73, 89-102 (2001) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгаты, состоящие из полимерного носителя, содержащего 30-3000 связанных мономерных единиц, формирующих полимерную цепь, включающих 60-99% N-(2-гидроксипропил)метакриламидных единиц,1-25% единиц метакрилоилированных гидразонов -аминокислот, -аминокислот, ароматических аминокислот или олигопептидов, заканчивающихся молекулой антрациклинового канцеростатика,0,5-15% единиц метакрилоилированных -аминокислот, -аминокислот, ароматических аминокислот, олигопептидов или их натриевых солей; и при необходимости 0,5-10% единиц метакрилоилированных гидразидов -аминокислот, -аминокислот, ароматических аминокислот или олигопептидов. 2. Конъюгаты по п.1, дополнительно содержащие 0,5-5% метакрилоилированных -аминокислот, аминокислот, ароматических аминокислот, олигопептидов, заканчивающихся молекулой иммуноглобулина или специфического моно- либо поликлонального антитела. 3. Конъюгаты по п.1 или 2, дополнительно содержащие 0,1-5% единиц ферментативно расщепляемых метакрилоилированных олигопептидов, соединенных алкилендиаминами, образующих связующие звенья между полимерными цепями с образованием поперечно-сшитой структуры конъюгата. 4. Конъюгаты по любому из пп.1-3, где антрациклиновым канцеростатиком является доксорубицин. 5. Конъюгаты по п.1, имеющие общую формулу-8 007353 где отдельные структурные единицы распределены в цепи произвольным образом, Х представляет собой звено, образованное остатком -аминокислоты, -аминокислоты или олигопептида, и х имеет значения от 20 до 3000, а - от 1 до 750, каждый из b и с имеет значения от 1 до 450. 6. Конъюгаты по п.2, имеющие общую формулу где X, х, a, b и с такие, как указано выше, d имеет значения от 1 до 150, S представляет собой антитело,выбранное из группы, включающей -глобулин для внутривенного введения, аутологические антитела,антитела анти-17-1-A, анти-СА 15-3 и аналогичные, присоединенные к полимерной цепи, либо S представляет собой биологически расщепляемое олигопептидное звено, соединяющее другие аналогичные цепи. 7. Конъюгаты по пп.1-6, где аминокислоты или олигопептиды выбраны из группы, включающейGly, Ala, Leu, GlyGly, GlyLeuGly, GlyPheGly, GlyPheLeuGly, -аланин, -аминомасляную кислоту, аминокапроновую кислоту (АКар), парааминобензойную кислоту (АВ). 8. Конъюгаты по п.2 или 6, где антитела выбраны из группы, включающей -глобулин для внутривенного введения, аутологические антитела, антитела анти-17-1-A, анти-СА 15-3 и другие опухолеспецифические и опухолеассоциированные антитела. 9. Конъюгаты по п.3, где связующие звенья, соединяющие полимерные цепи, выбраны из группы,включающей GlyPheLeuGly, GlyLeuGly, GlyPheGly, GlyLeuPheGly. 10. Фармацевтическая композиция для лечения опухолей, характеризующаяся тем, что содержит в качестве активного агента конъюгат, охарактеризованный в любом из пп.1-9. 11. Фармацевтическая композиция по п.10, предназначенная для лечения опухолей, таких как рак молочной железы или колоректальная опухоль.
МПК / Метки
МПК: A61K 47/48
Метки: терапии, рн-чувствительные, антрациклиновых, активных, конъюгаты, направленного, действия, полимерные, канцеростатических, агентов
Код ссылки
<a href="https://eas.patents.su/14-7353-rn-chuvstvitelnye-polimernye-konyugaty-antraciklinovyh-kancerostaticheskih-aktivnyh-agentov-dlya-terapii-napravlennogo-dejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">Рн-чувствительные полимерные конъюгаты антрациклиновых канцеростатических активных агентов для терапии направленного действия</a>
Предыдущий патент: Флотореагент для селективной флотации и способ флотации
Следующий патент: Применение реакционноспособных полимерных поверхностно-активных веществ для получения эмульсий
Случайный патент: Ролик для конвейера и уплотнение для использования в таком ролике












