Новые циклические α-амино-γ-гидроксиамидные соединения, способ их получения и фармацевтические композиции, их содержащие
Номер патента: 4955
Опубликовано: 28.10.2004
Авторы: Фуркез Жан-Мари, Ножан Оливье, Юссон-Робер Бернадетта, Вержбицкий Мишель, Буланже Мишель, Левен Нижель
Формула / Реферат
1. Соединения формулы (I)
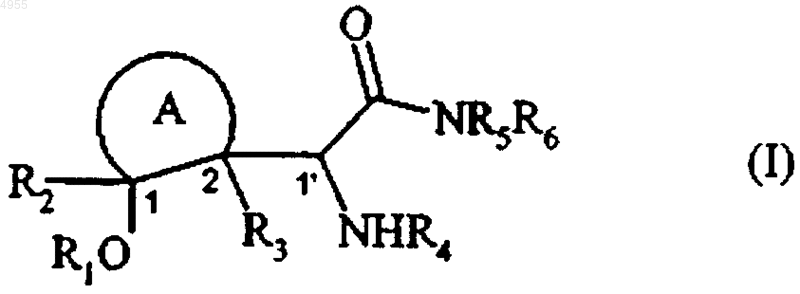
в которой
 представляет собой насыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода в кольце, необязательно замещенное одной или более линейными или разветвленными (C1-C6)алкильными группами,
представляет собой насыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода в кольце, необязательно замещенное одной или более линейными или разветвленными (C1-C6)алкильными группами,
R1 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)ацильную группу,
R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу,
R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу,
или R5 и R6 совместно с атомом азота, их несущим, образуют азотсодержащий гетероцикл, необязательно замещенный одной или более одинаковыми или различными группами, выбираемыми из групп циано, CO2R7 (в которой R7 представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу), COR7 (в которой R7 имеет значение, указанное здесь ранее), нитро, CONR8aR8b (в которой R8a и R8b, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу или R8a и R8b совместно образуют азотсодержащий гетероцикл), S(O)nR9 (в которой n представляет собой 1, 2 или 3 и R9 представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу или арильную группу) и PO3R10aR10b (в которой R10a и R10b, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6-алкильную группу),
их стереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой,
азотсодержащий гетероцикл понимается как необязательно мостиковая, насыщенная, моно- или бициклическая, имеющая от 5 до 12 членов кольца группа, содержащая 1, 2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота и необязательно присутствующий(е) дополнительный(е) гетероатом(ы) выбирают из атомов кислорода, азота и серы,
арильная группа понимается как фенил, бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена 1 или более одинаковыми или различными атомами или группами, выбираемыми из атомов галогенов и групп линейного или разветвленного (C1-C6)алкила, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)полигалоалкила, нитро и (C1-C2)алкилендиокси.
2. Соединение формулы (I) по п.1, в которой  представляет собой углеводородное кольцо, имеющее от 5 до 6 атомов углерода в кольце, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
представляет собой углеводородное кольцо, имеющее от 5 до 6 атомов углерода в кольце, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
3. Соединение формулы (I) либо по п.1, либо по п.2, в которой R5 и R6 совместно образуют необязательно замещенный азотсодержащий гетероцикл, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
4. Соединение формулы (I) по п.3, в которой R5 и R6 совместно образуют необязательно замещенный пирролидин или необязательно замещенный тиазолидин, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
5. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'S)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанол, его энантиомер (1S,2R,1'R), а также его аддитивные соли с фармацевтически приемлемой кислотой.
6. Соединение формулы (I) по п.1, которое представляет собой (1R*,2R*,1'R*)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанол, а также его аддитивные соли с фармацевтически приемлемой кислотой, причем соединение (1R*,2R*,1'R*) следует понимать как рацемическую смесь 2 энантиомеров, имеющих абсолютные конфигурации (1R,2R,1'R) и (1S,2S,1'S).
7. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанол, его (1S,2R,1'S)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой.
8. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'S)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанол, его (1S,2R,1'R)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой.
9. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанол, его (1S,2R,1'S)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой.
10. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанол, его (1S,2R,1'S)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой.
11. Способ получения соединений формулы (I) по п.1, который отличается тем, что хлороацетилхлорид подвергают реакции с соединением формулы (II)
HNR5R6 (II),
в которой R5 и R6 имеют значения, указанные для формулы (I),
с получением соединения формулы (III)
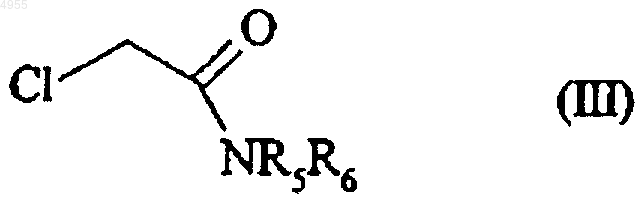
в которой R5 и R6 имеют значения, указанные тут ранее,
которое переводят в амин формулы (IV)
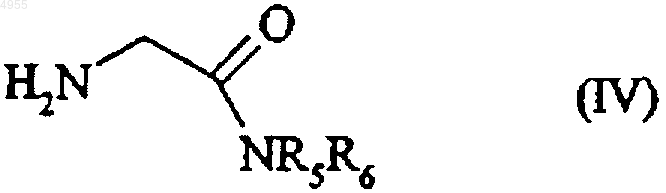
в которой R5 и R6 имеют значения, указанные тут ранее,
который подвергают реакции с бензальдегидом с получением соединения формулы (V)
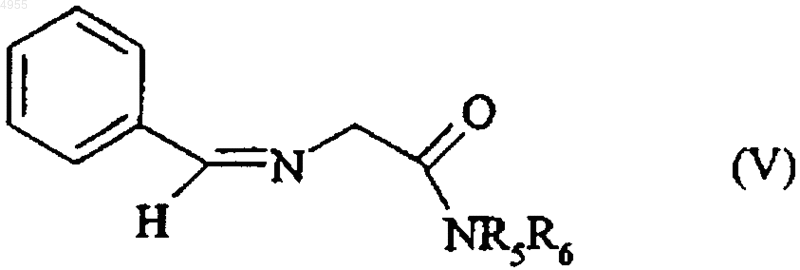
в которой R5 и R6 имеют значения, указанные тут ранее,
которое подвергают реакции с соединением формулы (VI)
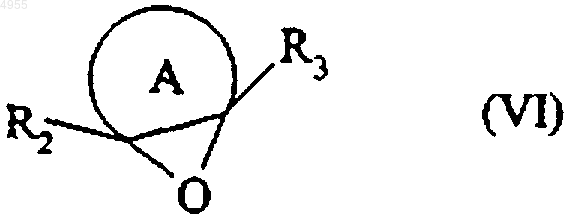
в которой  , R2 и R3 имеют значения, указанные для формулы (I),
, R2 и R3 имеют значения, указанные для формулы (I),
с получением, после необязательного ацилирования гидроксифункции, соединения формулы (VII), которое имеет относительную конфигурацию транс
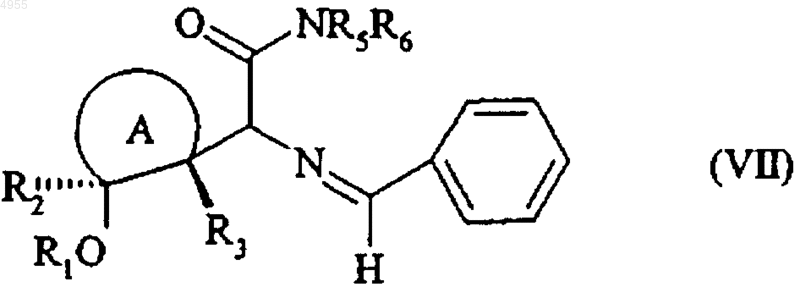
в которой  , R1, R2, R3, R5 и R6 имеют значения, указанные тут ранее,
, R1, R2, R3, R5 и R6 имеют значения, указанные тут ранее,
которое переводят при помощи гидролиза, после которого, при желании, следует ацилирование аминофункции, с получением соединения формулы (Ia) с относительной конфигурацией транс, частного случая соединений формулы (I)

в которой  , R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,
, R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,
которое переводят, при желании, в соединение формулы (Ib) с относительной конфигурацией цис, частный случай соединений формулы (I)
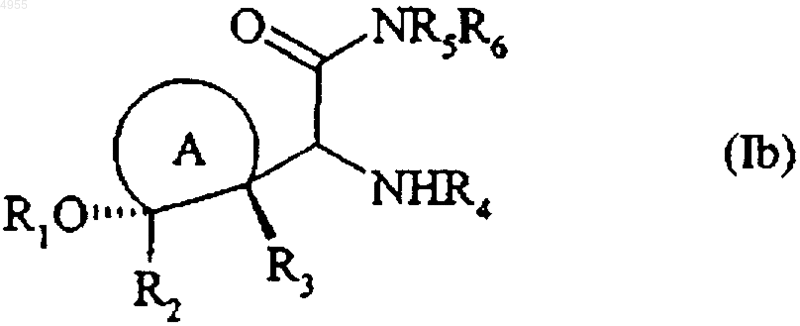
в которой  , R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,
, R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,
эти соединеэшя формул (Ia) и (Ib) разделяют, при желании, на их изомеры при помощи традиционных методик разделения, очищают, при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой.
12. Фармацевтическая композиция, которая включает в качестве активного ингредиента соединение по любому из пп.1-10 в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными носителями.
13. Фармацевтическая композиция по п.12 для применения в качестве лекарства при лечении непереносимости глюкозы и нарушений, связанных с гипергликемией, таких как диабет типа II или ожирение.
14. Фармацевтическая композиция по п.12 для применения в качестве противодиабетического лекарственного препарата.
Текст
1 Данное изобретение относится к новым аминогидроксиамидным соединениям, к способу их получения, к фармацевтическим композициям, их содержащим, а также к их применению в качестве противодиабетиков. Циклическое -аминогидроксикислотное соединение было описано в журнале J. Org.Chem. 1994, 59, (26), 8101-6, без упоминания какой-либо фармакологической активности для этого соединения. Данное изобретение более конкретно относится к соединениям формулы (I) в которой представляет собой насыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода в кольце, необязательно замещенное одной или более линейными или разветвленными (С 1-С 6)алкильными группами,R1 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)ацильную группу,R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,или R5 и R6 совместно с атомом азота, их несущим, образуют азотсодержащий гетероцикл, необязательно замещенный одной или более одинаковыми или различными группами,выбираемыми из групп циано, CO2R7 (в которойR7 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу), COR7 (в которой R7 имеет значение,указанное здесь ранее), нитро, CONR8aR8b (в которой R8a и R8b, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу или R8a иR8b совместно образуют азотсодержащий гетероцикл), S(O)nR9 (в которой n представляет собой 1, 2 или 3 и R9 представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу или арильную группу) иPO3R10aR10b (в которой R10a и R10b, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу),к их стереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой. 2 Среди фармацевтически приемлемых кислот можно упомянуть, без внесения ограничений, соляную, бромоводородную, серную, фосфорную, уксусную, трифтороуксусную, молочную, пирувовую, малоновую, сукциновую, глутаровую, фумаровую, винно-каменную, малеиновую, лимонную, аскорбиновую, оксалиловую,метансульфоновую, бензолсульфоновую, камфорную кислоту, др. Азотсодержащий гетероцикл следует понимать как необязательно мостиковую, насыщенную, моно- или бициклическую, имеющую от 5 до 12 членов кольца группу, содержащую 1,2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота, и необязательно присутствующий(е) дополнительный(е) гетероатом(ы) выбирают из атомов кислорода, азота и серы. Предпочтительными азотсодержащими гетероциклами являются группы пирролидинил,тиазолидинил, пиперидил, морфолинил, азабицикло[3,3,0]октил и пиперазинил. Арильную группу следует понимать как фенил, бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена 1 или более одинаковыми или различными атомами или группами, выбираемыми из атомов галогенов и групп линейного или разветвленного (С 1-С 6)алкила, гидрокси, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (C1-С 6)полигалоалкила, нитро и(С 1-С 2)алкилендиокси. Предпочтительными соединениями форпредмулы (I) являются такие, в которых ставляет собой углеводородное кольцо, имеющее от 5 до 6 атомов углерода в кольце. Преимущественный вариант изобретения касается соединений формулы (I), в которой R5 и R6 совместно образуют необязательно замещенный азотсодержащий гетероцикл. Среди них предпочтение отдается, в особенности, таким соединениям, в которых R5 иR6 совместно образуют необязательно замещенный пирролидин или необязательно замещенный тиазолидин. Среди предпочтительных соединений по изобретению следующие можно упомянуть более конкретно:(1R,2S,1'S)-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанол, его (1S,2R,1'R) энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой;(1R,2R,1'R)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанол, а также его аддитивные соли с фармацевтически приемлемой кислотой, причем соединение (1R,2R,1'R) следует понимать как рацемическую смесь 2 энантиомеров, имеющих абсолютные конфигурации (1R,2R,1'R) и (1S,2S,1'S); 3 энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой;(1R,2S,1'S)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанол, его (1S,2R,1'R) энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой;(1R,2S,1'R)-2-[1'-амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанол, его (1S,2R,1'S) энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой; и(1R,2S,1'R)-2-[1'-амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанол, его (1S,2R,1'S) энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой Изобретение также распространяется на способ получения соединений формулы (I), который отличается тем, что хлороацетилхлорид подвергают реакции с соединением формулы (II)(II) в которой R5 и R6 имеют значения, указанные для формулы (I),с получением соединения формулы (III) в которой R5 и R6 имеют значения, указанные тут ранее,который подвергают реакции с бензальдегидом с получением соединения формулы (V), R2 и R3 имеют значения, указанные для формулы (I),с получением, после необязательного ацилирования гидроксифункции, соединения формулы (VII), которое имеет относительную конфигурацию транс 4 которое переводят при помощи гидролиза,после которого, при желании, следует ацилирование аминофункции, с получением соединения формулы (Iа) с относительной конфигурацией транс, частного случая соединений формулы (I), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,которое переводят, при желании, в соединение формулы (Ib) с относительной конфигурацией цис, частный случай соединений формулы (I), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,эти соединения формул (Iа) и (Ib) разделяют, при желании, на их изомеры при помощи традиционных методик разделения, очищают,при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой. Соединения формулы (Iс), частный случай соединений формулы (I) в которой представляет собой насыщенное углеводородное кольцо, имеющее 6 атомов углерода в кольце, необязательно замещенное одной или более линейными или разветвленными(I),также можно получать из соединения формулы (VIII) в которой R11 представляет собой атом водорода или фенильную группу и G представляет собойCN или линейную или разветвленную (С 1-С 6)алкоксикарбонильную группу,которое подвергают реакции с соединением формулы (VIa), частным случаем соединений формулы (VI):, R2 и R3 имеют значения, указанные тут ранее,с получением соединения формулы (IX) с относительной конфигурацией транс, G, R2, R3 и R11 имеют значения,указанные тут ранее,это соединение формулы (IX),если желают получить соединение с относительной конфигурацией транс, гидролизируют в кислотных условиях с получением, после необязательного ацилирования аминофункции,соединения формулы (Xt), в которой соединение кольца представляет собой транс, R2, R3 и R4 имеют значения,указанные тут ранее,которое подвергают реакции с соединением формулы (II) с получением, после необязательного ацилирования гидроксифункции, соединения формулы (Id) с относительной конфигурацией транс, частного случая соединений формулы (Iс), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,или, если желают получить соединение с относительной конфигурацией цис, подвергают реакции Мицуноби с получением, после необязательного ацилирования аминофункции, соединения формулы (Хс), в котором кольцевое соединение представляет собой цис 6 которое подвергают реакции с соединением формулы (II) с получением, после необязательного ацилирования гидроксифункции, соединения формулы (Iе) с относительной конфигурацией цис, частного случая соединений формулы (Iс), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,эти соединения формул (Id) и (Iе) разделяют, при желании, на их изомеры при помощи традиционных методик разделения, очищают,при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой. Соединения формулы (If) с относительной конфигурацией цис, частный случай соединений формулы (I) в которой представляет собой насыщенное углеводородное кольцо с 5 атомами углерода в кольце, необязательно замещенное одной или более линейными или разветвленными (С 1 С 6)алкильными группами, и R1, R2, R3, R4, R5 иR6 имеют значения, указанные для формулы (I),также можно получать из соединения формулы (VIII), которое подвергают реакции с соединением формулы (VIb), частным случаем соединений формулы (VI), R2 и R3 имеют значения, указанные тут ранее,с получением соединения формулы (XI) с относительной конфигурацией транс, R2, R3 и R11 имеют значения,указанные тут ранее,которое подвергают гидролизу при кислотных условиях с получением, после необязательного ацилирования аминофункции, соеди 7 нения формулы (XII), в котором кольцевое соединение представляет собой цис, R2, R3 и R4 имеют значения,указанные тут ранее,которое подвергают реакции с соединением формулы (II) с получением, после необязательного ацилирования гидроксифункции, соединения формулы (If), которое разделяют, при желании, на его изомеры при помощи традиционных методик разделения, очищают, при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой. Соединения формулы (Ig) с относительной конфигурацией транс, частный случай соединений формулы (I) также можно получить из соединения формулы (XIII) в которой R11 имеет значение, указанное здесь ранее, и R12 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое подвергают реакции с соединением формулы (VIb) с получением соединения формулы (XIV) с относительной конфигурацией транс, R2, R3, R11 и R12 имеют значения, указанные тут ранее,которое подвергают гидролизу при мягких кислотных условиях с получением, после ацилирования или протекции аминофункции, соединения формулы (XV) с относительной конфигурацией транс, R2, R3 и R12 имеют значения,указанные тут ранее, и R'4 представляет собой либо линейную или разветвленную (С 1-С 6)алкильную группу, либо защитную группу для аминофункции,это соединение формулы (XV) подвергают реакции при условиях пептидного связывания с соединением формулы (II) с получением, после необязательного ацилирования гидроксифункции и необязательной депротекции аминофункции, соединения формулы (Ig), которое разделяют, при желании, на его изомеры при помощи традиционных методик разделения, очищают,при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой. Кроме того, что они новы, соединения по настоящему изобретению имеют ценные фармакологические свойства. Они имеют понижающие уровень глюкозы в крови свойства, которые делают их полезными при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение. Изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I) совместно с одним или более подходящими инертными, нетоксичными эксципиентами. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального (внутривенного,внутримышечного или подкожного) или назального применения, таблетки или драже,подъязычные таблетки, желатиновые капсулы,пастилки, суппозитории, инъекционные препараты, питьевые суспензии, пр. Полезная дозировка может варьироваться в зависимости от природы и сложности расстройства, графика приема, а также возраста и веса пациента и каких-либо связанных лечений. Дозировка варьируется от 0,5 мг до 2 г на 24 ч за один или более приемов. Следующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Применяемые исходные материалы представляют собой известные соединения или получаются по известным способам. Структуры соединений, описанных в примерах, определяли согласно обычным спектрометрическим методикам (инфракрасный, ЯМР,масс-спектрометрия). Соединение (1R,2R,1'S) следует понимать как рацемическую смесь 2 энантиомеров,имеющих абсолютные конфигурации (1R,2R,1'S) и (1S,2S,1'R). Соединение (1R,2R,1'RS) следует понимать как рацемическую смесь 4 энантиомеров, 9 имеющих абсолютные конфигурации (1R,2R,1'R),(1R,2R,1'S), (1S,2S,1'R) и (1S,2S,1'S). Соединение, имеющее конфигурацию(1,2,1') или (1,2,1') следует понимать как соединение, выбираемое из соединений, имеющих абсолютные конфигурации (1R,2S,1'S) и(1S,2R,1'R), причем если соединение (1,2,1') представляет собой соединение с конфигурацией (1R,2S,1'S), то соединение (1,2,1') представляет собой другой энантиомер. Фумарат соединения следует понимать как аддитивную соль 1:1 упомянутого соединения с фумаровой кислотой (1 моль фумаровой кислоты на 1 моль соединения). Хемифумарат соединения следует понимать как аддитивную соль 1:0,5 упомянутого соединения с фумаровой кислотой (0,5 моль фумаровой кислоты на 1 моль соединения). Пример 1. Фумарат (1R,2S,1'S)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанолa. Стадия A. (2RS,1'R,2'S)-2-[(Дифенилметилен)амино]-2-(2'-гидроксициклогексил)ацетонитрил. 10 ммоль 2,5 М раствора н-бутиллития добавляют при -30/-40 С к 10 ммоль диизопропиламина, растворенного в тетрагидрофуране, а затем, после перемешивания на протяжении 15 мин при этой температуре, реакционную смесь охлаждают до -70 С и добавляют 10 ммоль [(дифенилметилен)амино]ацетонитрила, растворенного в тетрагидрофуране. После перемешивания на протяжении 4 ч при -70 С добавляют 10 ммоль оксида циклогексена в тетрагидрофуране, после чего следует 10 ммоль этерата трифторида бора. Реакционную смесь перемешивают на протяжении еще 1 ч при -70 С и затем доводят до +10 С перед тем, как гидролизировать. Стадия В. (3R,3aR,7 аS)-3-Аминогексагидро-1-бензофуран-2(3 Н)-он. 160 мл 4 М соляной кислоты добавляют к неочищенной смеси, полученной на предыдущей стадии. Реакционную смесь затем перемешивают на протяжении 3 дней, и затем декантируют. Водную фазу промывают диэтиловым эфиром, затем добавляют 25 мл концентрированной соляной кислоты и реакционную смесь нагревают при 60 С на протяжении 5 дней. После возвращения к температуре окружающей среды растворители выпаривают. К полученному остатку добавляют воду, а затем карбонат калия, в количестве, достаточном для достижения уровня рН 9-10. После экстрагирования дихлорометаном комбинированные органические фазы сушат, фильтруют и после этого выпаривают. Полученный остаток очищают при помощи хроматографин на кремнеземе (элюант: дихлорометан/метанол 95/5) и потом разделяют диастереоизомеры при помощи препаративной ЖХВР. Ожидаемый продукт является первым из диастереоизомеров, разделенных таким образом. 10 Стадия С. (1R,2S,1'S)-2-[1'-Aмино-2'oкco-2'-1 пирролидинил)этил]циклогексанол. 20 ммоль пирролидина добавляют к 10 ммоль соединения, полученного на предыдущей стадии, растворенного в толуоле. После перемешивания на протяжении 24 ч при температуре окружающей среды растворитель выпаривают. Полученный остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол/аммиак 90/10/1) с получением ожидаемого продукта в виде рацемической смеси. Стадия D. Фумарат (1R,2S,1'S)-2-[1'амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Соединение, полученное на предыдущей стадии, переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта. Пример 2 А. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Рацемическую смесь, полученную на стадии С примера 1, разделяют при помощи препаративной хиральной хроматографии ЖХВР (колонна: Chiralpack AS, элюант: н-гептан/изопропанол/диэтиламин). Первый из полученныx энантиомеров переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Точка плавления: 190-192 С Индекс вpащения: D=-20,23 (вода, с=1,=365 нм) Элементный микроанализ: С% Н%N% Вычисленный 56,13 7,65 8,18 Обнаруженный 56,13 7,74 8,05 Пример 2 В. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Ожидаемый продукт получают, переводя второй из энантиомеров, полученных в примере 2 А, в его фумарат. Точка плавления: 190 С Элементный микроанализ: С% Н%N% Вычисленный 56,13 7,65 8,18 Обнаруженный 56,08 7,71 8,06 Пример 3. Фумарат (1R,2R,1'R)-2-[1'аминo-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Стадия A. (1R,2R,1'RS)-2-[1'-Aмино-2'оксо-2'-(1-пирролидинил)этил]циклопентанол. Ожидаемый продукт получают согласно способу, описанному на стадиях с А по С примера 1, заменив оксид циклогексена на оксид циклопентена. 11 Стадия В. Фумарат (1R,2R,1'R)-2-[1'амино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Соединение, полученное на предыдущей стадии, очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол/ аммиак 90/10/1). Первый из диастереоизомеров,полученных в порядке вымывания, затем переводят в его фумарат с получением ожидаемого продукта.N% Вычисленный 54,87 7,37 8,53 Обнаруженный 55,14 7,56 8,48 Пример 4. Хемифумарат (1R,2R,1'S)-2[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанолa. Ожидаемый продукт получают переводом второго из диастереоизомеров, полученных на стадии В примера 3, в его хемифумарат. Точка плавления: 210 С Элементный микроанализ: С% Н%N% Вычисленный 57,76 8,20 10,26 Обнаруженный 57,89 8,25 10,29 Пример 5. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Рацемическую смесь примера 3 разделяют при помощи препаративной хиральной хроматографии ЖХВР. Первый из полученных энантиомеров переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Пример 6. Фумарат (1,2,1')-2-[1'-aмино 2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Ожидаемый продукт получают, переводя второй из энантиомеров, полученных в примере 5, в его фумарат. Пример 7. Хемифумарат (1R,2S,1'R)-2[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Стадия А. Этил[(дифенилметилен)амино](2-гидроксициклопентил)ацетат. Ожидаемый продукт получают согласно способу, описанному на стадии А примера 1,исходя из глицината этил N-дифенилметилена и оксида циклопентена. Стадия В. Этил(1R,2S,1'RS)аминo-(2 гидроксициклопентил)ацетат. 24 ммоль 1 М раствора соляной кислоты добавляют к 10 ммоль соединения, полученного на предыдущей стадии, растворенного в эфире. Реакционную смесь затем перемешивают на протяжении 30 мин при температуре окружающей среды и затем декантируют. Водную фазу 12 затем промывают эфиром и затем ее рН устанавливают на от 7 до 8, добавляя карбонат калия. После экстрагирования дихлорометаном органическую фазу сушат и затем фильтруют и растворитель выпаривают с получением ожидаемого продукта. Стадия С. Этил(1R,2S,1'R)амино-(2 гидроксициклопентил)ацетат. Остаток, полученный на предыдущей стадии, хроматографируют на кремнеземе (элюант: дихлорометан/метанол 90/10). Ожидаемый продукт является первым из 2 диастереоизомеров,разделенных таким образом. Стадия D. Этил(1R,2S,1'R)[(бензилоксикарбонил)амино]-(2-гидроксициклопентил)ацетат. К 10 ммоль соединения, полученного на предыдущей мтадии, растворенного в этилацетате, добавляют концентрированный раствор гидрогенкарбоната натрия и затем, по каплям,10 ммоль хлороформата бензила. После перемешивания на протяжении 2 ч при температуре окружающей среды реакционную смесь декантируют и экстрагируют этилацетатом, а затем объединенные органические фазы промывают,сушат, фильтруют и затем выпаривают. Полученный остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/ метанол 95/5) с получением ожидаемого продукта. Стадия Е. (1R,2S,1'R)[(Бензилоксикарбонил)амино]-(2-гидроксициклопентил)уксусная кислота. 10 ммоль 1 М раствора гидрохлорида натрия добавляют к 10 ммоль соединения, полученного на предыдущей стадии, растворенного в этаноле. Реакционную смесь затем нагревают с обратным холодильником на протяжении 1 ч,и затем выпаривают этанол и воду, и затем добавляют 10 ммоль лимонной кислоты к полученному остатку. Водную фазу затем экстрагируют дихлорометаном и затем сушат, фильтруют и концентрируют с получением ожидаемого продукта. Стадия F. (1R,2S,1'R)-2-[1'-[(Бензилоксикарбонил)амино]-2'-оксо-2'-(1-пирролидинил) этил]циклопентанол. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в тетрагидрофуране, добавляют 12 ммоль пирролидина и 20 ммоль диизопропилэтиламина, а затем смесь 12 ммоль 1-гидроксибензотриазола и 12 ммоль тетрафторобората 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония. Реакционную смесь затем перемешивают при температуре окружающей среды на протяжении одной ночи, этилацетат затем удаляют и органическую фазу промывают, сушат, фильтруют и затем концентрируют с получением ожидаемого продукта. Стадия G. Хемифумарат (1R,2S,1'R)-2[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. 13 1,7 10% Pd/C добавляют к 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в этаноле, и смесь затем гидрогенируют при 90 мбар на протяжении 16 ч. После удаления катализатора при помощи фильтрации через целит и промывания этанолом фильтрат концентрируют и полученный остаток затем очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол/NH4 ОН 90/10/1). Продукт, полученный таким образом,переводят в его фумарат, добавляя раствор фумаровой кислоты в изопропаноле, после чего следует кристаллизация. Точка плавления: 193 С Элементный микроанализ: С% Н%N% Вычисленный 57,76 8,20 10,36 Обнаруженный 57,38 8,07 10,23 Пример 8. Фумарат (1R,2S,1'S)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на стадиях с D по G примера 7, исходя из второго из диастереоизомеров, разделенных на стадии С примера 7. Продукт, полученный таким образом, переводят в его фумарат, добавляя раствор фумаровой кислоты в изопропаноле, после чего следует кристаллизация. Точка плавления: 170 С Элементный микроанализ: С% Н%N% Вычисленный 54,87 7,37 8,53 Обнаруженный 54,44 7,28 8,66 Пример 9 А. Хемифумарат (1,2,1')-2[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Рацемическую смесь, полученную на стадии G примера 7, разделяют при помощи препаративной хиральной хроматографии ЖХВР на колонне Chiralpack AD (элюант: н-гептан/этанол/диэтиламин 75/25/1). Первый из энантиомеров, полученных таким образом, переводят в его хемифумарат, добавляя раствор фумаровой кислоты в изопропаноле, после чего следует кристаллизация. Элементный микроанализ: С% Н%N% Вычисленный 57,76 8,20 10,36 Обнаруженный 58,08 8,13 10,11 Пример 9 В. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Первый из энантиомеров, полученных в примере 9 А, переводят в его фумарат, добавляя раствор фумаровой кислоты в изопропаноле,после чего следует кристаллизация. Пример 10. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Второй из энантиомеров, разделенных в примере 9 А, переводят в его фумарат, добавляя раствор фумаровой кислоты в изопропаноле,после чего следует кристаллизация. Элементный микроанализ: С% Н%N% Вычисленный 54,87 7,37 8,53 Обнаруженный 54,97 7,43 8,41 Пример 11. Хемифумарат (1,2,1')-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклопентанола. Рацемическую смесь примера 8 разделяют при помощи препаративной хиральной хроматографии ЖХВР. Первый из энантиомеров, полученных таким образом, переводят в его фумарат, добавляя раствор фумаровой кислоты в изопропаноле, после чего следует кристаллизация. Точка плавления: 187 С Индекс вращения: D=-22,73 (вода, с=1,=589 нм) Элементный микроанализ: С% Н%N% Вычисленный 57,76 8,20 10,36 Обнаруженный 57,47 8,21 10,15 Пример 12. Хемифумарат (1,2,1')-2-[1'aмино-2'-оксо-2-(1-пирролидинил)этил]циклопентанола. Второй из энантиомеров, разделенных в примере 11, переводят в его хемифумарат, добавляя раствор фумаровой кислоты в изопропаноле, после чего следует кристаллизация. Точка плавления: 185 С Индекс вращения: D=+22,95 (вода, с=1,=589 нм) Элементный микроанализ: С% Н%N% Вычисленный 57,76 8,20 10,36 Обнаруженный 57,47 8,24 10,15 Пример 13. Хемифумарат (1,2,1')-2-[1'aмино-2-оксо-2'-(1-пирролидинил)этил]циклопентанола. Рацемическую смесь примера 4 разделяют при помощи препаративной хиральной хроматографии ЖХВР на колонне Chiralpack AD (элюант: н-гептан/этанол/диэтиламин 80/20/1). Первый из энантиомеров, полученных таким образом, переводят в его хемифумарат, добавляя раствор фумаровой кислоты в изопропаноле,после чего следует кристаллизация. Точка плавления: 180 СN% Вычисленный 57,76 8,20 10,36 Обнаруженный 56,63 7,83 9,50 Пример 14. Хемифумарат (1R,1S,1'R)2-[1'-амино-2'-оксо-2'-(1-морфолинил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному в примере 7, заменив пирролидин на морфолин на стадии F. Точка плавления: 192 С Элементный микроанализ: С% Н%N% Вычисленный 52,32 7,02 8,13 Обнаруженный 53,49 7,49 9,41 Пример 15. Хемифумарат (1R,2S,1'S)-2[1'-aмино-2'-оксо-2'-(1-морфолинил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на cтадиях с D по G примера 7, исходя из морфолина и второго из диастереоизомеров, разделенных на стадии С примера 7. Элементный микроанализ: С% Н%N% Вычисленный 52,32 7,02 8,13 Обнаруженный 52,83 7,11 8,77 Пример 16. Хемифумарат (1R,2S,1'R)2-[1'-амино-2'-оксо-2'-(1-азетидинил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному в примере 7, заменив пирролидин на азетидин на стадии F. Точка плавления: 208 С Элементный микроанализ: С% Н%N% Вычисленный 56,24 7,87 10,93 Обнаруженный 56,25 7,84 10,66 Пример 17. Хемифумарат (1R,2S,1'S)-2[1'-aмино-2'-оксо-2'-(1-азетидинил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на cтадиях с D по G примера 7, исходя из азетидина и второго из диастереоизомеров, разделенных на cтадии С примера 7. 16 Ожидаемый продукт получают согласно способу, описанному в примере 7, заменив пирролидин на пиперидин на стадии F. Точка плавления: 188 С Элементный микроанализ: С% Н%N% Вычисленный 39,14 8,51 9,85 Обнаруженный 58,82 8,45 9,65 Пример 19. Хемифумарат (1R,2S,1'S)-2[1'-aмино-2'-оксо-2'-(1-пиперидил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на стадиях с D по G примера 7, исходя из пиперидина и второго из диастереоизомеров, разделенных на стадии С примера 7. Точка плавления: 130 С Элементный микроанализ: С% Н%N% Вычисленный 59,14 8,51 9,85 Обнаруженный 59,02 8,54 9,68 Пример 20. Хемифумарат (1R,2S,1'R)2-[1'-aмино-2'-оксо-2'-(2-азабицикло[3,3,0]октан 2-ил)этил]циклопeнтанола. Ожидаемый продукт получают согласно способу, описанному в примере 7, заменив пирролидин на 2-азабицикло[3,3,0]октан на cтадии F. Точка плавления: 194 С Элементный микроанализ: С% Н%N% Вычисленный 61,91 8,44 9,03 Обнаруженный 61,65 8,36 8,90 Пример 21. Хемифумарат (1R,2S,1'S)-2[1'-aмино-2'-оксо-2'-(2-азабицикло[3,3,0]октан 2-ил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на cтадиях с D по G примера 7, исходя из 2-азабицикло[3,3,0]октана и второго из диастереоизомеров, разделенных наN% Вычисленный 61,91 8,44 9,03 Обнаруженный 61,52 8,33 8,87 Пример 22. Хемифумарат (1R,2S,1'R)2-[1'-aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил] циклопентанола. Стадия A. Этил(1R,2S,1'R)-[(трeт-бутилоксикарбонил)амино]-(2-гидроксициклопентил)ацетат. Раствор 1 Н гидроксида натрия (11 ммоль) и дикарбоната ди-трeт-бутила (11 ммоль) добавляют к 10 ммоль соединения, описанного на стадии С примера 7, растворенного в третбутаноле. После перемешивания на протяжении 1 ч растворители удаляют при помощи выпаривания, остаток отбирают в этилацетат и органи 17 ческую фазу промывают, сушат и выпаривают с получением ожидаемого продукта. Стадия В. (1R,2S,1'R)-2-[1'-(трет-Бутилоксикарбонил)амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклопентанол. Ожидаемый продукт получают согласно способу, описанному на стадиях Е и F примера 7, заменив пирролидин на 1,3-тиазолидин на стадии F. Стадия С. (1R,2S,1'R)-2-[1'-Амино-2'-оксо 2'-(1,3-тиазолидин-3-ил)этил]циклопентанол. Продукт, полученный на предыдущей стадии, депротектируют при помощи перхлората магния в ацетонитриле с обратным холодильником по способу, описанному в Chem. Comm. 1999, стр. 1809-1810, с получением ожидаемого продукта. Стадия D. Хемифумарат (1R,2S,1'R)-2[1'-амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил] циклопентанола. Продукт, полученный на предыдущей стадии, переводят в его хемифумарат, добавляя раствор фумаровой кислоты в изопропаноле,после чего следует кристаллизация. Точка плавления: 207 С Элементный микроанализ: С% Н% N% S% Вычисленный 49,98 6,99 9,71 11,12 Обнаруженный 49,68 7,06 9,51 11,33 Пример 23. Фумарат (1R,2S,1'S)-2-[1'амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному в примере 22, исходя из 1,3-тиазолидина и второго из диастереоизомеров, разделенных на стадии С примера 7.Tочка плавления: 190 С Элементный микроанализ: С% Н% N% S% Вычисленный 48,54 6,40 8,09 9,26 Обнаруженный 48,86 6,49 7,85 9,20 Пример 24. Фумарат (1R,2S,1'S)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Стадия A. (1R,2S,1'S)-2-[1'-Аминo-2'оксо-2'-(1-пирролидинил)этил]циклoгексанол. Ожидаемый продукт получают согласно способу, описанному на стадии С примера 1,исходя из второго из диастереоизомеров, полученных на стадии В примера 1. Стадия В. Фумарат (1R,2S,1'S)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Ожидаемый продукт получают согласно способу, описанному на стадии D примера 1,исходя из соединения, полученного на предыдущей стадии. Точка плавления: 174 С Элементный микроанализ: С% Н% 18 Пример 25. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Рацемическую смесь, полученную на cтадии А примера 24, разделяют при помощи препаративной хиральной хроматографии ЖХВР(элюант: н-гептан/этанол/диэтиламин 90/10/1). Первый из полученных энантиомеров переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Точка плавления: 165 С Элементный микроанализ: С% Н%N% Вычисленный 56,13 7,65 8,18 Обнаруженный 56,21 7,50 8,27 Индекс вpащения: D=+33,17 (вода, с=1,=589 нм) Пример 26. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанолa. Второй из энантиомеров, полученных в примере 25, переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Элементный микроанализ: С% Н%N% Вычисленный 56,13 7,65 8,18 Обнаруженный 55,88 7,65 8,19 Индекс вращения: D=-33,27 (вода, с=1,=589 нм) Пример 27. Фумарат (1R,2R,1'S)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Стадия А. (3S,3aR,7 аR)-3-Аминогексагидро-1-бензофуран-2(3 Н)-он. Соединение, полученное на стадии А примера 1, подвергают реакции Мицуноби согласно способу, описанному в Synthesis 1981, стр. 1 по 28. Продукт, полученный таким образом, очищают при помощи хроматографии и на кремнеземе и затем разделяют диастереоизомеры при помощи препаративной ЖХВР. Ожидаемый продукт является первым из диастереоизомеров,разделенных таким образом. Стадия С. Фумарат (1R,2R,1'S)-2-[1'амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Ожидаемый продукт получают согласно способу, описанному на стадиях С и D примера 1, исходя из соединения, полученного на предыдущей стадии. Точка плавления: 198 С Пример 28. Фумарат (1R,2R,1'R)-2-[1'амино-2'-оксо-2'-(1-пирролидинил)этил]циклогексанола. Ожидаемый продукт получают согласно способу, описанному на стадиях С и D примера 1, исходя из второго из диастереоизомеров, разделенных на стадии А примера 27.N% Вычисленный 56,13 7,65 8,18 Обнаруженный 55,83 7,60 8,11 Пример 29. Фумарат (1R,2S,1'R)-2-[1'aмино-2'-оксо-2'-(2,5-дигидро-1H-пиррол-1-ил) этил]циклогексанола. Ожидаемый продукт получают согласно способу, описанному на стадиях С и D примера 1, исходя из 2,5-дигидро-1 Н-пиррола и второго из диастереоизомеров, полученных на стадии В примера 1. Элементный микроанализ: С% Н%N% Вычисленный 56,46 7,11 8,23 Обнаруженный 56,06 6,77 8,21 Пример 30. Фумарат (1R,2S,1'R)-2-[1'aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанола. Стадия А. (1R,2S,1'R)-2-[1'-Амино-2'-оксо 2'-(1,3-тиазолидин-3-ил)этил]циклогексанол. Ожидаемый продукт получают согласно способу, описанному на стадии С примера 1,исходя из 1,3-тиазолидина и второго из диастереоизомеров, полученных на стадии В примера 1. Стадия В. Фумарат (1R,2S,1'R)-2-[1'амино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанола. Ожидаемый продукт получают согласно способу, описанному на стадии D примера 1,исходя из соединения, полученного на предыдущей стадии. Точка плавления: 195 С Элементный микроанализ: С% Н% N% S% Вычисленный 49,99 6,71 7,77 8,90 Обнаруженный 50,16 6,72 7,55 8,88 Пример 31. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанола. Рацемическую смесь, полученную на стадии А примера 30, разделяют при помощи препаративной хиральной хроматографии ЖХВР(элюант=этанол/диэтиламин 1000/1). Первый из полученных энантиомеров переводят в его фумарат при помощи реакции с этаноловым рас 20 твором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Точка плавления: 190 С Элементный микроанализ: С% Н% N% S% Вычисленный 49,99 6,71 7,77 8,90 Обнаруженный 49,79 6,74 7,57 8,86 Индекс вращения: D=-30,11 (вода, с=1,=589 нм) Пример 32. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-тиазолидин-3-ил)этил]циклогексанола. Второй из энантиомеров, полученных в примере 31, переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта в виде белого твердого вещества. Точка плавления: 188 С Элементный микроанализ: С% Н% N% S% Вычисленный 49,99 6,71 7,77 8,90 Обнаруженный 50,21 6,81 7,67 9,14 Индекс вращения: D=+32,11 (вода, с=1,=589 нм) Пример 33. Фумарат (1R,2S,1'R)-2-[1'aмино-2-оксо-2-(1-пирролидинил)этил]циклогептанола. Стадия А. Этил(1R,2S,1'RS)аминo-(2 гидроксициклoгeптил)aцeтат. Ожидаемый продукт получают согласно способу, описанному на стадиях А и В примера 7, заменив оксид циклопентена на циклогептен на стадии А. Стадия В. Этил(1R,2S,1'R)амино-(2 гидроксициклогептил)ацетат. Остаток, полученный на предыдущей стадии, хроматографируют на кремнеземе (элюант: дихлорометан/метанол 90/10). Ожидаемый продукт является первым из 2 диастереоизомеров,полученных таким образом. Стадия С. Фумарат (1R,2S,1'R)-2-[1'aмино-2'-оксо-2'-(1-пирролидинил)этил]циклогептанола. Ожидаемый продукт получают согласно способу, описанному на стадиях с D по G примера 7, исходя из соединения, полученного на предыдущей стадии. Точка плавления: 178 С Элементный микроанализ: С% Вычисленный 57,29 Обнаруженный 57,03 21 Пример 34. Фумарат (1R,2S,1'S)-2-[1'aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогептанола. Ожидаемый продукт получают согласно способу, описанному на cтадиях с D по G примера 7, исходя из второго из диастереоизомеров, разделенных на стадии В примера 33. Пример 35. Фумарат (1R,2S,1'S)-2-[1'аминo-2'-окco-2'-(N,N-диэтиламино)этил]циклопентанола. Ожидаемый продукт получают согласно способу, описанному на cтадиях с D по G примера 7, исходя из N,N-диэтиламина и второго из диастереоизомеров, разделенных на стадии С примера 7.N% Вычисленный 54,53 7,93 8,48 Обнаруженный 54,10 7,86 8,57 Пример 36. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклопентанола. Рацемическую смесь, полученную на cтадии С примера 22, разделяют при помощи препаративной хиральной хроматографии ЖХВР. Первый из полученных энантиомеров переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта. Пример 37. Фумарат (1,2,1')-2-[1'-aмино-2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклопентанола. Второй из энантиомеров, полученных в примере 36, переводят в его фумарат при помощи реакции с этаноловым раствором фумаровой кислоты, фильтрации и затем сушки, с получением ожидаемого продукта. Фармакологическое изучение соединений по изобретению Пример 38. Функциональный тест перегрузки глюкозой оральным путем приема. Под общей анестезией (пентобарбитал натрия) тучных самцов крыс Цукера (Zucker) (гомозиготы fa/fa) возрастом от 10 до 12 недель подвергали имплантации катетера (Silastic) в правую яремную вену за 24 ч до функционального теста перегрузки глюкозой путем орального приема (ПГОП). После 18-часового поста крысам, которые проснулись и были изолированы в индивидуальных клетках, вводили при помощи интубирования в пищевод 1 г/кг 40% раствора D(+)-глюкозы в воде Введение тестируемых продуктов (25, 10, 5 и 1 мг/кг) проводили в то же время, что и глюкозы, либо заранее (-10, 20 мин). При помощи венозного катетера брали образцы крови в моменты времени (-20, -10) 0, 10, 20, 40 и 60 мин после введения избыточного количества глюкозы, что давало возмож 004955 22 ность наблюдать за развитием инсулинаемического действия и гликаемического действия. Соединения по изобретению нормализуют инсулинаемию и гликаемию при дозах от 1 до 25 мг/кг при оральном применении. Пример 39. Фармацевтическая композиция. Формула получения 1000 таблеток, каждая из которых содержит по 10 мг: Соединение по примеру 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой представляет собой насыщенное углеводородное кольцо, имеющее от 4 до 8 атомов углерода в кольце, необязательно замещенное одной или более линейными или разветвленными (С 1-С 6)алкильными группами,R1 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)ацильную группу,R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,или R5 и R6 совместно с атомом азота, их несущим, образуют азотсодержащий гетероцикл, необязательно замещенный одной или более одинаковыми или различными группами,выбираемыми из групп циано, CO2R7 (в которойR7 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу), COR7 (в которой R7 имеет значение,указанное здесь ранее), нитро, CONR8aR8b (в которой R8a и R8b, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу или R8 а иR8b совместно образуют азотсодержащий гетероцикл), S(O)nR9 (в которой n представляет собой 1, 2 или 3 и R9 представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу или арильную группу) и РО 3R10 аR10b (в которой R10a и R10b, которые мо 23 гут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу),их стереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой,азотсодержащий гетероцикл понимается как необязательно мостиковая, насыщенная,моно- или бициклическая, имеющая от 5 до 12 членов кольца группа, содержащая 1, 2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота и необязательно присутствующий(е) дополнительный(е) гетероатом(ы) выбирают из атомов кислорода, азота и серы,арильная группа понимается как фенил,бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена 1 или более одинаковыми или различными атомами или группами, выбираемыми из атомов галогенов и групп линейного или разветвленного (С 1 С 6)алкила, гидрокси, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1-С 6)полигалоалкила, нитро и (С 1 С 2)алкилендиокси. 2. Соединение формулы (I) по п.1, в которой представляет собой углеводородное кольцо, имеющее от 5 до 6 атомов углерода в кольце, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 3. Соединение формулы (I) либо по п.1,либо по п.2, в которой R5 и R6 совместно образуют необязательно замещенный азотсодержащий гетероцикл, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 4. Соединение формулы (I) по п.3, в которой R5 и R6 совместно образуют необязательно замещенный пирролидин или необязательно замещенный тиазолидин, его стереоизомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 5. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'S)-2-[1'-амино-2'оксо-2'-(1-пирролидинил)этил]циклогексанол,его энантиомер (1S,2R,1'R), а также его аддитивные соли с фармацевтически приемлемой кислотой. 6. Соединение формулы (I) по п.1, которое представляет собой (1R,2R,1'R)-2-[1'-амино 2'-оксо-2'-(1-пирролидинил)этил]циклопентанол,а также его аддитивные соли с фармацевтически приемлемой кислотой, причем соединение(1R,2R,1'R) следует понимать как рацемическую смесь 2 энантиомеров, имеющих абсолютные конфигурации (1R,2R,1'R) и (1S,2S,1'S). 7. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино-2'оксо-2'-(1-пирролидинил)этил]циклопентанол,его (1S,2R,1'S)энантиомер, а также его аддитив 004955 24 ные соли с фармацевтически приемлемой кислотой. 8. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'S)-2-[1'-амино-2'оксо-2'-(1-пирролидинил)этил]циклопентанол,его (1S,2R,1'R)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой. 9. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино-2'оксо-2'-(1-пирролидинил)этил]циклогексанол,его (1S,2R,1'S)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой. 10. Соединение формулы (I) по п.1, которое представляет собой (1R,2S,1'R)-2-[1'-амино 2'-оксо-2'-(1,3-тиазолидин-3-ил)этил]циклогексанол, его (1S,2R,1'S)энантиомер, а также его аддитивные соли с фармацевтически приемлемой кислотой. 11. Способ получения соединений формулы (I) по п.1, который отличается тем, что хлороацетилхлорид подвергают реакции с соединением формулы (II)(II),в которой R5 и R6 имеют значения, указанные для формулы (I),с получением соединения формулы (III) в которой R5 и R6 имеют значения, указанные тут ранее,который подвергают реакции с бензальдегидом с получением соединения формулы (V), R2 и R3 имеют значения, указанные для формулы (I),с получением, после необязательного ацилирования гидроксифункции, соединения формулы (VII), которое имеет относительную конфигурацию транс, R1, R2, R3, R5 и R6 имеют значения, указанные тут ранее,которое переводят при помощи гидролиза,после которого, при желании, следует ацилирование аминофункции, с получением соединения формулы (Iа) с относительной конфигурацией транс, частного случая соединений формулы (I), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,которое переводят, при желании, в соединение формулы (Ib) с относительной конфигурацией цис, частный случай соединений формулы (I), R1, R2, R3, R4, R5 и R6 имеют значения, указанные тут ранее,эти соединения формул (Iа) и (Ib) разделяют, при желании, на их изомеры при помощи традиционных методик разделения, очищают,при необходимости, при помощи традиционных способов очистки и переводят, при желании, в аддитивные соли с фармацевтически приемлемой кислотой. 12. Фармацевтическая композиция, которая включает в качестве активного ингредиента соединение по любому из пп. с 1 по 10 в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными носителями. 13. Фармацевтическая композиция по п.12 для применения в качестве лекарства при лечении непереносимости глюкозы и нарушений,связанных с гипергликемией, таких как диабет типа II или ожирение. 14. Фармацевтическая композиция по п.12 для применения в качестве противодиабетического лекарственного препарата.
МПК / Метки
МПК: C07C 237/14, A61P 3/10, A61K 31/40, C07D 295/185
Метки: новые, соединения, получения, композиции, фармацевтические, alpha;-амино-γ-гидроксиамидные, циклические, содержащие, способ
Код ссылки
<a href="https://eas.patents.su/14-4955-novye-ciklicheskie-alpha-amino-gamma-gidroksiamidnye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые циклические α-амино-γ-гидроксиамидные соединения, способ их получения и фармацевтические композиции, их содержащие</a>


















