Композиции растительных экстрактов, обладающие иммуностимулирующей способностью, способы их получения и применения
Формула / Реферат
1. Композиция растительных экстрактов, обладающая иммуностимулирующей активностью, содержащая экстракт АРУМА.
2. Композиция растительных экстрактов по п.1, содержащая также экстракт ГРАНАТА.
3. Композиция растительных экстрактов по п.1, содержащая также экстракт ГИБИСКУСА.
4. Композиция растительных экстрактов по п.1, содержащая также экстракт ЧАЯ.
5. Композиция растительных экстрактов по п.2, содержащая также экстракт ГИБИСКУСА.
6. Композиция растительных экстрактов по п.2, содержащая также экстракт ЧАЯ.
7. Композиция растительных экстрактов по п.5, содержащая также экстракт ЧАЯ.
8. Композиция растительных экстрактов, обладающая иммуностимулирующей активностью, содержащая экстракт ГРАНАТА.
9. Композиция растительных экстрактов по п.8, содержащая также экстракт ГИБИСКУСА.
10. Композиция растительных экстрактов по п.8, содержащая также экстракт ЧАЯ.
11. Композиция растительных экстрактов по п.9, содержащая также экстракт ЧАЯ.
12. Композиция растительных экстрактов по п.7, отличающаяся тем, что экстракты АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ являются водными экстрактами.
13. Композиция растительных экстрактов по п.12, отличающаяся тем, что дополнительно содержит, по меньшей мере, один цитокин.
14. Композиция растительных экстрактов по п.13, где упомянутый цитокин представляет собой интерлейкин.
15. Композиция растительных экстрактов по п.13, где упомянутый цитокин представляет собой интерферон.
16. Композиция растительных экстрактов по п.12, где упомянутая композиция дополнительно содержит, по меньшей мере, один фактор некроза опухолей.
17. Композиция растительных экстрактов по п.12, где упомянутая композиция дополнительно содержит, по меньшей мере, один иммуноглобулин.
18. Композиция растительных экстрактов по п.12, где упомянутая композиция дополнительно содержит полисахарид.
19. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит протеины.
20. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит РНК.
21. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит ДНК.
22. Композиция растительных экстрактов по п.13, где упомянутая композиция содержит приблизительно равные части упомянутых водных экстрактов.
23. Способ получения композиции растительных экстрактов по п.2, обладающей иммуностимулирующей активностью, включающий следующие этапы:
(а) получение экстракта АРУМА путем кипячения высушенного измельченного АРУМА в воде;
(б) получение экстракта ГРАНАТА путем кипячения высушенного измельченного ГРАНАТА в воде;
(в) смешивание упомянутого экстракта АРУМА и упомянутого экстракта ГРАНАТА и кипячение смеси.
24. Способ получения композиции растительных экстрактов по пп.3-7, дополнительно включающий следующие этапы:
(а) получение экстракта АРУМА путем кипячения высушенного измельченного АРУМА в воде;
(б) получение экстракта ГРАНАТА путем кипячения высушенного измельченного ГРАНАТА в воде;
(в) получение экстракта ГИБИСКУСА путем кипячения высушенного измельченного ГИБИСКУСА в воде;
(г) получение экстракта ЧАЯ путем кипячения высушенного измельченного ЧАЯ в воде;
(д) смешивание упомянутого экстракта АРУМА, упомянутого экстракта ГРАНАТА, упомянутого экстракта ГИБИСКУСА и упомянутого экстракта ЧАЯ и кипячение смеси.
25. Способ стимуляции in vitro клеточно-опосредованного иммунитета, включающий воздействие на клетки эффективным количеством композиции растительных экстрактов по одному из пп.1-11.
26. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.25, в котором упомянутые клетки представляют собой клетки от здоровых людей.
27. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.25, в котором упомянутые клетки представляют собой клетки пациентов, страдающих лейкозом.
28. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.25, в котором упомянутые клетки представляют собой клетки пациентов, страдающих почечной недостаточностью.
29. Способ стимуляции in vitro клеточно-опосредованного иммунитета, включающий воздействие на суспензии лимфоцитов эффективного количества композиции растительных экстрактов по одному из пп.1-11.
30. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты здоровых людей.
31. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты пациентов, страдающих лейкозом.
32. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты пациентов, страдающих почечной недостаточностью.
33. Способ стимуляции in vitro клеточно-опосредованного иммунитета, включающий воздействие на мононуклеарные клетки периферической крови эффективного количества композиции растительных экстрактов по одному из пп.1-11.
34. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от здоровых людей.
35. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от пациентов, страдающих лейкозом.
36. Способ стимуляции in vitro клеточно-опосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от пациентов, страдающих почечной недостаточностью.
37. Способ ингибирования in vitro ВИЧ-инфекции, включающий воздействие на клетки эффективного количества композиции растительных экстрактов по одному из пп.1-11.
38. Способ ингибирования in vitro связывания gp120 с клетками МТ-4, включающий воздействие на упомянутые клетки МТ-4 эффективного количества композиции растительных экстрактов по одному из пп.1-11.
Текст
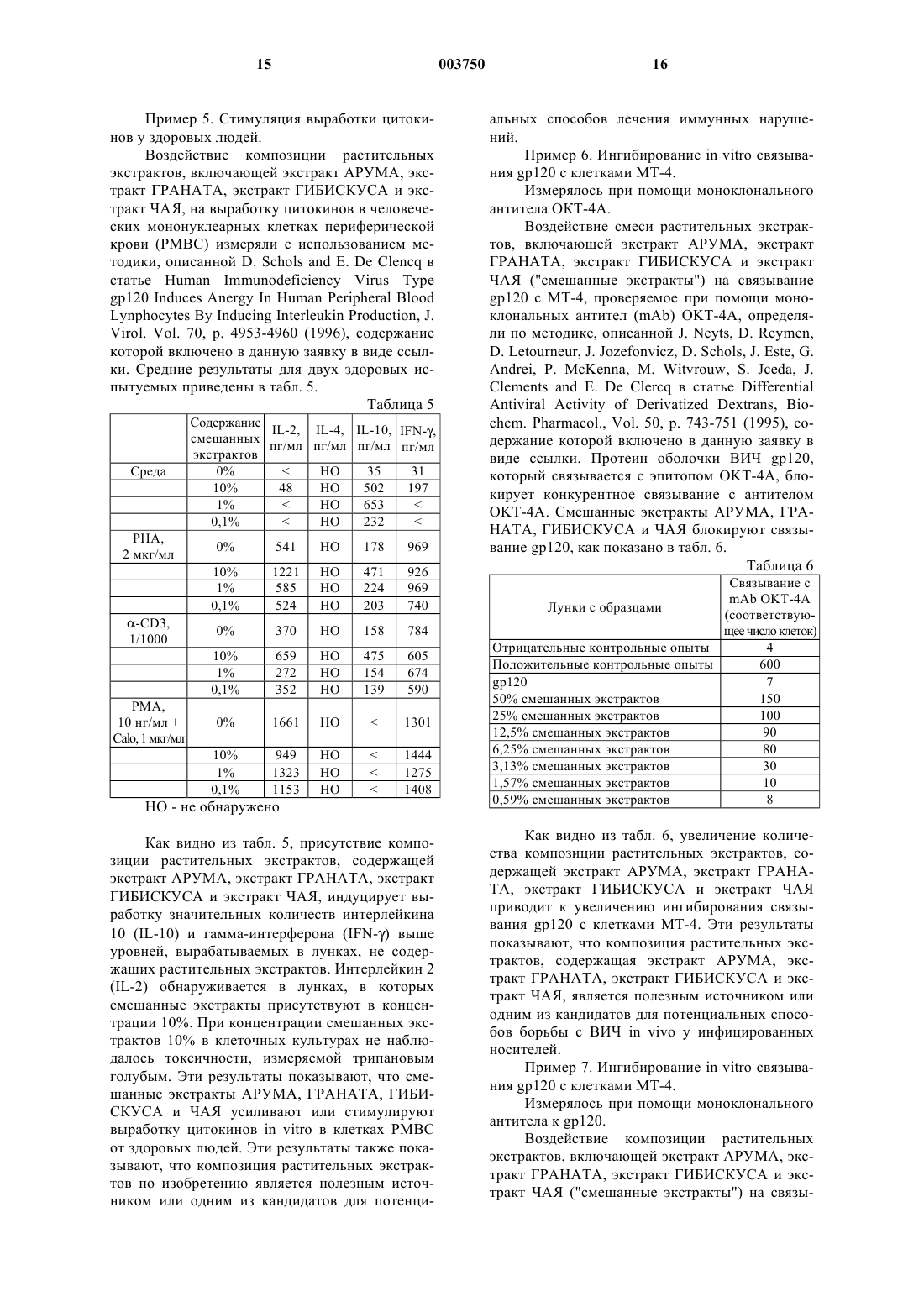
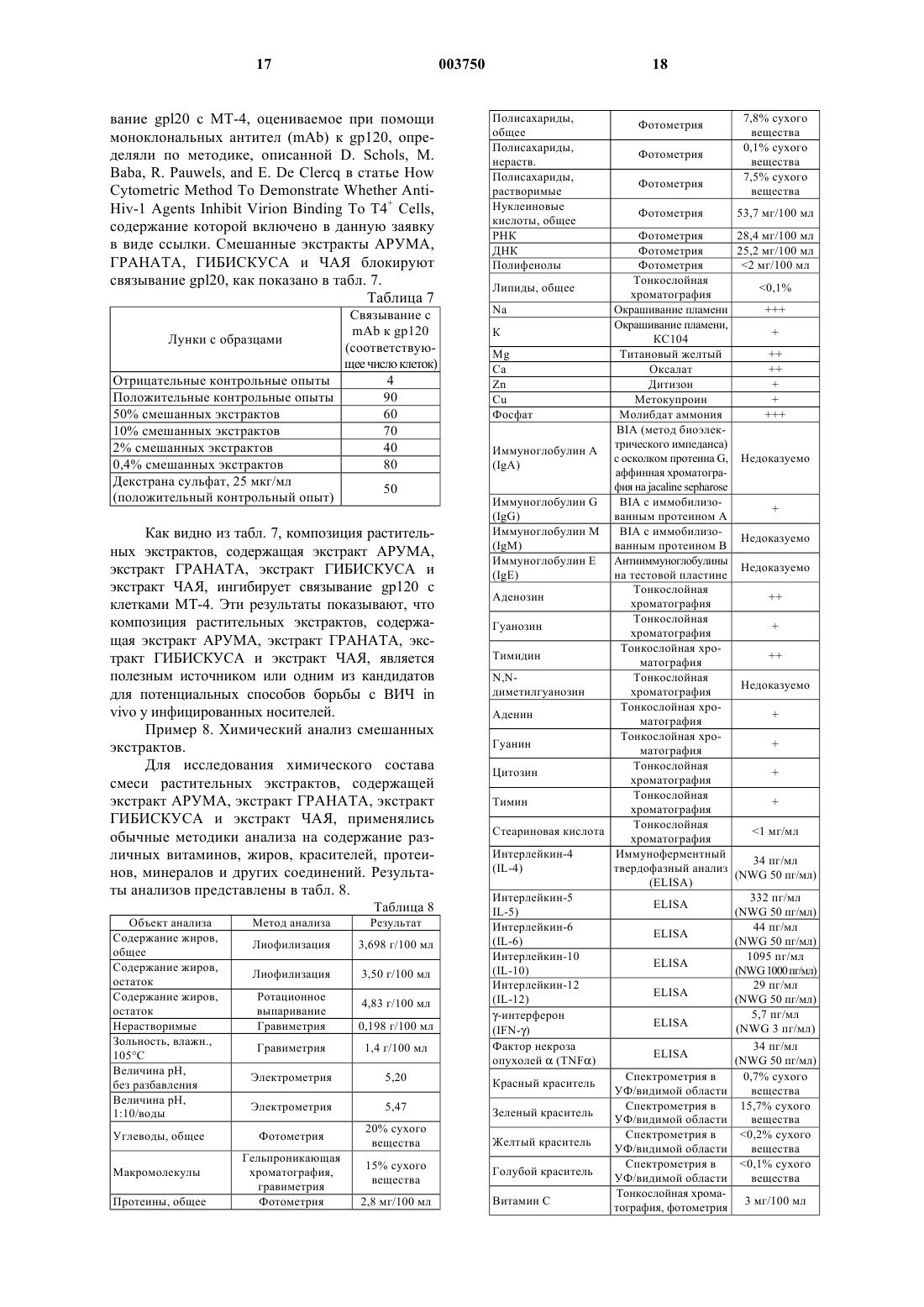
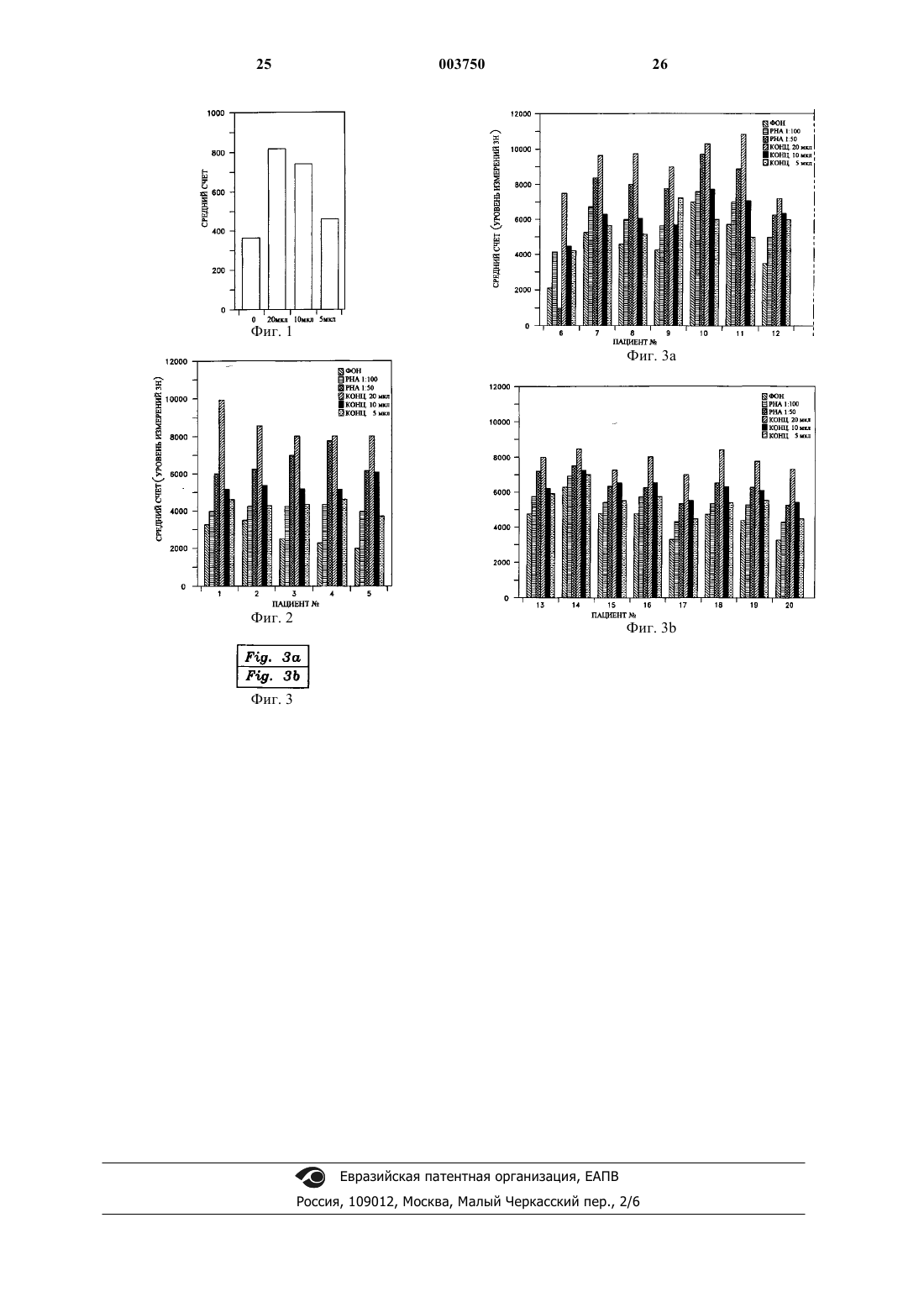
1 Область изобретения Изобретение в целом относится к растительным экстрактам, способам их применения и лечения, и в частности к композиции и способу применения растительных или травяных экстрактов, обладающих терапевтическим иммуностимулирующим и противовирусным действием, для усиления или стимуляции природной иммунной реакции у людей. Предпосылки изобретения История науки о травах сложно переплетается с современной медициной. Многие известные современные лекарства ведут свое начало от древних целительных традиций, связанных со специфическими растениями. Было обнаружено, что лекарственные свойства многих растений обусловлены специфическими химическими соединениями, которые были выделены, очищены и во многих случаях воспроизведены синтетическим путем. Многие общеизвестные лекарства изначально были получены из растений. Салициловая кислота, предшественник аспирина, была первоначально выделена из коры белой ивы и из таволги. Хинин, используемый для лечения малярии,был получен из коры хинного дерева. Винкристин,используемый для лечения рака, является производным барвинка. Лекарство против рака таксол было первоначально выделено из коры и хвои тихоокеанского тиса. Наверное, самыми известными лекарствами являются морфин и кодеин,которые были получены из опиумного мака. Морфин до сих пор является стандартом, с которым сравниваются новые синтетические болеутоляющие средства. Использование растений в медицинских целях известно из доисторических времен. Корень алтея, гиацинт и тысячелистник обнаружили аккуратно разложенными вокруг останков человека каменного века в Ираке. Корень алтея обладает успокоительными и противовоспалительными свойствами и используется для лечения воспаленных или раздраженных слизистых оболочек. Гиацинт используется в качестве диуретика, способствующего отдаче тканями избытка воды. Тысячелистник - испытанное временем средство от простуды и жара, которое когда-то использовалось так же широко, как аспирин сегодня. Современные врачи, особенно в Соединенных Штатах, в основном, полагаются на методики лечения с использованием синтетических лекарств или лекарств, полученных химическим путем. Вместо того, чтобы использовать для лечения целые растения или экстракты растений, фармацевты склонны идентифицировать,выделить, экстрагировать и синтезировать активные компоненты растений для использования в лечении. Однако этот подход имеет недостатки. Кроме отдельных физиологически активных соединений, присутствующих в растении, в нем также есть минералы, витамины,гликозиды, масла, алкалоиды, биофлавиноиды и 2 другие вещества, которые могут быть важны для поддержания лечебных свойств конкретного растения. Эти дополнительные вещества могут обеспечивать синергический эффект, отсутствующий при отдельном использовании очищенных или синтетических физиологически активных соединений. Кроме того, токсичность очищенных физиологически активных соединений в целом выше, чем токсичность физиологически активных соединений в совокупности с другими веществами растения. Эффективность различных растительных препаратов, экстрактов, настоев для питья и способов лечения общеизвестна, и лечебные растительные продукты все более признаются как желательная альтернатива синтетическим лекарствам. Например, в патенте США 4,446,130 описано использование экстракта женьшеня, обладающего стимулирующим и диуретическим эффектами. В патенте США 4,886,665 описано использование фармацевтического препарата экстрактов овса и крапивы. В патенте США 4,671,959 описано использование композиций натуральных масел для снижения стресса. Патент США 5,064,675 касается смеси растительных экстрактов, обладающей успокоительным действием. В патенте США 5,407,675 описан растительный экстракт, используемый для лечения волосистой части кожи головы. В патенте США 5,178,865 описана композиция растительных экстрактов, ингибирующая инфекцию вируса иммунодефицита человека, или ВИЧ, in vitro. В патентах США 5,500,340 и No. 5,294,443 описано использование растительных экстрактов для иммуносупрессии и лечения аутоиммунных расстройств. Иммунная реакция человека чрезвычайно сложна и требует постоянного взаимодействия клеток, участвующих в работе иммунной системы. Внутриклеточная связь определяется секрецией протеинов - предвестников химических реакций, известных как цитокины, которые обуславливают усиления роста клеток, содействуют активизации клеток, регулированию клеточного обмена, стимуляции функции макрофагов, разрушению антигенов и выполняют другие функции. Цитокины в целом включают лимфокины,вырабатываемые Т-лимфоцитами, и монокины,вырабатываемые моноцитами. Важным классом цитокинов являются интерфероны, которые используют для защиты от вирусных инфекций и роста опухолевых клеток. Цитокины также включают интерлейкины, которые участвуют в дифференциации клеток, а также являются факторами некроза опухолей и трансформирующими факторами роста, которые опосредуют воспалительные и цитотоксические реакции. Другой важный для иммунной реакции человека набор протеинов включает иммуноглобулины,которые вырабатываются В-лимфоцитами. Иммуноглобулины служат антителами против вирусных, бактериальных и других антигенов. 3 Люди, страдающие иммуносупрессивными заболеваниями или состояниями, такими как вирус иммунодефицита человека (ВИЧ), рак, гепатит, почечная недостаточность, диабет, астма, артрит и т.п., часто имеют повышенный уровень лимфоцитов и соответственно пониженные уровни цитокинов. Например, у ВИЧ-инфицированных людей лимфоциты, имеющие антиген клеточной поверхности, известные как CD4, присутствуют в нетипично низких количествах. У здоровых людей эти лимфоцитные клетки CD4 присутствуют в концентрациях около 800 клеток на миллиметр сыворотки, в то время, как ВИЧ-инфицированные лица имеют всего 200 клеток CD4 на миллиметр сыворотки,когда развиваются условнопатогенные инфекции. Специфические типы лимфоцитов CD4, известные как клетки ТН 1 и ТН 2,по-видимому, особенно важны для клеточноопосредованной реакции на ВИЧ-инфекцию. Клетки ТН 1 продуцируют интерлейкин-2 (IL-2) и гамма-интерферон (IFN). Клетки ТН 2 продуцируют интерлейкины -4, -5 и -10 (IL-4, IL-5 и IL-10). Предполагается, что цитокины, вырабатываемые клетками ТН 1 и ТН 2, оказывают друг на друга противодействующий эффект, при этом цитокины, вырабатываемые клетками ТН 1, регулируют выработку цитокинов клетками ТН 2, и наоборот. На ранней стадии инфекции ВИЧ реакция ТН 1 доминирует, и секреция IL-2 клетками ТН 1 увеличивает активность лимфоцитов CD8. Природные интерфероны, интерлейкины и иммуноглобулины, вырабатываемые лимфоцитами, хорошо приспособлены для регулирования иммунной реакции человека, и лечение пациентов, страдающих иммунодефицитом или иммуносупрессией, интерферонами, интерлейкинами и иммуноглобулинами может быть эффективным. Общеизвестно промышленное производство интерферонов, интерлейкинов и иммуноглобулинов методами генной инженерии,когда гены, ответственные за продуцирование этих протеинов, вводят в бактерии, которые затем выращивают и собирают. Затем интерфероны, интерлейкины и иммуноглобулины, выработанные генетически модифицированными бактериями, очищают и их вводят пациентам шприцом или внутривенными способами. Способ орального введения пациентам интерферонов, интерлейкинов и иммуноглобулинов еще не реализован, так как желудочные кислоты и энзимы имеют тенденцию к расщеплению этих протеинов до того, как они попадут в систему кровообращение. Различные лекарственные растения предположительно оказывают благоприятное действие на иммунную систему человека. Например,Echinacea Purpurea и Echinacea Angustifolia предположительно стимулируют активность Тклеток (см. Mowery, D.B.; The Scientific Validation of Herbal Medicine, Keats Publishing, Inc.,New Canaan Press, 1986, p. 118-119). Astragulas 4 способностью стимулировать выработку интерферона и иммуноглобулинов А и G (IgA и IgG) у мышей (см. Kaiser, J.D.; Immune Power. AMartin's Press, New York, 1993, p. 59-60). Однако растительные или травяные экстракты, обеспечивающие действенный стимулирующий или усиливающий эффект на иммунную систему человека, до сих пор не были известны. Таким образом, существует необходимость в смеси и способе применения растительных экстрактов, которые представляют собой целебную добавку и в целом обеспечивают лечение людей или животных, страдающих заболеваниями или состояниями, подавляющими иммунную реакцию. Данное изобретение удовлетворяет этим и другим требованиям и в целом преодолевает недостатки известных решений. Краткое описание изобретения Данное изобретение предлагает композицию растительных экстрактов и способ ее получения и использования для стимуляции или усиления иммунной реакции у людей и животных. Названия, классификация и географические источники растений или трав, используемых в изобретении, приведены ниже в табл. 1. Таблица 1 ИспользуНазвание Происхожемая часть используемо- Классификация дениеPunica,Сирия, Ирак,Granatum из Турция, Ита- Кожура ГРАНАТ семейства лия и другие плодовCamelia SinenКитай, Япоsis из семейния, Восточ- Листья ЧАЙ ства Theaceae,ная Индия семейства чая Семейство Африка, Восмальв,точная Индия Цветки ГИБИСКУС Как правило, для приготовления композиции растительных экстрактов по изобретению могут быть использованы свежие или высушенные листья, семена, кора, плоды, кожура, цветки и/или корни каждого из вышеупомянутых растений или трав, как подробно описано ниже. Однако предпочтительные части АРУМА, ГРАНАТА,ГИБИСКУСА и ЧАЯ, используемые для экстракции, представлены в табл. 1. В целом растения экстрагируют горячей водой, хотя в другом варианте для экстракции могут быть использованы водо-этанольные растворы и этанол. В общих чертах, композиция растительных экстрактов по изобретению включает экстракт АРУМА. Другой вариант изобретения представляет собой композицию растительных экс 5 трактов, включающую от 10 до 90% экстракта АРУМА и от 10 до 90% экстракта ГРАНАТА. Композиция растительных экстрактов по изобретению может также включать 10 до 90% экстракта ГИБИСКУСА и/или от 10 до 90% экстракта ЧАЯ. Предпочтительно композиция растительных экстрактов по изобретению включает, в целом, равные части экстракта АРУМА, экстракта ГРАНАТА, экстракта ГИБИСКУСА и экстракта ЧАЯ. Композиция растительных экстрактов по изобретению обеспечивает целебную и питательную добавку к рациону человека за счет того, что она содержит витамин С, витамин Е,витамин D2, витамин D3, витамин К, водорастворимые минералы, включая фосфор, натрий,калий, цинк, магний и медь, а также большое количество полезных протеинов. Эти протеины включают различные цитокины или цитокиноподобные протеины и иммуноглобулин или иммуноглобулинподобные протеины, которые предположительно оказывают стимулирующий или усиливающий эффект на иммунную систему. В качестве питательной добавки композицию растительных экстрактов принимают оральным путем или может быть использована для местного применения. Результаты экспериментов (описанных ниже) показывают, что композиция растительных экстрактов по изобретению эффективно усиливает иммунную реакцию человека. Эксперименты in vitro показывают, что композиция растительных экстрактов по изобретению стимулирует клеточно-опосредованный иммунитет путем стимуляции бластогенеза или бластной трансформации лимфоцитов, а также путем стимуляции выработки цитокинов в лимфоцитных суспензиях, взятых у здоровых людей, пациентов, страдающих лейкозом и пациентов,страдающих почечной недостаточностью. Результаты первичных экспериментов также показывают, что композиция растительных экстрактов по изобретению эффективно ингибирует ВИЧ-инфекцию in vitro. Эти эксперименты и данные результатов демонстрируют, что композиция растительных экстрактов по изобретению является полезным источником или одним из кандидатов для потенциальных способов лечения иммунных нарушений. Способ получения смеси растительных экстрактов по изобретению предпочтительно включает этапы получения экстракта АРУМА,получения экстракта ГРАНАТА, получение экстракта ГИБИСКУСА, получения экстракта ЧАЯ и объединение экстрактов АРУМА, ГРАНАТА,ГИБИСКУСА и ЧАЯ. Способ использования изобретения для стимуляции in vitro клеточно-опосредованного иммунитета включает контакт или воздействие на клетки эффективным количеством препарата,состоящего в основном из экстракта АРУМА, 003750 6 экстракта ГРАНАТА, экстракта ГИБИСКУСА и экстракта ЧАЯ. Способ использования изобретения для стимуляции in vitro бластогенеза лимфоцитов включает контакт или воздействие на суспензии лимфоцитов эффективным количеством препарата, состоящего в основном из экстракта АРУМА, экстракта ГРАНАТА, экстракта ГИБИСКУСА и экстракта ЧАЯ. Способ использования изобретения для стимуляции in vitro выработки цитокинов в мононуклеарных клетках периферической крови включает контакт или воздействие на такие клетки эффективным количеством препарата,состоящего в основном из экстракта АРУМА,экстракта ГРАНАТА, экстракта ГИБИСКУСА и экстракта ЧАЯ. Задача изобретения состоит в создании смеси растительных экстрактов и способа ее использования, которая является полезным источником или одним из кандидатов для потенциальных способов лечения людей и животных,страдающих иммуносупрессорными и аутоиммунными заболеваниями, нарушениями, инфекциями или состояниями. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая обеспечивает питательную диетическую добавку для людей и животных. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует или усиливает иммунную реакцию у людей и животных. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует in vitro клеточно-опосредованный иммунитет. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует клеточноопосредованный иммунитет у людей и животных. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует in vitro бластную трансформацию или бластогенез лимфоцитов. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует бластную трансформацию или бластогенез лимфоцитов у людей и животных. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует in vitro выработку цитокинов в периферических мононуклеарных клетках крови. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования, которая стимулирует выработку цитокинов у людей и животных. 7 Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования для ингибирования in vitro связывания gp120 с клетками МТ 4. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования для ингибирования in vitro ВИЧинфекции клеток МТ 4. Следующая задача изобретения - создание смеси растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, для ингибирования ВИЧ-инфекции у людей. Следующая задача изобретения - создание смеси растительных экстрактов и способа ее использования для лечения иммуносупрессорных заболеваний и состояний, являющейся относительно нетоксичной. Следующая задача изобретения - создание смеси растительных экстрактов, включающей различные цитокины и/или цитокиноподобные протеины, а также иммуноглобулины и/или иммуноглобулинподобные протеины. Следующая задача изобретения - создание смеси растительных экстрактов, содержащей витамин С, витамин Е, витамин D2, витамин D3,витамин К, водорастворимые минералы, включая фосфор, натрий, калий, цинк, магний и медь,а также большое количество полезных протеинов. Другие задачи и преимущества изобретения будут изложены в следующих разделах подробного описания, которое приведено в целях полного раскрытия предпочтительного варианта осуществления изобретения без наложения ограничений на него. Краткое описание чертежей Данное изобретение будет изложено более полно со ссылками на следующие фигуры, которые приведены лишь в иллюстративных целях. Фиг. 1 является графическим представлением воздействия композиции растительных экстрактов по изобретению на бластогенез нормальных лимфоцитов. Фиг. 2 является графическим представлением воздействия композиции растительных экстрактов по изобретению на бластогенез лимфоцитов, взятых у лейкозных пациентов. Фиг. 3 является графическим представлением воздействия композиции растительных экстрактов по изобретению на бластогенез лимфоцитов, взятых у пациентов с почечной недостаточностью. Подробное описание предпочтительных вариантов осуществления Данное изобретение, в целом, относится к использованию растительных экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ, а также их различных сочетаний для усиления или стимуляции иммунной реакции у людей и животных, для лечения людей и животных, страдаю 003750 8 щих иммуносупрессорными и аутоиммунными заболеваниями или состояниями, и для ингибирования ВИЧ-иифекции у людей. Пример 1 иллюстрирует способ получения и смешения растительных экстрактов АРУМА,ГРАНАТА, ГИБИСКУСА и ЧАЯ. Пример 2 относится к использованию композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, для бластной трансформации in vitro суспензии нормальных лимфоцитов. Пример 3 относится к использованию композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА,экстракт ГИБИСКУСА и экстракт ЧАЯ, для бластогенеза in vitro лимфоцитов периферической крови от пациентов с острым лейкозом. Пример 4 относится к использованию композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, для бластогенезаin vitro лимфоцитов периферической крови от пациентов с почечной недостаточностью. Пример 5 относится к использованию композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, для стимуляции in vitro выработки цитокинов в мононуклеарных клетках периферической крови (РМВС) от здоровых людей. Пример 6 относится к использованию композиции растительных экстрактов,включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ,для ингибирования in vitro связывания gp120 с клетками МТ 4, измеренного по связыванию с моноклональным антителом ОКТ-4 А. Пример 7 относится к использованию композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, для ингибирования invitro связывания gp120 с клетками МТ 4, измеренного по связыванию с моноклональным антителом к gp120. Пример 8 описывает аналитическое исследование смешанных экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ. Пример 1. Получение экстракта. В этом примере описано получение и смешение экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ. В приведенной выше табл. 1 описаны предпочтительные части растений АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ, используемые для экстракции. Описанные ниже способы могут осуществляться в большом масштабе для производства больших количеств экстрактов. Подробности получения описанных экстрактов отражают предпочтительный в настоящее время способ экстрагирования и не должны рассматриваться как ограничивающие. Количества веществ и интервалы времени, указанные ниже, могут существенно изменяться для получения подходящих экстрактов АРУМА, 9 ГРАНАТА, ГИБИСКУСА и ЧАЯ по изобретению. 1. Получение экстракта АРУМА. Около 20 г высушенного измельченного АРУМА и 1 л дистиллированной воды смешали в автоклаве из нержавеющей стали и закрыли автоклав герметичной крышкой из нержавеющей стали. Состав нагрели до кипения (около 100 С) и оставили кипеть в течение 45 мин,затем нагрели до 130 С и кипятили в течение 15 мин, после чего оставили охлаждаться до температуры ниже 100 С для получения жидкого экстракта АРУМА. Экстракт АРУМА использовали еще теплым или горячим, способом,описанным ниже. 2. Получение экстракта ГРАНАТА. Около 60 г высушенного измельченного ГРАНАТА и 1 л дистиллированной воды смешали в автоклаве из нержавеющей стали и закрыли автоклав герметичной крышкой из нержавеющей стали. Композицию нагрели до кипения (около 100 С) и оставили кипеть в течение 45 мин, затем нагрели до 130 С и кипятили в течение 15 мин, после чего оставили охлаждаться до температуры ниже 100 С для получения жидкого экстракта ГРАНАТА. Экстракт ГРАНАТА использовали еще теплым или горячим, способом, описанным ниже. 3. Получение экстракта ГИБИСКУСА. Около 15 г высушенного измельченного ГИБИСКУСА и 1 л дистиллированной воды смешали в автоклаве из нержавеющей стали и закрыли автоклав герметичной крышкой из нержавеющей стали. Композицию нагрели до кипения (около 100 С) и оставили кипеть в течение 45 мин, затем нагрели до 130 С и кипятили в течение 15 мин, после чего оставили охлаждаться до температуры ниже 100 С для получения жидкого экстракта ГИБИСКУСА. Экстракт ГИБИСКУСА использовали еще теплым или горячим, способом, описанным ниже. 4. Получение экстракта ЧАЯ. Около 40 г высушенного измельченного ЧАЯ и 1 л дистиллированной воды смешали в автоклаве из нержавеющей стали и закрыли автоклав герметичной крышкой из нержавеющей стали. Композицию нагрели до кипения (около 100 С) и оставили кипеть в течение 45 мин,затем нагрели до 130 С и кипятили в течение 15 мин, после чего оставили охлаждаться до температуры ниже 100 С для получения жидкого экстракта ЧАЯ. Экстракт ЧАЯ использовали еще теплым или горячим, способом, описанным ниже. 5. Получение смешанных экстрактов АРУМА и ГРАНАТА. Около 50 мл каждого из экстрактов АРУМА и ГРАНАТА перенесли еще теплыми или горячими (от 40 до 100 С) в автоклав из нержавеющей стали и закрыли его герметичной крышкой из нержавеющей стали, после чего нагревали вместе, при непрерывном перемеши 003750 10 вании или встряхивании, в течение 1,5 ч при 100 С. Полученную таким образом композицию можно охладить и хранить в холодильнике или использовать еще теплой или горячей, как описано ниже, для получения других композиций экстрактов. Смешанные экстракты АРУМА и ГИБИСКУСА. АРУМА и ЧАЯ, ГРАНАТА и ГИБИСКУСА, ГРАНАТА и ЧАЯ также получали при помощи в целом аналогичной методики. 6. Получение смешанных экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ. Около 100 г АРУМА и ГРАНАТА, полученных как описано выше, вместе с 50 мл каждого из экстрактов ГИБИСКУСА, полученного как описано выше, и ЧАЯ, полученного как описано выше, перенесли еще теплыми или горячими (от 40 до 100 С) в автоклав из нержавеющей стали и закрыли его герметичной крышкой из нержавеющей стали, после чего нагревали вместе, при непрерывном перемешивании или встряхивании, в течение 1,5 ч при 100 С. Полученная таким образом композиция содержала, в целом, равные части каждого из экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ, описанных выше. Комбинированную композицию экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ оставили охлаждаться до комнатной температуры. Во время охлаждения к комбинированной композиции добавили буферный раствор(Nа 2 НРO4/NаН 2 РO4), при температуре смеси около 30-60 С, для придания смеси слегка кислой рН. Предпочтительно, рН смешанных экстрактов поддерживают на уровне до 4,0, и более предпочтительно - до 3,8, хотя значение рН ниже 7 также приемлемо. По вышеописанной методике смешанные экстракты АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ хранили в холодильнике при 4 С. В смешанные экстракты можно ввести незначительное количество бензоата натрия в качестве консерванта, а также,если это желательно, ароматизатор или пищевые красители. Результаты химического анализа смешанных экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ приведены ниже в примере 8. Вышеописанную методику использовали для получения комбинированной композиции экстрактов АРУМА, ГРАНАТА и ГИБИСКУСА без экстракта ЧАЯ. Вышеописанную методику использовали также для получения комбинированной композиции экстрактов АРУМА, ГРАНАТА и ЧАЯ без экстракта ГИБИСКУСА. Кроме того, вышеописанную методику использовали для получения комбинированной композиции экстрактов ГРАНАТА, ГИБИСКУСА и ЧАЯ без экстракта АРУМА. Наконец, вышеописанную методику использовали для получения комбинированной композиции экстрактов ГРАНАТА и ГИБИСКУСА без экстрактов АРУМА и ЧАЯ. Пример 2. Властная трансформация in vitro лимфоцитов от здоровых людей. В этом примере описано воздействие композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, описанные в примере 1, на клеточно-опосредованный иммунитет, которое измерялось путем бластной трансформации или бластогенеза in vitro нормальных лимфоцитов. Бластогенез представляет собой первичный этап в индуцировании клеточноопосредованного иммунитета и связан с высвобождением или секрецией различных интерлейкинов, необходимых для межклеточного взаимодействия иммунной системы. Клеточноопосредованный иммунитет участвует в защите организма человека от злокачественных образований, некоторых вирусных инфекций, включая ВИЧ, межклеточной бактериальной инфекции, а также в регулировании различных клеточных и гуморальных иммунологических взаимодействий и в предотвращении аутоиммунных реакций. Бластную трансформацию измеряли путем обычного теста стимуляции лимфоцитов, в котором 3 Н-тимидин (т.е. меченый тритием) добавляли в суспензии лимфоцитов, после чего проводили инкубацию, собирали клетки и измеряли радиоактивность собранных клеток. Высокая радиоактивность означает, что лимфоциты подверглись трансформации и поглотили 3 Нтимидин. Лимфоциты цельной крови от трех здоровых людей получили путем сепарации по методу градиента плотности в Ficoll Isopaque. Подготовили многолуночные пластины микротитратора, содержащие суспензии лимфоцитов в растворе Хэнкса с добавкой 10% зародышевой телячьей сыворотки, пенициллина и стрептомицина. По 5, 10 и 20 мкл комбинированной композиции экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ добавили в лунки на каждой из пластин. Конечный объем суспензии лимфоцитов в каждой лунке составил 0,2 мл. Затем пластины микротитратора инкубировали в течение 72 ч при 37 С в СО 2-инкубаторе. В каждую лунку добавили 0,05 мл 3H-тимидина, после чего инкубировали еще 24 ч при 37 С, собрали клетки автоматическим сборщиком клеток и измерили радиоактивность сцинтиляционным счетчиком. Индекс стимуляции рассчитывали из среднего числа счетов для каждой концентрации смешанного экстракта. Результаты представлены в табл. 2 и на фиг. 1. Таблица 2 Индекс Средний показатель(уровень поглощения 3 Н) стимуляции Без смешанных экстрактов 20 мкл смешанных экстрактов 12 10 мкл смешанных экстрактов 5 мкл смешанных экстрактов Результаты, представленные в табл. 2 и на фиг. 1, показывают, что добавление к суспензии лимфоцитов возрастающих количеств экстрактов приводит к увеличению степени трансформации или бластогенеза лимфоцитов, что проявляется в повышении радиоактивности из-за увеличения поглощения 3H. Эти результаты означают, что композиция растительных экстрактов, содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, усиливает или стимулирует клеточноопосредованный иммунитет путем стимуляции бластогенеза и результирующей секреции цитокинов у здоровых людей. Эти результаты также показывают, что композиция растительных экстрактов по изобретению является полезным источником или одним из кандидатов для потенциальных способов лечения иммунных нарушений. Пример 3. Бластогенез in vitro лимфоцитов периферической крови от пациентов с острым лейкозом. В этом примере описано воздействие композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, описанные в примере 1, на клеточно-опосредованный иммунитет, которое измерялось также путем бластной трансформации или бластогенеза in vitro лимфоцитов, взятых у пяти лейкозных пациентов. В качестве контрольного образца использовали РНА (фитогемагглютинин), известный мощный митоген, который стимулирует трансформацию лимфоцитов, для подсчета или измерения эффективности смешанных экстрактов. Подготовили многолуночные пластины микротитратора, содержащие суспензии лимфоцитов от пяти лейкозных пациентов в растворе Хэнкса с добавкой 10% зародышевой телячьей сыворотки, пенициллина и стрептомицина. По 5, 10 и 20 мкл комбинированной композиции экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ добавили в лунки на каждой из пластин. Кроме того, в лунки добавили РНА (фитогемагглютинин) в концентрациях 1:50 и 1:100 в качестве контрольных образцов. Конечный объем суспензии лимфоцитов в каждой лунке составил 0,2 мл. Затем пластины микротитратора инкубировали в течение 72 ч при 37 С в СО 2 инкубаторе. В каждую лунку добавили 0,05 мл 3 Н-тимидина, после чего инкубировали еще 24 ч при 37 С. Клетки собрали автоматическим сборщиком и измерили радиоактивность сцинтиляционным счетчиком. Рассчитали индекс стимуляции для каждой концентрации смешанных экстрактов. Результаты представлены в табл. 3 и на фиг. 2. Результаты, представленные в табл. 3 и на фиг. 2, показывают, что добавление к суспензии лимфоцитов от лейкозных пациентов возрастающих количеств смешанных экстрактов приводит к увеличению степени трансформации или бластогенеза лимфоцитов, что проявляется в повышении радиоактивности из-за увеличения поглощения 3H. Композиция растительных экстрактов, содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, проявляет способность стимулировать трансформацию лимфоцитов, величина которой, по меньшей мере, такая же, как у РНА. Эти результаты означают, что композиция растительных экстрактов, содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, усиливает или стимулирует клеточно-опосредованный иммунитет invitro путем стимуляции бластогенеза лимфоцитов и, следовательно, результирующей секреции цитокинов в лимфоцитах от пациентов, страдающих лейкозом. Эти результаты также показывают, что композиция растительных экстрактов по изобретению является полезным источником или одним из кандидатов для потенциальных способов лечения иммунных нарушений. Пример 4. Бластогенез in vitro лимфоцитов периферической крови от пациентов с почечной недостаточностью. В этом примере описано воздействие композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, описанные в примере 1, на клеточно-опосредованный иммунитет, которое измерялось также путем бластной трансформации или бластогенеза in vitro лимфоцитов, взятых у пятнадцати пациентов,страдающих почечной недостаточностью. В качестве контрольного образца использовали РНА (фитогемагглютинин) в двух концентрациях для подсчета или измерения эффективности смешанных экстрактов. Подготовили многолуночные пластины микротитратора, содержащие суспензии лимфоцитов от пятнадцати пациентов, страдающих почечной недостаточностью, в растворе Хэнкса с добавкой 10% зародышевой телячьей сыворотки, пенициллина и стрептомицина. По 5, 10 и 20 мкл комбинированной композиции экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ добавили в лунки на каждой из пластин. Кроме 14 того, в лунки добавили РНА (фитогемагглютинин) с концентрациями 1:50 и 1:100 в качестве контрольных образцов. Конечный объем суспензии лимфоцитов в каждой лунке составил 0,2 мл. Затем пластины микротитратора инкубировали в течение 72 ч при 37 С в СО 2-инкубаторе. В каждую лунку добавили 0,05 мл 3 Н-тимидина,после чего инкубировали еще 24 ч при 37 С. Клетки собрали автоматическим сборщиком и измерили радиоактивность сцинтиляционным счетчиком. Рассчитали индекс стимуляции для каждой концентрации смешанных экстрактов. Результаты представлены в табл. 4 и на фиг. 3. Таблица 4 20 мкл экст- 10 мкл экст- 5 мкл экстПаци- Фон ент (кон- РНА PHA рактов (ин- рактов (ин- рактов (ин троль) 1:100 1:50 декс стим.) декс стим.) декс стим.) 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Результаты, представленные в табл. 4 и на фиг. 3, показывают, что добавление к суспензии лимфоцитов от пациентов с почечной недостаточностью возрастающих количеств смешанных экстрактов приводит к увеличению степени трансформации или бластогенеза лимфоцитов,что проявляется в повышении радиоактивности из-за увеличения поглощения 3H. Композиция растительных экстрактов АРУМА, ГРАНАТА,ГИБИСКУСА и ЧАЯ проявляет способность стимулировать трансформацию лимфоцитов,величина которой, по меньшей мере, такая же,как у РНА. Стимуляция бластной трансформации увеличилась на 306% при самой высокой концентрации (20 мкл). Эти результаты означают, что композиция растительных экстрактов АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ усиливает или стимулирует клеточноопосредованный иммунитет in vitro путем стимуляции бластогенеза лимфоцитов и, следовательно, результирующей секреции цитокинов в лимфоцитах от пациентов, страдающих почечной недостаточностью. Эти результаты также показывают, что композиция растительных экстрактов по изобретению является полезным источником или одним из кандидатов для потенциальных способов лечения иммунных нарушений. Пример 5. Стимуляция выработки цитокинов у здоровых людей. Воздействие композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, на выработку цитокинов в человеческих мононуклеарных клетках периферической крови (РМВС) измеряли с использованием методики, описанной D. Schols and E. De Clencq в статье Human Immunodeficiency Virus TypeVirol. Vol. 70, p. 4953-4960 (1996), содержание которой включено в данную заявку в виде ссылки. Средние результаты для двух здоровых испытуемых приведены в табл. 5. Таблица 5 НО - не обнаружено Как видно из табл. 5, присутствие композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, индуцирует выработку значительных количеств интерлейкина 10 (IL-10) и гамма-интерферона (IFN-) выше уровней, вырабатываемых в лунках, не содержащих растительных экстрактов. Интерлейкин 2(IL-2) обнаруживается в лунках, в которых смешанные экстракты присутствуют в концентрации 10%. При концентрации смешанных экстрактов 10% в клеточных культурах не наблюдалось токсичности, измеряемой трипановым голубым. Эти результаты показывают, что смешанные экстракты АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ усиливают или стимулируют выработку цитокинов in vitro в клетках РМВС от здоровых людей. Эти результаты также показывают, что композиция растительных экстрактов по изобретению является полезным источником или одним из кандидатов для потенци 16 альных способов лечения иммунных нарушений. Пример 6. Ингибирование in vitro связывания gp120 с клетками МТ-4. Измерялось при помощи моноклонального антитела ОКТ-4 А. Воздействие смеси растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ ("смешанные экстракты") на связываниеgp120 с МТ-4, проверяемое при помощи моноклональных антител (mAb) OKT-4A, определяли по методике, описанной J. Neyts, D. Reymen,D. Letourneur, J. Jozefonvicz, D. Schols, J. Este, G.Antiviral Activity of Derivatized Dextrans, Biochem. Pharmacol., Vol. 50, p. 743-751 (1995), содержание которой включено в данную заявку в виде ссылки. Протеин оболочки ВИЧ gp120,который связывается с эпитопом OKT-4A, блокирует конкурентное связывание с антителомOKT-4A. Смешанные экстракты АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ блокируют связывание gp120, как показано в табл. 6. Таблица 6 Связывание с(cоответствующее число клеток) Отрицательные контрольные опыты 4 Положительные контрольные опыты 600 Как видно из табл. 6, увеличение количества композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ приводит к увеличению ингибирования связывания gp120 с клетками МТ-4. Эти результаты показывают, что композиция растительных экстрактов, содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, является полезным источником или одним из кандидатов для потенциальных способов борьбы с ВИЧ in vivo у инфицированных носителей. Пример 7. Ингибирование in vitro связывания gp120 с клетками МТ-4. Измерялось при помощи моноклонального антитела к gp120. Воздействие композиции растительных экстрактов, включающей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ ("смешанные экстракты") на связы 17 вание gpl20 с МТ-4, оцениваемое при помощи моноклональных антител (mAb) к gp120, определяли по методике, описанной D. Schols, M.Cytometric Method To Demonstrate Whether AntiHiv-1 Agents Inhibit Virion Binding To T4+ Cells,содержание которой включено в данную заявку в виде ссылки. Смешанные экстракты АРУМА,ГРАНАТА, ГИБИСКУСА и ЧАЯ блокируют связывание gpl20, как показано в табл. 7. Таблица 7 Связывание с(cоответствующее число клеток) Отрицательные контрольные опыты 4 Положительные контрольные опыты 90 50% смешанных экстрактов 60 10% смешанных экстрактов 70 2% смешанных экстрактов 40 0,4% смешанных экстрактов 80 Декстрана сульфат, 25 мкг/мл 50 Как видно из табл. 7, композиция растительных экстрактов, содержащая экстракт АРУМА,экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, ингибирует связывание gp120 с клетками МТ-4. Эти результаты показывают, что композиция растительных экстрактов, содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, является полезным источником или одним из кандидатов для потенциальных способов борьбы с ВИЧ invivo у инфицированных носителей. Пример 8. Химический анализ смешанных экстрактов. Для исследования химического состава смеси растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, применялись обычные методики анализа на содержание различных витаминов, жиров, красителей, протеинов, минералов и других соединений. Результаты анализов представлены в табл. 8. Таблица 8 Объект анализа Содержание жиров,общее Содержание жиров,остаток Содержание жиров,остаток Нерастворимые Зольность, влажн.,105 С Величина рН,без разбавления Величина рН,1:10/воды Углеводы, общее Макромолекулы Протеины, общее 18 Полисахариды,общее Полисахариды,нераств. Полисахариды,растворимые Нуклеиновые кислоты, общее РНК ДНК Полифенолы Фотометрия Фотометрия Фотометрия Фотометрия(IgA) аффинная хроматография на jacaline sepharose Иммуноглобулин G(IgE) на тестовой пластине Тонкослойная АденозинN,NТонкослойная Недоказуемо диметилгуанозин хроматография Тонкослойная хроАденин+ хроматография Тонкослойная Стеариновая кислота 1 мг/мл хроматография Интерлейкин-4 Иммуноферментный 34 пг/мл(NWG 50 пг/мл) опухолей(TNF) Спектрометрия в 0,7% сухого Красный краситель УФ/видимой области вещества Спектрометрия в 15,7% сухого Зеленый краситель УФ/видимой области вещества Спектрометрия в 0,2% сухого Желтый краситель УФ/видимой области вещества Спектрометрия в 0,1% сухого Голубой краситель УФ/видимой области вещества Тонкослойная хромаВитамин С 3 мг/100 мл тография, фотометрия Тонкослойная хроматография Тонкослойная хроматография Тонкослойная хроматография Тонкослойная хроматография Как показывают результаты, приведенные в табл. 8, композиция растительных экстрактов,содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ,включает множество необходимых витаминов, в том числе витамин С, витамин Е, витамин К,витамин D2, витамин D3, а также различные необходимые минералы, другие полезные минералы, и поэтому представляет собой полезную и питательную диетическую добавку при оральном приеме. Результаты анализов, приведенные в табл. 8, также показывают, что в композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, присутствуют различные цитокины или цитокиноподобные протеины. В частности, в смешанных экстрактах АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ присутствуют обнаружимые количества IL-4, IL-5,IL-6, IL-10, IL-12, IFN- и TNF. Кроме того, в композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА,экстракт ГИБИСКУСА и экстракт ЧАЯ, обнаруживаются следы иммуноглобулина G и иммуноглобулинподобных протеинов. Присутствие человеческих IL-4, IL-5, IL-6, IL-10, IL-12,IFN-, TNF и IgG несколько противоречит растительному происхождению композиции растительных экстрактов. Однако известны некоторые растительные антивирусные факторы(AVF), которые имеют близкую гомологию последовательностей с человеческим -интерфероном (IFN) и которые предположительно обладают антивирусной активностью, сходной с активностью человеческих интерферонов. Таким образом, положительные результаты дляIL-4, IL-5, IL-6, IL-10, IL-12, IFN-, TNF и IgG,описанные выше, могут быть обусловлены интерлейкинподобными протеинами, интерферонподобными протеинами, TNF-подобными протеинами, присутствующими в композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ. Таким образом, выражение "композиция растительных экстрактов,содержащая экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ",используемое здесь, следует понимать как композиция, содержащая также IL-4, IL-5, IL-6, IL10, IL-12, IFN-, TNF и IgG, а кроме того, интерлейкинподобные протеины, интерферонпо 20 добные протеины, TNF-подобные протеины и иммуноглобулин-подобные протеины. Заключение Приведенные выше результаты экспериментов in vitro и анализов показывают, что композиция растительных экстрактов по изобретению является полезным потенциальным источником или одним из кандидатов для способов повышения иммунитета и способов лечения людей и животных, страдающих заболеваниями,расстройствами, инфекциями или состояниями,включая иммуносупрессорные состояния, обусловленные лейкозом, почечной недостаточностью, различными видами рака и опухолей, вирусными инфекциями, бактериальными инфекциями и паразитными инфекциями. Точный химический состав (составы) и фармакологический механизм (механизмы), которые приводят к стимуляции бластной трансформации и продуцирования цитокинов in vitro, не выяснены. Композиция растительных экстрактов по изобретению может содержать единственный фармакологически активный ингредиент, компонент или агент, действующий самостоятельно,или композицию таких ингредиентов, компонентов или агентов, и/или их биологических метаболитов или производных, действующих по отдельности или синергически. Способы лечения in vivo, использующие композицию растительных экстрактов по изобретению, повидимому, должны базироваться на жидких или твердых дозированных формах композиции растительных экстрактов для орального приема. Ректальный, парентеральный, внутривенный, местный, аэрозольный, ингаляционный или подкожный пути введения композиции растительных экстрактов in vivo также возможны. Композиция растительных экстрактов также может применяться in vivo в виде примесей или сочетаний с подходящими наполнителями, носителями, антивирусными агентами, иммуномодуляторами, химиотерапевтическими агентами,антителами или их сочетаниями. Фармацевтические препараты по изобретению могут представлять собой такие формы дозировки, как таблетки, капсулы, суппозитории, ампулы или жидкие или аэрозольные формы с контролируемым расходом. В настоящее время предполагается, что фармакологически активный компонент или компоненты по изобретению присутствуют в АРУМЕ и/или ГРАНАТЕ. Первичные исследования показывают, что отдельный экстракт АРУМА, отдельный экстракт ГРАНАТА, смешанные экстракты АРУМА и ГРАНАТА проявляют некоторые иммуностимулирующие эффекты. Однако предпочтительный вариант осуществления изобретения включает смешанные экстракты АРУМА и ГРАНАТА, а также ГИБИСКУСА и ЧАЯ. Предполагается, что ГИБИСКУС и ЧАЙ содержат другие дополнительные компоненты или агенты, действующие как на 21 полнители или носители, или же проявляющие синергический эффект вместе с компонентами,содержащимися в АРУМЕ и ГРАНАТЕ. Кроме того, предпочтительный способ получения композиции растительных экстрактов, содержащей экстракт АРУМА, экстракт ГРАНАТА, экстракт ГИБИСКУСА и экстракт ЧАЯ, в котором смешиваемые экстракты нагревают вместе по стадиям, как описано в примере 1, предположительно более благоприятен, чем простое смешивание или объединение экстракта АРУМА, экстракта ГРАНАТА, экстракта ГИБИСКУСА и экстракта ЧАЯ вместе без дополнительного нагрева. Приведенные выше результаты экспериментов in vitro и анализов показывают, что композиция растительных экстрактов по изобретению является полезным потенциальным источником или одним из кандидатов для способов лечения ВИЧ и других вирусов у людей и животных, страдающих ВИЧ и другими вирусными инфекциями, а также осложнениями и расстройствами, связанными с такими вирусными инфекциями. Растительный экстракт по изобретению потенциально может ингибировать или предотвращать инфицирование клеток множеством различных вирусов, включая (но не только) вирус герпеса, вирус бородавки человека,вирус коровьей оспы, вирус везикулярного стоматита, коксакивирусы, синцистовирусы, цитомегаловирус и вирусы ветряной оспы. АнтиВИЧ активный компонент композиции растительных экстрактов по изобретению может содержать единственный фармакологически активный ингредиент, компонент или агент, действующий самостоятельно, или композиция таких ингредиентов, компонентов или агентов,и/или их биологических метаболитов или производных, действующих по отдельности или синергически. Способы лечения ВИЧ и других вирусов in vivo, использующие композицию растительных экстрактов по изобретению, повидимому, должны базироваться на жидких или твердых дозированных формах смеси растительных экстрактов для орального или местного применения. Ректальный, парентеральный,внутривенный, местный, аэрозольный, ингаляционный или подкожный пути введения смеси растительных экстрактов in vivo также возможны. Что касается лечения иммуносупрессорных расстройств, композиция растительных экстрактов также может применяться in vivo для антивирусного лечения в виде примесей или сочетаний с подходящими наполнителями, носителями, антивирусными агентами, иммуномодуляторами, химиотерапевтическими агентами, антителами или их сочетаниями. Фармацевтические препараты по изобретению могут представлять собой такие формы дозировки, как таблетки, капсулы, суппозитории, лосьоны, ампулы или жидкие или аэрозольные формы с контролируемым расходом. 22 Таким образом, данное изобретение предоставляет композицию растительных экстрактов,которая представляет собой питательную добавку,которая стимулирует in vitro клеточноопосредованный иммунитет, которая стимулируетin vitro бластогенез лимфоцитов, которая стимулирует in vitro выработку цитокинов лимфоцитами, которая ингибирует in vitro ВИЧ-инфекцию и которая представляет собой один из потенциальных кандидатов для способов лечения, обеспечивающих усиление или стимуляцию иммунной реакции у людей и животных. Хотя приведенное выше описание содержит много специфических подробностей, их не следует рассматривать как ограничивающие объем изобретения, а просто как иллюстрации предпочтительного в настоящее время варианта осуществления изобретения. Таким образом, объем данного изобретения должен определяться прилагаемой формулой изобретения и ее эквивалентами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция растительных экстрактов,обладающая иммуностимулирующей активностью, содержащая экстракт АРУМА. 2. Композиция растительных экстрактов по п.1, содержащая также экстракт ГРАНАТА. 3. Композиция растительных экстрактов по п.1, содержащая также экстракт ГИБИСКУСА. 4. Композиция растительных экстрактов по п.1, содержащая также экстракт ЧАЯ. 5. Композиция растительных экстрактов по п.2, содержащая также экстракт ГИБИСКУСА. 6. Композиция растительных экстрактов по п.2, содержащая также экстракт ЧАЯ. 7. Композиция растительных экстрактов по п.5, содержащая также экстракт ЧАЯ. 8. Композиция растительных экстрактов,обладающая иммуностимулирующей активностью, содержащая экстракт ГРАНАТА. 9. Композиция растительных экстрактов по п.8, содержащая также экстракт ГИБИСКУСА. 10. Композиция растительных экстрактов по п.8, содержащая также экстракт ЧАЯ. 11. Композиция растительных экстрактов по п.9, содержащая также экстракт ЧАЯ. 12. Композиция растительных экстрактов по п.7, отличающаяся тем, что экстракты АРУМА, ГРАНАТА, ГИБИСКУСА и ЧАЯ являются водными экстрактами. 13. Композиция растительных экстрактов по п.12, отличающаяся тем, что дополнительно содержит, по меньшей мере, один цитокин. 14. Композиция растительных экстрактов по п.13, где упомянутый цитокин представляет собой интерлейкин. 15. Композиция растительных экстрактов по п.13, где упомянутый цитокин представляет собой интерферон. 16. Композиция растительных экстрактов по п.12, где упомянутая композиция дополни 23 тельно содержит, по меньшей мере, один фактор некроза опухолей. 17. Композиция растительных экстрактов по п.12, где упомянутая композиция дополнительно содержит, по меньшей мере, один иммуноглобулин. 18. Композиция растительных экстрактов по п.12, где упомянутая композиция дополнительно содержит полисахарид. 19. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит протеины. 20. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит РНК. 21. Композиция растительных экстрактов по п.13, где упомянутая композиция дополнительно содержит ДНК. 22. Композиция растительных экстрактов по п.13, где упомянутая композиция содержит приблизительно равные части упомянутых водных экстрактов. 23. Способ получения композиции растительных экстрактов по п.2, обладающей иммуностимулирующей активностью, включающий следующие этапы:(а) получение экстракта АРУМА путем кипячения высушенного измельченного АРУМА в воде;(б) получение экстракта ГРАНАТА путем кипячения высушенного измельченного ГРАНАТА в воде;(в) смешивание упомянутого экстракта АРУМА и упомянутого экстракта ГРАНАТА и кипячение смеси. 24. Способ получения композиции растительных экстрактов по пп.3-7, дополнительно включающий следующие этапы:(а) получение экстракта АРУМА путем кипячения высушенного измельченного АРУМА в воде;(б) получение экстракта ГРАНАТА путем кипячения высушенного измельченного ГРАНАТА в воде;(в) получение экстракта ГИБИСКУСА путем кипячения высушенного измельченного ГИБИСКУСА в воде;(г) получение экстракта ЧАЯ путем кипячения высушенного измельченного ЧАЯ в воде;(д) смешивание упомянутого экстракта АРУМА, упомянутого экстракта ГРАНАТА,упомянутого экстракта ГИБИСКУСА и упомянутого экстракта ЧАЯ и кипячение смеси. 25. Способ стимуляции in vitro клеточноопосредованного иммунитета, включающий воздействие на клетки эффективным количеством композиции растительных экстрактов по одному из пп.1-11. 26. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.25, в котором 24 упомянутые клетки представляют собой клетки от здоровых людей. 27. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.25, в котором упомянутые клетки представляют собой клетки пациентов, страдающих лейкозом. 28. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.25, в котором упомянутые клетки представляют собой клетки пациентов, страдающих почечной недостаточностью. 29. Способ стимуляции in vitro клеточноопосредованного иммунитета, включающий воздействие на суспензии лимфоцитов эффективного количества композиции растительных экстрактов по одному из пп.1-11. 30. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты здоровых людей. 31. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты пациентов, страдающих лейкозом. 32. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.29, в котором упомянутые суспензии лимфоцитов содержат лимфоциты пациентов, страдающих почечной недостаточностью. 33. Способ стимуляции in vitro клеточноопосредованного иммунитета, включающий воздействие на мононуклеарные клетки периферической крови эффективного количества композиции растительных экстрактов по одному из пп.1-11. 34. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от здоровых людей. 35. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от пациентов, страдающих лейкозом. 36. Способ стимуляции in vitro клеточноопосредованного иммунитета по п.33, в котором упомянутые мононуклеарные клетки периферической крови получены от пациентов, страдающих почечной недостаточностью. 37. Способ ингибирования in vitro ВИЧинфекции, включающий воздействие на клетки эффективного количества композиции растительных экстрактов по одному из пп.1-11. 38. Способ ингибирования in vitro связывания gp120 с клетками МТ-4, включающий воздействие на упомянутые клетки МТ-4 эффективного количества композиции растительных экстрактов по одному из пп.1-11.
МПК / Метки
МПК: A61P 37/04, A61K 35/78
Метки: обладающие, применения, композиции, иммуностимулирующей, получения, способы, экстрактов, способностью, растительных
Код ссылки
<a href="https://eas.patents.su/14-3750-kompozicii-rastitelnyh-ekstraktov-obladayushhie-immunostimuliruyushhejj-sposobnostyu-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции растительных экстрактов, обладающие иммуностимулирующей способностью, способы их получения и применения</a>