Способ получения 16-замещенных 4 -аза-5 альфа – андрост -1- ен-3-онов и промежуточные продукты для его осуществления
Формула / Реферат
1. Способ получения соединения структурной формулы (II)
где Аr является незамещенным или моно- или дизамещенным фенилом, нафтилом или 5-, 6- или 7-членным гетероароматическим кольцом, содержащим, по крайней мере, один члeн, выбранный из группы, состоящей из одного атома кислорода в кольце, одного атома серы в кольце, 1-4 атомов азота в кольце, или их сочетания; где гетероароматическое кольцо может также быть сконденсировано с одним бензо или гетероароматическим кольцом;
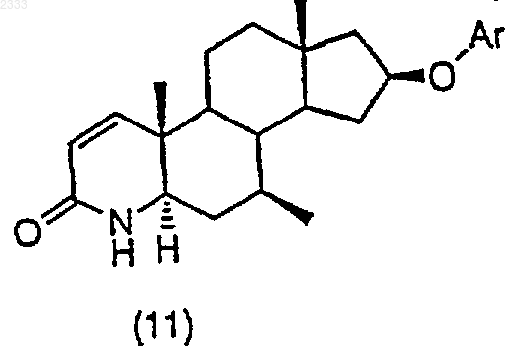
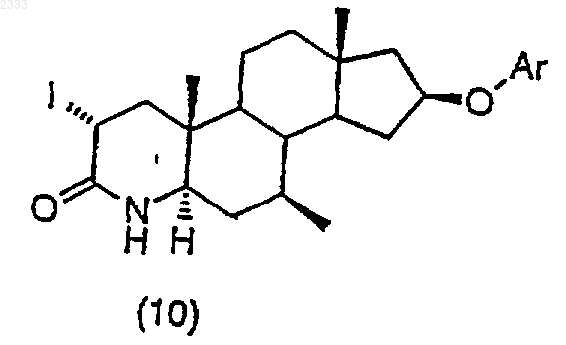
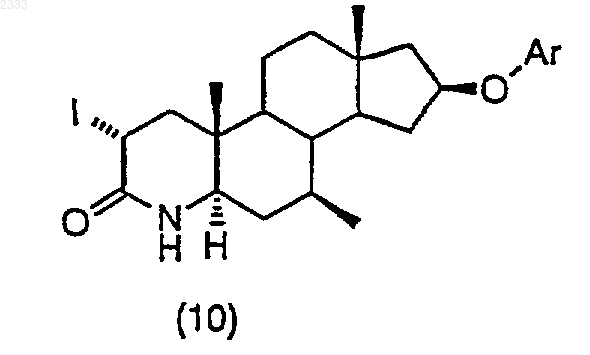
обработкой соединения структурной формулы (10)
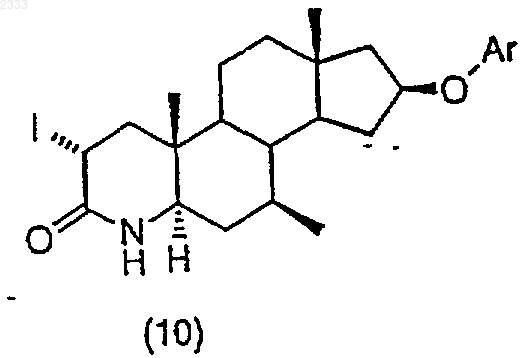
трет-бутоксидом калия и выделением полученного соединения (11).
2. Способ по п.1, дополнительно включающий стадию получения соединения структурной формулы (10)
обработкой соединения структурной формулы (9)
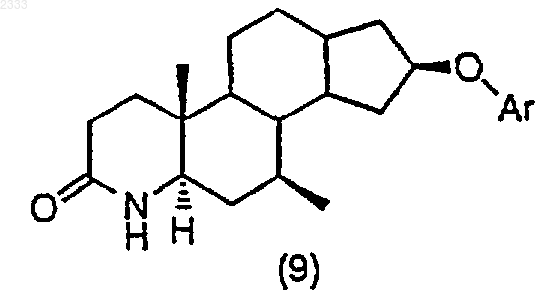
триметилсилилхлоридом в присутствии органического основания, добавлением йода и выделением полученного соединения (10).
3. Способ по п.2, дополнительно включающий стадию получения соединения структурной формулы (9)
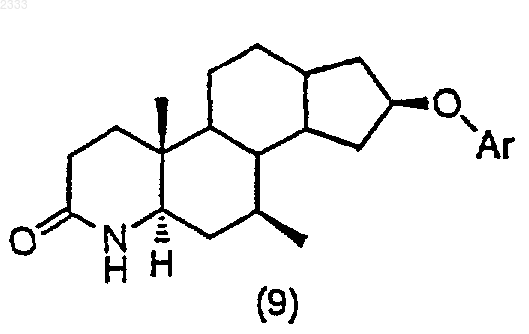
обработкой соединения структурной формулы (8)
трет-бутоксидом калия, добавлением Ar-F и выделением полученного соединения (9).
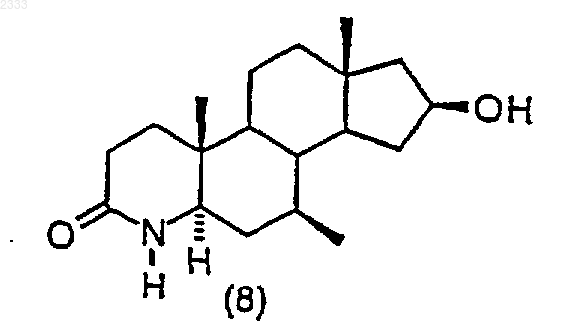
4. Способ по п.3, дополнительно включающий стадию получения соединения структурной формулы (8)
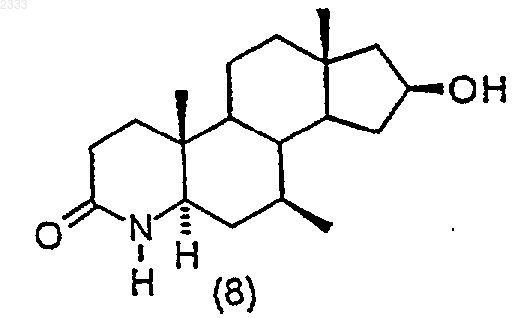
гидрированием соединения структурной формулы (7)
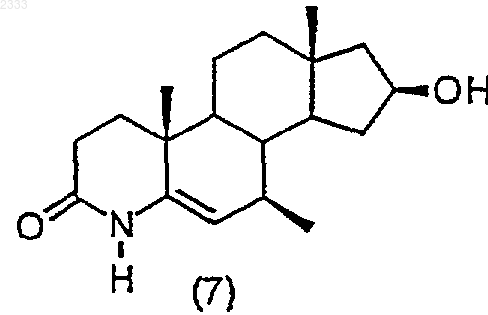
и выделением полученного соединения (8).
5. Способ по п.4, дополнительно включающий стадию получения соединения структурной формулы (7)
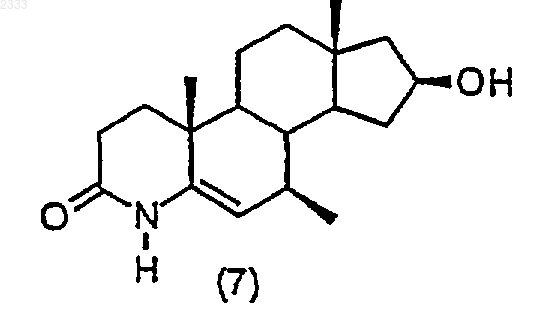
обработкой соединения структурной формулы (6)
три-втор-бутилборгидридом лития с последующим окислением и выделением полученного соединения (7).
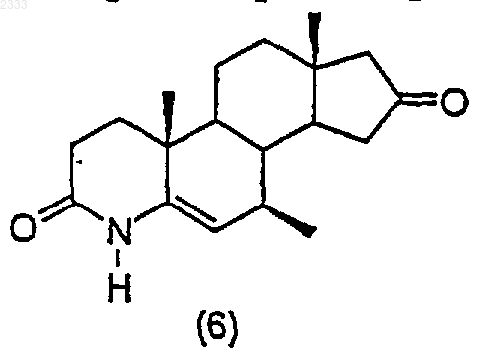
6. Способ по п.5, дополнительно включающий стадию получения соединения структурной формулы (6)
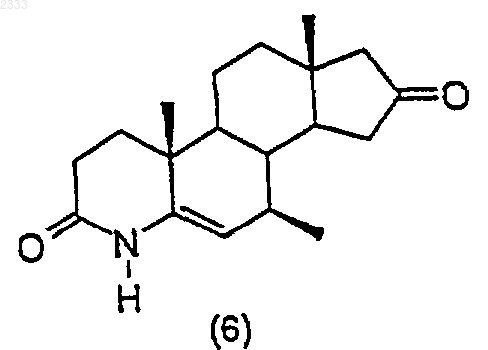
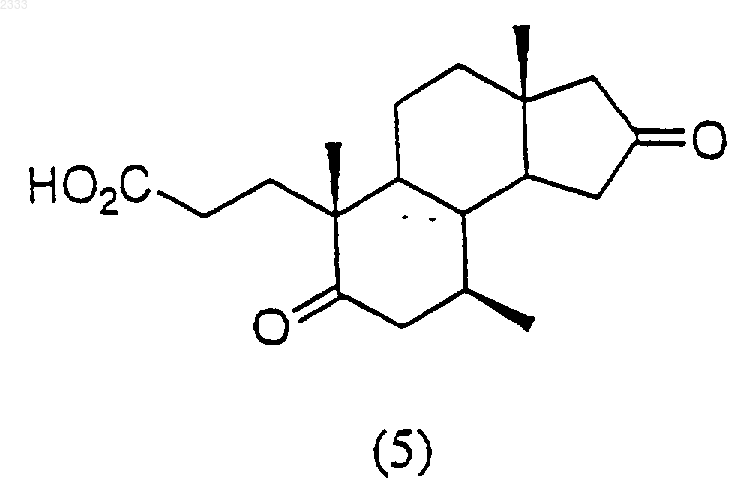
обработкой соединения структурной формулы (5)
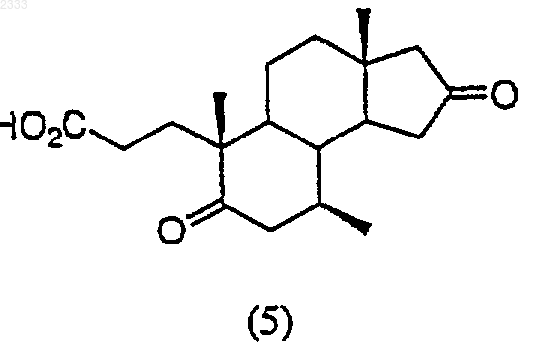
ацетатом аммония в кипящей уксусной кислоте с обратным холодильником, выделением полученного соединения (6).
7. Способ по п.6, дополнительно включающий стадию получения соединения структурной формулы (5)
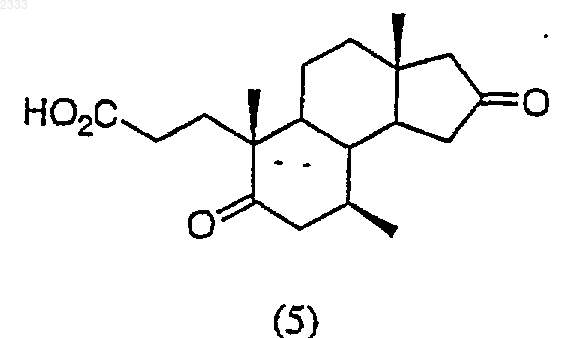
обработкой соединения структурной формулы (4)
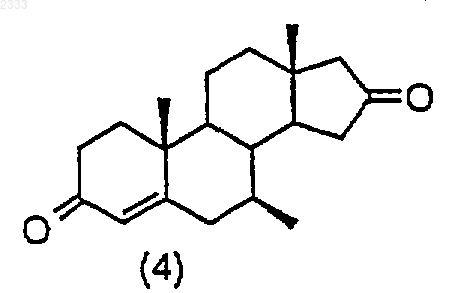
периодатом натрия и каталитическим перманганатом калия и карбонатом натрия и выделением полученного соединения (5).
8. Способ по п.7, дополнительно включающий стадию получения соединения структурной формулы (4)
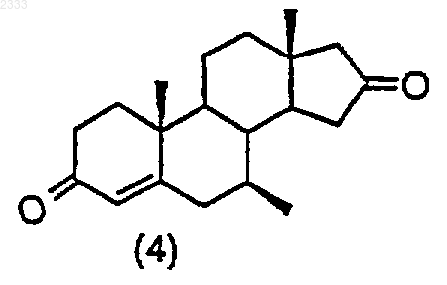
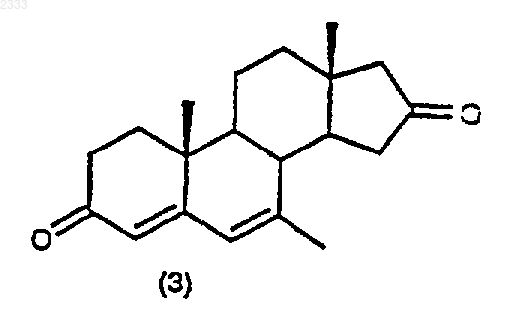
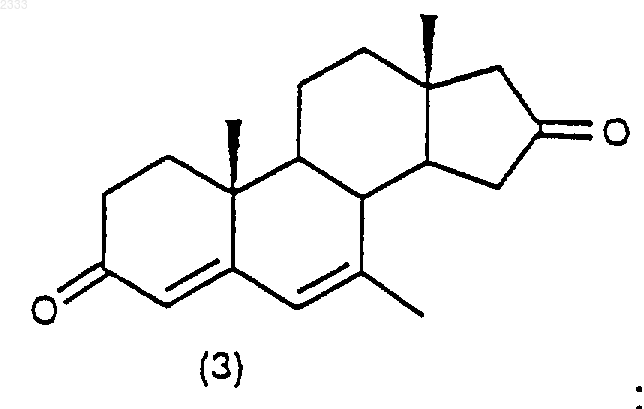
обработкой соединения структурной формулы (3)
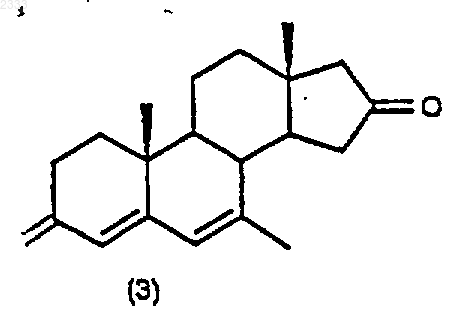
10% Pd/C, циклогексеном и этанолом в органическом растворителе и выделением полученного соединения (4).
9. Способ по п.8 дополнительно включающий стадию получения соединения структурной формулы (3)
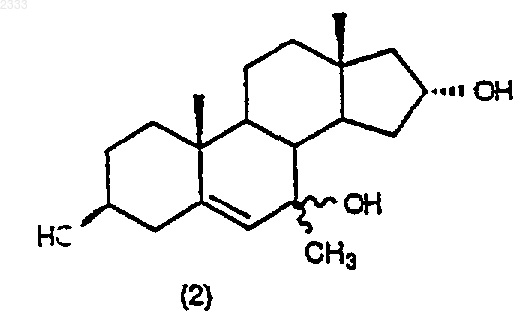
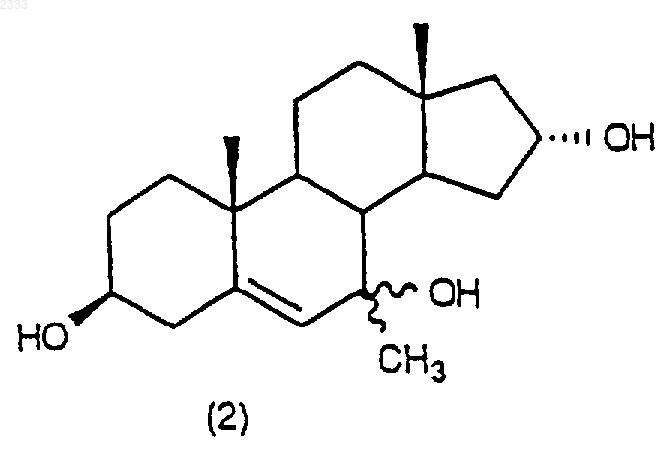
обработкой соединения структурной формулы (2)
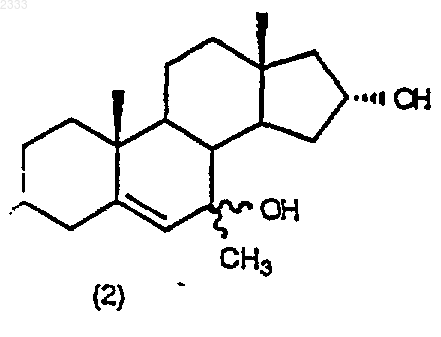
изопропоксидом алюминия и 2-бутаноном в присутствии органического основания в органическом растворителе с последующим добавлением водного раствора кислоты, нейтрализацией водным основанием и выделением соединения (3) в виде раствора в органическом растворителе.
10. Способ по п.9, дополнительно включающий стадию получения соединения структурной формулы (2)
обработкой соединения структурной формулы (1)
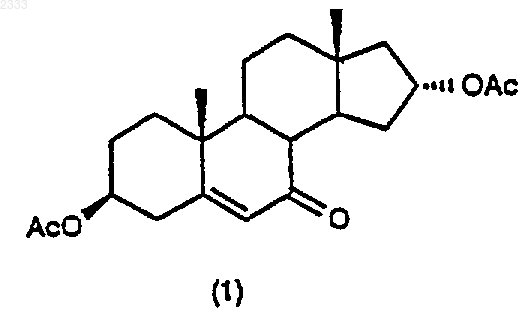
метилмагнийхлоридом в присутствии хлорида церия в органическом растворителе.
11. Способ по п.1, в котором Аr выбран из незамещенного или моно- или дизамещенного фенила, нафтила, пиридила, фурила, пирролила, тиенила, изотиазолила, имидазолила, бензимидазолила, тетразолила, пиразинила, пиримидила, хинолила, изохинолила, бензофурила, изобензофурила, бензотиенила, пиразолила, индолила, изоиндолила, пуринила, карбазолила, изоксазолила, тиазолила, оксазолила, бензтиазолила и бензоксазолила.
12. Способ по п. 11, дополнительно включающий стадию получения соединения структурной формулы (10)
обработкой соединения структурной формулы (9)
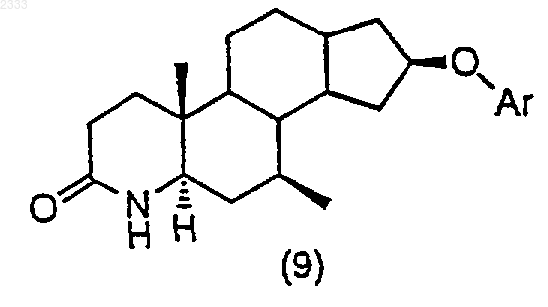
триметилсилилхлоридом в присутствии органического основания, добавлением йода и выделением полученного соединения (10).
13. Способ по п.12, дополнительно включающий стадию получения соединения структурной формулы (9)
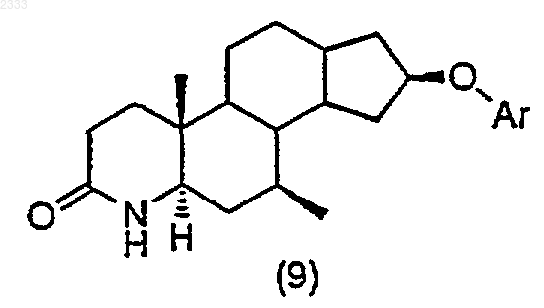
обработкой соединения структурной формулы (8)
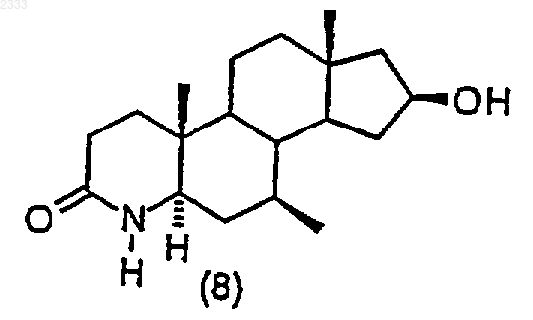
трет-бутоксидом калия, добавлением Ar-F и выделением полученного соединения (9).
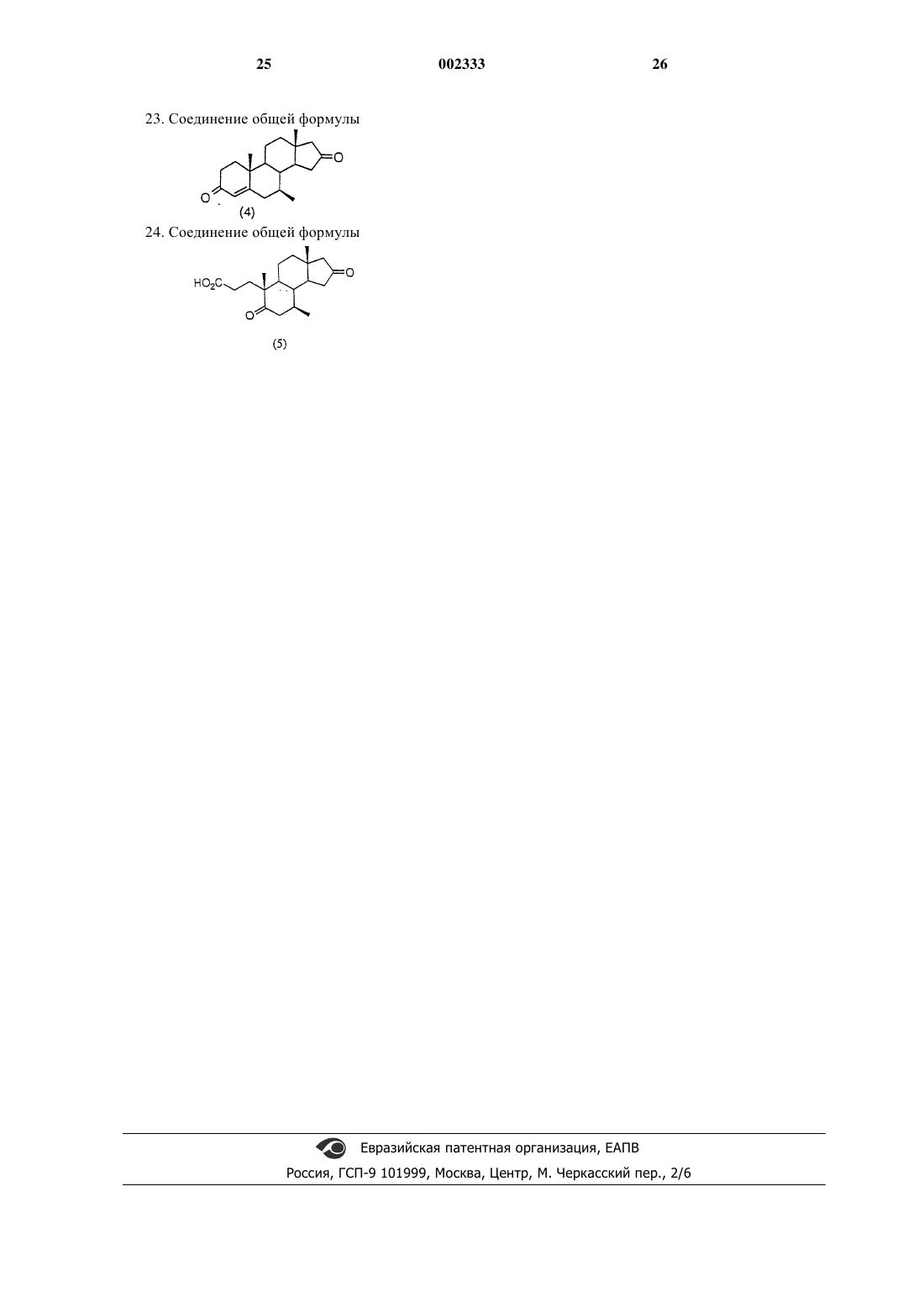
14. Способ получения соединения структурной формулы (11)
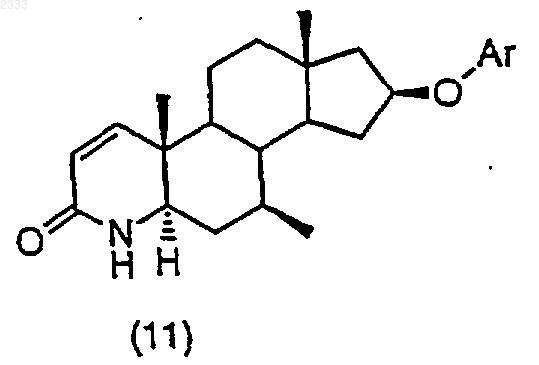
где Аr является незамещенным или моно- или дизамещенным фенилом, нафтилом или 5-,6- или 7- членным гетероароматическим кольцом, содержащим, по крайней мере, один атом, выбранный из группы, состоящей из одного атома кислорода в кольце, одного атома серы в кольце, 1-4 атомов азота в кольце, или их сочетания; где гетероароматическое кольцо может также быть сконденсировано с одним бензо или гетероароматическим кольцом;
включающий
(а) обработку соединения структурной формулы (1)
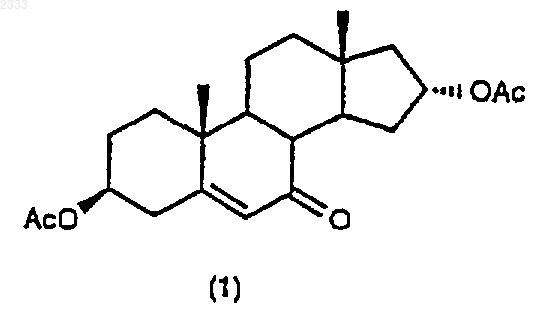
метилмагнийхлоридом в присутствии хлорида церия в органическом растворителе с получением соединения (2)
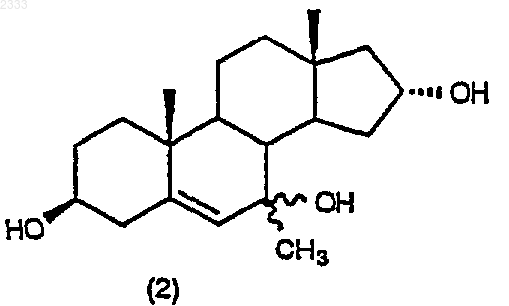
(b) обработку соединения структурной формулы (2) изопропоксидом алюминия и 2-бутаноном в присутствии органического основания в органическом растворителе с последующим добавлением водного раствора кислоты к раствору, нейтрализацией водным основанием и выделением соединения (3) в виде раствора в органическом растворителе
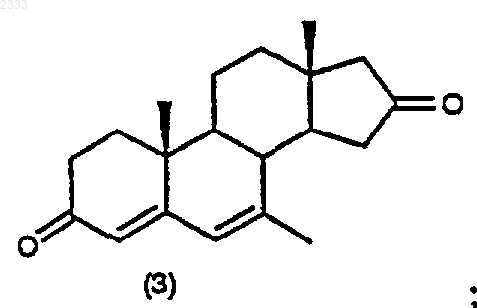
(с) обработку соединения структурной формулы (3) 10% Pd/C, циклогексеном и этанолом в органическом растворителе и выделение полученного соединения (4)
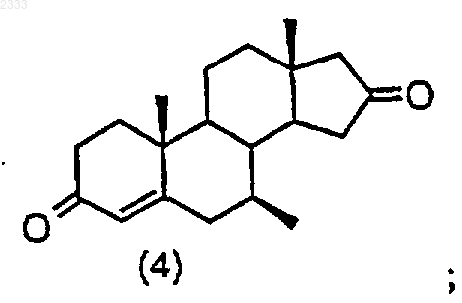
(d) обработку соединения структурной формулы (4) периодатом натрия и каталитическим перманганатом калия и карбонатом натрия и выделение полученного соединения (5)

(е) обработку соединения структурной формулы (5) ацетатом аммония в кипящей уксусной кислоте с обратным холодильником и выделение полученного соединения (6)
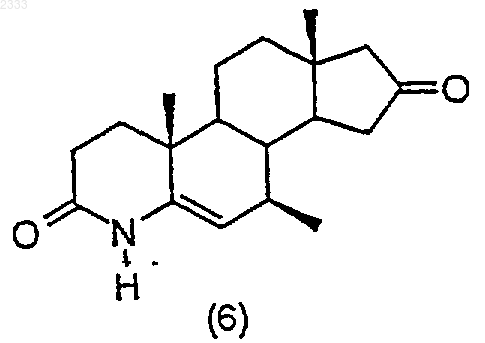
(f) обработку соединения структурной формулы (6) три-втор-бутилборгидридом лития с последующим окислением и выделение полученного соединения (7)
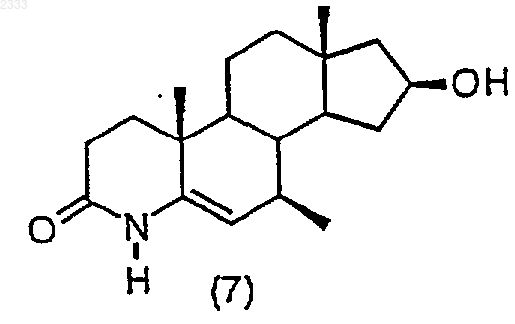
(g) гидрирование соединения структурной формулы (7) и выделение полученнюую соединения(8)
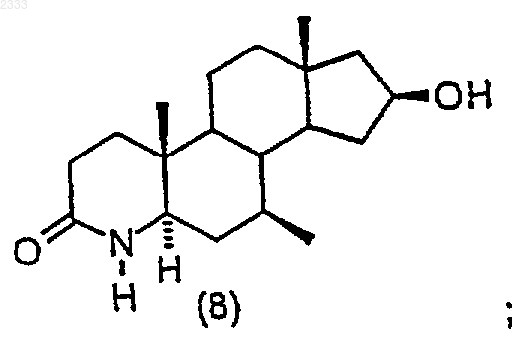
(h) обработку соединения структурной формулы (8) трет-бутоксидом калия с добавлением Ar-F и выделение полученного соединения (9)
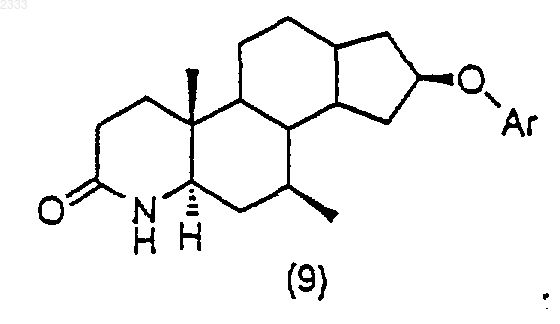
(i) обработку соединения структурной формулы (9) триметилсилилхлоридом в присутствии органического основания, добавление йода и выделение полученного соединения (10)
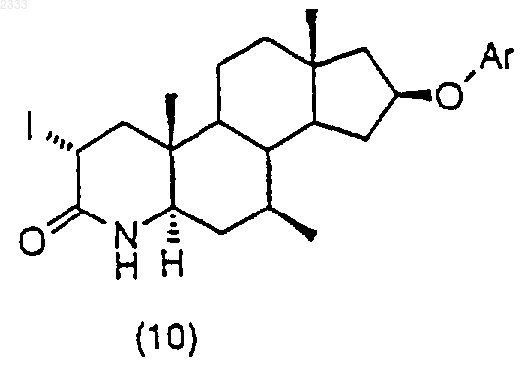
(j) обработку соединения структурной формулы (10) трет-бутоксидом калия и выделение полученного соединения (11).
15. Способ по п.14, в котором Аr является 4-метилфенилом.
16. Соединение общей структурной формулы (II)
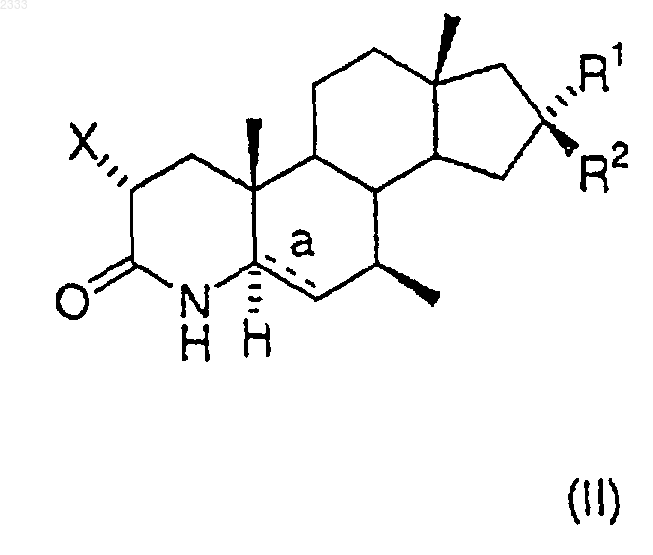
где R1 представляет атом водорода и R2 выбран из гидроксигруппы или группы O-Аr,
или R1 и R2, взятые вместе, образуют оксогруппу,
"а" означает простую связь и присутствует Н,
или "а" означает двойную связь и тогда Н отсутствует,
Х означает водород или йод.
17. Соединение по п.16, представленное формулой
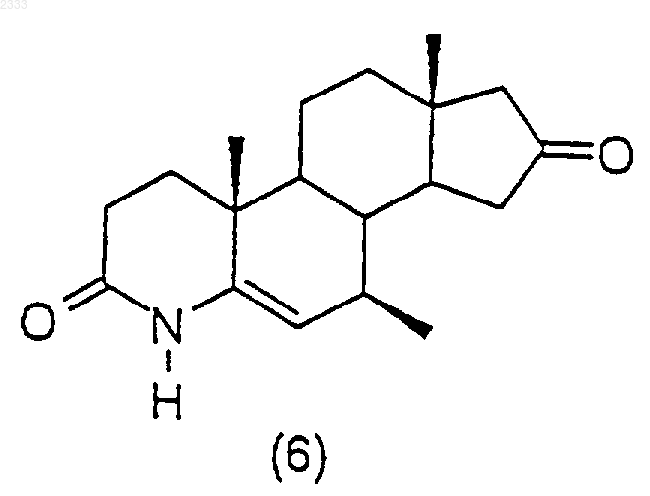
18. Соединение по п.16, представленное формулой
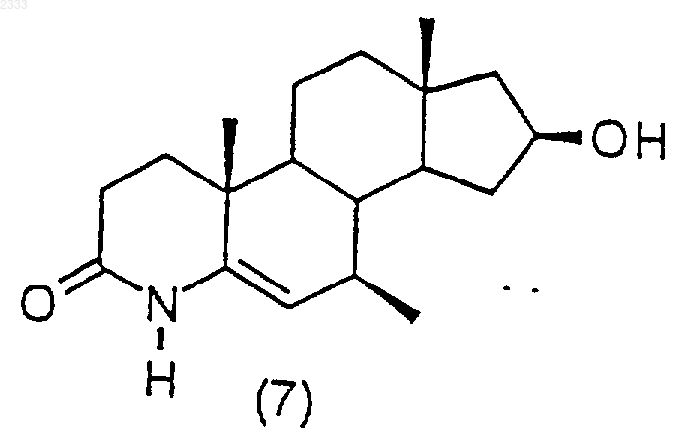
19. Соединение по п.16, представленное формулой

20. Соединение по п.16, представленное формулой

21. Соединение общей формулы
22. Соединение общей формулы
23. Соединение общей формулы

24. Соединение общей формулы
Текст
1 Уровень техники Основным медиатором андрогенной активности в некоторых целевых органах, например простате, является 5-дигидротестостерон(ДГТ), образуемый локально в целевом органе в результате действия 5-редуктазы, которая превращает тестостерон в ДГТ. Определенные нежелательные физиологические проявления,такие как обыкновенные угри, себорея, гирсутизм у женщин, андрогенная алопеция (также называемая андрогенетической алопецией), которая включает женское и мужское частичное облысение, и доброкачественная простатическая гиперплазия, являются результатом гиперандрогенного стимулирования, являющегося следствием избыточного накопления тестостерона(Т) или подобных андрогенных гормонов в метаболической системе. Ингибиторы 5 редуктазы служат для предотвращения или ослабления симптомов гиперандрогенной стимуляции в таких органах. См. патенты США 4,377,584, опубликованный 22 марта 1983 и 4,760,071, опубликованный 26 июля 1988, на имя MerckCo., Inc. В настоящее время известно, что существует второй изофермент 5 редуктазы, который взаимодействует с тканями кожи, особенно с тканями кожи головы. См.,например, G. Harris et al., Proc. Natl. Acad. Sci.USA, том 89, стр. 10787-10791 (ноябрь 1992) . Изофермент, который главным образом взаимодействует с тканями кожи, обычно обозначается как 5-редуктаза 1 (или 5-редуктаза, типа 1), в то время как изофермент, который главным образом взаимодействует с тканями простаты,обозначается как 5-редуктаза 2 (или 5 редуктаза, типа 2). В патенте США 5,237,064 описан способ получения 7-замещенных 5-андростан-3 онов. В патенте США 5,470,976 описано стереоселективное гидрирование дельта-5 двойной связи 17-замещенного азастероида. Патент США 5,120,847 и патент США 5,021,575 относятся к введению двойной связи в положениях 1,2-4-азастероида. Данное изобретение относится к улучшенному способу синтеза 16-замещенных 7-метил 4-аза-5-андрост-1-ен-3-онов. 16-Замещенные 7 метил-4-аза-5-андрост-1-ен-3-оны описаны в публикации РСТ WO 95/11254. Также в данном изобретении представлены промежуточные соединения, используемые в данном способе. Описание изобретения Новый способ данного изобретения включает стереоселективный синтез определенных 16-замещенных 4-аза-5-андрост-1-ен-3-онов, и получаемые при этом полезные промежуточные соединения. Одна группа промежуточных соединений представлена общей структурной формулой II где R1 представляет атом водорода и R2 выбран из гидроксигруппы или группы O-Аr,или R1 и R2 взятые вместе образуют оксогруппу,"а" означает простую связь и присутствует Н,или "а" означает двойную связь и тогда H отсутствует,Х означает водород или йод. Новый способ получения 16-замещенных 4-аза-5 андрост-1-ен-3-онов проиллюстрирован нижеприведенной схемой, в которой соединения (6),(7),(8) и (10) входят в группу промежуточных продуктов, охватываемых общей структурной формулой II, 3 Продукты данного способа используют в качестве ингибиторов 5-редуктазы, особенно 5-редуктазы типа 1. Ингибиторы 5-редуктазы используют при лечении гиперандрогенных расстройств, таких как доброкачественная гиперплазия простаты, обыкновенные угри, себорея, гирсутизм у женщин, андрогенная алопеция (андрогенетическая алопеция), которая включает мужское частичное облысение и профилактики и лечения карциномы простаты. Подробное описание изобретения Общая методика способа данного изобретения показана ниже. где Аr представляет собой незамещенный или моно- или дизамещенный фенил, нафтил, или 5,6 или 7 членное гетероароматическое кольцо, содержащее, по крайней мере, один член, выбранный из группы, включающей один атом кислорода в кольце, один атом серы в кольце, 1-4 атомов азота в кольце, или их комбинацию; где гетероароматическое кольцо также является сконденсированным с одним бензо или гетероароматическим кольцом. Если Аr является гетероарилом, гетероарильное кольцо может быть присоединено в пределах структурной формулы I, или замещено в любом атоме углерода в кольце, что дает создание стабильной структуры. Заместители в арильной и гетероарильной группах, указанных выше, независимо выбирают изC1-6 алкила; RbRcN-C (О)-C1-6 алкила; C1-6 алканоиламино C1-6 алкила; ароиламино C1-6 алкила; где C1-6 алкильная часть не замещена или замещена 1-3 заместителями, выбранными из галогена; C1-4 алкокси; или трифторметила;iii) арила; арилокси; арилкарбонила; арилтио; арилсульфонила; арилсульфинила; арилсульфонамидо; арилоксикарбонила; где арильная часть не замещена или замещена 1-3 заместителями выбранными из галогена; C1-4 алкила;Rc независимо являются Н, C1-6 алкилом, арилом или арил C1-6 алкилом; где алкильная часть не замещена или замещена 1-3 заместителями, выбранными из галогена; C1-4 алкокси; или трифторметила; и арильная часть может быть замещена 1-3 заместителями, выбранными из галогена; С 1-4 алкила; C1-4 алкокси; или трифторметила; и N(Rb)-С(О)-ORg, гдеRg является C1-6 алкилом или арилом, в котором алкильная часть не замещена или замещена 1-3 5 заместителями, выбранными из галогена; C1-4 алкокси; или трифторметила, и арильная часть не замещена или замещена 1-3 заместителями,выбранными из галогена; C1-4 алкила; C1-4 алкокси или трифторметила; -N(Rb)-С(О)NRcRd,где Rd выбирают из Н, C1-6 алкила и арила; где указанный C1-6 алкил и арил не замещены или замещены, как описано выше в (f) для Rb и Rc;iv) гетероциклической группы, где гетероциклическое кольцо может быть сконденсировано с бензольным кольцом, и где указанное гетероциклическое кольцо не замещено или замещено от одного до трех заместителями, как определено для i), ii), iii) и iv) , исключая iv) гетероциклическую группу. Предпочтительно Аr выбирают из незамещенного или моно- или дизамещенного фенила,нафтила, пиридила, фурила, пирролила, тиенила, изотиазолила, имидазолила, бензимидазолила, тетразолила, пиразинила, пиримидила, хинолила,изохинолила,бензофурила,изобензофурила, бензотиенила, пиразолила, индолила, изоиндолила, пуринила, карбазолила, изоксазолила, тиазолила, оксазолила, бензтиазолила и бензоксазолила. В другом варианте Аr выбирают из незамещенного или моно- или дизамещенного фенила, нафтила, пиридила, пирролила, пиразинила, пиримидила и оксазолила. Предпочтительно заместители арила и гетероарила выбирают изvi) -NRbRc; Rb-C(O)-N(Rc)-; где Rb и Rc независимо являются Н, C1-6 алкилом, арилом или арил C1-6 алкилом; где алкильная часть не замещена или замещена 1-3-заместителями, выбранными из галогена; C1-4 алкокси; или трифторметила; и арильная часть не замещена или замещена 1-3 заместителями, выбранными из галогена; C1-4 алкила;vii) гетероциклической группы, которая представляет собой 5 членное ароматическое кольцо, содержащее один атом азота в кольце или один атом кислорода в кольце и один атом азота в кольцe. Исходные вещества для данного способа получают по методикам, описанным у Miller etal Tetrahedron Letters 37(20) 3429-3432 (1996) и в публикации РСТ WO 95/32215, он является широко известным и коммерчески доступным в данной области техники. Добавление метилмагнийхлорида к 7-кето 3,16-бис-ацетатному исходному соединению (1) расщепляет 3 и 16 ацетаты с одновременным добавлением к 7-кетону с получением соединения (2). Безводный трихлорид церия в виде присущих игольчатых кристаллов добавляют к реагенту Гриньяра перед добавлением 7-кетона и 6 улучшают выход реакции на 15%. Триол (2) может быть использован на следующей стадии без очистки, или может быть выделен. Окисление триола (2) до диендиона (3) проводят в условиях реакции Оппенауэра с 2 бутаноном, изопропоксидом алюминия и триэтиламином. При старении концентрированной НСl имеет место одновременный гидролиз солей алюминия и удаление 7-ОН. Димеры бутанона могут быть удалены из реакционной смеси с помощью водной дистилляции до проведения следующей стадии, или может быть выделен диендион (3). Хемо- и стереоселективное восстановление диенона (3) до 7 метил енона (4) получают в условиях переходного гидрирования, используя 10% Pd/C и циклогексен в качестве донора водорода. Осторожное проведение реакции и частый контроль обеспечивают незначительное перевосстановление и высокий выход енона. Окислительное расщепление енона (4) до секокислоты (5) проводят с использованием периодата натрия и каталитического перманганата калия с карбонатом натрия. Введение атома азота в кольцо А проводят при кипячении с обратным холодильником уксусной кислоты с ацетатом аммония. В качестве ингибитора радикалов добавляют ВНТ для предотвращения разложения енелактам кетона (6). Хемо- и стереоселективное восстановление неочищенного енелактам кетона (6) проводят с L-Селектридом при температуре -5 С. После окислительной обработки для превращения побочных продуктов триалкилбора в борную кислоту, енелактамовый спирт (7) кристаллизуют из ацетонитрила. Прохождение данной реакции в более разбавленных условиях и снижение уровня толуола улучшают выход. Гидрирование енелактамового спирта (7) является основным, так как оставшийся енелактам не кристаллизуется из NH лактамового спирта (8) и влияет на чистоту конечного продукта. Арилирование NH лактамового спирта (8) проводят с использованием калий третбутоксида в N-метилпирролидиноне с получением соединения (9). Изомерная чистота фторзамещенного арильного реагента является ключевым фактором данной реакции так как орто,так и мета изомеры фтортолуола также взаимодействуют с получением соответствующих изомерных продуктов. Полное йодирование при образовании соединения (10) является важным фактором, так как NH лактамовый спирт не легко удаляется из йодида или конечного нерасфасованного лекарства при перекристаллизации. КонцентрацияNH лактамового спирта в йодиде обычно составляет менее чем 0,2 мас.%. Гашение при низких температурах (менее чем 5 С) должно проводиться с большой осторожностью, чтобы из 7 бежать восстановления йодида до исходного материала. Образование 1,2-двойной связи с помощью дегидройодирования дает соединение (11). Примерные методики экспериментов, использующие новый способ, более подробно представлены ниже. Эти методики являются только примерными и не ограничивают область данного изобретения. Аббревиатуры: АЦН - ацетонитрил; ВНТ 2,6-трет-бутил-4-метилфенол; ок. - около; ДБУ (1,8-диазабицикло[5.4.0]ундец-7-ен; ИС - изопропиловый спирт; L-Селектрид - литий тривтор-бутилборгидрид; МЭК - метилэтилкетон; МПЛ - 1-метил-2-пирролидинон; ТГФ - тетрагидрофуран; ТМЭДА - N,N,N',N'-тетраметилэтилендиамин; ХТМСИ - хлортриметилсилан. Пример 1. Получение 3,6,16-триола (2) Хлорид церия (3,96 кг) загружают в виде твердого вещества в реакционный сосуд. ТГФ(35 кг) загружают в вакууме, затем добавляют воду (20 мл) через входное отверстие и смесь подвергают старению при температуре 35 С в течение 1 часа. Отбирают пробу и исследуют ее с помощью микроскопии для того, чтобы удостовериться в превращении в требуемую кристаллическую форму. Аморфный хлорид церия, перемешиваемый в ТГФ, превращается в тонкоизмельченную стержневидную кристаллическую форму. Данная кристаллическая форма необходима для получения стереоселективности в реакции Гриньяра. Предыдущий опыт показал, что содержание воды в ТГФ/хлориде церия должно быть менее чем 1000 чнм для получения требуемой кристаллической формы. Было обнаружено, что более влажные суспензии необратимо образуют другую кристаллическую форму, которая не имеет той же специфичности в реакции Гриньяра. Однако ТГФ, используемый в данном примере, является крайне сухим (50 чнм) и перемешивание в нем аморфного хлорида церия не дает требуемого превращения и твердое вещество остается аморфным. Было продемонстрировано, что для того, чтобы имела место конверсия, необходимо небольшое количество воды, и к смеси добавляют воду до общего содержания воды около 500 чнм. После охлаждения смеси до температуры 25 С в сосуд добавляют 3 М метилмагнийхлорид в ТГФ (80,46 кг). Смесь охлаждают до температуры 0-5 С и подвергают старению 30 мин. Исходный 7-кетон (1) (9,2 кг) суспендируют в ТГФ(50 л) и добавляют к суспензии реагента Гриньяра в течение более 75 мин, поддерживая температуру 20 С. Берут пробу смеси и завершение реакции подтверждают с помощью ЖХВР: определяют 8 0,1 А% (1). Реакционную смесь Гриньяра медленно добавляют к погашенному раствору, полученному добавлением толуола (70 кг) к раствору воды (146 л) и твердой лимонной кислоты(43,9 кг). Добавление осуществляют очень аккуратно, чтобы сохранить температуру 20 С. Реакционный сосуд и линии промывают ТГФ(10 кг) . Смесь перемешивают в течение 15 мин, затем дают ей отвердевать в течение 30 мин. Обе фазы разделяют по цилиндрам, и водный слой повторно экстрагируют 39 кг этилацетата (перемешивая в течение 10 мин, позволяя отстаиваться в течение 30 мин). Водный слой отделяют в цилиндры с отработанным материалом, и ТГФ слой объединяют со слоем этилацетата. К перемешиваемому раствору добавляют 20% раствор карбоната натрия (49.2 кг) в течение 15 мин, затем смеси дают отстояться в течение 30 мин и водную фазу отделяют в отходы. Слой смеси промывают 51,5 кг 20% раствора хлорида натрия (перемешивая в течение 10 мин, отстаиваемого в течение 30 мин) и водную фазу отделяют в отходы. Добавляют триэтиламин (4,8 кг), и раствор концентрируют в вакууме до около 100 л. Добавляют толуол и дистилляцию продолжают до тех пор, пока уровень ТГФ/этилацетата не снизится до 0,5% об.,что подтверждают ГХ. Конечный объем доводят вплоть до 275 л толуолом, и суспензию оставляют для использования в примере 2. Условия ЖХВР: КолонкаYMC J-Sphere ODS H80 250 х 4.6 мм вн. диаметр Элюент А АЦН Элюент В Вода, не содержащая буфера Градиент От 30 до 80% А за 25 мин; удержание в течение 5 мин Объем впрыскивания 20 мкл Определение УФ при 200 нм Поток 1,5 мл/мин Температура колонки 35 С Приготовление образца 100 х Разбавление ацетонитрилом; отработанные водные слои, разбавленные 50 х Соединение Триолы 7-Кетон Толуол ВНТ Условия ГХ: Покрытие Колонки Температура печи Температура впрыскивания Температура определения Приготовление образца Соединение МеОН ТГФ/EtOAc ТолуолChrompack график сконденсированной двуокиси кремния 25 м х 0,53 мм Полярный график Q 250 С Изотермальная 275 С 275 С 40 х Разбавление МеОН Относительный фактор чувствительности 1 1,5 К суспензии триола в толуоле (7.59 кг в 275 л) добавляют триэтиламин (3,8 кг) и изопропоксид алюминия (10 кг) с последующим добавлением 2-бутанона (100 кг). Смесь нагревают при температуре дефлегмации в течение 6 ч, слегка охлаждают, отбирают пробу и завершение реакции подтверждают ЖХВР (5%А 16 ОН диенона по отношению к 16-кетодиендиону). Смесь охлаждают до температуры 20 С, затем выстаивают в течение ночи. Смесь воды (62,5 л) и 12N соляной кислоты (73,7 кг) вносят в реакционную смесь. Реакционную смесь нагревают до температуры 5860 С и выстаивают в течение 4 ч. Берут пробу и исчезновение промежуточного 7-ОН енона подтверждают ЖХВР. Смесь охлаждают до температуры 20 С, дают ей отстояться в течение 15 мин и водную фазу отделяют в отходы. В слой толуола добавляют 2,5% раствор бикарбоната натрия (100 л), перемешивают в течение 15 мин, отстаивают в течение 30 мин и водную фазу отделяют в отходы. Данную процедуру повторяют с использованием 100 л воды. Органические фазы из двух смесей, полученных как описано выше, объединяют и концентрируют в вакууме до объема 100 л. В вакууме подают воду, затем дистилляцию продолжают при атмосферном давлении до тех пор,пока уровень димеров 2-бутанона в смеси не упадет до 3 А% по отношению к диендиону; общий объем дистиллироанной воды составляет 70 л. К остатку добавляют толуол (100 л), смесь перемешивают в течение 5 мин и затем отстаивают в течение 15 мин. Органический слой сохраняют. Возвращенную водную фазу экстрагируют толуолом (40 л). Органические слои объединяют и концентрируют в вакууме до конечного объема около 60 л. Раствор оставляют для использования в примере 3. Условия ЖХВР: КолонкаYMC J-Sphere ODS H80 250 х 4.6 мм вн. диаметр Элюент А АЦН Элюент В Вода, не содержащая буфера Градиент От 30 до 80% А за 25 мин; удержание в течение 5 мин Поток 1,5 мл/мин Объем впрыскивания 20 мкл Определение УФ при 200 нм для триолов, 240 нм для 7-ОН енона и удаления побочного продукта МЭК, 290 нм для исследований диенона Температура колонки 35 С Приготовление образца 100 х Разбавление ацетонитрилом; отработанные водные слои,разбавленные 25-50 х Соединение Время удержания 1 Триолы 4,6; 6,4 200 нм 7-ОН енон 6,6 240 нм Диендион 13,1 290 нм Толуол 16,4 200 нм ВНТ 29,5 200 нм(4) (11,69 кг экспериментально, 90,0% выход) в одной смеси. Енон не выделяют, но получают для использования в примере 4 в виде раствора в трет-бутаноле. В реакционный сосуд добавляют 10% Pd/C(5,32 кг, 51,5% влажности) с последующим добавлением раствора диендиона в толуоле, полученного в виде соединения примера 2 (12,9 кг в 70 л), этанола (38,1 л) и циклогексена (64,9 л). Смесь перемешивают и добавляют ДБУ (1,28 кг). Берут пробу и смесь нагревают до дефлегмации. Из реакционной смеси периодически берут пробы и нагревание продолжают (6 ч) до тех пор, пока уровень диендиона, измеряемый с помощью ЖХВР, не упадет ниже 1,0 мг/мл.(Так как в качестве побочного продукта реакции образуется бензол, при использовании местного экстрагирования при отборе проб необходима особая осторожность.) После охлаждения до температуры 25 С смесь фильтруют через 45 см пластинчатый фильтр, покрытый полипропиленовой тканью,картоном и диатомовой землей Solka Floc. (1.5 кг). Фильтр забивается после прохождения через него около 50% суспензии и его необходимо разобрать и установить вновь. Сосуд, линии и фильтр промывают толуолом (20 л) и объединенные фильтраты выстаивают в течение ночи. К фильтрату добавляют 1N соляную кислоту (44 л). Смесь перемешивают в течение 5 мин, отстаивают в течение 15 мин и нижнюю водную фазу отделяют в отходы. Данную процедуру промывания повторяют с использованием 5% раствора хлорида натрия(42 л). Органическую фазу концентрируют в вакууме до около 50 л, затем переносят в реакционный сосуд через 0.5 м хлопковый патронный фильтр и дистилляцию продолжают до около 22 л. Растворитель меняют на трет-бутанол. третБутанол (всего 144 кг) загружают и дистиллируют в вакууме (дистиллируется 30 л) до тех пор, пока не будет достигнут требуемый уровень удаления предыдущих растворителей (толуол 15 мг/мл, циклогексен, 0,05 мг/мл). Смесь(11,69 кг енона в 136,2 кг раствора) оставляют для использования в примере 4.(Так как трет-бутанол застывает при температуре 26 С, все цилиндры с чистым растворителем и реакционные растворы хранят на подогревающей подушке для поддержания температуры около 40 С). Условия ЖХВР: Колонка Элюент А Элюент В Градиент Поток Объем впрыскивания Определение Температура колонки Приготовление образца Соединение Бензол Толуол Циклогексен Диендион ЕнонZorbax SB Phenyl 250 х 4.6 мм вн. диаметр АЦН Водный раствор 0.1 об/об % Н 3 РO4 От 30 до 80% А за 25 мин; удержание в течение 5 мин 1,5 мл/мин 20 мкл УФ при 192 нм (бензол, циклогексен), 245 нм (енон) 295 нм (диенон) 35 С 100-1000 х Разбавление ацетонитрилом; отработанные водные слои,разбавленные 15-25 х (не линейность для диендиона, енона) Время удержания 7,7 10,0 10,9 13,9 14,9 Енон (4) (11,69 кг экспериментально) превращают в секокислоту (10.3 кг экспериментально) с 83% выходом в двух загрузках. Соединение не выделяют, но оставляют в виде раствора в этилацетате для использования в примере 5. Сначала готовят окисляющий раствор. Воду (150 л), периодат натрия (25.54 кг) и перманганат калия (0.47 кг) добавляют в реакционный сосуд, и смесь нагревают до температуры 65 С до тех пор, пока не растворятся все твердые вещества (около 30 мин). Раствор енона (4) (5,9 кг) в трет-бутаноле(70 кг) добавляют во второй реакционный сосуд и промывают трет-бутанолом (16 кг). К раствору енона добавляют раствор карбоната натрия(2.10 кг) в воде (80 л) и перемешивают при температуре 55 С. Добавляют окислитель в течение около 1 ч, сохраняя температуру 60 С. Смесь подвергают старению при температуре 60 С в течение 30 мин, затем берут пробу и исследуют на предмет нахождения в ней исходного соединения (0,07 мг/мл, 99% превращение) и затем нагревают до температуры 80 С в течение 30 мин для разложения избытка окислителя. Полученную коричневую суспензию охлаждают до температуры 12-15 С, подвергают старению 15 мин, затем фильтруют через 65 см фильтр,заполненный полипропиленовой тканью. Сосуд и фильтр промывают водным трет-бутанолом(вода 70 л, трет-бутанол 35 л). Фильтр задерживает неорганические твердые вещества, но некоторые мелкие частицы коричневого материала проходят через него. Жидкости возвращают в реакционный сосуд через 0,5 м хлопковый патронный фильтр,затем рН раствора измеряют на уровне 9. Па 12 тронный фильтр забивается мелкими коричневыми частицами неорганического твердого вещества и требует нескольких замен во время переноса жидкости. Если рН 9, ее следует довести до данного уровня добавлением раствора карбоната натрия. Добавляют гексан (30 кг). Смесь перемешивают в течение 15 мин, отстаивают в течение 15 мин, затем водный слой отделяют в цилиндры и слой гексана отделяют в отходы. Водную фазу возвращают в реакционный сосуд вместе с этилацетатом (41 кг), затем рН загрузки доводят до 1-2 добавлением раствора 12N соляной кислоты, поддерживая температуру 15-20 С. Смесь перемешивают в течение 15 мин, отстаивают в течение 30 мин и обе фазы отделяют в пластиковые стоящие в ряд цилиндры. Водную фазу возвращают в сосуд и экстрагируют этилацетатом (26 кг). Экстрагирование повторяют и затем все органические фазы объединяют в реакционном сосуде и промывают 10% солевым раствором (27 л). Водную фазу отделяют в отходы и органическую фазу помещают в цилиндры и исследуют. Условия ЖХВР: Колонка Элюент А Элюент В Градиент Поток Объем впрыскивания Определение Температура колонки Приготовление образца Соединение Уксусная кислота Этилацетат Секокислота Толуол ЕнонZorbax SB Phenyl 250 х 4.6 мм вн. диаметр. АЦН Водный раствор 0.1 об/об % Н 3 РO4 От 30 до 80% А за 25 мин; удержание в течение 7 мин 1,5 мл/мин 20 мкл УФ при 192 нм (секокислота),245 нм (енон) 35 С 100 х Разбавление ацетонитрилом; отработанная вода, слои гексана, разбавленные 15-25 х Время удержания 2,1 3,6 8,1 10,0 14,9 Секокислоту (9,8 кг) превращают в енелактам кетон (9,07 кг) в одной смеси. Продукт не выделяют, а вместо этого используют в примере 6 в виде раствора в толуоле. Раствор секокислоты (10,3 кг) в этилацетате (282 кг) добавляют в реакционный сосуд и концентрируют в вакууме до минимального перемешиваемого раствора около 35 л. Затем растворитель меняют на уксусную кислоту в вакууме. Добавляют всего 80 кг уксусной кислоты и 60 л дистиллируют для получения концентрации этилацетата 1 мг/мл в конечном объеме 76 л (концентрация секокислоты: 124,9 г/л). Часть данного раствора (4 л, содержащего 500 г секокислоты) удаляют для других исследований. Оставшийся раствор (9,8 кг в 72 л) разбавляют уксусной кислотой до полного объема 150 л, затем добавляют ВНТ (0,1 кг) и ацетат аммония (23,7 кг) через загрузочный люк и смесь нагревают до температуры дефлегмации. Уксусную кислоту (60 л) дистиллируют и затем дефлегмацию продолжают в течение 5 ч. Развитие реакции контролируют с помощью ЖХВР и реакцию считают завершенной, если концентрация секокислоты снижается до 0,5 мг/мл. Смесь охлаждают до температуры 20 С,затем добавляют толуол (100 л) и воду (100 л),раствор перемешивают в течение 20 мин, отстаивают в течение 20 мин и обе фазы разделяют в пластиковые стоящие в ряд цилиндры. Водную фазу возвращают в реакционный сосуд и экстрагируют толуолом (50 л). Органические фазы объединяют, промывают 5% водным раствором хлорида натрия (50 л) и исследуют (общий объем 160 л, 56,7 г/л при 98,5% выхода). Раствор концентрируют в вакууме с получением густой суспензии (37 л) енелактам кетона. Условия ЖХВР: Колонка Элюент А Элюент В Градиент Поток Объем впрыскивания Определение Температура колонки Приготовление образца Соединение Уксусная кислота Этилацетат Секокислота Толуол Енелактам кетон ВHТZorbax SB Phenyl 250 х 4,6 мм вн. диаметр. АЦН Водный раствор 0,1 об/об % Н 3 РO4 От 30 до 80% А за 20 мин; удержание в течение 15 мин 1,5 мл/мин 20 мкл УФ при 192 нм (секокислота),240 нм (енелактам) 35 С 100 х Разбавление ацетонитрилом; отработанные водные слои,разбавленные 25 х Время удержания 2,1 3,5 8,5 9,4 9,9 17,1 14 бавляют еще L-селектрид (3,4 кг) и затем выстаивают в течение 40 мин при температуре 0 С и берут пробу. ЖХВР анализ показал, что еще остается 9,9 моль%. Реакцию гасят добавлением 20% водного раствора гидроксида натрия (37,4 кг), сохраняя температуру 20 С с последующим добавлением перекиси водорода (19,8 кг) при температуре 30 С. Смесь перемешивают при температуре 15-20 С в течение 1 ч, затем подтверждают наличие избытка перекиси с помощью тестовой полоски Merckoquant (E. Merck). Скорость продувания азотом повышают до 15 л/мин во время добавления перекиси водорода. Добавляют 10% водный раствор сульфита натрия (129 кг) и смесь выстаивают в течение 15 мин. Отсутствие перекиси подтверждают и затем смесь отстаивают в течение 15 мин и водную фазу отделяют в отходы. Добавляют 10% водный раствор хлорида натрия (58 кг), смесь перемешивают в течение 5 мин, отстаивают в течение 15 мин и водную фазу отделяют в отходы. Повторяют промывание насыщенным солевым раствором. Органическую фазу (128.3 кг) переносят в другой реакционный сосуд через 0,5 м хлопковый патронный фильтр. Смесь концентрируют до около 40 л при атмосферном давлении, затем растворитель заменяют на ацетонитрил. Загружают всего 200 кг ацетонитрила и смесь дистиллируют до конечного объема 65 л. Берут образец и измеряют уровень толуола (спец. 200 мг/мл, измерено 0,7 мг/мл) и KF (спец. 400 мг/л,измерено 73 мг/л). Смесь медленно охлаждают до комнатной температуры в течение ночи при мягком перемешивании, и затем охлаждают до температуры 5 С в течение 1 ч и выстаивают в течение 30 мин. Твердое вещество собирают на 33 см фильтр из нержавеющей стали, промывают ацетонитрилом, затем сушат при температуре окружающей среды в вакууме в течение ночи. Твердое вещество собирают. Условия ЖХВР: Колонка Элюент А Элюент В Градиент Поток Объем впрыскивания Определение Суспензию енелактам кетона (9.07 кг) в толуоле (35 л) в реакционном сосуде разбавляют ТГФ (89 кг) и охлаждают до температуры(34.5 кг 1 М раствора) в течение 1 ч, поддерживая температуру между -5 С и 0 С. Смесь выстаивают (проводят старение) при температуре 0 С в течение 20 мин, затем берут пробу. ЖХВР анализ показал, что еще остается 11,7 моль%. До Температура колонки Приготовление образца Соединение Енелактамовый 16 спирт Толуол Енелактам кетон ВНТZorbax SB Phenyl 250 х 4.6 мм вн. диаметр. АЦН Водный раствор 0.1 об/об % Н 3 РO4 от 30 до 80% А за 20 мин; удержание в течение 15 мин 1,5 мл/мин 20 мкл УФ при 240 нм (енелактам кетон,енелактамовый спирт) и 200 нм Енелактамовый спирт (750 г) растворяют в смеси ИС (10 л) и воды (1,6 л) нагреванием до температуры 30-40 С в 20 л колбе. Добавляют ВНТ (3 г) и 50% влажности 10% Pd/C (375 г) и смесь загружают с помощью вакуума через загрузочный рукав в 20 л автоклав и затем промывают ИС (1 л). Суспензию перемешивают в атмосфере водорода (4,219 кг/см 2 (60 psig), при температуре 50 С в течение 6 ч, затем при температуре 68 С в течение 16 ч. Берут пробу смеси через загрузочный рукав и проверяют завершение реакции с помощью ЖХВР (спец. 0,05 А% исходного материала). Если конечный показатель еще не достигнут, перемешивание в атмосфере водорода продолжают. Гидрирование проводят при температуре 50 С для первых нескольких периодов полупревращения и затем нагревают до температуры 68 С. Достижение конечного показателя спецификации реакции очень важно, так как енелактамовый спирт проникает в конечный продукт. Смесь охлаждают до температуры 30-40 С,несколько раз промывают азотом, затем переносят из автоклава и фильтруют через Solka Flok(1 кг). Автоклав и фильтр промывают 1:10 водой/ИС (2 л) и хранят объединенные фильтраты. Описанную выше процедуру повторяют 10 раз и 10 смесей фильтрата объединяют и концентрируют при атмосферном давлении до объема около 25 л. После охлаждения до комнатной температуры добавляют воду (42 л) в течение 45 мин и смесь охлаждают до температуры 5 С и выстаивают в течение 1 ч. Твердое вещество собирают на 33 см фильтр, наполненный полипропиленовой тканью, и затем промывают 4:1 водой/ИС (10 л). Сырое твердое вещество переносят на тарелки и сушат в вакууме при температуре 35 С в течение ночи с получением лактамового спирта (8). Пример 8. Получение арил-NН-лактама (9)(4,74 кг). Смесь выстаивают при температуре 20 С в течение 20 мин. Одной порцией добавляют 4-фтортолуол (2,21 кг). Суспензию нагревают до температуры 140 С до тех пор, пока в ней не останется менее чем 0,5 А% исходного соединения, что показывает ЖХВР анализ. Приготовление образца 100 мкл разбавляют АЦН до 10 мл Поток Объем впрыскивания Определение Температура колонки Время удержания:YMC J-sphere ODS 80H 4.6 мм х 25 см СН 3 СN Водный раствор 0,1 М Н 3 РO4 От 50 до 80% А более чем за 7 мин; удержание в течение 33 мин 1,2 мл/мин-1 20 мкл УФ при 200 нм 20 С Реакционную смесь охлаждают до температуры 20 С и добавляют воду (46.5 л) в течение 1 ч, сохраняя температуру 20-30 С. Суспензию перемешивают при температуре 20 С в течение 1 ч. Суспензию фильтруют, промывают вoдой(3.3 кг) в ТГФ (66 л) при температуре -5 С добавляют ТМЭДА (3,76 л) и ХТМСИ (2.64 л). Белую суспензию перемешивают при температуре -5 С в течение 15 мин. К суспензии добавляют йод(4.24 кг) тремя порциями в течение 20 мин. Условия ЖХВР для реакции: Колонка Элюент А Элюент В Градиент Объем впрыскивания Определение Температура колонкиZorbax SB Phenyl 4,6 мм х 25 см СН 3 СN Водный раствор 0,1 М Н 3 РO4 70% А, 30% В 20 мкл УФ при 200 нм 20 С Реакционную смесь перемешивают при температуре 0 С в течение 3 ч до тех пор, пока лактама SM не станет меньше чем 0,1 А% по отношению к соединению (200 нм). Реакционную смесь охлаждают до температуры -10 С и к ней добавляют холодный (5 С) свежеприготовленный раствор сульфита натрия в воде (1,65 кг в 33 л) в течение более 20 мин, сохраняя температуру гашения 5 С. Наблюдается изменение цвета от темнокоричневого до бледно-желтого. Смесь затравливают йодидом (10 г) и добавляют воду (66 л) в течение более 1 ч при 17 температуре 5 С. Полученную суспензию выстаивают при температуре 5 С в течение 1 ч. Суспензию фильтруют, промывают водой(33 л) и сушат в потоке азота на воронке с фильтром в течение ночи с получением чистого соединения (10). Пример 10. Получение 4-аза-7-метил-16(4-метилфенокси)-5-андрост-1-ен-3-она (11). К раствору трет-бутоксида калия (6,8 кг) в сухом ДМФ (19,8 л) при температуре -15 С в атмосфере азота добавляют суспензию йодлактама (3,95 кг) в сухом ТГФ (19.8 л) в течение более 1 ч. ТГФ (1 л) используют для промывки сосуда и линий. Температуру реакции поддерживают на уровне от -15 С до -10 С во время добавления. Через 15 мин выстаивания берут образец для анализа с помощью ЖХВР. Условия ЖХВР: Колонка Элюент А Элюент В Градиент Объем впрыскивания Определение Температура колонкиZorbax SB Phenyl 4,6 мм х 25 см СН 3 СN Водный раствор 0,1 М Н 3 РO4 70% А, 30% В 20 мкл УФ при 200 нм 20 С Добавляют воду (45 л) в течение более 20 мин, сохраняя температуру 10 С. Полученную суспензию выстаивают при температуре 5 С в течение 2 ч. Суспензию фильтруют и промывают водой (15 л). Лепешку сушат на воздухе до 15 мас.% воды. Влажную лепешку растворяют в ТГФ (30 л) при комнатной температуре и фильтруют через 5 микрон проходной фильтр в 50 л сосуд. Стеклянную посуду и линию промывают ТГФ (1 л). Фильтраты концентрируют при пониженном давлении до около 10 л. Добавляют N-бутилацетат (20 л) и концентрированно продолжают при атмосферном давлении до конечного объема около 10 л. Горячий (120 С) раствор охлаждают до температуры 80 С и затравливают соединение(11) (2 г). Полученную суспензию выстаивают при температуре 80 С в течение 30 мин, затем охлаждают до температуры -5 С в течение 2 ч. Суспензию фильтруют и лепешку промывают холодным н-бутилацетатом (1 л) и сушат в потоке азота в течение ночи. Пример 11. Согласно методикам, описанным в примерах 1-10, получают следующие соединения структурной формулы, представленной ниже: Хотя представленное выше описание раскрывает принципы данного изобретения, а примеры даны с целью иллюстрации, понятно, что практика данного изобретения охватывает все обычные вариации, адаптации и модификации,которые входят в область формулы изобретения и ее эквиваленты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения структурной формулы (II) где Аr является незамещенным или моно- или дизамещенным фенилом, нафтилом или 5-, 6 или 7-членным гетероароматическим кольцом,содержащим, по крайней мере, один члeн, выбранный из группы, состоящей из одного атома кислорода в кольце, одного атома серы в кольце, 1-4 атомов азота в кольце, или их сочетания; где гетероароматическое кольцо может также быть сконденсировано с одним бензо или гетероароматическим кольцом; обработкой соединения структурной формулы трет-бутоксидом калия и выделением полученного соединения (11). 2. Способ по п.1, дополнительно включающий стадию получения соединения структурной формулы (10) обработкой соединения структурной формулы триметилсилилхлоридом в присутствии органического основания, добавлением йода и выделением полученного соединения (10). 3. Способ по п.2, дополнительно включающий стадию получения соединения структурной формулы (9) обработкой соединения структурной формулы ацетатом аммония в кипящей уксусной кислоте с обратным холодильником и выделением полученного соединения (6). 7. Способ по п.6, дополнительно включающий стадию получения соединения структурной формулы (5) трет-бутоксидом калия, добавлением Ar-F и выделением полученного соединения (9). 4. Способ по п.3, дополнительно включающий стадию получения соединения структурной формулы (8) обработкой соединения структурной формулы гидрированием соединения структурной формулы (7) периодатом натрия и каталитическим перманганатом калия и карбонатом натрия и выделением полученного соединения (5). 8. Способ по п.7, дополнительно включающий стадию получения соединения структурной формулы (4) и выделением полученного соединения (8). 5. Способ по п.4, дополнительно включающий стадию получения соединения структурной формулы (7) обработкой соединения структурной формулы три-втор-бутилборгидридом лития с последующим окислением и выделением полученного соединения (7). 6. Способ по п.5, дополнительно включающий стадию получения соединения структурной формулы (6) обработкой соединения структурной формулы обработкой соединения структурной формулы 10% Pd/C, циклогексеном и этанолом в органическом растворителе и выделением полученного соединения (4). 9. Способ по п.8 дополнительно включающий стадию получения соединения структурной формулы (3) обработкой соединения структурной формулы изопропоксидом алюминия и 2-бутаноном в присутствии органического основания в органическом растворителе с последующим добавлением водного раствора кислоты, нейтрализацией водным основанием и выделением соеди 21 нения (3) в виде раствора в органическом растворителе. 10. Способ по п.9, дополнительно включающий стадию получения соединения структурной формулы (2) обработкой соединения структурной формулы метилмагнийхлоридом в присутствии хлорида церия в органическом растворителе. 11. Способ по п.1, в котором Аr выбран из незамещенного или моно- или дизамещенного фенила, нафтила, пиридила, фурила, пирролила,тиенила, изотиазолила, имидазолила, бензимидазолила, тетразолила, пиразинила, пиримидила, хинолила, изохинолила, бензофурила, изобензофурила, бензотиенила, пиразолила, индолила, изоиндолила, пуринила, карбазолила, изоксазолила, тиазолила, оксазолила, бензтиазолила и бензоксазолила. 12. Способ по п.11, дополнительно включающий стадию получения соединения структурной формулы (10) обработкой соединения структурной формулы триметилсилилхлоридом в присутствии органического основания, добавлением йода и выделением полученного соединения (10). 13. Способ по п.12, дополнительно включающий стадию получения соединения структурной формулы (9) обработкой соединения структурной формулы 22 трет-бутоксидом калия, добавлением Ar-F и выделением полученного соединения (9). 14. Способ получения соединения структурной формулы (11) где Аr является незамещенным или моно- или дизамещенным фенилом, нафтилом или 5-,6 или 7- членным гетероароматическим кольцом,содержащим, по крайней мере, один атом, выбранный из группы, состоящей из одного атома кислорода в кольце, одного атома серы в кольце, 1-4 атомов азота в кольце, или их сочетания; где гетероароматическое кольцо может также быть сконденсировано с одним бензо или гетероароматическим кольцом; включающий(а) обработку соединения структурной формулы (1) метилмагнийхлоридом в присутствии хлорида церия в органическом растворителе с получением соединения (2)(b) обработку соединения структурной формулы (2) изопропоксидом алюминия и 2 бутаноном в присутствии органического основания в органическом растворителе с последующим добавлением водного раствора кислоты к раствору, нейтрализацией водным основанием и выделением соединения (3) в виде раствора в органическом растворителе(с) обработку соединения структурной формулы (3) 10% Pd/C, циклогексеном и этанолом в органическом растворителе и выделение полученного соединения (4)(d) обработку соединения структурной формулы (4) периодатом натрия и каталитическим перманганатом калия и карбонатом натрия и выделение полученного соединения (5)(е) обработку соединения структурной формулы (5) ацетатом аммония в кипящей уксусной кислоте с обратным холодильником и выделение полученного соединения (6)(f) обработку соединения структурной формулы (6) три-втор-бутилборгидридом лития с последующим окислением и выделение полученного соединения (7)(g) гидрирование соединения структурной формулы (7) и выделение полученного соединения(8)(h) обработку соединения структурной формулы (8) трет-бутоксидом калия с добавлением Ar-F и выделение полученного соединения где R1 представляет атом водорода и R2 выбран из гидроксигруппы или группы O-Аr,или R1 и R2, взятые вместе, образуют оксогруппу,"а" означает простую связь и присутствует Н,или "а" означает двойную связь и тогда Н отсутствует,Х означает водород или йод. 17. Соединение по п.16, представленное формулой(i) обработку соединения структурной формулы (9) триметилсилилхлоридом в присутствии органического основания, добавление йода и выделение полученного соединения (10) 21. Соединение общей формулы(j) обработку соединения структурной формулы (10) трет-бутоксидом калия и выделение полученного соединения (11). 15. Способ по п.14, в котором Аr является 4-метилфенилом. 16. Соединение общей структурной формулы (II)
МПК / Метки
МПК: C07J 73/00, C07C 59/205
Метки: аза-5, продукты, андрост, промежуточные, альфа, 16-замещенных, ен-3-онов, способ, осуществления, получения
Код ссылки
<a href="https://eas.patents.su/14-2333-sposob-polucheniya-16-zameshhennyh-4-aza-5-alfa-androst-1-en-3-onov-i-promezhutochnye-produkty-dlya-ego-osushhestvleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 16-замещенных 4 -аза-5 альфа – андрост -1- ен-3-онов и промежуточные продукты для его осуществления</a>
Предыдущий патент: Ловушка для насекомых
Следующий патент: Устройство для раздачи жидкости под давлением
Случайный патент: Распорный профиль для изоляционных стеклопакетов