Промежуточные соединения для получения 2-имидазолин-5-онов
Формула / Реферат
1. Соединение 2-тиотиазолидин-5-он общей формулы (I)
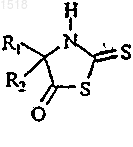
в которой
R1 означает (C1-С3)-алкильный pадикал или фенильный радикал;
R2 означает арильную группу, выбираемую из фенила или пиридила, возможно замещенного 1-3 группами, выбираемыми из атома галогена, нитрогруппы, цианогруппы, (C1-С3)-алкильного радикала, (C1-С3)-алкоксильного радикала;
а также его соли, его стереоизомеры, в частности, если радикалы R1 и R2 являются разными, оптические изомеры, образующиеся вследствие наличия асимметрического атома углерода, несущего радикалы R1 и R2;
за исключением 4-этил-4-фенил-2-тиотиазолидин-5-она.
2. Соединение по п.1, отличающееся тем, что
R1 означает (C1-С3)-алкильный радикал;
R2 означает фенил, возможно замещенный атомом галогена, цианогруппой, нитрогруппой, метильным радикалом или метоксигруппой.
3. Соединение по любому из пп.1 или 2, отличающееся тем, что R2 означает фенил и R1 означает метил.
4. Соединение по любому из пп.1-3, отличающееся тем, что оно является энантиомером по отношению к асимметрическому атому углерода, несущему R1 и R2.
5. Способ получения соединения формулы (I), описанного в любом из пп.1-4, отличающийся тем, что соединение формулы (II) вводят во взаимодействие с сероуглеродом в растворителе или смеси растворителей, при температуре от 0шС до +50шС согласно следующей схеме
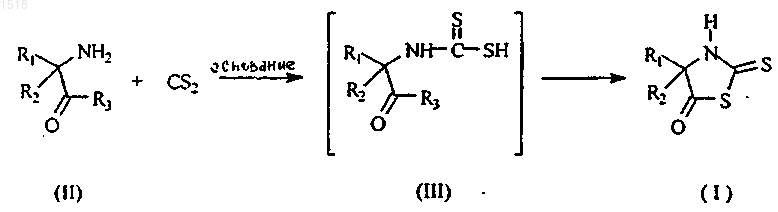
где R3 означает аминогруппу, гидроксил или линейный или разветвленный алкоксильный радикал, срдержащий 1-6 атомов углерода, предпочтительно 1-3 атома углерода, или бензилокси-радикал, возможно замещенный атомом галогена.
6. Способ по п.5, отличающийся тем, что его осуществляют при температуре 20-40шС при необходимости в присутствии основания.
7. Способ получения соединений формулы (VI)

в которой
R1 означает (C1-С3) -алкильный радикал или фенильный радикал;
R2 означает арильную группу, выбираемую из фенила или пиридила, возможно замещенного 1-3 группами, выбираемыми из атома галогена, нитрогруппы, цианогруппы, (C1-С3)-алкильного радикала, (C1-С3)-алкоксильного радикала;
R4 означает атом водорода или ацильный радикал;
R5 означает арильный или гегероарильный радикал, выбираемый из фенила, нафтила, пиридинила, пиримидинила, пиридазинила, пиразинила, тиенила, бензотиенила, фурила, бензофурила, хинолинила, изохинолинила или метилендиоксифенила, причем каждый из этих радикалов не замещен или замещен 1-7 одинаковыми или разными группами, предпочтительно 1-3 группами, выбираемыми из значений радикала R51, который означает:
- атом галогена; или
- линейный или разветвленный алкильный, галогеналкильный, алкоксильный, галогеналкоксильный, алкилтио-, галогеналкилтио- или алкилсульфонильный радикал c 1-6 атомами углерода; или
- циклоалкильный, галогенциклоалкильный, алкенилокси-, алкинилокси-, алкенилтио-, алкинилтио-радикал с 3-6 атомами углерода; или
- нитрогруппу или цианогруппу; или
- аминогруппу, незамещенную или моно- или дизамещенную алкильным или ацильным радикалом c l-6 атомами углерода или алкоксикарбонильным радикалом с 2-6 атомами углерода,
его солей и стереоизомеров,
отличающийся тем, что соединение формулы (I), описанной в одном из пп.1-4, вводят во взаимодействие с соединением формулы (V) в растворителе и при температуре от +20шС до +100шС, предпочтительно при 40-80шС, согласно схеме
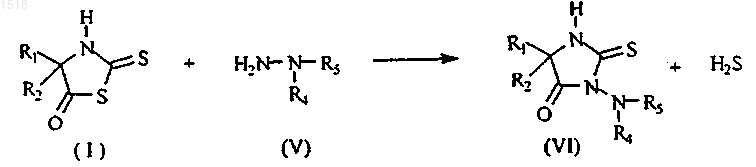
8. Способ по п.7, отличающийся тем, что его осуществляют в присутствии катализатора, выбираемого из третичного амина, такого как триэтиламин или трибутиламин, (или органической соли этого амина, такой как трибутиламинацетат), причем вышеуказанный катализатор находится в соотношении катализатор/соединение формулы (I) от 0,05 до 1, предпочтительно от 0,1 до 0,5.
Текст
1 Настоящее изобретение относится к новым продуктам, используемым в качестве промежуточных соединений для получения 2 имидазолин-5-онов, применяемых в качестве фунгицидов. Оно также относится к способам получения указанных новых продуктов, а также к способу получения 2-имидазолин-5-онов из новых промежуточных соединений. 2-Имидазолин-5-оны, применяемые в качестве фунгицидов, известны, в частности, из заявок на европейские патенты 551048,599749, 629616 и международной заявки 93/24467. Целью настоящего изобретения является получение новых промежуточных соединений,позволяющих синтезировать указанные 2 имидазолин-5-оны. Другой целью настоящего изобретения является разработка нового, более усовершенствованного способа получения фунгицидно активных 2-имидазолин-5-онов. Таким образом, первым объектом изобретения являются 2-тиотиазолидин-5-оны общей формулы (I)R1 означает (C1-С 3)-алкильный радикал или фенильный радикал;R2 означает арильную группу, выбираемую из фенила или пиридила, возможно замещенную 1-3 группами, выбираемыми из атома галогена,нитрогруппы, цианогруппы, (C1-С 3)-алкильного радикала, (C1-С 3)-алкоксильного радикала; за исключением 4-этил-4-фенил-2-тиотиазолидин-5-она, описанного в Tetrahedron Letters,16, 1351-1354 (1977). Изобретение также относится к солям и стереоизомерам соединений формулы (I). Изобретение относится, в частности, к оптическим изомерам, получающимся вследствие присутствия асимметрического атома углерода и, в частности, когда радикалы R1 и R2 являются разными, причем оптические изомеры образуются за счет наличия асимметрического атома углерода,несущего радикалы R1 и R2. Эти оптические изомеры являются оптически чистыми или сильно обогащенными одним энантиомером. В нижеследующем тексте описания под сильно обогащенным одним энантиомером понимают соединение, содержащее, по крайней мере, 80%,предпочтительно, по крайней мере, 90%, этого энантиомера. Все эти соединения рассматриваются как подпадающие под вышеуказанную формулу (I). Из соединений формулы (I) предпочтительными являются таковые, в которыхR2 означает фенил, возможно замещенный атомом галогена, цианогруппой, нитрогруппой,метильным радикалом или метоксигруппой. Из соединений формулы (I) предпочтительны, в частности, такие соединения, в которых R2 означает фенил и R1 означает метил. Наиболее предпочтительным является соединение формулы (I), в которой R1 означает метил и R2 означает фенил, представляющие собой энантиомер по отношению к асимметрическому атому углерода, несущему радикалы R1 и R2. В настоящем описании все группы, содержащиеся в нижеследующих химических формулах, а также группы, указанные выше в общей формуле (I), сохраняют одно и то же значение,если только не указано ничего другого. Указанные в настоящем тексте радикалы могут быть линейными или разветвленными. Ниже описывается способ получения соединения формулы (I). Этот способ получения указан для соединений, которые являются рацемическими по отношению к атому углерода,несущему радикалы R1 и R2. Однако специалист может использовать те же самые реакции, если надо получить соединение формулы (I), энантиомерное по отношению к атому углерода,несущему радикалы R1 и R2. В самом деле, нижеприводимые реакции обладают высокой стереоселективностью, поскольку они не вызывают модификации абсолютной конфигурации этого же атома углерода. Соединение формулы (I) может быть получено путем введения во взаимодействие соединения формулы (II) с сероуглеродом, в растворителе или смеси растворителей, в случае необходимости, в присутствии основания, при температуре от 0 С до +50 С, согласно следующей схеме где R3 означает аминогруппу, гидроксил или линейный или разветвленный алкоксильный радикал, содержащий 1-6 атомов углерода,предпочтительно 1-3 атома углерода, или бензилокси-радикал, возможно замещенный атомом галогена. Используемым, в случае необходимости,основанием может быть неорганическое основание, такое, как гидроксид или карбонат щелочного или щелочно-земельного металла, или органическое основание, такое, как первичный,вторичный или третичный амин. Оно может быть использовано в соотношении (выраженном в виде числа молей) основание/соединение формулы (II), составляющем от 0,05 до 1,2,предпочтительно от 0,1 до 1. Согласно этой схеме соединение формулы(III) может быть выделено в качестве промежу 3 точного соединения в виде соли в том случае,если используют основание. В качестве растворителя можно использовать воду, простые эфиры, простые циклические эфиры, сложные алкиловые эфиры, диполярные растворители, как ацетонитрил, спирты с 1-4 атомами углерода, ароматические растворители,предпочтительно толуол, дихлорметан или хлороформ, сероуглерод. В качестве смеси растворителей можно использовать смесь из одного или нескольких спиртов с одним или несколькими вышеуказанными растворителями. Когда R3 означает гидроксильную группу,предпочтительным является использование воды в качестве растворителя. Когда R3 имеет другое значение, чем гидроксильная группа, предпочитают использовать смесь спирта с водой в качестве растворителя. В случае, когда выделяют соединение формулы (III), его можно прямо превращать в соединение формулы (I) путем нагревания при температуре от 25 С до температуры кипения с обратным холодильником используемого растворителя. Превращение промежуточного соединения формулы (III) в соединение формулы(I) также можно осуществлять путем обработки сильной кислотой, которая является либо неорганической кислотой, такой, как соляная или серная кислота, либо органической кислотой,такой, как трифторуксусная кислота. Этот способ предпочтительно осуществляют в отсутствие основания или при температуре 20-40 С. В этом случае соединение формулы (III) не выделяют. Другие виды методик, позволяющих получать соединение формулы (I), исходя из соединения формулы (II), описываются А.С. Davis и(1952). Сложный -аминоэфир формулы (II), в которой R3 означает алкоксильный радикал, может быть получен путем этерификации соответствующих -аминокислот согласно способу,аналогичному таковому, описанному М. Brenner и W. Huber в Helv. Chim. Acta, 36, 1109-1115-Аминоамид формулы (II), в которой R3 означает аминогруппу, может быть получен из сложного аминоэфира путем воздействия аммиака, как описывается J.A. Garbarino в Ann.-Аминокислоты получают путем известных реакций и методов. Если соединение формулы (II) представляет собой энантиомер сложного аминоэфира, его можно получить, в частности- диастереоселективным аминированием прохирального соединения с последующим удалением защитной группы от полученного хи 001518- расщеплением соответствующего рацемата с помощью хирального соединения, как описывается Y. Sugi и S. Mitsui, Bull. Chem. Soc.- путем этерификации хиральной аминокислоты, как описывается D.J. Cram и др., J.Am. Chem. Soc., 83, 2183-2189 (1961). Если соединение формулы (II) представляет собой энантиомер аминоамида, оно может быть получено либо исходя из хирального сложного аминоэфира, либо путем расщепления соответствующего рацемата, как сообщается Н.(1970). 2-Тиотиазолидин-5-оны формулы (I) пригодны для получения фунгицидно активных 2 имидазолин-5-онов формулы (IV) в которой М означает атом кислорода или серы;R30 означает линейный или разветвленный алкильный радикал с 1-6 атомами углерода или линейный или разветвленный галогеналкильный радикал с 1-6 атомами углерода;R4 означает атом водорода или ацильный радикал;R5 означает арильный или гетероарильный радикал, выбираемый среди фенила, нафтила,пиридинила, пиримидинила, пиридазинила, пиразинила, тиенила, бензотиенила, фурила, бензофурила, хинолинила, изохинолинила или метилендиоксифенила, причем каждый из этих радикалов не замещен или замещен 1-7 одинаковыми или разными группами, предпочтительно 1-3 группами, выбираемыми из значений радикала R51, который означает- линейный или разветвленный алкильный,галогеналкильный, алкоксильный, галогеналкоксильный, алкилтио-, галогеналкилтио-или алкилсульфонильный радикал с 1-6 атомами углерода, или- аминогруппу, незамещенную или моноили дизамещенную алкильным или ацильным радикалом с 1-6 атомами углерода или алкоксикарбонильным радикалом с 2-6 атомами углерода; а также их солей, приемлемых в сельском хозяйстве, и их стереоизомеров, в частности,когда R1 и R2 являются разными, оптических 5 изомеров, образующихся за счет наличия ассиметрического атома углерода, несущего радикалы R1 и R2. Ниже описывается получение фунгицидно активных соединений фор.мулы (IV) из 2 тиотиазолидин-5-онов формулы (I) согласно способу, который может использоваться как для получения рацематов, так и энантиомеров. Согласно этому способу соединение формулы (I) вводят во взаимодействие с соединением формулы (V) в растворителе и при температуре от +20 С до +100 С, предпочтительно при 40-80 С, согласно следующей схеме В качестве растворителя можно использовать простой эфир, например, диоксан, апротонныи диполярный растворитель, в частности,N-метилпирролидон, диметилформамид, диметилсульфоксид или ацетонитрил; спирт с 1-4 атомами углерода, например, метанол; ароматический растворитель, например, пиридин или монохлорбензол. Эту реакцию предпочтительно осуществляют при использовании катализатора, выбираемого из третичного амина, такого, как триэтиламин или трибутиламин, или органической соли этого амина, такой, как трибутиламинацетат. Этот катализатор находится в соотношении катализатор/соединение формулы (I) (выраженном в виде числа молей) от 0,05 до 1, предпочтительно от 0,1 до 0,5. В этом случае достигают улучшенной чистоты. Тиогидантоин формулы (VI) превращают в 2-имидазолин-5-он формулы (IV) согласно способу, описанному в одной из заявок на европейские патенты 551048, 599749 или 629616. Нижеследующие примеры даны для иллюстрации как соединений так и способов получения, согласно изобретению. Они никоим образом не ограничивают объема настоящего изобретения. Структуру полученного производного устанавливают с помощью, по крайней мере,одного из следующих спектральных методов: протонная ЯМР-спектрометрия, ЯМР-спектрометрия углерода-13, инфракрасная спектрометрия и масс-спектрометрия, а также методов,используемых для определения вращательных способностей. Пример 1. Получение (4S)-4-метил-4 фенил-2-тиотиазолидин-5-она из аминоамида. В колбу емкостью 50 мл, снабженную механической мешалкой, вводят 3,26 г (20 ммоль)(2S)-2-амино-2-фенилпропионамида, 6 мл (100 ммоль) сероуглерода и 4 мл ацетонитрила. Гетерогенную среду выдерживают в течение 20 ч при перемешивании при температуре 20 С. После отгонки в вакууме избытка сероуглерода и ацетонитрила и после очистки и отфильтровывания получают 3,70 г (соответствует выходу 83%) (4S)-4-метил-4-фенил-2-тиотиазолидин-5 001518 6 она в виде твердого вещества белого цвета, плавящегося при температуре 104 С. Пример 2. Получение (4S)-4-метил-4 фенил-2-тиотиазолидин-5-она из сложного аминоэфира. В пробирку емкостью 25 мл, снабженную магнитной мешалкой, вводят 2 г (11,1 ммоль) метилового эфира(2S)-2-амино-2-фенилпропионовой кислоты, 15 мл тетрагидрофурана,1,82 мл (13 ммоль) триэтиламина и 0,78 мл (13 ммоль) сероуглерода. После герметического закрытия, пробирку выдерживают при температуре 45 С и гомогенную среду перемешивают в течение 4 ч при этой температуре. После охлаждения и очистки получают 2 г (или выход составляет 80%) (4S)-4-метил-4-фенил-2-тиотиазолидин-5-она в виде порошка белого цвета. Пример 3. Получение (4S)-4-метил-4 фенил-1-фениламино-2-тиогидантоина. В колбу емкостью 25 мл, снабженную магнитной мешалкой, вводят 893 мг (4 ммоль) (4S)4-метил-4-фенил-2-тиотиазолидин-5-она, 8 мл ацетонитрила и 100 мкл (0,4 ммоль) трибутиламина. Смесь нагревают до температуры 70 С,затем в течение двух часов приливают раствор 520 мг (4,8 ммоль) фенилгидразина в 4,5 мл ацетонитрила. Реакционную среду нагревают при температуре 80 С в течение 6 ч. После охлаждения ацетонитрил удаляют путем отгонки при пониженном давлении. После очистки получают 975 мг (или выход составляет 82%) (4S)-4 метил-4-фенил-1-фениламино-2-тиогидантоина в виде твердого вещества белого цвета, плавящегося при температуре 167 С, чистота которого, определенная путем высокоэффективной жидкостной хроматографии, составляет 100%. Пример 4. Получение (4S)-4-метил-4 фенил-2-тиотиазолидин-5-она из 2(S)-2-амино 2-фенилпропионовой кислоты. В колбу емкостью 50 мл, снабженную магнитной мешалкой, последовательно вводят 11 г(10-2 моль) (2S)-2-амино-2-фенилпропионовой кислоты (в виде смеси 15 мас.% аминокислоты в твердом хлориде натрия), 10 мл Nметилпирролидона, 0,8 г (210-2 моль) гидроксида натрия в таблетках, затем 1,8 мл (310-2 моль) сероуглерода. После герметического закрытия,реакционную среду нагревают при температуре 60 С в течение 5 ч при интенсивном перемешивании. После охлаждения к реакционной смеси добавляют 50 мл воды, затем 5,4 мл концентрированной серной кислоты. Органическую фазу отделяют, промывают, сушат, затем концентрируют. Получают (4S)-4-метил-4-фенил-2-тиотиазолидин-5-он с выходом 84%.R2 означает арильную группу, выбираемую из фенила или пиридила, возможно замещенного 1-3 группами, выбираемыми из атома галогена,нитрогруппы,цианогруппы,(C1-С 3)алкильного радикала, (C1-С 3)-алкоксильного радикала; а также его соли, его стереоизомеры, в частности, если радикалы R1 и R2 являются разными, оптические изомеры, образующиеся вследствие наличия асимметрического атома углерода, несущего радикалы R1 и R2; за исключением 4-этил-4-фенил-2 тиотиазолидин-5-она. 2. Соединение по п.1, отличающееся тем,чтоR2 означает фенил, возможно замещенный атомом галогена, цианогруппой, нитрогруппой,метильным радикалом или метоксигруппой. 3. Соединение по любому из пп.1 или 2,отличающееся тем, что R2 означает фенил и R1 означает метил. 4. Соединение по любому из пп.1-3, отличающееся тем, что оно является энантиомером по отношению к асимметрическому атому углерода, несущему R1 и R2. 5. Способ получения соединения формулы(I), описанного в любом из пп.1-4, отличающийся тем, что соединение формулы (II) вводят во взаимодействие с сероуглеродом в растворителе или смеси растворителей при температуре от 0 С до +50 С согласно следующей схеме где R3 означает аминогруппу, гидроксил или линейный или разветвленный алкоксильный радикал, содержащий 1-6 атомов углерода,предпочтительно 1-3 атома углерода, или бензилокси-радикал, возможно замещенный атомом галогена. 6. Способ по п.5, отличающийся тем, что его осуществляют при температуре 20-40 С при необходимости в присутствии основания. 7. Способ получения соединений формулыR1 означает (C1-С 3) -алкильный радикал или фенильный радикал;R2 означает арильную группу, выбираемую из фенила или пиридила, возможно замещенного 1-3 группами, выбираемыми из атома галогена,нитрогруппы,цианогруппы,(C1-С 3)алкильного радикала, (C1-С 3)-алкоксильного радикала;R4 означает атом водорода или ацильный радикал;R5 означает арильный или гегероарильный радикал, выбираемый из фенила, нафтила, пиридинила, пиримидинила, пиридазинила, пиразинила, тиенила, бензотиенила, фурила, бензофурила, хинолинила, изохинолинила или метилендиоксифенила, причем каждый из этих радикалов не замещен или замещен 1-7 одинаковыми или разными группами, предпочтительно 1-3 группами, выбираемыми из значений радикала R51, который означает- линейный или разветвленный алкильный,галогеналкильный, алкоксильный, галогеналкоксильный, алкилтио-, галогеналкилтио- или алкилсульфонильный радикал c 1-6 атомами углерода; или- аминогруппу, незамещенную или моноили дизамещенную алкильным или ацильным радикалом c l-6 атомами углерода или алкоксикарбонильным радикалом с 2-6 атомами углерода, его солей и стереоизомеров,отличающийся тем, что соединение формулы(I), описанной в одном из пп.1-4, вводят во взаимодействие с соединением формулы (V) в растворителе и при температуре от +20 С до 8. Способ по п.7, отличающийся тем, что его осуществляют в присутствии катализатора,выбираемого из третичного амина, такого как триэтиламин или трибутиламин, (или органической соли этого амина, такой как трибутиламинацетат), причем вышеуказанный катализатор находится в соотношении катализатор/соединение формулы (I) от 0,05 до 1, предпочтительно от 0,1 до 0,5.
МПК / Метки
МПК: C07D 277/36
Метки: получения, промежуточные, 2-имидазолин-5-онов, соединения
Код ссылки
<a href="https://eas.patents.su/5-1518-promezhutochnye-soedineniya-dlya-polucheniya-2-imidazolin-5-onov.html" rel="bookmark" title="База патентов Евразийского Союза">Промежуточные соединения для получения 2-имидазолин-5-онов</a>
Предыдущий патент: Комбинации, содержащие vx478, зидовудин и 3tc, для применения при лечении вич
Следующий патент: Способ роуминга и устройство для осуществления способа.
Случайный патент: Композиции и способы контроля нематод









