Производные пирано[2,3-с]имидазо[1,2-а]пиридина для лечения заболеваний желудочно-кишечного тракта
Номер патента: 6095
Опубликовано: 25.08.2005
Авторы: Постиус Штефан, Зенн-Билфингер Йёрг, Зимон Вольфганг-Александер, Кромер Вольфганг, Бур Вильм
Формула / Реферат
1. Соединение формулы 1
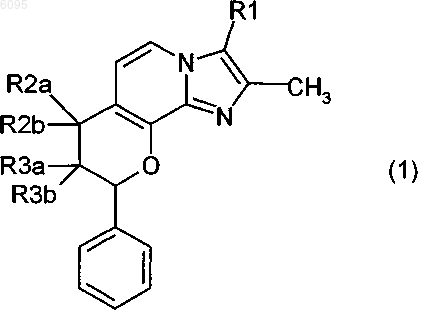
в котором
R1 означает метил или гидроксиметил,
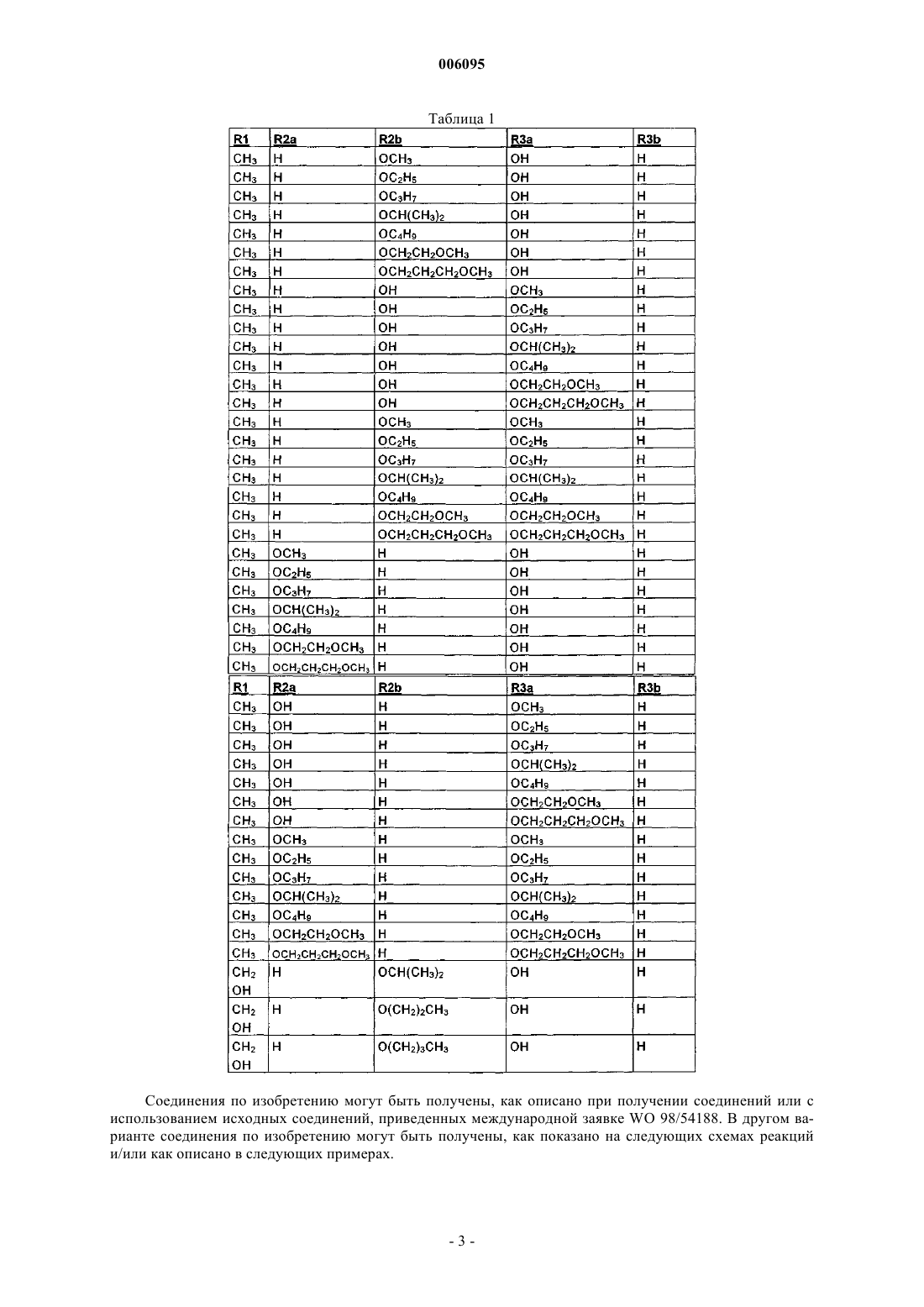
один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси,
и его соли.
2. Соединение по п.1 формулы 1*
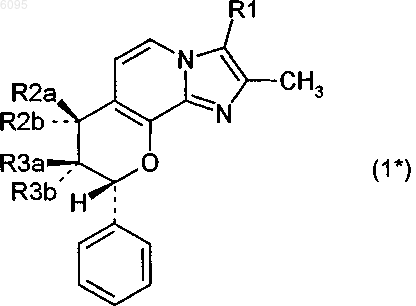
в котором
R1 означает метил или гидроксиметил,
один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси,
и его соли.
3. Соединение формулы 1* по п.2, в котором R1 означает метил,
один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b означает водород, а другой означает гидрокси,
и его соли.
4. Соединение формулы 1* по п.2, в котором R1 означает метил,
один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
и его соли.
5. Соединение формулы 1* по п.2, 3 или 4, в котором R3b означает водород.
6. Соединение формулы 1* по п.2, 3 или 4, в котором R2a и R3b означают водород.
7. Соединение по п.1 формулы 1**
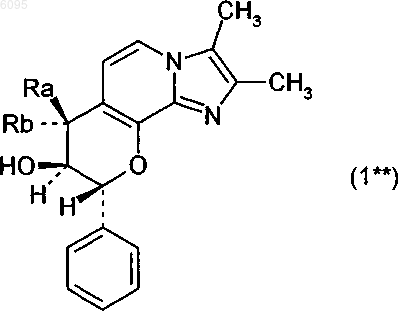
в котором
один из заместителей Ra и Rb означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,
и его соли.
8. Соединение по п.1, которое означает (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7H-8,9-дигидропирано[2,3-c]имидазо[1,2-a]пиридин и его соли.
9. Лекарственный препарат, включающий соединение по п.1 и/или его фармакологически приемлемую соль в смеси с обычными вспомогательными веществами и/или эксципиентами.
10. Применение соединения по п.1 и его фармакологически приемлемых солей для приготовления лекарственных препаратов, предназначенных для профилактики и лечения заболеваний желудочно-кишечного тракта.
Текст
006095 Область применения изобретения Изобретение относится к новым соединениям, которые используют в фармацевтической промышленности в качестве активных соединений для изготовления лекарственных препаратов. Уровень техники В международной заявке WO 95/27714 описаны некоторые замещенные трициклические имидазо[1,2-а]пиридины, которые, как считают, обратимо ингибируют секрецию соляной кислоты желудочного сока и могут быть использованы для профилактики и лечения воспалительных заболеваний желудочнокишечного тракта. В международной заявке WO 98/42707 описаны тетрагидроимидазо[1,2-h][1,7]нафтиридины, которые могут быть использованы для профилактики и лечения заболеваний желудочно-кишечного тракта. В WO 98/54188 описаны конденсированные дигидропираны, которые, как считают, могут быть использованы для терапии нарушений типа пептической язвы. Описание изобретения Изобретение относится к соединениям формулы IR1 означает метил или гидроксиметил,один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси, один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси; и к их солям. Пригодными солями соединений формулы I являются, прежде всего, все кислотно-аддитивные соли. Прежде всего, следует отметить фармакологически приемлемые соли неорганических и органических кислот, обычно используемые в фармацевтике. Эти пригодные соли являются растворимыми и нерастворимыми в воде кислотно-аддитивными солями кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4-гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота,фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтоевая кислота, причем при получении соли кислоты используют в эквимолярном или ином соотношении, в зависимости от их основности (моно-или полиосновные) или необходимого типа соли. Фармакологически неприемлемые соли, которые могут быть первоначально использованы, например, как технологические продукты при получении соединений по изобретению в промышленном масштабе, превращают в фармакологически приемлемые соли способами, известными специалисту в данной области. Специалисту в данной области известно, что соединения по изобретению и их соли, если они выделены, например, в кристаллической форме, могут содержать различные количества растворителей. Следовательно изобретение также включает все сольваты и, прежде всего, все гидраты соединений формулыI, а кроме того, все сольваты и, прежде всего, гидраты солей соединений формулы I. Соединения формулы I имеют по меньшей мере три хиральных центра. Изобретение относится ко всем восьми возможным стереоизомерам в любом требуемом соотношении, включая чистые энантиомеры, которые являются предпочтительным предметом изобретения. Предпочтительным вариантом осуществления изобретения являются соединения формулы 1R1 означает метил,один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси, и их соли. Одним из вариантов изобретения (вариант а) являются соединения формулы 1, в которых R1 означает метил,один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси,изопропокси, бутокси, метоксиэтокси или метоксипропокси, один из заместителей R3a и R3b означает водород, а другой означает гидрокси,и соли указанных соединений. Еще одним вариантом изобретения (вариантом б) являются соединения формулы 1, в которых R1 означает метил, один из заместителей R2a и R2b означает водород, а другой означает гидрокси, один из заместителей R3a и R3b означает водород, а другой означает метокси, этокси, пропокси, изопропокси,бутокси, метоксиэтокси или метоксипропокси,и их соли. Еще одним вариантом изобретения (вариантом в) являются соединения формулы 1, в которых R1 означает метил,один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси,изопропокси, бутокси, метоксиэтокси или метоксипропокси, один из заместителей R3a и R3b означает водород, а другой означает метокси,этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси, и их соли. В вариантах а-в настоящего изобретения предпочтительны соединения, в которых R3b означает водород. В описанных ниже примерах, в этих соединениях формулы 1, где R3b означает водород, оба положения 8 и 9 имеют абсолютную конфигурацию "R". В вариантах а-в настоящего изобретения, прежде всего, предпочтительны соединения, в которыхR2a и R3b означают водород. В объеме изобретения в варианте а предпочтительны соединения, которые могут иметь формулу 1 в которых один из заместителей Ra и Rb означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси, и их соли. В варианте а, прежде всего, предпочтительны соединения формулы 1, в которых Ra означает водород, аRb означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси, и их соли. Значения заместителей R1, R2a, R2b, R3a и R3b у типичных предпочтительных соединений формулы 1 по изобретению (и их солей) приведены в табл. 1. Соединения по изобретению могут быть получены, как описано при получении соединений или с использованием исходных соединений, приведенных международной заявке WO 98/54188. В другом варианте соединения по изобретению могут быть получены, как показано на следующих схемах реакций и/или как описано в следующих примерах. На вышеуказанной схеме 1 показан пример энантиоселективного синтеза диола 6, который затем этерифицировали, как более подробно описано ниже. В вышеупомянутом соединении 3 группа X означает соответствующую уходящую группу, например, атом галогена, предпочтительно атом хлора. Если уходящая группа означает атом хлора, ацилирование проводят в обычных условиях, предпочтительно с использованием бис(триметилсилил)амида натрия или калия. Следующее за ацилированием окисление также проводят в обычных условиях, известных специалисту в данной области, с использованием в качестве окислителя хлоранила, кислорода воздуха или диоксида марганца. При последующем удалении защитной группы и циклизации должны выполняться определенные условия в зависимости от используемой вспомогательной кислоты. В качестве вспомогательной кислоты по изобретению предпочтительно используют муравьиную кислоту. Восстановление в диол 6 также проводят в стандартных условиях, например, с использованием в качестве восстанавливающего агента боргидрида натрия. При использовании в качестве восстанавливающего агента боргидрида натрия указанный 7,8-трансдиол может быть получен в виде диастереомера с чистотой более 90%. Последующая этерификация по настоящему способу, например, как описано в примерах, приводит к конечным продуктам формулы 1, в которых R2a и R3b означают водород. Схема 2 Конденсацию (ацилирование и последующую циклизацию) соединения 2 (см. схему 1) с эпоксидом проводят в щелочных условиях, предпочтительно с использованием в качестве основания бис(триметилсилил) амида натрия или калия. Прежде чем проводить окисление защищают группу 8-ОН,-4 006095 предпочтительно соответствующей защитной группой Y, например, трет-бутилдиметилсилильной группой (ТБДМС), при взаимодействии спирта с ТБДМС-С 1 в стандартных условиях. Последующее окисление защищенного соединения проводят в условиях, известных специалисту в данной области, с использованием в качестве окислителя хлоранила, кислорода воздуха или диоксида марганца. Восстановление в диол 6 (см. схему 1) также проводят в стандартных условиях, например, с использованием в качестве восстанавливающего агента боргидрида натрия. При использовании в качестве восстанавливающего агента боргидрида натрия указанный 7,8-трансдиол может быть получен в виде энантиомера с чистотой более 90%. Последующая этерификация по настоящему способу, например, как описано в примерах, приводит к конечным продуктам формулы 1, в которых R2a и R3b означают водород. Дополнительная последовательность реакций для получения соединений формулы 6 (см. схему 1) показана на схеме 3. Схема 3 Ацилирование соединения 2 (см. схему 1) хлористым ацетилом следует проводить в сильно щелочных условиях, например, с использованием в качестве основания бис(триметилсилил)амида натрия или калия или диизопропиламида лития. Окисление проводят в условиях аналогичных, описанным для схем 1 и 2. Для защиты фенольной ОН-группы используют бензильную группу. Альдольную конденсацию с бензальдегидом проводят в стандартных условиях. Эпоксидирование также проводят известным способом с использованием в качестве окислителя предпочтительно пероксида водорода в щелочных условиях. Удаление защитной группы (а именно бензильной группы) и последующую циклизацию также проводят известными способами, причем циклизацию проводят в щелочных условиях. Восстановление соединения 5 (см. схему 1) и последующую этерификацию проводят, как описано для схемы 1. Выделение и очистку соединений по изобретению проводят известными методами, например, выпариванием растворителя в вакууме и перекристаллизацией полученного остатка в соответствующем растворителе, или с использованием одного из обычных методов очистки, например такого, как хроматография на колонке с соответствующим материалом-носителем. Соли получают растворением свободного соединения в соответствующем растворителе например,хлорированном углеводороде, таком, как дихлорметан или хлороформ, или низкомолекулярном алифатическом спирте (этаноле, изопропаноле), содержащем необходимую кислоту, или в который добавляют соответствующую кислоту. Соли получают фильтрованием, переосаждением, осаждением осадителем кислотно-аддитивной соли или выпариванием растворителя. Полученные соли могут быть превращены подкислением или подщелачиванием в свободные соединения, из которых в свою очередь могут быть получены соли. Таким способом фармакологически неприемлемые соли могут быть превращены в фармакологически приемлемые соли. Чистые энантиомеры, прежде всего, чистые энантиомеры формулы 1, которые являются предпочтительным предметом изобретения, могут быть получены способами, известными специалисту в данной области, например, с использованием чистых энантиомеров промежуточных соединений, энантиоселективным синтезом (см., например, приведенные схемы), хроматографическим разделением на колонках с хиральным сорбентом, получением производных с хиральными вспомогательными реагентами, последующим отделением диастереомеров и удалением хиральной вспомогательной группы, образованием солей с хиральными кислотами, последующим разделением солей и высвобождением необходимого соединения из его соли, или (фракционной) кристаллизацией из соответствующего растворителя. Полученные транс-изомеры (где R2a и R3b означают водород) могут быть превращены (по меньшей мере частично) в соответствующие цис-изомеры (где R2b и R3b означают водород) обработкой кислотами (напри-5 006095 мер, двумя эквивалентами кислоты, такой, как серная кислота) в соответствующем спирте R2a-OH. Аналогичным образом, цис-изомеры могут быть превращены в соответствующие транс-изомеры. Цис- и транс-изомеры разделяют, например, хроматографией или кристаллизацией. Следующие примеры иллюстрируют изобретение, не ограничивая его объем. Более того, аналогичным способом или способом, известным специалисту в данной области, с использованием обычных методов, могут быть получены другие соединения формулы 1, получение которых описано недостаточно подробно. ТГФ означает тетрагидрофуран, Na-ГМДС означает гексаметилдисилазан натрия [т.е. бис(триметилсилил)амид натрия], ТБДМС-С 1 означает трет-бутилдиметилсилилхлорид и ДМАП означает 4 диметиламинопиридин. В приведенных примерах (см. раздел Конечные продукты) получение пар диастереомеров в каждом случае описано в двух последующих примерах. В случае пар 7R,8R,9R/7S,8R,9R диастереоизомеры могут быть разделены хроматографией на колонке, при этом в первой основной фракции содержится диастереоизомер 7R,8R,9R, а во второй основной фракции диастереоизомер 7S,8R,9R. Примеры Конечные продукты 1.(7R,8R,9R)-2,3-Диметил-8-гидрокси-7(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с] имидазо[1,2-а]пиридин. К суспензии 1,50 г (4,83 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в 2-метоксиэтаноле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоль) серной кислоты. Затем смесь перемешивали при 120 С в течение 6 ч. Смесь разбавляли водой(100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке(диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,40 г (1,08 ммоль, 22%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 155-157 С (диэтиловый эфир). 2. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с] имидазо[1,2-a]пиридин. К суспензии 1,50 г (4,83 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в 2-метоксиэтаноле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоль) серной кислоты. Затем смесь перемешивали при 120 С в течение 6 ч. Смесь разбавляли водой(100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке(диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,61 г (1,66 ммоль, 34%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 197-199 С (диэтиловый эфир). 3. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-этокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2 а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в этаноле (7,0 мл) по каплям добавляли 0,69 мл (12,8 ммоль) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 100 С в течение 8 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 7:2), при этом получали 0,15 г (0,44 ммоль/7,0%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 249 С (диэтиловый эфир). 4. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-этокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2 а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в этаноле (7,0 мл) по каплям добавляли 0,69 мл (12,8 ммоль) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 100 С в течение 8 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 7:2), при этом получали 0,41 г (1,21 ммоль, 19%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 223 С (диэтиловый эфир). 5. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксипропокси)-9-фенил-7 Н-8,9-дигидропирано[2,3 с]имидазо[1,2-а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в 2-метоксипропаноле (10,0 мл) по каплям добавляли 0,69 мл (12,8 ммоль) серной кислоты. Затем смесь перемешивали при 140 С в течение 7 ч. Смесь разбавляли водой(100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над-6 006095 сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке(диэтиловый эфир/триэтиламин, 7:2), при этом получали 0,15 г (0,39 ммоль, 6,5%) указанного в заголовке соединения в виде бесцветного твердого вещества. 1 Н-ЯМР (200 МГц, CDCl3):1,92 (m, 2H), 2,36 (s, 3 Н), 2,38 (s, 3 Н), 3,34 (s, 3 Н), 3,54 (dd, 2 Н), 3,95(dd, 2 Н), 4,21 (dd, 1 Н), 4,76 (d, 1H), 5,06 (d, 1H), 6,83 (d, 1H), 7,30-7,57 (m, 6H). 6. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксипропокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с] имидазо[1,2-а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9 дигидропирано[2,3-с]имидазо[1,2-а]пиридина в 2-метоксиэтаноле (10,0 мл) по каплям добавляли 0,69 мл(12,8 ммоль) серной кислоты. Затем смесь перемешивали при 140 С в течение 7 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке(диэтиловый эфир/триэтиламин, 7:2), при этом получали 0,32 г (0,84 ммоль/13%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 209C (диэтиловый эфир). 7. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-пропокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина в пропан-2-оле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоля) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 100 С в течение 7 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,25 г (0,71 ммоль, 11%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 218 С (диэтиловый эфир). 8. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-пропокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. К суспензии 2,00 г (6,44 ммоля) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9 дигидропирано[2,3-с]имидазо[1,2-а]пиридина в пропан-2-оле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоль) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 100 С в течение 7 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,28 г (0,79 ммоля,12%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 222 С (диэтиловый эфир). 9. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-бутокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2 а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9 дигидропирано[2,3-с]имидазо[1,2-а]пиридина в бутаноле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоль) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 120 С в течение 7 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,14 г (0,38 ммоль,6,0%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 173 С (диэтиловый эфир). 10.[1,2-а]пиридин. К суспензии 2,00 г (6,44 ммоль) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7 Н-8,9 дигидропирано[2,3-с]имидазо[1,2-а]пиридина в бутаноле (7,0 мл) по каплям добавляли 0,51 мл (9,67 ммоля) серной кислоты. Затем смесь перемешивали в запаянной пробирке при 120 С в течение 7 ч. Смесь разбавляли водой (100 мл), нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,40 г (1,09 ммоль,17,0%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 188C (диэтиловый эфир).-7 006095 Исходные соединения А. 2,3-Диметил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. 500 мг (2,35 моль) 8-амино-2,3-диметилимидазо[1,2-а]пиридина (ЕР-А-299470) и 150 г палладия на угле (10% Pd), суспендированных в 6,0 н.соляной кислоте (5,0 л), перемешивали при давлении водорода 10 бар при 50 С в течение 24 ч. Катализатор отделяли фильтрованием и реакционную смесь концентрировали в вакууме до 2,0 л. Концентрат экстрагировали дихлорметаном, в водный слой добавляли конц. раствор аммиака до рН 4,8-5,0 и снова экстрагировали дихлорметаном. Эту операцию повторяли 10 раз. Объединенные органические экстракты сушили над сульфатом натрия и упаривали. Неочищенный продукт кристаллизовали из изопропанола, при этом получали 334,1 г указанного в заголовке соединения в виде кристаллов светло-коричневого цвета, tпл. 178,5 С (изопропанол). Б. 2,3-Диметил-7-[(2R,3S)-2,3-О,О-изопропилиден-3-фенилпропан-1-он-1-ил]-6,7-дигидро-5 Нимидазо[1,2-а]пиридин-8-он. К суспензии 28,50 г (118,4 ммоля) 2,3-диметил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-она в ТГФ(180 мл) при 0 С по каплям добавляли 237,0 мл (1 М раствор в ТГФ , 60,90 ммоля) Na-ГМДС. Реакционную смесь перемешивали в течение 1 ч, затем охлаждали до -78 С и медленно добавляли 19,40 г (80,60 ммоля) (2R,3S)-2,3-О,О-изопропилиден-3-фенилпропионилхлорида. Реакционную смесь перемешивали при температуре от -70 до -60 С в течение 2 ч и нагревали до 25 С, затем снова перемешивали в течение 4 ч. Реакцию останавливали добавлением насыщенного водного раствора хлорида аммония (2,0 мл). Затем смесь концентрировали в вакууме, растворяли в дихлорметане, промывали насыщенным водным раствором хлорида аммония, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали кристаллизацией (изопропанол), при этом получали 23,50 г (63,80 ммоля, 53%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета, tпл. 195 С (изопропанол). В. 2,3-Диметил-7-[(2R,3S) 2,3-О,О-изопропилиден-3-фенилпропан-1-он-1-ил]имидазо[1,2-а]пиридин-8-он. Смесь 16,80 г (45,60 ммоля) 2,3-диметил-7-[(2R,3S)-2,3-О,О-изопропилиден-3 -фенилпропан-1 -он-1-ил]-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-она и 12,30 г (50,20 ммоля) хлоранила в диоксане (170 мл) перемешивали при 100 С в течение 1 ч. Растворитель выпаривали и неочищенную смесь перемешивали в изопропаноле. После фильтрования при 0 С получали 11,40 г (31,11 ммоля, 68%) указанного в заголовке соединения в виде твердого вещества светло-зеленого цвета, tпл. 191 С (изопропанол). Г.(8R,9R)-2,3-Диметил-8-формилокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-7-он. Смесь 0,50 г (1,36 ммоля) 2,3-диметил-7-[(2R,3S)-2,3-О,О-изопропилиден-3-фенилпропан-1-он-1 ил]имидазо[1,2-а]пиридин-8-она и 0,42 г (0,68 ммоля) формиата аммония растворяли в муравьиной кислоте (10 мл) и перемешивали при 80 С в течение 2 ч. Затем кислоту удаляли в вакууме и остаток растворяли в дихлорметане. Раствор нейтрализовали насыщенным водным раствором гидрокарбоната натрия, промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/дихлорметан, 8:2), при этом получали указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (0,26 г, 0,77 ммоля, 57%), tпл. 204 оС (диэтиловый эфир/дихлорметан). Д. (7R,8R,9R)-2,3-Диметил-7,8-дигидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. 1,90 г (5,65 ммоля) (8R,9R)-2,3-диметил-8-формилокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-7-она перемешивали в этаноле при -5 С. Затем в течение 5 мин добавляли 0,43 г (11,3 ммоля) NaBH4 и реакционную смесь нагревали до 10 С. Затем добавляли насыщенный водный раствор хлорида аммония (50 мл). Выпавшее в осадок твердое вещество отделяли, промывали водой и сушили в вакууме при 50 С, при этом получали указанное в заголовке соединение в виде бесцветного твердого вещества (1,60 г, 5,16 ммоля, 91%), tпл.130 С(вода). Е. (8R,9R)-2,3-Диметил-8-гидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин-7 он. К 5,00 г (30,50 ммоля) 2,3-диметил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-она, суспендированного в толуоле (50 мл), добавляли 6,30 мл (36,60 ммоля, 20%-ный раствор в этаноле) этоксида натрия и смесь перемешивали в течение 30 мин. Затем при -5 С добавляли 13,1 мл (35,50 ммоля) этил-3 фенилглицидата и реакционную смесь перемешивали в течение еще 1 ч, после чего реакцию останавливали добавлением воды. Смесь дважды экстрагировали этилацетатом, объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (этилацетат/диэтиловый эфир/триэтиламин, 1:9:0,25:5:0,2), при этом получали (0,30 г, 1,00 ммоль, 3%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета, tпл. 197 С (этилацетат). Ж. (8R,9R)-2,3-Диметил-8-(трет-бутилдиметилсилил)-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо(1,60 ммоля) ДМАП в дихлорметане перемешивали при 25 С в течение 18 ч. Затем реакционную смесь разбавляли дихлорметаном, органический слой отделяли, промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией (диэтиловый эфир/циклогексан, 8:2), при этом получали (1,20 г, 2,83 ммоля, 37%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл.213 С (диэтиловый эфир/циклогексан). З.(8R,9R)-2,3-Диметил-8-(трет-бутилдиметилсилил)-9-фенил-7 Н-8,9-пирано[2,3-с]имидазо[1,2-а] пиридин-7-он. Суспензию 0,25 г (0,59 ммоля) (8R,9R)-2,3-диметил-8-(трет-бутилдиметилсилил)-9-фенил-7 Н-8,9 дигидропирано[2,3-с]имидазо[1,2-а]пиридин-7-она и 2,06 г (23,70 ммоля) MnO2 в дихлорметане (10 мл) перемешивали при 50 С в течение 120 ч. Концентрированную смесь суспендировали в эфире и фильтровали через силикагель. Неочищенный продукт очищали хроматографией (диэтиловый эфир/циклогексан,8:2), при этом получали (0,22 г, 0,52 ммоля, 88%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета, tпл. 223 С (диэтиловый эфир/циклогексан). И. (8R,9R)-2,3-Диметил-8-гидрокси-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[ 1,2-а]пиридин 7-он. 0,50 г (1,18 ммоля) (8R,9R)-2,3-диметил-8-(трет-бутилдиметилсилил)-9-фенил-7 Н-8,9-пирано[2,3-с] имидазо[1,2-а]пиридин-7-он обрабатывали HF/пиридином в пиридине/ТГФ в стандартных условиях с целью удаления защитных групп, при этом получали указанное в заголовке соединение в виде бесцветного твердого вещества, tпл. 168C (этилацетат). Промышленная применимость Соединения формулы 1 и их соли обладают ценными фармакологическими свойствами, что определяет их коммерческое применение. Прежде всего, они проявляют резко выраженное ингибирование секреции соляной кислоты желудочного сока и обладают чрезвычайно сильным защитным действием в желудочно-кишечном тракте у теплокровных животных, прежде всего, человека. В связи с этим, соединения по настоящему изобретению характеризуются высокой селективностью, благоприятной продолжительностью действия, прежде всего, достаточно высокой энтеральной активностью, отсутствием заметного побочного действия и широким спектром терапевтического использования. Термин защитное действие в желудочно-кишечном тракте в данном контексте означает профилактику и лечение желудочно-кишечных заболеваний, прежде всего, воспалительных процессов и поражений желудочно-кишечного тракта, а также заболеваний, вызванных соляной кислотой желудочного сока, (например, таких как язва желудка, язва двенадцатиперстной кишки, гастриты, гиперкислотная или связанная с медикаментозным лечением функциональная гастропатия, рефлюкс-эзофагит (воспаление пищевода), синдром Золлингера-Эллисона, изжога), у млекопитающих, включая человека, причем упомянутые заболевания могут быть вызваны, например, микроорганизмами (например, Helicobacter pylori),бактериальными токсинами, лекарственными средствами (например, определенными противовоспалительными и антиревматическими средствами), химикатами (например, этанолом), желудочной кислотой или стрессовыми ситуациями. Неожиданно оказалось, что по своим чрезвычайно полезным свойствам, соединения по настоящему изобретению значительно превосходят соединения, известные в предшествующем уровне техники, при испытании на различных моделях, с использованием которых определяли их противоязвенные и противосекреторные свойства. Благодаря этим свойствам соединения формулы 1 и их фармацевтически приемлемые соли, прежде всего, наиболее пригодны для использования в ветеринарной практике и медицине, где они используются, прежде всего, для лечения и/или профилактики нарушений в желудочном и/или кишечном тракте. Следовательно, изобретение, кроме того, относится к соединениям по настоящему изобретению для использования при лечении и/или профилактике вышеупомянутых заболеваний. Изобретение включает также использование соединений по настоящему изобретению для получения лекарственных препаратов, используемых для лечения и/или профилактики вышеупомянутых заболеваний. Изобретение, кроме того, включает использование соединений по настоящему изобретению для лечения и/или профилактики вышеупомянутых заболеваний. Изобретение, кроме того, относится к лекарственным препаратам, которые содержат одно или более соединений формулы 1 и/или их фармацевтически приемлемых солей. Лекарственные препараты получают с использованием известных способов, в том числе способов,известных специалистам в данной области техники. Фармакологически активные соединения (= активные соединения) по настоящему изобретению могут быть использованы в качестве лекарственных средств в отдельности или предпочтительно в смеси с соответствующими фармацевтическими добавками или эксципиентами в форме таблеток, таблеток с покрытием, капсул, суппозиториев, дисков (например, типа трансдерм, transdermal therapeutic system, TTS), эмульсий, суспензий или растворов, причем содержание активного соединения предпочтительно составляет от 0,1 до 95%, а фармацевтическая форма для введения (например, пролонгированная форма или энтеральная форма), созданная специально для активного соединения и/или с необходимым началом действия и/или с необходимой продолжительно-9 006095 стью действия, может быть получена с использованием соответствующего набора вспомогательных веществ и эксципиентов. Специалисту в данной области техники на основании его/ее квалификации известно, какие вспомогательные вещества или эксципиенты приемлемы для соответствующих фармацевтических составов. Кроме того, наряду с растворителями, гелеобразователями, основами для суппозиториев, вспомогательными веществами для таблеток и другими носителями активного соединения могут быть использованы,например, антиоксиданты, диспергирующие агенты, эмульгаторы, пеногасители, ароматизаторы, консерванты, солюбилизирующие агенты, красители или, прежде всего, стимуляторы всасывания через кожу и комплексообразователи (например, циклодекстрины). Активные соединения могут быть введены пероральным, парентеральным или чрескожным способом. В основном, как показано в медицинской практике, при лечении человека для получения требуемого результата при пероральном введении целесообразно вводить активное соединение (= активные соединения) в суточной дозе от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг, предпочтительно от 0,05 мг/кг до 5 мг/кг, прежде всего, от 0,1 мг/кг до 1,5 мг/кг массы тела, в соответствующих случаях в виде нескольких, предпочтительно от 1 до 4, отдельных доз. При парентеральном введении могут быть использованы аналогичные или, прежде всего, при внутривенном введении, как правило, более низкие дозы. Оптимальная доза и способ введения активного соединения в каждом конкретном случае легко определяется специалистом в данной области на основании его/ее квалификации. Если соединения по настоящему изобретению и/или их соли используют для лечения вышеупомянутых заболеваний, фармацевтические препараты могут также содержать один или более фармацевтически активных составляющих из других фармацевтических групп. В качестве примеров можно привести следующие соединения: транквилизаторы (например, группа бензодиазепинов, например, диазепам),спазмолитики (например, биетамиверин или камилофин), антихолинергические средства (например, оксифенциклимин или фенкарбамид), местные обезболивающие средства (например, тетракаин или прокаин) и, в соответствующих случаях, также ферменты, витамины или аминокислоты. В связи с этим, прежде всего, следует отметить, что, с целью потенциирования (усиления) основного действия в качестве добавок и супердобавок и/или исключения или снижения побочного действия используют комбинацию соединений по настоящему изобретению с фармацевтическими средствами,которые ингибируют кислотную секрецию, такими как, блокаторы H2-рецепторов (например, циметидин,ранитидин), ингибиторы Н+/K+ -АТФазы (например, омепразол, пантопразол) или, кроме того, с так называемыми периферическими антихолинергическими средствами (например, пирензепин, телензепин), а также с желудочными антагонистами или, кроме того, с целью подавления Helicobacter pylory в комбинации с антибактериальными соединениями (такими как, цефалоспорины, тетрациклины, пенициллины,макролиды, нитроимидазолы или в другом варианте соли висмута). В качестве примеров антибактериальных активных компонентов, используемых в комбинации, можно упомянуть мезлоциллин, ампициллин, амоксициллин, цефалотин, цефокситин, цефотаксим, имипинем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин, азитромицин, и их комбинации (например, кларитромицин + метронидазол). Фармакология Чрезвычайно высокое защитное и ингибирующее действие соединений по настоящему изобретению в отношении секреции соляной кислоты желудочного сока можно продемонстрировать при испытаниях на экспериментальных моделях животных. Для соединений по настоящему изобретению, исследованных в нижеупомянутых моделях, сохранена нумерация, приведенная в примерах. Определение ингибирующего действия на секрецию соляной кислоты желудочного сока на перфузионном желудке крысы В табл. А ниже показано влияние соединений по настоящему изобретению после внутривенного введения (в/в) на секрецию соляной кислоты в перфузионном желудке крысы, индуцированную пентагастрином. Таблица А Методика Брюшную полость анестезированных крыс (крысы CD, самки, 200-250 г, после введения 1,5 г/кг уретана внутримышечно) вскрывали после трахеотомии, делая надрез в центре верхнего отдела брюшины, и в пищевод через рот вводили катетер из ПВХ. Другой катетер вводили через привратник таким образом, чтобы концы трубок катетеров слегка входили в полость желудка, причем катетер из привратника выходил на поверхность через боковое отверстие в правой стенке брюшины.- 10006095 После тщательной промывки (приблизительно 50-100 мл) через желудок пропускали непрерывный поток теплого физиологического раствора NaCl (0,5 мл/мин, рН 6,8-6,9, фирмы Braun-Unita I) при 37 С. Затем в каждой фракции вытекающего потока, которые собирали через интервал, равный 15 мин, определяли рН (рН-метр 632, стеклянный электрод ЕА 147, диаметр 5 мм, фирма Metrohom), и секретированную НСl определяли титрованием свежеприготовленным 0,01 н. раствором NaOH до рН 7 (дозатор Dosimat 665, фирма Metrohom). Желудочную секрецию стимулировали непрерывным внутривенным вливанием пентагастрина (в левую бедренную вену) в дозе 1 мкг/кг (1,65 мл/ч) в течение приблизительно 30 мин после завершения операции (то есть после анализа двух предварительных фракций). Анализируемые соединения вводили внутривенно в объеме раствора 1 мл/кг через 60 мин после начала непрерывного вливания пентагастрина. Температуру тела животных поддерживали постоянной на уровне 37,8-38 С с использованием инфракрасного излучения и электрогрелки (автоматическая плавная регулировка с помощью ректального температурного датчика). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1R1 означает метил или гидроксиметил,один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси,и его соли. 2. Соединение по п.1 формулы 1R1 означает метил или гидроксиметил,один из заместителей R2a и R2b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b означает водород, а другой означает гидрокси, метокси, этокси,пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,где R2a или R2b с одной стороны и R3a или R3b с другой стороны одновременно не означают гидрокси,и его соли. 3. Соединение формулы 1 по п.2, в котором R1 означает метил,один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси,изопропокси, бутокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b означает водород, а другой означает гидрокси,и его соли. 4. Соединение формулы 1 по п.2, в котором R1 означает метил,один из заместителей R2a и R2b означает водород, а другой означает метокси, этокси, пропокси,изопропокси, бутокси, метоксиэтокси или метоксипропокси,один из заместителей в котором один из заместителей Ra и Rb означает водород, а другой означает метокси, этокси, пропокси, изопропокси, бутокси, метоксиэтокси или метоксипропокси,и его соли. 8. Соединение по п.1, которое означает (7R,8R,9R)-2,3-димeтил-8-гидрокси-7-(2-метоксиэтокси)-9 фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин и его соли. 9. Лекарственный препарат, включающий соединение по п.1 и/или его фармакологически приемлемую соль в смеси с обычными вспомогательными веществами и/или эксципиентами. 10. Применение соединения по п.1 и его фармакологически приемлемых солей для приготовления лекарственных препаратов, предназначенных для профилактики и лечения заболеваний желудочнокишечного тракта.
МПК / Метки
МПК: A61K 31/435, C07D 491/14, C07D 471/14, A61P 1/04
Метки: производные, заболеваний, лечения, пирано[2,3-с]имидазо[1,2-а]пиридина, тракта, желудочно-кишечного
Код ссылки
<a href="https://eas.patents.su/13-6095-proizvodnye-pirano23-simidazo12-apiridina-dlya-lecheniya-zabolevanijj-zheludochno-kishechnogo-trakta.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пирано[2,3-с]имидазо[1,2-а]пиридина для лечения заболеваний желудочно-кишечного тракта</a>
Предыдущий патент: Способ управления воздушным движением
Следующий патент: Ингибиторы протеазы вич широкого спектра действия на основе сульфонамидов 2-(замещенных-амино) бензотиазолов
Случайный патент: Пассажирское транспортное средство, в котором установлен громкоговоритель с панельным акустическим излучающим элементом