Полимерные конъюгаты паклитакселя и доцетакселя с контролируемым под действием ph высвобождением канцеростатического агента
Номер патента: 22803
Опубликовано: 31.03.2016
Авторы: Сирова Милада, Ульбрих Карел, Этрих Томаш, Ригова Бланка
Формула / Реферат
1. Полимерный конъюгат, состоящий из производного цитостатического агента, представляющего собой таксан, выбранный из паклитакселя (РТХ) и доцетакселя (DTX), и полимерного носителя, содержащего линейный или биодеградируемый привитой сополимер, состоящий из единиц N-(2-гидроксипропил)метакроиламида (НРМА) и единиц, содержащих метакрилоилированные гидразоны аминокислот или олигопептидов, где указанное производное цитостатического агента получено путем ацилирования вторичных гидроксильных групп цитостатического агента с оксокислотой, выбранной из группы, состоящей из левулиновой кислоты и 4-(2-оксопропил)бензойной кислоты, и оно связано с носителем с помощью гидролитически нестабильной гидразоновой связи, и где указанные аминокислоты или олигопептиды выбраны из группы, состоящей из глицила, глицилглицила, β-аланила, 6-аминогексаноила (АН), 4-аминобензоила и смешанных ацилов, являющихся производными олигопептидов GlyPheGly, GlyLeuGly, GlyLeuPheGly и GlyPheLeuGly.
2. Полимерный конъюгат по п.1, отличающийся тем, что он содержит 70-98 мол.% основного сополимера НРМА, 0,5-10 мол.% единиц с производным цитостатического агента, связанным гидразоновой связью, и дополнительно содержит 1,5-29,5 мол.% единиц с гидразидными функциональными группами.
3. Полимерный конъюгат по любому из пп.1, 2, отличающийся молярной массой, составляющей 10-50000 г/мол. в случае линейного полимера и 50-250000 г/мол. в случае привитого сополимера.
4. Способ получения полимерного конъюгата по пп.1-3, отличающийся тем, что полимерный носитель, содержащий линейный или биодеградируемый привитой сополимер, состоящий из единиц N-(2-гидроксипропил)метакроиламида (НРМА) и единиц, содержащих метакрилоилированные гидразиды аминокислот или олигопептидов, подвергают полимераналогичному превращению путем взаимодействия со сложным эфиром паклитакселя и доцетакселя с оксокислотой, выбранной из группы, состоящей из левулиновой кислоты и 4-(2-оксопропил)бензойной кислоты, и где указанные аминокислоты или олигопептиды выбраны из группы, состоящей из глицила, глицилглицила, β-аланила, 6-аминогексаноила (АН), 4-аминобензоила и смешанных ацилов, являющихся производными олигопептидов GlyPheGly, GlyLeuGly, GlyLeuPheGly и GlyPheLeuGly.
5. Применение полимерного конъюгата по пп.1-3 для изготовления лекарственного средства для лечения опухолевых заболеваний, выбранных из опухолей яичников, молочной железы, легкого, предстательной железы и карциномы молочной железы 4Т1, или для лечения лимфом.
Текст
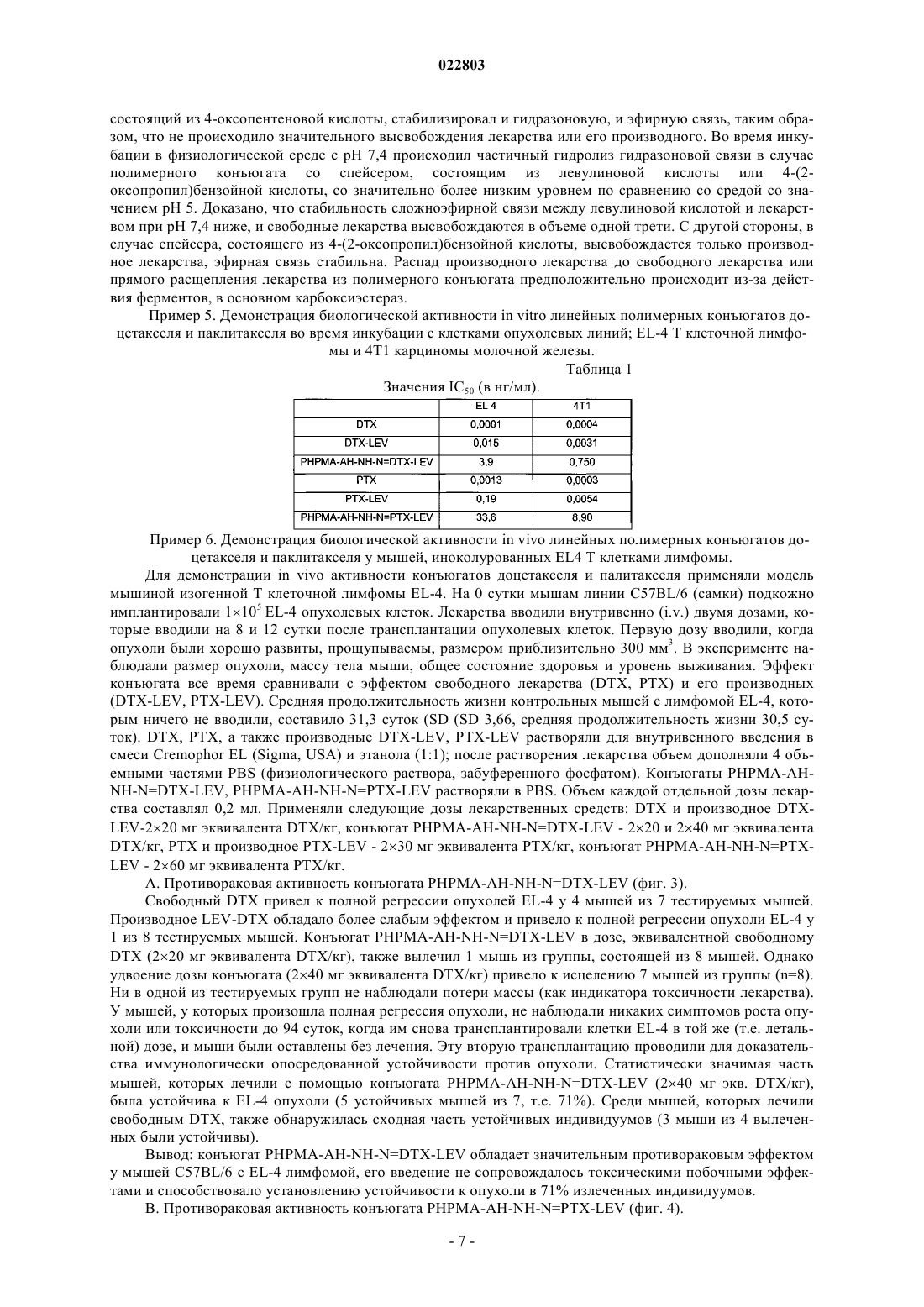
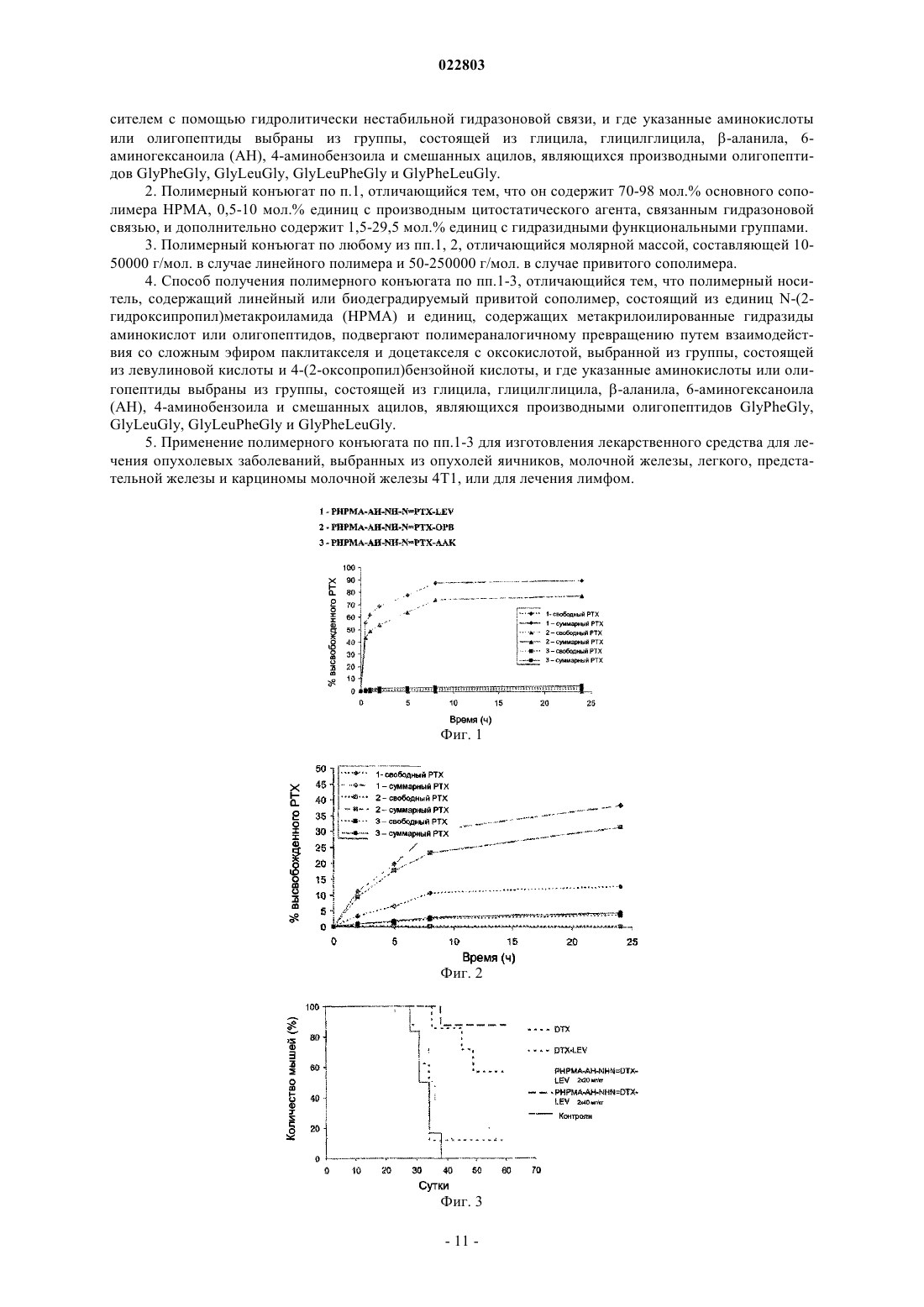
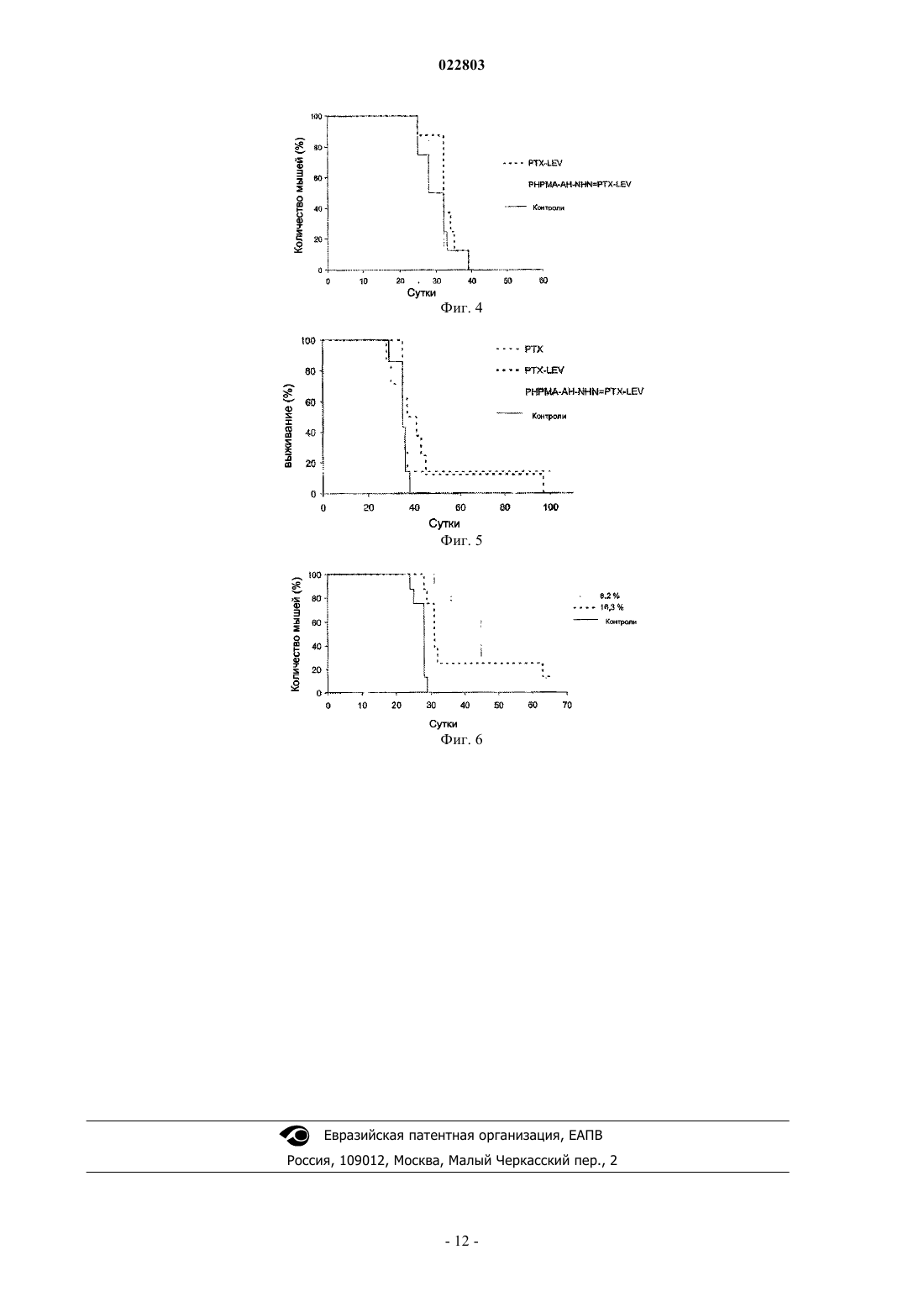
ПОЛИМЕРНЫЕ КОНЪЮГАТЫ ПАКЛИТАКСЕЛЯ И ДОЦЕТАКСЕЛЯ С КОНТРОЛИРУЕМЫМ ПОД ДЕЙСТВИЕМ pH ВЫСВОБОЖДЕНИЕМ КАНЦЕРОСТАТИЧЕСКОГО АГЕНТА Изобретение описывает полимерный конъюгат, состоящий из производного цитостатического агента, выбранного из группы таксанов, в частности паклитакселя (РТХ), доцетакселя (DTX) или ларотакселя (LTX), а также полимерного носителя, приготовленного на основе линейного или биодеградируемого привитого сополимера, состоящего из единиц основного сополимераN-(2-гидроксипропил)метакриламида (НРМА) и единиц, содержащих метакрилоилированные гидразоны аминокислот или олигопептиды. Изобретение также относится к способу получения упомянутого выше полимерного конъюгата, при котором полимерный носитель подвергают превращению, аналогичному полимерному, путем взаимодействия со сложным эфиром оксокислоты и цитостатического агента. Полимерный конъюгат применяют для изготовления медикамента для лечения опухолевых заболеваний. Область техники Изобретение относится к структуре и свойствам водорастворимых полимерных терапевтических агентов (пролекарств) на основе производных паклитакселя (РТХ), доцетакселя (DTX) и ларотакселя(LTX), предназначенных в основном для лечения солидных опухолей в терапии опухолевых заболеваний в человеческой медицине. Предшествующий уровень техники В настоящее время тенденции разработки лекарств очень часто фокусируются на разработке лекарственных форм, активирующих специфический эффект лекарства только в месте желаемого терапевтического эффекта. Биологически активные вещества, обладающие таким направленным действием, главным образом наносят в области, где нежелательные побочные эффекты лекарства могут повредить здоровые части организма. Эта опасность, в частности, связана с лечением цитостатическими веществами при химиотерапии опухолевых заболеваний. Известно, что присоединение цитостатического агента к водорастворимому полимерному носителю с помощью химической связи делает возможным повышение растворимости иным образом нерастворимых или плохо растворимых лекарств и значительно снижает их прямую токсичность. Высокая молекулярная масса полимеров предотвращают быструю экскрецию лекарства из организма путем клубочковой фильтрации, обеспечивая более длительное время циркуляции в крови и присутствие в организме, и, таким образом, более длительное время биологической доступности лекарства. В прошлом изготавливали и изучали многие полимерные конъюгаты канцеростатических агентов, в которых лекарство, обладающее действием против рака, присоединяли к полимеру при помощи нерасщепляемой ковалентной связи, гидролитически нестабильной ионной связи и/или ковалентной связи,позволяющей контролируемое высвобождение лекарства и, таким образом, его активацию, на основе ферментативного или простого химического гидролиза этой связи. Системы полимерных носителей обычно конструируются таким образом, чтобы происходило высвобождение терапевтически активного канцеростатического агента из носителя в опухоль или, более специфически, непосредственно в опухолевую клетку. Важная группа полимерных терапевтических агентов представлена полимерными лекарствами, изготовленными на основе сополимеров N-(2-гидроксипропил)метакриламида (НРМА), большое количество которых активно направлено на опухоли путем того, что нацеливающая структура присоединена к полимеру (антителу, лектину, гормону) [Duncan 1985, Rihova 2000, Kopecek 2001, 2000, Duncan,2005; Satchi-Fainaro et al., 2006]. Однако их синтез очень сложен. Во время разработки полимерных канцеростатических агентов было доказано, что для специфического транспорта лекарства в место нахождения опухоли нет необходимости применять активно нацеливающий носитель, но значительно повышенного накопления полимерных цитостатических агентов, особенно в солидных опухолях, можно достичь путем повышения молекулярной массы полимерного лекарственного средства выше предела выделения носителя почками (т.е. пассивное нацеливание на солидные опухоли). Эта способность макромолекул накапливаться в солидных опухолях была названа эффектом EPR (Повышенная Проницаемость и Удерживание), и было доказано, что этот эффект значительно проявляется у носителей на основе сополимеров НРМА [Noguchi et al., 1998; Seymour et al., 1995]. Одна из главных проблем применения сополимеров НРМА в качестве пассивно нацеливающих высокомолекулярных носителей возникает из-за нерасщепляемой углеродной цепи, и единственные полимеры, чья молекулярная масса не превышает 40-50000 г/мол., могут выводиться из организма. Это означает, что если накопление полимера в организме после повторного введения лекарства не происходит, и если молекулярная масса носителя является настолько высокой, насколько это возможно для осуществления пассивного нацеливания настолько эффективно, насколько это возможно, полимерный носитель нужно конструировать как разрушающийся в организме. Такие полимерные носители на основе сополимеров НРМА были недавно разработаны, и их структура была запатентована [Chytil et al., 2008; Etrych etal., 2008, Chytil PV 2006-207, Etrych PV 2006-592]. В литературе упоминают огромное количество информации о изготовлении и исследовании свойств полимеров, несущих канцеростатический агент, прикрепленный к полимеру с помощью связи, чувствительной к гидролизу в водной среде [Kratz 1999]. Среди них сополимеры НРМА, несущие канцеростатический агент доксорубицин, связанный с полимерной цепью с помощью гидролитически расщепляемой гидразоновой связи, занимают важное место [Etrych 2002, Ulbrich 2004a, Ulbrich 2004b, Ulbrich pat CZ 293787 B6]. Эта связь относительно стабильна в среде кровотока (на пути транспорта в организме) и гидролитически нестабильна в слабокислой окружающей среде живой клетки. Скорость гидролиза этой связи также управляет скоростью высвобождения лекарства и, следовательно, концентрацией активного вещества в месте желаемого эффекта. При проведении испытаний in vitro, a также in vivo у мышей такие полимерные канцеростатические агенты проявляли значительно более выраженное противоопухолевое действие против большого числа опухолевых линий, чем свободное лекарство, и в большом количестве случаев их применение приводило к полному восстановлению тестируемого животного даже в случае терапевтического способа введения [Rihova 2001, Etrych 2001]. Повышение молекулярной массы носителя (биодеградируемые привитые полимеры, мицеллярные и наногелевые системы) всегда приводит к повышению эффективности противоопухолевого действия лекарства, проверенного в in vivo системах. Паклитаксель и доцетаксель относятся к группе таксанов, лекарств против рака, обычно применяемых для лечения опухолей яичников и молочной железы, легких, предстательной железы и других опухолей[Vanhoefer at al., 1997]. Кроме их вторичной токсичности, обычной для канцеростатических агентов, они обладают другим недостатком, очень низкой растворимостью в водных растворах, что приводит к необходимости введения в разных вспомогательных веществах, особенно в Cremophor EL, который также приводит к другим побочным эффектам лекарственной формы. В некоторых схемах введения таксанов вCremophor EL может быть даже значительно снижена эффективность терапии [Ng at al., 2006]. При связывании этих лекарств с полимерными носителями (PEG, НРМА сополимер, поли(глютаминовая кислота получают очень хорошо растворимые в воде неактивные формы лекарства, обладающие повышенным временем циркуляции в организме и повышенным накоплением в солидных опухолях. Их противораковую активность проверяли in vivo на животных моделях и в некоторых случаях клинически. Таким образом, паклитаксель (РТХ) ковалентно связывали с полиэтиленгликолем (PEG) с помощью нерасщепляемой сложноэфирной или 7-карбаматной связи (С 2-ОН группа) или с помощью гидролитически нестабильного аминокислотного спейсера (Ala, Gly) [Greenwald et al., 1995; Greenwald, 2001; Greenwald et al.,2003; Pendri et al., 1998]. Было показано, что противоопухолевая активность конъюгатов зависит от структуры связи, применяемой между полимером и лекарством, и что молекулярная масса носителя является другим важным фактором. Конъюгат с РТХ тестировали в фазе I клинических испытаний [SatchiFainaro et al., 2006], но очевидно, что с небольшим успехом. Конъюгат паклитакселя с поли(глютаминовой кислотой) (Xyotax), как оказалось, является более успешным в клинических испытаниях [Winter 2005, Kratz et al., 2008]. В этом конъюгате РТХ связан с полиаминокислотным носителем с помощью сложноэфирной связи через -ОН группу в положении 2. Лекарство высвобождается из-за деградации полимерной цепи, образования Glu производных РТХ и их последующего гидролиза. В настоящее время этот конъюгат находится в фазе III клинических испытаний. Паклитаксель также соединяли с сополимерами НРМА с помощью эфирной связи с использованием биодеградируемого олигопептидного GlyPheLeuGly спейсера. Продемонстрировали, что РТХ после инкубирования с лизосомальными ферментами высвобождается из носителя, и это высвобождение важно для достижения противораковой активности in vivo. PNU166945 представляет собой конъюгат сополимера НРМА, связанного эфирной связью с РТХ, который клинически тестировали в фазе I [Terwogt et al.,2000; Terwogt et al., 2001], однако после этой фазы дальнейшее тестирование прекратили. Описанные выше результаты показывают, что конъюгация паклитакселя с полимерным носителем приводит к значительному улучшению свойств лекарства (растворимости, улучшенной биологической доступности). Однако, если лекарство применяют для лечения людей, то структуру и молекулярную массу носителя,так же как структуру спейсера между полимером и лекарством, контролирование уровня и, таким образом, концентрации лекарства в месте желаемого эффекта следует тщательно выбирать и готовить индивидуально. При разработке оптимальных структур важно проверять функцию этих структур в подходящих in vivo моделях. Описание изобретения Полимерное лекарство в соответствии с настоящим изобретением характеризуется тем, что канцеростатический агент из группы таксанов, паклитаксель (РТХ), доцетаксель (DTX) или ларотаксель (LTX)(здесь и далее лекарства) связан с водорастворимым полимерным носителем, изготовленным на основе линейного или привитого сополимера НРМА. Лекарство связано с полимерными цепями через сложноэфирную группу, образующуюся при ацилировании группы -ОН в позиции 2 с помощью спейсеров, содержащих чувствительные к рН расщепляемые гидразоновые связи. Эти спейсеры могут состоять из кислотных остатков различных оксокислот, с помощью которых карбонильную группу внедряют в структуру лекарства, связанную с остатками индивидуальных аминокислот, олигопептидов или других структур, позволяя тем самым завершение боковых цепей полимерного носителя гидразоновой группой. В случае линейного полимера молекулярную массу полимерной цепи выбирают ниже предела выведения сополимеров НРМА из организма, предпочтительно в диапазоне 10-50000 г/моль. В случае привитого сополимера выбранная молекулярная масса находится в диапазоне 50-250000 г/моль. Полимерное лекарство по настоящему изобретению предназначено для внутривенного (инъекция или инфузия) введения в растворе, но его также можно ввести внутрь опухоли или внутрибрюшинно, и оно предназначено для лечения солидных опухолей. Полимер с химически связанным цитостатическим агентом конструируется таким образом, чтобы оставаться стабильным во время циркуляции в кровотоке и для предотвращения гидролиза гидразоновой связи между данным таксаном и полимером, или, возможно, сохранять уровень гидролиза во время транспорта через организм настолько низким, насколько это возможно (при значении рН 7,4 в кровотоке), таким образом, чтобы цитотоксический эффект высвобождаемого лекарства или его производного не мог проявиться. Цельную систему конструируют как двухфазную систему. Благодаря подходящему выбору молекулярной массы носителя, позволяющего просачивание, а также эффективное накопление в опухолевой ткани, взаимодействие с клеточной мембраной должно происходить после первичного накопления лекарства в опухолевой ткани, и молекулярно растворенное полимерное лекарство должно проникнуть в отдельные опухолевые клетки путем пиноцитоза. Внутри клеток-мишеней должен происходить немедленный гидролиз гидразоновой связи и высвобождение лекарства или его производного из носителя благодаря снижению рН с внешнего значения (7,4) до внутриклеточного значения (5-6). На следующей стадии гидролиз сложноэфирной связи производного лекарства, уже выделившего из полимера, должен осуществляться путем химического гидролиза, или, более специфически, с помощью эффекта внутриклеточных ферментов, например карбоксиэстераз. Осуществимость описанного выше механизма действия полимерных лекарств по изобретению доказана в экспериментах с моделью высвобождения лекарств из полимерного носителя. Результаты этих тестов, включая тесты на активность против рака, приведены в экспериментальной части заявки на изобретение. Полимерные конъюгаты с направленным эффектом против рака по изобретению отличаются тем,что цитостатический агент (таксол, доцетаксель, ларотаксель) прикреплен с помощью сложноэфирной связи и спейсера к полимерному носителю, образованному линейным [Etrych pat CZ 297827 В 6, publ. 2008] или привитым [Etrych pat CZ 298945 (B6), publ. 2008] сополимером НРМА через гидролитически нестабильную гидразоновую группу, образованную путем взаимодействия карбонильной группы молекулы производного лекарства с гидразидной группой полимерного носителя. Полимерные носители готовят, главным образом, путем радикальной сополимеризации НРМА с сомономерами, соответствующими желаемой композиции. Связывание соответствующего таксана с полимерным носителем приводит к заметному снижению цитотоксичности, заметному повышению молекулярной массы лекарства и, таким образом, увеличению времени циркуляции в кровотоке; т.е. увеличению общей продолжительности пребывания лекарства в организме и, следовательно, повышению его биологической доступности. Полимерное лекарство согласно изобретению далее характеризуется тем, что связь лекарства с полимерным носителем относительно стабильна в ходе транспорта в кровотоке и жидкостях тела, и она гидролитически расщепляема в слабокислой окружающей среде опухоли и особенно внутри опухолевых клеток мишеней в эндосомах, характеризующихся слабокислым значением рН. Это означает, что лекарство транспортируется через кровоток в инактивированной форме, связанной с полимером, и оно высвобождается и активируется преимущественно после проникновения в опухолевые клетки-мишени. Факт, что лекарство активируется только в клетках-мишенях, устраняет побочные эффекты токсических цитостатических агентов и направляет их действие преимущественно на опухолевые клетки. Существует полимерный носитель, приготовленный на основе сополимеров НРМА, чьи молекулярные массы, т.е. эффективность накопления в опухолевой ткани, могут контролироваться путем изменения в структуре скелета полимерного носителя (не способный к расщеплению линейный полимер, высоко молекулярный биодеградируемый привитой полимер), который отвечает за направленный (пассивный) транспорт к опухоли или опухолевым клеткам. Область применения настоящего изобретения включает применение полимерных лекарств по изобретению для лечения солидных опухолей при злокачественных заболеваниях человека. Синтез и структуры полимерных конъюгатов Синтез полимерных конъюгатов согласно изобретению проводят в несколько стадий; подробная конечная структура конъюгата сильно зависит от выбранного способа синтеза. На первой стадии синтеза основных мономеров синтезируют: НРМА, метакрилоилированные производные аминокислот и олигопептидов, оканчивающиеся гидразидной (CONHNH2) группой, или, возможно, заканчивающиеся гидразидной группой, защищенной трет-бутилоксикарбонильной группой (Boc). На второй стадии синтезируют полимерные предшественники, т.е. сополимеры НРМА, несущие функциональные группы (статистические сополимеры), служащие в качестве полимерных носителей для лекарства. Полимерный предшественник, несущий функциональные гидразидные группы вдоль цепи,можно приготовить с помощью радикальной сополимеризации упомянутых выше функциональных мономеров с НРМА или с помощью превращения основного сополимера, несущего функциональные группы, аналогичного полимерному. Привитые сополимеры готовят из многовалентных и полутелехелатных сополимеров НРМА в соответствии со способом, описанным в [Etrych 2008 pat, publ.]. Основной сополимер (предшественник) представляет собой сополимер НРМА и метакрилоилированных гидразидов аминокислот или олигопептидов, выбранных из группы глицила, глицилглицила, аланила, 6-аминогексаноила (АН), 4-аминобензоила, или смешанного ацила, происходящего из олигопептидов GlyPheGly, GlyLeuGly, GlyLeuPheGly и GlyPheLeuGly, характеризующегося тем, что он содержит 70-98 моль.% НРМА и 2-30 моль.% единиц с гидразидными функциональными группами (см. схему 2 со спейсером, состоящим из 6-аминогексаноила). Производное лекарства представляет собой соединение лекарства (РТХ, DTX или LTX), полученное путем ацилирования гидроксильной группы в положении 2 лекарства, с соответствующей оксокислотой. Предпочтительно применяли следующие оксокислоты: левулиновую кислоту, 4-(2 оксопропил)бензойную кислоту, 4-оксопенто-2-еноевую кислоту и 5-оксогекса-2-еноевую и 6-оксогепта 2-еноевую кислоту (см. схему 1). Полимерный конъюгат представляет собой соединение полимерного предшественника с производным лекарства, где производное лекарства связано с полимерным предшественником гидразоновой связью, образованной при взаимодействии карбонильной группы производного лекарства с гидразидными группами полимера, характеризующегося тем, что он содержит 70-98 моль.% НРМА, 1,5-29,5 моль.% единиц с гидразидными функциональными группами и 0,5-10 моль.% единиц с производным лекарства,связанным с гидразоном (см. схему 3 со спейсером, состоящим из 6-аминогексаноиловой и левулиновой кислот). Описание фигур Фиг. 1 - диаграмма уровня высвобождения РТХ и его производных из линейных полимерных конъюгатов в буфере со значением рН 5 (модель внутриклеточной окружающей среды). Фиг. 2 - диаграмма уровня высвобождения РТХ и его производных из линейных полимерных конъюгатов в буфере со значением рН 7,4 (модель кровотока). Фиг. 3 - уровень выживания мышей C57BL/6 с EL-4 лимфомой, которым вводили DTX, производное LEV-DTX и PHPMA-AH-NH-N=DTX-LEV линейный полимерный конъюгат. Дозы лекарства составляли 220 мг эквивалента DTX/кг, конъюгат PHPMA-AH-NH-N=DTX-LEV вводили в дозах 220 и 240 мг эквивалента DTX/кг. Фиг. 4 - уровень выживания мышей C57BL/6 с EL-4 лимфомой, которым вводили производное паклитакселя LEV-PTX и PHPMA-AH-NH-N=PTX-LEV линейный полимерный конъюгат. Из-за ограниченной растворимости РТХ не могли вводить в свободной форме. Фиг. 5 - уровень выживания мышей BALB/c с 4 Т 1 карциномой молочной железы, которым на 8 и 12 сутки вводили паклитаксель, производное паклитакселя LEV-PTX и PHPMA-AH-NH-N=PTX-LEV линейный полимерный конъюгат. РТХ и PTX-LEV инъецировали в дозе 230 мг эквивалента РТХ/кг на 8 и 12 сутки (смотри текст) и конъюгат PHPMA-AH-NH-N=PTX-LEV в дозе 260 мг эквивалента РТХ/кг. Фиг. 6 - уровень выживания мышей C57BL/6 с EL-4 лимфомой, которым на 9 и 13 сутки вводилиPHPMA-AH-NH-N=DTX-LEV линейные полимерные конъюгаты с содержанием DTX 8,2 и 16,3% в дозе 230 мг эквивалента DTX. Примеры. Примеры проведения синтеза промежуточных соединений и конъюгатов по изобретению. Пример 1. Синтез мономеров и производных лекарств. НРМА готовили в соответствии с ранее описанным способом [Ulbrich et al., 2000]. Элементарный анализ: вычислено 58,8% С, 9,16% Н, 9,79% N; найдено 58,98% С, 9,18% Н, 9,82% N. Продукт был хроматографически чистым. 6-(Метакрилоиламино)гексаноилгидразин (N1-(6-гидразино-6-оксогексил)-2-метилакриламид) (MAAH-NHNH2) готовили в соответствии с ранее описанным способом [патенты Ulbrich, патент Etrych]. Эфир левулиновой кислоты и паклитакселя (в положении-ОН 2) (LEV-PTX) готовили путем взаимодействия левулиновой кислоты с паклитакселем путем карбодиимидного способа (дициклогексилкарбодиимид, DCC) в N,N'-диметилформамиде (DMF). Левулиновую кислоту (19,4 мг, 0,167 ммоль) и DCC (37,5 мг, 0,182 ммоль) растворяли каждый в 0,15 мл DMF при температуре лаборатории. Оба раствора охлаждали до -18 С и смешивали. Через 20 мин раствор паклитакселя (100 мг, 0,117 ммоль) и N,N-диметиламинопиридина (DMAP) (14 мг, 0,117 ммоль) в 0,3 мл DMF добавляли к этому раствору. Взаимодействие происходило при -18 С в течение 30 мин и при 4 С в течение 16 ч. За ходом реакции наблюдали с помощью планшетов на силикагеле дляTLC (тонкослойной хроматографии) - 60 F254 (этилацетат:гексан 1:1, Rf(PTX)=0,25, Rf(LEV-РТХ)=0,15,Pf(левулиновой кислоты)=0,45). Продукт очищали от низкомолекулярных примесей с помощью хроматографии на колонке (604 см), заполненной силикагелем в этилацетате. Фракцию, содержащую продуктPTX-LEV, собирали и концентрировали до 0,4 мл, и продукт осаждали с 20 мл диэтилового эфира. Продукт отбирали, промывали небольшим количеством эфира и сушили в условиях вакуума до постоянной массы. Выход составлял 98 мг продукта (84%) с точкой плавления от 136 до 138 С. ТСХ (этилацетат:гексан 1:1): одно пятно с Rf=0,15. MALDI-TOF MS: 970 (M+Na). Чистоту мономеров и производных лекарства проверяли с использованием системы ВЭЖХ [система ВЭЖХ Shimadzu, оборудованная обращенно-фазовой колонкой Chromolith Performance RP-18e(1004,6 мм) и UV-VIS детектором - Shimadzu SPD- IOAVvp (230 нм); элюент: вода-ацетонитрил с градиентом 50-100 об.% ацетонитрила, скорость потока жидкости 0,5 мл мин-1]. Эфир левулиновой кислоты и доцетакселя (в позиции 2 -ОН) (LEV-DTX) готовили по аналогии сLEV-PTX путем карбодиимидного способа (DCC) в DMF. Левулиновую кислоту (38 мг, 0,327 ммоль) и DCC (100 мг, 0,487 ммоль) растворяли каждый в 0,25 мл DMF при температуре лаборатории. Оба раствора охлаждали до -18 С и смешивали. Через 20 мин раствор доцетакселя (200 мг, 0,247 ммоль) и N,N-диметиламинопиридин (DMAP) (28 мг, 0,229 ммоль) в 0,6 мл DMF добавляли к этому раствору. Взаимодействие происходило при -18 С в течение 30 мин и при 4 С в течение 16 ч. За ходом реакции наблюдали с помощью пластин силикагеля для ТСХ (тонкослойная хроматография) 60 F254 (этилацетат:гексан 1:1, Rf(DTX)=0,3, Rf(LEV-DTX)=0,2, Pf(левулиновой кислоты)=0,45). Продукт очищали от низкомолекулярных примесей дважды с использованием колоночной хроматографии (604 см), заполненной силикагелем в этилацетате. Фракцию, содержащую продуктDTX-LEV, собирали каждый раз и концентрировали до 0,6 мл, а продукт осаждали с 20 мл диэтилового эфира. Продукт отбирали, промывали небольшим количеством диэтилового эфира и сушили в условиях вакуума до постоянной массы. Выход продукта составлял 179 мг продукта (80%) с точкой плавления от 86 до 89 С. ТСХ (этилацетат:гексан 1:1): одно пятно с Rf=0,20. MALDI-TOF (время-пролетная ионизация лазерной десорбцией с использованием матрицы) MS: 929 (M+Na). Схема 1 Структуры сложных эфиров левулиновой кислоты и 4-(2-оксопропил)бензойной кислоты с паклитакселем и доцетакселем: А) эфир левулиновой кислоты и паклитакселя, LEV-PTX; В) эфир 4-(2 оксопропил)бензойной кислоты и паклитакселя, ОРВ-РТХ; С) эфир левулиновой кислоты и доцетакселя,LEV-DTX. Сложный эфир 4-(2-оксопропил)бензойной кислоты и паклитакселя (в положении 2 -ОН) (ОРВРТХ) готовили с помощью такого же вышеописанного способа для приготовления LEV-PTX, а именно путем взаимодействия 4-(2-оксопропил)бензойной кислоты и паклитакселя с использованием реагента для конъюгации DCC в DMF. Выход продукта составил 85%. Точка плавления от 143 до 145 С. TLC(этилацетат:гексан 1:1): одно пятно с Rf=0,25. MALDI-TOF MS: 1032 (M+Na). Сложный эфир 4-(2-оксопропил)бензойной кислоты и доцетакселя (в положении 2 -ОН) (ОРВ-РТХ) готовили с помощью такого же вышеописанного способа для приготовления DTX-LEV, а именно путем взаимодействия 4-(2-оксопропил)бензойной кислоты с доцетакселем с использованием DCC в DMF. Выход продукта составил 81%. Точка плавления от 94 до 96 С. TLC (этилацетат:гексан 1:1): одно пятно сRf=0,28. MALDI-TOF MS: 990 (M+Na). Сложный эфир 4-оксопентеноевой [3-ацетилакриловой] кислоты и паклитакселя (в положении 2 ОН) (AAK-РТХ) готовили с помощью такого же вышеописанного способа для приготовления LEV-PTX,а именно путем взаимодействия 4-оксопентеноевой кислоты с паклитакселем с использованием DCC вDMF. Выход составлял 86%. Точка плавления от 138 до 139 С, ТСХ (этилацетат:гексан 3:1): одно пятно с Rf=0,6. MALDI-TOF MS: 968 (M+Na). Сложный эфир 5-оксогексеновой кислоты и паклитакселя (в положении 2 -ОН) (ОНЕ-РТХ) готовили с помощью такого же вышеописанного способа для приготовления PTX-LEV, а именно путем взаимодействия 5-оксогексеновой кислоты с паклитакселем с использованием реагента для конъюгации DCC в DMF. Выход составлял 85%. Точка плавления от 132 до 134 С, ТСХ (этилацетат:гексан 3:1): одно пятно с Rf=,65. MALDI-TOF MS: 982 (M+Na). Сложный эфир 5-оксогексеновой кислоты и доцетакселя (в положении 2 -ОН) (OHE-DTX) готовили с помощью такого же вышеописанного способа для приготовления DTX-LEV, а именно путем взаимодействия 5-оксогексеновой кислоты с доцетакселем с использованием реагента для конъюгации DCC вDMF. Выход продукта составлял 86%. Точка плавления от 84 до 86 С. ТСХ (этилацетат:гексан 3:1): одно пятно с Rf=0,7. MALDI-TOF MS: 940 (M+Na). Пример 2. Синтез полимерного предшественника - сополимера HPMA c MA-AH-NHNH2. Поли(HPMA-СO-MA-AH-NHNH2) сополимер готовили путем радикальной сополимеризации НРМА и MA-AH-NHNH2 в метаноле при 60 С в соответствии с описанным ранее способом [патент Etrych]. Пример 3. Получение полимерных конъюгатов, содержащих производные лекарств (PHPMA-AH-NHN=LEV-PTX, PHPMA-AH-NH-N=LEV-DTX, PHPMA-AH-NH-N=OPB-PTX, PHPMA-AH-NH-N=OPBDTX, PHPMA-AH-NH-N=OHE-PTX, PHPMA-AH-NH-N=OHE-DTX, PHPMA-AH-NH-N=AKK-PTX иPHPMA-AH-NH-N=AKK(-DTX). Сополимеры с производными РТХ, DTX и LTX, связанные с носителем РНРМА с помощью гидролитически расщепляемой гидразоновой связью, получали путем взаимодействия предшественников полимеров, содержащих гидразиновые группы, с соответствующими производными лекарств в метаноле в условиях катализа уксусной кислотой. Раствор 100 мг поли(НРМА-со-МА-АН-NHNH2) сополимера в 1,1 мл метанола смешивали с раствором LEV-PTX в 0,2 мл метанола. Через 1 мин к перемешиваемой реакционной смеси при 25 С добавляли 40 мкл уксусной кислоты. За ходом реакции (утрата LEV-PTX) наблюдали с помощью ТСХ (пластины силикагеля 60F254, этилацетат, Rf(LEV-PTX)=0,8). Через 2 ч реакционную смесь очищали от свободных производных лекарств путем гель-фильтрации на колонке, заполненной Сефадексом LH-20 в метаноле. Полимерную фракцию выделяли, концентрировали в вакуумном испарителе, и продукт осаждали 50 мл этилацетата, выделяли с помощью фильтрации на фритте S4, отмывали 150 мл этилацетата и высушивали до постоянной массы. Содержание общего РТХ или его производных в полимерном конъюгате определяли с помощью способа ВЭЖХ (система для ВЭЖХ Shimadzu) после полного гидролиза полимерного конъюгата в растворе HCl (рН 2) при 37 С в течение 1 ч и экстракции производного РТХ хлороформом. MW и распределение молекулярной массы определяли с помощью жидкостной хроматографии (колонка TSKGel 4000(30010 мм), 20% 0,3 М ацетатный буфер (CH3COONa/CH3COOH; рН 6,5; 0,5 г/л NaN3) и 80% метанол,скорость потока 0,5 мл/мин, детекцию осуществляли с помощью дифференциального рефрактометра,детектора рассеивания света (DAWN-DSP-F, Wyatt Technology, USA) и УФ-детектора (250 нм). Описание полимерного лекарства: общий выход реакции связывания лекарства 96 мг (88%), содержание общегоLEV-PTX составило 9,2 мас.%, содержание свободного РТХ 0,2% от общего содержания РТХ. Способ связывания производного РТХ с предшественниками полимеров с помощью гидразоновой связи являлся таким же, как и для всех типов предшественников и производных лекарств. Схема 3. Структуры полимерного конъюгата PHPMA-AH-NH-N=DTX-LEV со связывающим производным,сложным эфиром левулиновой кислоты и доцетакселем. Пример 4. Высвобождение РТХ, DTX или их производных из полимерных конъюгатов. Количества РТХ, DTX или их производных, высвобождающихся из полимерных конъюгатов, измеряли после их инкубации в фосфатном буфере со значением рН 5,0 (0,1 М фосфатный буфер, содержащий 0,05 М NaCl), имитирующем внутриклеточную среду, и в фосфатном буфере со значением рН 7,4, имитирующем среду кровотока. Количества высвобождающихся лекарств или их производных в растворах для инкубации определяли с помощью ВЭЖХ (Shimadzu). Через определенные временные интервалы 200 мкл дозы растворов для инкубации отбирали и после экстракции высвободившегося лекарства и его производных хлороформом их количества определяли с использованием системы ВЭЖХ [система ВЭЖХShimadzu, оборудованная обращенно-фазовой колонкой Chromolith Performance RP-18e (1004,6 мм) и детектором UV-VIS - Shimadzu SPD - 10AVvp (230 нм); элюент:вода-ацетонитрил с градиентом 50-100 об.% ацетонитрила, скорость потока 0,5 мл мин-1. После инкубации конъюгатов (концентрация 5 мг/мл) в физиологической окружающей среде при 37 С (фосфатный буфер, рН 7,4) лекарства (РТХ и DTX) (или их производные) высвобождались значительно медленнее (фиг. 2), чем в слабокислой среде с рН 5,0, имитирующей среду эндосом и лизосом опухолевых клеток (фиг. 1). Для обоих лекарств на уровень высвобождения из полимерного конъюгата и пропорцию выделенных компонентов (лекарств и их производных) принципиально влияла структура оксокислотного спейсера. Спейсер, состоящий из левулиновой кислоты или 4-(2-оксопропил)бензойной кислоты, позволял очень быстрое высвобождение производного лекарства при рН 5; однако гидролиз эфирной связи между лекарством и кислотой происходил очень медленно. С другой стороны, спейсер,-6 022803 состоящий из 4-оксопентеновой кислоты, стабилизировал и гидразоновую, и эфирную связь, таким образом, что не происходило значительного высвобождения лекарства или его производного. Во время инкубации в физиологической среде с рН 7,4 происходил частичный гидролиз гидразоновой связи в случае полимерного конъюгата со спейсером, состоящим из левулиновой кислоты или 4-(2 оксопропил)бензойной кислоты, со значительно более низким уровнем по сравнению со средой со значением рН 5. Доказано, что стабильность сложноэфирной связи между левулиновой кислотой и лекарством при рН 7,4 ниже, и свободные лекарства высвобождаются в объеме одной трети. С другой стороны, в случае спейсера, состоящего из 4-(2-оксопропил)бензойной кислоты, высвобождается только производное лекарства, эфирная связь стабильна. Распад производного лекарства до свободного лекарства или прямого расщепления лекарства из полимерного конъюгата предположительно происходит из-за действия ферментов, в основном карбоксиэстераз. Пример 5. Демонстрация биологической активности in vitro линейных полимерных конъюгатов доцетакселя и паклитакселя во время инкубации с клетками опухолевых линий; EL-4 Т клеточной лимфомы и 4 Т 1 карциномы молочной железы. Таблица 1 Значения IC50 (в нг/мл). Пример 6. Демонстрация биологической активности in vivo линейных полимерных конъюгатов доцетакселя и паклитакселя у мышей, иноколурованных EL4 Т клетками лимфомы. Для демонстрации in vivo активности конъюгатов доцетакселя и палитакселя применяли модель мышиной изогенной Т клеточной лимфомы EL-4. На 0 сутки мышам линии C57BL/6 (самки) подкожно имплантировали 1105 EL-4 опухолевых клеток. Лекарства вводили внутривенно (i.v.) двумя дозами, которые вводили на 8 и 12 сутки после трансплантации опухолевых клеток. Первую дозу вводили, когда опухоли были хорошо развиты, прощупываемы, размером приблизительно 300 мм 3. В эксперименте наблюдали размер опухоли, массу тела мыши, общее состояние здоровья и уровень выживания. Эффект конъюгата все время сравнивали с эффектом свободного лекарства (DTX, РТХ) и его производных(DTX-LEV, PTX-LEV). Средняя продолжительность жизни контрольных мышей с лимфомой EL-4, которым ничего не вводили, составило 31,3 суток (SD (SD 3,66, средняя продолжительность жизни 30,5 суток). DTX, РТХ, а также производные DTX-LEV, PTX-LEV растворяли для внутривенного введения в смеси Cremophor EL (Sigma, USA) и этанола (1:1); после растворения лекарства объем дополняли 4 объемными частями PBS (физиологического раствора, забуференного фосфатом). Конъюгаты PHPMA-AHNH-N=DTX-LEV, PHPMA-AH-NH-N=PTX-LEV растворяли в PBS. Объем каждой отдельной дозы лекарства составлял 0,2 мл. Применяли следующие дозы лекарственных средств: DTX и производное DTXLEV-220 мг эквивалента DTX/кг, конъюгат PHPMA-AH-NH-N=DTX-LEV - 220 и 240 мг эквивалентаDTX/кг, РТХ и производное PTX-LEV - 230 мг эквивалента РТХ/кг, конъюгат PHPMA-AH-NH-N=PTXLEV - 260 мг эквивалента РТХ/кг. А. Противораковая активность конъюгата PHPMA-AH-NH-N=DTX-LEV (фиг. 3). Свободный DTX привел к полной регрессии опухолей EL-4 у 4 мышей из 7 тестируемых мышей. Производное LEV-DTX обладало более слабым эффектом и привело к полной регрессии опухоли EL-4 у 1 из 8 тестируемых мышей. Конъюгат PHPMA-AH-NH-N=DTX-LEV в дозе, эквивалентной свободномуDTX (220 мг эквивалента DTX/кг), также вылечил 1 мышь из группы, состоящей из 8 мышей. Однако удвоение дозы конъюгата (240 мг эквивалента DTX/кг) привело к исцелению 7 мышей из группы (n=8). Ни в одной из тестируемых групп не наблюдали потери массы (как индикатора токсичности лекарства). У мышей, у которых произошла полная регрессия опухоли, не наблюдали никаких симптомов роста опухоли или токсичности до 94 суток, когда им снова трансплантировали клетки EL-4 в той же (т.е. летальной) дозе, и мыши были оставлены без лечения. Эту вторую трансплантацию проводили для доказательства иммунологически опосредованной устойчивости против опухоли. Статистически значимая часть мышей, которых лечили с помощью конъюгата PHPMA-AH-NH-N=DTX-LEV (240 мг экв. DTX/кг),была устойчива к EL-4 опухоли (5 устойчивых мышей из 7, т.е. 71%). Среди мышей, которых лечили свободным DTX, также обнаружилась сходная часть устойчивых индивидуумов (3 мыши из 4 вылеченных были устойчивы). Вывод: конъюгат PHPMA-AH-NH-N=DTX-LEV обладает значительным противораковым эффектом у мышей C57BL/6 с EL-4 лимфомой, его введение не сопровождалось токсическими побочными эффектами и способствовало установлению устойчивости к опухоли в 71% излеченных индивидуумов. В. Противораковая активность конъюгата PHPMA-AH-NH-N=PTX-LEV (фиг. 4). Невозможно вводить свободный РТХ мышам из-за его очень ограниченной растворимости (мыши погибали немедленно после инъекции). Производное PTX-LEV не обладало противораковым действием на EL-4 лимфому (оно не продлевало среднюю продолжительность жизни, ни одна мышь не была вылечена; n=8). Конъюгат PHPMA-AH-NH-N=PTX-LEV в дозе 260 мг эквивалента РТХ/кг не вылечил ни одной мыши или не продлил среднее времени жизни (n=8). Ни в одной группе не было отмечено потери массы как индикатора токсичности лекарства. Вывод: производное PTX-LEV (230 мг экв. РТХ/кг) или конъюгат, содержащий производное РТХ(260 мг экв. РТХ/кг), не обладали никаким лечебным эффектом при лечении изогенной EL-4 лимфомы у мышей. Пример 7. Демонстрация биологической активности in vivo линейного полимерного конъюгата паклитакселя у мышей, инокулированных 4 Т 1 карциномой молочной железы (фиг. 5). Применяли модель мышиной изогенной карциномы молочной железы 4 Т 1. Мышам линии BALB/c(самкам) подкожно имплантировали 1106 4 Т 1 клеток карциномы на 0 сутки. Лекарства вводили внутривенно (i.v.) двумя дозами на 8 и 12 день после трансплантации опухолевых клеток. Первую дозу вводили,когда опухоль была хорошо развита, прощупывалась, с размером приблизительно 300 мм 3. В ходе эксперимента наблюдали за размером опухоли, массой тела мышей, общим состоянием здоровья и уровнем выживания. Эффект конъюгата всегда сравнивали с эффектом свободного лекарства (РТХ) и его производного (PTX-LEV). Среднее время выживания контрольных мышей, которым не водили лекарства, составило 34,9 суток (SD 2,59; среднее время выживания 35 суток). РТХ, PTX-LEV и конъюгат PHPMA-AH-NH-N=PTX-LEV готовили для внутривенного введения таким же способом, как упоминалось выше (см. пример 6 А, В). Вводили следующие дозы: РТХ и PTXLEV в дозе 230 мг эквивалента РТХ/кг, конъюгат PHPMA-AH-NH-N=PTX-LEV в дозе 260 мг эквивалента РТХ/кг. Конъюгат PHPMA-AH-NH-N=PTX-LEV полностью вылечил 3 из 8 тестируемых мышей. После введения производного PTX-LEV регрессия 4 Т 1 опухоли произошла у 1 из 8 мышей. Введение свободного лекарства (РТХ) сопровождалось значительными побочными эффектами: внутривенное введение второй дозы вызывало тяжелые реакции (спазмы, позднее плохое общее состояние - поднятая дыбом шерсть, вялость, которая продолжалась по меньшей мере 24 ч) у первой половины мышей. Для других мышей в группе вторую дозу уменьшили на 10% и вводили внутрибрюшинно вместо внутривенного введения. Вылечилась только одна мышь, которой вводили дозу лекарства внутривенно, у других мышей не было обнаружено лечебного эффекта РТХ. Ни в какой тестируемой группе не отмечали потерю массы в качестве индикатора токсичности. Для проверки устойчивости к 4 Т 1 опухоли вылеченным мышам через 129 суток после первой трансплантации снова трансплантировали опухолевые клетки. Во второй раз инъецировали 1105 4 Т 1 клеток подкожно, и мышей оставляли без лечения. У всех этих мышей (3 вылеченных конъюгатом РНРМА-AH-NH-N=PTX-LEV, 1 вылеченная PTX-LEV) опухоли не росли, что означает, что эти мыши были устойчивы к данной опухоли. Вывод: конъюгат PHPMA-AH-NH-N=PTX-LEV обладает значительным противораковым эффектом у мышей BALB/c с 4 Т 1 карциномой молочной железы, его введение не сопровождалось никаким побочным токсическим эффектом и способствовало установлению устойчивости к опухоли у 38% вылеченных индивидуумов. Пример 8. Демонстрация биологической активности in vivo линейного полимерного конъюгата доцетакселя с различным содержанием лекарства у мышей, инокулированных Т клетками EL4 лимфомы(рис. 6). Применяли опухолевую модель EL-4 лимфомы, описанную выше (пример 6). Конъюгаты PHPMAAH-NH-N=DTX-LEV с содержанием лекарства DTX 8,2 мас.% (9,1 мас.% DTX-LEV) и 16,3 мас.% DTX(18,0 мас.% DTX-LEV) растворяли в PBS (0,2 мл) для введения, и субоптимальную дозу 230 мг эквивалента DTX/кг вводили внутривенно на 9 и 13 сутки после трансплантации опухолевых клеток. Конъюгат с более низким содержанием лекарства (8,2% DTX) вылечил 1 из 8 тестируемых мышей,и у других он продлил время выживания статистически значимым образом (не обработанные контроли: средняя продолжительность жизни 27,25 суток, SD 1,64, среднее 28 суток; обработанные мыши: среднее 41,75 суток, SD 6,54, медиана 45 суток; р 0.01). Конъюгат с более высоким содержанием лекарства(16,3% DTX) также привел к вылечиванию 1 из 8 тестированных мышей, но время жизни других мышей не было значительно увеличено. Вывод: содержание производного лекарства в конъюгате PHPMA-AH-NH-N=DTX-LEV оказывало значительное влияние на противораковый эффект у мышей C57BL/6 с EL-4 лимфомой при введении в субоптимальной дозе 230 мг эквивалента DTX/кг. Полимерный конъюгат с более низким содержанием обеспечил более высокую противораковую активность. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полимерный конъюгат, состоящий из производного цитостатического агента, представляющего собой таксан, выбранный из паклитакселя (РТХ) и доцетакселя (DTX), и полимерного носителя, содержащего линейный или биодеградируемый привитой сополимер, состоящий из единиц N-(2 гидроксипропил)метакроиламида (НРМА) и единиц, содержащих метакрилоилированные гидразоны аминокислот или олигопептидов, где указанное производное цитостатического агента получено путем ацилирования вторичных гидроксильных групп цитостатического агента с оксокислотой, выбранной из группы, состоящей из левулиновой кислоты и 4-(2-оксопропил)бензойной кислоты, и оно связано с но- 10022803 сителем с помощью гидролитически нестабильной гидразоновой связи, и где указанные аминокислоты или олигопептиды выбраны из группы, состоящей из глицила, глицилглицила, -аланила, 6 аминогексаноила (АН), 4-аминобензоила и смешанных ацилов, являющихся производными олигопептидов GlyPheGly, GlyLeuGly, GlyLeuPheGly и GlyPheLeuGly. 2. Полимерный конъюгат по п.1, отличающийся тем, что он содержит 70-98 мол.% основного сополимера НРМА, 0,5-10 мол.% единиц с производным цитостатического агента, связанным гидразоновой связью, и дополнительно содержит 1,5-29,5 мол.% единиц с гидразидными функциональными группами. 3. Полимерный конъюгат по любому из пп.1, 2, отличающийся молярной массой, составляющей 1050000 г/мол. в случае линейного полимера и 50-250000 г/мол. в случае привитого сополимера. 4. Способ получения полимерного конъюгата по пп.1-3, отличающийся тем, что полимерный носитель, содержащий линейный или биодеградируемый привитой сополимер, состоящий из единиц N-(2 гидроксипропил)метакроиламида (НРМА) и единиц, содержащих метакрилоилированные гидразиды аминокислот или олигопептидов, подвергают полимераналогичному превращению путем взаимодействия со сложным эфиром паклитакселя и доцетакселя с оксокислотой, выбранной из группы, состоящей из левулиновой кислоты и 4-(2-оксопропил)бензойной кислоты, и где указанные аминокислоты или олигопептиды выбраны из группы, состоящей из глицила, глицилглицила, -аланила, 6-аминогексаноила(АН), 4-аминобензоила и смешанных ацилов, являющихся производными олигопептидов GlyPheGly,GlyLeuGly, GlyLeuPheGly и GlyPheLeuGly. 5. Применение полимерного конъюгата по пп.1-3 для изготовления лекарственного средства для лечения опухолевых заболеваний, выбранных из опухолей яичников, молочной железы, легкого, предстательной железы и карциномы молочной железы 4 Т 1, или для лечения лимфом.
МПК / Метки
МПК: A61K 47/48, A61P 35/00
Метки: контролируемым, конъюгаты, доцетакселя, канцеростатического, высвобождением, полимерные, действием, паклитакселя, агента
Код ссылки
<a href="https://eas.patents.su/13-22803-polimernye-konyugaty-paklitakselya-i-docetakselya-s-kontroliruemym-pod-dejjstviem-ph-vysvobozhdeniem-kancerostaticheskogo-agenta.html" rel="bookmark" title="База патентов Евразийского Союза">Полимерные конъюгаты паклитакселя и доцетакселя с контролируемым под действием ph высвобождением канцеростатического агента</a>
Предыдущий патент: Соединения, композиции и способы для лечения заболеваний, опосредованных jak-киназой
Следующий патент: Кухонная плита и принадлежности, использующие солнечную энергию
Случайный патент: Композиция и лекарственная форма для задерживаемого желудочного выделения алендроната и/или других бис-фосфонатов