Пептид-полимерные конъюгаты
Формула / Реферат
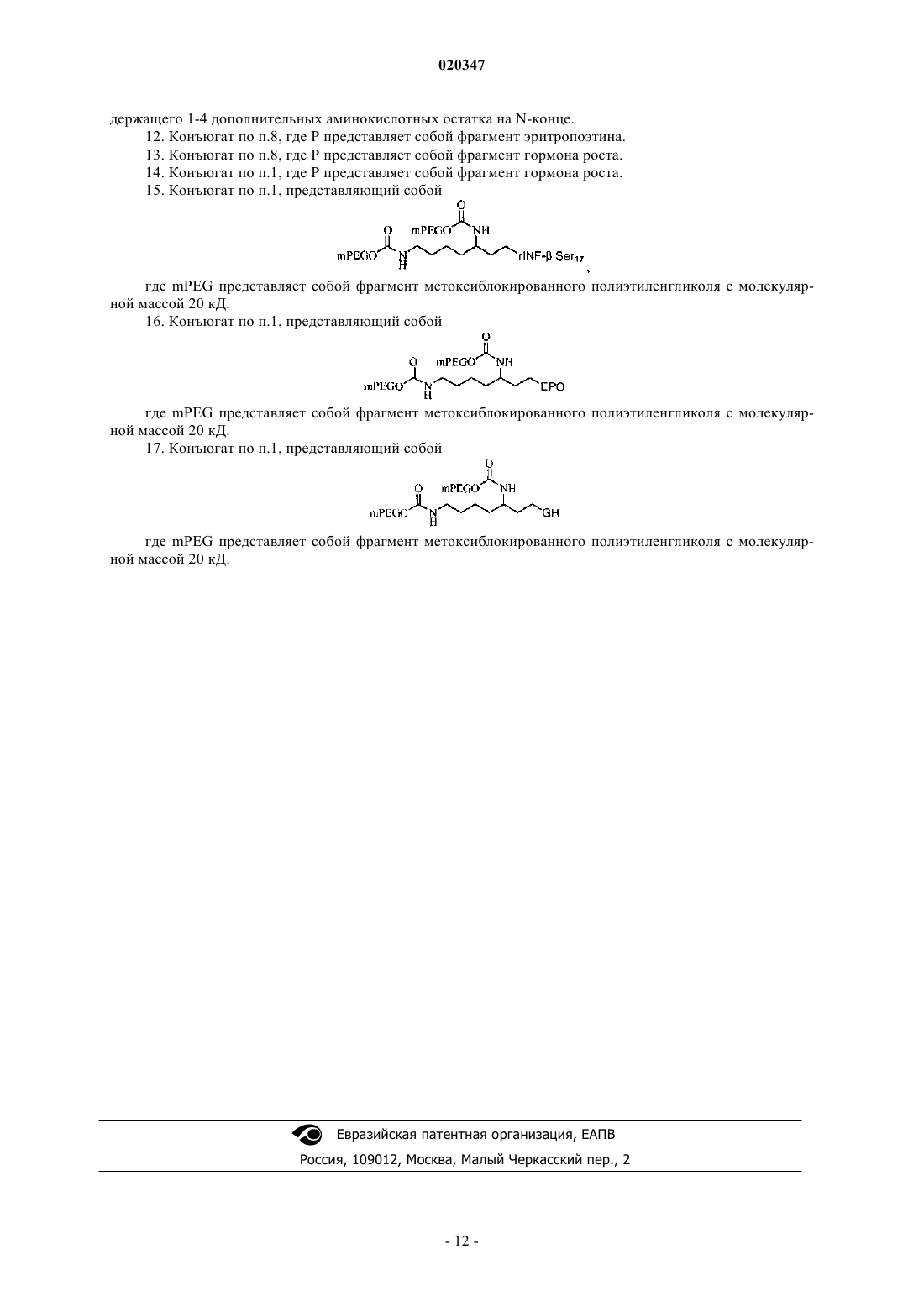
1. Пептид-полимерный конъюгат следующей формулы:
где каждый из R1, R2, R3, R4 и R5 представляет собой Н;
каждый из А1 и А2 независимо представляет собой полиэтиленгликолевый фрагмент;
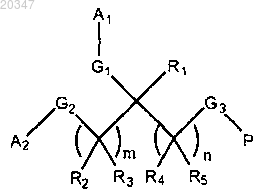
каждый из G1 и G2 представляет собой связывающую функциональную группу:
в которой O связан с А1 или А2 и атом N связан с атомом углерода;
G3 представляет собой связь;
P выбирают из группы, состоящей из фрагмента интерферона-β (INF-β), фрагмента эритропоэтина (EPO) и фрагмента гормона роста (GH), при этом атом азота на N-конце P связан с G3;
m равно 0 или целому числу от 1 до 10;
n равно целому числу от 1 до 10.
2. Конъюгат по п.1, где P представляет собой фрагмент интерферона-β.
3. Конъюгат по п.2, где P представляет собой rINF-β Ser17.
4. Конъюгат по п.2, где P представляет собой фрагмент модифицированного интерферона-β, содержащего 1-4 дополнительных аминокислотных остатка на N-конце.
5. Конъюгат по п.1, где P представляет собой фрагмент эритропоэтина.
6. Конъюгат по п.1, где каждый из A1 и A2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 2-100 кД.
7. Конъюгат по п.6, где каждый из A1 и A2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 10-30 кД.
8. Конъюгат по п.1, где m равно 4, n равно 2.
9. Конъюгат по п.8, где P представляет собой фрагмент интерферона-β.
10. Конъюгат по п.9, где P представляет собой rINF-β Ser17.
11. Конъюгат по п.9, где P представляет собой фрагмент модифицированного интерферона-β, содержащего 1-4 дополнительных аминокислотных остатка на N-конце.
12. Конъюгат по п.8, где P представляет собой фрагмент эритропоэтина.
13. Конъюгат по п.8, где P представляет собой фрагмент гормона роста.
14. Конъюгат по п.1, где P представляет собой фрагмент гормона роста.
15. Конъюгат по п.1, представляющий собой
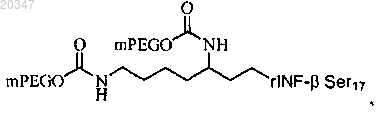
где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД.
16. Конъюгат по п.1, представляющий собой
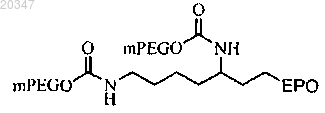
где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД.
17. Конъюгат по п.1, представляющий собой
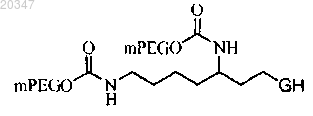
где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД.
Текст
Изобретение относится к конъюгату полимерного фрагмента и фрагмента интерферона, фрагмента эритропоэтина или фрагмента гормона роста. Перекрестная ссылка на родственные заявки По заявке на данное изобретение испрашивается приоритет на основании предварительной патентной заявки США 61/085072, поданной 31 июля 2008 г., полное содержание которой включено в настоящее описание посредством ссылки. Уровень техники Прогресс в области клеточной биологии и технологии рекомбинантных белков привел к разработке белковых терапевтических средств. Тем не менее, все еще существуют значительные затруднения. Большинство белков чувствительны к протеолитическому разложению и вследствие этого имеют короткое время циркуляции в организме. К другим недостаткам относятся низкая растворимость в воде и индукция выработки нейтрализующих антител. Присоединение полимера, например полиэтиленгликоля (PEG), к белку препятствует доступу протеолитических ферментов к белковому остову, что приводит к повышению стабильности белка. Кроме того, это также может повышать растворимость в воде и сводить к минимуму иммуногенность. Существует потребность в эффективных способах присоединения полимера к белкам. Сущность изобретения Один из аспектов настоящего изобретения относится к пептид-полимерному конъюгату следующей формулы: где каждый из R1, R2, R3, R4 и R5 представляет собой Н; каждый из A1 и А 2 независимо представляет собой полиэтиленгликолевый фрагмент; каждый из G1 и G2 представляет собой связывающую функциональную группу:G3 представляет собой связь; Р выбирают из группы, состоящей из фрагмента интерферона- (INF-), фрагмента эритропоэтина(EPO) и фрагмента гормона роста (GH), при этом атом азота на N-конце P связан с G3;m равно 0 или целому числу от 1 до 10;n равно целому числу от 1 до 10. В предпочтительном варианте P представляет собой фрагмент интерферона-, в частности rINFSer17. В другом предпочтительном варианте P представляет собой фрагмент модифицированного интерферона-, содержащего 1-4 дополнительных аминокислотных остатка на N-конце. В ещ одном предпочтительном варианте P представляет собой фрагмент эритропоэтина. В ещ одном другом предпочтительном варианте каждый из A1 и А 2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 2-100 кД, наиболее предпочтительно каждый из A1 и А 2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 10-30 кД. В предпочтительном варианте предложен конъюгат, где m равно 4, n равно 2. Наиболее предпочтительно, когда в указанном конъюгате P представляет собой фрагмент интерферона-, в частности, такой как rINF- Ser17. В другом предпочтительном варианте P представляет собой фрагмент модифицированного интерферона-, содержащего 1-4 дополнительных аминокислотных остатка на N-конце. В другом предпочтительном варианте P представляет собой фрагмент эритропоэтина. В ещ одном другом предпочтительном варианте P представляет собой фрагмент гормона роста. В предпочтительном варианте конъюгат согласно настоящему изобретению может быть представлен следующей структурой: где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД. В ещ одном предпочтительном варианте конъюгат может представлять собой фрагмент следующей структуры: где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД. В ещ одном другом предпочтительном варианте конъюгат может представлять собой фрагмент следующей структуры: где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД. В контексте настоящего изобретения термин "полимерный фрагмент" означает одновалентный радикал, производный от линейного, разветвленного или звездообразного полимера. Молекулярная масса полимерного фрагмента может составлять 2-100 кД. Примеры полимерного фрагмента включают, но не ограничиваются ими, полиэтиленоксид, полиэтиленгликоль, полиизопропиленоксид, полибутениленоксид, полиэтиленгликоль и их сополимеры. Другие полимеры, такие как декстран, поливиниловые спирты, полиакриламиды или полимеры на основе углеводов, также можно использовать при условии, что они не являются антигенными, токсичными или вызывающими иммунный ответ. Термин "полипептидный фрагмент" означает одновалентный радикал, производный либо от природного полипептида, либо от модифицированного полипептида. Природным пептидом может являтьсяINF-2b, INF-, GH, EPO и гранулоцитарный колониестимулирующий фактор либо антитело. Модифицированным пептидом может являться, например, пептид, содержащий INF и 1-4 дополнительных аминокислотных остатка на N-конце INF-2b., IFN, представляющий фрагмент Примером такого модифицированного INF являетсяINF-2b, аминогруппа на N-конце которого связана с карбонильной группой. Термин "интерферон-" относится к семейству высокогомологичных белков, ингибирующих вирусную репликацию и клеточную пролиферацию, а также модулирующих иммунный ответ. См. Deryncket al. (1980). Nature. 285(5766): 542-7 и Taniguchi et al. (1980). Gene. 10(1): 11-5. Он включает как природные INF-, так и их функциональные эквиваленты, т.е. полипептиды, по меньшей мере на 80% (например, 85, 90, 95 или 99%) идентичные своему аналогу дикого типа. Примеры INF- включают активные ингредиенты коммерчески доступных лекарственных средств, таких как авонекс, бетаферон и ребиф. См., например, Etemadifar M. et al., Acta Neurol. Scand., 2006, 113(5): 283-7. Ниже приведены аминокислотные последовательности примеров белков INF- человека либо в форме предшественников, либо в зрелой форме:(см. номер доступа GenBank: M28622, версия от 27 апреля 1993 г.; выделенная курсивом часть относится к сигнальным пептидам);(см. номер доступа GenBank: CAA00839, версия от 3 декабря 1993 г). В одном примере INF- представляет собой мутантную форму rINF- Ser17 (рекомбинантный INF-,где в положении 17 находится серин вместо цистеина природной зрелой последовательности INF-. Аминокислотная последовательность данной мутантной формы приведена ниже: В другом примере INF- представляет собой модифицированный природный INF-, где 1-4 дополнительных аминокислотных остатка присоединены к N-концу природного INF-.EPO, продуцируемый либо в печени, либо в почках, представляет собой гликопротеиновый гормон,контролирующий эритропоэз или производство красных кровяных клеток. Он включает как природныйEPO, так и его функциональные эквиваленты. См. патент США 5621080 и публикацию патентной заявки США 20050176627. Аминокислотные последовательности человеческого EPO (в форме предшественника и в зрелой форме) приведены ниже: Белок EPO, используемый для создания конъюгата по настоящему изобретению, может представлять собой белок EPO либо в форме предшественника, либо в зрелой форме, продуцируемый организмами соответствующих видов, например человеческий, мышиный, свиной или крупного рогатого скота. В одном примере белок EPO имеет аминокислотную последовательность, по меньшей мере на 80% (например, 85, 90, 95 или 99%) идентичную одной из аминокислотных последовательностей, приведенных выше. В другом примере EPO представляет собой модифицированный природный EPO, где 1-4 дополнительных аминокислотных остатка присоединены к N-концу природного EPO. Термин "гормон роста" относится к природному человеческому гормону роста либо в форме предшественника, либо в зрелой форме и его функциональным вариантам, т.е. имеющим аминокислотную последовательность, по меньшей мере на 80% (например, 85, 90, 95 или 99%) идентичную природному человеческому гормону роста, и обладающим такой же физиологической активностью, что и человеческий гормон роста. В одном примере гормон роста представляет собой модифицированный природный гормон роста, где 1-4 дополнительных аминокислотных остатка присоединены к N-концу природного гормона роста. Аминокислотные последовательности природного человеческого гормона роста (в форме предшественника и в зрелой форме) приведены ниже:"Процент идентичности" двух аминокислотных последовательностей определяют, используя алгоритм, описанный Karlin and Altschul в Proc. Natl. Acad. Sci. USA 87: 2264-68, 1990, модифицированный согласно Karlin and Altschul Proc. Natl. Acad. Sci. USA 90: 5873-77, 1993. Такой алгоритм включен в программы NBLAST и XBLAST (версия 2.0) Altschul, et al. J. Mol. Biol. 215: 403-10, 1990. Поиски белка программой BLAST можно проводить с помощью программы XBLAST, количество баллов = 50, длина "слова" = 3, для получения аминокислотных последовательностей, гомологичных белковым молекулам, используемым в настоящем изобретении. Если между двумя последовательностями существуют гэпы,можно использовать программу Gapped BLAST, как описано у Altschul et al., в Nucleic Acids Res. 25(17): 3389-3402, 1997. При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). Термин "связывающая функциональная группа" означает бивалентную функциональную группу,один конец которой связан с полимерным фрагментом, а другой конец связан с пептидным фрагментом. Примеры включают, но не ограничиваются ими, -О-, -S-, сложный эфир карбоновой кислоты, карбонил,карбонат, амид, карбамат, мочевину, сульфонил, сульфинил, амино, имино, гидроксиамино, фосфонатную или фосфатную группу. Пептид-полимерные конъюгаты, описанные выше, могут находиться в свободной форме или в форме соли, если это применимо. Соль, например, может быть образована между анионом и положительно заряженной группой (например, амино) на пептид-полимерном конъюгате настоящего изобретения. Подходящие анионы включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат. Кроме того, соль может быть образована между катионом и отрицательно заряженной группой (например, карбоксилатом) на полипептид-полимерном конъюгате настоящего изобретения. Подходящие катионы включают ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Кроме того, пептид-полимерный конъюгат может иметь одну или несколько двойных связей или один или несколько асимметричных центров. Такие конъюгаты могут существовать как рацематы, рацемические смеси, одиночные энантиомеры, отдельные диастереомеры, диастереомерные смеси, а также цис- или транс- либо с Е- или Z-двойной связью изомерные формы. Примеры полимер-пептидных конъюгатов настоящего изобретения приведены ниже: где mPEG представляет собой метоксиблокированный полиэтиленгликоль с молекулярной массой 20 кД и N-концы rINF- Ser17, EPO и GH присоединены к крайнему правому атому углерода, показанному на приведенных выше структурах. Некоторые белки имеют терапевтическую полезность. Вследствие этого конъюгаты настоящего изобретения, содержащие пептидный фрагмент, можно использовать для лечения заболеваний. Например, INF- является иммуномодулирующим лекарственным средством для лечения инфекции HCV илиHBV. См., например, Journal of Vascular and Interventional Radiology. 13 (2002): 191-196. Таким образом,конъюгаты настоящего изобретения можно применять в способе лечения инфекции, вызванной вирусом гепатита С (HCV), или инфекции, вызванной вирусом гепатита В (HBV), с помощью INFполимерного конъюгата, описанного выше. В качестве другого примера EPO является гормоном, продуцируемым почками, для стимулирования образования красных кровяных клеток в костном мозге. Он был использован в качестве иммуномодулирующего лекарственного средства для лечения анемии, вызванной хроническим заболеванием почек, вторичной анемии после лечения СПИДа зидовудином и анемии, связанной с раком. Недавние исследования также показали, что EPO увеличивает нейрогенез и играет важную роль в восстановлении после инсульта. См., например, Р.Т. Tsai, Journal of Neuroscience, 2006, 26: 1269. Таким образом, еще один аспект настоящего изобретения относится к способу лечения анемии или усиления нейрогенеза с помощью EPO-полимерного конъюгата, описанного выше. Также описанный выше INFполимерный конъюгат настоящего изобретения можно использовать в составе композиции, предназначенной для лечения инфекции HCV или инфекции HBV. Кроме того,описанный выше EPO-полимерный конъюгат можно использовать в составе композиции для лечения анемии или для усиления нейрогенеза. Конъюгаты настоящего изобретения можно использовать для производства лекарственного средства для лечения инфекции HCV, инфекции HBV или анемии или для усиления нейрогенеза. Подробности одного или более вариантов осуществления изобретения изложены в приведенном ниже описании. Другие особенности, цели и преимущества изобретения будут очевидны из описания и из формулы изобретения. Подробное описание изобретения Пептид-полимерные конъюгаты по настоящему изобретению можно получать способами синтеза,хорошо известными в области химии. Например, можно объединять линкерную молекулу, имеющую одну или более активных функциональных групп, с двумя молекулами полимера, имеющими функциональную группу, реагирующую с функциональными группами на линкерной молекуле. Затем проводят взаимодействие пептидной молекулы, содержащей функциональную группу, с функциональной группой на линкерной молекуле, с получением пептид-полимерного конъюгата настоящего изобретения. В настоящем описании приведены две иллюстративные схемы синтеза. Приведенная ниже схема 1 демонстрирует пример получения пептид-полимерных конъюгатов формулы I. Диаминное соединение 1, содержащее ацетальную группу, подвергают взаимодействию сN-гидроксисукцинимидилкарбонатом mPEG (т.е. соединением 2) с образованием дипегилированного соединения 3, которое впоследствии преобразуют в альдегид 4. Проводят взаимодействие полученного альдегидного соединения с пептидом Н-Р, имеющим свободную аминогруппу, путем восстановительного алкилирования, с получением пептид-полимерного конъюгата настоящего изобретения. Схема 1 Схема 2 демонстрирует пример получения пептид-полимерных конъюгатов формулы II. Химическое соединение 6 содержит полимерный фрагмент и альдегидную функциональную группу. Оно может быть подвергнуто взаимодействию с пептидом 7, имеющим свободную функциональную аминогруппу. Полученный продукт 8 затем восстанавливают, например, гидрированием или с помощью NaBH3CN с получением пептид-полимерного конъюгата 9. Схема 2 Приведенная ниже схема 3 является примером получения пептид-полимерного конъюгата формулыIII. Соединение 10, содержащее ацетальную группу, которое можно получить из -аминокислоты, подвергают взаимодействию с N-гидроксисукцинимидилкарбонатом mPEG2 с образованием пегилированного соединения 11, которое впоследствии преобразуют в альдегид 12. Проводят взаимодействие полученного альдегидного соединения с пептидом Н-Р, имеющим свободную аминогруппу, путем восстановительного алкилирования, с получением желаемого соединения 13. Схема 3 Проведение химических реакций, описанных выше, включает использование растворителей, реагентов, катализаторов, реактивов для создания защитных групп и снятия защитных групп, а также определенных условий реакции. Они могут дополнительно включать стадии, либо до, либо после стадий,специально описанных в настоящем описании, необходимые для добавления или удаления соответствующих защитных групп, чтобы в конечном итоге осуществлять синтез пептид-полимерного конъюгата. Кроме того, различные стадии синтеза можно проводить в другой последовательности или порядке, чтобы получать нужные полипептид-полимерные конъюгаты. Преобразования синтетической химии и методики работы с защитными группами (создание и снятие защиты), полезные при синтезе соответствующих пептид-полимерных конъюгатов, известны в данной области и включают, например, такие, как описано в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene andM. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John WileySons (1994) и L. Paquette, ed.,Encyclopedia of Reagents for Organic Synthesis, John WileySons (1995) и в их последующих изданиях. Синтезированный таким образом пептид-полимерный конъюгат можно дополнительно очищать таким методом, как ионообменная хроматография, гель-фильтрационная хроматография, электрофорез,диализ, ультрафильтрация или ультрацентрифугирование. Пептид-полимерный конъюгат настоящего изобретения может быть фармацевтически активен в форме конъюгата. Альтернативно, он может высвобождать фармацевтически активный пептид in vivo(например, путем гидролиза) в результате ферментативного расщепления связи между пептидным фрагментом и полимерным фрагментом. Примеры ферментов, принимающих участие в расщеплении связейin vivo, включают окислительные ферменты (например, пероксидазы, аминоксидазы или дегидрогеназы),восстановительные ферменты (например, кеторедуктазы) и гидролитические ферменты (например, протеазы, эстеразы, сульфатазы или фосфатазы). Таким образом, один из аспектов настоящего изобретения относится к способу введения эффективного количества одного или нескольких из описанных выше пептид-полимерных конъюгатов для лечения заболевания (например, инфекции HCV или HBV либо анемии). В частности, заболевание можно лечить путем введения субъекту одного или нескольких пептид-полимерных конъюгатов в эффективном количестве. Такой субъект может быть определен профессионалом в области здравоохранения на основании результатов любого подходящего метода диагностики. Используемый в настоящем описании термин "воздействие" или "лечение" определяют как применение или введение композиции, содержащей пептид-полимерный конъюгат, субъекту (человеку или животному), имеющему заболевание, симптом заболевания, вторичное по отношению к заболеванию заболевание или расстройство, или предрасположенность к заболеванию, с целью лечения, облегчения,уменьшения, устранения или улучшения состояния заболевания, симптома заболевания, вторичного по отношению к заболеванию заболевания или расстройства, или предрасположенности к заболеванию."Эффективное количество" означает количество пептид-полимерного конъюгата, которое оказывает терапевтический эффект на подвергаемого лечению субъекта. Терапевтический эффект может быть объективным (т.е. измеряемым при помощи определенных тестов или маркеров) или субъективным (т.е. субъект демонстрирует признаки или ощущает эффект). В применении на практике способа по настоящему изобретению композицию, содержащую один или несколько из указанных выше конъюгатов, можно вводить парентерально, перорально, через нос,ректально, местно или трансбуккально. Используемый в настоящем описании термин "парентерально" означает подкожную, внутрикожную, внутривенную, внутримышечную, внутрисуставную, внутриарте-6 020347 риальную, интрасиновиальную, интрастернальную, интратекальную, внутриочаговую, внутрибрюшинную, интратрахеальную или внутричерепную инъекцию, а также любой подходящий инфузионный метод. Стерильная инъекционная композиция может представлять собой раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. В числе приемлемых сред и растворителей, которые можно использовать, находятся маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют нелетучие масла (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны для создания инъецируемых препаратов, а также природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированном варианте. Такие масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергатор либо карбоксиметилцеллюлозу или аналогичные диспергирующие агенты. Для создания препарата можно также использовать другие обычно используемые поверхностно-активные вещества, такие как твины или спаны, или другие аналогичные эмульгаторы или усилители биодоступности, которые обычно используют в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм. Композиция для перорального введения может представлять собой любую приемлемую для перорального введения дозированную форму, включая капсулы, таблетки, эмульсии, а также водные суспензии, дисперсии и растворы. В случае таблеток обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют лубриканты, такие как стеарат магния. Для перорального введения в форме капсул полезные разбавители включают лактозу и сухой кукурузный крахмал. При пероральном введении водных суспензий или эмульсий активные ингредиенты можно суспендировать или растворять в масляной фазе в сочетании с эмульгаторами или суспендирующими агентами. При желании, можно добавлять определенные подсластители, отдушки или красители. Назальный аэрозоль или ингаляционную композицию можно получать способами, хорошо известными в области создания фармацевтических препаратов. Например, такую композицию можно получать в виде раствора в физиологическом растворе, используя бензиловый спирт или другие подходящие консерванты, усилители абсорбции для увеличения биодоступности, фторуглероды и/или другие солюбилизирующие или диспергирующие агенты, известные в данной области. Композицию, содержащую одно или несколько из указанных выше соединений, можно также вводить в форме суппозиториев для ректального введения. С одним или несколькими указанными выше активными конъюгатами, как правило, используют фармацевтически приемлемый носитель. Носитель в фармацевтической композиции должен быть "приемлемым" в том смысле, что он должен быть совместимым с активным ингредиентом композиции (и предпочтительно способным стабилизировать активный ингредиент) и не наносить ущерб субъекту, подвергающемуся лечению. Один или более солюбилизирующих агентов можно использовать в качестве фармацевтических эксципиентов для доставки указанного выше соединения. Примеры других носителей включают коллоидный оксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и красительDC Yellow10. Приведенные ниже примеры должны рассматриваться как чисто иллюстративные и никоим образом не ограничивающие оставшуюся часть раскрытия информации. Считается, что без дополнительных подробностей специалист в данной области может, исходя из приведенного описания, в полной мере использовать настоящее изобретение. Полное содержание всех публикаций, цитированных в настоящем описании, включено в него посредством ссылок. Пример 1. IFNди-PEG полимерный конъюгат. Получение ди-PEG альдегида 20 кД PEGO(C=O)OSu получали из 20 кД mPEGOH, приобретенного у (SunBio Inc., CA, USA), способом, описанным в Bioconjugate Chem. 1993, 4, 568-569. Раствор 6-(1,3-диоксолан-2-ил)гексан-1,5-диамина в дихлорметане (11,97 г раствора, содержащего 9,03 мг диамина, 47,8 мкмоль) добавляли в колбу, содержащую 20 кД PEGO(C=O)OSu (1,72 г,86,0 мкмоль). После полного растворения PEGO(C=O)OSu добавляли N,N-диизопропилэтиламин(79 мкл, 478 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч и затем по каплям добавляли метил-трет-бутиловый эфир (200 мл) при перемешивании. Образовавшийся осадок собирали и сушили в вакууме с получением ди-PEG-ацеталя (1,69 г, 98%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, d6-ДМСО)7,16 (т, J=5,2 Гц, 1 Н), 7,06 (д, J=8,8 Гц, 1 Н), 4,76 (т, J=4,8 Гц, 1 Н),-7 020347 Ди-PEG-ацеталь (4,0 г, 0,2 ммоль) суспендировали в буфере pH 2,0 (лимонная кислота, 40 мл). Реакционную смесь перемешивали при 35 С в течение 24 ч и затем экстрагировали дихлорметаном(350 мл). Объединенные органические слои сушили над сульфатом магния, концентрировали и затем снова растворяли в дихлорметане (20 мл). Раствор добавляли по каплям к метил-трет-бутиловому эфиру(400 мл) при перемешивании. Образовавшийся осадок собирали и сушили при пониженном давлении с получением ди-PEG альдегида (3,8 г, 95%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, d6-ДМСО)9,60 (с, 1 Н), 7,24 (д, J=8,4 Гц, 1 Н), 7,16 (т, J=5,2 Гц, 1 Н), 4,10-3,95(м, 4 Н), 3,95-3,80 (м, 1 Н), 3,00-2,85 (м, 2 Н), 2,58-2,36 (м, 2 Н), 1,46-1,15 (м, 6 Н). Альтернативно, ди-PEG альдегид получали следующим образом. Две аминогруппы коммерчески доступного гомолизина (Astatech Pharmaceutical Co., Ltd, China) защищали бензилоксикарбонилом. Гомолизин с N-защитой этерифицировали и восстанавливали с образованием альдегидного соединения. Затем альдегидную группу защищали с помощью этиленгликоля. Бензилоксикарбонильную защитную группу затем удаляли гидрированием в присутствии катализатора палладия. Соединение со снятой N-защитой подвергали взаимодействию с активированным mPEGOH(Sunbio Chemicals Co., Ltd., South Korea) в слабощелочных условиях. Полученный продукт перемешивали в лимоннокислом буфере pH 2,0 (Sigma-Aldrich, Germany) при 25 С в течение 72 ч для удаления альдегидной защитной группы. Получали 109 г альдегида ди-PEG полимера (выход: 95%). Чистота была более 97,7% (по данным ВЭЖХ) и более 95% (по данным 1 Н ЯМР анализа). Получение человеческого rhIFN- Ser17. Фрагмент ДНК, кодирующий человеческий IFN- Ser17, клонировали в экспрессионный вектор рЕТ 24 а для создания экспрессионной плазмиды rhIFN- Ser17-pET24a. Полученную экспрессионную плазмиду трансформировали в Е.coli и положительные трансформанты, т.е. клоны, несущие экспрессионную плазмиду, отбирали, культивировали и полученные культуры Е.coli хранили при -80 С. 10 мкл указанной выше сохраняемой культуры Е.coli инокулировали в 200 мл среды для посева, состоящей из среды Terrific Broth и глицерина, примерно на 15 ч при 37C и 200 об/мин. 150 мл полученной таким образом культуры Е.coli переносили в 2,5 л культуральной среды, содержащей глюкозу(1 M) для индукции экспрессии rhIFN- Ser17. Индуцированную культуру инкубировали при 37C и 300 об/мин в течение 3 ч. При необходимости в процессе инкубации к культуре Е.coli добавляли питательную среду, содержащую 800 г/л глюкозы и 20 г/л MgSO4. Культуру Е.coli, полученную, как описано выше, подвергали центрифугированию для сбора клеток Е.coli. Клетки ресуспендировали в буфере PBS (0,1 М Na2HPO4, 0,15 M NaCl) и разрушали в гомогенизаторе APV. Полученный таким образом гомогенизированный раствор центрифугировали при 10000 об/мин, 4C в течение 15 мин. Осадки (включая тельца включения) собирали, ресуспендировали вPBS и перемешивали при комнатной температуре в течение 20-30 мин для образования суспензии. NaOH(6 н.) добавляли к суспензии для доведения ее pH до 12, чтобы растворились белки, заключенные в тельца включения. Примерно через 2 мин pH суспензии доводили до 7,5 при помощи 6 н. HCl. Затем суспензию подвергали центрифугированию и полученный в результате супернатант собирали, определяя в нем концентрацию белка на спектрофотометре. Супернатант смешивали с буфером для рефолдинга (TEA, pH 8,3) и инкубировали при комнатной температуре без перемешивания в течение 24-48 ч. Затем его концентрировали и диализовали, используя TFF систему и кассету PLCCC, поставляемую Millipore, Inc. Полученный раствор подвергали ультрафильтрации, диализу и фракционированию на колонке с сефарозойSPFF. Полученные в результате фракции A9 и A10, содержащие рекомбинантный белок rhIFN- Ser17,затем фракционировали на другой колонке с сефарозой SPFF для обогащения рекомбинантным белком(во фракциях A8-A10). Содержащие rhIFN- Ser17 фракции затем очищали гель-фильтрацией (Superdex 75 HR 10/300) с получением белка rhIFN- Ser17 (1 мг/мл) с чистотой более 90%. Биологическая активность рекомбинантного белка составляла менее 2107 МЕ/мг белка. Получение IFNди-PEG полимерного конъюгата. 18,9 мг rhIFN- Ser17 и 1,51 г ди-PEG альдегида суспендировали в 26 мл 0,1 М натрий-фосфатного буфера (pH 5,0). К полученному раствору добавляли 400 экв. NaCNBH3 (Acros Organics, Belgium). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и затем подвергали диализу с 25 мМ трис-HCl (pH 7,8). Неочищенный продукт очищали на ионообменной колонке с получением 2 мгIFN-, функционально связанную с промотором Е.coli, инокулировали в 250 мл среды SYN (10 г/л добавки "select soytone", 5 г/л дрожжевого экстракта, 10 г/л NaCl) с добавлением 50 мкл/мл канамицина и 50 мкл/мл хлорамфеникола. Затем клетки культивировали при 37 С в инкубаторе с шейкером при 220 об/мин в течение ночи (т.е. 16 ч). 250 мл ночной культуры, указанной выше, инокулировали в 3,0 л минимальной среды (10 г/л глюкозы, 0,7 г/л MgSO47H2O, 4 г/л (NH4)2HPO4, 3 г/л KH2PO4, 6 г/л K2HPO4, 2 г/л цитрата, 10 г/л дрожжевого экстракта и 2 г/л изолейцина) с добавлением 10 г/л основной глюкозы, 0,7 г/л питательного MgSO4, 30 мл питательных микроэлементов (10 г/л FeSO47H2O, 2,25 г/л ZnSO47H2O, 1 г/л CuSO45H2O, 0,5 г/л(Bioflo 3000; Brunswick Scientation Co., Edison NJ). В процессе ферментации pH среды поддерживали на уровне pH 7,1 автоматизированным добавлением 37% раствора NH4OH. Содержание растворенного кислорода (DO) поддерживали на уровне 30%. Питательный раствор (800 г/л глюкозы, 20 г/л MgSO4,50 мкл/мл канамицина и 50 мкл/мл хлорамфеникола) добавляли, используя программно-управляемый насос, который был запрограммирован на подпитку в случае, когда уровень DO превышает 40-60. Когда плотность клеток (OD600) в ферментируемой культуре достигала 180-200, 4 мл 1 М изопропилD-1-тиогалактопиранозида (IPTG) добавляли к ферментируемой культуре для индукции экспрессии IFN-, совместно с 30 мл питательных микроэлементов и 25 г дрожжевого экстракта. Клетки собирали центрифугированием через 5 ч после индукции IPTG. Клеточные осадки суспендировали в буфере PBS (0,1 М фосфат натрия, 0,15 М хлорид натрия, pH 7,4) в приблизительном соотношении 1:3 (г мокрой массы/мл), разрушали микрофлюидизатором и затем центрифугировали при 10000 об/мин в течение 20 мин при 4 С. Осадок, содержащий тельца включения(IB), дважды промывали буфером PBS, центрифугировали, как описано выше, и суспендировали в 1 л раствора PBS (0,1 М фосфат натрия, 0,15 М хлорид натрия, pH 7,4, 3% zwittergent 3-14, 5 мМ ДТТ). После перемешивания в течение 30 мин pH суспензии доводили до 12 при помощи 6 М NaOH, перемешивая для растворения осадка. Затем pH суспензии доводили до pH 7,5 при помощи 6 н. HCl. После центрифугирования при 10000 об/мин в течение 20 мин собирали супернатант, содержащий растворимый IFN-. Затем проводили рефолдинг растворимого IFN- следующим образом. Указанный выше супернатант разбавляли в 10 л свежеприготовленного буфера для рефолдинга (100 мМ трис-HCl (pH 1,6), 0,5 МL-аргинин, 2 мМ EDTA) с получением рефолдинговой смеси. Смесь инкубировали в течение 48 ч без перемешивания. После инкубации смесь, содержащую заново свернутый рекомбинантный IFN-, диализовали против 20 мМ трис-буфера (с 100 мМ NaCl, 0,05% zwittergent 3-14, pH 7,0). Диализованную смесь наносили на колонку с SP-сефарозой (GE Amersham Pharmacia), которую предварительно уравновешивали и промывали 20 мМ трис-HCl буфером с 100 мМ NaCl (pH 7,0). IFNэлюировали раствором, содержащим 20 мМ трис-HCl буфер (pH 7,0) и 200 мМ NaCl. Фракции, содержащие IFN-, собирали, основываясь на их оптической плотности при 280 нм. Содержащийся в них IFNдополнительно очищали на колонке с гидрофобным взаимодействием (GE healthcare, Butyl Sepharose FastFlow), которую предварительно уравновешивали и промывали раствором, содержащим 1 М сульфат аммония, 20 мМ ацетат натрия и 0,05% zwittergent (pH 4,5). IFN- элюировали раствором, содержащим 0,5 М сульфат аммония и 20 мМ ацетат натрия. Фракции, содержащие белок, собирали, основываясь на их оптической плотности при 280 нм. Полученные фракции объединяли и концентрацию IFN- определяли белковым анализом ВСА (ВСА Protein assay, Pierce). Получение конъюгата PEG-IFN-. К раствору ди-PEG альдегида (296 мг, 7,4 мкмоль) в воде (1,46 мл) добавляли 2 М натрийфосфатный буфер (pH 4,0, 0,37 мл), zwittergent 3-14 (1,48 мл, 10% в воде) и IFN- (14,8 мг в 3,7 мл буфера с pH 4,5, содержащего 20 мМ ацетат натрия, 0,7% сульфат аммония и 0,05% детергент). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем добавляли водный раствор цианоборгидрида (400 мМ, 92,5 мкл, 37 мкмоль). Реакционную смесь перемешивали в темноте в течение 40 ч и очищали хроматографией на SP HP сефарозе. Фракции, содержащие желаемый конъюгат PEGIFN-, собирали, основываясь на их времени удержания и оптической плотности при 280 нм. Концентрацию конъюгата определяли белковым анализом ВСА (ВСА Protein assay, Pierce). Фармакокинетические исследования на крысах. Проводили фармакокинетическое исследование на крысиной модели, чтобы сравнить время полужизни в сыворотке IFN- и PEG-IFN-. Самцам крыс (250-350 г) вводили внутривенно в дозе 600 мкг/кг массы IFN- (n=3) и PEG-IFN- (n=3). Кровь (250 мкл) собирали от каждой крысы перед введением и через 0,1, 1, 2, 4, 6, 10, 24, 48, 72 и 96 ч после введения. Из крови получали образцы сыворотки и количества IFN-, содержащиеся в образцах, анализировали иммуноферментным анализом (ELISA). Время полужизни в сыворотке IFN- и PEG-IFN- составляло 2 и 20 ч соответственно, рассчитанное, исходя из концентрации в сыворотке в последних трех временных точках. Пример 2. EPO-PEG полимерный конгьюгат. Получение PEG-EPO. К раствору ди-PEG альдегида (267 мг, 6,1 мкмоль) в воде (2,67 мл) добавляли 2 М натрийфосфатный буфер (pH 4,0, 1 мл) и EPO (10 мг в 3,03 мл буфера, pH 7,3, содержащего 20 мМ фосфат натрия и 150 мМ NaCl). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин с последующим добавлением водного раствора цианоборгидрида натрия (400 мМ, 100 мкл, 40 мкмоль). Реакционную смесь перемешивали в темноте в течение 17 ч и очищали на колонке с SP Toyopearl(Tosoh). Колонку уравновешивали 20 мМ натрий-ацетатным буфером, pH 4,5. Реакционную смесь разбавляли до концентрации 0,3-0,4 мг/мл и наносили на колонку с SP Toyopearl. Фракции, содержащие желаемый конъюгат PEG-EPO, собирали, основываясь на их времени удержания и оптической плотности при 280 нм. Концентрацию конъюгата определяли поглощением в УФ-области при 280 нм. Фармакокинетические исследования на крысах. Проводили фармакокинетическое исследование на крысиной модели, чтобы сравнить время полужизни в сыворотке EPO и PEG-EPO. Самцам крыс (250350 г) вводили внутривенно EPO (n=5) иPEG-EPO (n=5) в дозе 25 мкг/кг массы. Кровь (250 мкл) собирали от каждой крысы перед введением и через 0,088, 0,75, 1,5, 3, 6, 10, 24 и 48 ч после введения. При введении крысам PEG-EPO образцы крови дополнительно собирали через 72 и 96 ч после введения. Из крови получали образцы сыворотки и анализировали иммуноферментным анализом (ELISA) для определения содержащихся в них количеств EPO. Результаты свидетельствуют, что время полужизни в сыворотке EPO составляло 9 ч, тогда как дляPEG-EPO оно значительно увеличивалось, т.е. составляло 38 ч. Получение EPO-PEG полимерного конъюгата. 0,2 мг EPO (Cashmere Scientific Company, Taiwan) и 4 мг ди-PEG альдегида (20 экв.) суспендировали в 0,1 М фосфатном буфере (pH 5,0). К полученному раствору добавляли 400 экв. NaCNBH3. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Данные ВЭЖХ подтвердили образование EPO-ди-PEG полимера. Пример 3. GH-PEG полимерный конгьюгат. Получение Met-hGH. Трансформированные клетки E.coli BLR (DE3)-RIL, способные экспрессировать Met-hGH, культивировали согласно методу ферментации, описанному выше, для экспрессии Met-hGH. Клетки собирали центрифугированием и клеточный осадок суспендировали в ТЕ буфере (50 мМ трис-HCl, 1 мМ EDTA, pH 8,0) в приблизительном соотношении 1:3 (г мокрой массы/мл). После этого клетки разрушали микрофлюидизатором и затем центрифугировали при 10000 об/мин в течение 20 мин. Осадок, содержащий тельца включения (IB), дважды промывали буфером TED (50 мМ трис-HCl, 1 мМMilliQ воде и центрифугировали при 20000 об/мин в течение 15 мин. IB суспендировали в 400 мл 50 мМ раствора TUD (50 мМ трис-HCl, 4 М мочевина, 2,5 мМ ДТТ, pH 10,0) и суспензию центрифугировали при 20000 об/мин в течение 20 мин; супернатант собирали. Супернатант разводили в 2,0 л свежеприготовленного буфера для рефолдинга (50 мМ трис-HCl,0,5 мМ EDTA, 5% глицерин, смесь 10 мМ GSH/1 мМ GSSG, pH 8,0). Полученную таким образом смесь инкубировали в течение 36 ч без перемешивания и затем диализовали против 20 мМ трис-буфера(pH 7,0). Диализованную смесь, содержащую Met-hGH, наносили на колонку с Q-сефарозой (GE AmershamPharmacia, Pittsburgh, PA), которую заранее уравновешивали и промывали 20 мМ трис-HCl буфером,pH 7,0. Met-hGH элюировали раствором, содержащим 20 мМ трис-HCl буфер, pH 7,0,и 100 мМ NaCl. Фракции, содержащие Met-hGH, определенные по их оптической плотности при 280 нм, собирали, объединяли и наносили на колонку с гидрофобным взаимодействием (GE Amersham Pharmacia, Pittsburgh,PA), заранее уравновешенную и промытую 20 мМ натрий-ацетным буфером (pH 7,0) при скорости потока 5 мл/мин. Met-hGH элюировали раствором, содержащим 20 мМ натрий-ацетный буфер и 150 мМ сульфат аммония. Фракцию, содержащую Met-hGH, собирали и проводили белковый анализ ВСА(ВСА Protein assay, Pierce) для определения концентрации Met-hGH. Получение конъюгата PEG-Met-hGH. К раствору ди-PEG альдегида (74 мг, 1,7 мкмоль) в воде (387 мкл) добавляли 2 М натрийфосфатный буфер (pH 4,0, 374 мкл) и человеческий GH (22,4 мг в 6,5 мл буфера, pH 4,5, содержащего 20 мМ ацетат натрия и 150 мМ NaCl). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин с последующим добавлением водного раствора цианоборгидрида натрия (400 мМ,140 мкл, 56 мкмоль). Реакционную смесь перемешивали в темноте в течение 17 ч и очищали хроматографией на SP XL сефарозе. Фракции, содержащие желаемый полимер-белковый конъюгат, собирали,основываясь на их времени удержания и оптической плотности при 280 нм. Концентрацию конъюгата определяли при помощи набора для определения белков методом Брэдфорд (Pierce, Rockford, IL). Фармакокинетические исследования на крысах. Проводили фармакокинетическое исследование на крысиной модели, чтобы сравнить время полужизни в сыворотке Met-hGH и PEG-Met-hGH. Самцам крыс (250-350 г) вводили внутривенно MethGH (n=5) или PEG-Met-hGH (n=5) в дозе 100 мкг/кг веса. Образцы крови собирали у крыс, которым вводили Met-hGH, до введения и через 0,083, 1, 2, 4, 8, 12 и 24 ч после введения; и у крыс, которым вводили PEG-Met-hGH, до введения и через 0,33, 1, 4, 8, 12, 24, 48, 72 и 96 ч после введения. Из крови получали образцы сыворотки и анализировали иммуноферментным анализом (ELISA) для определения концентраций hGH. Время полужизни Met-hGH и PEG-Met-hGH составляло 3 и 35 ч соответственно. Другие варианты осуществления. Все признаки, раскрытые в данном описании, можно объединять в любой комбинации. Каждый признак, раскрытый в данном описании, можно заменять другим признаком, служащим той же, эквивалентной или аналогичной цели. Таким образом, если прямо не указано иное, каждый раскрытый признак является только примером конкретной группы эквивалентных или аналогичных признаков. Исходя из приведенного выше описания, специалист в данной области может легко установить основные характеристики настоящего изобретения и, не отходя от его сущности и объема, сможет вносить различные изменения и модификации в настоящее изобретение, чтобы адаптировать его к различным способам применения и условиям. Таким образом, другие варианты осуществления также входят в объем прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептид-полимерный конъюгат следующей формулы: где каждый из R1, R2, R3, R4 и R5 представляет собой Н; каждый из А 1 и А 2 независимо представляет собой полиэтиленгликолевый фрагмент; каждый из G1 и G2 представляет собой связывающую функциональную группу:P выбирают из группы, состоящей из фрагмента интерферона- (INF-), фрагмента эритропоэтина(EPO) и фрагмента гормона роста (GH), при этом атом азота на N-конце P связан с G3;m равно 0 или целому числу от 1 до 10;n равно целому числу от 1 до 10. 2. Конъюгат по п.1, где P представляет собой фрагмент интерферона-. 3. Конъюгат по п.2, где P представляет собой rINF- Ser17. 4. Конъюгат по п.2, где P представляет собой фрагмент модифицированного интерферона-, содержащего 1-4 дополнительных аминокислотных остатка на N-конце. 5. Конъюгат по п.1, где P представляет собой фрагмент эритропоэтина. 6. Конъюгат по п.1, где каждый из A1 и A2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 2-100 кД. 7. Конъюгат по п.6, где каждый из A1 и A2 представляет собой фрагмент полиэтиленгликоля с молекулярной массой 10-30 кД. 8. Конъюгат по п.1, где m равно 4, n равно 2. 9. Конъюгат по п.8, где P представляет собой фрагмент интерферона-. 10. Конъюгат по п.9, где P представляет собой rINF- Ser17. 11. Конъюгат по п.9, где P представляет собой фрагмент модифицированного интерферона-, со- 11020347 держащего 1-4 дополнительных аминокислотных остатка на N-конце. 12. Конъюгат по п.8, где P представляет собой фрагмент эритропоэтина. 13. Конъюгат по п.8, где P представляет собой фрагмент гормона роста. 14. Конъюгат по п.1, где P представляет собой фрагмент гормона роста. 15. Конъюгат по п.1, представляющий собой где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД. 16. Конъюгат по п.1, представляющий собой где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД. 17. Конъюгат по п.1, представляющий собой где mPEG представляет собой фрагмент метоксиблокированного полиэтиленгликоля с молекулярной массой 20 кД.
МПК / Метки
МПК: C08G 65/28, A61K 47/34, A61K 47/42, C08G 65/325, C08H 1/00, C08G 65/32
Метки: пептид-полимерные, конъюгаты
Код ссылки
<a href="https://eas.patents.su/13-20347-peptid-polimernye-konyugaty.html" rel="bookmark" title="База патентов Евразийского Союза">Пептид-полимерные конъюгаты</a>