Синтез дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидиндиолов
Номер патента: 19735
Опубликовано: 30.05.2014
Авторы: Тампоне Томас Г., Фрутос Рохелио Перес, Кришнамурти Дайлипкумар, Малдер Джейсон Алан, Сенанаяке Крис Хью
Формула / Реферат
1. Способ получения соединения формулы I

включающий:
(а) реакцию исходного соединения формулы II
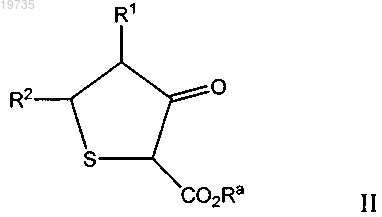
с мочевиной в присутствии кислоты и растворителя с получением промежуточного продукта формулы IV
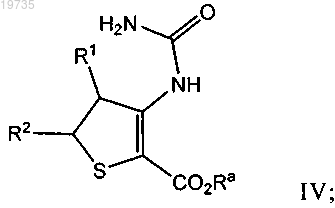
(b) циклизацию промежуточного продукта формулы IV с основанием с получением конечного продукта формулы I, в которой R1 и R2 независимо выбраны из группы, включающей Н, -С1-10-алкил, -С3-8-циклоалкил, -С6-12-арил, 5-8-членный моноциклический гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, 8-11-членный бициклический гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, 4-8-членный моноциклический гетероциклоалкил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, 8-11-членный бициклический гетероциклоалкил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, галоген, -С1-10-алкоксигруппу,
-С6-12-арилоксигруппу, -С3-8-циклоалкоксигруппу, 5-8-членную гетероарилоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, -С3-8-гетероцикло-С1-10-алкоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, -NO2, -NRR', галоген(С1-10)алкил, галоген(С1-10)алкоксигруппу, -SH, -S-(С1-10)алкил, -SO2-(С1-10)алкил,
-SO2NH2, -SO2NH-(C1-10)алкил и -SO2N-((C1-10)алкил)2;
где R и R' все независимо выбраны из группы, включающей Н или -(C1-10)алкил;
в которой Ra выбран из группы, включающей Н, -(C1-10)алкил и -С6-12-арил.
2. Способ по п.1, в котором R1 и R2 независимо выбраны из группы, включающей Н, -С1-10-алкил, -С6-12-арил, -C1-10-алкоксигруппу, галоген, галоген(C1-10)алкил, галоген(C1-10)алкоксигруппу и -NRR', где R и R' все независимо выбраны из группы, включающей Н или -C1-10-алкил.
3. Способ по п.1 или 2, в котором Ra обозначает -C1-10-алкил, выбранный из группы, включающей метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил.
4. Способ по одному из пп.1-3, в котором кислота выбрана из группы, включающей уксусную кислоту, трифторуксусную кислоту, хлорную кислоту, толуолсульфоновую кислоту, бромисто-водородную кислоту, хлористо-водородную кислоту, серную кислоту и азотную кислоту.
5. Способ по одному из пп.1-4, в котором кислотой является хлористо-водородная кислота.
6. Способ по одному из пп.1-5, в котором основание выбрано из группы, включающей основания-гидриды металлов, основания-гидроксиды металлов, карбонаты металлов, основания-алкоксиды металлов и основания-фосфаты металлов.
7. Способ по п.6, в котором основанием является MeONa.
8. Способ по п.6, в котором основанием является NaOH.
9. Способ по п.1, в котором соединение формулы I представляет собой
6,7-дигидротиено[3,2-d]пиримидин-2,4-диол;
6-метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол;
6-этил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол;
6-фенил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол;
6,6-диметил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол или
7-метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол.
10. Способ по п.1, в котором промежуточный продукт формулы IV выделяют перед циклизацией на стадии (b).
11. Способ по п.10, в котором выделенный промежуточный продукт формулы IV также очищают по методике, известной в данной области техники.
12. Способ по п.11, в котором методикой, известной в данной области техники, является колоночная хроматография, ВЭЖХ или перекристаллизация.
13. Способ по п.1, в котором промежуточный продукт формулы IV не выделяют перед циклизацией на стадии (b).
14. Способ по п.1, в котором растворителем на стадии (а) является спирт или смесь спиртов.
15. Способ по п.14, в котором спиртом или смесью спиртов является метанол, этанол, изопропанол, н-пропанол, бутанол или их смеси.
16. Способ по п.14, в котором реакцию проводят при температуре от 0°С до температуры кипения растворителя.
17. Способ по п.14, в котором для завершения стадии (а) требуется от 0,5 до 24 ч.
18. Способ по п.1, в котором растворителем на стадии (b) является вода, спирт или смесь спиртов.
19. Способ по п.18, в котором спиртом или смесью спиртов является метанол, этанол, изопропанол, н-пропанол, бутанол или их смеси.
20. Способ по п.18, в котором реакцию циклизации (b) проводят при температуре от 0°С до температуры кипения растворителя.
21. Способ по п.18, в котором для завершения реакции циклизации (b) требуется от 0,5 до 24 ч.
Текст
В изобретении описан улучшенный способ получения дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидиндиолов, который является эффективным и характеризующимся высоким выходом и для которого не требуются дорогостоящие и потенциально нестабильные промежуточные продукты. Диолы используют в качестве промежуточных продуктов для синтеза пиримидинов, которые ингибируют PDE4 и поэтому применимы для лечения респираторных или желудочно-кишечных заболеваний и нарушений и заболеваний и нарушений периферической или центральной нервной системы, воспалительных патологических состояний и раковых заболеваний.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Перекрестная ссылка на родственные заявки По настоящему изобретению испрашивается приоритет по предварительной заявке U.S.61/052816, поданной 13 мая 2008 г., содержание которой включено в настоящее изобретение в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к улучшенному способу получения дигидротиено[3,2d]пиримидиндиолов, в частности 6,7-дигидротиено[3,2-d]пиримидин-2,4-диола и сходных пиримидиндиолов. Точнее, настоящее изобретение относится к способу получения пиримидиндиолов посредством эффективной и характеризующейся высоким выходом реакции, для которой не требуются дорогостоящие и потенциально нестабильные промежуточные продукты. Пиримидиндиолы применимы для различных целей, в том числе в качестве промежуточных продуктов синтеза лекарственных средств. Уровень техники Дигидротиенопиримидины обычно синтезируют из дигидротиено[3,2-d]пиримидиндиолов, например, как это описано в публикации патента U.S. 2007/0259846 и WO 2006/111549. Для синтеза промежуточных дигидротиено[3,2-d]пиримидиндиолов необходимо использовать эффективную реакцию, для которой не требуются дорогостоящие и потенциально нестабильные промежуточные продукты и которая также позволяет получить искомый продукт с высоким выходом и чистотой. Например, в патенте U.S. 3318881 описана конденсация метилового эфира кетодигидротиофен-2-карбоновой кислоты с Sэтилизотиомочевиной с образованием 2-этилсульфанил-6,7-дигидротиено[3,2-d]пиримидин-4-ола, который затем можно подвергнуть кислому гидролизу и получить дигидротиено[3,2-d]пиримидиндиол, как это описано в публикации патента U.S.2007/0259846. Однако этот способ приводит лишь к умеренным выходам и для него необходима S-этилизотиомочевина или другие S-алкилизотиомочевины, которые дорогостоящи и ограниченно доступны и приводят к неприятным запахам, связанным с выделением этантриола при кислом гидролизе. Попытки заменить в реакции конденсации S-алкилизотиомочевину на менее дорогую мочевину оказались безуспешными вследствие плохих выходов, например, как это описано в публикации Ohno et al. (1986) Chem. Pharm Bull., 34:4150. Другие пиримидины можно синтезировать из пиримидин-2,4-диолов, таких как 6,7-дигидро-5Hциклопентапиримидин-2,4-диол, с умеренными выходами. Например, диолы, описанные в публикацииSekiya et al. (1980) Eur. J. Med. Chem., 15, 4: 317, использовали для получения производных 2,4-диамино 5,6-полиметиленпиримидина, предназначенных для использования в качестве гипогликемических, гипотензивных и анорексигенных средств. Однако вследствие рассмотренных выше ограничений в данной области техники сохраняется необходимость в улучшенных и эффективных способах синтеза промежуточных диолов. Краткое изложение сущности изобретения Настоящее изобретение относится к улучшенному и характеризующемуся высоким выходом способу получения дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидин-2,4-диолов. Раскрытый способ получения соединения формулы I включает реакцию исходного соединения формулы II с мочевиной в присутствии кислоты с получением промежуточного продукта формулы IV и циклизацию промежуточного продукта формулы IV с основанием с получением конечного продукта формулы I. Кислоту можно выбрать из числа следующих: уксусная кислота, трифторуксусная кислота, хлорная кислота, толуолсульфоновая кислота, бромисто-водородная кислота, хлористо-водородная кислота, серная кислота и азотная кислота. В предпочтительном варианте осуществления кислотой является хлори-1 019735 сто-водородная кислота. Основание можно выбрать из группы, включающей основания-гидриды металлов, основания-алкоксиды металлов и основания-фосфаты металлов. В предпочтительном варианте осуществления основанием является MeONa. В другом предпочтительном варианте осуществления основанием является NaOH. В одном варианте осуществления настоящего изобретения соединение формулы I представляет собой 6,7-дигидротиено[3,2-d]пиримидин-2,4-диолIf). Указанные выше и дополнительные особенности и преимущества настоящего изобретения станут понятными после рассмотрения приведенного ниже подробного описания его конкретных вариантов осуществления. Подробное описание изобретения Ниже подробно описаны предпочтительные в настоящее время варианты осуществления настоящего изобретения и примеры, которые предназначены для разъяснения основных положений настоящего изобретения. Эти варианты осуществления описаны настолько подробно, чтобы специалисты в данной области техники могли осуществить настоящее изобретение и понять, что можно использовать другие варианты осуществления и что без отклонения от сущности и объема настоящего изобретения в него можно внести структурные, физические и химические изменения. Если не приведены другие определения, то все технические и научные термины, использующиеся в настоящем изобретении, обладают такими же значениями, которые известны специалисту с общей подготовкой в области техники, к которой относится настоящее изобретение. Хотя при осуществлении и проверке настоящего изобретения можно использовать любые способы и материалы, сходные с описанными в настоящем изобретении или эквивалентные им, ниже описаны предпочтительные способы, устройства и материалы. В настоящем изобретении используются следующие аббревиатуры:t=трет; ТСХ=тонкослойная хроматография. Терминам, специально не определенным в настоящем изобретении, следует придавать значения,которые им должен придать специалист в данной области техники с учетом раскрытия и контекста. Например, "С 1-С 6-алкоксигруппа" означает С 1-С 6-алкил с концевым атомом кислорода, такой как метоксигруппу, этоксигруппу, пропоксигруппу, пентоксигруппу и гексоксигруппу. Все алкильные, алкиленовые или алкинильные следует понимать как разветвленные или неразветвленные, если это возможно для структуры и если не указано иное. Другими более конкретными определениями являются следующие. Термин "алкил" означает насыщенный алифатический радикал, содержащий от 1 до 10 атомов углерода,или моно- или полиненасыщенный алифатический углеводородный радикал, содержащий от 2 до 12 атомов углерода, если не указано иное. Моно- или полиненасыщенный алифатический углеводородный радикал содержит по меньшей мере одну двойную или тройную связь соответственно. Примеры "алкила" включают алкильные группы, которыми являются обладающие линейной цепью алкильные группы, содержащие от 1 до 8 атомов углерода, и обладающие разветвленной цепью алкильные группы, содержащие от 3 до 10 атомов углерода. Другие примеры включают низш. алкильные группы, которыми являются обладающие линейной цепью алкильные группы, содержащие от 1 до 6 атомов углерода, и обладающие разветвленной цепью алкильные группы, содержащие от 3 до 6 атомов углерода. Следует понимать,что любой комбинированный термин, содержащий приставку "алк" или "алкил", означает аналоги, соответствующие приведенному выше определению "алкила". Например, такие термины, как "алкоксигруппа", "алкилтиогруппа" означают алкильные группы, связанные со второй группой через атом кислорода или серы. "Алканоил" означает алкильную группу, присоединенную к карбонильной группе (С=O). Каждый алкил или аналог алкила, описанный в настоящем изобретении, следует понимать как необязательно частично или полностью галогенированный. Термин "циклоалкил" означает циклический аналог алкильной группы, определенной выше. Примерами циклоалкильных групп являются насыщенные или ненасыщенные неароматические циклоалкильные группы, содержащие от 3 до 8 атомов углерода, и другие примеры включают циклоалкильные группы, содержащие от 3 до 6 атомов углерода. Примеры "циклоалкила" включают, например, циклопропил, циклопентил и циклогексил. Термин "гетероциклоалкил" означает стабильный 4-8-членный (но предпочтительно 5- или 6 членный) моноциклический или 8-11-членный бициклический гетероциклический радикал, который мо-2 019735 жет быть насыщенным или ненасыщенным и является неароматическим. Каждый гетероцикл состоит из атомов углерода от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Гетероцикл может быть присоединен с помощью любого атома цикла, если это приводит к образованию стабильной структуры. Примеры "гетероциклоалкила" включают такие радикалы, как пирролинил, пирролидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил,индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил, гексагидропиримидинил,гексагидропиридазинил,дигидрооксазолил,1,2-тиазинанил-1,1-диоксид,1,2,6 тиадиазинанил-1,1-диоксид, изотиазолидинил-1,1-диоксид и имидазолидинил-2,4-дион. Термин "галоген" означает бром, хлор, фтор или йод. При использовании выше или во всем настоящем изобретении "азот" и "сера" включают любую окисленную форму азота и серы и кватернизованную форму любого основного атома азота. Термин "арил" следует понимать как означающий 6-12-членный ароматический карбоцикл, который может представлять собой одно кольцо или несколько колец, сконденсированных друг с другом или связанных ковалентно. Термин "арил" включает, например, фенил и нафтил; другие термины, включающие "арил", характеризуются таким же определением арильного компонента, примеры этих фрагментов включают арилалкил, арилоксигруппу или арилтиогруппу. Термин "гетероарил" означает стабильный 5-8-членный (но предпочтительно 5- или 6-членный) моноциклический или 8-11-членный бициклический ароматический гетероциклический радикал. Каждый гетероцикл состоит из атомов углерода от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Гетероарильная группа может быть присоединена с помощью любого атома цикла,если это приводит к образованию стабильной структуры. Примеры "гетероарила" включают такие радикалы, как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, индолизинил, индолил, изоиндолил, бензофуранил, бензотиенил, индазолил, бензимидазолил,бензтиазолил, бензоксазолил, пуринил, хинолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинил, карбазолил, акридинил, феназинил, фенотиазинил и феноксазинил. Термины "необязательный" или "необязательно" означают, что описанное после этого событие или обстоятельства могут осуществиться или не осуществиться и что описание включает случаи, когда событие или обстоятельства осуществляются, и случаи, когда событие или обстоятельства не осуществляются. Например, "необязательно замещенный арил" означает, что арильный радикал может быть и может не быть замещенным и что описание включает и замещенные арильные радикалы, и арильные радикалы,которые не замещены. Настоящее изобретение относится к новой стратегии синтеза дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидин-2,4-диолов, которая приводит к более высоким выходам, более эффективным реакциям и устраняет множество из затруднений, присущих предшествующему уровню техники, связанных с крупномасштабным производством дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидин 2,4-диолов. Эта стратегия дает эффективную схему синтеза, для которой не требуются дорогостоящие или потенциально нестабильные промежуточные продукты и которую при необходимости можно провести в однореакторном режиме. В настоящем изобретении описаны способы получения соединений формул I и X. Соединения,предлагаемые в настоящем изобретении, можно получить по общим методикам и в соответствии с примерами, приведенными ниже, и по дополнительным методикам, известным специалистам с общей подготовкой в данной области техники. Оптимальные условия проведения и длительность реакций могут меняться в зависимости от конкретных использующихся реагентов. Если не указано иное, то растворители,температуры, давления и другие условия проведения реакций может легко выбрать специалист с общей подготовкой в данной области техники. За протеканием реакции можно следить с помощью обычных методик, таких как ТСХ или ВЭЖХ. Промежуточные и конечные продукты можно очистить по методикам, известным в данной области техники, включая колоночную хроматографию, ВЭЖХ или перекристаллизацию. Предпочтительными способами являются технологии получения дигидротиено[3,2d]пиримидиндиола формулы I, например в которой R1 и R2 независимо выбраны из группы, включающей Н, алкил, циклоалкил, арил, гетероарил, гетероциклоалкил, галоген, алкоксигруппу, арилоксигруппу, циклоалкоксигруппу, гетероарилоксигруппу, гетероциклоалкоксигруппу, -NO2, -NRR', галогеналкил, галогеналкоксигруппу, -SH, -S-алкил,-SO2-алкил, -SO2NH2, -SO2NH-алкил и -SO2N(алкил)2, предпочтительно из группы, включающей H, алкил, алкоксигруппу, галоген, галогеналкил, галогеналкоксигруппу и -NRR'; и где R и R' обозначают Н или алкил. Как показано на схеме 1, в одном варианте осуществления настоящего изобретения соединения формулы I можно получить, начиная с катализируемой кислотой конденсации алкилового эфира 3 кетодигидротиофен-2-карбоновой кислоты формулы II, в которой Ra обозначает алкил, и мочевины (III),с получением алкилового эфира 3-уреидодигидротиофен-2-карбоновой кислоты формулы IV. Затем соединение формулы IV циклизуют и получают дигидротиено[3,2-d]пиримидиндиол формулы I. Циклизацию предпочтительно проводят в щелочной среде. Реакции конденсации и циклизации можно проводить на отдельных стадиях или можно объединить в однореакторной процедуре. Продукт, соединение формулы I, можно дополнительно модифицировать по методикам, известным в данной области техники, и получить дополнительные соединения, такие как дигидротиено[3,2-d]пиримидины. Схема 1 Реакцию конденсации соединений формул II и III проводят в присутствии кислотного катализатора,например уксусной кислоты, трифторуксусной кислоты, хлорной кислоты, толуолсульфоновой кислоты,бромисто-водородной кислоты, хлористо-водородной кислоты, серной кислоты или азотной кислоты. В предпочтительном варианте осуществления кислотой является хлористо-водородная кислота. В качестве растворителя можно использовать спирт или смесь спиртов, например метанол, этанол, изопропанол, нпропанол, бутанол и т.п. Метанол является предпочтительным спиртовым растворителем. Реакцию можно провести при температурах от 0 С до температуры кипения растворителя и для ее завершения обычно требуется от 0,5 до 24 ч, предпочтительно примерно 2-6 ч и более предпочтительно примерно 4-6 или примерно 3-5 ч. Реакцию можно провести при нормальном давлении или при пониженном или повышенном давлении. Описанная выше реакция дает алкиловый эфир 3-уреидо-дигидротиофен-2-карбоновой кислоты формулы IV, который в этот момент можно выделить или можно оставить в сосуде для проведения реакции для выполнения однореакторной процедуры. Выделение может быть полезно, когда желательно удаление примесей до проведения циклизации, но оно не является обязательным. С выделением или без выделения соединение формулы IV циклизуют предпочтительно в присутствии основания, в подходящем растворителе, таком как вода или спирт, например метанол, этанол, изопропанол, н-пропанол, бутанол и т.п. Неограничивающие примеры подходящих неорганических оснований включают гидриды металлов (например, NaH), гидроксиды металлов (например, NaOH, KOH), алкоксиды металлов (например, MeONa, t-BuOK и Na-трет-амилат), карбонаты металлов (например,Na2CO3, K2CO3, Cs2CO3) и фосфаты металлов (например, K3PO4). В предпочтительном варианте осуществления основанием является MeONa и растворителем является метанол. В другом предпочтительном варианте осуществления основанием является NaOH и растворителем является вода. Реакцию можно провести при температурах от 0 С до температуры кипения растворителя и для ее завершения обычно требуется от 0,5 до 24 ч, предпочтительно примерно от 0,5 до 5 ч, более предпочтительно примерно 1-3 ч и еще более предпочтительно примерно 1-2 ч. Реакцию можно провести при нормальном давлении. Описанная выше реакция дает дигидротиено[3,2-d]пиримидиндиол формулы I. Описанная выше схема реакций (схема 1) предпочтительнее других известных методик синтеза дигидротиено[3,2-d]пиримидиндиолов формулы I в том, что она приводит к большему выходу, более эффективна и более экономична, поскольку в ней используется мочевина, которая является недорогой и доступной, вместо более дорогостоящих реагентов, таких как гидробромид S-этилизотиомочевины. В способе, предлагаемом в настоящем изобретении, также исключается образование неприятного запаха,связанного с выделением этантриола в известных способах. Кроме того, способ, предлагаемый в настоящем изобретении, обеспечивает другое преимущество, заключающееся в том, что алкиловый эфир 3 уреидо-дигидротиофен-2-карбоновой кислоты формулы IV является твердым промежуточным продуктом, обладающим повышенной стабильностью, что при необходимости обеспечивает его выделение и длительное хранение. Алкиловый эфир дигидротиофенкарбоновой кислоты формулы II можно получить по методикам,известным в данной области техники. Например, тиол формулы V и сложный эфир формулы VI можно ввести в реакцию и получить простой тиоэфир алкилового эфира карбоновой кислоты формулы VII, который затем можно циклизовать и получить алкиловый эфир дигидротиофенкарбоновой кислоты формулы II. Неограничивающая типичная процедура представлена на схеме 2. Схема 2 Пиримидиндиолы указанных выше вариантов осуществления можно использовать в качестве промежуточных продуктов для синтеза лекарственных средств, таких как ингибиторы PDE4 (фосфодиэстераза 4), по методикам, известным в данной области техники. В одном варианте осуществления настоящего изобретения способ получения соединения формулы I(а) реакцию исходного соединения формулы II с мочевиной в присутствии кислоты с получением промежуточного продукта формулы IV(b) циклизацию промежуточного продукта формулы IV с основанием с получением конечного продукта формулы I, в которой R1 и R2 независимо выбраны из группы, включающей Н, алкил, циклоалкил,арил, гетероарил, гетероциклоалкил, галоген, алкоксигруппу, арилоксигруппу, циклоалкоксигруппу, гетероарилоксигруппу, гетероциклоалкоксигруппу, -NO2, -NRR', галогеналкил, галогеналкоксигруппу, -SH,-S-алкил, -SO2-алкил, -SO2NH2, -SO2NH-алкил и -SO2N(алкил)2; где R и R' все независимо выбраны из группы, включающей Н или алкил; в которой Ra выбран из группы, включающей Н, галоген, алкил и арил. В предпочтительном варианте осуществления R1 и R2 независимо выбраны из группы, включающей Н, алкил, арил, алкоксигруппу, галоген, галогеналкил, галогеналкоксигруппу и -NRR', где R и R' все независимо выбраны из группы, включающей Н или алкил. В еще одном предпочтительном варианте осуществления соединение формулы I представляет собой 6,7-дигидротиено[3,2-d]пиримидин-2,4-диол, 6-метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол,6-этил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол,6-фенил-6,7-дигидротиено[3,2-d]пиримидин-2,4 диол, 6,6-диметил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол или 7-метил-6,7-дигидротиено[3,2d]пиримидин-2,4-диол. Предпочтительно, если в описанных выше способах Ra обозначает алкил, выбранный из группы,включающей метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил. Кроме того, кислоту можно выбрать из группы, включающей уксусную кислоту, трифторуксусную кислоту, хлорную кислоту, толуолсульфоновую кислоту, бромисто-водородную кислоту, хлористоводородную кислоту, серную кислоту и азотную кислоту. Предпочтительно, если кислотой является хлористо-водородная кислота. Основание можно выбрать из группы, включающей основания-гидриды металлов, основания-гидроксиды металлов, карбонаты металлов, основания-алкоксиды металлов и основания-фосфаты металлов. Предпочтительно, если основанием является MeONa или NaOH. В описанных выше способах промежуточный продукт формулы IV предпочтительно выделяют перед циклизацией на стадии (b). Выделенный промежуточный продукт формулы IV очищают по методикам, известным в данной области техники, включая колоночную хроматографию, ВЭЖХ или перекристаллизацию. Альтернативно, промежуточный продукт формулы IV не выделяют перед его циклизацией на стадии (b). В другом варианте осуществления растворителем на стадии (а) описанных выше способов является спирт или смесь спиртов. Спиртом или смесью спиртов может быть метанол, этанол, изопропанол, нпропанол, бутанол или их смеси. В еще одном варианте осуществления реакцию, описанную для стадии(а) указанных выше способов, проводят при температуре от 0 С до температуры кипения растворителя и для ее завершения требуется от 0,5 до 24 ч. В другом варианте осуществления растворителем на стадии (b) описанных выше способов является вода, спирт или смесь спиртов. Спиртом или смесью спиртов может быть метанол, этанол, изопропанол,н-пропанол, бутанол или их смеси. В еще одном варианте осуществления реакцию, описанную для стадии (b) указанных выше способов, проводят при температуре от 0 С до температуры кипения растворителя и для ее завершения требуется от 0,5 до 24 ч. Примеры Пример 1. Соединение III (мочевина; 2 экв.) помещали в колбу, снабженную мешалкой, трубкой для подачи N2 и термометром с термопарой, затем метанол (3 мл/г соединения IIa) и соединение IIa (1 экв.) (см. схему 4). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4 ч. NaOMe (1,2 экв., 25% раствор в МеОН) добавляли при 0 С и полученную выше смесь перемешивали при кипячении с обратным холодильником в течение 1,5 ч и затем охлаждали до 0 С. Концентрированную HCl по каплям добавляли, пока значение рН раствора не становилось равным 2-3, смесь перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре тщательно промывали водой, сушили воздухом в течение 2-3 ч(с отсасыванием) и затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 1216 ч и получали соединение Ia с выходом 80-85% в пересчете на соединение IIa. Схема 4 Пример 2. Метиловый эфир 3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2 мл/г соединения IIa) и соединение IIa(1 экв.) (см. схему 5). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IIa) и получали соединение (IVa) в виде белого твердого вещества с выходом 95%.H ЯМР (500 МГц, (CD3)2SO)3,10 (dd, 2H, J=8,5, 8,5 Гц), 3,50 (dd, 2 Н, J=8,5, 8,5 Гц), 3,73 (s, 3 Н),6,50-7,20 (bs, 2 Н), 9,47 (s, 1 Н); 13 С ЯМР (125 МГц, (CD3)2SO)28,7, 37,8, 52,4, 100,0, 151,6, 154,7, 165,7; ЖХМС (ЭУ) для C7H11N2O3S, (М+Н)+ рассчитано 203,0, найдено 203,0. 6,7-Дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVa) добавляли к воде (3 мл/мл соединения IVa) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре тщательно дважды промывали водой (0,5 мл/г соединения IVa), сушили воздухом в течение 2-3 ч (с отсасыванием), затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение (Ia) в виде белого твердо-6 019735 го вещества с выходом 95% в пересчете на соединение (IVa). Пример 3. Метиловый эфир 5-метил-3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2,0 мл/г соединения IIb) и соединениеIIb (1 экв.) (см. схему 6). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IIb) и получали соединение (IVb) в виде белого твердого вещества с выходом 93%. Н ЯМР (400 МГц, (CD3)2SO)1,32 (d, 3 Н, J=6,5 Гц), 3,24 (dd, 1H, J=6,5, 18,0 Гц), 3,55-3,73 (m, 2 Н),3,72 (s, 3 Н), 6,40-7,30 (bs, 1H), 9,35-9,65 (bs, 1H); 13 С ЯМР (100 МГц, (CD3)2SO)22,8, 40,1, 45,6, 52,3,99,5, 150,0, 154,7, 165,8; ЖХМС (ЭУ) для C8H13N2O3S, (M+H)+ рассчитано 217,1, найдено 217,6. 6-Метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVb) добавляли к воде (3 мл/мл соединения IVb) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре дважды тщательно промывали водой (0,5 мл/г соединения IVb), сушили воздухом в течение 2-3 ч (с отсасыванием) и затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение (Ib) в виде белого твердого вещества с выходом 90% в пересчете на соединение (IVb). Пример 4. Метиловый эфир 5-этил-3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2 мл/г соединения IIc) и соединение IIc(1 экв.) (см. схему 7). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IIc) и получали соединение (IVc) в виде белого твердого вещества с выходом 93%.C9H15N2O3S, (М+Н)+ рассчитано 231,1, найдено 231,1. 6-Этил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVc) добавляли к воде (3 мл/мл соединения IVc) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре дважды тщательно промывали водой (0,5 мл/г соединения IVc), сушили воздухом в течение 2-3 ч (с отсасыванием), затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение (Ic) в виде белого твердого вещества с выходом 74% в пересчете на соединение (Ivc). Пример 5. Метиловый эфир 5-фенил-3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2 мл/г соединения IId) и соединение IId(1 экв.) (см. схему 8). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IId) и получали соединение (IVd) в виде белого твердого вещества с выходом 97%. Н ЯМР (500 МГц, (CD3)2SO)3,70 (dd, 1H, J=8,0, 18,0 Гц), 3,74 (s, 3 Н), 3,92 (dd, 1H, J=8,0, 18,0 Гц),4,87 (dd, 1H, J=8,0, 8,0 Гц), 6,60-7,20 (bs, 2 Н), 7,25-7,50 (m, 5 Н), 9,51 (s, 1 Н); 13 С ЯМР (100 МГц,(CD3)2SO)45,1, 48,1, 52,4, 99,4, 127,8, 128,3, 129,5, 142,8, 149,5, 154,7, 165,4 (2 сигнала отсутствуют вследствие перекрывания); ЖХМС (ЭУ) для C13H15N2O3S, (M+H)+ рассчитано 279,1, найдено 279,1. 6-Фенил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVd) добавляли к воде (3 мл/мл соединения IVd) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре дважды тщательно промывали водой (0,5 мл/г соединения IVd), сушили воздухом в течение 2-3 ч (с отсасыванием), затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение (Id) в виде белого твердого вещества с выходом 89% в пересчете на соединение (IVd).H ЯМР (500 МГц, (CD3)2SO) 3,29 (dd, 1H, J=8,5, 17,5 Гц), 3,51 (dd, 1H, J=8,5, 17,5 Гц), 5,17 (dd, 1H,J=8,5, 8,5 Гц), 7,30-7,50 (m, 5 Н), 11,20 (s, 1H), 11,42 (s, 1 Н); 13 С ЯМР (125 МГц, (CD3)2SO)42,7, 49,6,107,8, 128,0, 128,7, 129,6, 142,0, 148,5, 152,3, 160,1 (2 сигнала отсутствуют вследствие перекрывания); ЖХМС (ЭУ) для C12H11N2O2S, (M+H)+ рассчитано 247,1, найдено 247,1. Схема 8 Пример 6. Метиловый эфир 5,5-диметил-3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2 мл/г соединения IIe) и соединение IIe(1 экв.) (см. схему 9). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IIe) и получали соединение (IVe) в виде белого твердого вещества с выходом 83%.H ЯМР (400 МГц, (CD3)2SO)1,46 (s, 6 Н), 3,38 (s , 2 Н), 3,71 (s, 3 Н), 6,60-7,20 (bs, 2 Н), 9,45 (s, 1 Н); С ЯМР (100 МГц, (CD3)2SO)30,4, 51,6, 52,0, 52,3, 100,2, 149,5, 154,8, 165,8 (1 сигнал отсутствовал вследствие перекрывания); ЖХМС (ЭУ) для C9H15N2O3S, (M+H)+ рассчитано 231,1, найдено 231,6. 6,6-Диметил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVe) добавляли к воде (3 мл/мл соединения IVe) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре дважды тщательно промывали водой (0,5 мл/г соединения IVe), сушили воздухом в течение 2-3 ч (с отсасыванием), затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение (Ie) в виде белого твердого вещества с выходом 90% в пересчете на соединение (IVe). Н ЯМР (400 МГц, (CD3)2SO)1,53 (s, 6 Н), 2,95 (s, 2 Н), 11,10 (s, 1H), 11,32 (s, 1 Н); 13 С ЯМР (100 МГц, (CD3)2SO)30,7, 49,2, 54,7, 108,4, 148,2, 152,3, 160,5 (1 сигнал отсутствовал вследствие перекрывания); ЖХМС (ЭУ) для C8H11N2O2S, (М+Н)+ рассчитано 199,1, найдено 199,1. Пример 7. Метиловый эфир 4-метил-3-уреидо-4,5-дигидротиофен-2-карбоновой кислоты. Соединение III (мочевина; 2 экв.) помещали в сосуд, снабженный мешалкой, трубкой для подачи N2 и термометром с термопарой, затем добавляли метанол (от 1,5 до 2 мл/г соединения IIf) и соединение IIf(1 экв.) (см. схему 10). Концентрированную HCl (0,2 экв.) добавляли при 20-25 С и смесь перемешивали при кипячении с обратным холодильником в течение 4-6 ч. Реакционную смесь охлаждали до 0 С и полученное твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (дважды с 1 мл/г соединения IIf) и получали соединение (IVf) в виде белого твердого вещества с выходом 48%.H ЯМР (500 МГц, (CD3)2SO)1,16 (d, 3 Н, J=7,0 Гц), 2,75 (d, 1H, J=11,0 Гц), 3,20 (dd, 1 Н, J=7,5, 11,0 Гц), 3,73 (s, 3 Н), 4,35-4,43 (m, 1 Н), 6,50-7,20 (m, 2 Н), 9,40 (s, 1 Н); 13 С ЯМР (125 МГц, (CD3)2SO)16,7,36,0, 42,0, 52,4, 98,8, 154,3, 155,7, 166,0; ЖХМС (ЭУ) для C8H13N2O3S, (M+H)+ рассчитано 217,1, найдено 217,1. 7-Метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. Соединение (IVf) добавляли к воде (3 мл/мл соединения IVf) и NaOH при температуре окружающей среды. Указанную выше смесь перемешивали при 85 С в течение 1,5 ч. После охлаждения до 0 С медленно добавляли концентрированную HCl (примерно 1,1 экв.), пока значение рН раствора не становилось равным 0-1. Смесь охлаждали до 0 С, перемешивали в течение 5-10 мин и полученное твердое вещество собирали фильтрованием. Осадок на фильтре дважды тщательно промывали водой (0,5 мл/г соединенияIVf), сушили воздухом в течение 2-3 ч (с отсасыванием), затем дополнительно сушили в вакуумном сушильном шкафу при 50 С в течение 12-16 ч и получали соединение If в виде белого твердого вещества с выходом 89% в пересчете на соединение (IVf). Приведенные выше описание, чертежи и примеры являются только иллюстрациями предпочтительных вариантов осуществления, которые обеспечивают реализацию объектов, особенностей и преимуществ настоящего изобретения. Не предполагается, что настоящее изобретение ограничивается иллюстративными вариантами осуществления. Любую модификацию настоящего изобретения, которая соответствует сущности и объему приведенной ниже формулы изобретения, следует считать частью настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I(а) реакцию исходного соединения формулы II с мочевиной в присутствии кислоты и растворителя с получением промежуточного продукта формулы IV(b) циклизацию промежуточного продукта формулы IV с основанием с получением конечного продукта формулы I, в которой R1 и R2 независимо выбраны из группы, включающей Н, -С 1-10-алкил, -С 3-8 циклоалкил, -С 6-12-арил, 5-8-членный моноциклический гетероарил, содержащий от 1 до 4 гетероатомов,выбранных из группы, включающей азот, кислород и серу, 8-11-членный бициклический гетероарил,содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, 4-8 членный моноциклический гетероциклоалкил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, 8-11-членный бициклический гетероциклоалкил, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, галоген, -С 1-10 алкоксигруппу, -С 6-12-арилоксигруппу, -С 3-8-циклоалкоксигруппу, 5-8-членную гетероарилоксигруппу,содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, -С 3-8 гетероцикло-С 1-10-алкоксигруппу, содержащую от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу, -NO2, -NRR', галоген(С 1-10)алкил, галоген(С 1-10)алкоксигруппу, -SH, -S-(С 110)алкил, -SO2-(С 1-10)алкил, -SO2NH2, -SO2NH-(C1-10)алкил и -SO2N-C1-10)алкил)2; где R и R' все независимо выбраны из группы, включающей Н или -(C1-10)алкил; в которой Ra выбран из группы, включающей Н, -(C1-10)алкил и -С 6-12-арил. 2. Способ по п.1, в котором R1 и R2 независимо выбраны из группы, включающей Н, -С 1-10-алкил, С 6-12-арил, -C1-10-алкоксигруппу, галоген, галоген(C1-10)алкил, галоген(C1-10)алкоксигруппу и -NRR', где R и R' все независимо выбраны из группы, включающей Н или -C1-10-алкил. 3. Способ по п.1 или 2, в котором Ra обозначает -C1-10-алкил, выбранный из группы, включающей метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил. 4. Способ по одному из пп.1-3, в котором кислота выбрана из группы, включающей уксусную кислоту, трифторуксусную кислоту, хлорную кислоту, толуолсульфоновую кислоту, бромисто-водородную кислоту, хлористо-водородную кислоту, серную кислоту и азотную кислоту. 5. Способ по одному из пп.1-4, в котором кислотой является хлористо-водородная кислота. 6. Способ по одному из пп.1-5, в котором основание выбрано из группы, включающей основаниягидриды металлов, основания-гидроксиды металлов, карбонаты металлов, основания-алкоксиды металлов и основания-фосфаты металлов. 7. Способ по п.6, в котором основанием является MeONa. 8. Способ по п.6, в котором основанием является NaOH. 9. Способ по п.1, в котором соединение формулы I представляет собой 6,7-дигидротиено[3,2-d]пиримидин-2,4-диол; 6-метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол; 6-этил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол; 6-фенил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол; 6,6-диметил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол или 7-метил-6,7-дигидротиено[3,2-d]пиримидин-2,4-диол. 10. Способ по п.1, в котором промежуточный продукт формулы IV выделяют перед циклизацией на стадии (b). 11. Способ по п.10, в котором выделенный промежуточный продукт формулы IV также очищают по методике, известной в данной области техники. 12. Способ по п.11, в котором методикой, известной в данной области техники, является колоночная хроматография, ВЭЖХ или перекристаллизация. 13. Способ по п.1, в котором промежуточный продукт формулы IV не выделяют перед циклизацией на стадии (b). 14. Способ по п.1, в котором растворителем на стадии (а) является спирт или смесь спиртов. 15. Способ по п.14, в котором спиртом или смесью спиртов является метанол, этанол, изопропанол,н-пропанол, бутанол или их смеси. 16. Способ по п.14, в котором реакцию проводят при температуре от 0 С до температуры кипения растворителя. 17. Способ по п.14, в котором для завершения стадии (а) требуется от 0,5 до 24 ч. 18. Способ по п.1, в котором растворителем на стадии (b) является вода, спирт или смесь спиртов. 19. Способ по п.18, в котором спиртом или смесью спиртов является метанол, этанол, изопропанол,н-пропанол, бутанол или их смеси. 20. Способ по п.18, в котором реакцию циклизации (b) проводят при температуре от 0 С до температуры кипения растворителя. 21. Способ по п.18, в котором для завершения реакции циклизации (b) требуется от 0,5 до 24 ч.
МПК / Метки
МПК: C07D 239/70, C07D 495/04
Метки: синтез, дигидротиено[3,2-d]пиримидиндиолов, сходных, пиримидиндиолов
Код ссылки
<a href="https://eas.patents.su/13-19735-sintez-digidrotieno32-dpirimidindiolov-i-shodnyh-pirimidindiolov.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез дигидротиено[3,2-d]пиримидиндиолов и сходных пиримидиндиолов</a>
Предыдущий патент: Способ сборки резинометаллического шарнира
Следующий патент: Ингаляционное устройство
Случайный патент: Магнитоэлектрическая машина с постоянными магнитами (её варианты), способ и пресс-форма для её изготовления

















