Способ получения полиморфной формы i гидросульфата (s)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-c] пиридин-5(4н)-ацетата
Формула / Реферат
1. Способ получения фармацевтически применимой полиморфной формы I гидросульфата (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата формулы I
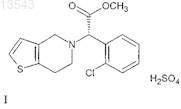
путем реакции (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата и серной кислоты в присутствии растворителей, который включает растворение (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата в простом эфире; смешивание данного раствора с раствором спирта С6-С11и серной кислоты и извлечение полученного таким образом соединения формулы I из маточного раствора.
2. Способ по п.1, в котором используют один или более простой алифатический эфир с прямой или разветвленной цепью общей формулы Cn-O-Cm, где n и m могут быть различными или одинаковыми и n равно 1-4, a m равно 2-4.
3. Способ по п.2, в котором используют метил-трет-бутиловый эфир.
4. Способ по любому из пп.1-3, в котором используют один или более линейный или разветвленный, алифатический или циклический, первичный, вторичный или третичный спирт С6-С11.
5. Способ по п.4, в котором используют 1-деканол.
6. Способ по любому из пп.1-5, в котором (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетат растворяют в 0,7-7,4-кратном количестве эфира.
7. Способ по п.6, в котором (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетат растворяют в 7,4-кратном количестве эфира.
8. Способ по любому из пп.1-7, в котором спирт используют в 0,8-4,1-кратном количестве, исходя из массы (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата.
9. Способ по п.8, в котором спирт используют в 1,66-кратном количестве, исходя, из массы (S)-(+)- метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата.
10. Способ по любому из пп.1-9, в котором эфир используют в 0,17-8,96-кратном количестве, исходя из массы спирта.
11. Способ по п.10, в котором эфир используют в 4,45-кратном количестве, исходя из массы спирта.
12. Способ по любому из пп.1-11, в котором используют 0,9-1,25 мольных эквивалентов серной кислоты на 1 моль (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетата.
13. Способ по п.12, в котором используют 1 мольный эквивалент серной кислоты на 1 моль (S)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4H)-ацетата.
14. Способ по любому из пп.1-13, в котором используют серную кислоту с концентрацией 90-100 мас.%.
15. Способ по п.14, в котором используют серную кислоту с концентрацией 96 мас.%.
16. Способ по любому из пп.1-15, в котором кристаллизацию осуществляют в течение 24-48 ч.
17. Способ по любому из пп.1-16, в котором реакцию проводят при комнатной температуре.
Текст
013543 Область техники, к которой относится изобретение Изобретение относится к способу получения фармацевтически применимой полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата (также известного как гидросульфат (S)-(+)-клопидогреля) формулы (I) смешиванием эфирного раствора (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)ацетата (также известного как основание (S)-(+)-клопидогреля) с раствором спирта С 6-С 11 в серной кислоте, затем выделением осажденной полиморфной формы I гидросульфата (S)-(+)-клопидогреля из маточного раствора. Уровень техники Гидросульфат (S)-(+)-клопидогреля формулы (I) является известным ценным фармацевтическим веществом, использующимся в качестве ингибитора агрегации тромбоцитов и антитромбического средства. Первый способ получения гидросульфата (S)-(+)-клопидогреля формулы (I) был раскрыт в Европейской фармакопее (ЕР) 281459. Для получения гидросульфата (S)-(+)-клопидогреля формулы (I) было разработано большое число химических процессов. Опубликованная международная заявка WO 99/65915 первой указала на существование по меньшей мере двух полиморфных форм соединения формулы (I). Был также описан первый способ получения полиморфной формы II (температура плавления: 1763 С). Кроме того, было раскрыто, что кристаллическая форма (температура плавления: 1843 С), описанная в ЕР 281459, соответствует полиморфной форме I. Вышеупомянутая публикация раскрывает различия в стабильности, физических свойствах, спектральных характеристиках и способах получения кристаллических форм I и II. Согласно опубликованной заявке WO 99/65915 полиморфную форму II получают при 20 С растворением основания (S)-(+)-клопидогреля в ацетоне с последующим добавлением серной кислоты (80%). Согласно примеру 1 В полиморфную форму I получают почти в таких же условиях. Однако согласно примеру 2 чистую полиморфную форму II получают путем добавления затравочных кристаллов полиморфной формы II к полиморфной форме I. Специалист поймет, что вышеупомянутый способ WO 99/65915 получения полиморфной формы I из основания (S)-(+)-клопидогреля с использованием ацетона не может рассматриваться в качестве приемлемого для промышленного применения, поскольку полиморфная форма I подвергается превращению в полиморфную форму II вследствие легкого образования или потенциального присутствия полиморфной формы II. Другие многочисленные патентные заявки относятся к получению полиморфной формы I соединения формулы (I). Полиморфные формы III, IV, V, VI и аморфная форма гидросульфата(S)-(+)-клопидогреля раскрываются в опубликованной патентной заявке WO 2003/051362, в которой форма III гидросульфата клопидогреля определена как сольват с 1-бутанолом, форма IV является сольватом с 2-пропанолом, форма V является сольватом с 2-бутанолом, а форма VI является сольватом с 1-пропанолом. Помимо полиморфных форм III, IV, V и VI, опубликованная патентная заявка WO 2003/051362 раскрывает также новый способ получения полиморфной формы I добавлением антирастворителя к раствору гидросульфата (S)-(+)-клопидогреля в спирте. В частности, к раствору соединения формулы (I) в 1,3-2,0-кратном количестве метанола добавляли 10-150-кратный избыток метил-трет-бутилового эфира или диэтилового эфира, в результате чего осаждалась полиморфная форма I. Полиморфную форму I можно получать также путем добавления 9-кратного количества метил-трет-бутилового эфира или диэтилового эфира к раствору соединения формулы (I) в 3-кратном количестве этанола. В ходе проведенных экспериментов были осуществлены способы получения полиморфной формыI, описанной в WO 2003/051362. В результате авторы обнаружили, что в случае недостаточного растворения гидросульфата (S)-(+)-клопидогреля нерастворенная часть гидросульфата (S)-(+)-клопидогреля действует как зародыш кристаллизации во время процесса осаждения. Таким образом, существует возможность получения преимущественно полиморфной формы III. Согласно изложенному способ получения полиморфной формы является ненадежным. Вследствие данного недостатка методики способ не может приниматься в качестве промышленной методики. Опубликованная патентная заявка WO 2003/051362 также раскрывает новый способ получения полиморфной формы II соединения формулы (I) добавлением серной кислоты (80%) к раствору основания(S)-(+)-клопидогреля в метилэтилкетоне, дихлорметане, толуоле, хлороформе, этилацетате, эфире метилтрет-бутиловом эфире или 1,4-диоксане при температуре 20 С. В другом маршруте реакции полиморф-1 013543 ная форма II была получена из раствора гидросульфата (S)-(+)-клопидогреля в ацетонитриле добавлением к нему диэтилового эфира. Опубликованная патентная заявка WO 2004/020443 относится к способу получения полиморфной формы I соединения формулы (I) путем растворения основания (S)-(+)-клопидогреля в спирте C1-C5,предпочтительно в 2-пропаноле, или в их сложном эфире, предпочтительно бутилацетате. Затем раствор охлаждали до температуры между минус 5-0 С и добавляли серную кислоту (98%). Для образования зародышей кристаллизации полиморфной формы I добавляли гидросульфат (S)-(+)-клопидогреля. В другой методике основание (S)-(+)-клопидогреля растворяли в смеси 2-пропанола и бутилацетата, затем добавляли серную кислоту (98%) при температуре между минус 2-0 С без зародышеобразования. В каждой вышеупомянутой методике из маточного раствора выделяли также полиморфную форму II. Одним из существенных недостатков данной методики является наличие полиморфной формы II в маточном растворе, что делает промышленную применимость данной методики сомнительной. Кроме того, при использовании 2-пропанола увеличивается возможность образования полиморфной формы IV,раскрытой первоначально в WO 2003/051362. Также увеличивается возможность образования полиморфной формы II при использовании добавленных зародышей кристаллизации неудовлетворительной полиморфной чистоты. В способе, раскрытом в опубликованной патентной заявке WO 2004/020443, полиморфная форма I соединения формулы (I) была получена из гидросульфата (S)-(+)-клопидогреля путем его нагревания в 46-кратном количестве бутилацетата до температуры кипения, затем после охлаждения была получена полиморфная форма I. Однако при использовании такого высокого отношения растворитель:продукт оборудование используется недостаточно, и поэтому данная методика не пригодна для промышленного применения. Согласно опубликованной патентной заявке WO 2004/048385 полиморфная форма I соединения формулы (I) была получена добавлением концентрированной серной кислоты к раствору основания(S)-(+)-клопидогреля в диоксане, 1,2-диметоксиэтане, бис-(2-этоксиэтиловом) эфире или в смеси метилтрет-бутиловый эфир/2-пропанол или в изобутилметилкетоне. Однако способ, описанный в WO 2004/048385, противоречит данным предшествующей опубликованной заявки WO 2003/051362, где при использовании подобных растворителей была получена полиморфная форма II. Проведенные эксперименты также подтверждают данные, опубликованные вWO 2003/051362. Согласно другому способу, раскрытому в опубликованной патентной заявке WO 2004/048385, основание (S)-(+)-клопидогреля растворяли в этаноле или метоксиэтаноле, затем добавляли серную кислоту (96%) и осаждали продукт добавлением 9-кратного количества метил-трет-бутилового эфира или диметоксиэтана. Недостатком вышеупомянутого способа, аналогично методике, описанной в WO 2003/051362, является то, что осаждение может привести к маслянистому гидросульфату (S)-(+)-клопидогреля, что не приемлемо для промышленного применения методики. Опубликованная патентная заявка WO 2004/081016 раскрывает способ получения полиморфной формы I добавлением серной кислоты (80%) к раствору основания (S)-(+)-клопидогреля в ацетоне при температуре 20 С и последующим перемешиванием при температуре -20 С или добавлением серной кислоты (80%) к раствору основания (S)-(+)-клопидогреля в ацетоне при температуре между 50-52 С. Осуществлять вышеупомянутый способ в промышленных условиях очень опасно, при этом выходы ниже 62%. С полным знанием способов, описанных в опубликованной заявке WO 99/65915, поданной в международное патентное ведомство, где способы осуществлялись в равных условиях с несогласующимися результатами, вышеупомянутый способ, по-видимому, является непригодным для получения полиморфной формы I в промышленном масштабе. Согласно опубликованной заявке WO 2004/081016 полиморфная форма II был получена из аморфной формы гидросульфата (S)-(+)-клопидогреля при его перемешивании в ацетоне или в этилацетате. Согласно способу, раскрытому в опубликованной заявке WO 2005/003139, полиморфная форма I соединения формулы (I) была получена добавлением серной кислоты (96%) к раствору основания(S)-(+)-клопидогреля в ацетоне, дихлорметане или в 2-пропаноле при температуре 10-15 С. Затем полиморфную форму I осаждали при температуре 0 С 25-30-кратным количеством диизопропилового эфира,циклогексана или этилацетата, содержащего 30 мас.% полиморфной формы I гидросульфата(S)-(+)-клопидогреля, исходя из массы клопидогреля. Согласно другому маршруту реакции смесь серной кислоты (96%) и диизопропилового эфира добавляли при температуре 0 С к раствору полиморфной формы гидросульфата (S)-(+)-клопидогреля I в 25-кратном количестве диизопропилового эфира и 4-кратном количестве 2-пропанола, содержащего полиморфную форму I в количестве 30 мас.%, исходя из массы основания клопидогреля. Серьезным недостатком методики, описанной в опубликованной заявке WO 2005/003139, является то, что затравочные кристаллы полиморфной формы I используются в очень больших количествах. Кроме того, согласно методике, описанной в опубликованной заявке WO 2003/051362, при использовании подобных растворителей была получена полиморфная форма II; следовательно, способ, описанный вWO 2005/003139, является неподходящим для промышленных целей. Опубликованная заявка WO 2005/003139 раскрывает способ получения полиморфной формы II соединения формулы (I), в котором к раствору основания (S)-(+)-клопидогреля в ацетоне, дихлорметане или в смеси этилацетат/ацетон, дихлорметан/ацетон или метилэтилкетон/ацетон добавляли затравочные кристаллы полиморфной формы I, а затем добавляли концентрированную серную кислоту для осаждения полиморфной формы II. Как наше исследование воспроизводимости, так и данные, представленные в опубликованной патентной заявке WO 2005/003139, показали, что при использовании растворителей, применяемых обычно для получения полиморфной формы I, даже в присутствии затравочных кристаллов полиморфной формыI часто образуется полиморфная форма II. Согласно раскрытию опубликованной патентной заявки WO 2005/003139 добавлением серной кислоты к раствору гидросульфата (S)-(+)-клопидогреля в дихлорметане с последующим осаждением продукта диизопропиловым эфиром без затравочных кристаллов была получена аморфная форма гидросульфата (S)-(+)-клопидогреля, показывая, что, хотя применение затравочных кристаллов является существенным, полиморфную форму продукта "нелегко предвидеть". Согласно способу, описанному в WO 2005/012300, полиморфная форма I соединения формулы (I) была получена растворением основания (S)-(+)-клопидогреля в этилацетате и добавлением к образующемуся раствору затравочных кристаллов полиморфной формы I (2,5 мас.%, исходя из основания клопидогреля) и концентрированной серной кислоты. Однако выход ниже 70%. Кроме того, методика, описанная в вышеупомянутой заявке WO 2005/012300, не согласуется с раскрытием опубликованной заявки WO 2003/051362, поскольку, согласно последней патентной заявке при использовании этилацетата была получена полиморфная форма II. Согласно опубликованной заявке WO 2005/016931 полиморфную форму I соединения формулы (I) получали растворением основания (S)-(+)-клопидогреля в 2-пропаноле. Затем к раствору добавляли сначала смесь серной кислоты (97%) и 2-пропанола, а затем затравочные кристаллы полиморфной формы I. Недостатком вышеупомянутой методики является то, что использование 2-пропанола приводит к увеличенному риску образования полиморфной формы IV, как описано в WO 2003/051362. В другом маршруте реакции, описанном в опубликованной заявке WO 2005/016931, гидросульфат(S)-(+)-клопидогреля растворяли в смеси метанола и 2-пропанола, затем осуществляли кристаллизацию. Согласно примеру 4 в WO 2005/016931, поданной в международное патентное ведомство, гидросульфат (S)-(+)-клопидогреля растворяли в метаноле и образующийся раствор упаривали, затем остаток кристаллизовали из 2-пропанола. В примере 6 заявки WO 2005/016931 полиморфную форму II получали растворением гидросульфата(S)-(+)-клопидогреля в смеси метанол/2-пропанол, затем осуществляли кристаллизацию. В примерах 4 и 6 заявки WO 2005/016931 могут быть получены или полиморфная форма I, или полиморфная форма II в зависимости от того, находилась ли используемая температура реакции между 10-12 С или поддерживалась при 25 С. Другим недостатком является то, что способ осуществляется с низкими выходами (менее 70%). Неправильное растворение гидросульфата (S)-(+)-клопидогреля может вызвать другую проблему, поскольку остающиеся в растворе нерастворенные микрокристаллы могут действовать как затравочные кристаллы, уменьшая возможность образования полиморфной формы I. Поэтому вышеупомянутая методика не пригодна для промышленных целей. В процессе, раскрытом в патентной заявке США 2005/059696, основание (S)-(+)-клопидогреля растворяли в 2-бутаноле, затем добавляли серную кислоту, но выход составлял только 70%. Другим недостатком методики является серьезный риск образования полиморфной формы V (сольват с 2-бутанолом),как описано в заявке WO 2003/051362. Согласно заявке WO 2005/063708 полиморфную форму I соединения формулы (I) получали растворением основания (S)-(+)-клопидогреля в н-гексаноле или в н-гептаноле, затем к раствору добавляли водную серную кислоту, потом добавляли затравочные кристаллы полиморфной формы I. Наши исследования, использующие вышеупомянутую методику, показали, что в случае, если присутствовала полиморфная форма II, во многих образцах получалась полиморфная форма II. Кроме того,неправильное добавление серной кислоты может привести к маслянистому осаждающемуся материалу,таким образом, вышеупомянутая методика не пригодна для промышленных целей. Согласно другому способу получения полиморфной формы I, описанному в WO 2005/063708, основание (S)-(+)-клопидогреля растворяли в смеси н-гексанол/вода или н-деканол/вода, затем добавляли концентрированную серную кислоту и затравочные кристаллы полиморфной формы I. В данной методике затравочные кристаллы повышают риск образования полиморфной формы II. Кроме того, другим недостатком процесса является медленный гидролиз метильной сложноэфирной группы (S)-(+)-клопидогреля в карбоновую кислоту под влиянием воды, используемой в кислой среде согласно методике, в результате чего снижается чистота продукта. Поэтому полученный таким образом продукт является неподходящим для терапевтического применения.-3 013543 Согласно другой методике, описанной в заявке WO 2005/063708, полиморфную форму I получали растворением гидросульфата (S)-(+)-клопидогреля в гексаноле, затем полученный осадок перемешивали в течение 12 ч, фильтровали и промывали метил-трет-бутиловым эфиром. В другом маршруте реакции основание (S)-(+)-клопидогреля растворяли в н-деканоле, затем к реакционной смеси добавляли водную серную кислоту. Полученный осадок перемешивали в течение 24 ч и промывали метил-трет-бутиловым эфиром. Недостатком данной методики является очень низкий выход, примерно 60%. Методика также неблагоприятна с экологической точки зрения вследствие присутствия в 7-кратном количестве спиртов с длинной углеродной цепью. Трудно снизить содержание в конечном продукте спиртов с высокой температурой кипения до предельного содержания растворителя, требуемого фармацевтическими регулирующими органами. Согласно заявке WO 2005/100364 получение полиморфной формы I соединения формулы (I) осуществляли растворением основания (S)-(+)-клопидогреля в метилацетате или этилацетате и добавлением серной кислоты (90-95% или концентрированной) при температуре между минус (15-5)С. Недостаток вышеупомянутого процесса заключается в том, что применение сложных эфиров уксусной кислоты с короткой цепью может привести к образованию полиморфной формы II, как было описано в заявке WO 2003/051362, это наблюдение не согласуется с раскрытием в заявке WO 2003/051364. Наши эксперименты также подтверждают раскрытие WO 2005/100362. В другом маршруте реакции, раскрытом в заявке WO 2005/100364, для получения полиморфной формы I к раствору основания (S)-(+)-клопидогреля в метил-трет-бутиловом эфире добавляли метилтрет-бутиловый эфир, содержащий серную кислоту (40%), при температуре между минус (15-5)С. Заявки WO 2003/051362 и WO 2005/063708 также содержат способы получения полиморфной формы II в чистом метил-трет-бутиловом эфире; данные подтверждаются также проведенными экспериментами. Соответственно вышеупомянутая методика, по-видимому, является неподходящей для получения полиморфной формы I. Заявка WO 2005/100364 раскрывает другие способы получения полиморфной формы I соединения формулы (I). Соответственно к раствору основания (S)-(+)-клопидогреля в диизопропиловом эфире добавляли при температуре между минус 5 и 5 С концентрированную серную кислоту. Согласно другой методике, описанной в патентной заявке, дихлорметан, содержащий 10%-ную серную кислоту, добавляли при температуре между минус (15-5)С к раствору основания (S)-(+)-клопидогреля в смеси метилацетат/дихлорметан или этилацетат/диизопропиловый эфир. В ходе проведенных экспериментов обнаружено, что при осуществлении методик получения полиморфной формы I по способам, описанным в вышеуказанных патентных заявках, часто получают полиморфную форму II вследствие использования неподходящего растворителя. Как упоминалось, для получения полиморфной формы I гидросульфата (S)-(+)-клопидогреля формулы (I) было разработано большое количество химических процессов. Однако данные, представленные в цитированных ссылках, противоречат друг другу. Вследствие их невоспроизводимости, которая наблюдается особенно в присутствии полиморфной формы II, способы, описанные в вышеупомянутых опубликованных патентных заявках, являются неподходящими для промышленного производства полиморфной формы I гидросульфата (S)-(+)-клопидогреля. Все способы получения полиморфной формы I соединения формулы (I), известные в технической литературе, имеют следующие общие недостатки: способы являются неподходящими для промышленных целей, поскольку не определено, получается или нет чистая полиморфная форма I; стадия кристаллизации осуществляется в большом избытке опасных и экологически нежелательных растворителей; в некоторых случаях затравочные кристаллы используются в очень большом количестве, что, с одной стороны, неэкономично, а с другой стороны - снижается полиморфная чистота; микрокристаллы соединения формулы (I), остающиеся нерастворенными в растворе, могут действовать как затравочные кристаллы; некоторые из способов могут осуществляться только при низких температурах, что затрудняет промышленную применимость; данные, опубликованные в цитированных ссылках, являются несогласующимися друг с другом, тем самым показывая, что проблема получения полиморфной формы I соединения формулы (I) не решена; вследствие низкого выхода промышленное производство неэкономично; в некоторых процессах из реакционной смеси может выделяться маслянистый продукт, в результате промышленное производство становится невозможным; в некоторых процессах используют водную реакционную смесь и вследствие наличия воды в кислой среде метальная группа сложного эфира (S)-(+)-клопидогреля подвергается гидролизу с образованием карбоновой кислоты. В результате снижается чистота конечного продукта, и, следовательно, он не пригоден для фармацевтического применения.-4 013543 Соответственно в свете технической литературы получение полиморфной формы I соединения формулы (I) с желаемой определенностью в промышленном масштабе, по-видимому, невозможно. Осуществление изобретения Цель изобретения состояла в обеспечении экономичного способа, с помощью которого может быть получена полиморфная форма I гидросульфата (S)-(+)-клопидогреля с требуемой чистотой лекарственного средства через стадии реакции, дающие хорошие выходы, а также с соответствующей надежностью образования полиморфной формы I. Изобретение основано на признании того, что, если основание (S)-(+)-клопидогреля растворить в эфире и смешать с раствором спирта С 6-С 11 в серной кислоте, получается полиморфная форма I гидросульфата (S)-(+)-клопидогреля. Различия между процессом согласно изобретению и способами, описанными в технической литературе, следующие. При сравнении способа, описанного в заявке WO 2003/051362, со способом согласно изобретению различие состоит в том, что для получения полиморфной формы I соединения формулы (I) по способу согласно изобретению используются основание (S)-(+)-клопидогреля и спирты с более длинной цепью(С 6-С 11) вместо гидросульфата (S)-(+)-клопидогреля и низших спиртов (метанола или этанола). Другое различие состоит в том, что в методике согласно изобретению при добавлении серной кислоты после растворения основания (S)-(+)-клопидогреля в эфире в присутствии спирта С 6-C11 получается полиморфная форма I соединения формулы (I) вместо полиморфной формы II соединения формулы (I). В отличие от способа согласно изобретению в способе, описанном в заявке WO 2004/020443, основание (S)-(+)-клопидогреля растворяют в спирте вместо эфира, и спирт является спиртом С 1-С 5 вместо спирта С 6-С 11, а эфир не используют. При сравнении способов, раскрытых в настоящей патентной заявке, с WO 2005/016931, можно заметить, что в методике согласно изобретению основание (S)-(+)-клопидогреля растворяют в эфире, затем к раствору добавляют смесь спирта С 6-С 11 и серной кислоты. В противоположность, заявкаWO 2005/016931 заявляет способ, в котором раствор основания (S)-(+)-клопидогреля в спирте С 3-C10 реагирует с серной кислотой, но для растворения основания (S)-(+)-клопидогреля эфир не используется. Также не иллюстрируется применение спиртов с длинной цепью для растворения основания клопидогреля, дается пример только для 2-пропанола. В отличие от способа согласно изобретению в методике, раскрытой в заявке WO 2005/063708, основание (S)-(+)-клопидогреля, спирт С 6-С 12 и разбавленная серная кислота реагируют с образованием полиморфной формы I соединения формулы (I); затем смесь фильтруют, промывают метил-третбутиловым эфиром. Соответственно реакционная смесь, описанная в вышеуказанной ссылке, содержит воду, в то время как эфир в упомянутой методике не используется. В отличие от способа согласно изобретению в способе, раскрытом в заявке WO 2005/100364, раствор основания (S)-(+)-клопидогреля в метил-трет-бутиловом эфире реагирует с серной кислотой без использования спирта. В ходе проведенных экспериментов было неожиданно обнаружено, что, если растворить основание(S)-(+)-клопидогреля в растворителе, известном как антирастворитель, т.е. в эфире, и добавить к данному раствору смесь спирта с длинной цепью и серной кислоты, полученный продукт идентифицируется как полиморфная форма I соединения формулы (I) с помощью DSC, TGA, ИК и XRPD. Данное является более неожиданным, поскольку в примерах предыдущих способов получения полиморфных форм соединения формулы (I) описывается применение растворителей, аналогичных использованным в настоящем изобретении, однако полиморфная форма I не получалась. Например, как описано в примере 10 ссылки WO 2003/051362, основание (S)-(+)-клопидогреля растворяли в метил-третбутиловом эфире, затем добавляли серную кислоту и полученный продукт идентифицировали как полиморфную форму II. Далее, согласно примеру 23 ссылки WO 2005/063708 при перемешивании аморфной формы в метил-трет-бутиловом эфире также получают полиморфную форму II. В ходе наших начальных экспериментов, осуществляющих воспроизводимость вышеупомянутых известных способов получения, было установлено, что, если растворение гидросульфата(S)-(+)-клопидогреля является неполным, может быть получена полиморфная форма II, поскольку нерастворенная часть гидросульфата (S)-(+)-клопидогреля действует как затравочный кристалл во время процедуры осаждения. В ходе наших дальнейших экспериментов был разработан новый способ получения полиморфной формы I соединения формулы (I), очень надежный и удобный для осуществления в промышленном масштабе. На основе вышеуказанных экспериментов авторы неожиданно обнаружили, что способ согласно изобретению обеспечивает такую высокую надежность получения полиморфной формы I гидросульфата(S)-(+)-клопидогреля, что полиморфная форма I получается, даже если количество полиморфной формы-5 013543 Поскольку способ согласно изобретению осуществляется без воды, не может образовываться примесь карбоновой кислоты в результате гидролиза сложноэфирной группы; т.е. концентрация примесей в образующемся продукте не увеличивается. В способе согласно изобретению полиморфная форма I гидросульфата (S)-(+)-клопидогреля может быть получена с очень высокой чистотой и выходом; и выход, и чистота лучше, чем для продуктов, описанных в области техники. Способ получения согласно изобретению становится более экономичным при использовании легко рециркулируемого эфира и малого количества спирта с длинной цепью. Принимая во внимание вышеупомянутую техническую литературу, можно уверенно утверждать,что полиморфная форма I соединения формулы (I) не была получена по способу согласно изобретению. Изобретение относится к способу получения фармацевтически применимой полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы(I) по реакции (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата с серной кислотой в присутствии растворителей, отличающемуся тем, что (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетат растворяют в эфире; данный раствор перемешивают с раствором спирта С 6-С 11 в серной кислоте; и полученный таким образом кристаллический продукт извлекают из маточного раствора. Подробное изложение изобретения Определения терминов и сокращений, используемых в настоящем документе, имеют следующие значения. Используемый в настоящем документе термин "при комнатной температуре" относится к температурам примерно между 20 и 25 С. Используемое в настоящем документе сокращение "m.р." относится к температуре плавления. Используемое в настоящем документе сокращение "DSC" означает дифференциальный сканирующий калориметрический анализ. Используемое в настоящем документе сокращение TGA" означает термогравиметрический анализ. Используемое в настоящем документе сокращение "ИК" означает инфракрасные спектры. Используемое в настоящем документе сокращение "PXRD" означает исследование порошковой рентгеновской дифракции. Как правило, способ получения терапевтически применимой полиморфной формы I соединения формулы (I) согласно изобретению может осуществляться следующим образом. Соответственно к раствору спирта С 6-С 11 в серной кислоте добавляют раствор основания (S)-(+)-клопидогреля в эфире. После перемешивания смеси в течение 24-48 ч при комнатной температуре образующаяся полиморфная формаI гидросульфата (S)-(+)-клопидогреля отделяется от маточного раствора. Порядок добавлений двух вышеуказанных растворов является взаимозаменяемым. В способе согласно изобретению в качестве растворителя для растворения основания(S)-(+)-клопидогреля используют один или более простой эфир алифатического ряда с прямой или разветвленной цепью общей формулы Cn-O-Cm, где n и m могут быть различными или одинаковыми, n=1-4,a m=2-4; предпочтительно применяют метил-трет-бутиловый эфир. В способе согласно изобретению в качестве спирта С 6-С 11 используют один или более с прямой или разветвленной цепью, алифатический или циклический, первичный, вторичный или третичный спирт,предпочтительно 1-деканол. В способе согласно изобретению основание (S)-(+)-клопидогреля растворяют в 0,7-7,4-кратном,предпочтительно 7,4-кратном количестве эфира. В способе согласно изобретению спирт используют в 0,8-4,1-кратном, предпочтительно 1,66-кратном количестве, исходя из массы основания (S)-(+)-клопидогреля. В способе согласно изобретению эфир используется в 0,17-8,96-кратном, предпочтительно 4,45-кратном количестве, исходя из количества спирта, используемого в методике. В способе согласно изобретению используют 0,9-1,25 мол.экв., предпочтительно 1 мол.экв. серной кислоты на 1 моль основания (S)-(+)-клопидогреля. Концентрация серной кислоты, используемой в способе получения согласно изобретению, составляет 90-100 мас.%, предпочтительно 96 мас.%. При методике согласно изобретению очень важно раздельное приготовление реагентов; а именно раствор основания (S)-(+)-клопидогреля в эфире и раствор спирта С 6-С 11 в серной кислоте должны приготавливаться раздельно. Также в способе согласно изобретению очень важно отношение реагентов. Преимущество изобретения проявляется в том, что отношение растворителей друг к другу может изменяться в широких пределах. Использование спирта в большом количестве (4,1-кратное количество, исходя из массы основания(S)-(+)-клопидогреля), а эфира в малом количестве (0,73-кратное количество, исходя из массы основания-6 013543 Если порядок добавления двух растворов, используемых в методике, меняют на обратный, т.е. подкисленный спирт добавляют к раствору основания (S)-(+)-клопидогреля в эфире, также получают более низкий выход, как показано в примере 15. В способе согласно изобретению кристаллизацию осуществляют предпочтительно в течение 24-48 ч. Для получения полиморфной формы I соединения формулы (I) реакцию осуществляют предпочтительно при комнатной температуре. В способе согласно изобретению выход составляет более 80%, более того, в лучшем случае почти 90%. Способ согласно изобретению имеет преимущество в том, что, исходя из массы основания (S)-(+)клопидогреля, требуется только 1,66-кратное количество спирта с длинной цепью для получения выхода примерно 90%. Смесь растворителей, используемая в способе согласно изобретению, более выгодна также с экологической точки зрения, так как эфирный компонент смеси растворителя может извлекаться простой перегонкой вследствие большой разности между температурами кипения и извлеченный эфир может быть снова повторно использован. В способе получения согласно изобретению воду не используют, поэтому продукт не содержит карбоновую кислоту, возможную примесь в случае, если может происходить гидролиз сложного эфира. Поскольку спирт с длинной цепью используется в малом количестве, а эфир может рециркулироваться, процесс согласно изобретению является экономичным. Чем короче углеродная цепь используемого спирта, тем выше растворимость гидросульфата(S)-(+)-клопидогреля, а увеличенная растворимость приводит к потере выхода, как показано в примере 9. При использовании способа согласно изобретению для получения полиморфной формы I гидросульфата (S)-(+)-клопидогреля формулы (I) отсутствует необходимость использования затравочных кристаллов. Главное преимущество способа согласно изобретению состоит в том, что полиморфная форма I гидросульфата (S)-(+)-клопидогреля образуется с большой надежностью даже в присутствии примеси полиморфной формы II гидросульфата (S)-(+)-клопидогреля. Данный факт доказывается примером 13, в котором полиморфная форма I была получена, несмотря на намеренное добавление полиморфной формыII гидросульфата (S)-(+)-клопидогреля к реагирующей смеси. В способе согласно изобретению не являются существенными ни способ перемешивания, ни температура реакции. Преимущества способа согласно изобретению следующие: высокая степень чистоты полиморфа; безопасная промышленная применимость; высокий выход; снижение нежелательных экологических эффектов; меньшая загрязненность продукта; использование затравочных кристаллов не является необходимым; способ перемешивания не является существенным; используемая температура не является существенной; может использоваться серная кислота 90-100 мас.%; отношение используемых растворителей может изменяться в широких пределах. Изобретение поясняется следующими неограничивающими примерами. Пример 1. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-c]пиридин-5(4H)-ацетата формулы (I). При комнатной температуре 0,54 мл серной кислоты (96 мас.%) добавили к 15 мл (12,4 г) 1-деканола при перемешивании, затем при комнатной температуре добавили в течение примерно 15 мин раствор 3,0 г основания (S)-(+)-клопидогреля в 3,0 мл (2,2 г) метил-трет-бутилового эфира, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 48 ч, затем ее фильтровали и промывали метил-трет-бутиловым эфиром и сушили в вакууме при температуре между 50-60 С. Было получено 2,2 г соединения формулы (I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 56,0%. Температура плавления: 180-181 С (определена с помощью DSC).-7 013543 Пример 2. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I). При комнатной температуре 0,72 мл (96% мас./мас.) серной кислоты добавили к 4 мл (3,3 г) 1-деканола при перемешивании. Затем раствор 4,0 г основания (S)-(+)-клопидогреля в 20,0 мл (14,8 г) метил-трет-бутилового эфира добавили при комнатной температуре в течение примерно 15 мин, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 26 ч, затем ее фильтровали и промывали метил-трет-бутиловым эфиром. Ее сушили в вакууме при температуре между 50-60 С до получения 4,58 г соединения формулы (I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 87,7%. Температура плавления: 180-181 С (определена с помощью DSC). Пример 3. Получение полиморфной формы I гидросульфата (S)-(+)метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). Осуществляли методику, описанную в примере 1, за исключением того, что вместо количества, используемого в примере 1, использовали 4 мл (3,3 г) 1-деканола, 0,68 мл (96 мас.%) серной кислоты,4,0 основания г (S)-(+)-клопидогреля и 40,0 мл (29,6 г) метил-трет-бутилового эфира. Вышеупомянутым образом было получено 4,52 г соединения формулы (I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 86,5%. Температура плавления: 182-183 С (определена с помощью DSC). Пример 4. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I). При комнатной температуре 0,72 мл (96 мас.%) серная кислота была добавлена к 8 мл (6,6 г) 1-деканола при перемешивании. Затем при комнатной температуре в течение примерно 15 мин добавили раствор 4,0 г основания (S)-(+)-клопидогреля в 40,0 мл (29,0 г) диизопропилового эфира, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 26 ч, затем ее фильтровали и промывали диизопропиловым эфиром и сушили в вакууме при температуре между 50-60 С. Данным образом было получено 4,66 г соединения формулы(I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 89,3%. Температура плавления: 180-181 С (определена с помощью DSC). Пример 5. Получение полиморфной формы I гидросульфата (S)-(+)метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I). При комнатной температуре 0,54 мл серной кислоты (96 мас.%) добавили к 6 мл (5,0 г) 1-деканола при перемешивании. Затем раствор 3,0 г основания (S)-(+)-клопидогреля в 30,0 мл (21,2 г) диэтилового эфира добавили при комнатной температуре в течение примерно 15 мин, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 48 ч, затем фильтровали, промывали диэтиловым эфиром и сушили в вакууме при температуре между 50-60 С. Данным образом было получено 3,29 г соединения формулы (I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 84,0%. Температура плавления: 184-185 С (определена с помощью DSC). Пример 6. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При комнатной температуре 1,8 мл серной кислоты (96 мас.%) добавили к 20 мл (16,6 г) 1-деканола при перемешивании. Затем при комнатной температуре добавили раствор 10,0 г основания (S)-(+)клопидогреля в 100 мл (74,0 г) метил-трет-бутилового эфира в течение примерно 15 мин, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 48 ч, затем фильтровали и промывали метил-трет-бутиловым эфиром и сушили в вакууме при температуре между 50-60 С. Вышеупомянутым образом было получено 11,5 г соединения формулы (I), которое было идентифицировано как полиморфная форма I на основе данных аналитических исследований. Выход: 88,1%. Температура плавления: 184-185 С (определена с помощью DSC). Для аналитического исследования полученных таким образом соединений использовались следующие устройства: калориметр Shimadzu DSC-50, ТА Instruments DSC Q10 и TG Q50, спектрофотометрNicolet 380 FTIR и прибор для исследования рентгеновской дифракции Philips PW 1840.-8 013543 Краткое описание чертежей Для подтверждения способа согласно изобретению приложены фиг. 1-4. Фиг. 1 представляет термограмму дифференциальной сканирующей калориметрии (DSC) полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)ацетата формулы (I), полученной согласно примеру 6. Фиг. 2 показывает опытные данные термогравиметрического анализа (TGA) полиморфной формы I(I), полученной согласно примеру 6. Фиг. 3 представляет инфракрасный (ИК) спектр полиморфной формы I гидросульфата(S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I), полученной согласно примеру 6. Фиг. 4 показывает изображение порошковой рентгеновской дифракции (PXRD) полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I), полученной согласно примеру 6. Пример 7. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I). При комнатной температуре 0,54 мл (96 мас.%) серной кислоты добавили к 6 мл (5,0 г) 1-нонанола при перемешивании. Затем раствор 3,0 г основания (S)-(+)-клопидогреля в 30,0 мл (22,2 г) метил-третбутилового эфира добавили при комнатной температуре в течение примерно 15 мин, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 48 ч и фильтровали, промывали метил-трет-бутиловым эфиром и сушили в вакууме при температуре между 50-60 С. Вышеупомянутым образом было получено 3,36 г соединения формулы (I). Аналитические данные подтверждают, что соединение является полиморфной формой I. Выход: 85,8%. Температура плавления: 182-183 С (определена с помощью DSC). Пример 8. Получение полиморфной формы I (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2 с]пиридин-5(4H]-ацетат гидросульфата формулы (I). При использовании методики, описанной в примере 7, было получено соединение формулы (I) с тем отличием, что вместо 1-нонанола использовали 6 мл (5,0 г) 1-деканола. Данным образом было получено 3,44 г соединения формулы (I), которое было идентифицировано аналитическими испытаниями как полиморфная форма I. Выход: 87,9%. Температура плавления: 182-183 С (определена с помощью DSC). Пример 9. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При использовании методики, описанной в примере 7, было получено соединение формулы (I) с тем отличием, что вместо 1-нонанола использовали 6 мл (4,9 г) 1-гептанола. Данным образом было получено 2,63 г соединения формулы (I), которое было идентифицировано аналитическими испытаниями как полиморфная форма I. Выход: 67,2%. Температура плавления: 183-184 С (определена с помощью DSC). Пример 10. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При использовании методики, описанной в примере 7, было получено соединение формулы (I) с тем отличием, что вместо 1-нонанола использовали 6 мл (5,7 г) циклогексанола. Данным образом было получено 3,25 г соединения формулы (I), которое было идентифицировано аналитическими испытаниями как полиморфная форма I. Выход: 83,0%. Температура плавления: 181-182 С (определена с помощью DSC). Пример 11. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При использовании методики, описанной в примере 1, было получено соединение формулы (I), за исключением того, что вместо количества, используемого в методике примера 1, использовали 6 мл(5,0 г) 1-деканола, 0,59 мл (90% мас./мас.) серной кислоты, 3,0 г основания (S)-(+)-клопидогреля и 30,0 мл (22,2 г) метил-трет-бутилового эфира. Данным образом было получено 3,55 г соединения формулы (I), которое было идентифицировано аналитическими испытаниями как полиморфная форма I. Выход: 89,4%. Температура плавления: 182-183 С (определена с помощью DSC).-9 013543 Пример 12. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При использовании методики, описанной в примере 11, было получено соединение формулы (I) с теми изменениями, что вместо 0,59 мл (90 мас.%) серной кислоты использовали 0,54 мл (96 мас.%) серной кислоты, кроме того, добавление раствора основания клопидогреля в эфире и перемешивание реакционной смеси осуществляли при температуре между 30-35 С в течение 48 ч. Данным образом было получено 3,29 г указанного в заголовке соединения. Аналитические испытания подтвердили, что продукт является полиморфной формой I. Выход: 84,0%. Температура плавления: 181-182 С (определена с помощью DSC). Пример 13. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с 1 пиридин-5(4 Н)-ацетата формулы (I). При комнатной температуре 0,51 мл (96 мас.%) серной кислоты добавили к 6 мл (5,0 г) 1-деканола при перемешивании. К раствору 3,0 г основания (S)-(+)-клопидогреля в 30,0 мл (22,2 г) метил-третбутилового эфира добавили 0,05 г полиморфной формы II гидросульфата (S)-(+)-клопидогреля, затем полученную суспензию добавили к вышеупомянутому раствору 1-деканола в серной кислоте при комнатной температуре в течение примерно 15 мин. При этом из реакционной смеси выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 48 ч, затем ее фильтровали, промывали метил-трет-бутиловым эфиром и сушили в вакууме при температуре между 50-60 С. Данным образом было получено 3,19 г продукта, который был идентифицирован аналитическими испытаниями как полиморфная форма I. Выход: 81,4%. Температура плавления: 181-182 С (определена с помощью DSC). Пример 14. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4H)-ацетата формулы (I). При комнатной температуре 0,67 мл (96 мас.%) серной кислоты добавили к 3,75 мл (3,1 г) 1-деканола при перемешивании. К раствору 3,75 г основания (S)-(+)-клопидогреля в 18,8 мл (13,9 г) метил-трет-бутилового эфира добавили вышеупомянутый раствор 1-деканола в серной кислоте при комнатной температуре в течение примерно 15 мин, при этом выделяется трудный для перемешивания материал. При комнатной температуре реакционную смесь перемешивали в течение еще 26 ч, затем ее фильтровали, промывали метил-трет-бутиловым эфиром и сушили в вакууме при температуре между 50-60 С. Данным образом было получено 3,96 г продукта, который был идентифицирован аналитическими испытаниями как полиморфная форма I. Выход: 80,9%. Температура плавления; 181-182 С (определена с помощью DSC). Пример 15. Получение полиморфной формы I гидросульфата (S)-(+)-метил(2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I). При использовании методики, описанной в примере 14, был получен указанный в заголовке продукт с тем различием, что вместо количеств примера 14 использовали 4 мл (3,3 г) 1-деканола, 0,72 мл(96 мас.%) серной кислоты, 4,0 г основания (S)-(+)-клопидогреля и 40,0 мл (29,6 г) метил-третбутилового эфира и реакционную смесь перемешивали в течение еще 24 ч. Данным образом было получено 3,27 г продукта, который был идентифицирован аналитическими испытаниями как полиморфная форма I. Выход: 62,6%. Температура плавления: 182-183 С (определена с помощью DSC). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения фармацевтически применимой полиморфной формы I гидросульфата (S)-(+)метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата формулы (I) путем реакции (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата и серной кислоты в присутствии растворителей, который включает растворение (S)-(+)-метил(2 хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата в простом эфире; смешивание данного раствора с раствором спирта С 6-С 11 и серной кислоты и извлечение полученного таким образом соединения формулы (I) из маточного раствора. 2. Способ по п.1, в котором используют один или более простой алифатический эфир с прямой или разветвленной цепью общей формулы Cn-O-Cm, где n и m могут быть различными или одинаковыми и n равно 1-4, a m равно 2-4. 3. Способ по п.2, в котором используют метил-трет-бутиловый эфир. 4. Способ по любому из пп.1-3, в котором используют один или более линейный или разветвленный, алифатический или циклический, первичный, вторичный или третичный спирт С 6-С 11. 5. Способ по п.4, в котором используют 1-деканол. 6. Способ по любому из пп.1-5, в котором (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2 с]пиридин-5(4 Н)-ацетат растворяют в 0,7-7,4-кратном количестве эфира. 7. Способ по п.6, в котором (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)ацетат растворяют в 7,4-кратном количестве эфира. 8. Способ по любому из пп.1-7, в котором спирт используют в 0,8-4,1-кратном количестве, исходя из массы (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата. 9. Способ по п.8, в котором спирт используют в 1,66-кратном количестве, исходя из массы (S)-(+)метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата. 10. Способ по любому из пп.1-9, в котором эфир используют в 0,17-8,96-кратном количестве, исходя из массы спирта. 11. Способ по п.10, в котором эфир используют в 4,45-кратном количестве, исходя из массы спирта. 12. Способ по любому из пп.1-11, в котором используют 0,9-1,25 мольных эквивалентов серной кислоты на 1 моль (S)-(+)-метил(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-ацетата. 13. Способ по п.12, в котором используют 1 мол.экв. серной кислоты на 1 моль (S)-(+)-метил(2 хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4H)-ацетата. 14. Способ по любому из пп.1-13, в котором используют серную кислоту с концентрацией 90-100 мас.%. 15. Способ по п.14, в котором используют серную кислоту с концентрацией 96 мас.%. 16. Способ по любому из пп.1-15, в котором кристаллизацию осуществляют в течение 24-48 ч. 17. Способ по любому из пп.1-16, в котором реакцию проводят при комнатной температуре.
МПК / Метки
МПК: A61P 7/02, C07D 495/04, A61K 31/4365
Метки: полиморфной, способ, пиридин-5(4н)-ацетата, s)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-c, гидросульфата, формы, получения
Код ссылки
<a href="https://eas.patents.su/14-13543-sposob-polucheniya-polimorfnojj-formy-i-gidrosulfata-s-metil-a-2-hlorfenil-67-digidrotieno32-c-piridin-54n-acetata.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения полиморфной формы i гидросульфата (s)-(+)-метил-a-(2-хлорфенил)-6,7-дигидротиено[3,2-c] пиридин-5(4н)-ацетата</a>
Предыдущий патент: Производные индола, обладающие противоопухолевой активностью
Следующий патент: Применение оксикодона для лечения висцеральной боли
Случайный патент: Способ лечения синдрома отвыкания от зависимости у беременных женщин












