Способ рацемизации r(-) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-c]пиридин-5(4н)-уксусной кислоты
Формула / Реферат
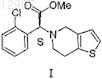
1. Способ рацемизации R(-) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-уксусной кислоты формулы II
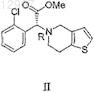
посредством превращения его части в S(+) изомер метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-уксусной кислоты формулы I
и получения S(+) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-уксусной кислоты формулы I, отличающийся тем, что смесь веществ I и II растворяют в сложном эфире формулы Ra(O)ORb, где Ra и Rb независимо представляют собой С1-С5алифатический заместитель или С5-С8 ароматический заместитель, и добавляют к этому раствору раствор R-камфорсульфоновой кислоты в растворителе формулы RaOH, из перемешанного раствора кристаллизуют соль камфорсульфоновой кислоты вещества формулы I, которую на следующей стадии превращают в вещество формулы I; далее к маточным растворам после кристаллизации добавляют основание формулы R1R2R3R4N+OH-, где R1, R2, R3 и R4 представляют собой одинаковые или разные заместители, выбранные из С1-С5-алкилов или С5, С6-циклоалкилов или арилов, С7-С9-алкилциклоалкилов или алкиларилов, в растворе в веществе формулы RaOH, получая в результате смесь веществ I и II, пригодную для получения вещества формулы I.
2. Способ по п.1, отличающийся тем, что в качестве вещества формулы RaOH выбирают метанол, а в качестве вещества формулы Ra(O)ORb выбирают изопропилацетат.
Текст
012907 Область техники Изобретение относится к новому способу рацемизации R(-) изомера метилового эфира (2 хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-уксусной кислоты, который представляет собой противоположный изомер известного антитромботического агента клопидогреля и является отходом синтеза. Предшествующий уровень техникиS-(+) изомер метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)-уксусной кислоты формулы I известный под непатентованным названием клопидогрель (или S-клопидогрель), является эффективным антитромботическим агентом, показанным, в частности, для предупреждения атеросклеротических процессов у пациентов, перенесших инфаркт или удар или страдающих ишемической болезнью нижних конечностей. Он, следовательно, играет ключевую роль в предупреждении рецидивов таких заболеваний и,следовательно, предотвращает фатальные последствия этих заболеваний. Способ получения клопидогреля (вещества формулы I) описан в ряде патентов. Здесь цитируются те, которые составляют наиболее релевантную в отношении настоящего изобретения часть предшествующего уровня техники. В патенте ЕР 99802 была описана группа веществ с антиагрегационным эффектом, которая включает также вещество формулы I. В этом патенте также упомянуты оптически активные изомеры этих веществ. Получение веществ типа клопидогреля (I) согласно данному патенту осуществляли посредством взаимодействия 4,5,6,7-тетрагидротиено[3,2-с]пиридина с альфа-хлор-производным эфира альфа(хлорфенил)уксусной кислоты в присутствии основания. Дальнейшие исследования, опубликованные в патенте ЕР 281459, показали, что из веществ, описанных в вышеупомянутом патенте, наиболее предпочтительным является гидросульфат (анион HSO4-) вещества формулы I. Данную соль тестировали в отношении антиагрегационных эффектов и сравнивали с некоторыми другими солями. В ЕР 281459 также описан способ получения этой соли, который состоит в разделении рацемической смеси вещества формулы I с R изомером формулы II Смесь веществ I и II переводили в соли R(-) камфорсульфоновой кислоты в ацетоне, а затем кристаллизовали. За этим следовало несколько перекристаллизаций, в том числе из ацетона, до получения,по существу, чистого камфорсульфоната вещества I. В патенте США 6737411 описан усовершенствованный способ такого разделения. Он состоит в получении камфорсульфоновой кислоты в смеси C1-C12 углеводородов с подходящим сорастворителем,который выбран из группы, включающей диметилформамид, бутанол или ацетон. В предпочтительном воплощении камфорсульфоновую кислоту растворяют в диметилформамиде и добавляют к раствору смеси веществ I и II в толуоле. Рацемизация нежелательного энантиомера R, состоящая в превращении его части в S-энантиомер и возвращении этой смеси в реакцию разделения, описана в патентной заявке WO 00/59128, где неорганическое основание используют для рацемизации в отношении 1:1. Хотя эта методика стабильно дает рацемическую смесь S(+) и R(-) энантиомеров, имеет место омыление эфиров I и II. Чтобы получить возможность вернуть рацемическую смесь в реакцию разделения, необходимо превратить щелочные соли обратно в эфиры. Это требует дополнительных стадий, что повышает потери и трудоемкость получения. Указанный недостаток устраняется в патенте США 6737411, согласно которому используют каталитическое количество алкоголята, предпочтительно трет-бутанолята калия. Этот способ дает в результате рацемическую смесь эфиров, но эта реакция может проходить только в абсолютно безводной среде. Поэтому реакционную смесь следует сначала высушить и в ней нужно поддерживать определенное содержание воды, которое должно быть ниже чем 0,05% (согласно определению по способу Карла Фишера). Однако авторы изобретения открыли способ, который дает в результате рацемическую смесь эфиров, но не требует строго безводной среды.-1 012907 Описание изобретения Изобретение относится к способу рацемизации R(-) изомера метилового эфира (2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-уксусной кислоты (II) (также называемого R-клопидогрелем) посредством превращения его части в S(+) изомер метилового эфира (2-хлорфенил)-6,7 дигидротиено[3,2-с]пиридин-5(4 Н)-уксусной кислоты (I) (также называемого S-клопидогрелем), которое протекает в органическом растворителе, выбранном из спиртов RaOH, сложных эфиров формулы Ra(O)ORb, кетонов формулы Ra(O)Rb или простых эфиров формулы RaORb, или в их смеси, где Ra иRb независимо представляют собой алифатический С 1-С 5 заместитель или ароматический С 5-С 8 заместитель, в присутствии основания, выбранного из веществ формулы R1R2R3R4N+OH-, где R1, R2, R3 и R4 представляют собой одинаковые или разные заместители, выбранные из С 1-С 5-алкилов или С 5, С 6 циклоалкилов или арилов, С 7-С 9-алкилциклоалкилов или алкиларилов, где молярное отношение основания к исходному веществу составляет от 1:1 до 1:10. Этот способ основан на удивительно выгодных свойствах гидроксидов алкил-, арил- или циклоалкиламмония, которые катализируют рацемизацию даже будучи взятыми в малом молярном отношении к реагирующему веществу (1:10), однако отношение от 1:2 до 1:4 оказалось более выгодным. Однако эти вещества не вызывают омыление эфиров даже в эквимолярном сочетании. Из группы гидроксидов аммония, которые применимы в этой реакции, предпочтительно выбирать имеющиеся в продаже или самые дешевые соединения. В предпочтительном воплощении, таким образом, заместители R1, R2, R3 и R4 представляют собой С 1-С 5-алкил, более предпочтительно R1=R2=R3=R4 и представляет собой метил или бутил. Выбор растворителей связан с растворимостью этих двух агентов. Соответственно, реакцию можно проводить в спиртах формулы RaOH, где Ra представляет собой алифатический С 1-С 5 заместитель или ароматический С 5-С 8 заместитель, в сложных эфирах формулы Ra(O)ORb, где Rb также представляет любой алифатический С 1-С 5 заместитель или ароматический С 5-С 8 заместитель, либо в кетонах формулыRa(O)Rb, либо в простых эфирах формулы RaORb, либо в смеси таких растворителей. С учетом широкого диапазона растворителей, которые могут быть выбраны для рацемизации согласно изобретению, возможно сделать такой выбор, чтобы рацемизация проходила в том же растворителе, в котором произошло разделение веществ I и II и отделение нежелательного S-изомера. Маточные растворы, в которых преобладает R-изомер II, подвергают рацемизации без дополнительного выделения,и, в конце концов, выделяют смесь R- и S-изомеров клопидогреля, т.е. веществ I и II. В отношении успешности отделения нежелательного S-изомера I очень подходящей комбинацией оказывается растворение исходной смеси I и II в сложном эфире формулы Ra(O)ORb, предпочтительно изопропилацетате, с последующим взаимодействием с раствором R-камфорсульфоновой кислоты в растворителе формулы RaOH, предпочтительно в метаноле. После отделения соли S-клопидогреля путем кристаллизации к маточным растворам (значение условных обозначений описано выше) добавляют гидроксид R1R2R3R4N+OH (где значения условных обозначений такие, как определено выше), предпочтительно имеющиеся в продаже гидроксиды, где R1, R2, R3 и R4 представляют собой алифатические заместители, такие как гидроксид тетраметиламмония или гидроксид тетрабутиламмония, в растворе RaOH,предпочтительно в метаноле. Такая методика дает возможность экономной организации как процесса получения S-клопидогреляI, пригодного для медицинского применения, так и процесса рацемизации по изобретению. Реакционную смесь сначала охлаждают до температуры от 0 до 10 С и при нормальной температуре, т.е. примерно 20-25 С, реакция может пройти до конца спустя 1-5 ч. Обычное время реакции составляет от 10 до 24 ч. Примеры Далее изобретение проиллюстрировано с использованием приведенных ниже примеров. Сокращения, использованные в примерах, имеют следующие значения: ГТМА - гидроксид тетраметиламмония; ГТБА - гидроксид тетрабутиламмония. Пример 1. 2,53 г R-клопидогреля (7,86 ммоль) растворяли в 50 мл метанола. Полученный в результате раствор-2 012907 охлаждали в бане вода+лед до температуры 5-10 С и добавляли к этому раствору 1,65 мл (3,93 ммоль) 25% раствора ГТМА в метаноле. Полученный в результате раствор перемешивали в охлаждающей бане при температуре от 5 до 10 С в течение 2,5 ч. Затем охлаждающую баню удаляли и раствору давали нагреться до комнатной температуры. При этой температуре реакционную смесь перемешивали еще в течение 20 ч. После этого метанол выпаривали из раствора в роторном вакуумном испарителе и остаток после выпаривания распределяли между 20 мл воды и 20 мл дихлорметана. Дихлорметановый слой высушивали безводным сульфатом магния и выпаривали в роторном вакуумном испарителе. Получили 1,75 г (69,2%) рацемической смеси R-клопидогреля и S-клопидогреля.[a]D=-0,5; МеОН. Анализ с использованием капиллярного электрофореза продемонстрировал присутствие Rклопидогреля:S-клопидогреля в соотношении 50:50. Спектр 1 Н ЯМР (250 МГц, CDCl3):7.71 m (1 Н),7.40 m (1H), 7.23-7.31 m (2 Н), 7.07 d (5 Гц, 1 Н),6.76 d (5.0 Гц, 1 Н), 4.94 s (1H), 3.81 m (2H), 3.72 s (3H), 2.88 m (2H), 2.74 m (2H). Спектр 13 С ЯМР (62,9 МГц, CDCl3):171.3, 134.7, 133.8, 133.5, 132.4, 130.0, 129.8, 129.4, 127.2,126.9, 122.4, 67.5, 52.1, 49.7, 48.0, 25.6. Пример 2. 9,48 г R-клопидогреля (29,45 ммоль) растворяли в 75 мл изопропилацетата. Полученный в результате раствор охлаждали в бане вода+лед до температуры 5-10 С и добавляли к этому раствору 6,2 мл (14,72 ммоль) 25% раствора ГТМА в метаноле. Полученный в результате раствор перемешивали в охлаждающей бане при температуре от 5 до 10 С в течение 4 ч. Затем охлаждающую баню удаляли и раствору давали нагреться до комнатной температуры. При этой температуре реакционную смесь перемешивали в течение ночи. Затем к реакционной смеси добавляли 10 мл воды. Воду отделяли и органическую фазу экстрагировали еще раз 20 мл воды, высушивали безводным сульфатом магния и выпаривали в роторном вакуумном испарителе. Получили 6,9 г (72,9%) рацемического клопидогреля.[а]D=0; МеОН. Пример 3. Раствор 35,8 г R-клопидогреля (0,111 моль) в 350 мл изопропилацетата охлаждали в бане вода+лед до температуры 5-10 С и добавляли к этому раствору 42,5 мл (55,62 ммоль) 40% раствора ГТБА в метаноле. Полученный в результате раствор перемешивали в охлаждающей бане при температурах от 5 до 10 С в течение 2 ч. Затем охлаждающую баню удаляли и раствору давали нагреться до комнатной температуры. При этой температуре реакционную смесь перемешивали в течение 17 ч. Затем реакционную смесь экстрагировали 2150 мл воды, высушивали безводным сульфатом магния и выпаривали в роторном вакуумном испарителе. Получили 35,4 г рацемического клопидогреля.[а]D=-0,5; МеОН. Пример 4. Раствор 73,57 г R-клопидогреля (0,2286 моль) в 900 мл изопропилацетата охлаждали в бане вода+лед до температуры 5-10 С и добавляли к этому раствору 48,18 (55,62 ммоль) 25% раствора ГТМА в метаноле в течение 15 мин. Полученный в результате раствор перемешивали в охлаждающей бане при температурах от 1 до 2 С в течение 2,5 ч. Затем охлаждающую баню удаляли и раствору давали нагреться до комнатной температуры. При этой температуре реакционную смесь перемешивали в течение ночи. Затем реакционную смесь экстрагировали 2150 мл воды, высушивали безводным сульфатом магния и выпаривали в роторном вакуумном испарителе. Получили 73,0 г рацемической смеси R- и S-клопидогреля.[a]D=-1,0; МеОН. Пример 5. Раствор основания в изопропилацетате (3,134 кг смеси R-клопидогреля и S-клопидогреля (1:1); 4,96 моль в 14 л изопропилацетата) загружали в бойлер, оборудованный термометром, холодильником и кальций-хлоридной трубкой. При перемешивании этот раствор нагревали в водяной бане до температуры от 45 до 50 С. К этому теплому раствору добавляли предварительно приготовленный раствор (R)-(-)-10 камфорсульфоновой кислоты в метаноле (1,160 кг кислоты в 1200 мл метанола). Затем к этому прозрачному раствору добавляли 12 л изопропилацетата при температуре от 45 до 50 С. Начинали охлаждение раствора до температуры 20-25 С. Раствор затравливали и давали кристаллизоваться при перемешивании сначала при температуре 20-25 С в течение 2 ч. Затем начинали охлаждение раствора до температуры от 5 до 10 С и раствор кристаллизовали при этой температуре в течение 3 ч. Полученные в результате кристаллы отсасывали через воронку Бюхнера и промывали минимальным количеством изопропилацетата (примерно 0,5 л). Получили 1560 г S-клопидогреля камфорсульфоната. Маточные растворы после кристаллизации обрабатывали с помощью методики, описанной в примере 6.-3 012907 Пример 6. 1 л изопропилацетатных маточных растворов из примера 5 экстрагировали 2150 мл 10% раствораNaHCO3. Органический слой отделяли и высушивали безводным MgSO4. Осушитель удаляли фильтрованием и 500 мл изопропилацетатного раствора, который содержал 45,73 г (0,142 моль) основания клопидогреля, загружали в трехгорлую колбу, оборудованную термометром, магнитной мешалкой и капельной воронкой. Изопропилацетатный раствор охлаждали в бане вода+лед до температуры 2 С. Затем по каплям в течение 10 мин добавляли раствор ГТМА (26 г 25% метанольного раствора). Реакционную смесь охлаждали до температуры 2 С в течение 2,5 ч. Затем ее медленно доводили до комнатной температуры и перемешивали при этой температуре в течение 19 ч. Затем реакционную смесь экстрагировали 280 мл дистиллированной воды. Изопропилацетатный раствор основания выпаривали и получили 44,08 г смеси R-клопидогреля основания и S-клопидогреля основания.[a]D=0; МеОН. Пример 7. Смесь R- и S-клопидогреля основания из предшествующего примера растворяли в 144 мл изопропилацетата и к этому раствору добавляли раствор 16,21 г (R)-(-)-10-камфорсульфоновой кислоты в 16,8 мл метанола при температуре 50 С. К полученному в результате раствору добавляли еще 168 мл изопропилацетата. Затем реакционную смесь охлаждали до комнатной температуры и перемешивали при этой температуре в течение 2 ч. Затем реакционную смесь кристаллизовали при 5 С в течение 48 ч. Затем ее отсасывали и промывали небольшим количеством изопропилацетата. Получили 20,5 г S-клопидогреля камфорсульфоната. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ рацемизации R(-) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2 с]пиридин-5(4 Н)-уксусной кислоты формулы II посредством превращения его части в S(+) изомер метилового дигидротиено[3,2-с]пиридин-5(4 Н)-уксусной кислоты формулы I(2-хлорфенил)-6,7 и получения S(+) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4 Н)уксусной кислоты формулы I, отличающийся тем, что смесь веществ I и II растворяют в сложном эфире формулы Ra(O)ORb, где Ra и Rb независимо представляют собой С 1-С 5 алифатический заместитель или С 5-С 8 ароматический заместитель, и добавляют к этому раствору раствор R-камфорсульфоновой кислоты в растворителе формулы RaOH, из перемешанного раствора кристаллизуют соль камфорсульфоновой кислоты вещества формулы I, которую на следующей стадии превращают в вещество формулы I; далее к маточным растворам после кристаллизации добавляют основание формулы R1R2R3R4N+OH-, где R1, R2,R3 и R4 представляют собой одинаковые или разные заместители, выбранные из С 1-С 5-алкилов или С 5,С 6-циклоалкилов или арилов, С 7-С 9-алкилциклоалкилов или алкиларилов, в растворе в веществе формулы RaOH, получая в результате смесь веществ I и II, пригодную для получения вещества формулы I. 2. Способ по п.1, отличающийся тем, что в качестве вещества формулы RaOH выбирают метанол, а в качестве вещества формулы Ra(O)ORb выбирают изопропилацетат.
МПК / Метки
МПК: C07D 495/04
Метки: эфира, рацемизации, метилового, изомера, 2-хлорфенил)-6,7-дигидротиено[3,2-c]пиридин-5(4н)-уксусной, способ, кислоты
Код ссылки
<a href="https://eas.patents.su/5-12907-sposob-racemizacii-r-izomera-metilovogo-efira-2-hlorfenil-67-digidrotieno32-cpiridin-54n-uksusnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ рацемизации r(-) изомера метилового эфира (2-хлорфенил)-6,7-дигидротиено[3,2-c]пиридин-5(4н)-уксусной кислоты</a>









