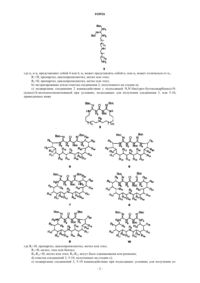
Циклические гуанидиновые производные, способ их получения и применения
Формула / Реферат
1. Соединение, имеющее общую формулу (9)
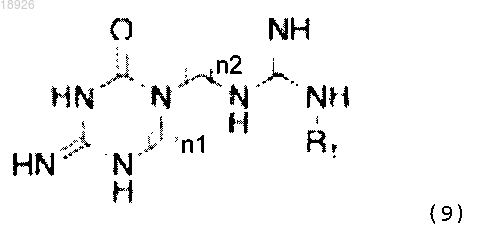
где R1 представляет собой Н, пропаргил, циклопропилметил, бензил, бут-2-енил, изобутенил, пренил;
n1 и n2 представляют собой равные или различные числа в диапазоне от 4 до 8,
и его соли.
2. Соединение по п.1, где
R1 представляет собой Н, бензил, пропаргил, бут-2-енил, изобутенил или пренил;
n1 = 8 и n2 = 8.
3. Применение соединения по любому из пп.1-2 в качестве противогрибкового средства.
4. Применение по п.3, где противогрибковое средство является противогрибковым средством против видов Candida.
5. Применение по п.4, где виды Candida принадлежат к группе С. albicans, С. krusei, С. parapsilosis.
6. Фармацевтическая композиция, содержащая соединение по любому из пп.1-2 или смесь любых из них и подходящие эксципиенты и разбавители.
7. Способ получения соединения по любому из пп.1-2, включающий следующие стадии:
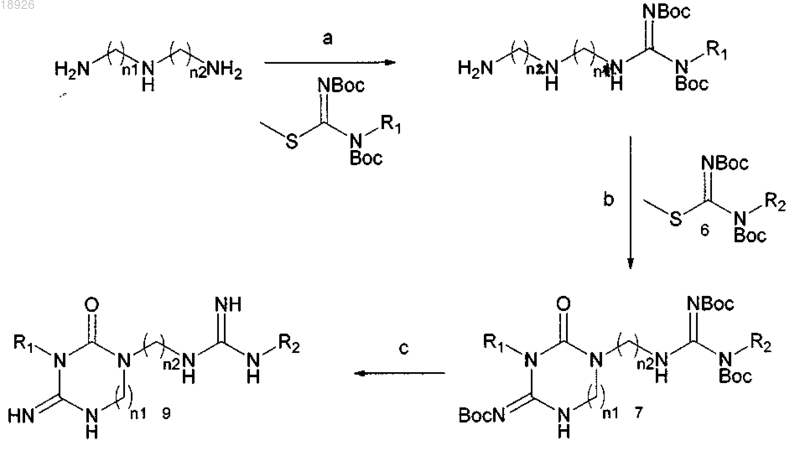
а) ТГФ:МеОН (5:3), 50°С; b) ТГФ 60°С; с) 10% ТФК, безводный CH2Cl2, 24 ч, комнатная температура, R1=H, R2=H, пропаргил, циклопропилметил, бензил, изобутенил, бут-2-енил, пренил, n1 и n2 представляют собой равные или различные числа в диапазоне от 4 до 8.
Текст
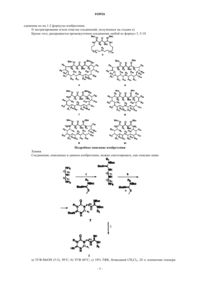
ЦИКЛИЧЕСКИЕ ГУАНИДИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ Настоящее изобретение относится к циклическим гуанидиновым производным формулы (9),способу их получения и применениям, фармацевтическим композициям, которые применяются в качестве противогрибковых средств, особенно против видов Candida.(71)(73) Заявитель и патентовладелец: УНИВЕРСИТА ДЕЛЬИ СТУДИ ДИ СИЕНА (IT) Область техники Настоящее изобретение относится к циклическим гуанидиновым производным, их способу получения и применениям, фармацевтическим композициям, которые пригодны в качестве противогрибковых средств, особенно против видов Candida. Уровень техники, к которому относится изобретение Условно-патогенные для человека виды Candida albicans или другие не-albicans виды приобрели существенное клиническое значение в качестве возбудителей инфекции у больных с ослабленным иммунитетом, при этом обуславливая существенные причины заболеваемости и смертности. Рекомендованная терапия основана на флуконазоле, вориконазоле и каспофунгине. Фактически, также многие из новых возможных противогрибковых средств, которые можно найти в литературе, обладают азоловым ядром. Значимость патогенных видов Candida обуславливается не только тяжестью вызываемых инфекций,но также их способностью развивать резистентность к многообразию противогрибковых средств. Фактически, распространенное и длительное применение азолов привело к быстрому развитию множественной лекарственной резистентности, что создает главное препятствие в противогрибковой терапии. Многие из доступных в настоящее время лекарственных средств стали неэффективными против новых или вновь появляющихся грибков, что обусловлено быстрым развитием резистентности. Данные проблемы вызвали необходимость разработки новых эффективных противогрибковых средств. Соответственно, в последние годы сообщалось о новых структурных классах противогрибковых средств, среди которых, как оказалось, гуанидиновые производные обладают очень интересной ингибирующей активностью. В качестве примера гуазатин (смесь гуанидинов и полиаминов, применяемая в качестве фунгицида в сельском хозяйстве) был классифицирован как умеренно опасное противогрибковое средство, тогда как результаты исследований на животных in vivo показали высокий потенциал гуазатина и родственных соединений в качестве противогрибковых средств. Недавно авторы сообщили, что компоненты гуазатина способны действовать на виды Candida albicans и не-albicans виды. Сущность изобретения Настоящее изобретение касается новых циклических гуанилированных производных различных полиаминов. На основании результатов, полученных с компонентами гуазатина, были синтезированы новые циклические гуанидиновые производные различных полиаминов, и был проведен их биологический анализ по отношению к 8 клиническим изолятам и 3 контрольным видам Candida (С. albicans ATCC 60193, С. krusei ATCC 14243, С. parapsilosis ATCC 34136). Новые соединения, объект данного изобретения, обладают превосходной противогрибковой активностью, и они 1) являются очень активными по отношению к различным видам Candida; 2) имеют низкую токсичность; 3) также являются активными по отношению к штаммам Candida, резистентным к лекарственным средствам. Соединения данного изобретения раскрыты в прилагаемой формуле изобретения в пп.1-2. Нужно понимать, что данное раскрытие является частью описания. Кроме того, объектом данного изобретения являются соединения, которые раскрыты в формуле изобретения пп.1-2, для применения в качестве лекарственного средства. Кроме того, объектом данного изобретения является применение соединений, которые раскрыты в пп.1-2 формулы изобретения, в качестве противогрибкового средства, более предпочтительно в качестве противогрибкового средства против видов Candida, еще более предпочтительным является, если видыCandida принадлежат к группе С. albicans, С. krusei, С. parapsilosis. Кроме того, объектом данного изобретения является фармацевтическая композиция, содержащая соединения по любому из пп.1-2 или смесь любых из них, и подходящие эксципиенты и разбавители. Специалист в данной области подберет подходящие эксципиенты и разбавители в соответствии со способом введения (местный, пероральный, парентеральный и т.д.). Соединения, которые раскрыты в любом из пп.1-2 формулы изобретения, могут быть получены способом, включающим следующие стадии: а) взаимодействие подходящего амина R1-NH2 с подходящей S-метилизотиомочевиной в подходящем растворителе для получения соединения 2 где n1 и n2 представляют собой 4 или 6, n2 может представлять собой n1 или n2 может отличаться от n1;b) экстрагирование и/или очистка соединения 2, полученного на стадии а);c) подвергание соединения 2 взаимодействию с подходящей N,N'-бис(трет-бутоксикарбонил)-N(алкил)-S-метилизотиомочевиной при условиях, подходящих для получения соединения 3, или 5-10,приведенных нижеR4-R23=H, метил или этил; R4-R23 могут быть одинаковыми или разными;d) очистка соединений 3, 5-10, полученных на стадии с);e) подвергание соединений 3, 5-10 взаимодействию при подходящих условиях для получения со-2 018926f) экстрагирование и/или очистка соединений, полученных на стадии е). Кроме того, раскрывается промежуточное соединение любой из формул 3, 5-10 Подробное описание изобретения Химия. Соединения, описанные в данном изобретении, можно синтезировать, как описано ниже тура, R1=H, R2=H, пропаргил, циклопропилметил, бензил, изобутенил, бут-2-енил, пренил, n1 и n2 представляют собой равные или различные числа в диапазоне от 4 до 8. Примеры синтетических способов(12). К перемешиваемому при 50 С раствору 1,17-диамино-9-азагептадекана 3 (4,9 г, 15,06 ммоль) в ТГФ/СН 3 ОН 5/3 (80 мл) добавляли по каплям раствор N,N'-бис(трет-бутоксикарбонил)-Sметилизотиомочевины (1,456 г, 5,02 ммоль) в ТГФ (25 мл) в течение 1 ч. Через 16 ч реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали посредством флэшхроматографии (6% метанол, 4% триэтиламин, 90% этилацетат), получая 12 в виде бледно-желтого масла, 3,51 г (70%). Референсный пример 2. Общий способ получения 14. К перемешиваемому при 60 С раствору 12 (1,5 ммоль) в ТГФ (15 мл) добавляли по каплям раствор подходящей N,N'-бис(трет-бутоксикарбонил)-N-(алкил)-S-метилизотиомочевины (1 ммоль) в ТГФ (5 мл). Реакционные смеси перемешивали при 60 С в течение 16 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Неочищенные смеси очищали посредством флэшхроматографии, получая при этом 14 а-b в виде желтых масел. Данные ЯМР для соединений 14 а-b. 2,6[(ди-трет-Бутоксикарбонил)диимидо]-3-бензил-5-трет-бутоксикарбонил-1,3,5,7,16-пентаазациклотетракозан-4-он (14 а). 1H ЯМР (CDCl3) : 8,09 (NH, уш.с), 4,45 (2 Н, с), 3,50 (1 Н, с), 3,45-3,20 (4 Н, м), 3,25-3,15 (4 Н, м),2,01-1,82 (4 Н, м), 1,48 (9 Н, с), 1,43 (9 Н, с), 1,41 (9 Н, с), 1,32-1,11 (20 Н, м). МС (ESI): m/z=720,2 [M+H]+. Референсный пример 3. Общий способ синтеза соединений 4 а-4 е. Соединения 3 а-3 е обрабатывали 10% раствором свежеперегнанной ТФК в безводном ДХМ (30 мл для 1 ммоль) и полученные реакционные смеси перемешивали при комнатной температуре в атмосфере аргона. Через 24 ч реакционные смеси концентрировали при пониженном давлении с получением желаемых соединений в виде три трифторацетатных солей (коричневые масла), с количественным выходом. Полученные смеси очищали посредством полупрепаративной ВЭЖХ, получая при этом конечные соединения в виде три триформиатных солей. Данные ЯМР для соединений 15 а-15 е. Три трифторацетат 2,6-диимидо-3-бензил-1,3,5,7,16-пентаазациклотетракозан-4-она (15 а). 1(4 Н, м), 3,20-3,10 (4 Н, м), 1,65-1,44 (14 Н, м), 1,30-1,28 (16 Н, м). МС (ESI): m/z=450,3 [M+H]+. Биологические исследования Определение минимальных ингибирующих концентраций (МИК) посредством стандартной методики AFST-EUCAST. Среда для анализа. Средой для анализа была RPMI 1604 без NaHCO3 и с L-глутамином (Sigma Aldrich, Italy) с рН 7,0, поддерживаемым при помощи 0,165 М морфолинпропансульфоновой кислотой(Sigma Aldrich, Italy), и добавлением 2% (мас./об.) глюкозы. Данную среду, приготовленную в виде раствора двойной концентрации, стерилизовали посредством фильтрации и разбавляли 1:2 (по объему) грибковым инокулятом, приготовленным в стерильной дистиллированной воде. Приготовление инокулята. Дрожжевые изоляты выращивали на агаре Сабуро с декстрозой (Oxoid, Madrid, Spain) в течение 48 ч при 37 С перед исследованием. Суспензии получали посредством объединения пяти отдельных колоний каждой культуры 1 мм в диаметре. Применяли спектрофотометрический анализ препарата инокулята. Конечная суспензия инокулята, приготовленная в стерильной дистиллированной воде, содержала от 0,5105 до 2,5105 КОЕ/мл. Противогрибковые средства. Исходные растворы исследуемых соединений готовили в 100% диметилсульфоксиде. Исходные растворы готовили в концентрации в 100 раз большей относительно самой высокой концентрации в исследовании противогрибковой активности и замораживали при -70 С до момента применения. Исследование чувствительности к воздействию лекарственного средства. Применяли стерильные пластиковые микротитрационные планшеты, содержащие плоскодонные ячейки. Планшеты содержали серийное разбавление противогрибковых средств средой для анализа объемом 100 мкл/ячейка. В качестве контроля стерильности и контроля роста две ячейки оставляли без лекарственного средства только со средой. Планшеты инокулировали 100 мкл/ячейка конечного инокулята за исключением ячеек контроля стерильности. Диапазон исследуемых концентраций для каждого лекарственного средства составлял 1,25-80 мкМ. Микротитрационные планшеты инкубировали при 37 С в течение 24 ч. Минимальные ингибирующие концентрации (МИК) определяли через 24 ч как визуально,так и спектрофотометрически. Визуальное определение конечной точки. МИК определяли посредством визуального определения конечной точки по шкале S-I-R, где S(чувствительная к лекарству) обозначает оптически чистую культуру, I (промежуточная чувствительность к лекарству) обозначает слегка опалесцирующую культуру, a R (резистетнтная к лекарству) обозначает культуру, в которой опалесценция не уменьшается. МИК 50 определяли как самую низкую концентрацию лекарственного препарата, которая соответствует S культуре. Спектрофотометрическое определение конечной точки. Микротитрационные планшеты перемешивали при помощи микротитрационного встряхивателя,перед тем как снимать показания, чтобы обеспечить однородную опалесценцию. МИК получали посредством измерения поглощения при 450 нм при помощи микротитрационного планшет-ридера. Значение для контроля вычитали из показаний остальных ячеек. Для каждого исследуемого противогрибкового средства определяли две конечные точки, при этом МИК 80 обозначала самую низкую концентрацию лекарственного средства, приводящую к 80% или более уменьшению роста (определено спектрофотометрически) по сравнению с ростом контроля, а МИК 50 обозначала самую низкую концентрацию лекарственного средства, приводящую к 50% уменьшению роста (определено спектрофотометрически) по сравнению с ростом контроля. МИК 50 также определяли как спектрофотометрическую конечную точку. Результаты Результаты биологических исследований показаны в табл. 1 и 2. Соединение 15 е, содержащее самую объемную боковую цепь (пренильную группу), показало вызывающую интерес активность по отношению к С. albicans (20-40 мкМ), С. krusei и С. tropicalis, тогда как С. parapsilosis и С. glabrata были менее чувствительны к данному соединению (40-80 мкМ). При уменьшении размера ненасыщенной цепи до бутенильной группы (15 с), активность значительно увеличилась, показывая хорошие величины по отношению к С. albicans (2,5 мкМ против всех штаммов) и С. tropicalis (1,25 мкМ). Штаммы С. krusei также были чувствительными, но при более низкой концентрации (10 мкМ). Замена бутенильной цепи на метилпропенильную группу (15d) приводила к драматическому уменьшению активности против всех грибковых штаммов. Самая лучшая активность для данного соединения была обнаружена по отношению к С. albicans (МИК=20 мкМ по отношению к стандартному штамму и штамму 15 Т). При дальнейшем уменьшении размера боковой цепи до пропаргиловой группы, как в соединении 15b, восстанавливается хорошая активность по отношению к С. albicans (за исключением С. albicans 4T, который был резистентным к данному соединению) и С. tropicalis (5 мкМ). Наконец, ароматизация боковой цепи до бензильной группы (15 а) приводит к данным по активности, сопоставимым с данными, обнаруженными для бутенильного производного (15 с). В заключение, как бутенильное, так и бензильное производные проявили самые лучшие значения противогрибковой активности, за ними следует пропаргиловое соединение, которое сохраняло вызывающую интерес активность по отношению к широкому ряду грибковых штаммов. Таблица 1 Противогрибковая активность гуазатиновых компонентов и линейных и циклических гуанидиновых производных Величины a МИК определяли после 24 ч как визуально, так и спектрофотометрически.F представляет собой флуконазол. Таблица 2 Противогрибковая активность гуазатиновых компонентов и линейных и циклических гуанидиновых производных Величины a МИК определяли после 24 ч как визуально, так и спектрофотометрически. БиблиографияDeschenes, R.J. et al., Antimicrob. Agents Chemother. 1999, 43, 1700. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую формулу (9)n1 и n2 представляют собой равные или различные числа в диапазоне от 4 до 8,и его соли. 2. Соединение по п.1, гдеn1 = 8 и n2 = 8. 3. Применение соединения по любому из пп.1-2 в качестве противогрибкового средства. 4. Применение по п.3, где противогрибковое средство является противогрибковым средством против видов Candida. 5. Применение по п.4, где виды Candida принадлежат к группе С. albicans, С. krusei, С. parapsilosis. 6. Фармацевтическая композиция, содержащая соединение по любому из пп.1-2 или смесь любых из них и подходящие эксципиенты и разбавители. 7. Способ получения соединения по любому из пп.1-2, включающий следующие стадии: а) ТГФ:МеОН (5:3), 50 С; b) ТГФ 60 С; с) 10% ТФК, безводный CH2Cl2, 24 ч, комнатная температура, R1=H, R2=H, пропаргил, циклопропилметил, бензил, изобутенил, бут-2-енил, пренил, n1 и n2 представляют собой равные или различные числа в диапазоне от 4 до 8.
МПК / Метки
МПК: C07D 255/02, A61P 31/10, A61K 31/395, C07D 259/00
Метки: гуанидиновые, применения, производные, циклические, получения, способ
Код ссылки
<a href="https://eas.patents.su/8-18926-ciklicheskie-guanidinovye-proizvodnye-sposob-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические гуанидиновые производные, способ их получения и применения</a>