Соединения и способ получения замещенных 4-фенил-4-цианоциклогексановых кислот
Номер патента: 1783
Опубликовано: 27.08.2001
Авторы: Лиу Ли, Мендельсон Уилфорд, Дидерих Энн Мари, Аллен Эндрю, Уэбб Кевин
Формула / Реферат
1. Способ получения соединения формулы
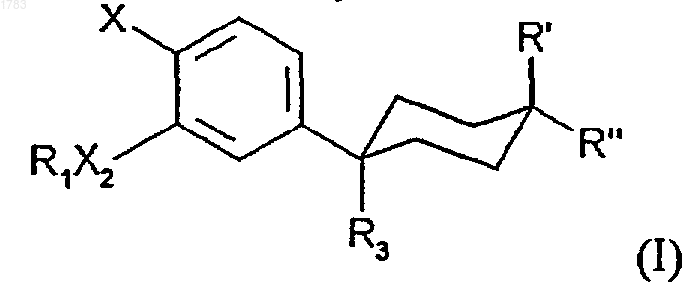
где R1 обозначает -(CR4R5)rR6, гдe алкильные звенья могут быть не замещены или замещены одним или более атомом галогена;
r принимает значения от 0 до 6;
R4 и R5 независимо выбирают из водорода или C1-2алкила;
R6 представляет метил, гидроксил, арил, талогензамещенный арил, арилокси С1-3алкил, галогензамещенный арилокси C1-3алкил, инданил, инденил, С7-11полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С3-6циклоалкил или С4-6циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть незамещены или замещены 1-3 метильными группами или этильной группой;
при условии, что:
a) когда R6 обозначает гидроксил, тогда r принимает значения от 2 до 6; или
b) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, тогда r принимает значения от 1 до 6;
Х обозначает YR2;
X2 обозначает О или NR8;
Y обозначает О или S(O)m;
m' обозначает 0, 1 или 2;
R2 независимо выбирают из -СН3 или -СН2СН3, не замещенных или замещенных 1 или более атомами галогена;
R3 обозначает CN,
R8 обозначает водород или C1-4алкил, незамещенный или замещенный атомами фтора в количестве от одного до трех;
R' и R" независимо обозначают водород или -С(О)ОН;
при этом данный способ включает стадии
а) проведения реакции соединения формулы II(а) или II(b)
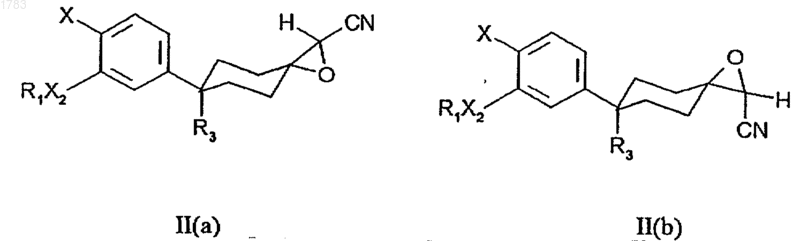
где R1, R3, X2 и Х принимают те же значения, что и в формуле (I), с приблизительно 1,5 эквивалентами кислоты Льюиса в растворителе, смешиваемом с водой, при температуре в интервале приблизительно от 60 до 100шС, возможно в инертной атмосфере;
где соединение формулы (II) получается в результате
b) проведения реакции кетона формулы А
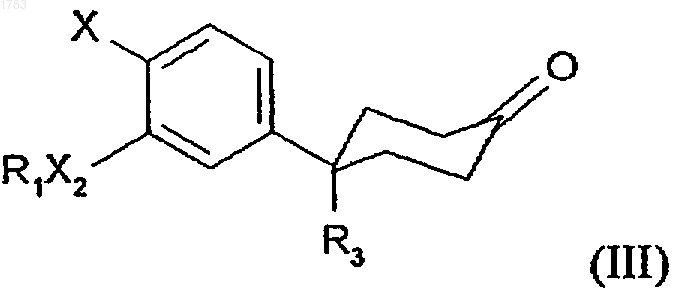
где R1, R3, X2 и Х принимают те же значения, что и в формуле (I), с молярным избытком хлорацетонитрила, неорганическим основанием и каталитическим количеством хлорида бензилтриэтиламмония в растворителе, смешиваемом с водой;
где соединение формулы (А) получается в результате
с) декарбоксилирования бета-кето-сложного эфира формулы В
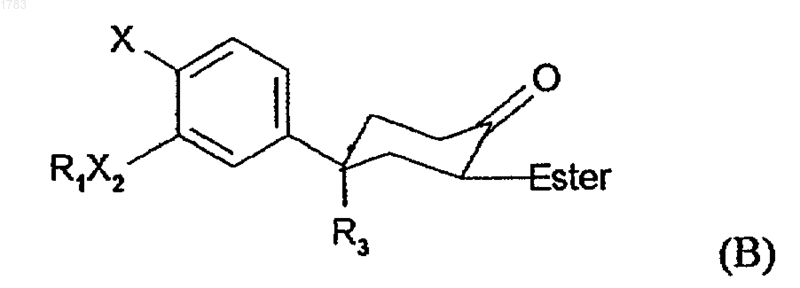
где R1, R3, X2 и Х принимают те же значения, что и в формуле (I), путем нагревания раствора бета-кето-сложного эфира с диметилсульфоксидом до приблизительно 150шС;
где бета-кето-сложный эфир формулы В получается в результате
d) циклизации пимелата формулы С
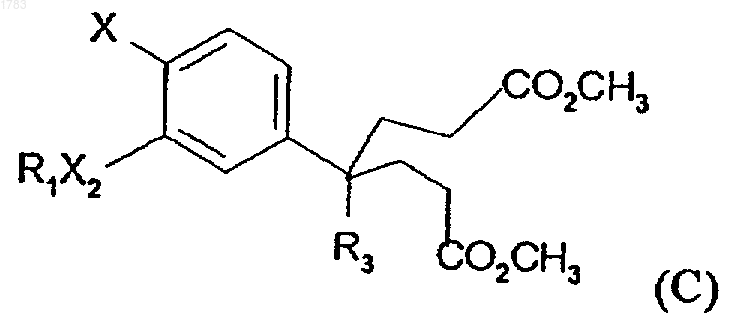
где R1, R3, X2 и Х обозначают то же, что и в формуле (I), с приблизительно 2 молярными эквивалентами сильного основания приблизительно при 75шС, где соединение формулы С получается в результате
е) проведения реакции нитрила формулы D
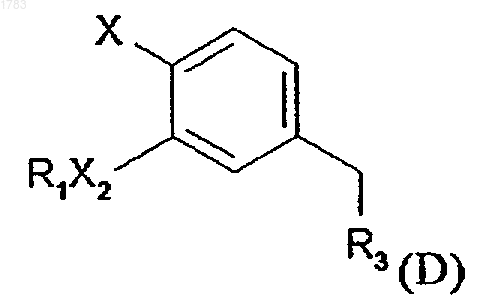
где R1, R3, X2 и Х обозначают то же, что и в формуле (I), с алкилакрилатом в 3-4-кратном молярном избытке в присутствии каталитического количества Triton-B, где соединения формулы (D) получаются в результате
f) проведения реакции соединения формулы (Е)
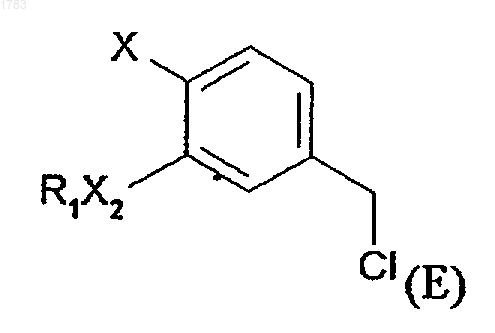
где R1, X2 и Х обозначают то же, что и в формуле (I), с приблизительно 50%-ным молярным избытком цианида щелочного металла, где соединения формулы (Е) получаются в результате
g) проведения реакции спирта формулы (F)
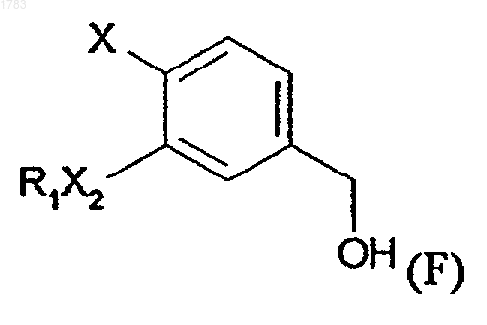
где R1, X2 и Х обозначают то же, что и в формуле (I), с избыточным количеством хлористо-водородной кислоты, где соединения формулы (F) получаются в результате
h) восстановления альдегида формулы (G)
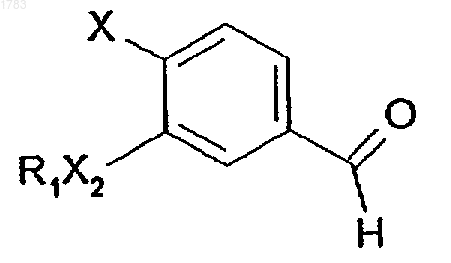
где R1, X2 и X обозначают то же, что и в формуле (I), с помощью неорганического восстановителя.
2. Способ по п.1, где на стадии а) кислотой Льюиса является бромид лития, а вода добавляется в качестве сорастворителя.
3. Способ по п.1 или 2, где на стадии а) в качестве сорастворителя используется приблизительно 2 эквивалента воды.
4. Способ по пп.1-3, где на стадии а) реакционная смесь нагревается до приблизительно 90-95шС в течение приблизительно 8 ч.
5. Способ по пп.1-4, где раствор реакционной смесь далее обрабатывается путем добавления неорганического основания, а затем гипохлоритной соли.
6. Способ по п.1, где на стадии b) неорганическим основанием является водный раствор гидроксида калия, а смешиваемым с водой растворителем является тетрагидрофуран, и реакция проводится при температуре около 0шС.
7. Способ по п.1, где на стадии с) сильным основанием является метоксид натрия, который присутствует в количестве приблизительно 1,5 молярных эквивалентов, а реакция проводится при температуре приблизительно от 70 до 75шС в течение промежутка времени вплоть до 2 ч.
8. Способ по п.1, где стадии с) и d) объединяются циклизацией пимелата в результате реакции с метоксидом натрия декарбоксилированием получаемого в результате бета-кетосложного эфира без его выделения с добавлением диметилсульфоксида к раствору, содержащему сложный эфир, и нагревания этого раствора до приблизительно 145шС в течение промежутка времени вплоть до 2 ч.
9. Способ по п.8, где после завершения стадии циклизации реакционная смесь охлаждается до приблизительно комнатной температуры, а рН доводится до 6,8-7,2 перед добавлением диметилсульфоксида.
10. Способ по п.1, стадия е), где алкилакрилатом является метилакрилат.
11. Способ по п.1, стадия f), где цианидом щелочного металла является цианид натрия, а реакция проводится приблизительно при 55шС.
12. Способ по п.1, стадия h), где восстановителем является боргидрид натрия.
13. Способ по любому из пп.1-12, где в соединениях R1 обозначает CH2-циклопропил, CH2-C5-6циклоалкил, С4-6циклоалкил, не замещенный или замещенный ОНС7-11полициклоалкилом, (3-или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2алкил, не замещенный или замещенный 1 или более атомами фтора, -(CH2)1-3С(O)O(СН2)0-2СН3, -(CH2)1-3О(СН2)0-2СН3 и -(СН2)2-4OН; X обозначает YR2, a Y обозначает кислород; X2 обозначает кислород; R2 обозначает C1-2алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор.
14. Способ по любому из пп.1-12, где в соединениях R1 обозначает -СН2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H, где Х обозначает YR2, Y обозначает кислород, X2 обозначает кислород и R2 обозначает CF2H или метил.
15. Способ по любому из пп.1-12, где R1 обозначает циклопентил, X2 обозначает кислород, Y обозначает кислород и R2 обозначает метил.
16. Соединение формулы
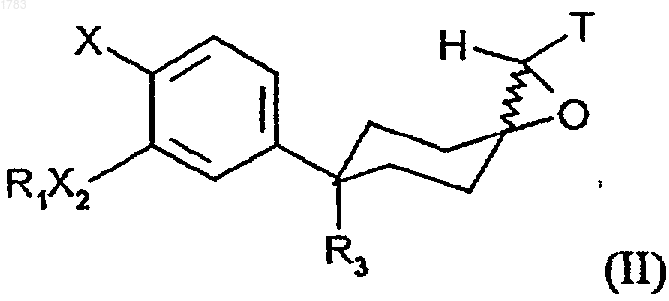
где R1 обозначает -(СR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;
r принимает значения от 0 до 6;
R4 и R5 независимо выбирают из водорода или C1-2алкила;
R6 представляет метил, гидроксил, арил, галогензамещенный арил, арилокси C1-3алкил, галогензамещенный арилокси С1-3алкил, инданил, инденил, С7-11полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С3-6циклоалкил или С4-6циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой;
при условии, что:
a) когда R6 обозначает гидроксил, то тогда r обозначает число от 2 до 6; или
b) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6;
Х обозначает YR2, галоген, нитро, NH2 или формиламин;
X2 обозначает О или NR8;
Y обозначает О или S(O)m;
m' обозначает 0, 1 или 2;
R2 независимо выбирают из -СН3 или -СН2СН3, не замещенных или замещенных 1 или более атомами галогена;
R3 обозначает CN,
R8 обозначает водород или C1-4алкил, не замещенный или замещенный от одного до трех атомами фтора и
Т обозначает CN или SО2R, где R обозначает C1-6алкил или С0-3 алкилфенил.
17. Соединение по п.16, где Т обозначает CN.
18. Соединение по п.16 или 14, где R1 обозначает СН2-циклопропил, CH2-C5-6циклоалкил, С4-6циклоалкил, не замещенный или замещенный ОНС7-11полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, не замещенный или замещенный 1 или более атомами фтора, -(СН2)1-3С(O)O(СН2)0-2СН3, -(СН2)1-3О(СН2)0-2СН3 и -(СН2)2-4OН;
Х обозначает YR2, a Y обозначает кислород; X2 обозначает кислород; R2 обозначает C1-2алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор.
19. Соединение по любому из пп.16-18, где R1 обозначает -СН2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H; X обозначает YR2; Y обозначает кислород; X2 обозначает кислород; и R2 обозначает CF2H или метил.
20. Соединение по п.19, представляющее собой цис-(+/-)-6-[3-(циклопентилокси)-4-метоксифенил]-1-оксобицикло-[2.5]октан-2,6-дикарбонитрил.
21. Соединение формулы
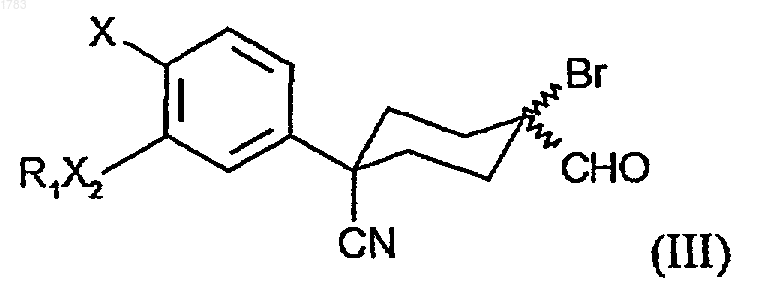
где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;
r принимает значения от 0 до 6;
R4 и R5 независимо выбирают из водорода или C1-2алкила;
R6 представляет метил, гидроксил, арил, галогензамещенный арил, арилокси C1-3алкил, галогензамещенный арилокси C1-3 алкил, инданил, инденил, С7-11полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С3-6циклоалкил или С4-6циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой;
при том условии, что:
a) когда R6 обозначает гидроксил, то тогда r принимает значения от 2 до 6; или
b) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда
r принимает значения от 1 до 6;
Х обозначает YR2;
Х2 обозначает О или NR8;
Y обозначает О или S(O)m';
m' обозначает 0, 1 или 2;
R2 независимо выбирают из -СН3 или -СН2СН3 не замещенных или замещенных 1 или более атомом галогена;
R3 обозначает CN,
R8 обозначает водород или C1-4алкил, не замещенный или замещенный от одного до трех атомами фтора.
22. Соединение по п.21, где R1 обозначает CH2-циклопропил, CH2-C5-6циклоалкил, С4-6циклоалкил, не замещенный или замещенный ОНС7-11полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, незамещенный или замещенный 1 или более атомом фтора, -(СН2)1-3С(O)O(СН2)0-2СН3, -(СН2)1-3О(СН2)0-2СН3 и -(СН2)2-4OН;
Х обозначает YR2, a Y обозначает кислород; Х2 обозначает кислород; R2 обозначает C1-2алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор.
23. Соединение по п.22, где R1 обозначает -CH2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H; Х обозначает YR2; Y обозначает кислород; X2 обозначает кислород и R2 обозначает CF2H или метил.
24. Соединение по п.23, где R1 обозначает циклопентил, X2 обозначает кислород, R2 обозначает метил и Y обозначает кислород.
25. Соединение формулы (V)
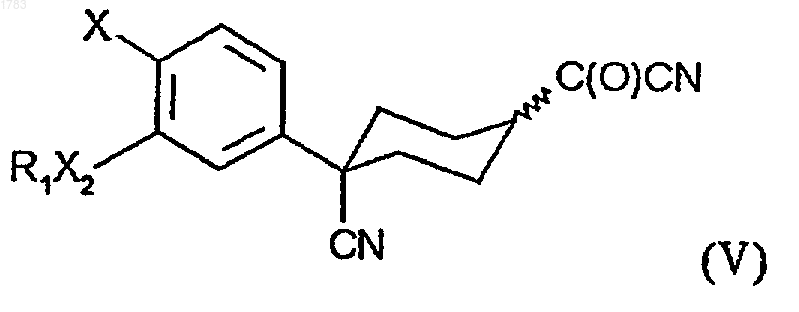
где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;
r обозначает число от 0 до 6;
R4 и R5 независимо выбирают из водорода или С1-2алкила;
R6 представляет водород, метил, гидроксил, арил, галогензамещенный арил, арилоксиC1-3алкил, галогензамещенный арилоксиC1-3алкил, инданил, инденил, С7-11полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С3-6 циклоалкил или С4-6циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть незамещены или замещены от 1 до 3 метильными группами или одной этильной группой;
при условии, что:
a) когда R6 обозначает гидроксил, то тогда r принимает значения от 2 до 6; или
b) если R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6;
Х обозначает YR2;
Х2 обозначает О или NR8;
Y обозначает О или S(O)m';
m' обозначает 0, 1 или 2;
R2 независимо выбирают из -СН3 или -СН2СН3, не замещенных или замещенных 1 или более атомами галогена;
R3 обозначает CN,
R8 обозначает водород или C1-4алкил, не замещенный или замещенный от одного до трех атомами фтора.
26. Соединение по п.25, где R1 обозначает CH2-циклопропил, CH2-C5-6циклоалкил, С4-6циклоалкил, не замещенный шыш замещенный ОНС7-11полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, не замещенный или замещенный 1 или более атомами фтора, -(СН2)1-3С(O)O(СР2)0-2СН3, -(СН2)1-3О(СН2)0-2СН3 и -(CH2)2-4OH;
Х обозначает YR2, a Y обозначает кислород; Х2 обозначает кислород; R2 обозначает C1-2алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор.
27. Соединение по п.26, где R представляет -CH2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H, Х обозначает YR2, Y обозначает кислород, Х2 обозначает кислород и R2 обозначает CF2H или метил.
28. Соединение по п.27, где RI обозначает циклопентил, X2 обозначает кислород, Ry обозначает метил и Y обозначает кислород.
29. Соединение по п.28, представляющее собой нитрил 4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанацила.
30. Способ получения соединения формулы (II)
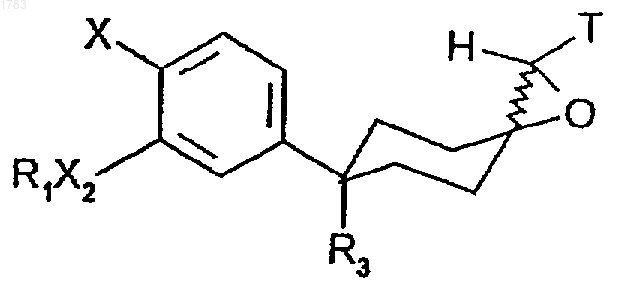
где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;
r принимает значения от 0 до 6;
R4 и R5 независимо выбирают из водорода или C1-2алкила;
R6 представляет водород, метил, гидроксил, арил, галогензамещенный арил, арилокси C1-3алкил, галогензамещенный арилоксиC1-3алкил, инданил, инденил, С7-11полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С3-6циклоалкил или С4-6циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой;
при условии, что
а) когда R6 обозначает гидроксил, то тогда r принимает значения от 2 до 6; или
b) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6;
Х обозначает YR2;
X2 обозначает О или NR8;
Y обозначает О или S(O)m';
m' обозначает 0, 1 или 2;
R2 независимо выбирают из -СН3 или -СН2СН3, не замещенных или замещенных 1 или более атомами галогена;
R3 обозначает CN,
R8 обозначает водород или C1-4алкил, не замещенный или замещенный от одного до трех атомами фтора, а Т обозначает CN;
при этом данный способ включает стадии:
b) проведения реакции кетона формулы А
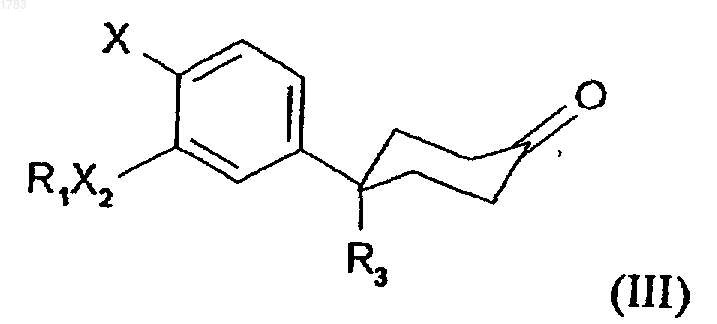
где R1, R3, X2 и Х обозначают то же, что и в формуле (II), с мольным избытком хлорацетонитрила, неорганическим основанием и каталитическим количеством хлорида бензилтриэтиламмония в растворителе, смешиваемом с водой.
31. Способ по п.30, где неорганическим основанием является водный раствор гидроксида калия, а растворителем, смешиваемым с водой, является тетрагидрофуран.
32. Способ по п.31, где реакция проводится при температуре, равной приблизительно 0шС.
33. Способ повышения содержания формы с -4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновой кислоты, используя смесь цис- и транс-изомеров кислоты, при этом данный способ включает стадию кристаллизации из гексан/этилацетатного раствора цис- и транс-изомеров цис-изомера, по существу, не содержащего транс-изомера.
34. Способ по п.33, где цис-/транс-смесь растворяется в этилацетате и гексанах.
35. Способ по п.34, где цис-/транс-смесь растворяется в этилацетате, а после этого добавляются гексаны.
36. Способ по п.35, где этилацетатный раствор цис-/транс-изомеров нагревается в реакторе с обратным холодильником до кипения, охлаждается, а затем добавляются гексаны.
37. Соединение, представляющее собой хлорид с-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновой кислоты.
Текст
1 Изобретение относится к промежуточным соединениям и синтетическому пути получения 4-циано-4-(3-циклопентилокси-4-метоксифенил) циклогексановой кислоты и ее аналогов. Эта кислота и ее указанные аналоги проявляют селективность в отношении ингибирования каталитического сайта в изоферменте фосфодиэстеразе, названной IV (здесь далее - PDE IV), и как таковые, эти кислоты полезны при лечении некоторых заболеваний, которые могут быть облегчены воздействием на фермент PDE IV и его подтипы. Бронхиальная астма является сложным многофакторным заболеванием, характеризующимся обратимым сужением дыхательных путей и повышенной реактивностью респираторного тракта на внешний раздражитель. Установление новых терапевтических средств против астмы затрудняется тем фактом,что за развитие болезни ответственны многие медиаторы. Поэтому, кажется маловероятным,что исключение эффектов единственного медиатора будет иметь значительное влияние на все три компонента хронической астмы. Альтернативой "медиаторному подходу" является регулирование активности клеток, ответственных за патофизиологию болезни. Один такой путь осуществляется за счет повышенных уровней цАМФ (циклического аденозин-3',5'-монофосфата). Показано, что циклический АМФ является вторичным мессенджером, опосредующим биологические отклики на широкий круг гормонов, нейротрансмиттеров и лекарств; [Krebs Endocrinology Proceedings of the 4th International Congress ExcerptaMedica, 17-29, 1973]. Когда подходящий агонист связывается с конкретными поверхностными рецепторами клетки, активируется аденилатциклаза, которая превращает Мg+2-АТФ в цАМФ с более высокой скоростью. Циклический АМФ видоизменяет активность большинства, если не всех, клеток, которые вносят свой вклад в патофизиологию, проявляющейся под действием внешнего раздражителя (аллергической) астмы. Поэтому повышение цАМФ давало бы полезные эффекты, включая: 1) релаксацию гладкой мускулатуры дыхательных путей, 2) ингибирование выделения медиатора мастоцитов, 3) подавление дегрануляции нейтрофилов, 4) ингибирование дегрануляции базофилов и 5) ингибирование активации моноцитов и макрофагов. Таким образом, соединения, которые активируют аденилатциклазу или ингибируют фосфодиэстеразу, должны быть эффективными в подавлении неестественной активации гладкой мускулатуры дыхательных путей и широкого разнообразия воспалительных клеток. Главным клеточным механизмом инактивации цАМФ является гидролиз 3'фосфодиэфирной связи одним или несколькими членами семейства изоферментов, относящихся(PDE). В настоящее время обнаружено, что распознаваемый изо-фермент циклическая нуклеотидфосфодиэстераза (PDE), PDE IV, ответственен за разрушение цАМФ в гладкой мускулатуре дыхательных путей и в воспалительных клетках. [Torphy, "Phos-phodiesterase Isozymes: Potential Targets for Novel Antiasthmatic Agents" вServices Ltd., 1989]. Исследование показывает,что ингибирование этого фермента не только производит релаксацию гладкой мускулатуры дыхательных путей, но также подавляет дегрануляцию мастоцитов, базофилов и нейтрофилов,наряду с ингибированием активации моноцитов и нейтрофилов. Более того, полезные эффекты ингибиторов PDE IV заметно усиливаются, когда активность аденилатциклазы целевых клеток повышается соответствующими гормонами или паракринными гормонами (вещество, синтезируемое одним типом клеток, влияющее на функцию других близко расположенных типов клеток, функционирующее как местный гормон или паракринный гормон), как было бы в случаеin vivo. Так, ингибиторы PDE IV были бы эффективны в астматическом легком, где уровни простагландина E2 и простациклина (активаторы аденилатциклазы) повышены. Такие соединения могли бы предложить уникальный подход к фармакотерапии бронхиальной астмы, и они обладают заметными терапевтическими преимуществами перед другими средствами,имеющимися в настоящее время на рынке лекарств. Способ и промежуточные соединения этого изобретения обеспечивают средства для получения конкретных 4-замещенных -4-(3,4 дизамещенный фенил)циклогексановых кислот,которые полезны для лечения астмы и других болезней, которые могут быть облегчены воздействием на фермент PDE IV и его подтипы. Особый интерес представляют продукты, которые широко описаны в патенте США 5552483,выданном 03 сентября 1996. Постольку поскольку раскрытые в нем информация и представления необходимы для понимания этого изобретения и его практического осуществления в целом, заявленное в нем включается здесь ссылкой. Краткое описание изобретения Это изобретение относится к способу получения соединения формулы I 3 которых алкильные части молекул могут быть необязательно замещены одним или несколькими галогенами;m принимает значения от 0 до 2;n имеет значения от 1 до 4 ;r принимает значения от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;R6 обозначает водород, метил, гидроксил,арил, замещенный галогеном арил, арилоксиС 1-3 алкил, замещенный галогеном арилоксиС 1-3 алкил, инданил, инденил, С 7-11 полициклоалкил,тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкильные и гетероциклические части молекул могут быть необязательно замещены 1-3 метилгруппами или одной этилгруппой; при условии, что:b) когда R6 обозначает гидроксил, тогда r принимает значения от 2 до 6, илиd) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, тогда r принимает значения от 1 до 6,e) когда n равно 1 и m равно 0, тогда R6 обозначает иное, чем Н в -(CR4R5)nO(CR4R5)mR6; Х обозначает YR2, галоген, нитро, NH2 или формиламин; Х 2 обозначает О или NR8;R2 независимо выбирают из -СН 3 илиR8 обозначает водород или C1-4 алкил, необязательно замещенный одним-тремя атомами фтора;R11 обозначает водород или C1-4 алкил, необязательно замещенный одним-тремя атомами фтора;R' и R" независимо обозначают водород или -С(О)ОН; 4 этот способ включает обработку соединения формулы II(а) или II(b) где R1, R2, Х 2 и Х являются такими же, как в формуле (I), бромидом лития или бромидом магния в полярном растворителе при температуре между около 60 и 100 С необязательно под инертной атмосферой в течение времени,достаточного для завершения реакции. Это изобретение также относится к соединениям формулы II как таковым. В другом аспекте это изобретение относится к осуществляемому в одном реакторе способу получения кетона формулы III, исходя из изованилина, где R1, R3, Х 2 и Х являются такими же, как в формуле (I), как более полно описано здесь ниже. Еще в третьем аспекте это изобретение относится к способу получения соединения формулы I, включающему обработку соединения формулы (IV) с использованием цианида щелочного металла, например LiCN, в совместимом растворителе, таком как диметилформамид, содержащим небольшое количество воды. где, в формуле III, R1, X2 и Х являются такими же, как в формуле I. Далее это изобретение относится к способу получения соединения формулы I, включающему обработку ацилнитрила формулы V водой. Группы X, Х 2 и R1 в формуле V являются такими же, как в формуле II. Кроме того, это изобретение относится к соединениям формулы II-(CR4R5)nC(О)О(СR4R5)mR6,-(CR4R5)nC(O)NR4(CR4R5)mR6,-(CR4R5)nO(CR4R5)mR6, или (CR4R5)rR6,где алкильные части молекул могут быть необязательно замещены одним или несколькими галогенами;m принимает значение от 0 до 2;n принимает значение от 1 до 4;r принимает значение от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;R6 обозначает водород, метил, гидроксил,арил, замещенный галогеном арил, арилоксиС 1-3 алкил, замещенный галогеном арилоксиС 1-3 алкил, инданил, инденил, С 7-11 полициклоалкил,тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкильные и гетероциклические части молекул могут быть необязательно замещены 1-3 метилгруппами или одной этилгруппой; при условии, чтоb) когда R6 обозначает гидроксил, тогда r имеет значения от 2 до 6, илиd) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, тогда r имеет значения от 1 до 6,e) когда n равно 1 и m равно 0, тогда R6 обозначает иное, чем Н, в -(CR4R5)nO(CR4R5)mR6; Х обозначает YR2, галоген, нитро, NH2 или формиламин; Х 2 обозначает О или NR8;R2 независимо выбирают из -СН 3 илиNR8R10 или CCR8',R8 обозначает водород или C1-4 алкил, необязательно замещенный одним-тремя атомами фтора;R11 обозначает водород или C1-4 алкил, необязательно замещенный одним-тремя атомами фтора;NR8R8; и Т обозначает CN или SO2R, где R обозначает C1-6 алкил или С 0-3 алкилфенил. Этот способ включает девятистадийный синтез для получения конкретных 4-замещенных-4-(3,4-дизамещенный фенил)циклогексановых кислот. Исходным материалом является изованилин, 3-гидрокси-4-метоксибензальдегид, 001783 6 или его аналог. "Аналог" обозначает другую конформацию заместителя в положении 3 и/или 4 по отношению к определениям R1, R3, Х 2 и Х в определении формулы (I). Соединения, которые получают этим способом, являются ингибиторами PDE IV. Они полезны для лечения многих болезней, как описано в патенте США 5552438, выданном 3 сентября 1996. Предпочтительными соединениями, которые могут быть получены этим способом, являются соединения, в которых: Предпочтительными заместителями R1 для соединений всех названных формул являются СН 2-циклопропил, СН 2-С 5-6 циклоалкил, С 4-6 циклоалкил, незамещенный или замещенный ОНС 7-11 полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, незамещенный или замещенный 1 или несколькими атомами фтора, -(СН 2)1-3 С(О)О(CH2)0-2 СН 3,-(СН 2)1-3 О(СН 2)0-2 СН 3 и-(СН 2)2-4OН. Предпочтительными группами Х для формул (I), (II) или (III) являются такие, где Х обозначает YR2 и Y обозначает кислород. Предпочтительной группой X2 для формулы (I) является такая, где Х 2 обозначает кислород. Предпочтительными группами R2 являются C1-2 алкилы,незамещенные или замещенные 1 или несколькими галогенами. Атомами галогена предпочтительно являются фтор и хлор, более предпочтительно фтор. Более предпочтительными группами R2 являются такие, где R2 обозначает метил или фторзамещенные алкилы, конкретно C1-2 алкил,такой как -СF3, -CHF2 или -CH2CHF2 группы. Наиболее предпочтительными являются группы -CHF2 и СН 3. Наиболее предпочтительными являются те соединения, где R1 обозначает -СН 2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H; Х обозначает YR2; Y обозначает кислород; Х 2 обозначает кислород, и R2 обозначает CF2H или метил, и R3 обозначает CN. Схематическое представление об этом способе дано на схемеI. В этом графическом представлении использованы конкретные примеры для иллюстрации общей методологии, используемой в этом изобретении. Что касается схемы I, изованилин, 3 гидрокси-4-метоксибензальдегид, является легко доступным исходным материалом. Он может быть алкилирован группой R1X (X = Сl, Вr и I),как представлено циклопентилхлоридом. Реакционный сосуд вначале промывают инертным газом, например азотом. Затем в реакционный сосуд добавляют полярный растворитель, такой как ДМФ, потом изованилин, затем аддукт R1X и какое-нибудь основание. Используют около 2 эквивалентов аддукта R1X по отношению к изованилину. Подобным образом используют около 2 эквивалентов основания также по отношению к изованилину. Основание может быть неорганическим основанием или карбонатом. Здесь оно представлено карбонатом калия. Содержимое сосуда нагревают до около 125 С в течение 8 около 90-120 мин, до завершения реакции. Содержимое сосуда охлаждают до температуры окружающей среды, фильтруют, чтобы удалить неорганические соли и промывают спиртом,таким как метанол. Фильтрат содержит альдегид, помеченный 1-1. Затем альдегид восстанавливают до спирта, используя неорганический восстановитель. Для этого фильтрат из предыдущей реакции обрабатывают боргидридом натрия и после обработки получают желаемый спирт, 1-2, с общим выходом 97% от изованилина. Этого достигают путем охлаждения фильтрата до 0 С,после чего добавляют восстановитель, в данном случае боргидрид натрия. Используют около 0,25-0,5 эквивалента этого восстановителя. Температуру поддерживают около 0 С во время добавления восстановителя и в течение около 30-40 мин после. Затем температуре позволяют повышаться примерно до комнатной температуры, после чего в реакционный сосуд добавляют около половины эквивалента НСl. Далее спирт экстрагируют в органический растворитель, в качестве иллюстрации приведен толуол, и промывают разбавленным бикарбонатом натрия. Верхний органический слой, содержащий спирт, обрабатывают затем избытком концентрированной хлороводородной кислоты при температуре окружающей среды, чтобы получить после обработки желаемый бензилхлорид 1-3. Хлорид изолируют в виде маc./маc. раствора в амидном растворителе, здесь указан ДМФ,и обрабатывают приблизительно 50%-ным молярным избытком цианида натрия при умеренно повышенной температуре, в данном случае при 55 С. В результате этого получают нитрил 1-4. Нитрил выделяют в виде маc./маc. раствора в подходящем растворителе, таком как безводный ацетонитрил, и используют непосредственно на следующей стадии. В раствор нитрила загружают метилакрилат. Охлаждают до-10 С и медленно обрабатывают каталитическим количеством Triton-B в том же растворителе, который используют для растворения нитрила. Метилакрилат добавляют в 3-4-кратном избытке. Реакцию завершают в течение 30-45 мин, после присоединения акрилата, продукт пимелат, 1-5, выделяют в виде маc./маc. раствора в толуоле и обрабатывают приблизительно 2 эквивалентами метоксида натрия при 75 С, чтобы получить сложный кетоэфир, 1-6. Реакционный раствор охлаждают и нейтрализуют до рН 7 минеральной кислотой,такой как 6 н. хлороводородная кислота. В раствор загружают диметилсульфоксид, хлорид натрия, воду и нагревают, например, до около 150 С, чтобы осуществить декарбоксилирование, с целью получения 1-7. Кетон, 1-7, выделяют из системы растворителей в виде не совсем белого твердого вещества. Дикарбонитрил 1-8 получают путем взаимодействия кетона с хлорацетонитрилом в при 9 сутствии неорганического основания и каталитического количества хлорида бензилтриэтиламмония (БТЭА). Кетон загружают в смесь сильного основания (водный гидроксид калия) и смешивающегося с водой растворителя, такого как тетрагидрофуран. Добавляют небольшой избыток хлорацетонитрила при пониженной температуре, приблизительно 0 С или около того. Реакцию поддерживают примерно при этой температуре для продолжительности реакции обычно около 1 ч. Продукт изолируют, и обычно он кристаллический. Дикарбонитрил превращают в циклогексанкарбоновую кислоту, используя в качестве катализатора кислоту Льюиса и воду, из-за отсутствия которой промежуточные соединения 110 а и 1-10b могут димеризоваться. Эту реакцию проводят путем загрузки в сосуд растворителей,в этом случае представленных, например, ДМФ,ацетонитрилом и водой, и кислоты Льюиса(около 1,5 эквивалента), например, LiBr, продувания сосуда инертным газом, добавления дикарбонитрила IIа или IIb или смеси IIа и IIb и нагревания сосуда и его содержимого до 100 С в течение нескольких часов, например 8 ч. Кислоту выделяют обычными способами. Следует отметить, что в этой реакции, в результате которой из эпоксида получают кислоту, участвуют несколько промежуточных соединений, которые не требуется выделять. Обнаружено, что обработка эпоксида LiBr дает промежуточные соединения 1-9 а и 1-9b. Промежуточное соединение 1-9 а образуется, когдаLiBr добавляют в реакционный сосуд. Но промежуточное соединение 1-9 а снова превращается в эпоксид при указанных условиях реакции. Промежуточное соединение 1-9b также образуется, но, очевидно, быстро реагирует с образованием промежуточных соединений, таких как енолят А, 1-10 а и 1-10b и т.д., приводящих к образованию продукта. По-видимому, 1-9 а и 19b образуются, но так, что 1-9 а превращается снова в эпоксид, который в конечном счете образует 1-9b, который затем превращается в другие промежуточные соединения при образовании кислот 1-11 а и 1-11b. Заключенное в скобки обозначение "ОМ(Н)" в 1-9 а и 1-9b обозначает соль металла со спиртом или спирт как таковой,в зависимости от условий реакции. Промежуточное соединение 1-9b, вероятно, превращается в ацилнитрилы формул 1-10 а и 1-10b через предполагаемое, указанное в скобках промежуточное соединение. Существование предполагаемого промежуточного соединения (енолят) не было подтверждено полностью. Существует косвенное доказательство существования ацилнитрилов 1-10 а и 1-10b посредством того факта,что продукт бис-конденсации димер В был выделен и является аналогичным представленным соединениям, где подобный бис-конденсат является продуктом ацилнитрила. Известно, что димеры, такие как димер А,образуются из подобных ацилнитрилов 1-10 а/b в присутствии HCN (Thesing, J.; Witzel, D.;Brehm, A. Angew Chem., 1956, 68, 425; и Hunig,S.; Schaller, R. Angew Chem. Int. Ed. Engl., 1982,21, 36). И в дополнение, получены достоверные образцы промежуточных соединений 1-10 а и 110b и обнаружено, что они превращаются в кислоты 1-11 а и 1-11b, когда открыты для доступа воды. Экваториальный изомер 1-10 а превращался в кислоту в отношении экваториальный/аксиальный около 98:2, в то время как аксиальный изомер 1-10 а изомеризовался в заранее предвиденную форму экваториального изомера 1-11 а (77:23). Вероятно, аксиальный ацилнитрил превращается в экваториальный ацилнитрил через предполагаемое указанное в скобках енолятное промежуточное соединение. Вторая следующая схема реакции иллюстрирует получение кислот формулы (I) из бромальдегида формулы (IV). Схема 3 Следующие примеры приведены для иллюстрации специфики изобретения, но не для ограничения его. Притязания изобретателей установлены в прилагаемой формуле изобретения. Пример 1. Получение 3-циклопентилокси 4-метоксибензальдегида. 12-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают диметилформамид (2,4 л), изованилин (350 г, 2,3 моль, 1 эквивалент), циклопентилхлорид (481 г,4,6 моль, 2,0 эквивалента) и карбонат калия (634 г, 4,6 моль, 2,0 эквивалента). Энергично перемешиваемую суспензию нагревают до 125 С в течение двух часов или до исчезновения изованилина. Реакционную смесь охлаждают до 2030 С и фильтруют, чтобы удалить неорганические соли. Осадок на фильтре промывают метанолом (1,0 л). Прозрачный светло-коричневый фильтрат(ДМФ и метанол), содержащий продукт, 3 циклопентилокси-4-метоксибензальдегид,ис 11 пользуют непосредственно на следующей стадии (100% выход раствора). Пример 2. Получение 3-циклопентилокси 4-метоксибензилового спирта. 12-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают диметилформамид (2,4 л), метанол (1,0 л) и 3 циклопентилокси-4-метоксибензальдегид (506 г,2,3 моль, 1 эквивалент). Содержимое колбы охлаждают до 0-5 С с последующим добавлением боргидрида натрия (32,2 г, 0,85 моль, 0,37 эквивалента). Реакционную смесь выдерживают при 0-5 С в течение 30 мин и нагревают до 20-25 С в течение 2 ч или до исчезновения альдегида. Раствор 6 н. хлороводородной кислоты (195 мл,1,17 моль, 0,51 эквивалента) добавляют в течение более 20 мин. Реакционную смесь концентрируют при пониженном давлении и охлаждают до 20-25 С. В колбу загружают деионизированную воду (1,9 л) и толуол (1,9 л). Слои разделяют, органический слой отделяют и промывают дважды деионизированной водой (2 х 800 мл). Продукт, 3-циклопентилокси-4-метоксибензиловый спирт, собирают в виде раствора в толуоле (97% выход раствора) и используют непосредственно на следующей стадии. Пример 3. Получение 4-хлорметил-2 циклопентилокси-1-метоксибензола. 12-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают 3 циклопентилокси-4-метоксибензиловый спирт(495 г, 2,2 моль, 1 эквивалент) в растворе толуола. К энергично перемешиваемой реакционной смеси при 22 С добавляют концентрированную хлороводородную кислоту (600 г, 2,75 эквивалента). Реакцию поддерживают при 20-25 С в течение 30 мин. Верхний органический слой отделяют и донный кислотный слой отбрасывают. К верхнему органическому слою добавляют раствор 10% бикарбоната натрия (550 г, 0,65 моль, 0,36 эквивалента) и трет-бутилметилового эфира (814 г). Содержимое колбы энергично перемешивают и позволяют отстояться. Продукт, 4-хлорметил-2-циклопентилокси-1-метоксибензол, отделяют в виде раствора в толуоле и трет-бутилметиловом эфире (96,8% выход раствора) и используют непосредственно на следующей стадии. Пример 4. Получение 4-цианометил-2 циклопентилокси-1-метоксибензола. 12-Литровую круглодонную колбу, снабженную верхней мешалкой и перегонным аппаратом, промывают азотом. В колбу загружают 4-хлорметил-2-циклопентилокси-1-метоксибензол (519 г, 2,15 моль, 1,0 эквивалент) в растворе толуола и простого трет-бутилметилового эфира. Реакционную смесь концентрируют при по 001783 12 ниженном давлении до остатка. В 12-литровую колбу загружают ДМФ (1,44 кг) и цианид натрия (142 г, 2,9 моль, 1,35 эквивалента). Реакционную смесь нагревают до 55 С в течение 6 ч или до завершения реакции, которую считают закончившейся по исчезновению бензилхлорида. Реакционную смесь концентрируют при пониженном давлении до остатка. В колбу загружают трет-бутилметиловый эфир(2,30 кг) и деионизированную воду (800 мл). Содержимое колбы энергично перемешивают и позволяют отстояться. Верхний органический слой отделяют, промывают три раза деионизированной водой (3 х 800 мл) и концентрируют при атмосферном давлении до остатка. В колбу добавляют ацетонитрил (1,26 кг) и продолжают перегонку до тех пор, пока не соберут дополнительные 400 мл растворителя. Продукт, 4 цианометил-2-циклопентилокси-1-метоксибензол выделяют в виде раствора в ацетонитриле(92,2% выход) и используют непосредственно на следующей стадии. Пример 5. Получение диметил-4-циано-4(3-циклопентилокси-4-метоксифенил)пимелата. 12-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают раствор 4-цианометил-2-циклопентилокси-1 метоксибензола (460 г, 1,99 моль, 1,0 эквивалент) в ацетонитриле и метилакрилат (520 г, 6,0 моль, 3,0 эквивалента). Содержимое колбы охлаждают до -10 С. В уравнивающую давление капельную воронку загружают ацетонитрил (1,1 л) и гидроксид бензилтриметиламмония (40% маc./маc. раствор в метаноле, 25 г, 0,06 моль,0,03 эквивалента). Содержимое капельной воронки добавляют в колбу. Наблюдают экзотермический эффект и после перемешивания в течение 30 мин содержимое колбы охлаждают до 20 С. Реакционную смесь концентрируют при пониженном давлении до остатка. К остатку добавляют толуол (2,6 л). Этот раствор диметил-4-циано-4-(3-циклопентилокси-4-метоксифенил)пимелата (90% выход раствора) используют непосредственно на следующей стадии. Пример 6. Получение 4-циано-4-(3-циклопентилокси-4-метоксифенил)циклогексан-1-она. 12-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают раствор диметил-4-циано-4-(3-циклопентилокси-4-метоксифенил) пимелата (720 г, 1,78 моль, 1,0 эквивалент) в толуоле и метоксид натрия (25 мас.% в метаноле, 545 г, 2,67 моль, 1,5 эквивалента). Реакционную смесь нагревают до 70-75 С в течение 2 ч или до предполагаемого завершения реакции по исчезновению пимелата. Реакционную смесь охлаждают до 25 С. Раствор 6 н. хлороводородной кислоты добавляют,чтобы довести рН до 6,8-7,2. Реакционную 13 смесь концентрируют под вакуумом, до остатка. В колбу загружают диметилсульфоксид (3,3 л),деионизированную воду (250 мл) и хлорид натрия (250 г). Содержимое колбы нагревают до 145155 С и выдерживают при этой температуре в течение 2 ч. Реакционную смесь охлаждают и концентрируют под вакуумом до остатка. К остатку добавляют воду (1,9 л), этилацетат (1,25 л) и простой трет-бутилметиловый эфир (620 мл). Раствор перемешивают и позволяют ему отстояться. Слои разделяют и водный слой повторно экстрагируют этилацетатом (1,25 л). Объединенные органические слои дважды промывают деионизированной водой (2 х 2,5 л). Органический слой выделяют и концентрируют при пониженном давлении до остатка. К этому остатку добавляют изопропанол (1,66 л) и нагревают для получения раствора и затем медленно добавляют гексаны (1,66 л). Суспензию охлаждают до 5 С свыше 30 мин и выдерживают при 05 С в течение 2 ч. Продукт фильтруют и промывают смесью изопропанол-гексаны 50-50 (840 мл) при 0 С. Продукт сушат, чтобы получить 4 циано-4-(3-циклопентилокси-4-метоксифенил) циклогексан-1-он (315 г, 56% от пимелата). Пример 7. Получение цис-(+/-)-6-[3(циклопентилокси)-4-метоксифенил]-1-оксобицикло[2,5]октан-2,6-дикарбонитрила. 5-литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и впуском азота, промывают азотом. В колбу загружают 50% гидроксид калия (220 г) и тетрагидрофуран (550 мл). При перемешивании при комнатной температуре добавляют хлорид бензилтриэтиламмония (8,1 г, 0,035 моль, 0,05 эквивалента). Раствор охлаждают до 0 С. В выравнивающую давление капельную воронку при комнатной температуре загружают раствор, содержащий тетрагидрофуран (550 мл), 4-циано-4(3-циклопентилокси-4-метоксифенил)циклогексан-1-он (230 г, 73 моль, 1,0 эквивалент) и хлорацетонитрил (59 г, 0,78 моль, 1,07 эквивалента). При перемешивании содержимого в колбе при 0 С добавляют в течение свыше 15 мин раствор из уравнивающей давление капельной воронки. Температуру поддерживают между 0 и 5 С и перемешивание продолжают один час. Реакционную смесь нагревают до 25 С, разбавляют водой (900 мл) и этилацетатом (900 мл). Раствор перемешивают и позволяют отстояться в течение 30 мин. Слои разделяют, органический слой выделяют и концентрируют путем вакуумной перегонки до остатка. Добавляют метанол (540 мл) и раствор нагревают до 40 С. Во время охлаждения до 20 С свыше 90 мин добавляют гексаны (540 мл). Охлаждение продолжают, и продукт начинает кристаллизоваться при 10 С. Суспензию затем охлаждают до -5 С и выдерживают при -5-0 С в течение двух часов. Продукт фильтруют и промывают смесью метанолгексаны 50-50 (300 мл) при 0 С. Продукт сушат, 001783 14 чтобы получить цис-(+/-)-6-[3-(циклопентилокси)-4-метоксифенил]-1-оксобицикло[2,5]октан 2,6-дикарбонитрил (190 г, 73%) в виде белого кристаллического твердого вещества. Пример 8. Получение 1-9 а. В закупориваемую винтовой крышкой склянку емкостью 12 драхм (1 драхма = 1/8 аптекарской унции или 1/16 торговой унции) добавляют диглим (5,92 г) и эпоксинитрил (0,70 г,1 экв. ) из примера 7. Эту смесь перемешивают при нагревании на масляной бане в течение 5 мин. Затем добавляют МgВr26 Н 2 О (0,906 г, 1,55 экв.). После 3 ч не обнаруживают исходного материала. Реакционную смесь охлаждают, затем смешивают с 5% водной лимонной кислотой/этилацетатом и слои встряхивают и разделяют. Вторая экстракция смесью простой эфир/этилацетат дает некоторое количество окрашенного вещества, экстрагированного в органический слой; но следующая экстракция не имеет окраски. Органические фракции объединяют и промывают водой и солевым раствором и сушат с помощью MgSO4. Продукт кристаллизуют из гексана; т.пл. 151-152 С. Элементарный анализ: С - 58,20, Н - 5,82, Вr - 18,44, N -6,46, найдено С - 58,32, Н - 5,73, Вr - 18,48, N -6,34. Структуру подтверждают рентгено-структурным анализом кристаллического образца, полученного из метилового спирта. Пример 9. Получение 1-9b. К Мg (0,189 г, 2,02 экв.) (полированному с помощью ступки и пестика) в простом эфире добавляют 1,2-дибромэтан (1,55 г, 2,06 экв.) в небольшом объеме простого эфира, чтобы инициировать реакцию Гриньяра. Когда израсходуется большая часть магния и больше не наблюдается выделения этана, реакционную смесь перемешивают дополнительно 0,5 ч при комнатной температуре, после чего добавляют эпоксид из примера 7 (1,41 г, 1 экв.) в минимальном количестве сухого тетрагидрофурана при температуре окружающей среды. Спустя около 70 ч при комнатной температуре получают и бромцианоспирт (1-9b) и бромцианогидрин(1-9 а) в соотношении 6:1. Продукт 1-9b выделяют в виде масла путем препаративной ВЭЖХ. Структуру подтверждают углеродным и протонным ЯМР. Пример 10. Получение соединения 3-1 эпоксисульфона. В круглодонную колбу емкостью 25 мл,снабженную магнитной мешалкой и каучуковой перегородкой, загружают 1,00 г 4-циано-4 -(3 циклопентилокси-4-метоксифенил)циклогексан 1-она, 0,70 г хлорметил-п-толуолсульфона и 7 мл тетрагидрофурана. Все это перемешивают,затем добавляют 3 мл 50% маc./маc. водногоNaOH и бензилтриметилметан (0,05 г). Суспензию энергично перемешивают в течение 2 ч при комнатной температуре. Реакционный раствор переносят в разделительную воронку, в которуюMgSO4 и фильтруют, чтобы удалить соли. Пример 11. Получение соединения 3-2 бромальдегида. К магнию (0,048 г, 1,03 экв., 0,021 моль; полированному с помощью ступки и пестика) в простом эфире добавляют 1,2-дибромэтан (0,40 г, 1,06 экв., 0,02 моль) под азотом. Две капли иода добавляют в простой эфир, чтобы начать реакцию, после чего реакционную смесь осторожно нагревают. Как только произойдет реакция Гриньяра, реакционную колбу охлаждают до около 5 С и добавляют эпоксисульфон из примера 10 (0,93 г, 1 экв., 0,002 моль) в смеси простой эфир/метиленхлорид. Реакцию сопровождают ТСХ (условия: силикагель с циклогексан:толуол:ацетонитрил: уксусная кислота 40:40:20:4). Реакционную смесь перемешивают при 5 С в течение 2 ч. Продукт выделяют путем добавления воды и смеси простой эфир/ТБМЭ к реакционной смеси и отделения органических слоев. Их промывают водой и солевым раствором и сушат над МgSO4. Выпаривание дает масло, которое подвергают флеш-хроматографии на 40 г силикагеля с использованием смеси гексана и этилацетата (5-40% этилацетата). Это дает светлое масло (0,49 г), содержащее примерно в равных долях экваториальные и аксиальные изомеры, как определено протонным ЯМР. Масс-спектр обнаруживает молекулярный ион при m/е 405, содержащий 1 атом брома[С 20H24 ВrNО 3]. Пример 12. Получение с-4-циано-4-(3 циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновой кислоты. 5-Литровую круглодонную колбу, снабженную верхней мешалкой, внутренним термометром и дефлегматором, снабженным впуском азота, промывают азотом. В колбу загружают диметил-формамид (580 г), ацетонитрил (480 г),бромид лития (72 г, 0,83 моль, 1,62 эквивалента) и деионизированную воду (20 г, 1,1 моль, 2,2 эквивалента). Раствор перемешивают под азотом при 25-30 С с последующим добавлением цис-(+/-)-6-[3-(циклопентилокси)-4-метоксифенил]-1-оксобицикло[2,5]октан-2,6-дикарбонитрила (180 г, 0,51 моль, 1,0 эквивалент). Реактор нагревают до 90-95 С в течение 8 ч или до предполагаемого завершения реакции по исчезновению эпоксинитрила. Содержимое колбы охлаждают до 20 С, затем добавляют раствор гидроксида натрия (92 г гидроксида натрия, 2,3 моль, 4,5 эквивалента, растворенного в 200 мл деионизированной воды). Суспензию перемешивают при 20 С в течение 30 мин с последующим добавлением гипохлорита натрия (600 мл, 0,46 моль, 0,9 эквивалента). Содержимое колбы перемешивают в течение 90 мин с последующим добавлением простого трет-бутилметилового эфира (2,27 кг ) и 6 н. НСl (644 мл, 3,86 16 моль, 7,5 эквивалента). Донный водный слой подвергают обратной экстракции простым третбутилметиловым эфиром (454 г) и объединенный органический слой промывают четыре раза деионизированной водой (4 х 800 мл). Органический слой концентрируют до остатка. В колбу загружают этилацетат (900 г) и нагревают до орошения флегмой. Содержимое колбы охлаждают до 50 С с последующим добавлением гексанов (672 г). Содержимое колбы охлаждают до 0 С и выдерживают в течение 1 ч. Продукт фильтруют и промывают холодной смесью этилацетат/гексаны (1/9, 175 г). Продукт сушат,чтобы получить с-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновую кислоту (125 г, 69%) в виде не совсем белого порошка. Пример 13. Получение хлорида с-4-циано 4-(3-циклопентилокси-4-метоксифенил)-rциклогексанкарбоновой кислоты. В 1-горлой колбе, оборудованной для пропускания азота, загружают -с-4-циано-4-(3 циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновую кислоту (1,372 г, 1 экв., 0,004 моль) и оксалилхлорид (4,568 г, 9 экв., 0,036 моль). Затем добавляют одну каплю диметилформамида. Эту смесь перемешивают при температуре окружающей среды в течение ночи. После испарения под высоким вакуумом получают указанный целевой продукт. Пример 14. Получение 1-10 а-4-циано-4-(3 циклопентилокси-4-метоксифенил)-r-циклогексанацилнитрила. В колбе образец хлорангидрида кислоты(0,004 г). Этот раствор нагревают с обратным холодильником в течение ночи. Это дает 0,211 г указанного в заголовке продукта. ИК: COCN,2220 см-1; С=0,1720 см-1. Изомерную чистоту 1-10 а определяют путем гидролиза ацилнитрила в теплой воде, продукт является по существу чистым соединением 1-11 а. Пример 15. Получение формы 1-10b 4 циано-4-(3-циклопентилокси-4-метоксифенил)r-циклогексанацилнитрила. В эксперименте, аналогичном примеру 14,аксиальную карбоновую кислоту превращают в хлорангидрид кислоты с использованием оксалилхлорида и каталитического количества диметилформамида. Этот хлорангидрид кислоты превращают непосредственно в соответствующий ацилнитрил, 1-10b, изомер соединения,полученного в примере 14. Изомерную чистоту анализируют путем гидролиза ацилнитрила путем перемешивания в теплой воде в течение 20 ч. Аналитическое определение ВЭЖХ показывает, что 96% продукта имеет форму 1-10b. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R1 обозначает -(CR4R5)rR6, гдe алкильные звенья могут быть не замещены или замещены одним или более атомом галогена;r принимает значения от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;R6 представляет метил, гидроксил, арил,талогензамещенный арил, арилокси С 1-3 алкил,галогензамещенный арилокси C1-3 алкил, инданил, инденил, С 7-11 полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 46 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть незамещены или замещены 1-3 метильными группами или этильной группой; при условии, что:a) когда R6 обозначает гидроксил, тогда r принимает значения от 2 до 6; илиb) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, тогда r принимает значения от 1 до 6; Х обозначает YR2;R2 независимо выбирают из -СН 3 или-СН 2 СН 3, не замещенных или замещенных 1 или более атомами галогена;R3 обозначает CN,R8 обозначает водород или C1-4 алкил, незамещенный или замещенный атомами фтора в количестве от одного до трех;R' и R" независимо обозначают водород или -С(О)ОН; при этом данный способ включает стадии а) проведения реакции соединения формулы II(а) или II(b) где R1, R3, X2 и Х принимают те же значения,что и в формуле (I), с приблизительно 1,5 эквивалентами кислоты Льюиса в растворителе,смешиваемом с водой, при температуре в интервале приблизительно от 60 до 100 С, возможно в инертной атмосфере; где соединение формулы (II) получается в результатеb) проведения реакции кетона формулы А где R1, R3, X2 и Х принимают те же значения,что и в формуле (I), с молярным избытком хлорацетонитрила, неорганическим основанием и каталитическим количеством хлорида бензилтриэтиламмония в растворителе, смешиваемом с водой; где соединение формулы (А) получается в результате с) декарбоксилирования бета-кетосложного эфира формулы В где R1, R3, X2 и Х принимают те же значения, что и в формуле (I), путем нагревания раствора бета-кето-сложного эфира с диметилсульфоксидом до приблизительно 150 С; где бета-кето-сложный эфир формулы В получается в результатеd) циклизации пимелата формулы С где R1, R3, X2 и Х обозначают то же, что и в формуле (I), с приблизительно 2 молярными эквивалентами сильного основания приблизительно при 75 С, где соединение формулы С получается в результате е) проведения реакции нитрила формулы D где R1, R3, X2 и Х обозначают то же, что и в формуле (I), с алкилакрилатом в 3-4-кратном молярном избытке в присутствии каталитического количества Triton-B, где соединения формулы (D) получаются в результатеf) проведения реакции соединения формулы (Е) где R1, X2 и Х обозначают то же, что и в формуле (I), с приблизительно 50%-ным молярным избытком цианида щелочного металла, где соединения формулы (Е) получаются в результатеg) проведения реакции спирта формулы (F) где R1, X2 и Х обозначают то же, что и в формуле (I), с избыточным количеством хлористоводородной кислоты, где соединения формулыh) восстановления альдегида формулы (G) где R1, X2 и X обозначают то же, что и в формуле (I), с помощью неорганического восстановителя. 2. Способ по п.1, где на стадии а) кислотой Льюиса является бромид лития, а вода добавляется в качестве сорастворителя. 3. Способ по п.1 или 2, где на стадии а) в качестве сорастворителя используется приблизительно 2 эквивалента воды. 4. Способ по пп.1-3, где на стадии а) реакционная смесь нагревается до приблизительно 90-95 С в течение приблизительно 8 ч. 5. Способ по пп.1-4, где раствор реакционной смесь далее обрабатывается путем добавления неорганического основания, а затем гипохлоритной соли. 6. Способ по п.1, где на стадии b) неорганическим основанием является водный раствор гидроксида калия, а смешиваемым с водой растворителем является тетрагидрофуран, и реакция проводится при температуре около 0 С. 7. Способ по п.1, где на стадии с) сильным основанием является метоксид натрия, который присутствует в количестве приблизительно 1,5 молярных эквивалентов, а реакция проводится при температуре приблизительно от 70 до 75 С в течение промежутка времени вплоть до 2 ч. 8. Способ по п.1, где стадии с) и d) объединяются циклизацией пимелата в результате реакции с метоксидом натрия декарбоксилированием получаемого в результате бета-кетосложного эфира без его выделения с добавлением диметилсульфоксида к раствору, содержащему сложный эфир, и нагревания этого раствора до приблизительно 145 С в течение промежутка времени вплоть до 2 ч. 9. Способ по п.8, где после завершения стадии циклизации реакционная смесь охлаждается до приблизительно комнатной температуры, а рН доводится до 6,8-7,2 перед добавлением диметилсульфоксида. 10. Способ по п.1, стадия е), где алкилакрилатом является метилакрилат. 11. Способ по п.1, стадия f), где цианидом щелочного металла является цианид натрия, а реакция проводится приблизительно при 55 С. 12. Способ по п.1, стадия h), где восстановителем является боргидрид натрия. 13. Способ по любому из пп.1-12, где в соединениях R1 обозначает CH2-циклопропил,CH2-C5-6 циклоалкил, С 4-6 циклоалкил, не замещенный или замещенный ОНС 7-11 полициклоалкилом, (3-или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, не замещенный или замещенный 1 или более атомами фтора, -(CH2)1-3 С(O)O(СН 2)0-2 СН 3, -(CH2)1-3 О(СН 2)0-2 СН 3 и -(СН 2)2-4OН; X обозначает YR2, aR2 обозначает C1-2 алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор. 14. Способ по любому из пп.1-12, где в соединениях R1 обозначает -СН 2-циклопропил,циклопентил, 3-гидроксициклопентил, метил или CF2H, где Х обозначает YR2, Y обозначает кислород, X2 обозначает кислород и R2 обозначает CF2H или метил. 15. Способ по любому из пп.1-12, где R1 обозначает циклопентил, X2 обозначает кислород, Y обозначает кислород и R2 обозначает метил. 16. Соединение формулы где R1 обозначает -(СR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;r принимает значения от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;R6 представляет метил, гидроксил, арил,галогензамещенный арил, арилокси C1-3 алкил,галогензамещенный арилокси С 1-3 алкил, инданил, инденил, С 7-11 полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 46 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой; при условии, что:r обозначает число от 2 до 6; илиb) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6; Х обозначает YR2, галоген, нитро, NH2 или формиламин;R2 независимо выбирают из -СН 3 или-СН 2 СН 3, не замещенных или замещенных 1 или более атомами галогена;R3 обозначает CN,R8 обозначает водород или C1-4 алкил, не замещенный или замещенный от одного до трех атомами фтора и Т обозначает CN или SО 2R, где R обозначает C1-6 алкил или С 0-3 алкилфенил. 17. Соединение по п.16, где Т обозначаетCN. 18. Соединение по п.16 или 14, где R1 обозначает СН 2-циклопропил, CH2-C5-6 циклоалкил,С 4-6 циклоалкил, не замещенный или замещен 21 ный ОНС 7-11 полициклоалкилом, (3- или 4 циклопентенил), фенил, тетрагидрофуран-3-ил,бензил или C1-2 алкил, не замещенный или замещенный 1 или более атомами фтора, -(СН 2)1-3 С(O)O(СН 2)0-2 СН 3,-(СН 2)1-3 О(СН 2)0-2 СН 3 и-(СН 2)2-4OН; Х обозначает YR2, a Y обозначает кислород; X2 обозначает кислород; R2 обозначает C1-2 алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор. 19. Соединение по любому из пп.16-18, где где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;r принимает значения от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;R6 представляет метил, гидроксил, арил,галогензамещенный арил, арилокси C1-3 алкил,галогензамещенный арилокси C1-3 алкил, инданил, инденил, С 7-11 полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой; при том условии, что:r принимает значения от 2 до 6; илиr принимает значения от 1 до 6; Х обозначает YR2; Х 2 обозначает О или NR8;R2 независимо выбирают из -СН 3 или-СН 2 СН 3 не замещенных или замещенных 1 или более атомом галогена;R3 обозначает CN,R8 обозначает водород или C1-4 алкил, не замещенный или замещенный от одного до трех атомами фтора.CH2-циклопропил, CH2-C5-6 циклоалкил, С 4-6 циклоалкил, не замещенный или замещенный ОНС 7-11 полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, незамещенный или замещенный 1 или более атомом фтора, -(СН 2)1-(СН 2)1-3 О(СН 2)0-2 СН 3 и 3 С(O)O(СН 2)0-2 СН 3,-(СН 2)2-4OН; Х обозначает YR2, a Y обозначает кислород; Х 2 обозначает кислород; R2 обозначает C12 алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор. 23. Соединение по п.22, где R1 обозначает CH2-циклопропил, циклопентил, 3-гидроксициклопентил, метил или CF2H; Х обозначает YR2; Y обозначает кислород; X2 обозначает кислород и где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;r обозначает число от 0 до 6;R4 и R5 независимо выбирают из водорода или С 1-2 алкила;R6 представляет водород, метил, гидроксил,арил,галогензамещенный арил,арилоксиC1-3 алкил, галогензамещенный арилокси C1-3 алкил, инданил, инденил, С 7-11 полициклоалкил, тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть незамещены или замещены от 1 до 3 метильными группами или одной этильной группой; при условии, что:r принимает значения от 2 до 6; илиb) если R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6; Х обозначает YR2; Х 2 обозначает О или NR8;R2 независимо выбирают из -СН 3 или-СН 2 СН 3, не замещенных или замещенных 1 или более атомами галогена;R8 обозначает водород или C1-4 алкил, не замещенный или замещенный от одного до трех атомами фтора. 26. Соединение по п.25, где R1 обозначаетCH2-циклопропил, CH2-C5-6 циклоалкил, С 4-6 циклоалкил, не замещенный или замещенный ОНС 7-11 полициклоалкилом, (3- или 4-циклопентенил), фенил, тетрагидрофуран-3-ил, бензил или C1-2 алкил, не замещенный или замещенный 1 или более атомами фтора, -(СН 2)1-3 С(O)OH; Х обозначает YR2, a Y обозначает кислород; Х 2 обозначает кислород; R2 обозначает C12 алкил, не замещенный или замещенный 1 или более атомами галогена, где галогенами являются фтор и хлор. 27. Соединение по п.26, где R представляетYR2, Y обозначает кислород, Х 2 обозначает кислород и R2 обозначает CF2H или метил. 28. Соединение по п.27, где RI обозначает циклопентил, X2 обозначает кислород, Ry обозначает метил и Y обозначает кислород. 29. Соединение по п.28, представляющее собой нитрил 4-циано-4-(3-циклопентилокси-4 метоксифенил)-r-циклогексанацила. 30. Способ получения соединения формулы (II) где R1 обозначает -(CR4R5)rR6, где алкильные звенья могут быть не замещены или замещены одним или более атомами галогена;r принимает значения от 0 до 6;R4 и R5 независимо выбирают из водорода или C1-2 алкила;C1-3 алкил, галогензамещенный арилоксиC1-3 алкил, инданил, инденил, С 7-11 полициклоалкил,тетрагидрофуранил, фуранил, тетрагидропиранил, пиранил, тетрагидротиенил, тиенил, тетрагидротиопиранил, тиопиранил, С 3-6 циклоалкил или С 4-6 циклоалкил, содержащий одну или две ненасыщенные связи, где циклоалкил и гетероциклические звенья могут быть не замещены или замещены от 1 до 3 метильными группами или одной этильной группой; при условии, что а) когда R6 обозначает гидроксил, то тогдаr принимает значения от 2 до 6; илиb) когда R6 обозначает 2-тетрагидропиранил, 2-тетрагидротиопиранил, 2-тетрагидрофуранил или 2-тетрагидротиенил, то тогда r принимает значения от 1 до 6; Х обозначает YR2;R2 независимо выбирают из -СН 3 или-СН 2 СН 3, не замещенных или замещенных 1 или более атомами галогена;R3 обозначает CN,R8 обозначает водород или C1-4 алкил, не замещенный или замещенный от одного до трех атомами фтора, а Т обозначает CN; при этом данный способ включает стадии:b) проведения реакции кетона формулы А где R1, R3, X2 и Х обозначают то же, что и в формуле (II), с мольным избытком хлорацетонитрила, неорганическим основанием и каталитическим количеством хлорида бензилтриэтиламмония в растворителе, смешиваемом с водой. 31. Способ по п.30, где неорганическим основанием является водный раствор гидроксида калия, а растворителем, смешиваемым с водой, является тетрагидрофуран. 32. Способ по п.31, где реакция проводится при температуре, равной приблизительно 0 С. 33. Способ повышения содержания формы с -4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновой кислоты, используя смесь цис- и транс-изомеров кислоты, при этом данный способ включает стадию кристаллизации из гексан/этилацетатного раствора циси транс-изомеров цис-изомера, по существу, не содержащего транс-изомера. 34. Способ по п.33, где цис-/транс-смесь растворяется в этилацетате и гексанах. 35. Способ по п.34, где цис-/транс-смесь растворяется в этилацетате, а после этого добавляются гексаны. 36. Способ по п.35, где этилацетатный раствор цис-/транс-изомеров нагревается в реакторе с обратным холодильником до кипения, охлаждается, а затем добавляются гексаны. 37. Соединение, представляющее собой хлорид с-4-циано-4-(3-циклопентилокси-4-метоксифенил)-r-циклогексанкарбоновой кислоты.
МПК / Метки
МПК: A61P 11/06, C07C 233/00, C07D 303/00
Метки: кислот, получения, соединения, замещенных, 4-фенил-4-цианоциклогексановых, способ
Код ссылки
<a href="https://eas.patents.su/13-1783-soedineniya-i-sposob-polucheniya-zameshhennyh-4-fenil-4-cianociklogeksanovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и способ получения замещенных 4-фенил-4-цианоциклогексановых кислот</a>
Следующий патент: Эффективный синтез 1,4-дигидро 2н-3,1-бензоксазин-2-она
Случайный патент: Способ конверсии оксигенатов в олефины в вертикальном реакторе

















