Производные винилсульфеновых кислот и способ их получения
Формула / Реферат
1. Соединение формулы
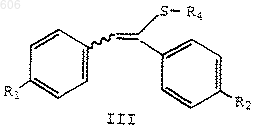
в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R4 представляет OSi(R)3, NR5R6 или SR8;
каждый R независимо представляет С1-С6-алкил, арил или арилалкил;
R5 и R6 независимо представляет водород, С1-С6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и
R8 представляет С1-С6-алкил, арил или арилалкил.
2. Соединение по п.1, в котором R1 представляет водород, С1-С4-алкокси или арилалкоксигруппу; и R2 представляет водород, С1-С4-алкокси или арилалкоксигруппу.
3. Соединение по п.2, в котором R4 представляет OSi(R4); и каждый R независимо друг от друга представляет C1-С6-алкил, арил или арилалкил.
4. Соединение по п.3, в котором R4 представляет о-триметилсилил, о-триэтилсилил, о-триизопропилсилил, о-диметилизопропилсилил, о-диэтилизопропилсилил, о-диметилгексилсилил, о-третбутилдиметилсилил, о-третбутилдифенилсилил, о-трибензилсилил, о-трифенилсилил, о-дифенилметилсилил или о-третбутилди(метоксифенил)силил.
5. Соединение по п.4, котором R4 представляет о-триметилсилил, о-триэтилсилил, о-диметилизопропилсилил, о-диэтилизопропилсилил, о-третбутилдиметилсилил, о-трибензилсилил, о-трифенилсилил.
6. Соединение по п.5, в котором R1 и R2 представляют C1-С4-алкоксигруппу.
7. Соединение по п.6, в котором R1 и R2 представляют метоксигруппу и R4 представляет о-триметилсилил.
8. Соединение по п.2, в котором R4 представляет NR5R6; и
R5 и R6 независимо представляют водород, C1-C6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина.
9. Соединение по п.8, в котором R5 и R6 независимо представляют водород, C1-C6-алкил, арилалкил или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина и пирролидина.
10. Соединение по п.9, в котором R1 и R2 представляют C1-С4-алкоксигруппу.
11. Соединение по п.10, в котором R1 и R2 представляют метоксигруппу и R5 и R6 представляют метил.
12. Соединение по п.10, в котором R1 и R2 представляют метоксигруппу, R5 представляет водород и R6 представляет бензил.
13. Соединение по п.2, в котором R4 представляет SR8 и R8 представляет С1-С6-алкил, арил или арилалкил.
14. Соединение по п.13, в котором R8 представляет С1-С6-алкил или арилалкил.
15. Соединение по п.14, в котором R8 представляет С1-С6-алкил.
16. Соединение по п.15, в котором R1 и R2 представляют С1-С4-алкоксигруппу.
17. Соединение по п.16, в котором R1 и R2 представляют метоксигруппу и R8 представляет этил.
18. Способ получения соединения формулы III
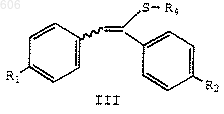
в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R4 представляет OSi(R)3, NR5R6 или SR8;
каждый R, независимо, представляет С1-С6-алкил, арил или арилалкил;
R5 и R6, независимо, представляют водород, С1-С6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и
R8 представляет С1-С6-алкил, арил или арилалкил;
который включает:
(1) реакцию соединения формулы II
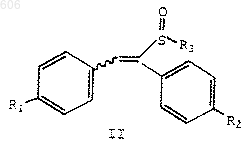
в которой R1 и R2 определены выше, и
R3 представляет термически или кислотонеустойчивый С2-С10-алкил, С4-С10-алкенил или арил(С1-С10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV
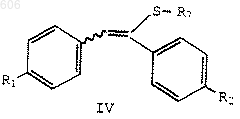
в которой R1 и R2определены выше; R7 представляет OSi(R)3; и каждый R независимо представляет С1-С6-алкил, арил или арилалкил;
(2) необязательную реакцию силилсульфената с амином формулы HNR5R6, в которой R5 и R6 определены выше; или
(3) необязательную реакцию силилсульфената с меркаптаном формулы HSR8, в которой R8 определен выше, в присутствии аминного основания.
19. Способ по п.18 получения соединения формулы IV
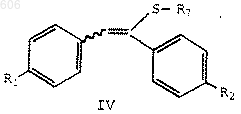
в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R7 представляет OSi(R)3;
каждый R, независимо, представляет С1-С6-алкил, арил или арилалкил, который включает реакцию соединения формулы II
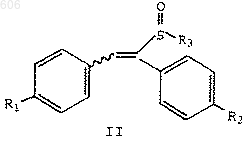
в которой R1 и R2 определены выше, и
R3 представляет термически или кислотонеустойчивый С2-С10-алкил, С4-С10-алкенил или арил(С1-С10) алкил; с силилирующим реагентом.
20. Способ по п.19, в котором R1 представляет водород, С1-С4-алкокси или арилалкоксигруппу; и R2 представляет водород, С1-С4-алкокси или арилалкоксигруппу.
21. Способ по п.20, в котором R7 представляет собой о-триметилсилил, о-триэтилсилил, о-триизопропилсилил, о-диметилизопропилсилил, о-диэтилизопропилсилил, о-диметилгексилсилил, о-третбутилдиметилсилил, о-третбутилдифенилсилил, о-трибензилсилил, о-трифенилсилил, о-дифенилметилсилил или о-третбутилди (метоксифенил) силил.
22. Способ по п.21, отличающийся тем, что силилирующим реагентом является бис(триалкилсилил)мочевина или комбинация гексаалкилдисилилазана и каталитического количества триалкилсилилхлорида и R представляет C1-С6-алкил.
23. Способ по п.22, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил.
24. Способ по п.23, в котором R3 представляет термически или кислотонеустойчивый С2-С10-алкил.
25. Способ по п.24, в которой R1 и R2 представляют метоксигруппу и R3 представляет трет-бутил.
26. Способ по п.18 получения соединения формулы V

в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу; и
R5 и R6 независимо представляют водород, С1-С6-алкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина, включающий:
(1) реакцию соединения формулы II
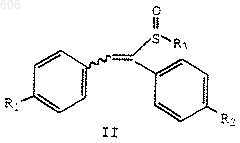
в которой R1 и R2 определены выше, и
R3 представляет термически или кислотонеустойчивый С2-С10-алкил, С4-С10-алкенил или арил(С1-С10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV
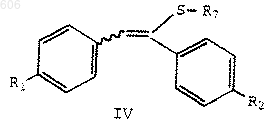
в которой R1 и R2 определены выше;
R7 представляет OSi(R)3; и
каждый R, независимо, представляет С1-С6-алкил, арил или арилалкил; и
(2) реакцию силилсульфенатов с амином формулы HNR5R6, в которой R5 и R6 определены выше.
27. Способ п.26, в котором R1 представляет водород, С1-С4-алкокси или арилалкоксигруппу и R2 представляет водород, С1-С4-алкокси или арилалкоксигруппу.
28. Способ по п.27, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил.
29. Способ по п.28, в котором R3 представляет термически или кислотонеустойчивый С2-С10-алкил.
30. Способ по п.29, в котором R1 и R2 представляют метоксигруппу и R3 представляет трет-бутил.
31. Способ по п.30, в котором R5 и R6, независимо, представляют водород, С1-С6-алкил или арил.
32. Способ по п.31, в котором R5 и R6 представляют метил или R5 представляет водород и R6 представляет бензил.
33. Способ по п.18 получения соединения формулы XIV
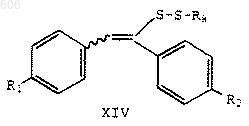
в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу; и
R8 представляет С1-С6-алкил, арил или арилалкил, который включает:
(1) реакцию соединения формулы II
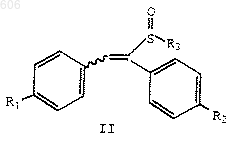
в которой R1 и R2 определены выше, и
R3 представляет термически или кислотонеустойчивый С2-С10-алкил, С4-С10-алкенил или арил(С1-С10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV
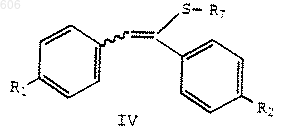
в которой R1 и R2 определены выше;
R7 представляет OSi(R)3; и каждый R независимо представляет С1-С6-алкил, арил или арилалкил; и
(2) реакцию указанных силилсульфенатов с меркаптаном формулы HSR8, где R8 определен выше, в присутствии аминного основания.
34. Способ по п.33, в котором R1 представляет водород, С1-С4-алкокси или арилалкоксигруппу и R2 представляет водород, С1-С4-алкокси или арилалкоксигруппу.
35. Способ по п.34, отличающийся тем, что основанием амина является триэтиламин, диизопропилэтиламин или пиридин.
36. Способ по п.35, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил.
37. Способ по п.36, в котором R3 представляет термически или кислотонеустойчивый С2-С10-алкил.
38. Способ по п.37, отличающийся тем, что аминным основанием является триэтиламин.
39. Способ по п.38, в котором R1 и R2 представляет метоксигруппу и R3 представляет трет-бутил.
40. Способ по п.39, в котором R8 представляет С1-С6-алкил.
41. Способ по п.40, в котором R8 представляет этил.
42. Способ получения соединения формулы XIII
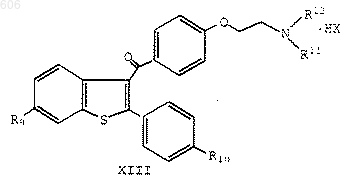
в которой
R9 представляет водород, галоген, амино или гидроксигруппу;
R10 представляет водород, галоген, амино или гидроксигруппу;
R11 и R12 независимо представляют С1-С4-алкил, или R11 и R12 вместе с соседним атомом азота образуют гетероциклическое кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и НХ является НСl или НВr;
который включает:
(а) циклизацию в присутствии кислотного катализатора соединения формулы III
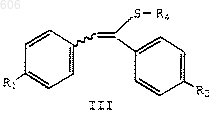
в которой R1 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R2 представляет водород, С1-С4-алкокси, арилалкокси, галоген или аминогруппу;
R4 представляет OSi(R)3, NR5R6 или SR8;
каждый R независимо представляет С1-С6-алкил, арил или арилалкил;
R5 и R6 независимо представляют водород, С1-С6-алкил или арил или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и
R8 представляет С1-С6-алкил, арил или арилалкил;
с получением бензотиофенового соединения формулы I
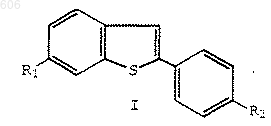
в которой R1 и R2 определены выше;
(б) ацилирование указанного бензотиофенового соединения ацилирующим реагентом формулы XII
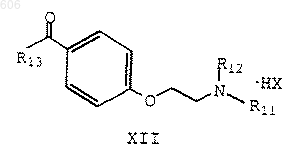
в которой R11, R12 и НХ определены ранее; и R13 представляет хлор, бром или гидроксигруппу, в присутствии ВХ'3, в котором X' представляет хлор или бром;
(в) если R1 и/или R2 представляет С1-С4-алкокси или арилалкоксигруппу, деалкилирование одной или нескольких фенольных групп продукта ацилирования стадии (б) реакцией с дополнительным количеством ВХ'3, в котором X' определен выше; и ,необязательно,
(г) выделение соединения формулы XIII.
Текст
1 Изобретение относится к новым производным винилсульфеновых кислот и новому способу их получения. Эти соединения используются для синтеза бензо[b]тиофенов, особенно 2 арилбензо[b]тиофенов. Бензо[b]тиофены получают многими различными синтетическими способами. Одним из самых широко используемых способов является циклизация о-меркаптокоричных кислот. Этот способ ограничен получением бензо[b]тиофен 2-карбоксилатов. 2-Фенилбензо[b]тиофены получают циклизацией диалкилацеталей 2 фенилтиоацетальдегида, катализируемой кислотой. Незамещенные бензо[b]тиофены получают каталитической конденсацией стирола и серы. 3-Замещенные бензо[b]тиофены получают циклизацией ариптиометилкетонов, катализируемой кислотой; однако, этот способ ограничен получением 3-алкилбензо[b]тиофенов. См.Campaigne, "Thiophenes and their Benzo Derivatives: (iii) Synthesis and Applications", in Comprehensive Hetercyclic Chemistry (Katritzky and Rees,eds.), Volume IV, Part III, 863-934 (1984). 3 Хлор-2-фенил-бензо[b]тиофен получают реакцией дифенилацетилена с дихлоридом серы.(1970). Бензо[b]тиофены также получают пиролизом стирилсульфоксидов. Однако, низкие выходы и экстремально высокие температуры делают этот способ неприемлемым для синтезов в промышленном масштабе. См. Ando, J. Chem.Soc., Chem. Comm., 704-705 (1975). Полагают, что сульфеновые кислоты являются ключевыми полупродуктами многих химических реакций; однако, существует очень мало примеров выделения этих соединений. См.Shelton and Davis, J. Am. Chem. Soc.,89 (3), 718719 (1968) и Davis и др., J. Am. Chem. Soc., 100,2844 (1978). Сульфеновые кислоты получают insitu и внутримолекулярно или межмолекулярно циклизуют с олефинами и ацетиленами. Смотри, Maz-zanti и др., J. Chem.Soc., Perkin Trans. 1,3299-3004 (1944) и Davis и др., J. Org. Chem., 45,1650-1653 (1980). Ряд триметилсилиларенсульфенатов получают из соответствующих Nбензилиденаренсульфинамидов; однако, выходы триметилсилильных эфиров обычно очень низки. Davis и др., J. Org. Chem., 45, 1650-1653(1980). Получение 6-гидрокси-2-(4-гидроксифенил)бензо[b]тиофенов описано в патентах США 4 133 814 и 4 380 635. Одним из способов,описанных в этих патентах, является катализируемая кислотой внутримолекулярная циклизация/перегруппировка (3-метоксифенилтио)-4 метоксиацетофенона. Реакция этого исходного соединения в неразбавленной полифосфорной кислоте при от примерно 85 С до примерно 90 С дает приблизительно 3:1 смесь региоизомеразных продуктов: 6-метокси-2-(4-метоксифенил)бензо[b]тиофен и 4-метокси-2-(4 000606 2 метоксифенил)бензо [b]тиофен. Эти изомерные бензо[b]тиофены соосаждаются из реакционной смеси, давая смесь, содержащую оба соединения. Чтобы получить индивидуальный изомер,региоизомеры должны быть разделены, такими методами как хроматография или фракционная кристаллизация. Следовательно, в настоящее время существует необходимость в эффективном и региоселективном синтезе 2 арилбензо[b]тиофенов из легко доступных исходных материалов. Настоящее изобретение относится к новым производным винилсульфеновых кислот: новым силиловым эфирам сульфеновых кислот, сульфенамидам и дисульфидам, и к способу получения производных винилсульфеновых кислот. В частности, настоящее изобретение относится к соединениям формулы IIIR6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; иR8 представляет С 1-С 4-алкил, арил или арилалкил. Следовательно, настоящее изобретение включает индивидуальные изомеры Е и Z или их смеси формулы III. Эти Е и Z региоизомеры представлены следующими структурами: Другим объектом настоящего изобретения является способ получения силилсульфенатов,сульфенамидов и дисульфидов. Настоящее изобретение относится к способу получения соединения формулы IIIR5 и R6, независимо, представляет водород,С 1-С 6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и(1) реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил (С 1-С 10) алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV(2) необязательно реакцию полученного силилсульфената с амином формулы HNR5R6, в которой R5 и R6 определены выше; или(3) необязательно реакцию силилсульфената с меркаптаном формулы HSR8, в которойR8 определен выше, в присутствии аминного основания. Одним из объектов настоящего изобретения является способ получения силилсульфенатов формулы IV. В частности, настоящее изобретение относится к способу получения соединения формулы IVR7 представляет OSi(R)3,каждый R, независимо представляет С 1-С 6 алкил, арил или арилалкил, который включает реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил,С 4-С 10 представляет алкенил или арил(С 1 С 10)алкил; с силилирующим реагентом. Другим объектом настоящего изобретения является способ получения сульфенамидов формулы V, в частности, настоящее изобретение относится к способу получения соединения формулы VR5 и R6, независимо представляют водород,С 1-С 6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина, который включает:(1) реакцию соединения формулы II:R3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил (С 1-С 10)алкил; с силилирующим реагентом с получением силилсульфената формулы IV(2) реакцию полученного силилсульфената с амином формулы HNR5R6, в которой R5 и R6 определены выше. Другим объектом настоящего изобретения является способ получения дисульфидов формулы XIV. В частности, настоящее изобретение относится к способу получения соединения формулы XIV(1) реакцию соединения формулы II:R3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил; с силилирующим реагентом с получением силилсульфената формулы IV(2) реакцию полученного силилсульфената с меркаптаном формулы HSR8, в которой R8 определен выше, в присутствии аминного основания. Другим объектом изобретения является способ синтеза соединения формулы XIIIR11 и R12, независимо друг от друга представляют С 1-С 4-алкил, или R11 и R12 вместе с соседним атомом азота образуют гетероциклическое кольцо, выбранное из группы, состоящей из пирролидино, пиперидино, гексаметиленимино и морфолино; и НХ является НСl или НВr, который включает:(а) циклизацию в присутствии кислотного катализатора соединения формулы IIIR5 и R6, независимо представляет водород,С 1-С 6-алкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; иR8 представляет С 1-С 6-алкил, арил или арилалкил; с получением бензотиофенового соединения формулы I(б) ацилирование указанного бензотиофенового соединения ацилирующим реагентом формулы XIIR13 представляет хлор, бром или гидроксигруппу, в присутствии ВХ'3, в котором X' представляет хлор или бром;(в) если R1 и/или R2 представляет С 1-С 4 алкоксигруппу или арилоксигруппу, деалкилирование одной или нескольких фенольных групп продукта ацилирования со стадии (б) реакцией с дополнительным количеством ВХ'3, в котором X' определен выше; и(г) выделение соединения формулы XIII. Термин "кислотный катализатор" обозначает кислоту Льюиса или кислоту Бренстеда. Типичными кислотами Льюиса являются хлорид цинка, иодид цинка, хлорид алюминия и бромид алюминия. Типичные кислоты Бренстеда включают неорганические кислоты, такие как серная и фосфорная кислота; карбоновые кислоты, такие как уксусная и трифторуксусная кислоты; сульфокислоты, такие как метансульфоновая, бензолсульфоновая, 1-нафталинсульфоновая, 1-бутансульфоновая, этансульфоновая,4-этилбензолсульфоновая, 1-гексансульфоновая,1,5-нафталиндисульфоновая,1-октансульфо 7 новая, камфорсульфоновая, трифторметансульфоновая и п-толуолсульфоновая кислоты; и полимерные арилсульфокислоты, такие как НафионR, АмберлистR или АмберлитR. Предпочтительными кислотами для использования в катализировании процессов настоящего изобретения являются сульфоновые или полимерные сульфоновые кислоты. Более предпочтительно, кислотными катализаторами являются сульфоновые кислоты, такие как метансульфоновая кислота, бензолсульфоновая кислота,камфорсульфоновая кислота и п-толуолсульфоновая кислота. Наиболее предпочтительным кислотным катализатором является птолуолсульфоновая кислота. Термин "С 1-С 4-алкоксигруппа" обозначает группы, такие как метоксигруппа, этоксигруппа,н-пропоксигруппа,изопропоксигруппа,нбутоксигруппа, трет-бутоксигруппа и подобные группы. Термин "галоген" относится к фтору,хлору, брому или иоду. Термин "С 1-С 6-алкил" обозначает нормальную или разветвленную алкильную цепь,имеющую от одного до шести атомов углерода. Типичные С 1-С 6-алкильные группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, 2-метилпентил и подобные группы. Термин "С 1-С 4-алкил" обозначает нормальную или разветвленную алкильную цепь,имеющую от одного до четырех атомов углерода и включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и третбутил. Термин "арил" обозначает группы, такие как фенил и замещенный фенил. Термин "замещенный фенил" обозначает фенил, замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена,гидроксигруппы, нитрогруппы. С 1-С 4-алкила,С 1-С 4-алкоксигруппы, трихлорметила и трифторметила. Примеры замещенной фенильной группы включают 4-хлорфенил,2,6 дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил,3-хлорфенил,3-бромфенил,4 бромфенил,3,4-дибромфенил,3-хлор-4 фторфенил, 2-фторфенил, 4-гидроксифенил, 3 гидроксифенил,2,4-дигидроксифенил,3 нитрофенил, 4-нитрофенил, 2,4-динитрофенил,4-метилфенил, 4-этилфенил, 4-метоксифенил, 4 пропилфенил, 4-н-бутилфенил, 4-трет-бутилфенил, 3-фтор-2-метилфенил, 2,3-дифторфенил,2,6-дифторфенил, 2,6-диметилфенил, 2-фтор-5 метилфенил, 2,4,6-трифторфенил, 2-трифторметилфенил, 2-хлор-5-трифторметилфенил, 3,5 бис (трифторметил)фенил, 2-метоксифенил, 3 метоксифенил, 3,5-диметоксифенил, 4-гидрокси-3-метилфенил, 3,5-диметил-4-гидроксифенил,2-метил-4-нитрофенил,4-метокси-2 нитрофенил и другие. Термин "арилалкил" обозначает С 1-С 4 алкильную группу, замещенную одной или не 000606 8 сколькими арильными группами. Представители этой группы включают бензил, о-нитробензил,п-нитробензил, п-галогенбензил (такой, как пхлорбензил, п-бром-бензил, п-иодбензил), 1 фенилэтил, 2-фенилэтил, 3-фенилпропил, 4 фенилбутил,2-метил-2-фенилпропил,(2,6 дихлорфенил)метил, бис(2,6-дихлорфенил) метил,(4-гидроксифенил)метил,(2,4 динитрофенил)метил, дифенилметил, трифенилметил,(п-метоксифенил)дифенилметил,бис(п-метоксифенил)метил, бис(2-нитрофенил) метил и другие. Термин "арилалкокси" обозначает С 1-С 4 алкоксигруппу, замещенную одной или несколькими арильными группами. Представители этой группы включают бензилокси, онитробензилокси, п-нитробензилокси, п-галогенбензилокси (такой как п-хлорбензилокси, пбромбензилокси, п-иодбензилокси), 1-фенилэтокси, 2-фенилэтокси, 3-фенилпропокси, 4 фенилбутокси, 2-метил-2-фенилпропокси, (2,6 дихлорфенил)метокси,бис(2,6-дихлорфенил) метокси,(4-гидроксифенил)метокси,(2,4 динитрофенил)метокси, дифенилметокси, трифенилметокси, (п-метоксифенил)дифенилметокси, бис(п-метоксифенил)метил, бис(2-нитрофенил)метокси и другие. Термин "термически или кислотонеустойчивый С 2-С 10-алкил,С 4-С 10-алкенил или арил(С 1-С 10)алкил" обозначает группу, которая легко отщепляется от сульфоксидной (SO) группы при нагревании или обработке кислотным катализатором. Термически или кислотонеустойчивые С 2 С 10-алкильные группы имеют нормальную или разветвленную алкильную цепь, имеющую от двух до десяти атомов углерода и имеющую, по меньшей мере, один атом водорода в положении бета. Типичные термически или кислотнонеустойчивые С 2-С 10-алкилы включают этил, нпропил, изопропил, 1,1-диметилпропил, нбутил,втор-бутил,трет-бутил,1,1 диметилбутил, 2-метилбутил, 3-метилбутил, 1 метилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,4-диметилбутил, 3,3-диметилбутил, нпентил, 1-метил-пентил, 2-метилпентил, 3 метилпентил, 4-метилпентил, н-гексил и другие. Термически или кислотонеустойчивые С 4 С 10-алкенильные группы имеют нормальные или разветвленные алкенильные цепи, имеющие от четырех до десяти атомов углерода, по меньшей мере, одно место ненасыщенности и либо бета-водород, либо дельта-водород. Типичные термически или кислотнонеустойчивые С 4-С 10-алкенильные группы включают 2-бутенил, 3-бутенил, 2-метил-2-бутенил, 3-метил-2 бутенил, 2-метил-3-бутенил, 2-пентенил, 3 пентенил, 4-пентенил, 2-метил-2-пентенил, 3 метил-2-пентенил, 4-метил-2-пентенил, 2-метил 3-пентенил, 3-метил-3-пентенил, 4-метил-3 пентенил,2-метил-4-пентенил,3-метил-4 9 пентенил, 4-метил-4-пентенил, 2-гексенил, 3 гексенил, 4-гексенил, 5-гексенил и другие. Термин термически или кислотонеустойчивый арил(С 1-С 10)алкил представляет термически или кислотонеустойчивые С 2-С 10-алкильные группы, дополнительно содержащие одну или несколько арильных групп и арилзамещенные метильные группы. Типичные арил(С 1 С 10)алкильные группы включают бензил, дифенилметил, трифенилметил, п-метоксибензип, 2 фенилэтил, 2-фенилпропил, 3-фенилпропил и другие. Одна группа соединений настоящего изобретения является силилсульфенатами. В частности, соединения формулы III, где R4 представляет OSi(R)3 и каждый R, независимо друг от друга, является С 1-С 6-алкилом, арилом ипи арилалкилом, и соединения формулы IV являются силилсульфенатами. Предпочтительные силилсульфенаты названы с помощью аббревиатуры по номенклатуре, известной в химии,как показано в следующей таблице. Таблица 1 Аббревиатура ТМС ТЭС ТИПС ДМИПС ДЭИПС ДМГС ТБДМС ТБДФС ТБС ТФС ДФМС ТБМФС Силильная группа Триметилсилил Триэтилсилил Триизопропилсилил Диметилизопропилсилил Диэтилизопропилсилил Диметилгексилсилил Трет-бутилдиметилсилил Трет-бутилдифенилсилил Трибензилсилил Трифенилсилил Дифенилметилсилил Трет-бутилди(метоксифенил)силил Термин "силилирующий реагент" обозначает соединение или комбинацию соединений,используемых для превращения промежуточной сульфеновой кислоты в силилсульфенаты. Типичные силилирующие реагенты включают бис(триалкилсилил)мочевины, такие как 1,3-бис(триметилсилил)мочевины,1,3-бис(триэтилсилил)мочевина,1,3-бис(диметилгексилилсилил)мочевина и 1,3-бис(трет-бутилдиметилсилил)мочевина; бис(триарилсилил)мочевины, такие как 1,3 бис(трифенилсилил)мочевина; бис(диарилалкилсилил)мочевины,такие как 1,3-бис(дифенилметилсилил)мочевина и 1,3-бис(трет-бутилдифенилсилил)мочевина; и гексаалкилдисилилазаны, такие как гексаметилдисилилазан; или комбинация гексаалкилдисилилазана и каталитического количества триалкилсилилхлорида, такого как хлортриметилсилан. Соединения формулы III существуют в двух региоизомерных формах, Е и Z. Эти E и Z Исходные соединения для процессов настоящего изобретения могут быть получены различными способами. Один способ получения соединений формулы II показан на схеме 1. Схема 1 Обычно соединение формулы VII превращают в стирилсульфид реакцией с меркаптаном формулы HSR3 в присутствии кислоты Льюиса. Соединение формулы VIII затем окисляют в стирилсульфоксид формулы II. Более подробно, соединение формулы VII,в которой R1 и R2 определены выше, обрабатывают кислотой Льюиса, такой как хлорид титана(IV). Эту реакцию проводят в безводном органическом растворителе, таком как тетрагидрофуран, при температуре от примерно 0 до примерно 35 С. Через от примерно 15 мин до примерно одного часа реакционную смесь обрабатывают основанием амина и меркаптаном формулы HSR3, где R3 представляет термически или кислотонеустойчивую группу С 2-С 10-алкил, С 4 С 10-алкенил или арил(С 1-С 10)алкил. Предпочтительно меркаптан и основание амина добавляют в виде раствора в растворителе реакции. Представителем основания амина является триэтиламин. После добавления меркаптана и основания амина реакционную смесь нагревают до температуры от примерно 35 С до примерно 65 С, предпочтительно до примерно 50 С. Продукты этой реакции могут быть очищены с использованием методик, хорошо известных в химии, таких как кристаллизация или хроматография. Соединение формулы VIII, где R1, R2 и R3 определены выше, затем окисляют с получением соединений формулы II. Подходящими окислителями для этой реакции являются перкислоты, такие как перуксусная кислота и мхлорпероксибензойная кислота и пероксид водорода. Эту реакцию окисления обычно проводят в органическом растворителе, таком как толуол, метиленхлорид, хлороформ или тетрахлорид углерода. Если в качестве окислителя используют перкислоту, реакцию обычно проводят при температуре от примерно -30 С до-20 С. Продукты реакции легко очищают перекристаллизацией. Если R3 является третбутилом, кристаллический продукт этой последовательности реакций является региоизомером Е формулы II. Если R3 имеет третичный углерод, соединенный с атомом серы, то региоизомер Z соединений формулы II может быть получен селективно по второму пути, как показано на схеме 2. Схема 2 Обычно, бензиловый спирт формулы IX,вводят в реакцию с меркаптаном формулы R3SH с получением бензилсульфида формулы X. Бензилсульфид вводят в реакцию с сильным основанием с образованием бензильного аниона,который конденсируют с бензальдегидом. Продукт конденсации вводят в реакцию с ацилхлоридом и образовавшийся промежуточный продукт обрабатывают вторым сильным основанием для получения стирилсульфида формулыVIIIZ. Этот стирилсульфид затем окисляют окисляющим агентом с получением соединенияZ-стирилсульфоксидных соединений является превращение бензилового спирта в бензилсульфид формулы X. Реакция соединения формулы IX, гдеR3SH, в которой R3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10 алкенил или арил(С 1-С 10)алкил, имеющий третичный атом углерода соседний с атомом серы,в присутствии кислоты Льюиса дает бензилсульфид формулы X. Подходящими кислотами Льюиса для этого превращения являются бромид цинка, хлорид цинка, иодид цинка, хлорид железа, хлорид титана (IV), трихлорид алюминия и трибромид алюминия, предпочтительно иодид цинка. Реакцию обычно проводят в органическом растворителе, таком как 1,2 дихлорэтан или метиленхлорид. Если реакцию проводят при комнатной температуре, то реакция завершается через 18 ч. Бензилсульфид вводят в реакцию с сильным основанием с образованием бензильного аниона. Подходящие сильные основания для этой реакции включают алкоксиды металлов,такие как метоксид натрия, этоксид натрия,этоксид лития, трет-бутоксид лития и трет 000606 12 бутоксид калия; гидрид натрия; и литийалкилы,такие как н-бутиллитий, трет-бутиллитий, вторбутиллитий и метиллитий. Предпочтительным сильным основанием для этой реакции является н-бутиллитий. Предпочтительным растворителем для этой реакции является тетрагидрофуран. Если в качестве сильного основания используют н-бутиллитий, то реакцию проводят при температуре от примерно -35 С до примерно -15 С. Бензильный анион конденсируют с бензальдегидом с получением промежуточного продукта конденсации. Бензальдегид имеет общую формулу п-R1(С 6 Н 4)СНО, в которой R1 представляет водород, С 1-С 4-алкоксигруппа,арилалкоксигруппа, галоген или аминогруппа. Предпочтительно, получают бензильный анион и продукт конденсации образуют in situ добавлением бензальдегида к холодному раствору бензильного аниона. Продукт конденсации обрабатывают хлорангидридом кислоты с получением промежуточного соединения. Представители хлорангидридов кислот включают ацилхлориды, такие как ацетилхлорид и бензоилхлорид; сульфонилхлориды, такие как метансульфонилхлорид, бензолсульфонилхлорид,1-бутансульфонилхлорид, этансульфонилхлорид, изопропилсульфонилхлорид и п-толуолсульфонилхлорид; алкоксикарбонилхлориды,такие как метоксикарбонилхлорид и бензилоксикарбонихлорид; и диалкиламинокарбонилхлориды, такие как N,N-диметиламинокарбонилхлорид; предпочтительно сульфонилхлорид. Предпочтительно, метансульфонилхлорид добавляют к реакционной смеси вскоре после образования продукта конденсации. Промежуточное соединение вводят в реакцию со вторым сильным основанием с получением стирилсульфида формулы VIIIZ, где R1, R2 и R3 определены выше. Подходящие сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, этоксид лития, трет-бутоксид лития и трет-бутоксид калия; гидрид натрия; и литийалкилы, такие как н-бутиллитий, третбутиллитий, втор-бутиллитий и метиллитий; и амиды металлов, такие как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтительным сильным основанием для этой реакции является трет-бутоксид калия. Обычно, эту реакцию проводят при температуре от примерно 15 С до примерно комнатной температуры, предпочтительно при комнатной температуре. Стирилсульфид окисляют с получением соответствующего стирилсульфоксида. Подходящими окисляющими агентами для этой реакции являются перкислоты,такие как перуксусная кислота и м-хлорпероксибензойная кислота; органические пероксиды, такие как третбутилпероксид; и пероксид водорода. Предпоч 13 тительным окисляющим агентом является перуксусная кислота. Окисление обычно проводят в органическом растворителе, таком как толуол,бензол, ксилол, метанол, этанол, метилацетат,этилацетат, метиленхлорид, 1,2-дихлорэтан или хлороформ; предпочтительно, метиленхлорид. Это окисление может быть проведено при температуре от примерно -40 С до примерно 0 С. Альтернативно, если R3 имеет третичный атом углерода, соседний с атомом серы, бензилсульфидный промежуточный продукт (соединение формулы X) может быть использован для получения смеси Е и Z изомеров стирилсульфоксидов формулы II. Этот синтез изображен на схеме 3: Схема 3 Бензилсульфид, полученный как описано выше, окисляют с получением соответствующего бензилсульфоксида. Этот бензилсульфоксид вводят в реакцию с сильным основанием и образующийся анион конденсируют с бензальдегидом. Продукт конденсации вводят в реакцию с хлорангидридом кислоты и образовавшееся промежуточное соединение вводят в реакцию со вторым сильным основанием с получением стирилсульфоксида. Бензилсульфид формулы X, в которой R2 определен выше и R3 представляет термически или кислотонеустойчивый с С 2-С 10-алкил, С 4 С 10-алкенил или арил(С 1-С 10)алкил, имеющий тертичный атом углерода соседний с атомом серы, окисляют с получением соответствующего бензилсульфоксида формулы XI. Подходящими окисляющими агентами для этой реакции являются перкислоты, такие как перуксусная кислота и м-хлорпероксибензойная кислота; органические пероксиды,такие как трет-бутилпероксид; и пероксид водорода. Предпочтительно окисляющим агентом является перуксусная кислота. Окисление обычно проводят в органическом растворителе,таком как толуол, бензол, ксилол, метанол, этанол, метилацетат, этилацетат, метиленхлорид,1,2-дихлорэтан или хлороформ; предпочтительно при температуре от примерно -35 С до примерно 5 С. Бензилсульфоксид, соединение формулыXI, в которой R2 и R3 определены выше, вводят в реакцию с сильным основанием с получением бензильного аниона. Подходящие сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, этоксид лития, трет-бутоксид лития и 14 трет-бутоксид калия; гидрид натрия; и литийалкилы, такие как н-бутиллитий, трет-бутиллитий,втор-бутиллитий и метиллитий; и амиды металлов, такие как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтительным сильным основанием для этого превращения является н-бутиллитий. Реакцию депротонирования проводят в сухом органическом растворителе, таком как тетрагидрофуран или 1,2-диметоксиэтан, при температуре примерно-25 С. Бензильный анион конденсируют, без выделения, с бензальдегидным соединением формулы п-R1(С 6 Н 4)СНО, в котором R1 определен выше. Предпочтительно добавляют примерно один эквивалент бензальдегида к холодному раствору, полученному как описано в предшествующем параграфе. Полученная диастереомерная смесь продуктов конденсации может быть выделена или, предпочтительно, использована на следующей стадии без выделения. Продукт конденсации реагирует с хлорангидридом кислоты с получением промежуточного соединения. Продукт конденсации, необязательно, обрабатывают основанием, таким как н-бутиллитий, и вводят в реакцию с хлорангидридом кислоты.Представители хлорангидридов кислот включают ацилхлориды, такие как ацетилхлорид и бензоилхлорид; сульфонилхлориды, такие как метансульфонилхлорид, бензолсульфонилхлорид,1-бутансульфонилхлорид,этансульфонилхлорид,изопропилсульфонилхлорид и п-толуолсульфонилхлорид; алкоксикарбонилхлориды, такие как метоксикарбонилхлорид и бензилоксикарбонилхлорид; и диалкиламинокарбонилхлориды, такие как N,Nдиметиламинокарбонилхлорид; предпочтительно, сульфонилхлорид. Хлорангидрид кислоты добавляют к холодной реакционной смеси и полученной смеси позволяют нагреться до комнатной температуры. Предпочтительно метансульфонилхлорид добавляют к реакционной смеси вскоре после образования продукта конденсации, что избавляет от необходимости добавлять дополнительное основание. Полученное промежуточное соединение вводят в реакцию со вторым сильным основанием с получением Е- и Z-стирилсульфоксида формулы II, где R1, R2 и R3 определены выше. Подходящие сильные основания для этой реакции элиминирования включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, этоксид лития, трет-бутоксид лития и трет-бутоксид калия; гидрид натрия; и литийалкилы, такие как н-бутиллитий, трет-бутиллитий,втор-бутиллитий и метиллитий; и амиды металлов, такие как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтительным сильным основанием для этой реакции является трет-бутоксид калия. Предпочтительно добавляют 20% избыток, такой как 1,2 эквивалента второго основания. Обычно, реакцию проводят при температуре от примерно 15 С до примерно комнатной температуры, предпочтительно при комнатной температуре. Соединения настоящего изобретения могут быть получены из соединений формулы II. Новые силилсульфенаты получают из стирилсульфоксидов как показано на схеме 4. Схема 4 Обычно, силилсульфенаты, где R1, R2 и R7 определены выше и R3 - термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил, получают реакцией соединения формулы II с силилирующим реагентом. Подходящие растворители для этой реакции включают бензол, толуол, ксилол и высококипящие галогенированные углеводородные растворители, имеющие точку кипения больше чем или равную 80 С, такие как 1,1,2 трихлорэтан. Подходящие силилирующие реагенты включают бис(триалкилсилил) мочевины,такие как 1,3-бис(триметилсилил) мочевина,1,3-бис(триэтилсилил)мочевина, 1,3-бис(диметилизопропилсилил)мочевина, 1,3-бис(триизопропилсилил)мочевина, 1,3-бис(диэтилизопропилсилил)мочевина, и 1,3-бис (трет-бутилдиметилсилил)мочевина; бис(триарилсилил) мочевины, такие как 1,3-бис(трифенилсилил)мочевина; бис(диалкиларилсилил)мочевины, такие как 1,3 бис(дифенилметилсилил)мочевина и 1,3 бис(трет-бутилдифенилсилил)мочевина; и гексаалкилдисилилазаны, такие как гексаметилдисилилазан; или комбинацию гексаалкилдисилилазана и каталитического количества триалкилсилидхлорида, такого как триметилсилилхлорид. Для лучших результатов, после завершения добавления, конечная концентрация соединения формулы II составляет примерно от 0,001 М до примерно 0,5 М. Предпочтительно используют небольшой избыток, такой как 10 процентов, силилирующего реагента. Эта реакция может быть проведена при от примерно 80 С до примерно 140 С в течение от примерно десяти минут до примерно двух часов. Поскольку Zизомер реагирует значительно быстрее соответствующего Е-изомера, то использование толькоZ-изомера в качестве исходного соединения требует меньше времени для полного превращения. Новые сульфенамиды получают из силилсульфенатов как показано на схеме 5. Обычно, силилсульфенат, где R1, R2 и R7 определены выше, получают из стирилсульфоксида и, предпочтительно без выделения или очистки, вводят в реакцию с амином формулыHNR5R6, где R5 и R6 определены выше. Обычно,получают силилсульфенат, реакционную смесь охлаждают до от примерно 0 С до примерно 50 С и обрабатывают амином. Предпочтительно используют один-два эквивалента амина. Превращение из силилового эфира в сульфенамид обычно завершается через примерно два-восемь часов. Полученные сульфенамиды могут быть очищены стандартными для органической химии методами, такими как хроматография на силикагеле. Новые дисульфиды получают из силилсульфенатов как показано на схеме 6. Схема 6 Обычно, силилсульфенат, где R1, R2 и R7 определены выше, получают из стирилсульфоксида и, предпочтительно без выделения и очистки, вводят в реакцию с меркаптаном формулыHSR8, где R8 определен выше, в присутствии аминного основания. Предпочтительно получают силилсульфенат, реакционному раствору дают охладиться до комнатной температуры и реакционную смесь обрабатывают раствором,содержащим меркаптан и аминное основание. Растворитель для получения раствора меркаптан/амин является тем же, что и растворитель для силилсульфенатсодержащей смеси. Типичные основания амина включают триэтиламин,диизопропилэтиламин, пиридин, морфолин, Nметилморфолин и коллидин. Превращение силилсульфената обычно завершается через примерно один-восемь часов. Образующиеся дисульфиды могут быть очищены стандартными для органической химии методами, такими как хроматография на силикагеле. Промежуточные силилсульфенаты, сульфенамиды и дисульфиды полезны для синтеза 2 арилбензо[b]тиофенов как показано на схеме 7. Схема 7 17 Обычно, силилсульфенаты, сульфенамиды или дисульфиды обрабатывают кислотными катализаторами с получением соединений формулы I. Подходящие кислотные катализаторы для этой реакции включают кислоты Льюиса или кислоты Бренстеда. Типичными кислотами Льюиса являются хлорид цинка, иодид цинка, хлорид алюминия и бромид алюминия. Типичные кислоты Бренстеда включают неорганические кислоты, такие как серная и фосфорная кислота, карбоновые кислоты, такие как уксусная и трифторуксусная кислоты; сульфокислоты, такие как метансульфоновая, бензолсульфоновая, 1-нафталинсульфоновая, 1-бутансульфоновая, этансульфоновая, 4 этилбензолсульфоновая, 1-гексансульфоновая,1,5-нафталиндисульфоновая, 1-октансульфоновая, камфорсульфоновая, трифторметансульфоновая и п-толуолсульфоновая кислоты; и полимерные арилсульфокислоты, такие как НафионR,АмберлистR или АмберлитR. Более предпочтительными кислотными катализаторами являются сульфоновые кислоты, такие как метансульфоновая кислота, бензолсульфоновая кислота,камфорсульфоновая кислота и птолуолсульфоновая кислота. Наиболее предпочтительным кислотным катализатором является п-толуолсульфоновая кислота. Обычно, раствор кислотного катализатора в органическом растворителе, таком как толуол, бензол, ксилол или высококипящем галогенированном углеводородном растворителе, таком как 1,1,2 трихлорэтан, нагревают от примерно 80 С до примерно 140 С и обрабатывают раствором силилсульфената, сульфенамида или дисульфида в том же самом растворителе. Используют избыточное количество кислотного катализатора,предпочтительно три эквивалента кислоты. Для лучших результатов конечная концентрация исходного соединения составляет от примерно 0,01 М до примерно 0,2 М, предпочтительно 0,05 М. Кроме того, самые лучшие выходы получают, если силилсульфенат медленно добавляют к нагретому раствору кислоты в течение от примерно 15 мин до примерно трех часов. Для получения лучших результатов остаточную воду удаляют из реакционного раствора, используя насадку Дина-Старка и экстрактор Сокслета. Стирилсульфоксиды также используют для получения бензотиофенилстирилсульфида как показано на схеме 8. Схема 8 18 где R1 и R2 определены выше и R3 представляет термически или кислотонеустойчивый С 2-С 10 алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил,добавляют к раствору кислотного катализатора при температуре от примерно 100 С до примерно 140 С, причем кислотный катализатор определен выше. Концентрация кислотного катализатора зависит от конечной концентрации соединения формулы II и скорости добавления соединения формулы II. Если стирилсульфоксид присутствует в конечной концентрации примерно 0,2 М и добавляется в течение шести часов,то концентрация кислоты составляет примерно 0,002 М. Если стирилсульфоксид присутствует в конечной концентрации примерно 0,05 М и добавляется за 30 мин, то концентрация кислоты составляет примерно 0,025 М. Через примерно один-два часа в реакции присутствуют значительные количества соединений формулы VI. Длительное время реакции приводит к получению соединений формулы I. Эти соединения формулы VI могут быть затем превращены в соединения формулы I обработкой дополнительным количеством кислоты, таким как от примерно 0,5 до примерно три эквивалента и нагреванием до примерно 100 С 140 С. Концентрация соединения формулы VI находится в интервале от примерно 0,01 М до примерно 0,5 М. Подходящие растворители как для образования соединений формулы VI, так и для превращения их в соединения формулы 1 включают толуол, ксилол и 1,2-дихлорэтан. Соединения формулы I полезны в качестве промежуточных соединений в синтезе ряда 3 ароил-2-арилбензо[b]тиофенов. Патенты США 4 133 814 и 4 418 068, которые включены сюда в качестве ссылки, описывают эти 3 ароил-2-арилбензо[b]тиофены и способы их получения из соединений формулы I. Улучшенный синтез группы таких 3-ароил-2 арилбензо[b]тиофенов из соединений формулы 1, в которой R1 и R2 представляет водород, С 1 С 4-алкокси или арилалкоксигруппу, показан на схеме 9. Схема 9 Соединение формулы I, в которой R1 и R2 представляют водород; С 1-С 4-алкокси- или арилалкоксигруппу, ацилируют соединением формулы XII, в которой R13 представляет хлор или гидроксигруппу, в присутствии трихлорида бора или трибромида бора; трихлорид бора предпочтителен. Реакцию можно проводить во мно 19 гих органических растворителях, таких как хлороформ, метиленхлорид, 1,2-дихлорэтан, 1,2,3 трихлорпропан,1,1,2,2-тетрахлорэтан,1,2 дихлорбензол, хлорбензол и фторбензол. Предпочтительным растворителем для этого синтеза является 1,2-дихлорэтан. Реакцию проводят при температуре от примерно -10 С до примерно 25 С, предпочтительно при 0 С. Реакция лучше всего протекает при концентрации бензотиофена формулы I от примерно 0,2 М до примерно 1,0 М. Реакция ацилирования обычно завершается через примерно 2-8 ч. Если R1 и/или R2 представляет С 1-С 4 алкокси- или арилалкоксигруппу, ацилированный бензотиофен предпочтительно превращают в соединение формулы XIII, в которой R5 и/илиR6 представляет гидроксигруппу, без выделения продукта из реакции ацилирования. Это превращение проводят добавлением дополнительного количества трихлорида бора или трибромида бора и нагреванием реакционной смеси. Предпочтительно два-пять мольных эквивалента трихлорида бора добавляют к реакционной смеси, наиболее предпочтительно три мольных эквивалента. Реакцию проводят при температуре от примерно 25 С до примерно 40 С, предпочтительно при 35 С. Реакция обычно завершается через примерно 4-48 ч. Реакцию ацилирования или реакцию ацилирования/деалкилирования останавливают спиртом или смесью спиртов. Подходящие спирты для прекращения реакции включают метанол, этанол и изопропанол. Предпочтительно реакционную смесь ацилирования/деалкилирования добавляют к смеси этанола (этанол 3 А) и метанола 95:5. Этанол 3 А может быть при комнатной температуре или нагрет до температуры кипения. Когда остановку реакции выполняют таким образом, соединение формулы XIII обычно кристаллизуется из полученной спиртовой смеси. Обычно используют 1,25-3,75 мл спирта на миллимоль бензотиофенового исходного материала. Следующие ниже примеры иллюстрируют настоящее изобретение. Примеры не ограничивают объем настоящего изобретения и не должны быть так истолкованы. Все опыты проводились при положительном давлении сухого азота. Все растворители и реагенты использовались в том виде как были получены. Процентный состав, как правило, рассчитан на весовой (w/w) основе; за исключением растворителей для высокоэффективной жидкостной хроматографии(ВЭЖХ), которые рассчитаны на объемной основе. Спектры протонного ядерного магнитного резонанса (1 Н ЯМР) и спектры 13 С ядерного магнитного резонанса (13 С ЯМР) получают на спектрометре Bruker AC-300 FINMR при 300,135 МГц или при 75,469 МГц для протона и углерода, соответственно, или на спектрометреGE QE-300 при 300,15 МГц. Флэшхроматографию на силикагеле выполняли как описано, Still et аl., используя Silica Gel 60 (230400 меш, E. Merk). Still et al., J. Org. Chem., 43,2923 (1978). Элементные анализы на углерод,водород и азот выполняли на элементном анализаторе 440 Control Equipment Corporation. Элементные анализы на серу проводили на колориметрическом элементном анализатореBrinkman. Точки плавления определяли в открытых стеклянных капиллярах на приборе для определения точки плавления Mel-Temp 11 или на автоматическом приборе Mettler FP62 и брали без поправки. Масс-спектры с полевой десорбцией (МСПД) получали на массспектрометрах Varian Instruments VG 70-SЕ илиVG ZAB-3F. Масс-спектры высокого разрешения бомбардировкой свободными атомами(МСБСА) получали на масс-спектрометре Varian Instruments VG ZAB-2SE. Выходы in situ 6-метокси-2-(4-метоксифенил)бензо[b]тиофена определяли высокоэффективной жидкостной хроматографией (ВЭЖХ) по сравнению с аутентичным образцом этого соединения, полученного известными способами. См. патент США 4 133 814. Обычно образцы реакционной смеси разбавляли ацетонитрилом и разбавленные образцы анализировали ВЭЖХ с использованием колонки ZorbaxR RX-C8 (4,6 мм х 25 см) и УФ детектирования (280 нм). Для этих анализов использовали следующую линейно-градиентную систему растворителя. Градиентная система растворителя Время (мин) А (%) В (%) 0 50 50 2 50 50 20 20 80 35 20 80 37 50 50 45 50 50 А: 0,01 М водный раствор фосфата натрия(рН 2,0); В: ацетонитрил. Количество (процентное содержание) гидрохлорида 6-гидрокси-2-(4-гидроксифенил)-3[4-(2-пиперидиноэтокси)бензоил]-бензо[b]тиофена в кристаллическом материале (содержание) определяли следующим методом. Образец кристаллического твердого вещества (5 мг) отвешивали в 100 мл мерную колбу и растворяли в смеси 75 мМ калийфосфатного буфера (рН 2,0) и ацетонитрила 70/30 (об/об.). Аликвоту раствора (10 мл) анализировапи ВЭЖХ с использованием колонки ZorbaxRRX-C8 (25 см х 4,6 мм (внут.диаметр), частица 5 м) и УФ детектирования (280 нм). Использовали следующую градиентную систему растворителя:(содержание) Время (мин) А (%) В (%) 0 70 30 12 70 30 14 25 75 16 70 30 25 70 30 А: буфер 75 мМ КН 2 РО 4 (рН 2,0); В: ацетонитрил. Процентное содержание гидрохлорида 6 гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофена в образце рассчитывали с использованием площади пика,наклона (m) и отсекаемого отрезка (b) калибровочной кривой по следующему уравнению: площадь пикаb объем образца (мл) Количество (процентное) растворителя,такого как 1,2-дихлорэтан, присутствующего в кристаллическом материале определяли газовой хроматографией. Образец кристаллического твердого вещества (50 мг) отвешивали в мерную колбу объемом 10 мл и растворяли в растворе 2 бутанола (0,025 мг/мл) в диметилсульфоксиде. Образец этого раствора анализировали на газовом хроматографе с использованием колонкиDB Wax (30 мм х 0,53 мм (внутр. диаметр),(частица 1 м), скорости потока через колонку 10 мл/мин и пламенно-ионизационного детектирования. Колонку нагревали от 35 до 230 С за 12 мин. Количество растворителя определяли сравнением с внутренним стандартом (2 бутанол). Пример 1. Е-трет-Бутил(4,4'-диметоксистильбенил)сульфоксид. А. Получение Е-трет-бутил(4,4'-диметоксистильбенил)сульфида. Раствор дезоксианизоина (12,82 г) в тетрагидрофуране (100 мл) обрабатывали хлоридом,титана (IV) (10,43 г). В течение добавления хлорида титана (IV) по каплям реакционную смесь охлаждали для поддержания температуры ниже 35 С. После завершения добавления полученную смесь перемешивали при 30 С. Через 30 мин эту смесь обрабатывали раствором 2-метил-2-пропантиола (6,76 мл) и триэтиламина(16,70 мл) в тетрагидрофуране (15 мл). Полученную смесь перемешивали при 50 С. Через два часа смесь добавляли к 10% раствору карбоната натрия (500 мл). Полученную смесь экстрагировали метиленхлоридом. Объединенные метиленхлоридные экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 17,2 г масла, которое кристаллизуется после охлаждения до комнатной температуры. Кристаллический продукт 22 перекристаллизовывали из горячего этанола с получением 12,3 г целевого соединения. Температура плавления 71-73 С. Рассчитано для С 20H24O2S; C 73,13; H 7,36;S 9,76. Найдено: С 73,37; Н 7,51; S 9,87. В. Получение Е-трет-бутил(4,4'-диметкосистильбенил)сульфоксида. Кристаллическое соединение, полученное по примеру 1 А, растворяли в толуоле (150 мл) и полученный раствор охлаждали до примерно-20 С. Холодный раствор обрабатывали перуксусной кислотой (32 вес.% в разбавленной уксусной кислоте, 1,24 г) в течение 10 мин. Полученную смесь экстрагировали насыщенным раствором сульфита натрия и насыщенным раствором хлорида натрия. Органическую фазу концентрировали в вакууме. Остаток перекристаллизовывали из смеси этилацетат/гептан с получением 14,11 г целевого соединения. Температура плавления 104 С (разл.). Рассчитано для C20H24O3S: C 69,74; H 7,02;(9,92 мл), одной порцией. Полученную смесь перемешивали при комнатной температуре. Через примерно 18 ч реакцию разбавляли водой(100 мл) и метиленхлоридом (100 мл). Органическую фазу удаляли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 14,4 г масла. 1H ЯМР (CDCl3):7,28 (д, 2 Н); 6,85 (д,2 Н); 3,77 (с, 3 Н); 3,73 (с, 2 Н); 1,36 (с, 9 Н). 13 С ЯМР (CDCl3):130, 114, 56, 35, 32. Рассчитано для C12H18OS: C 68,52; H 8,63. Найдено: C 68,80; H 8,67. В. Получение Z-трет-бутил(4,4'-диметкосистильбенил)сульфида. Раствор соединения, полученного по примеру 2 А (2,51 г) в тетрагидрофуране (50 мл) охлаждали до примерно -20 С. Холодный раствор обрабатывали раствором н-бутиллития в гексане (1,6 М, 7,47 мл) в течение 10 мин. Полученному раствору давали нагреться до примерно 0 С в течение 35 мин. Холодный раствор обрабатывали п-анисальдегидом (1,46 мл). Через 15 мин реакционный раствор обрабатывали метансульфонилхлоридом (0,95 мл). Полученной смеси позволяли нагреться до комнатной температуры. Через 45 мин реакционную смесь обрабатывали раствором трет-бутоксида калия в тетрагидрофуране (1,0 М, 12,0 мл). Еще через 45 мин реакцию останавливали добавлением 1 Н соляной кислоты (12 мл). Органическую фазу 23 отделяли, сушили над сульфатом магния,фильтровали и концентрировали с получением масла (4,4 г). 1H ЯМР (CDCl3):7,95 (д, Н); 7,05 (с, Н); 6,9 (д,Н); 6,8 (дд, 2 Н); 3,75 (с, 3 Н); 0,95 (с, 9 Н). 13 С ЯМР (CDCl3):153, 139, 137, 114, 56,32. С. Получение Z-трет-бутил(4,4'-диметоксистильбенил)сульфоксида. Соединение примера 2 В превращали в целевое соединение по методике, в основном описанной в примере 1 В. 1 Н ЯМР (CDCl3):7,61 (д, Н); 7,56 (д, Н); 7,1 (с, Н), 6,9 (дд, 2 Н); 3,83 (с, 3 Н); 1,05 (с, 9 Н). 13(9,92 мл), одной порцией. Полученную смесь перемешивали при комнатной температуре. Через примерно 18 ч реакцию разбавляли водой(100 мл) и метиленхлоридом (100 мл). Органическую фазу удаляли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 14,4 г масла. 1H ЯМР (CDCl3):7,28 (д, 2 Н); 6,85 (д,2 Н); 3,77 (с, 3 Н); 3,73 (с, 2 Н); 1,36 (с, 9 Н). 13 С ЯМР (CDCl3):130, 114, 56, 35, 32. Рассчитано для C12H18OS: C 68,52; H 8,63. Найдено: C 68,80; H 8,67. В. Получение трет-бутил(4-метоксибензил) сульфоксида. Раствор соединения, полученного как описано в примере 3 А (14,4 г) в 1,2-дихлорэтане (50 мл) охлаждали до примерно 5 С и холодный раствор обрабатывали перуксусной кислотой(32 вес.% в разбавленной уксусной кислоте, 14,2 мл) в течение 30 мин. После завершения добавления перуксусной кислоты реакционную массу обрабатывали насыщенным раствором хлорида натрия и бикарбонатом натрия. Органическую фазу удаляли, сушили над сульфатом магния,фильтровали и концентрировали до желтого остатка. Остаток обрабатывали гексаном (100 мл) и полученную смесь перемешивали при комнатной температуре. Через примерно 18 ч смесь фильтровали и твердые вещества промывали гексаном (100 мл). Сушка твердого материала в вакууме дает 14,07 г целевого соединения. Температура плавления 124-126 С. 1 24 Рассчитано для C12H18O2S: С 63,68; Н 8,02. Найдено: С 63,72; Н 7,93. С. Получение Е- и Z-трет-бутил(4,4'-диметоксистильбенил)сульфоксида. Раствор соединения, полученного как описано в примере 3 В, (10,0 г) в тетрагидрофуране(140 мл) охлаждали до примерно -30 С - -25 С(баня сухой лед/ацетон). Холодный раствор обрабатывали н-бутиллитием в циклогексане (1,6 М, 27,65 мл) в течение 25 мин. После перемешивания в течение 35 мин реакционную смесь обрабатывали п-анизальдегидом (5,4 мл). Баню сухой лед/ацетон удаляли и реакционной массе позволяли нагреваться до примерно 20 С. Смесь обрабатывали метансульфонилхлоридом (3,5 мл). Температура реакции поднималась от примерно 20 до примерно 35 С после добавления метансульфонилхлорида. Смесь охлаждали до примерно 25 С и обрабатывали раствором третбутоксида калия в тетрагидрофуране (1 М, 50,9 мл). После перемешивания в течение 35 мин реакцию обрабатывали 1 Н соляной кислотой(51,0 мл). Фазы разделяли и органический слой сушили над сульфатом магния, фильтровали и концентрировали с получением масла (16,67 г). Этот материал использовали в следующей стадии без дополнительной очистки. Спектры углеродного и протонного ЯМР подобны спектрам соединения, полученного в примерах 1 и 2. Пример 4. Е- и Z-Триметилсилил-4,4'диметоксистильбенилсульфенат. Смесь соединения, полученного как описано в примере 1, (350 мг) и 1,3-бис(триметилсилил)мочевину (116 мг) в толуоле (11 мл) кипятили с обратным холодильником. Через 1,5 ч реакционной смеси позволяли охладиться до комнатной температуры, фильтровали и фильтрат концентрировали в вакууме с получением целевых соединений в виде смеси региоизомеров E/Z=7:1. МСПД: m/z=361 (М+1). Е-изомер: 1(с, ЗН); 3,26 (с, 3 Н); -0,05 (с, 9 Н). Пример 5. Е- и Z-Триметилсилил-4,4'-диметоксистильбенилсульфенат. Смесь соединения, полученного как описано в примере 2 и 1,3-бис(триметилсилил)мочевины в толуоле кипятили с обратным холодильником. Через 10 мин смеси позволяли охладиться, фильтровали и концентрировали в вакууме с получением целевых соединений в виде смеси региоизомеров E/Z=7:1. Е-изомер: 13 С ЯМР (d6-бензол, 8 С):160,49, 158,53,141,54, 131,97, 129,91, 129,65, 125,59, 116,41,114,68, 113,98, 54,56, -0,09. 25 Пример 6. Е- и Z-N,N-Диметил-4,4'-диметоксистильбенилсульфенамид. Смесь соединения, полученного как описано в примере 1.(578 мг) в толуoлe (54 мл) кипятили с обратным холодильником. Через 1,5 ч реакционной смеси позволяли охладиться до комнатной температуры и обрабатывали диметиламином (2,80 мл, 2,0 М раствор в тетрагидрофуране). Через два часа реакционный раствор упаривали досуха с получением целевых соединений в виде смеси региоизомеров E/Z=7:1. Эту смесь очищали флэшхроматографией на силикагеле, элюент-смесь этилацетат/гексан 9:1, с получением 1,06 г целевых соединений в виде смеси региоизомеров(с, 3 Н); 2,41 (с, 6 Н). 13 С ЯМР (d6-бензол):159,89, 159,30,139,76, 136,46, 131,94, 131,82, 130,22, 130,20,113,83, 113,76, 54,81,54,73, 48,61. Пример 7. Е- и Z-N,N-Диметил-4,4'-диметоксистильбенилсульфенамид. Смесь соединения, полученного как описано в примере 1 (1,74 г) и 1,3 бис(триметилсилил)мочевину (578 мг) в толуоле(54 мл) кипятили с обратным холодильником. Через 1,5 ч реакционной смеси позволяли охладиться до комнатной температуры и обрабатывали бензиламином (0,575 мл). Через два часа реакционный раствор упаривали досуха с получением целевых соединений в виде смеси региоизомеров E/Z=7:1. Смесь очищали флэшхроматографией на силикагеле, элюент-смесь этилацетат/гексан 7:1, с получением 1,06 г целевых соединений в виде смеси региоизомеров Е/Z=6:1. Рассчитано для C23H23NO2S: С 73,18; Н 6,14; N 3,71. Найдено: С 73,16; Н 6,18; N 3,50. Е-изомер: 1(15 мл) и кипятили с обратным холодильником,удаляя воду с применением насадки ДинаСтарка. Этот кипящий раствор обрабатывали раствором региоизомерных соединений, полученных как описано в примере 4, (523 мг) в толуоле (15 мл) в течение 15 мин. После завершения добавления отбирали аликвоту для анализа ВЭЖХ. Этот анализ показал in situ выход целевого соединения 46,6%. Пример 9. 6-Метокси-2-(4-метоксифенил) бензо[b] тиофен. Раствор моногидрата птолуолсульфоновой кислоты (1,26 г) в толуоле(20 мл) кипятили с обратным холодильником,удаляя воду с применением насадки ДинаСтарка. Раствор региоизомерных соединений,полученных как описано в примере 6, (650 мг) в толуоле (9 мл) добавляли к кипящему раствору кислоты в течение 1,8 ч. Реакционный раствор обрабатывали этанолом (10 мл) и полученной смеси позволяли охладиться до комнатной температуры. Полученную суспензию перемешивали при комнатной температуре. Через примерно 18 ч смесь охлаждали до примерно 5 С и фильтровали с получением 290 мг целевого соединения. Температура плавления 199-200 С. 1(дд, 1 Н); 3,81 (с, 3 Н); 3,79 (с, 3 Н). Рассчитано дня С 16 Н 14O2S: С 71,09; Н 5,22. Найдено: C 71,09; H 5,27. Пример 10. Е- и Z-3-(4,4'-Диметоксистильбенилтио)-6-метокси-2-(4-метоксифенил)бензо[b]тиофен. Раствор моногидрата п-толуолсульфоновой кислоты (552 мг) в толуоле (111 мл) кипятили с обратным холодильником, удаляя воду с применением насадки Дина-Старка. Раствор соединения, полученного как описано в примере 1, (10 г) в толуоле (34 мл) добавляли к кипящему раствору кислоты в течение шести часов. Через два часа смесь охлаждали до 0 С. Через 18 ч холодную смесь фильтровали для удаления осажденного 6-метокси-2-(4-метоксифенил) бензо[b]тиофена. Фильтрат экстрагировали равным объемом насыщенного раствора бикарбо 27 ната натрия. Органическую фазу отделяли, сушили сульфатом натрия, фильтровали и концентрировали в вакууме с получением оранжевого масла. Масло разделяли на две части и каждую часть очищали флэш-хроматографией, элюент гексан/этилацетат (3,5:1). Фракции, содержащие целевые региоизомеры, концентрировали до масла. Масло обрабатывали диэтиловым эфиром для селективной кристаллизации региоизомера, элюирующегося первым (155 мг). Маточная жидкость от этих кристаллизацией обогащена региоизомером, элиюрующимся вторым. Изомер, элюирующийся первым. 1(с, 3 Н); 3,67 (с, 3 Н). МСПД: m/z=540 (m+). Пример 11. 6-Метокси-2-(4-метоксифенил) бензо[b]тиофен. Соединение (изомер, элюирующийся первым), полученный как описано в примере 10,(125 мг) добавляли к кипящему раствору моногидрата п-толуолсульфоновой кислоты (4,2 мг) в толуоле (1,5 мл). Через шесть часов добавляли к реакционной смеси метансульфоновую кислоту (7,5 мл). Через час реакционной смеси позволяли охладиться до комнатной температуры. Полученную смесь разбавляли ацетонитрилом и анализировали ВЭЖХ, которая показала in situ выход целевого соединения 71,1%. Пример 12. 1,2-Дихлорэтановый сольват гидрохлорида 6-гидрокси-2-(4-гидроксифенил)3-[4-(2-пиперидиноэтокси)бензоил]бензо[b] тиофена. А. Получение этил-4-(2-пиперидиноэтокси)бензоата. Смесь этил-4-гидроксибензоата (8,31 г),моногидрохлорида 1-(2-хлорэтил)пиперидина(10,13 г), карбоната калия (16,59 г) и метилэтилкетона (60 мл) нагревали до 80 С. Через час смесь охлаждали до примерно 55 С и обрабатывали дополнительным количеством моногидрохлорида 1-(2-хлорэтил)пиперидина (0,92 г). Полученную смесь нагревали до 80 С. Реакцию контролировали тонкослойной хроматографией(ТСХ) с использованием пластинок силикагеля и смеси этилацетат/ацетонитрил/триэтил-амин(10:6:1, по объему) в качестве элюента. Дополнительные порции моногидрохлорида 1-(2 хлорэтил)пиперидина добавляли до тех пор, 000606 28 пока не израсходовался исходный 4 гидроксибензоат. После завершения реакции реакционную смесь обрабатывали водой (60 мл) и позволяли охладиться до комнатной температуры. Водный слой выбрасывали, а органический слой концентрировали в вакууме при 40 С и 40 мм рт.ст. Полученное масло использовали на следующей стадии без дополнительной очистки. В. Получение гидрохлорида 4-(2 пиперидиноэтокси)бензойной кислоты. Раствор соединения, полученного как описано в примере 12 А, (примерно 13,87 г) в метаноле (30 мл) обрабатывали 5 Н гидроксида натрия (15 мл) и нагревали до 40 С. Через 4 1/2 ч добавляли воду (40 мл). Полученную смесь охлаждали до 5-10 С и медленно добавляли концентрированную соляную кислоту (18 мл). Целевое соединение кристаллизовалось во время подкисления. Этот кристаллический продукт собирали фильтрованием и сушили в вакууме при 40-50 С с получением целевого соединения с выходом 83%. Температура плавления 270271 С. С. Получение гидрохлорида 4-(2 пиперидиноэтокси)бензоилхлорида. Раствор соединения, полученного как в примере 12 В, (30,01 г) и диметилформамида (2 мл) в метиленхлориде (500 мл) обрабатывали оксалилхлоридом (10,5 мл) в течение 30-35 мин. После перемешивания в течение примерно 18 ч полноту протекания реакции анализировали ВЭЖХ анализом. Если присутствует исходная карбоновая кислота, то может быть добавлено дополнительное количество оксалилхлорида. После завершения реакции реакционный раствор упаривали в вакууме досуха. Остаток растворяли в метиленхлориде (200 мл) и полученный раствор упаривали досуха. Процедуру растворение/упаривание повторяли с получением целевого соединения в виде твердого вещества.[b]тиофен. Смесь соединения, полученного как описано в примере 8 или 9, (2,92 г), соединения,полученного как описано в примере 12 С, (3,45 г) и 1,2-дихлорэтана (52 мм) охлаждали до примерно 0 С. Газообразный трихлорид бора конденсировали в холодный градуированный цилиндр (2,8 мл) и добавляли к холодной смеси,описанной выше. Через восемь часов реакционную смесь обрабатывали при 0 С дополнительным количеством трихлорида бора (2,8 мл). Полученный раствор нагревали при 35 С. Через 16 ч реакция завершалась. Метанол (30 мл) обрабатывали реакционной смесью, полученной выше, в течение 20 мин, что вызывала кипение метанола. Полученную суспензию перемешивали при 25 С. Через 29 час кристаллический продукт отфильтровывали,промывали холодным метанолом (8 мл) и сушили при 40 С в вакууме с получением 5,14 г целевого соединения. Температура кипения 225 С. Степень разведения (ВЭЖХ): 86,8%. 1,2 Дихлорэтан (газовая хроматография): 6,5% Пример 13. 6-Метокси-2-(4-метоксифенил) бензо[b]тиофен. Раствор моногидрата п-толуолсульфоновой кислоты (1,05 г) в толуоле (20 мл) кипятили с обратным холодильником и воду удаляли,применяя насадку Дина-Старка. Раствор региоизомерных соединений, полученных как описано в примере 7, (780 мг) в толуоле (9 мл) добавляли к кипящему раствору кислоты в течение десяти минут. Через час реакционный раствор обрабатывали этанолом (10 мл) и полученной смеси позволяли охладиться до комнатной температуры. Полученную суспензию перемешивали при комнатной температуре. Через примерно 18 ч смесь фильтровали с получением 149 мг целевого соединения. Температура плавления 199-200 С. Рассчитано для C16H14O2S: C 71,09; H 5,22. Найдено: С 71,05; Н 5,22. Пример 14. Е- и Z-4,4'-Диметоксистильбенилэтилдисульфид. Раствор региоизомерных соединений, полученный как описано в примере 4, (1,83 г) в толуоле (54 мл) обрабатывали этантиолом(0,433 мл) и триэтиламином (0,715 мл). Через примерно 2,5 ч при комнатной температуре реакционный раствор упаривали в вакууме досуха с получением смеси региоизомеров. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексан (9:1) и получали 1,14 г целевых соединений в виде смеси региоизомеров Е/Z=5,7:1. Рассчитано для C18H20O2S2: С 65,03; Н 6,06. Найдено: С 65,32; Н 6,28. Е-изомер: 1 30 описано в примере 14, (685 мг, смесь региоизомеров 5,7:1) толуоле (9 мл) добавляли к кипящему раствору кислоты в течение 1,8 ч. Аликвоту смеси анализировали ВЭЖХ, которая показала ib situ выход целевого соединения 23,2%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR5 и R6 независимо представляет водород,С 1-С 6-алкил, арилалкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; иR8 представляет С 1-С 6-алкил, арил или арилалкил. 2. Соединение по п.1, в котором R1 представляет водород, С 1-С 4-алкокси или арилалкоксигруппу; и R2 представляет водород, С 1-С 4 алкокси или арилалкоксигруппу. 3. Соединение по п.2, в котором R представляет OSi(R4) и каждый R независимо друг от друга представляет C1-С 6-алкил, арил или арилалкил. 4. Соединение по п.3, в котором R4 представляет о-триметилсилил, о-триэтилсилил, отриизопропилсилил, о-диметилизопропилсилил,о-диэтилизопропилсилил, о-диметилгексилсилил, о-третбутилдиметилсилил, о-третбутилдифенилсилил, о-трибензилсилил, о-трифенилсилил, о-дифенилметилсилил или о-третбутилди(метоксифенил)силил. 5. Соединение по п.4, котором R4 представляет о-триметилсилил, о-триэтилсилил, одиметилизопропилсилил, о-диэтилизопропилсилил, о-третбутилдиметилсилил, о-трибензилсилил, о-трифенилсилил. 6. Соединение по п.5, в котором R1 и R2 представляют C1-С 4-алкоксигруппу. 7. Соединение по п.6, в котором R1 и R2 представляют метоксигруппу и R4 представляет о-триметилсилил. 8. Соединение по п.2, в котором R4 представляет NR5R6; и R5 и R6 независимо представляют водород, C1-C6-алкил, арилалкил или арил,или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина. 31 9. Соединение по п.8, в котором R5 и R6 независимо представляют водород, C1-C6-алкил,арилалкил или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина и пирролидина. 10. Соединение по п.9, в котором R1 и R2 представляют C1-С 4-алкоксигруппу. 11. Соединение по п.10, в котором R1 и R2 представляют метоксигруппу и R5 и R6 представляют метил. 12. Соединение по п.10, в котором R1 и R2 представляют метоксигруппу, R5 представляет водород и R6 представляет бензил. 13. Соединение по п.2, в котором R4 представляет SR8 и R8 представляет С 1-С 6-алкил,арил или арилалкил. 14. Соединение по п.13, в котором R8 представляет С 1-С 6-алкил или арилалкил. 15. Соединение по п.14, в котором R8 представляет С 1-С 6-алкил. 16. Соединение по п.15, в котором R1 и R2 представляют С 1-С 4-алкоксигруппу. 17. Соединение по п.16, в котором R1 и R2 представляют метоксигруппу и R8 представляет этил. 18. Способ получения соединения формулы IIIR6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и(1) реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV(2) необязательную реакцию силилсульфената с амином формулы HNR5R6, в которой R5 и(3) необязательную реакцию силилсульфената с меркаптаном формулы HSR8, в которойR8 определен выше, в присутствии аминного основания. 19. Способ по п.18 получения соединения формулы IVR7 представляет OSi(R)3; каждый R, независимо, представляет С 1 С 6-алкил, арил или арилалкил, который включает реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10) алкил; с силилирующим реагентом. 20. Способ по п.19, в котором R1 представляет водород, С 1-С 4-алкокси или арилалкоксигруппу; и R2 представляет водород, С 1-С 4 алкокси или арилалкоксигруппу. 21. Способ по п.20, в котором R7 представляет собой о-триметилсилил, о-триэтилсилил, отриизопропилсилил, о-диметилизопропилсилил,о-диэтилизопропилсилил, о-диметилгексилсилил, о-третбутилдиметилсилил, о-третбутилдифенилсилил, о-трибензилсилил, о-трифенилсилил,о-дифенилметилсилил или отретбутилди (метоксифенил) силил. 22. Способ по п.21, отличающийся тем, что силилирующим реагентом является бис(триалкилсилил)мочевина или комбинация гексаалкилдисилилазана и каталитического количества триалкилсилилхлорида и R представляет C1-С 6 алкил. 23. Способ по п.22, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил. 33 24. Способ по п.23, в котором R3 представляет термически или кислотонеустойчивый С 2 С 10-алкил. 25. Способ по п.24, в которой R1 и R2 представляют метоксигруппу и R3 представляет трет-бутил. 26. Способ по п.18 получения соединения формулы VR5 и R6 независимо представляют водород,С 1-С 6-алкил или арил, или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина, включающий:(1) реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV(2) реакцию силилсульфенатов с амином формулы HNR5R6, в которой R5 и R6 определены выше. 27. Способ п.26, в котором R1 представляет водород, С 1-С 4-алкокси или арилалкоксигруппу и R2 представляет водород, С 1-С 4-алкокси или арилалкоксигруппу. 28. Способ по п.27, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил. 29. Способ по п.28, в котором R3 представляет термически или кислотонеустойчивый С 2 С 10-алкил. 30. Способ по п.29, в котором R1 и R2 представляют метоксигруппу и R3 представляет трет-бутил. 31. Способ по п.30, в котором R5 и R6, независимо, представляют водород, С 1-С 6-алкил или арил. 34 32. Способ по п.31, в котором R5 и R6 представляют метил или R5 представляет водород и R6 представляет бензил. 33. Способ по п.18 получения соединения формулы XIV(1) реакцию соединения формулы IIR3 представляет термически или кислотонеустойчивый С 2-С 10-алкил, С 4-С 10-алкенил или арил(С 1-С 10)алкил; с силилирующим реагентом с получением силилсульфенатов формулы IV(2) реакцию указанных силилсульфенатов с меркаптаном формулы HSR8, где R8 определен выше, в присутствии аминного основания. 34. Способ по п.33, в котором R1 представляет водород, С 1-С 4-алкокси или арилалкоксигруппу и R2 представляет водород, С 1-С 4 алкокси или арилалкоксигруппу. 35. Способ по п.34, отличающийся тем, что основанием амина является триэтиламин, диизопропилэтиламин или пиридин. 36. Способ по п.35, отличающийся тем, что силилирующим реагентом является бис(триметилсилил)мочевина и R представляет метил. 37. Способ по п.36, в котором R3 представляет термически или кислотонеустойчивый С 2 С 10-алкил. 38. Способ по п.37, отличающийся тем, что аминным основанием является триэтиламин. 39. Способ по п.38, в котором R1 и R2 представляет метоксигруппу и R3 представляет трет-бутил. 40. Способ по п.39, в котором R8 представляет С 1-С 6-алкил. 41. Способ по п.40, в котором R8 представляет этил. 42. Способ получения соединения формулы XIIIR11 и R12 независимо представляют С 1-С 4 алкил, или R11 и R12 вместе с соседним атомом азота образуют гетероциклическое кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; и НХ является НСl или НВr; который включает:(а) циклизацию в присутствии кислотного катализатора соединения формулы IIIR5 и R6 независимо представляют водород,С 1-С 6-алкил или арил или R5 и R6 вместе с атомом азота образуют кольцо, выбранное из пиперидина, пирролидина, морфолина или гексаметилимина; иR8 представляет С 1-С 6-алкил, арил или арилалкил; с получением бензотиофенового соединения формулы I(б) ацилирование указанного бензотиофенового соединения ацилирующим реагентом формулы XII в которой R11, R12 и НХ определены ранее; и R13 представляет хлор, бром или гидроксигруппу, в присутствии ВХ'3, в котором X' представляет хлор или бром;(в) если R1 и/или R2 представляет С 1-С 4 алкокси или арилалкоксигруппу, деалкилирование одной или нескольких фенольных групп продукта ацилирования стадии (б) реакцией с дополнительным количеством ВХ'3, в которомX' определен выше; и ,необязательно,(г) выделение соединения формулы XIII.
МПК / Метки
МПК: C07F 7/08, C07C 313/00, C07D 223/08
Метки: способ, получения, винилсульфеновых, кислот, производные
Код ссылки
<a href="https://eas.patents.su/19-606-proizvodnye-vinilsulfenovyh-kislot-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные винилсульфеновых кислот и способ их получения</a>
Следующий патент: Трициклические бензазепиновые антагонисты вазопрессина.
Случайный патент: Способ удаления минерального отложения из труб и лифтовой трубы при нефтегазодобыче












