Промежуточные соединения для получения (3r,4s)-1-(4-фторфенил)-3-[(3s)-3-(4-фторфенил)-3-гидроксипропил]-4-(4-гидроксифенил)-2-азетидинона
Номер патента: 17362
Опубликовано: 30.11.2012
Авторы: Гайицек Йосеф, Зезула Йосеф, Степанкова Гана, Славикова Маркета
Формула / Реферат
1. Способ получения (4S)-3-{(2R,5S)-5-(4-фторфенил)-2-[(S)-[(4-фторфенил)амино](4-гидроксифенил)метил]-5-гидроксипентаноил}-4-фенил-1,3-оксазолидин-2-онов общей формулы II
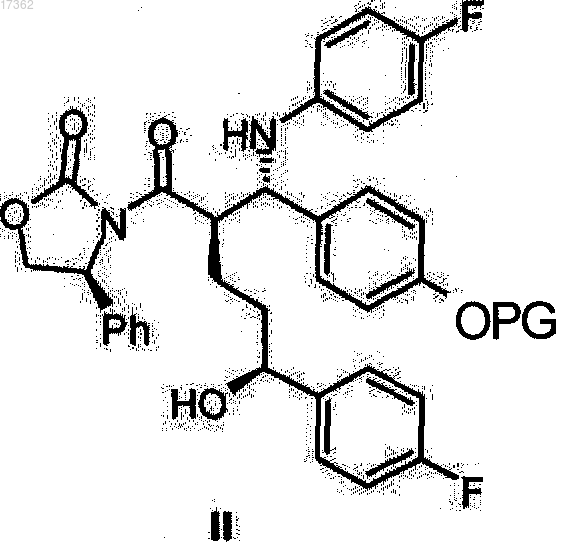
где PG представляет водород или гидроксильную защитную группу, выбранную из группы, включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил,
характеризующийся тем, что с кеталь оксазолидидов общей формулы III
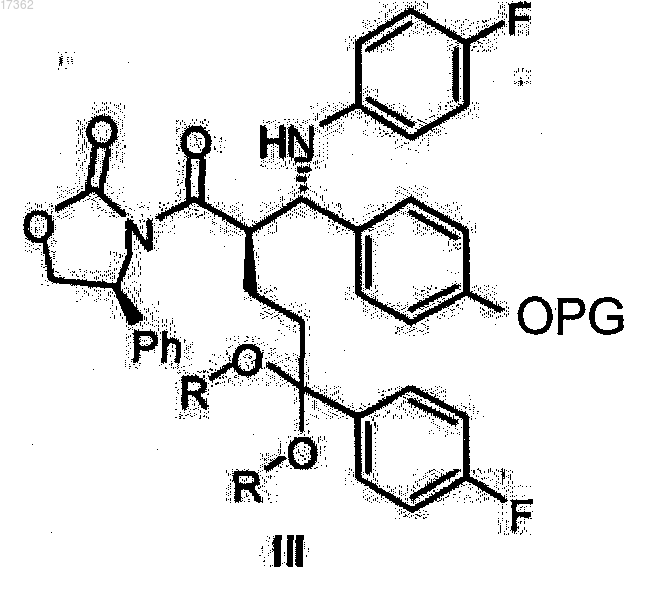
где PG имеет то же значение, что указано выше;
R представляет собой алкил с 1-4 атомами углерода, линейный или разветвленный, или
R+R вместе представляют собой дивалентный алкил, выбранный из группы, состоящей из 1,2-этилена, 1,2-пропилена, 1,2-бутилена, 1,3-пропилена или 2,2-диметил-1,3-пропилена,
снимают защиту действием кислотных реагентов в смеси воды и смешиваемого с водой растворителя в температурном диапазоне от 0 до 100°С, и полученный кетон оксазолидид общей формулы IV

где PG имеет вышеуказанное значение,
восстанавливают асимметричным реагентом в инертном органическом растворителе в диапазоне температур от -30 до 40°С, где ассиметричный реагент представляет собой боргидридный комплекс с диметилсульфидом, тетрагидрофураном (ТГФ), диметиланилином или диэтиланилином в присутствии 2-замещенного (R)-CBS-оксазаборолидина в качестве хирального лиганда, выбранного из (R)-2-метил-CBS-оксазаборолидина, т.е. (R)-тетрагидро-1-метил-3,3-дифенил-1Н,3H-пирроло[1,2-с][1,3,2]оксазаборола формулы
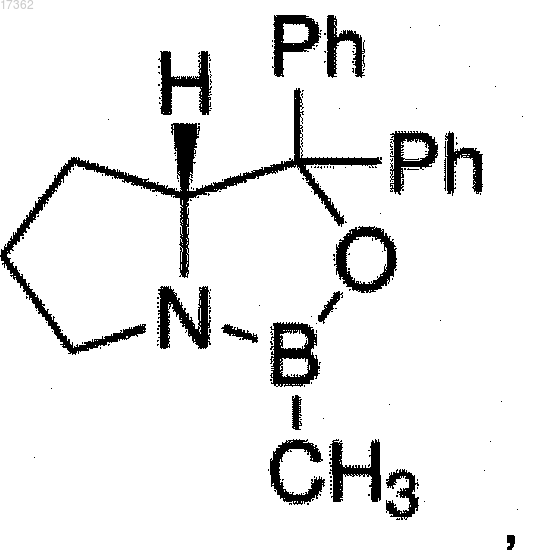
где Ph представляет собой фенил,
и (R)-2-(о-толил)-CBS-оксазаборолидина, т.е. (R)-(+)-3,3-дифенил-1-о-толил-тетрагидропирроло(1,2-с)(1,3,2) оксазаборола формулы
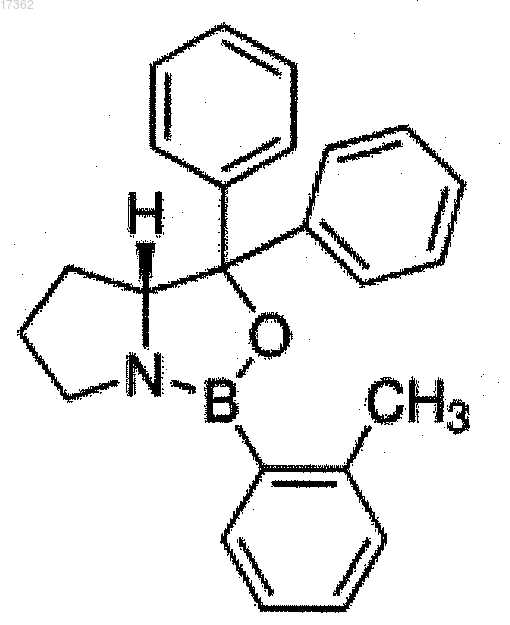
2. Способ по п.1, характеризующийся тем, что в качестве кислотного реагента для снятия защиты используют органическую кислоту, выбранную из группы, включающей п-толуолсульфоновую кислоту, метансульфоновую кислоту и уксусную кислоту, или неорганическую кислоту, выбранную из группы, включающей соляную и серную кислоты.
3. Способ по п.1 или 2, характеризующийся тем, что снятие защиты проводят в смеси воды и смешиваемого с водой растворителя, выбранного из группы, включающей тетрагидрофуран, ацетон, метилэтилкетон или изобутилметилкетон, метанол и этанол, в диапазоне температур от 20 до 100°С, предпочтительно от 50°С до температуры кипения смеси.
4. Способ по п.1, характеризующийся тем, что 2-замещенный (R)-CBS-оксазаборолидин используют в количестве от 5 до 20 мол.%.
5. Способ по любому из пп.1 и 4, характеризующийся тем, что инертный органический растворитель выбирают из группы, включающей тетрагидрофуран, 2-метилтетрагидрофуран, трет-бутилметиловый эфир, толуол или дихлорометан и их смеси.
6. Способ по любому из пп.1 и 4, характеризующийся тем, что восстановление проводят при температуре от -25 до -15°С или от 20 до 30°С.
7. Способ получения О-защищенных (4S)-3-{(2R)-5-(4-фторфенил)-2-[(S)-[(4-фторфенил)амино](4-гидроксифенил)метил]-5-оксопентаноил}-4-фенил-1,3-оксазолидин-2-онов общей формулы IV
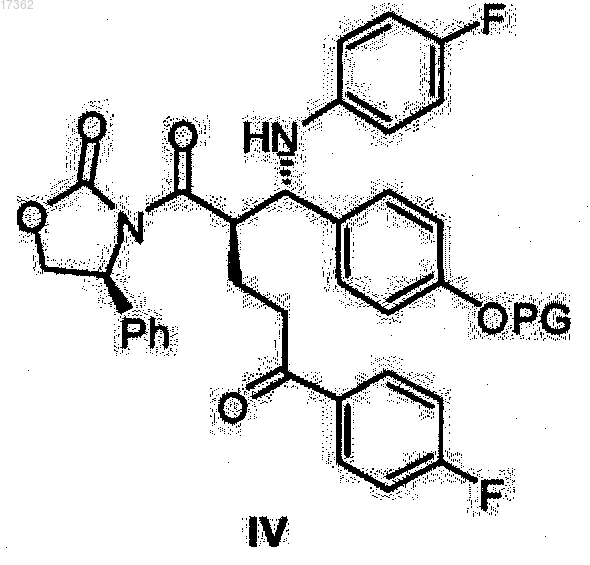
где PG представляет собой водород или гидроксильную защитную группу, выбранную из группы, включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил,
характеризующийся тем, что начинают с (S)-3-[5-(4-фторфенил)-1,5-оксопентил]-4-фенилоксазолидин-2-она формулы V

который кетализуют реакцией с одноатомным спиртом общей формулы VI
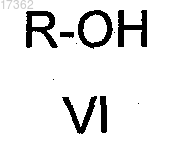
где R представляет собой алкил с 1-4 атомами углерода, линейный или разветвленный,
в присутствии катализатора в диапазоне температур от 10 до 100°С (стадия 1), полученный кеталь оксазолидид общей формулы VII
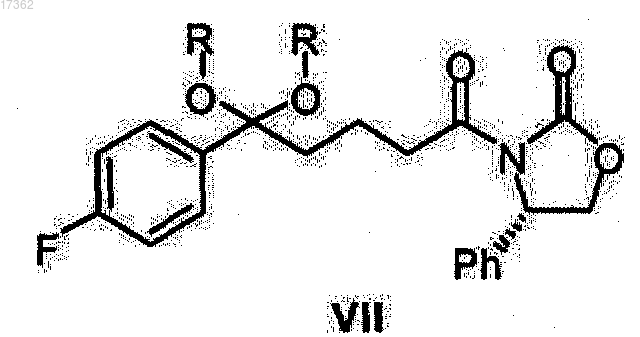
где R имеет то же значение, что указано выше,
подвергают реакции с защищенным имином общей формулы VIII
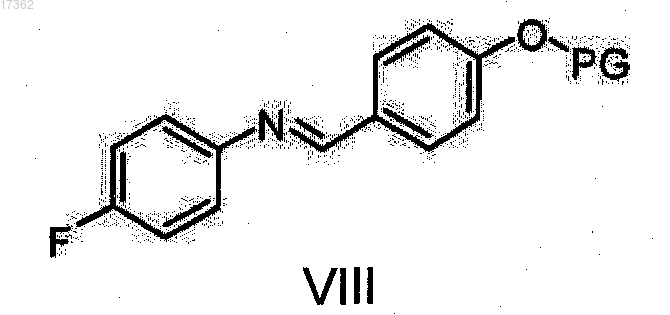
где PG имеет то же значение, что указано выше,
в присутствии кислоты Льюиса и сильного органического основания в инертном органическом растворителе в диапазоне температур от-40 до 0°С (стадия 2), и с полученного кеталь оксазолидида общей формулы III
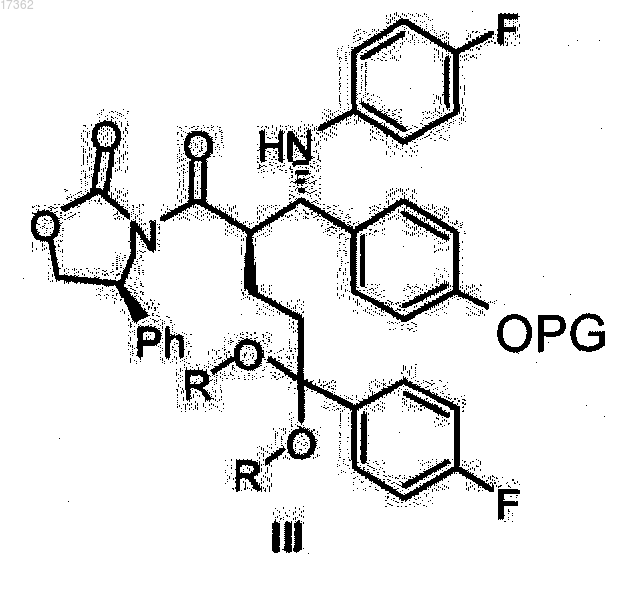
где R и PG имеют то же значение, что и выше,
снимают защиту действием кислотных реагентов в смеси воды со смешиваемым с водой растворителем в диапазоне температур от 10 до 100°С (стадия 3).
8. Способ по п.7, характеризующийся тем, что сильную неорганическую или органическую кислоту, выбранную из группы, включающей серную кислоту или п-толуолсульфоновую кислоту, в присутствии поглощающего воду агента, выбранного из группы, включающей молекулярное сито и триалкилортоформиат, используют как катализатор на стадии 1.
9. Способ по п.7 или 8, характеризующийся тем, что реакцию проводят при температуре от 50°С до температуры кипения смеси на стадии 1.
10. Способ по п.7, характеризующийся тем, что на стадии 2 титана i-пропоксида трихлорид или титана н-бутоксида трихлорид в количестве от 1 до 2 экв. используют в качестве кислоты Льюиса, а диизопропилэтиламин в количестве от 2 до 5 экв. используют в качестве сильного органического основания.
11. Способ по п.7 или 10, характеризующийся тем, что на стадии 2 кислоту Льюиса используют в количестве от 1,1 до 1,4 экв. и диизопропилэтамин в количестве от 2,1 до 4 экв.
12. Способ по любому из пп.7, 10 или 11, характеризующийся тем, что на стадии 2 инертные органические растворители выбирают из группы, включающей дихлорометан, дихлороэтан, толуол, трет-бутилметилэфир и их смеси, в диапазоне температур от -40 до 0°С, предпочтительно от -35 до -15°С.
13. Способ по любому из пп.7 и 10-12, характеризующийся тем, что имин общей формулы VIII получают in situ на стадии 2 путем реакции N-(4-гидроксибензилиден)-4-фторанилина (VII, PG=Н) с защитными PG-X агентами.
14. Способ по п.7, характеризующийся тем, что органическую кислоту, выбранную из группы, включающей п-толуолсульфоновую кислоту, метансульфоновую кислоту и уксусную кислоту, или неорганическую кислоту, выбранную из группы, включающей соляную или серную кислоты, используют как кислотный реагент на стадии 3.
15. Способ по п.7 или 14, характеризующийся тем, что снятие защиты на стадии 3 проводят в смеси воды и смешиваемого с водой растворителя, выбранного из группы, включающей тетрагидрофуран, 2-метилтетрагидрофуран, ацетон, изобутилметилкетон, метанол, этанол и их смеси, предпочтительно в диапазоне температур от 20°С до температуры кипения смеси.
16. Способ по любому из пп.7, 14 или 15, характеризующийся тем, что снятие защиты на стадии 3 проводят с использованием каталитической п-толуолсульфоновой кислоты в водном ацетоне, соляной кислоты в метаноле или этаноле или уксусной кислоты в водном тетрагидрофуране.
17. Кетон оксазолидиды общей формулы IV
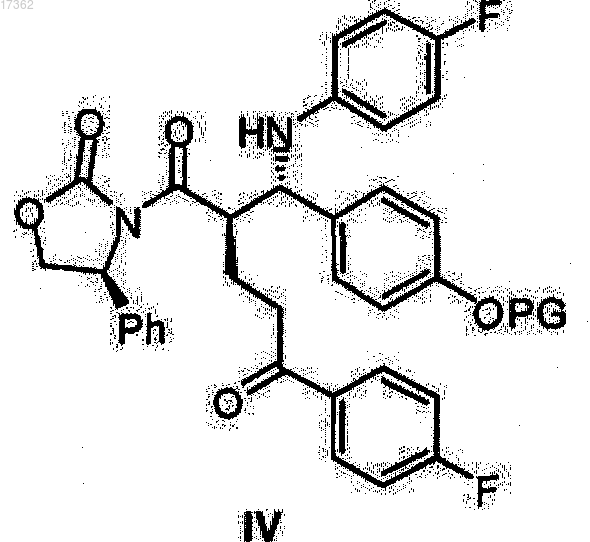
где PG представляет собой водород или гидроксильную защитную группу, выбранную из группы, включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил и тритил.
18. Применение кетон оксазолидидов общей формулы IV, как определено в п.17, для получения эзетимиба.
19. Кетон оксазолидид формулы IVa
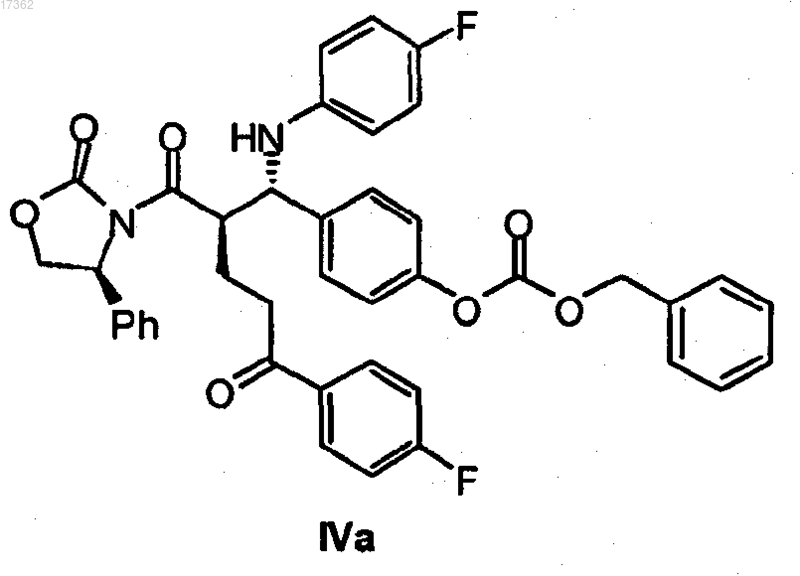
20. Кетон оксазолидид формулы IVb
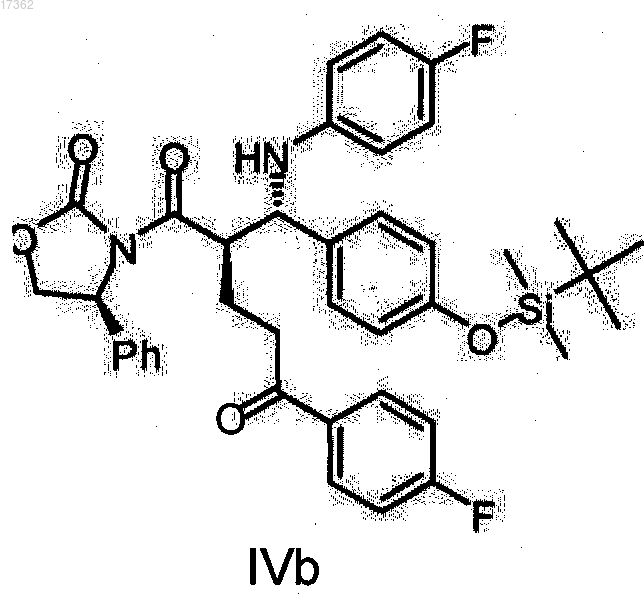
21. Кетон оксазолидид формулы IVc
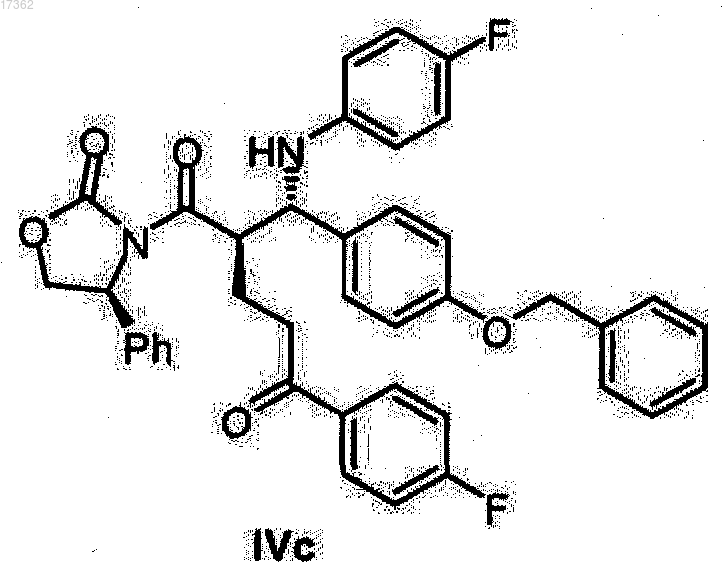
22. Кетон оксазолидид формулы IVd
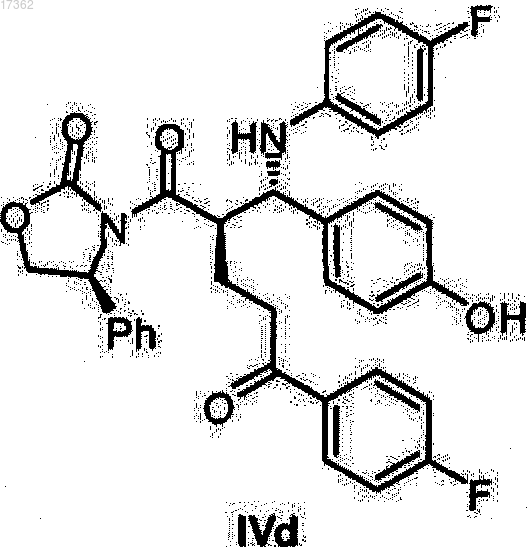
23. (S)-Спиртооксазолидидиды общей формулы II
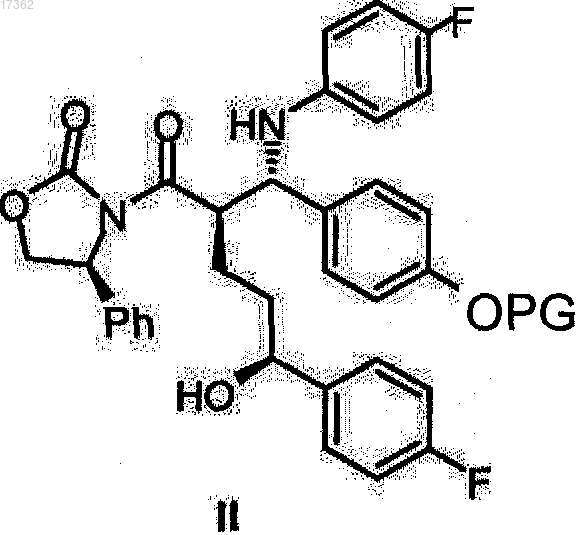
где PG представляет собой водород или защитную гидроксильную группу, выбранную из группы, включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил и тритил.
24. Применение (S)-спиртооксазолидидов общей формулы II, как определено в п.23, для получения эзетимиба.
25. Спиртооксазолидид общей формулы IIa
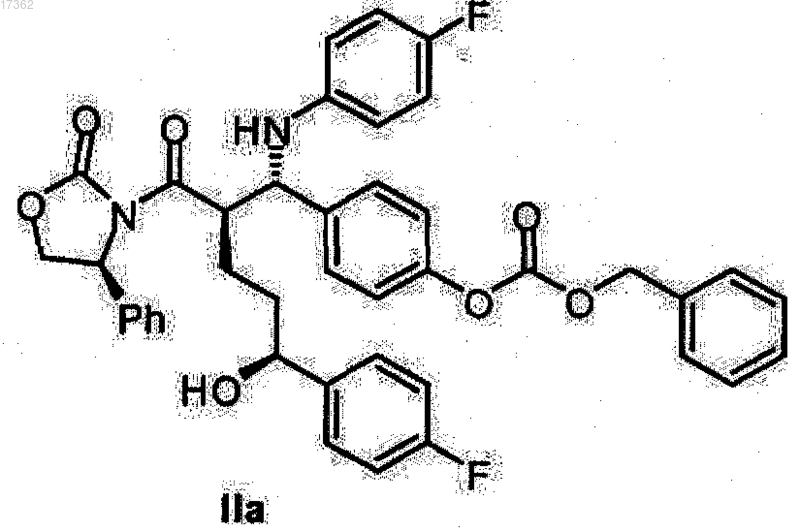
26. Спиртооксазолидид общей формулы IIb
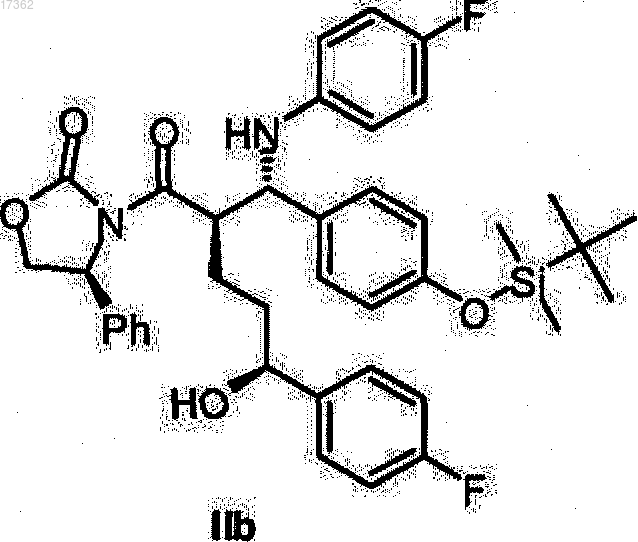
27. Спиртооксазолидид общей формулы IIc
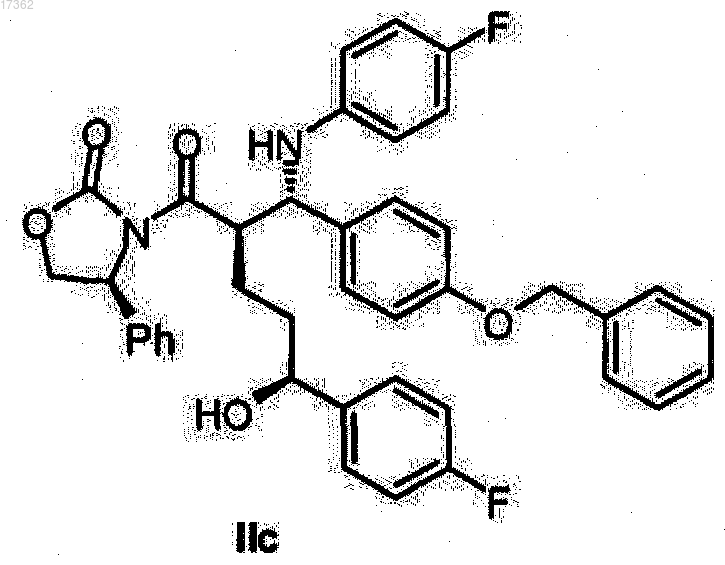
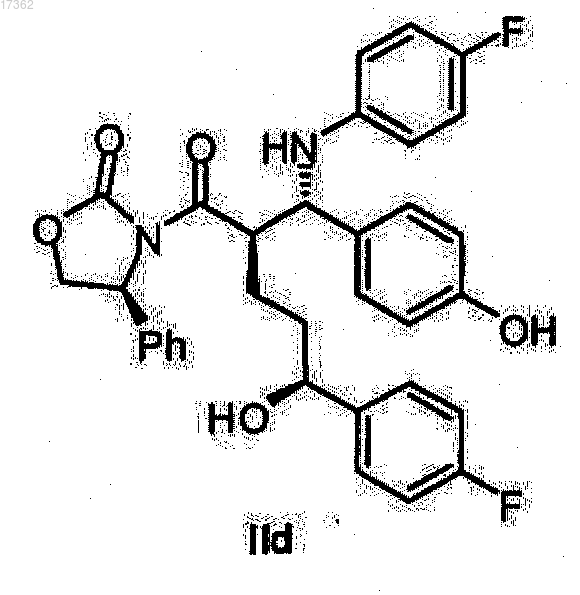
28. Спиртооксазолидид общей формулы IId
Текст
ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ (3R,4S)-1-(4-ФТОРФЕНИЛ)-3[(3S)-3-(4-ФТОРФЕНИЛ)-3-ГИДРОКСИПРОПИЛ]-4-(4-ГИДРОКСИФЕНИЛ)-2 АЗЕТИДИНОНА Способ получения (S)-спиртооксазолидидов общей формулы II, где PG представляет собой водород или гидроксильную защитную группу, такую как триметилсилил, трет-бутилдиметилсилил,бензилокарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил, в котором с кеталь оксазолидида общей формулы III, где PG имеет то же значение, что и выше, и R означает алкил с 1-4 атомами углерода, линейный или разветвленный, такой как метил, этил, изопропил или бутил, или R+R вместе представляют дивалентный алкил, или замещенный 1 или 2 алкильными группами, например 1,2-этилен, 1,2-пропилен, 1,2-бутилен, 1,3-пропилен или 2,2-диметил-1,3 пропилен, снимают защиту действием кислотных реагентов в смеси воды и смешиваемого с водой растворителя в температурном диапазоне от 0 до 100 С (стадия А), и полученный кетон оксазолидид общей формулы IV, где PG имеет то же значение, что и выше, восстанавливают асимметричными реагентами в инертном органическом растворителе в температурном диапазоне от -30 до 40 С (стадия В). 017362 Область техники Изобретение связано с новым способом синтеза О-защищенных (4S)-3-(2S,5S)-5-(4-фторфенил)-2[(S)-[(4-фторфенил)амино](4-гидроксифенил)метил]-5-гидроксипентаноил-4-фенил-1,3-оксазолидин-2 онов. Уровень техники известный под международным непатентованным названием эзетимиб, описан в патенте США 5631365 как гиполипидемический агент, уменьшающий кишечное всасывание холестерина и других стеринов. По патентам США 5739321 и 5886171 эзетимиб получают путем того, что (S)-4-гидроксибутанолид добавляют к N-(4-бензилоксибензилиден)-4-фторанилину с применением аморфного льда малой плотности при -78 С, при этом полученный диол расщепляется периодатом до альдегида, который реагирует с 4-фторацетофеноном О-триметилсилиленолом, образуя альдол. Альдол дегидратируют с образованием ненасыщенного кетона, двойную связь которого или также бензиловую защитную группу гидрогенизируют на палладиевом катализаторе. Затем кетон асимметрично восстанавливают боргидридом в присутствии хирального лиганда с образованием эзетимиба, или же его О-бензил производного, который гидрогенолизируют на палладиевом катализаторе. Недостаток этого способа состоит в том, что необходимо работать при очень низкой температуре и неоднократно применять дорогостоящие катализаторы палладиевого типа. Способ получения эзетимиба, описанный в патенте США 5856473, начинают с 5-(4-фторфенил)-4 пентеновой кислоты, которую превращают в хлорид с применением оксалилхлорида и далее, путем реакции с (S)-4-фенил-2-оксазолидиноном, в ацилоксазолидид. Последний добавляют к N-(4 бензилоксибензилиден)-4-фторанилин с применением тетрахлорида титана в присутствии диизопропилэтиламина с образованием продукта, который циклизуют с применением бистриметилсилилацетамида и каталитического тетрабутиламмоний фторида с образованием олефин азетидинона. Этот алкен превращают в кетон воздействием Pd(OAc)2 и бензохинона в присутствии хлорной кислоты. Кетон снова асимметрично восстанавливают боргидридом в присутствии хирального лиганда и проводят окончательный гидрогенолиз О-бензиловой защитной группы. Значительным недостатком этого способа является неоднократное применение дорогостоящего катализатора палладиевого типа и использование токсичного оксалилхлорида. По вышеупомянутому патенту США 5631365 эзетимиб получают таким способом, что (S)-N-(4 метоксикарбонилбутаноил)оксазолидид синтезируют из (S)-4-фенил-2-оксазолидинона и хлорида эфира глутаровой кислоты и затем это добавляют в присутствии тетрахлорида титана к вышеупомянутому N(4-бензилоксибензилидену)-4-фторанилину, и полученный продукт циклизуют воздействием бистриметилсилилацетамида и каталитического фторида тетрабутиламмония с получением эфира азетидинона. В результате щелочного гидролиза эфира получается кислота, которая превращается в хлорид кислоты,который, реагируя с реактивом Гриньяра в присутствии ZnCl2 и Pd(PPh3)4, образует кетон. Последний асимметрично восстанавливают в присутствии хирального лиганда и проводят окончательный гидрогенолиз О-бензиловой защитной группы на палладиевом катализаторе. В этом случае также недостаток заключается в применении дорогостоящих катализаторов палладиевого типа и токсичного оксалилхлорида. Способ получения эзетимиба в соответствии с WO 2006/137080 схож с вышеупомянутым способом и также имеет сходные недостатки. Хлорид метилового эфира глутаровой кислоты получают действием оксалилхлорида на соответствующую кислоту и проводят реакцию с (S)-4-фенил-2-оксазолидиноном с образованием (S)-N-(4-метоксикарбонилбутаноил)оксазолидида. Последний добавляют в присутствии тетрахлорида титана к вышеупомянутому N-(4-бензилоксибензилиден)-4-фторанилину, и полученный продукт циклизуют воздействием бистриметилсилилацетамида и каталитического фторида тетрабутиламмония на эфир азетидинона. В результате щелочного гидролиза эфира получается кислота, которую с применением оксалилхлорида превращают в ацилхлорид, который, реагируя с реактивом Гриньяра в присутствии ZnCl2 и ацетата переходного металла такого, как палладий, образует кетон. Кетон асимметрично восстанавливают диборгидридомом в присутствии хирального лиганда и проводят окончательный гидрогенолиз О-бензиловой защитной группы на палладиевом катализаторе. Значительный недостаток этого способа также выражается в неоднократном применении дорогостоящих катализаторов палладиевого типа, а также в неоднократном применении токсичного оксалилхлорида. Способ получения эзетимиба в соответствии с WO 2007/072088 начинают с 4-(4-1 017362 фторбензоил)бутановой кислоты, которую сначала превращают этиленкеталь, а затем путем реакции с(S)-3-[4-[2-(4-фторфенил)-[1,3]-диоксолан-2-ил]бутаноил]-4 фенилоксазолидин-2-он. Добавление его к О-силилированному N-(4-гидроксибензилиден)-4 фторанилину действием изопропоксидтрихлорид титана образует продукт, который циклизовали с применением бистриметилсилацетамида и каталитического тетрабутиламмоний фторида в кеталь азетидинон и снимали защиту, превращая в кетоназетидинон с применением монтмориллонита К 10. Силилированный кетон, полученный этим способом, восстанавливали диборгидридом в присутствии хирального С полученного О-силилированного эзетимиба с выходом 98% была окончательно снята защита серной кислотой в изопропиловом спирте. Способ получения в соответствии с WO 2007/119106 включает не только вышеупомянутый кеталь,(S)-3-[4-[2-(4-фторфенил)-[1,3]-диоксолан-2-ил]бутанол]-4-фенил оксазолидин-2-он, но также его аналог,полученный из 1,3-пропандиола. Их добавление к О-бензилированному или триметилсилилированномуN-(4-гидроксибензилиден)-4-фторанилину действием изопропоксида трихлорида титана дает продукты,которые циклизовали в кеталь азетидиноны с применением бистриметилсилилацетамида и каталитического тетрабутиламмоний фторида и затем снимали защиту с применением п-толуол сульфоновой кислоты в ацетоне, превращая в кетоназетидиноны. Бензилоксикетон, полученный этим способом, восстанавливали боргидридом в присутствии хирального (R)-2-метил-CBS-оксазаборолидина и далее с него снимали защиту гидрогенизацией на палладиевом катализаторе. Другой способ получения эзетимиба был с применением того же CBS восстановления гидроксикетона. Сходный способ синтеза эзетимиба из 5- и 6-членных кеталей и защищенных иминов также описан в заявке на патентWO 2007/120824. Общая проблема этих трех способов - это хемоселективность и диастереоселективность CBS восстановления кетонов боргидридом и последующая трудоемкая очистка образующегося эзетимиба. Раскрытие изобретения Изобретение касается способа получения (S)-спиртооксазолидидов общей формулы II где PG представляет водород или гидроксильную защитную группу, такую как триметилсилил,трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил,сущностью которого является то, что с кеталь оксазолидид общей формулы IIIR+R вместе представляют двухвалентный алкил, который необязательно может быть замещен одной или двумя алкильными группами, например 1,2-этиленом, 1,2-пропиленом, 1,2-бутиленом, 1,3 пропиленом или 2,2-диметил-1,3-пропиленом,снимают защиту путем обработки кислотными реагентами в смеси воды и смешиваемого с водой растворителя при температуре в диапазоне от 0 до 100 С (стадия А), а полученный кетон оксазолидид общей формулы IV где PG имеет то же значение, что указано выше,восстанавливают асимметричными реагентами в инертном органическом растворителе при температуре в диапазоне от-30 до 40 С (стадия Б). Авторы изобретения обнаружили, что О-защищенные (4S)-3-(2R)-5-(4-фторфенил)-2-[(S)-[(4 фторфенил)амино](4-гидроксифенил)метил]-5-оксопентаноил-4-фенил-1,3-оксазолидин-2-оны (здесь и далее - кетон оксазолидиды) общей формулы IV и О-защищенные (4S)-3-(2R,5S)-5-(4-фторфенил)-2[(S)-[(4-фторфенил)амино](4-гидроксифенил)метил]-5-гидроксипентаноил-4-фенил-1,3-оксазолидин-2 оны (здесь и далее - (S)-спиртооксазолидиды) общей формулы II, в которой PG имеет вышеупомянутое значение, являются новыми и представляют важные промежуточные соединения в промышленном, хорошо осуществимом производстве эзетимиба формулы I. Было доказано, что предпочтительнее эти соединения общих формул II и IV, где PG представляет триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил группы, и из них предпочтительнее группы бензилоксикарбонил, трет-бутилдиметилсилил и бензил. Авторы изобретения также обнаружили, что восстановление кетонов общей формулы IV до (S)спиртов общей формулы II с применением способа с CBS боргидридом не только высокодиастереоселективно, но также высокохемоселективно. Высокая хемоселективность обеспечивается тем, что чувствительная азетидиноновая группа не присутствует в молекулах общих формул II и IV. Этот факт вносит вклад в преимущество способа получения эзетимиба формулы I из защищенных кетон оксазолидидов общей формулы III через кетон оксазолидиды общей формулы IV и (3S)-спиртооксазолидиды общей формулы II. Стадия А. Кеталь общей формулы III, где PG и R имеют те же значения, что указаны выше, гидролизуют воздействием кислотных реагентов, таких как органические кислоты, например п-толуолсульфоновая кислота, метансульфоновая кислота, уксусная кислота, или неорганические кислоты, например соляная кислота, в смеси воды и смешиваемого с водой растворителя, такого как ТГФ, ацетон, метилэтилкетон или спирт, например метанол или этанол, при температуре в диапазоне от 20 до 100 С, предпочтительно от 50 С до температуры кипения смеси. Стадия Б. Кетоны общей формулы IV, в которой PG и R имеют то же значение, что указано выше, восстанавливают асимметричными реагентами в инертных органических растворителях в температурном диапазоне от -30 до 40 С. Как асимметричный реагент, боргидрид применяют в присутствии хирального лиганда или источника водорода в присутствии хирального катализатора. Если применяют боргидрид в присутствии хирального лиганда, источником боргидрида может быть боргидридный комплекс, например, с диметилсульфидом, ТГФ, диметиланилином или диэтиланилином, и 2-замещенный (R)-CBS-оксазаборолидин может быть применен как хиральный лиганд, такой как (R)-2-метил-CBS-оксазаборолидин или (R)-2-(о-толил)-CBS-оксазаборолидин в количестве от 1 до 100 мол.%, предпочтительнее от 5 до 25 мол.%. Восстановление проводят в присутствии каталитического количества протонной кислоты, или кислоты Льюиса, такой как метансульфоновая кислота, птолуолсульфоновая кислота,трифторуксусная кислота,бортрифторид эфират или пхлордиизопинокамфенил боргидрид. Подходящие инертные растворители представляют собой, например, тетрагидрофуран, 2 метилтетрагидрофуран, трет-бутилметилэфир, толуол или дихлорометан или их смеси. Восстановление предпочтительно проводят при температурах от -25 до -15 С или от 20 до 30 С. Если применяют асимметричный реагент, состоящий из источника водорода в присутствии хирального катализатора, это случай асимметричного гомогенного восстановления. В качестве источника водорода может применяться как сам водород, так и его источник, такой как муравьиная кислота или ее соли,например формиат триэтиламмония или изопропиловый спирт. В качестве хирального катализатора применяют комплекс переходного металла, например железа, родия и рутения и их комбинаций, в присутствии хирального лиганда, или комплекса вышеупомянутых переходных металлов с хиральным лигандом, встроенным в молекулу, предпочтительнее, например, (R)-4-изопропил-2-[(R)-2(дифенилфосфино)ферроцен-1-ил]оксазолин трифенилфосфино рутения(II) хлорид. Выгоднее получать хиральный катализатор in situ. Данное изобретение также включает новый способ синтеза О-защищенных (4S)-3-(2R)-5-(4 фторфенил)-2-[(S)-[(4-фторфенил)амино](4-гидроксифенил)метил]-5-оксопентаноил-4-фенил-1,3-3 017362 оксазолидин-2-оны (здесь и далее - кетон оксазолидиды) общей формулы IV где PG представляет собой водород или гидроксильную защитную группу, такую как триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил,начинающийся с (S)-3-[5-(4-фторфенил)-1,5-оксопентил]-4-фенилоксазолидин-2-он формулы V который кетализируют реакцией с одноатомным спиртом общей формулы VI где R представляет алкил с 1-4 углеродными атомами, линейный или разветвленный, такой как метил, этил, изопропил или бутил,в присутствии катализатора в температурном диапазоне от 10 до 100 С (стадия 1), полученный в результате кеталь оксазолидид общей формулы VII где R означает то же, что указано выше,подвергают реакции с защищенным имином общей формулы VIII где PG имеет то же значение, что указано выше,в присутствии кислоты Льюиса и сильного органического основания в инертном органическом растворителе в температурном диапазоне от -40 до 0 С (стадия 2), и с полученного в результате кеталь оксазолидида общей формулы III где R и PG имеют те же значения, что и вышеупомянутые,снимают защиту воздействием кислотных реагентов в смеси воды и смешиваемого с водой растворителя в температурном диапазоне от 0 до 100 С (стадия 3). Авторы изобретения обнаружили, что кетон оксазолидиды общей формулы IV, где PG представляет водород или гидроксильную защитную группу, такую как триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил, бензгидрил или тритил, могут быть предпочтительно синтезированы способом, где используют защиту карбонила в соединении формулы V в форме диалкилацеталя общей формулы VII. Большое преимущество способа состоит в том, что с ацеталь оксазолидидов формулы III, полученных реакцией с иминами общей формулы VIII, очень легко снимается защита с получением желаемых кетонов общей формулы IV. Этот способ синтеза кетон оксазолидидов формулы IV состоит из трех стадий, которые детально описаны ниже.(S)-3-[5-(4-Фторфенил)-1,5-диоксопентил]-4-фенилоксазолидин-2-он формулы V кетализируют реакцией с R-OH спиртами общей формулы VI, где R означает алкил с 1-4 атомами углерода, линейными или разветвленными, таким как метил, этил, изопропил или бутил, в присутствии катализатора в температурном диапазоне от 10 до 100 С, предпочтительно от 50 С до температуры кипения смеси. В качестве катализатора применяют сильную минеральную или органическую кислоту, такую как серная кислота или п-толуолсульфоновая кислота, в присутствии поглощающих воду агентов, таких как молекулярные сита, предпочтительно триалкилортоформиат, такой как триметилортоформиат или триэтилортоформиат. Предпочтительнее применяют триметилортоформиат с высококипящими спиртами R-OH, и получаемый метанол отделяется ректификацией. Стадия 2.(S)-Кеталь оксазолидиды общей формулы VII, где R имеет вышеупомянутое значение, подвергают реакции с защищенными иминами общей формулы VIII, где PG представляет собой водород или гидроксильную защитную группу, такую как триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил,трет-бутоксикарбонил, бензил, бензгидрил или тритил, в присутствии кислоты Льюиса, например тетрахлорида титана или трихлорида алкоксида титана, в количестве от 1 до 2 экв., предпочтительно от 1,1 до 1,4 экв. Добавление проводят в присутствии сильного органического основания, предпочтительно диизопропилэтиламина, в количестве от 2 до 5 экв., в инертном органическом растворителе, таком как дихлорометан, дихлороэтан, толуол, трет-бутилметилэфир, ТГФ, 2-метилтетрагидрофуран, в температурном диапазоне от -40 до 0 С, предпочтительно от -35 до -15 С. Способ может быть преимущественно осуществлен однореакторным методом, таким образом, что сначала защищенный имин общей формулы VIII получают in situ реакцией имина VIII (PG=Н) с защитными агентами PG-X, в которой PG имеет вышеупомянутое значение, а X представляет собой уходящую группу, такая как хлор, и затем ацеталь оксазолидид формулы VII добавляют к нему вышеупомянутым способом. Стадия 3. Кеталь общей формулы III, где PG и R имеют то же значение, что указано выше, гидролизуют воздействием кислотных реагентов, таких как органические кислоты, например п-толуолсульфоновая кислота, метансульфоновая кислота, уксусная кислота, или неорганические кислоты, например соляная кислота, в смеси воды и смешиваемого с водой растворителя, такого как тетрагидрофуран, ацетон, метилэтилкетон, или изобутилметилкетон, или спирт, например метанол или этанол, в температурном диапазоне от 10 до 100 С, предпочтительно от 20 С до температуры кипения смеси. Следующие примеры иллюстрируют общий способ, но ни в коем случае не ограничивают его. Пример 1. Получение (S)-3-[5,5-диметокси-5-(4-фторфенил)-1-оксопентил]-4-фенилоксазолидин-2-она. К суспензии 15,0 г (42,15 ммоль) (S)-3-[4-(4-фторбензоил)-1-оксобутил]-4-фенилоксазолидин-2-она в метаноле (300 мл) добавляют триметилортоформиат (22,2 г, 0,21 моль, 5 экв.) и п-толуолсульфоновую кислоту (0,25 г). Смесь размешивают при комнатной температуре 18 ч и полученный раствор затем нагревают при температуре кипения 5 ч. После охлаждения добавляют толуол (400 мл) и 9% растворNaHCO3 (170 мл). Отделенную водную фазу экстрагируют толуолом (100 мл). Объединенные органические фазы промывают водой (150 мл) и выпаривают после сушки. Выход: 17,5 г стекловидного вещества. ВЭЖХ: чистота 95,5%. 1 Н ЯМР (250 МГц, CDCl3):7,44-7,19 (m, 7 Н), 6,99 (t, J=8,8 Гц, 2 Н), 5,33 (dd, J=8,7 Гц, J=3,6 Гц,1 Н), 4,59 (t, J=8,8 Гц, 1 Н), 4,19 (dd, J=8,9 Гц, J=3,6 Гц, 1 Н), 3,10 (с, 3 Н), 3,08 (с, 3 Н), 2,79 (t, J=7,4 Гц, 2 Н),1,93-1,82 (m, 2H), 1,36-1,20 (m, 2 Н). Получение соединения общей формулы IV (PG=Cbz). К суспензии N-(4-гидроксибензилидена)-4-фторанилина (3,73 г; 17,35 ммоль) в дихлорометане(46 мл) добавляют диизопропилэтиламин (9,5 мл, 55,5 ммоль) при перемешивании и охлаждении до 5 С и затем добавляют 50% раствор бензилхлороформиата в толуоле (6,5 мл, 19,08 ммоль; 1,1 экв.) в течение 5 мин. Полученный раствор оставляют нагреваться до 10 С в течение 1 ч, при этом ход реакции контролируют с помощью тонкослойной хроматографии. Затем раствор охлаждают до -30 С и при перемешивании добавляют раствор (S)-3-[5,5-диметокси-5-(4-фторфенил)-1-оксопентил]-4-фенилоксазолидин-2 она (5,58 г, соответствующие 13,44 ммоль) в дихлорометане (25 мл) в течение 5 мин. Смесь далее охлаждают до -33 С и после 45 мин перемешивания начинают добавлять в течение 30 мин раствор TiCl3(Oi-Pr),который предварительно получили смешиванием TiCl (1 М раствор в CH2Cl2; 13,0 мл, 13,0 ммоль) иTi(Oi-Pr)4 (1,32 мл, 4,4 ммоль) в CH2Cl2 (21 мл) при 10 С, после чего перемешивают в течение 45 мин. Полученный темный раствор перемешивают при той же температуре в течение 3 ч и затем в течение 5 мин добавляют уксусную кислоту (3,6 мл) и продолжают перемешивание при -33 С в течение 5 мин. Затем к реакционной смеси добавляют 0,46 М раствор дигидроцитрата натрия (90 мл). Реакционную смесь интенсивно перемешивают 30 мин, органическую фазу отделяют и водную фазу экстрагируют CH2Cl2(40 мл). Объединенные органические фазы промывают водой (40 мл), сушат (Na2SO4) и выпаривают в-5 017362 ротационном вакуумном испарителе. К выпаренному осадку (13,3 г) добавляют метанол (70 мл) и суспензию нагревают до точки кипения в течение 1 ч и затем выдерживают при комнатной температуре 2 ч. Выделенный продукт отфильтровывают и промывают метанолом (220 мл) и сушат при 45 С. Температура плавления 178-179 С. Выход: 5,55 г (58,6%) соединения формулы IV (PG=Cbz). ВЭЖХ: диастереоизомерная чистота 98,7%. 1 Н ЯМР (250 МГц, CDCl3):7,87 (m, 2 Н), 7,50-7,34 (m, 6 Н), 7,27-6,99 (m, 10 Н), 6,74 (t, J=8,7 Гц,2 Н), 6,37 (dd, J=9,0 Гц, J=4,4 Гц, 2 Н), 5,42 (dd, J=8,5 Гц, J=3,5 Гц, 1 Н), 5,26 (с, 2 Н), 5,03 (d, J=9,8 Гц, 1 Н),4,65 (t, J=8,6 Гц, 1 Н), 4,59 (dt, J=8,5 Гц, J=4,6 Гц, 1 Н), 4,47 (m, 1 Н), 4,18 (dd, J=8,8 Гц, J=3,5 Гц, 1 Н), 2,88(dt, J=7,3 Гц, J=1,4 Гц, 2 Н), 2,21 (m, 1 Н), 1,85 (m, 1 Н). Получение соединения формулы II (PG=Cbz). К раствору кетона общей формулы IV (PG=Cbz) (6,00 г, 8,51 ммоль) в сухом ТГФ (200 мл) добавляют 1 М раствор (R)-Me-CBS катализатора (2,12 мл, 2,12 ммоль, 25 мол.%) при комнатной температуре под аргоном. Реакционную смесь перемешивают 10 мин и затем добавляют по каплям в течение 1 ч 1 М раствор ВН 3Me2S в CH2Cl2 (11,9 мл, 11,9 моль, 1,4 экв.). После перемешивания в течение еще 40 мин реакцию прекращают путем медленного добавления метанола (20 мл) при охлаждении до 10 С после теста методом тонкослойной хроматографии (ТСХ). Затем добавляют 1 М водный раствор HCl (50) и дихлорометан (100 мл) и после перемешивания в течение 10 мин отделяют органическую фракцию, промывают водой (50 мл) и высушивают сульфатом натрия. После фильтрования и выпаривания получают неочищенный продукт в виде твердой пены, который кипятят с метанолом (120 мл) и затем кристаллизуют в течение ночи. Осажденные кристаллы отсасывают, промывают метанолом (15 мл) и высушивают сульфатом натрия. Выход: 5,62 г, т.е. 93,4% спирта общей формулы II (R=Cbz). Температура плавления=165-167 С. ВЭЖХ: диастереоизомерная чистота 98,6%. 1 Н ЯМР (250 МГц, CDCl3):7,47-7,35 (m, 5H), 7,27-7,03 (m, 11H), 6,99 (t, J=8,7 Гц, 2 Н), 6,73 (t, J=8,7 Гц, 2 Н), 6,34 (m, 2H), 5,39 (dd, J=8,5 Гц, J=3,3 Гц, 1 Н), 5,26 (с, 2 Н), 4,97 (d, J=10,1 Гц, 1 Н), 4,65 (t, J=8,7 Гц, 1 Н), 4,60-4,49 (m, 2H), 4,37 (dd, J=10,1 Гц, J=8,4 Гц, 1 Н), 4,18 (dd, J=8,8 Гц, J=3,4 Гц, 1 Н), 1,86 (d,J=3,4 Гц, 1 Н), 1,85-1,41 (m, 4 Н). 1 Н ЯМР (250 МГц, CD3SOCD3):7,50-7,36 (m, 7 Н), 7,30 (m, 2 Н), 7,25-7,07 (m, 7 Н), 7,06 (t, J=8,7 Гц,2 Н), 6,79 (t, J=8,8 Гц, 2 Н), 6,55 (dd, J=9,1 Гц, J=4,5 Гц, 2 Н), 6,10 (d, J=9,7 Гц, 1 Н), 5,55 (dd, J=8,5 Гц, 7=4,5 Гц, 1 Н), 5,27 (с, 2 Н), 4,75 (t, J=8,7 Гц, 1 Н), 4,53-4,27 (m, 3 Н), 4,08 (dd, J=8,7 Гц, J=4,6 Гц, 1 Н), 1,47 (m,2 Н), 1,29 (m, 2 Н). Пример 2. Получение соединения общей формулы IV (PG=Bn). Суспензию кеталя общей формулы III (R+R=СН 2 СН 2, PG=Bn) (8,5 г, 12,06 ммоль) и птолуолсульфоновой кислоты (0,5 г) в смеси ацетона (320 мл) и воды (35 мл) нагревают до кипения при перемешивании. После завершения реакции при этой температуре (ТСХ, 4 ч) реакционную смесь концентрируют приблизительно до 1/2 объема и кристаллизуют при комнатной температуре. Кристаллы отсасывают, промывают холодным ацетоном (15 мл) и сушат при 50 С. Температура плавления: 176,5178 С. Выход: 7,59 г, т.е. 95,3% кетона общей формулы IV (PG=Bn). ВЭЖХ: диастереоизомерная чистота 98,8%. 1 Н ЯМР (250 МГц, CDCl3):7,86 (m, 2H), 7,49-7,25 (m, 6H), 7,21-6,99 (m, 8 Н), 6,85 (d se str., J=8,8 Гц, 2 Н), 6,74 (t, J=8,8 Гц, 2 Н), 6,39 (dd, J=9,0 Гц, J=4,5 Гц, 2H), 5,45 (dd, J=8,5 Гц, J=3,3 Гц, 1H), 4,99 (с,2 Н), 4,65 (t, J=8,6 Гц, 1 Н), 4,55 (dt, J=8,8 Гц, J=4,5 Гц, 1 Н), 4,40 (m, 1 Н), 4,18 (dd, J=8,8 Гц, J=3,4 Гц, 1 Н),2,88 (t, J=7,3 Гц, 2 Н), 2,17 (m, 1H), 1,80 (m, 1H). Пример 3. Получение соединения формулы II (PG=Bn). 2,00 г (3,03 ммоль) соединения общей формулы IV (PG=Bn) растворяют в 100 мл сухого ТГФ в инертной атмосфере. При комнатной температуре и при размешивании в этот раствор добавляют 1 М раствор (R)-2-метил-CBS-оксазаборолидина в толуоле (0,75 мл, 0,25 экв). Смесь перемешивают в течение 10 мин и затем при комнатной температуре в течение 1 ч добавляют по каплям 1 М раствор ВН 3Me2S в дихлорометане (4,24 мл). После того как добавление закончено, реакционную смесь перемешивают еще 30 мин (ТСХ), затем осторожно разлагают метанолом (7 мл) и после перемешивания в течение 30 мин разводят раствором 1 М HCl (25 мл). Смесь экстрагируют дихлорометаном (100 мл) и объединенные органические фракции промывают водой (40 мл) и сушат безводным сульфатом натрия. Органические растворители выпаривают в вакуумном испарителе, кипятят с метанолом (80 мл) и затем кристаллизуют при комнатной температуре 3 ч. Отделенные кристаллы отсасывают, промывают метанолом (10 мл) и сушат при 50 С. Выход: 1,57 г (78,5%) спирта общей формулы II (PG=Bn).(d, J=3,5 Гц, 1H), 1,81-1,54 (m, 3 Н), 1,43 (m, 1 Н). Пример 4. Получение соединения формулы IV (PG=Cbz). Суспензию кеталя общей формулы III (R+R=СН 2 СН 2 СН 2, PG=Cbz) (3,83 г, 5,02 ммоль) и птолуолсульфоновой кислоты (0,21 г) в смеси ацетона (120 мл) и воды (22 мл) нагревают до кипения при перемешивании и поддерживают при этой температуре 3 ч (ТСХ). Реакционную смесь концентрируют в ротационном вакуумном испарителе до примерно 1/2 объема и кристаллизуют при комнатной температуре. Кристаллы отсасывают, промывают холодным ацетоном (5 мл) и сушат при 40 С. Температура плавления 178,5-179,5 С. Выход: 3,44 г, т.е. 97,2% кетона общей формулы IV (R=Cbz). ВЭЖХ: 98,2%. Пример 5. К суспензии N-(4-гидроксибензилидена)-4-фторанилина (4,30 г; 20,0 ммоль) и тритилхлорида(5,91 г, 21,2 ммоль; 1,06 экв.) в дихлорометане (65 мл) добавляют диизопропилэтиламин (10,1 мл,59,0 ммоль) при перемешивании и охлаждении до 10 С в течение 5 мин. Полученный раствор оставляют нагреваться до комнатной температуры, в то время как ход реакции контролируется ТСХ. После завершения реакции раствор охлаждают до -5 С и добавляют при перемешивании раствор (S)-3-[4-[2-(4 фторфенила)-[1.3]диоксан-2-ил]-1-оксобутил]-4-фенилоксазолидин-2-он (6,62 г, 16,0 ммоль) в дихлорометане (15 мл) в течение 5 мин. Затем смесь охлаждают до -32 С и после перемешивания в течение 10 мин начинают добавлять в течение 20 мин раствор TiCl3(Oi-Pr), который предварительно получили смешиванием TiCl4 (1 M раствор в CH2Cl2; 15,5 мл, 15,5 ммоль) и Ti(Oi-Pr)4 (1,54 г, 5,17 ммоль) в CH2Cl2(25 мл) при 10 С, после чего перемешивают в течение 30 мин. Полученный темный раствор перемешивают при той же температуре 2,5 ч, и затем добавляют уксусную кислоту (4,5 мл) в течение 5 мин и раствор перемешивают при -30 С еще 10 мин. Затем к реакционной среде добавляют 0,46 М раствор натрия дигидроцитрата (120 мл, или, другим способом, реакционную смесь выливают в этот буфер), а также метиленхлорид (50 мл). Реакционную смесь интенсивно перемешивают 20 мин, отделяют органическую фазу и водную фазу экстрагируют CH2Cl2 (50 мл). Объединенные органические фазы промывают водой(50 мл), соляным раствором (40 мл) и выпаривают в ротационном вакуумном испарителе. К остатку после выпаривания добавляют метанол (200 мл) и 10% водную соляную кислоту (4,5 мл) и смесь перемешивают при 25 С в течение ночи. Отделенный продукт отфильтровывают, промывают EtOH (210 мл) и сушат. Полученный продукт перекристаллизуют из этилацетата (120 мл), кристаллы отсасывают, промывают этилацетатом и высушивают при 45 С. Температура плавления 210-213 С. Выход: 4,69 г (51,4%) соединения формулы IV (PG=Н). ВЭЖХ: диастереоизомерная чистота 98,6%. 1 Н ЯМР (250 МГц, CD3SOCD3):7,95 (dd, J=8,6 Гц, J=5,7 Гц, 2 Н), 7,38-7,26 (m, 4 Н), 7,25-7,05 (m,5 Н), 6,80 (t, J=8,9 Гц, 2 Н), 6,68 (d, J=8,5 Гц, 2 Н), 6,56 (m, 2 Н), 6,00 (d, J=9,4 Гц, 1 Н), 5,55 (dd, J=8,6 Гц,J=4,5 Гц, 1 Н), 4,76 (t, J=8,6 Гц, 1 Н), 4,50-4,30 (m, 2 Н), 4,10 (dd, J=8,7 Гц, J=4,5 Гц, 1 Н), 2,93 (t, J=7,3 Гц,2 Н), 1,69 (m, 2H). Пример 6. Синтез соединения общей формулы II (PG=Н). К раствору кетона общей формулы IV (PG=Н) (1,00 г, 1,59 ммоль) в ТГФ (35 мл) добавляют 1 М раствор в толуоле (R)-2-метил-CBS-оксазаборолидина (0,8 мл, 0,8 ммоль; 50 мол.%). После перемешивания при комнатной температуре в течение 15 мин добавляют по каплям 1 М раствор BH3Me2S в CH2Cl2(3,2 мл, 2 мол.экв.) в течение 1 ч и раствор перемешивают при комнатной температуре еще 30 мин, при этом ход реакции контролируют ТСХ. Реакцию прекращают добавлением МеОН (5 мл) при температуре 0 С и перемешиванием при этой температуре в течение 15 мин. Затем добавляют 1 М HCl (5 мл) и воду(20 мл) и смесь перемешивают при 0 С еще 10 мин. Органическую фазу отделяют и водную фазу экстрагируют дихлорометаном (40 и 15 мл). Объединенные органические фазы промывают водой (15 мл) и выпаривают в ротационном вакуумном испарителе. Кристаллический осадок после выпаривания перекристаллизуют из этанола (10 мл). После стояния при комнатной температуре в течение 1 ч и при 10 С отделенные кристаллы отсасывают, промывают этанолом и сушат. Температура плавления 195-197 С. Выход: 0,75 г (75%) соединения II (PG=Н). ВЭЖХ: диастереоизомерная чистота 98,3%. 1 Н ЯМР (250 МГц, CD3SOCD3):9,29 (с, 1 Н), 7,30 (d, J=7,6 Гц, 2 Н), 7,25-7,00 (m, 9 Н), 6,78 (t, J=8,9 Гц, 2 Н), 6,66 (d, J=8,4 Гц, 2 Н), 6,53 (dd, J=8,9 Гц, J=4,5 Гц, 2 Н), 5,91 (d, J=9,2 Гц, 1 Н), 5,54 (dd, J=8,5 Гц,J=4,3 Гц, 1 Н), 5,09 (d, J=4,4 Гц, 1 Н), 4,74 (t, J=8,7 Гц, 1 Н), 4,40-4,21 (m, 3 Н), 4,08 (dd, J=8,8 Гц, J=4,4 Гц,-7 017362 1 Н), 1,54-1,27 (m,4 Н). Пример 7. Синтез соединения общей формулы II (PG=Cbz). К суспензии спирта общей формулы II (PG=Н) (1,50 г; 2,62 ммоль) в дихлорометане (30 мл) добавляют триэтиламин (0,29 г, 2,88 ммоль) и диметиламинопиридин (12 мг) при перемешивании и охлаждении при 5 С. Затем в течение 10 мин добавляют по каплям 50% раствор в толуоле бензилхлороформиата(1,00 мл, 2,9 ммоль, 1,1 экв.). Полученный раствор оставляют нагреваться до 10 С в течение 1 ч, при этом ход реакции контролируют ТСХ. После истечения в общей сложности 2 ч в реакционную смесь добавляют воду (25 мл) и отделенную органическую фазу промывают 1 н. водной HCl (10 мл), 9% воднымNaHCO3 (15 мл) и снова водой (15 мл) и сушат (Na2SO4). Кристаллический осадок после выпаривания кипятят с метанолом (12 мл) и оставляют стоять при комнатной температуре в течение 1 ч. Кристаллы отсасывают, промывают метанолом и сушат. Выход: 1,69 г соединения формулы II (PG=Cbz), т.е. 91,1%. ВЭЖХ: чистота 98,3%. Пример 8. Синтез соединения общей формулы IV (PG=Cbz). К суспензии кетона общей формулы IV (PG=Н) (5,97 г; 9,5 ммоль) в дихлорометане (100 мл) при перемешивании добавляют триэтиламин (1,15 г, 11,39 ммоль) и диметиламинопиридин (15 мг). Затем при охлаждении до 5 С по каплям добавляют 50% раствор в толуоле бензилхлороформиата (3,88 г,11,39 ммоль; 1,2 экв.) в течение 10 мин. Полученный раствор оставляют нагреваться до 15 С в течение 1 ч, при этом ход реакции контролируют ТСХ. После истечения в общей сложности 2 ч реакционную смесь промывают 1 н. водной HCl (30 мл), 9% водным NaHCO3 (230 мл) и снова водой (40 мл) и высушивают (Na2SO4). Кристаллический осадок после выпаривания кипятят с метанолом (100 мл) 30 мин и оставляют при комнатной температуре в течение 1 ч. Кристаллы отсасывают, промывают метанолом и сушат. Температура плавления 178,5-179 С. Выход: 6,45 г (96,4%) соединения общей формулы II (PG=Cbz). ВЭЖХ: чистота 98,6%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения где PG представляет водород или гидроксильную защитную группу, выбранную из группы, включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил, бензил,бензгидрил или тритил,характеризующийся тем, что с кеталь оксазолидидов общей формулы III где PG имеет то же значение, что указано выше;R представляет собой алкил с 1-4 атомами углерода, линейный или разветвленный, илиR+R вместе представляют собой дивалентный алкил, выбранный из группы, состоящей из 1,2 этилена, 1,2-пропилена, 1,2-бутилена, 1,3-пропилена или 2,2-диметил-1,3-пропилена,снимают защиту действием кислотных реагентов в смеси воды и смешиваемого с водой растворителя в температурном диапазоне от 0 до 100 С, и полученный кетон оксазолидид общей формулы IV где PG имеет вышеуказанное значение,восстанавливают асимметричным реагентом в инертном органическом растворителе в диапазоне температур от -30 до 40 С, где ассиметричный реагент представляет собой боргидридный комплекс с диметилсульфидом, тетрагидрофураном (ТГФ), диметиланилином или диэтиланилином в присутствии 2 замещенного (R)-CBS-оксазаборолидина в качестве хирального лиганда, выбранного из (R)-2-метилCBS-оксазаборолидина, т.е. (R)-тетрагидро-1-метил-3,3-дифенил-1 Н,3H-пирроло[1,2-с][1,3,2]оксазаборола формулы 2. Способ по п.1, характеризующийся тем, что в качестве кислотного реагента для снятия защиты используют органическую кислоту, выбранную из группы, включающей п-толуолсульфоновую кислоту,метансульфоновую кислоту и уксусную кислоту, или неорганическую кислоту, выбранную из группы,включающей соляную и серную кислоты. 3. Способ по п.1 или 2, характеризующийся тем, что снятие защиты проводят в смеси воды и смешиваемого с водой растворителя, выбранного из группы, включающей тетрагидрофуран, ацетон, метилэтилкетон или изобутилметилкетон, метанол и этанол, в диапазоне температур от 20 до 100 С, предпочтительно от 50 С до температуры кипения смеси. 4. Способ по п.1, характеризующийся тем, что 2-замещенный (R)-CBS-оксазаборолидин используют в количестве от 5 до 20 мол.%. 5. Способ по любому из пп.1 и 4, характеризующийся тем, что инертный органический растворитель выбирают из группы, включающей тетрагидрофуран, 2-метилтетрагидрофуран, третбутилметиловый эфир, толуол или дихлорометан и их смеси. 6. Способ по любому из пп.1 и 4, характеризующийся тем, что восстановление проводят при температуре от -25 до -15 С или от 20 до 30 С. 7. Способ получения О-защищенных (4S)-3-(2R)-5-(4-фторфенил)-2-[(S)-[(4-фторфенил)амино](4 гидроксифенил)метил]-5-оксопентаноил-4-фенил-1,3-оксазолидин-2-онов общей формулы IV где PG представляет собой водород или гидроксильную защитную группу, выбранную из группы,включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил,бензил, бензгидрил или тритил,характеризующийся тем, что начинают с (S)-3-[5-(4-фторфенил)-1,5-оксопентил]-4-фенилоксазолидин-2 она формулы V который кетализуют реакцией с одноатомным спиртом общей формулы VI где R представляет собой алкил с 1-4 атомами углерода, линейный или разветвленный,в присутствии катализатора в диапазоне температур от 10 до 100 С (стадия 1), полученный кеталь оксазолидид общей формулы VII где R имеет то же значение, что указано выше,подвергают реакции с защищенным имином общей формулы VIII где PG имеет то же значение, что указано выше,в присутствии кислоты Льюиса и сильного органического основания в инертном органическом растворителе в диапазоне температур от-40 до 0 С (стадия 2), и с полученного кеталь оксазолидида общей формулы III где R и PG имеют то же значение, что и выше,снимают защиту действием кислотных реагентов в смеси воды со смешиваемым с водой растворителем в диапазоне температур от 10 до 100 С (стадия 3). 8. Способ по п.7, характеризующийся тем, что сильную неорганическую или органическую кислоту, выбранную из группы, включающей серную кислоту или п-толуолсульфоновую кислоту, в присутствии поглощающего воду агента, выбранного из группы, включающей молекулярное сито и триалкилортоформиат, используют как катализатор на стадии 1. 9. Способ по п.7 или 8, характеризующийся тем, что реакцию проводят при температуре от 50 С до температуры кипения смеси на стадии 1. 10. Способ по п.7, характеризующийся тем, что на стадии 2 титана i-пропоксида трихлорид или титана н-бутоксида трихлорид в количестве от 1 до 2 экв. используют в качестве кислоты Льюиса, а диизопропилэтиламин в количестве от 2 до 5 экв. используют в качестве сильного органического основания. 11. Способ по п.7 или 10, характеризующийся тем, что на стадии 2 кислоту Льюиса используют в количестве от 1,1 до 1,4 экв. и диизопропилэтамин в количестве от 2,1 до 4 экв. 12. Способ по любому из пп.7, 10 или 11, характеризующийся тем, что на стадии 2 инертные органические растворители выбирают из группы, включающей дихлорометан, дихлороэтан, толуол, третбутилметилэфир и их смеси, в диапазоне температур от -40 до 0 С, предпочтительно от -35 до -15 С. 13. Способ по любому из пп.7 и 10-12, характеризующийся тем, что имин общей формулы VIII получаютin situ на стадии 2 путем реакции N-(4-гидроксибензилиден)-4-фторанилина (VII, PG=Н) с защитными PG-X агентами. 14. Способ по п.7, характеризующийся тем, что органическую кислоту, выбранную из группы,включающей п-толуолсульфоновую кислоту, метансульфоновую кислоту и уксусную кислоту, или неорганическую кислоту, выбранную из группы, включающей соляную или серную кислоты, используют как кислотный реагент на стадии 3. 15. Способ по п.7 или 14, характеризующийся тем, что снятие защиты на стадии 3 проводят в смеси- 10017362 воды и смешиваемого с водой растворителя, выбранного из группы, включающей тетрагидрофуран, 2 метилтетрагидрофуран, ацетон, изобутилметилкетон, метанол, этанол и их смеси, предпочтительно в диапазоне температур от 20 С до температуры кипения смеси. 16. Способ по любому из пп.7, 14 или 15, характеризующийся тем, что снятие защиты на стадии 3 проводят с использованием каталитической п-толуолсульфоновой кислоты в водном ацетоне, соляной кислоты в метаноле или этаноле или уксусной кислоты в водном тетрагидрофуране. 17. Кетон оксазолидиды общей формулы IV где PG представляет собой водород или гидроксильную защитную группу, выбранную из группы,включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил,бензил, бензгидрил и тритил. 18. Применение кетон оксазолидидов общей формулы IV, как определено в п.17, для получения эзетимиба. 19. Кетон оксазолидид формулы IVa 20. Кетон оксазолидид формулы IVb 21. Кетон оксазолидид формулы IVc 22. Кетон оксазолидид формулы IVd где PG представляет собой водород или защитную гидроксильную группу, выбранную из группы,включающей триметилсилил, трет-бутилдиметилсилил, бензилоксикарбонил, трет-бутоксикарбонил,бензил, бензгидрил и тритил. 24. Применение (S)-спиртооксазолидидов общей формулы II, как определено в п.23, для получения эзетимиба. 25. Спиртооксазолидид общей формулы IIa 26. Спиртооксазолидид общей формулы IIb 27. Спиртооксазолидид общей формулы IIc 28. Спиртооксазолидид общей формулы IId
МПК / Метки
МПК: C07D 263/26, C07D 205/08
Метки: получения, промежуточные, 3r,4s)-1-(4-фторфенил)-3-[(3s)-3-(4-фторфенил)-3-гидроксипропил]-4-(4-гидроксифенил)-2-азетидинона, соединения
Код ссылки
<a href="https://eas.patents.su/13-17362-promezhutochnye-soedineniya-dlya-polucheniya-3r4s-1-4-ftorfenil-3-3s-3-4-ftorfenil-3-gidroksipropil-4-4-gidroksifenil-2-azetidinona.html" rel="bookmark" title="База патентов Евразийского Союза">Промежуточные соединения для получения (3r,4s)-1-(4-фторфенил)-3-[(3s)-3-(4-фторфенил)-3-гидроксипропил]-4-(4-гидроксифенил)-2-азетидинона</a>
Предыдущий патент: Способ увеличения количества молока и/или мяса животных, которых кормят силосом
Следующий патент: Привод для глубинно-насосной балансирно-штанговой установки
Случайный патент: Способ и схема для резонансной инверсии












