Способ получения бисфуранового спирта
Номер патента: 16140
Опубликовано: 28.02.2012
Авторы: Полняшек Ричард П., Гутиерес Арнольд, Юй Ричард Хун Чуй, Дауди Эрик Д., Кроуфорд Кеннет Р.
Формула / Реферат
1. Способ получения бисфуранового спирта, имеющего структурную формулу 0
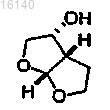
Формула 0
включающий в себя проведение реакции 2,3-дигидрофурана и гликолевого альдегида или димера гликолевого альдегида в присутствии катализатора, содержащего лантаноид или переходный металл, с образованием бисфуранового спирта формулы 0.
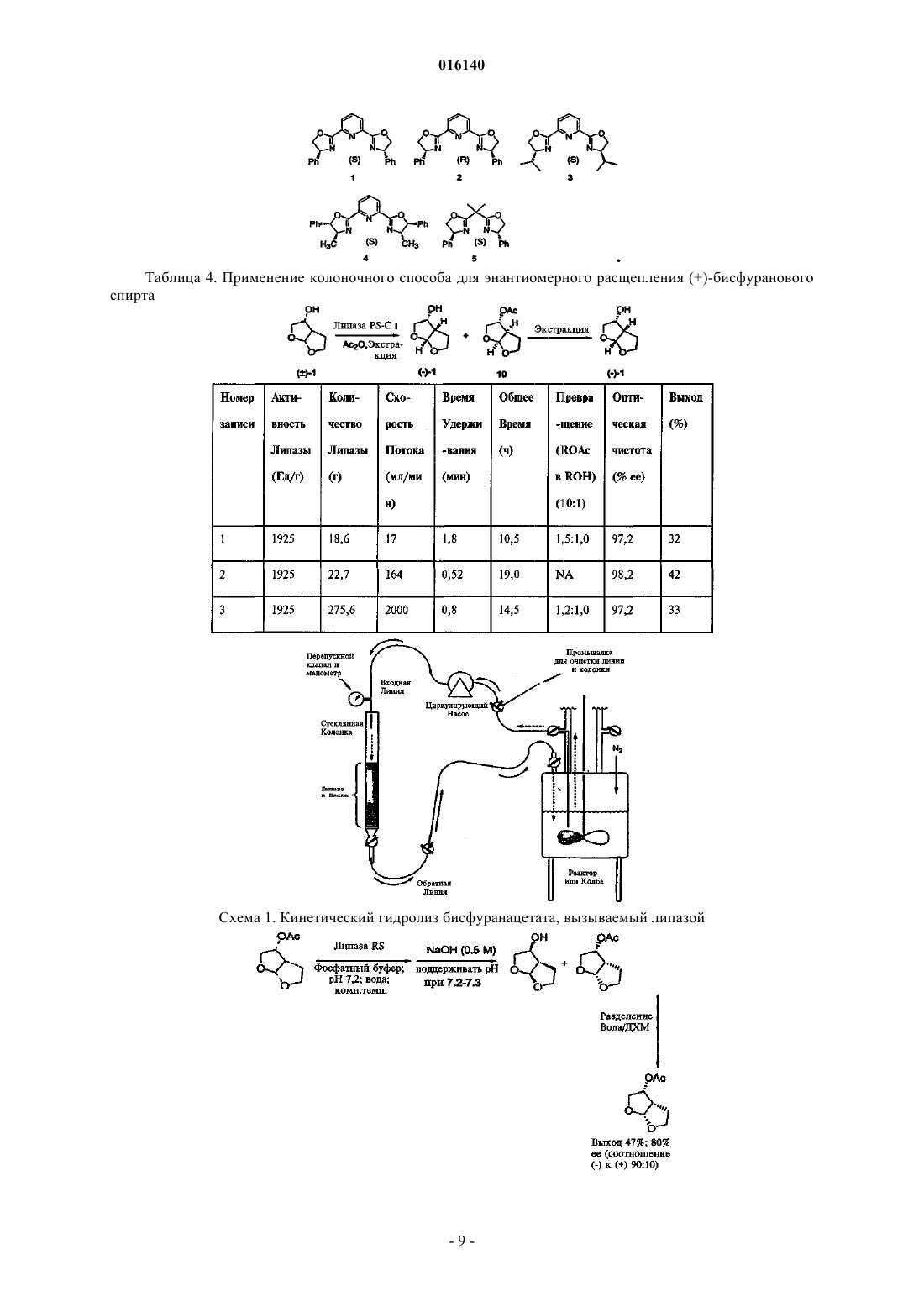
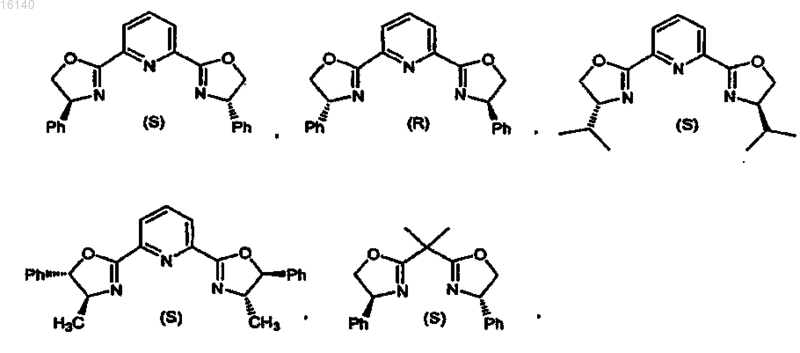
2. Способ по п.1, в котором в качестве катализаторов используют комплексы Yb, Pr, Cu, Eu и Sc с лигандами, выбранными из
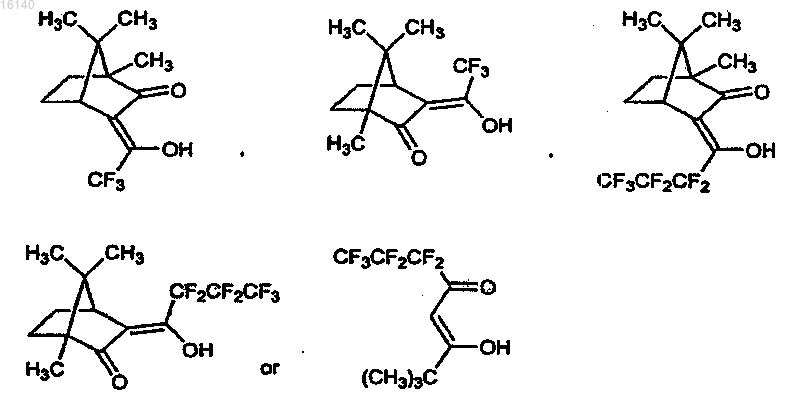
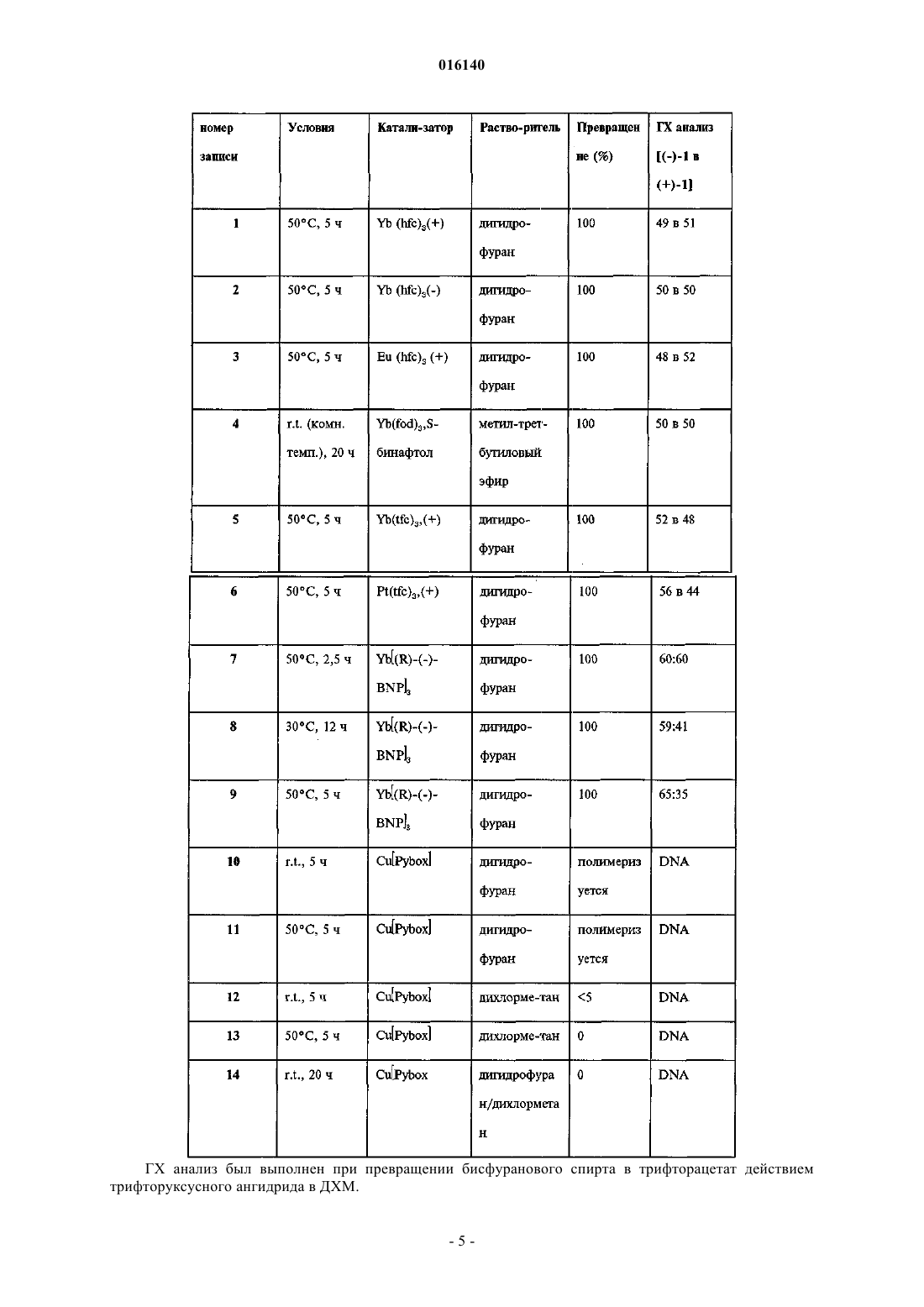
3. Способ по п.2, в котором в качестве катализаторов используют Yb(hfc)3(+),Yb(hfc)3(-). Eu(hfc)3(+), Eu(hfc)3(-), Yb(fod)3(+) и S-бинафтол, Yb(tfc)3(+), Sc(OTf)3 и (S)-pybox и Pr(tfc)3(+)
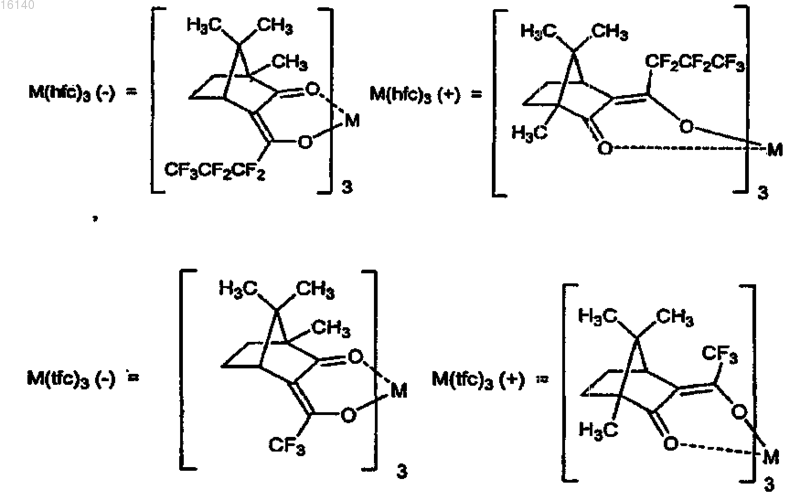
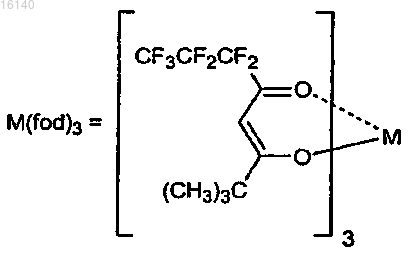
где М представляет собой Yb, Pr, Cu, Eu или Sc.
4. Способ по п.1, в котором реакцию проводят при температуре примерно от 0 до примерно 100°С.
5. Способ по п.1, в котором в качестве катализатора используют комплекс лантаноида или переходного металла с хиральным лигандом с получением бисфуранового спирта формулы 0, представляющего собой (3R,3aS,6aR)-гексагидрофуро[2,3-b]фуран-3-ол.
6. Способ по п.5, в котором в качестве хирального лиганда используют
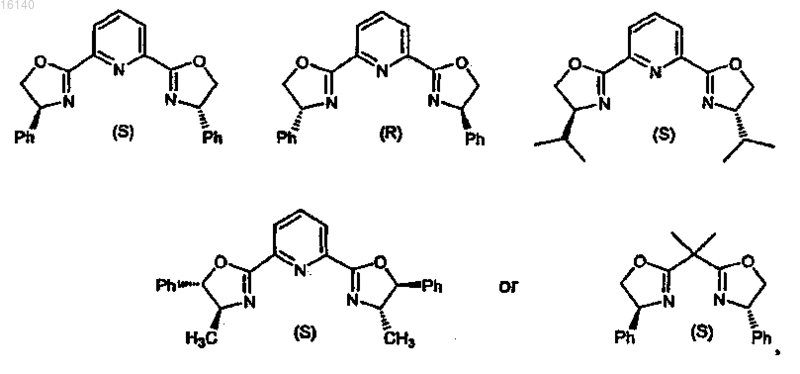
где Ph представляет собой фенил.
7. Способ по п.1, в котором реакцию проводят в присутствии растворителя.
8. Способ по п.7, в котором в качестве растворителя используют полярный апротонный растворитель.
9. Способ по п.8, в котором в качестве полярного апротонного растворителя используют метил-трет-бутиловый эфир, дихлорметан или их смесь.
10. Способ по п.1, в котором реакцию проводят в присутствии растворителя, в качестве которого используют избыток 2,3-дигидрофурана.
11. Способ по п.1, в котором используют катализатор, содержащий Sc.
12. Способ по п.1, в котором используют катализатор, содержащий Yb.
Текст
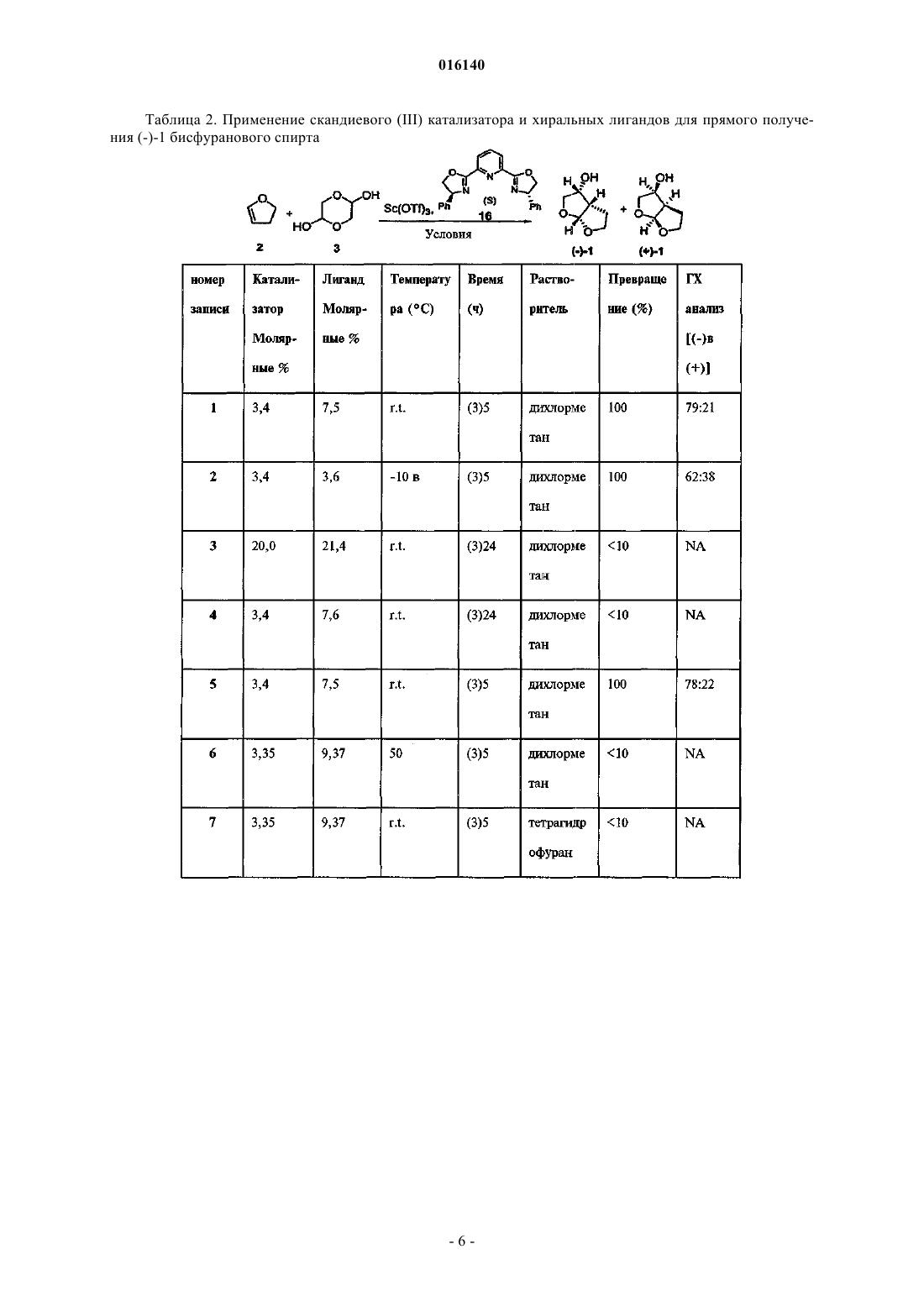
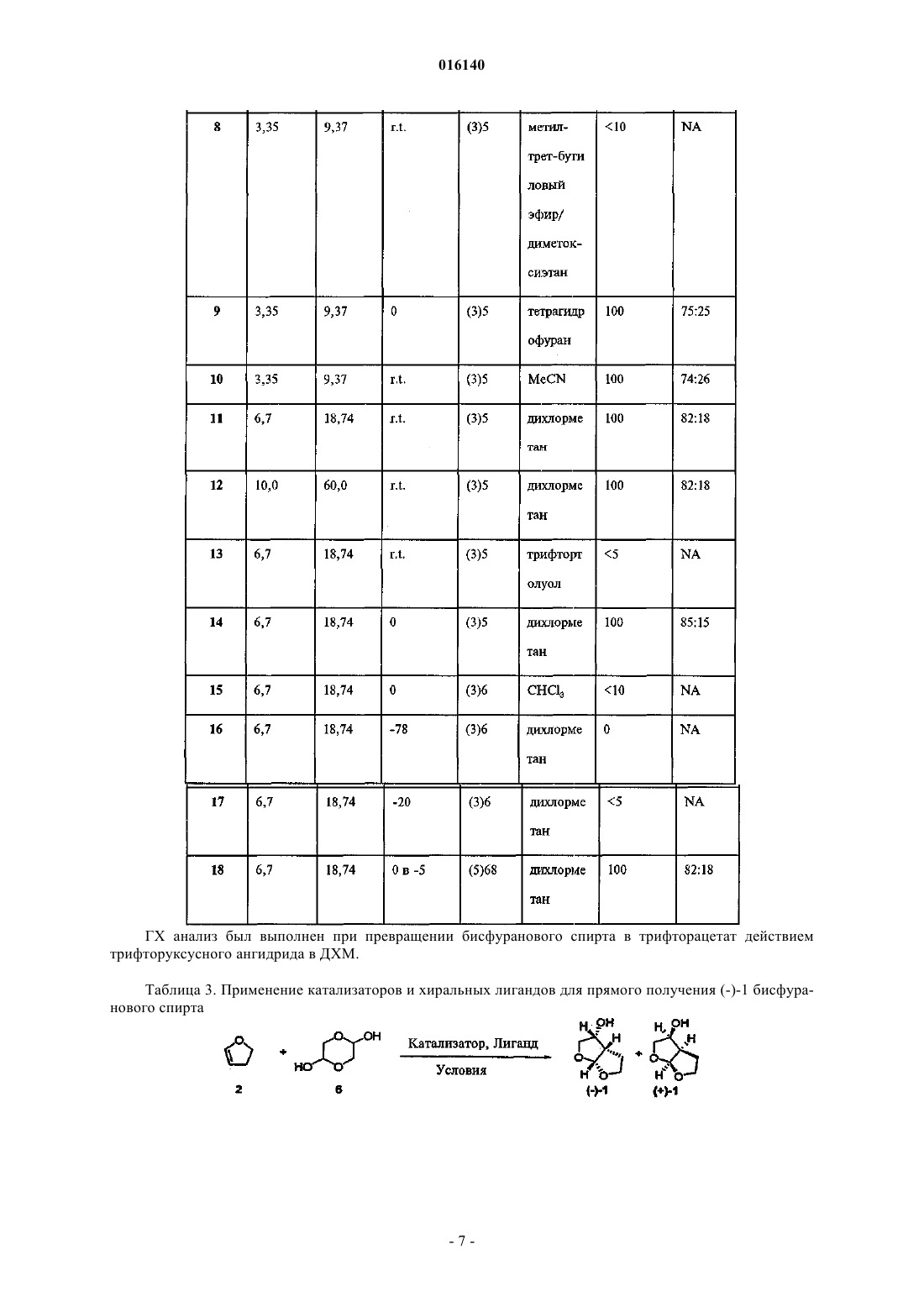
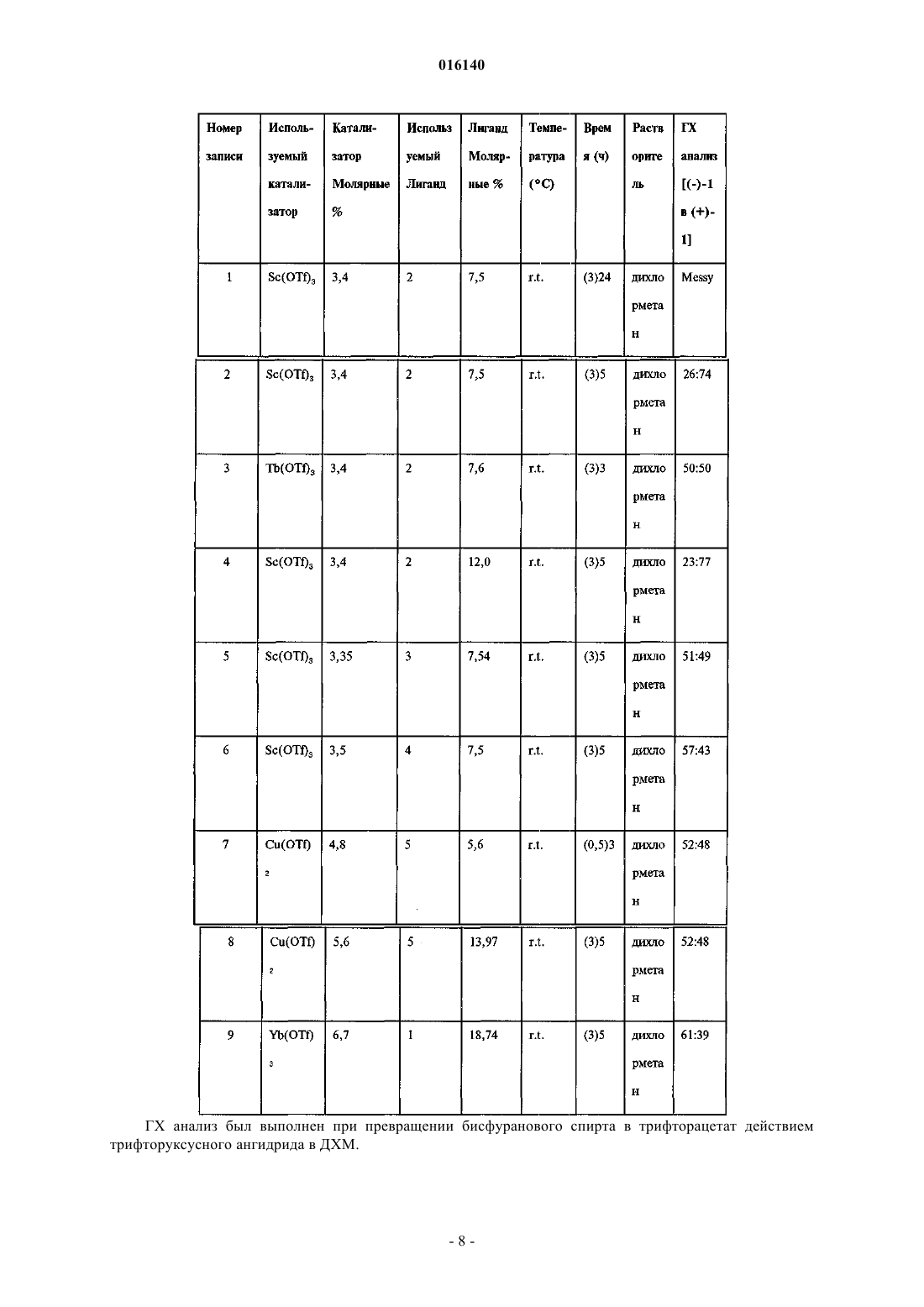
СПОСОБ ПОЛУЧЕНИЯ БИСФУРАНОВОГО СПИРТА Предложен способ синтеза бисфуранового спирта. Кроуфорд Кеннет Р., Дауди Эрик Д.,Гутиерес Арнольд, Полняшек Ричард П., Юй Ричард Хун Чуй (US) Попеленский Н.К. (RU) 016140 Область техники, к которой относится изобретение Изобретение относится к способам получения интермедиатов эфиров карбаматсульфонамидаминофосфорной кислоты. Сведения о предшествующем уровне техники СПИД является огромной проблемой общественного здоровья во всем мире. Хотя лекарства, направленные на вирусы ВИЧ широко используются и уже показали свою эффективность, их применение ограничивается токсичностью и появлением устойчивых штаммов. Способы анализа, способные определять наличие, отсутствие или количество вирусов ВИЧ используются на практике как для поиска ингибиторов, так и для диагностики наличия ВИЧ. Традиционный способ для получения ингибитора ВИЧ протеазы (ИП) общей формулы I Формула I является длительным с низким выходом около 1% и непостоянной воспроизводимостью,требует многочисленных стадий хроматографической очистки и использует нежелательные реагенты,такие как озон, цианоборгидрид натрия и гидрид трибутилолова. Соединения формулы I являются ингибиторами ВИЧ протеазы, что было показано и заявлено в WO 2003/090690. Способы получения бисфурановых спиртов, как интермедиатов, используемых при синтезе соединений формулы I, были описаны Pezechk (Pezechk, M. et.al., Tetrahedron Letters, 1986, 27, 3715) и Ghosh(Ghosh, A.K. et. al., J. Med. Chem., 1994, 37, 2506; Ghosh, A.K. et. al., J. Med. Chem., 1996, 39, 3278; Ghosh,A.K. et. al., Tetrahedron Letters, 1995, 36, 505). На схеме 1 показан синтез бисфурановых спиртов по Традиционный способ включает много стадий и использует токсичные реагенты. По одному из этих способов (Ghosh, A.K. et. al., Tetrahedron Letters, 1995, 36, 505) разделение рацемической смеси достигалось обработкой иммобилизованным ферментом с последующим хроматографическим разделением. Реактивные карбонатные эфиры были получены из бисфуранового спирта (I) и дипиридилкарбонатаand Medicinal Chemistry Letters, 1996, 6, 2847). Эти реагенты вводились в реакцию с соответствующими нуклеофилами, но не всегда проявляли достаточную реактивность и эффективность. Существуют способы для получения хиральных галоспиртов из N-защищенных аминокислот (Albeck, A. et al., Tetrahedron, 1994, 50, 6333). Способы превращения таких хлорсодержащих спиртов в карбаматные производные сульфонамида известны (Malik, A. et al., WO 01/46120A1). Подобным образом,галогидрины также могут быть превращены в эпоксиды и затем в карбаматные производные сульфона-1 016140 мида (WO 03/090690). Получение карбаматных производных аминофосфорных кислот и их последующее превращение в моно- и диэфиры фосфорных кислот было описано в Yamauchi, K. et al., J. Org. Chem.,1984, 49, 1 158; Yamauchi, K. et al., J. Chem. Soc. Perkin Trans. 1,1986, 765. Диэфиры аминоэтилфосфорной кислоты могут быть получены способом, включающим ацилирование аминофосфорной кислоты ацилгалидом или бензилхлорформиатом (CBZCl), дающим соединения формулы VII. Формула VII Соединения формулы VII могут быть активированы и сконденсированы с фенолом, образуя соединения формулы VIII. Формула VIII Соединения формулы VIII могут быть активированы и сконденсированы с вторым спиртом или фенолом, образуя IX. Формула IX Соединение формулы IX может быть деацилировано, образуя аминофосфонат формулы X Формула X Соединение формулы X может быть выделено в виде соли органической или неорганической кислоты. Способ Ghosh для бисфурановых спиртов (Ghosh, А. К. et al, J. Org. Chem., 1995, 36, 505) требует использования гидрида трибутилолова и озона. Соединение формулы I в виде свободного основания является некристаллическим и гигроскопичным с ограниченной стабильностью в протонных растворителях. Таким образом, существует потребность в разработке синтеза более стабильных форм ИП формулыI. Также существует потребность в разработке более эффективных способов синтеза ИП формулы I. Сущность изобретения Настоящее изобретение предлагает усовершенствованный способ получения бисфуранового спирта формулы 0 Формула 0 включающий в себя реакцию между 2,3-дигидрофураном и гликолевым альдегидом или димером гликолевого альдегида в присутствии лантаноида или переходного металла в качестве катализатора с образованием бисфуранового спирта формулы 0. Сведения, подтверждающие возможность осуществления изобретения Если не указано иного, следующие термины и фразы, используемые в данном документе, подразумевают следующие значения: Когда используются торговые названия, заявители намерены независимо включать продукт торговой марки и активные фармацевтические ингредиенты продукта торговой марки."Защитная группа" означает фрагмент соединения, который маскирует или изменяет свойства функциональной группы или свойства соединения в целом. Химические защитные группы и стратегии защиты/снятия защиты хорошо известны специалистам. См. например Protective Groups in Organic Chemistry, Theodora W. Greene, John WileySons, Inc., New York, 1991. Защитные группы часто используются для маскировки реактивности определенных функциональных групп с целью способствования эффективности целевой химической реакции, например, создание и разрыв химических связей в регулярном и-2 016140 запланированном порядке. Защита функциональных групп в соединении кроме реактивности защищенной функциональной группы изменяет другие физические свойства, такие как полярность, липофильность (гидрофобность) и другие свойства, которые могут быть измерены обычными аналитическими способами. Химически защищенные интермедиаты могут в свою очередь быть биологически активными или неактивными. Термин "хиральный" отностися к молекулам, которые обладают свойством несовместимости со своим зеркальным изображением, в то время как "ахиральный" отностися к молекулам, которые накладываются на свое зеркальное отображение. Термин "стереоизомеры" относится к соединениям, которые имеют одинаковое химическое строение, но отличаются расположением атомов или групп в пространстве."Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, и молекулы которых не являются зеркальными отображениеми друг друга. Диастереомеры обладают разными физическими свойствами, такими как температура плавления, температура кипения, спектральными свойствами и реактивностью. Смеси диастереомеров могут быть разделены аналитическими способами высокого разрешения, такими как электрофорез и хроматография. Термин "энантиомеры" относится к двум стереоизомерам соединения, которые несовместимы с зеркальными отображениями друг друга. "Лантаноиды" относятся к следующим элементам и их ионам: La,Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu."Переходные металлы" относятся к следующим элементам и их ионам: Sc, Ti, V, Cr, Mn, Fe, Co, Ni,Cu, Zn, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, Hf, Та, W, Re, Os, Ir, Pt, Au, Hg. Лиганды, входящие в металлсодержащий катализатор, могут быть хиральными, ахиральными или рацемическими. Схемы и примеры Общие аспекты этих иллюстративных способов описаны ниже и в примерах. Каждый из продуктов следующих способов необязательно отделяется, выделяется, и/или очищается перед его использованием в последующих процедурах. Реакции окисления и восстановления, как правило, проводятся при температурах, близких к комнатной (около 20 С), хотя при восстановлении металлическими гидридами температуру часто понижают до 0 С - -100 С, растворители, как правило, являются апротонными для восстановления, но могут быть либо протонными, либо апротонными для окисления. Время реакции подбирают для достижения желаемой конверсии. Реакции конденсации, как правило, проводят при температурах, близких к комнатной, хотя неравновесные, кинетически контролируемые конденсации часто также проводят при пониженных температурах (от 0 С до -100 С). Растворитель может быть либо протонным (обычно для равновесных реакций),либо апротонный (обычно для кинетически контролируемых реакций). Стандартные синтетические процедуры, такие как азеотропная отгонка побочных продуктов реакции и использование безводных условий реакции (например, среда инертного газа) являются обычными в данной области и будут применяться, когда это возможно. Термины "обработанный", "которым обрабатывают", "обработка" и подобные при использовании в связи с химической синтетической операцией означают контакт, смешивание, реагирование, позволение реагировать, приведение в контакт и другие термины, обычные в этой области для обозначения того, что один или более одного химических компонентов обработаны таким образом, чтобы превратить его(их) в один или более одного других химических компонентов. Это означает, что "обработка соединения один соединением два" является синонимом выражениям "позволение соединению один реагировать с соединением два", "контактирование соединения один с соединением два", "реагирование соединения один с соединением два" и другим выражениям, корректно употребляемым в области органического синтеза для обозначения того, что соединение один было "обработано", "прореагировало", "оставлено реагировать" и т.п. с соединением два. Например, обработка обозначает корректный и разумный способ, при котором органическим химическим реагентам позволяется реагировать. Если не указано другого, подразумеваются нормальные концентрации (от 0,01 до 10 М, обычно от 0,1 до 1 М), температуры (от -100 до 250 С,обычно от -78 до 150 С, наиболее обычно от -78 до 100 С, еще более обычно от 0 до 100 С), реакционные сосуды (обычно стеклянные, пластиковые или металлические), растворители, давление, среды(обычно воздушная для реакций, не чувствительных к кислороду и воде, или азот или аргон для реакций,чувствительных к кислороду или воде) и т.п. При выборе условий и аппаратуры для данного процесса используются знания о подобных реакциях, известных в области органического синтеза. В частности,человек, обладающий обычными навыками органического синтеза, подберет условия и аппаратуру для вероятного успешного выполнения химических реакций, основываясь на знаниях в этой области. В каждой иллюстративной схеме может быть целесообразным разделение продкутов реакции друг от друга и/или от исходных материалов. Целевой продукт на каждой стадии или серии стадий выделяют и/или очищают (в дальнейшем выделяют) до желаемой степени гомогенности способами, известными в данной области. Обычно такое выделение включает многоступенчатую экстракцию, кристаллизацию из растворителя или смеси раство-3 016140 рителей, перегонку, сублимацию или хроматографию. Хроматография может использовать любой набор способов, включающих, например, хроматографию на нормальной или обращенной фазе, гельфильтрацию, ионобменную хроматографию, высоко, умеренно и низко эффективные жидкостные хроматографические способы и аппаратуру, аналитическую с небольшими загрузками, противоточную хроматографию псевдоподвижного слоя и препаративную толсто- и тонкослойную, а также способы тонкослойной и флэш-хроматографии на небольших загрузках. Другой класс способов разделения включает обработку смеси реагентом, селективно связывающимся с целевым продуктом или другим способом делающим его выделяемым, но не связывающимся с исходными материалами, побочными продуктами реакции и т.п. Такие реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ион-обменные смолы и так далее. В качестве альтернативы, реагент может быть кислотой - в случае основных материалов, основанием - в случае кислых материалов, связывающим реагентом, таким как антитела, связывающимися белками, селективными хелаторами, такими как краун-эфиры, жидкостно-жидкостные ион-экстрагирующие реагенты и так далее. Отдельный стереоизомер, например энантиомер, практически свободный от своего стереоизомера,может быть получен путем разделения рацемической смеси с использованием такого способа, как образование диастереомеров при действии оптически активных разделяющих реагентов (Stereochemistry ofCarbon Compounds. (1962) by E. L Eliel, McGraw Hill; Lochmuller, С. Н., (1975) J. Chromatogr., 113:(3) 283302). Рацемические смеси хиральных соединений данного изобретения могут быть разделены и изолированы любым подходящим способом, включая: (1) образование ионных диастереомерных солей с хиральными соединениями и разделение дробной кристаллизацией или другими способами, (2) образование диастереомерных соединений с хиральным модифицирующими реагентами, разделение диастереомеров и превращение производных в чистые стереоизомеры и (3) прямое разделение достаточно чистых или обогащенных стереоизомеров в хиральных условиях. Иллюстративные варианты осуществления Типичный восстанавливающий агент, который может быть использован для превращения нитрильной группы в карбальдегидную группу, может быть найден в Larock, Richard, С. "Comprehensive OrganicTransformations 2nd Ed. 1999 John Wiley and Sons publisher, pages 1271-1272. В другом варианте осуществления изобретение предлагает способ получения бисфуранового спирта, включающий в себя: прибавление дигидрофурана к димеру гликолевого альдегида в присутствии Yb, Pr, Cu, Eu или Sc в качестве катализатора с образованием бисфуранового спирта формулы 0 Формула 0 Таблица 1. Хиральные катализаторы при образовании бисфуранового спирта ГХ анализ был выполнен при превращении бисфуранового спирта в трифторацетат действием трифторуксусного ангидрида в ДХМ.-5 016140 Таблица 2. Применение скандиевого (III) катализатора и хиральных лигандов для прямого получения (-)-1 бисфуранового спирта ГХ анализ был выполнен при превращении бисфуранового спирта в трифторацетат действием трифторуксусного ангидрида в ДХМ. Таблица 3. Применение катализаторов и хиральных лигандов для прямого получения (-)-1 бисфуранового спирта ГХ анализ был выполнен при превращении бисфуранового спирта в трифторацетат действием трифторуксусного ангидрида в ДХМ. Таблица 4. Применение колоночного способа для энантиомерного расщепления (+)-бисфуранового спирта Получение (3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ола (1) В реакционный сосуд загружают димер гликолевого альдегида (4,45 кг), катализатор Yb(fod)3 (0,29 кг) и дигидрофуран (20,5 кг). Содержимое перемешивают и нагревают до 50 С в течение приблизительно 5 ч. Реакционную смесь концентрируют до сырого масла, растворяют в насыщенном водном раствореNaHCO3 (60 кг) и промывают дихлорметаном (6 кг). К водному слою прибавляют дихлорметан (58 кг),KBr (0,89 кг), TEMPO (0,116 кг) и смесь охлаждают до 0 С. К этой смеси медленно добавляют гипохлорит натрия (NaOCl, приблизительно 11% Cl, 55 кг). По окончании реакции органическому и водному слоям позволяют разделиться. Водный слой промывают дихлорметаном (29 кг). Органические слои объединяют и промывают водой, 10% HCl с Kl и 10% тиосульфатом натрия. Органический слой высушивают над сульфатом натрия, отфильтровывают твердое вещество, и фильтрат охлаждают до температуры ниже 0 С. Поддерживая температуру реакционной смеси ниже 0 С, добавляют раствор боргидрида натрия (0,36 кг) в этаноле (7,1 кг). По завершении реакции для ее подавления добавляют уксусную кислоту(1,4 кг) и воду (13,4 кг). Смесь концентрируют вакуумной перегонкой. К полученной сырой маслообразно-полутвердой смеси добавляют этилацетат (31 кг). Органический слой высушивают над сульфатом натрия, отфильтровывают твердое вещество и концентрируют путем вакуумной перегонки, выделяя -1(рацемат гексагидрофуро[2,3-b]фуран-3-ола) в виде масла. Ферментативное разрешение Сырой маслообразный продукт обрабатывают диметиловым эфиром этиленгликоля (DME, 14,7 кг) и уксусным ангидридом (4,6 кг). Этот раствор многократно пропускают через колонку, набитую смесью Липазы PS-C "Amano I" (0,36 кг) и песка (6 кг). По окончании энантиомерного разрешения раствор концентрируют путем вакуумной перегонки. Для растворения продукта добавляют воду (18 кг) и раствор промывают дихлорметаном (28 кг). Продукт, содержащий водный слой, концентрируют путем вакуумной перегонки. Полученное масло растворяют в этилацетате (16 кг) и сушат над сульфатом натрия. Дополнительное количество продукта может быть выделено повторной экстракцией дихлорметанового слоя водой несколько раз. Объединенные водные фракции концентрируют путем вакуумной перегонки. Полученное масло растворяют в этилацетате, сушат над сульфатом натрия и отфильтровывают твердое вещество. Объединенные этилацетатные фракции концентрируют путем вакуумной перегонки, получая продукт (3R,3aS,6aR) гексагидрофуро[2,3-b]фуран-3-ол, (-)-(1) в виде масла (1,6 кг, 97% ее, выход 33%),загрязненный примерно 15 вес.% соответствующего ацетата. Аналитические даные: 1 Н ЯМР (ДМСО-d6, 300 МГц)5,52 (дд, 1 Н), 4,25-4,15 (м, 1 Н), 3,85-3,75 (м,2 Н), 3,7-3,6 (м, 1 Н), 3,3 (т, 1 Н), 2,75-2,65 (м, 1 Н), 2,23- 2,13 (м, 1 Н), 1,75-1,6 (м, 1 Н). Была сделана ссылка на определенный вариант осуществления изобретения, примеры которого иллюстрируются в описании, а также структурами и формулами. Хотя изобретение было описано на примере ограниченного числа вариантов осуществления, должно быть понятно, что изобретение не ограничивается этими вариантами осуществления. Наоборот, подразумевается, что изобретение покрывает все альтернативы, модификации и эквиваленты, которые могут быть включены в пределы действия настоящего изобретения, как определено в формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения бисфуранового спирта, имеющего структурную формулу 0 Формула 0 включающий в себя проведение реакции 2,3-дигидрофурана и гликолевого альдегида или димера- 10016140 гликолевого альдегида в присутствии катализатора, содержащего лантаноид или переходный металл, с образованием бисфуранового спирта формулы 0. 2. Способ по п.1, в котором в качестве катализаторов используют комплексы Yb, Pr, Cu, Eu и Sc с лигандами, выбранными из 3. Способ по п.2, в котором в качестве катализаторов используют Yb(hfc)3(+), Yb(hfc)3(-),Eu(hfc)3(+), Eu(hfc)3(-), Yb(fod)3(+) и S-бинафтол, Yb(tfc)3(+), Sc(OTf)3 и (S)-pybox и Pr(tfc)3(+) где М представляет собой Yb, Pr, Cu, Eu или Sc. 4. Способ по п.1, в котором реакцию проводят при температуре примерно от 0 до примерно 100 С. 5. Способ по п.1, в котором в качестве катализатора используют комплекс лантаноида или переходного металла с хиральным лигандом с получением бисфуранового спирта формулы 0, представляющего собой (3R,3aS,6aR)-гексагидрофуро[2,3-b]фуран-3-ол. 6. Способ по п.5, в котором в качестве хирального лиганда используют где Ph представляет собой фенил. 7. Способ по п.1, в котором реакцию проводят в присутствии растворителя. 8. Способ по п.7, в котором в качестве растворителя используют полярный апротонный растворитель. 9. Способ по п.8, в котором в качестве полярного апротонного растворителя используют метилтрет-бутиловый эфир, дихлорметан или их смесь. 10. Способ по п.1, в котором реакцию проводят в присутствии растворителя, в качестве которого используют избыток 2,3-дигидрофурана. 11. Способ по п.1, в котором используют катализатор, содержащий Sc. 12. Способ по п.1, в котором используют катализатор, содержащий Yb.
МПК / Метки
МПК: C07F 9/02, C07D 493/04, C07C 327/42
Метки: бисфуранового, получения, спирта, способ
Код ссылки
<a href="https://eas.patents.su/13-16140-sposob-polucheniya-bisfuranovogo-spirta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бисфуранового спирта</a>
Предыдущий патент: N-тиоантраниламидные соединения и их применение в качестве пестицидов
Следующий патент: Цинковая соль розувастатина
Случайный патент: Способ превращения вязкого жидкого остатка в топливо, пригодное к применению