Способ получения замещенных бензотиазиноиндолов
Номер патента: 12750
Опубликовано: 30.12.2009
Авторы: Дешпанде Амол Динкар, Камбхампати Рама Састри, Ширсатх Викас Шрикришна, Рамакришна Венката Сатья Нироги, Котхмиркар Прабхакар, Джасти Венкатесварлу
Формула / Реферат
1. Способ получения замещенных бензотиазиноиндолов общей формулы (I)

где R1, R2 и R4 могут быть одинаковыми или различными и, каждый независимо, представляют водород, хлор, фтор, амино, нитро, циано, CHO, (C1-С3)алкил, пергалоген(C1-С3)алкил, (C1-С3)алкокси, арил, аралкил, аралкокси, (С5-С7)гетероциклил, (С5-С7)гетероциклилалкил, (С5-С7)гетероциклилокси, ацил, ацетил, алкиламино, аминоалкил, амид, гидроксиалкил, группу карбоновой кислоты и ее производных;
R3 представляет водород, (C1-С3)алкил, арил и группу карбоновой кислоты и ее производных,
включающий циклизацию соединений общей формулы II (т.е. замещенного 1-бензолсульфонил-7-бром-1Н-индола)
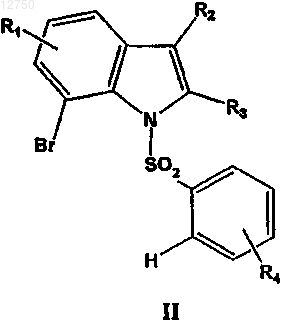
где R1, R2, R3 и R4 определены выше в присутствии подходящего палладиевого (0) или (II) каталитического комплекса, в присутствии подходящего основания и растворителя при температуре в интервале 0-200шС катализатора с получением соединения формулы (I), где R1, R2, R3 и R4 определены выше; причем основание выбирают из ацетата калия или триэтилацетата и подходящий растворитель выбирают из диметилформамида, диметилсульфоксида или диметилацетамида.
2. Способ по п.1, в котором указанное соединение формулы I выбрано из
8-метил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-фтор-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-изопропил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид-3-карбоксальдегида;
3-ацетил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-изопропил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-хлор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
8-фтор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
5-фтор-8-метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
5-хлор-8-фтор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-хлор-8-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,8-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-8-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,8-диметил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,8-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,9,10-трихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-хлор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,8,10-трифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-хлор-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-хлор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-метил-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-7-трифторметил-10-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5-фтор-7-трифтометил-10-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;
3-(N,N-диметиламиноэтил)-5,10-дихлор-7-трифторметил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида.
3. Способ по п.1, в котором используемый катализатор представляет собой систему комплексного палладиевого (0) или (II) катализатора.
4. Способ по п.1, в котором подходящая система комплексного палладиевого (0) или (II) катализатора выбрана из одного или более: Pd(OAc)2, PdCl2, Pd (0)(PPh3)4, Pd(0)(P(o-CH3)Ph3)4, PdCl2(PPh3)2, Pd2(dba)3-CHC13, (h3-аллил-PdCl)2 или Pd-на-угле без фосфиновых лигандов.
5. Способ по любому из указанных пунктов, где подходящие лиганды, используемые с палладиевым катализатором, выбраны из одного или более фосфинов, фосфитов, гетероциклических карбеновых лигандов или Li и более предпочтительно фосфинов.
6. Способ по любому из пп.3-5, в котором соотношение предпочтительного палладиевого катализатора и фосфинового катализатора может быть в интервале от 2 до 4, как, например, в PdCl2(PPh3)2 и Pd(0)(PPh3)4.
7. Способ по любому из предыдущих пунктов, в котором молярное соотношение используемого палладиевого катализатора находится в интервале от 0,01 до 0,10 мольного эквивалента (от 1 до
10 мол.%) в расчете на соединение формулы (II).
8. Способ по п.7, в котором молярное соотношение используемого в реакции палладиевого катализатора предпочтительно находится в интервале от 0,03 до 0,05 мольного эквивалента (от 3 до 5 мол.%) в расчете на соединение формулы (II).
9. Способ по любому из предыдущих пунктов, в котором подходящее основание представляет собой или CH3COOK, или TEA.
10. Способ по п.9, в котором молярное соотношение используемого в реакции основания составляет примерно 0-5 мольных эквивалентов в расчете на соединение формулы (II).
11. Способ по п.9 или 10, в котором подходящее основание или растворено, или суспендировано в полярном апротонном растворителе, таком как диметилформамид, диметилсульфоксид, диметилацетамид.
12. Способ по любому из предыдущих пунктов, в котором используемый растворитель представляет собой диметилацетамид в соотношении 5-20 об./об.
13. Способ по п.1, в котором используемый в реакции растворитель представляет собой диметилформамид в соотношении 5-20 об./об.
14. Способ по п.1, в котором указанная циклизация проводится в температурном диапазоне от 0 до 200шС в зависимости от растворителя.
15. Способ по п.14, в котором указанный температурный диапазон составляет от 90 до 180шС.
16. Способ по п.1, в котором указанная циклизацшя проводится в инертной атмосфере/дегазированных условиях с использованием инертных газов, таких как N2, Ar или Не.
Текст
012750 Область изобретения Настоящее изобретение относится к способу получения замещенных бензотиазиноиндолов из замещенного 7-броминдольного производного формулы (II) посредством циклизации с получением соединения формулы (I), используя подходящий катализатор и растворители. Схема I (стадия изобретения) В предпочтительном варианте осуществления изобретение включает обработку соединения формулы (II) подходящим комплексом палладиевого (0) или (II) катализатора в присутствии подходящего основания, растворенного/суспендированного в растворителе в подходящем диапазоне температур в инертной атмосфере/дегазированных условиях. Впервые о реакции Хека было сообщено в конце 1960-х годов авторами Moritani, Fujiwara и Heck(см. ссылки). Имеется несколько докладов об использовании внутримолекулярной реакции Хека для получения систем полициклических колец. Некоторые из них были новыми рабочими платформами, представленными для дальнейшего потенциального использования их в медицине. Задачей изобретения является синтезирование соединений, имеющих общую структуру (I), которые используются в качестве лекарственных средств. Начальная стратегия представлена на схеме (II) и включает циклизацию замещенного 1-(2'-бромбензолсульфонил)индола, используя хорошо известную реакцию Хека. Схема II Синтетический подход, описанный схемой (II), имеет следующие недостатки: 1) могут быть получены только несколько соединений с желаемой тетрациклической системой колец; 2) скорость конверсии исходных реагентов в целевой продукт была низкой. Эта проблема становится критической, когда синтезируется конечный продукт и в реакцию вовлечен катализатор, подобный палладию. Этот феномен особенно наблюдался, когда заместители кольца имели варьируемые электронные или стерические эффекты; 3) иногда полученный продукт нуждался в дополнительной очистке; 4) средний выход всех индивидуальных реакций был в общем низким; 5) требовалось большое количество различных замещенных 2-бромарилсульфонилхлоридов для получения библиотеки соединений. Кроме того, иногда реакция не протекает из-за стерических и/или электронных эффектов различных заместителей, когда используются такие мультизамещенные арилсульфонилхлориды. Следует отметить, что монозамещенные/дизамещенные арилсульфонилхлориды в общем не являются утилитарными реактивами и являются дорогими и синтетически труднодоступными; 6) в особом случае, когда R3 представляет собой водород, возможно получение смеси двух изомерных соединений (см. схему IIa, R3=H) Схема IIa-1 012750 и часто основной продукт представляет собой нежелательную тетрациклическую систему колец,циклизуясь по атому С 2 индола (формула III), который, в свою очередь, может ожидаться вследствие предпочтительных стерических и термодинамических факторов (ссылки WO 2004/000849A2,WO 2004/055026A1). Кроме того, выделение, очистка и идентификация каждого из двух изомерных соединений представляли собой сложную задачу. Кроме того, при изменении комбинации заместителей в реагенте могло изменяться соотношение двух получаемых изомеров. В результате этого число получаемых соединений было ограничено доступностью конкретных замещенных 2'-бромарилсульфонилхлоридов. Следовательно, для повышения многообразия заместителей в этих системах колец заявители начали исследовать новую химию для синтеза систем колец, определенных соединением формулы (I). В тех попытках заявители обнаружили, что схема (I), подробно описанная ниже, остается имеющей прекрасный потенциал в решении проблемы повышения многообразия, чистоты, выходов и экономичности синтезов. Ключевым моментом является использование замещенных 7-броминдолов, которые вступают в реакцию Хека. Применение помогает устранить многие приведенные выше ограничения и повышает многообразие целевых тетрациклических систем колец. Результат может быть вследствие распределения электронов, легкости образования комплекса с палладиевым катализатором, более легкой конверсией в целевой продукт благодаря предпочтительной стереохимии и другим общим принципам смещения химического равновесия реакции по направлению к целевым продуктам, таким образом улучшая выходы. Реакция способствует получению только одного продукта, и чистота полученного продукта является хорошей. Исходный материал, 7-броминдол, один раз полученный, может быть соответствующим образом функционализован в дальнейшем. Эти соединения в дальнейшем могут быть обработаны обычно доступными моно-/дизамещенными арилсульфонилхлоридами. Таким образом, размер библиотеки и ее многообразие значительно увеличились, выполнив основную задачу Сущность изобретения Настоящее изобретение относится к способу получения замещенных бензотиазиноиндолов общей формулы (I), включающей циклизацию исходного материала, т.е. соединения общей формулы (II) (т.е. замещенного 1-бензосульфонил-7-бром-1 Н-индола), в присутствии подходящего катализатора и растворителей. Схема I (стадия изобретения) Предпочтительным подходящим катализатором является комплекс палладиевого (0) или (II) катализатора в присутствии подходящего основания, растворенного/суспендированного в пригодном растворителе в подходящем диапазоне температур в инертной атмосфере/дегазированных условиях. Предпочтительные заместители для R1, R2, R3 и R4 в соединениях формулы (I) и (II) определены как следующие: R1, R2 и R4, каждый независимо, могут представлять собой водород, хлор, фтор, амино, нитро, циано, СНО, (C1-C3)алкил, пергалоген (C1-C3)алкил, (C1-C3)алкокси, арил, аралкил, аралкокси,(С 5-С 7)гетероциклил, (С 5-С 7)гетероциклилалкил, (С 5-С 7)гетероциклилокси, ацил, ацетил, алкиламино,аминоалкил, амид, гидроксиалкил, карбоновую кислоту и ее производные; R3 независимо может представлять собой водород, (C1-C3)алкил, арил и карбоновую кислоту и ее производные. Подходящий катализатор может представлять собой любой из известных в литературе, которые применимы в процессе образования колец. Предпочтительным катализатором может являться такой катализатор, который содержит металл палладий в подходящей валентности. Более предпочтительным катализатором может являться палладий с валентностью или (0), или (II) в форме комплексного катализатора, который может иметь лиганд/основание. Известно, что внутримолекулярная циклизация протекает при участии Pd(0). Таким образом, подходящая каталитическая система предпочтительно может включать соединение палладия, связанное с носителем и основанием (в некоторых случаях), которое может предоставлять активированный Pd(0) in situ, которое достаточно стабильно для протекания реакции в указанном направлении. Некоторые примеры таких комплексов палладия, описанных в литературе, при-2 012750 ведены ниже. 1. Соединения Pd(II) с соответствующими лигандами, например фосфинами, фосфитами, гетероциклическими карбеновыми лигандами, Li, как указано в ссылке [6]. Соединения Pd(II), такие какPd(OAc)2, PdCl2, Pd(0)(PPh3)4, PdCl2(PPh3)2, Pd2(dba)3-CHCl3, (3-аллил-PdCl)2 или Pd-на-угле без фосфиновых лигандов. Pd(OAc)2 и PdCl2 были использованы в качестве предшественников Pd(0) катализаторов с добавлением или без добавления восстанавливающих агентов, например фосфиновых лигандов. Например, тетракис-(трифенилфосфин)палладий, бис-(трифенилфосфин)палладия(II) дихлорид и(бис-три-о-толилфосфин)палладий. Литературный источник [6] включен в описание посредством ссылки. 2. Коллоидные палладиевые частицы, защищенные тетраалкиламмониевыми солями. 3. Полимер, содержащий активный палладиевый катализатор. 4. Палладий-на-угле без фосфина. Могут быть использованы оба типа палладиевых соединений, а именно комплексы Pd(0) и солиPd(II). В литературе общепризнано, что каталитическая активность Pd(0), образованного in situ из других палладиевых соединений, не всегда одинакова, и целесообразно проверить их все по порядку для достижения эффективных каталитических реакций. Соотношение палладиевого катализатора и лигандов является важным. Известно, что присутствие избытка лиганда приводит к уменьшению концентрации активной формы катализатора, таким образом замедляя каталитический процесс. Некоторые Pd-катализируемые реакции протекают без фосфиновых лигандов, и свободный от фосфина катализатор представляет собой идеальный катализатор, потому что фосфины дорогие, сложные для восстановления и координированные фосфины, как таковые, не принимают прямого участия в каталитической реакции. Pd представляет собой дорогой металл, и необходима оптимизация его использования посредством его утилизации и повторного использования. Выбранное подходящее основание должно быть способно, по меньшей мере, активировать палладиевый каталитический комплекс и может играть некоторые второстепенные роли. Такие пригодные основания включают CH3COOK, TEA и им подобные. Предпочтительно эти основания следует использовать в количестве 1-5 мольных эквивалентов в расчете на соединение формулы (II) в реакционном растворителе и реакционной температуре. Подходящие растворители для реакции предпочтительно должны быть инертными в условиях реакции, нетоксичными и имеющими высокую температуру кипения. Некоторыми примерами подходящих растворителей являются полярные апротонные растворители, например диметилформамид (ДМФА), диметилсульфоксид (ДМСО), диметилацетамид (ДМА) и им подобные. Обычно является предпочтительным растворитель, имеющий температуру кипения выше 80 С; примеры включают диметилацетамид,диметилформамид и им подобные. Количество при подходящем использовании составляет примерно 5-20 об./об. Инертная атмосфера может поддерживаться за счет использования инертных газов, например N2, Ar или He. Кроме того, реакционная смесь может быть дегазирована, если требуется. Температура реакции может изменяться от 0 до 200 С в зависимости от выбора растворителя, предпочтительна температура от 80 до 140 С. Наиболее предпочтительные условия реакции следующие: Следующее описание иллюстрирует способ получения различных замещенных соединений общей формулы (I). Они приведены только в качестве иллюстрации и, таким образом, не могут быть истолкованы для ограничения объема настоящего изобретения. Коммерческие реагенты были использованы без дополнительной очистки. Комнатная температура относится к 25-30 С. Температуры плавления не откорректированы. ИК-спектры были получены с использованием KBr в твердом состоянии и абсорбция выражена в см-1. Если не оговорено иное, все массспектры были выполнены с использованием условий ионизации электрораспылением (ESI). 1 Н-ЯМР спектры были записаны при 400 МГц на приборе Bruker. В качестве растворителя был использован дейтерированный хлороформ (99,8% D). TMS был использован как внешний эталонный стандарт. Значения химических сдвигов, приведенные в описании, выражены в значениях миллионных долей ( ppm). Следующие сокращения были использованы для мультипликативности ЯМР сигналов: с=синглет,уш.с=уширенный синглет, д=дублет, т=триплет, к=квартет, кв=квинтет, г=гептет, дд=дублет дублетов,-3 012750 дт=дублет триплетов, тт=триплет триплетов, м=мультиплет. ЯМР, масс-спектры были откорректированы для основных пиков. Хроматография относится к колоночной хроматографии с использованием 60-120 меш силикагеля и выполненная в условиях давления азота (флэш-хроматография). Пример 1. 8-Метил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь 1-(4-метилбензолсульфонил)-3-(4-метилпиперазин-1-илметил)-7-броминдола (170 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 90-100 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. После завершения реакции (3-4 ч, ТСХ) реакционную смесь охлаждали до 25 С и отфильтровывали через Hyflow. Фильтрат разбавляли смесью льда и воды при интенсивном перемешивании. Продукт экстрагировали этилацетатом (210 мл) после подщелачивания водным раствором KOH до рН 9-10. Объединенные этилацетатные экстракты промывали насыщенным раствором NaCl, водой и сушили над сульфатом магния, летучие органические вещества удаляли отгонкой при пониженном давлении и неочищенный остаток очищали с использованием колоночной хроматографии (силикагель,этилацетат:триэтиламин = 99,5:0,5). Чистое соединение получали в виде слегка коричневого масла(60 мг, 46%), которое при отстаивании затвердевало. ИК-спектр (см-1): 799, 1145, 1322, 1455; масс-спектр (m/z): 382 (М+Н)+; 1(171 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 130-140 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. ИК-спектр (см-1): 801, 1102, 1262, 1323; масс-спектр (m/z): 386 (М+Н)+; 1 Н-ЯМР: 2,30 (3 Н, с), 2,37-2,60 (8 Н, м), 3,57 (2 Н, с), 7,30-7,32 (1 Н, м), 7,47-7,51 (1 Н, т), 7,64 (1 Н, с),7,82-7,85 (1 Н, дд), 7,89-7,91 (1 Н, д), 7,94-7,96 (1 Н, д), 8,22-8,26 (1 Н, дд). Пример 3. 3-(4-Метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь 1-(бензолсульфонил)-3-(4-метилпиперазин-1-илметил)-7-броминдола (165 мг, 0,368 ммоль),бис-(трифенилфосфин)палладия(II) хлорида (8,0 мг, 0,011 ммоль) и ацетата калия (54,0 мг, 0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 110-120 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 368 (М+Н)+. Пример 4. 8-Изопропил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Смесь 1-(4-изопропилбензолсульфонил)-3-(4-метилпиперазин-1-илметил)-7-броминдола (180 мг,0,368 ммоль), бис-(трифенилфосфин)палладия(II) хлорида (8,0 мг, 0,011 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 110-120 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. ИК-спектр (см-1): 804, 1172, 1322, 1454; масс-спектр (m/z): 410 (М+Н)+; 1 Н-ЯМР: 1,35-1,37 (6 Н, д), 2,29 (3 Н, с), 2,31-2,60 (8 Н, м), 3,09-3,13 (1 Н, септет), 3,75 (2 Н, с), 7,457,50 (2 Н, м), 7,64 (1 Н, с), 7,88-7,90 (1 Н, дд), 7,98-8,01 (2 Н, м), 8,14-8,16 (1 Н, д). Пример 5. 1,2-Бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь 1-(бензолсульфонил)-7-броминдола (124 мг, 0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (21,0 мг, 0,018 ммоль) и ацетата калия (54,0 мг, 0,55 ммоль) в диметилформамиде(4,0 мл) нагревали до 90-110 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 256 (М+Н)+. Пример 6. 1,2-Бензотиазино[2,3,4-ab]индол-S,S-диоксид-3-карбоксальдегид. Смесь 1-бензолсульфонил-3-формил-7-броминдола (134 мг, 0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг, 0,55 ммоль) в диметилацетамиде(4,0 мл) нагревали до 130-140 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 284 (М+Н)+.(4,0 мл) нагревали до 130-140 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 298 (М+Н)+. Пример 8. 3-(N,N-Диметиламиноэтил)-1,2-бензотиазино[2,3, 4-ab]индол-S,S-диоксид. Смесь [2-(1-бензолсульфонил-7-бром-1-Н-индол-3-ил)этил]диметиламина (150 мг, 0,368 ммоль),тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг, 0,55 ммоль) в диметилформамиде (4,0 мл) нагревали до 120-140 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. ИК-спектр (KBr, см-1): 2982, 1594, 1328, 1173, 1128, 756; масс-спектр (m/z): 327,2 (М+Н)+; 1 Н-ЯМР: 2,35 (6 Н, с), 2,69-2,72 (2 Н, м), 2,97-3,01 (2 Н, м), 7,46-7,5 (1 Н, м), 7,59-7,64 (2 Н, м), 7,717,73 (1 Н, д, J=7,72 Гц), 7,779 (1 Н, ушир.м), 7,95-7,97 (1 Н, д, J=7,68 Гц), 8,17-8,19 (1 Н, д, J=7,92 Гц), 8,228,24 (1 Н, дд, J=8,0 Гц, 0,96 Гц). Пример 9. 8-Метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь 2-[7-бром-1-(4-метилбензолсульфонил)-1 Н-индол-3-ил]этилдиметиламина (155 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (13,0 мг, 0,011 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 110-130 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 341,2 (М+Н)+; 1(54,0 мг, 0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 110-130 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 369,4 (М+Н)+; 1 Н-ЯМР: 1,355-1,372 (6 Н, д, J=6,96 Гц), 2,35 (6 Н, с), 2,69-2,73 (2 Н, м), 2,97-3,01 (2 Н, м), 3,09-3,12(162 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 140-150 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Масс-спектр (m/z): 361,6 (М+Н)+; 1(54,0 мг, 0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 140-160 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. ИК-спектр (KBr, см-1): 2930, 1602, 1463, 1323, 1173, 633; масс-спектр (m/z): 345,3 (М+Н)+; 1-5 012750 Пример 13. 5-Фтор-8-метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь [2-(1-(4-метилбензолсульфонил-5-фтор-7-бром-1 Н-индол-3-ил)этил]диметиламина (162 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (13,0 мг, 0,011 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилацетамиде (4,0 мл) нагревали до 110-130 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. Интервал плавления: 215-218 С; ИК-спектр (KBr, см-1): 2921, 1602, 1473, 1316, 1171, 1136, 533; масс-спектр (m/z): 359,2 (М+Н)+; 1 Н-ЯМР: 2,43 (6 Н, с), 2,56 (3 Н, с), 2,76-2,8 (2 Н, м), 2,99-3,03 (2 Н, м), 7,41-7,47 (3 Н, м), 7,62-7,72 (2 Н,м), 7,87 (1 Н, с), 8,09-8,11 (1 Н, д, J=7,88 Гц). Пример 14. 5-Хлор-8-фтор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Смесь [2-(1-(4-фторбензолсульфонил-5-хлор-7-бром-1 Н-индол-3-ил)этил]диметиламина (169 мг,0,368 ммоль), тетракис-(трифенилфосфин)палладия(0) (26,0 мг, 0,022 ммоль) и ацетата калия (54,0 мг,0,55 ммоль) в диметилсульфоксиде (4,0 мл) нагревали до 160-180 С в атмосфере азота. Завершение реакции наблюдали по ТСХ. Это соединение выделяли, очищали и охарактеризовывали согласно методу, в принципе, описанному выше для примера 1. ИК-спектр (KBr, см-1): 2763, 1603, 1330, 1174, 1126, 865, 551; масс-спектр (m/z): 379,2 (М+Н)+; 1 Н-ЯМР: 2,34 (6 Н, с), 2,66-2,7 (2 Н, т), 2,93-2,96 (2 Н, м), 7,34-7,38 (1 Н, м), 7,63 (1 Н, с), 7,723-7,727(1 Н, д, J=1,52 Гц), 7,77-7,8 (1 Н, дд, J-9,4 Гц), 7,863-7,866 (1 Н, д, J=1,28 Гц), 8,22-8,26 (1 Н, дд, J=8,6 Гц). Пример 15. 3-(N,N-Диметиламиноэтил)-5-хлор-8-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 155-160 С; ИК-спектр (KBr, см-1): 2923, 1332, 1166, 1136, 810,67; масс-спектр (m/z): 375,1 (М+Н)+; 1 Н-ЯМР: 2,46 (3 Н, с), 2,57 (6 Н, с), 3,03 (2 Н, ушир.м), 3,049 (2 Н, ушир.м), 7,46-7,48 (1 Н, ушир.д,J=7,72 Гц), 7,61 (1 Н, с), 7,71-7,73 (1 Н, ушир.м), 7,92-7,94 (2 Н, ушир.м), 8,1-8,12 (1 Н, д, J=8,16 Гц). Пример 16. 3-(N,N-Диметиламиноэтил)-5,8-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 150-152,5 С; ИК-спектр (KBr, см-1): 2976, 1602, 1474, 1336, 1173, 1134, 860, 662, 539; масс-спектр (m/z): 363,3 (М+Н)+; 1H-ЯМР: 2,34 (6 Н, с), 2,66-2,7 (2 Н, м), 2,92-2,96 (2 Н, м), 7,358 (1 Н, м), 7,43-7,45 (1 Н, дд, J=8,52 Гц),7,59-7,62 (1 Н, дд, J=9,6 Гц), 7,64 (1 Н, с), 7,72-7,75 (1 Н, дд, J=9,4 Гц), 8,22-8,26 (дд, 1 Н, J=8,8 Гц). Пример 17. 3-(N,N-Диметиламиноэтил)-5-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 126-129 С; ИК-спектр (KBr, см-1): 2953, 1461, 1333, 1173, 1138, 765, 561; масс-спектр (m/z): 345,3 (М+Н)+; 1H-ЯМР: 2,35 (6 Н, с), 2,67-2,71 (2 Н, м), 2,92-2,96 (2 Н, м), 7,38-7,41 (1 Н, дд, J=8,56 Гц, 2,08 Гц), 7,647,69 (3 Н, м), 7,78-7,8 (1 Н, м), 8,09-8,11 (1 Н, д, J=7,92 Гц), 8,22-8,25 (1 Н, дд, J=7,92 Гц, 1,00 Гц). Пример 18. 3-(N,N-Диметиламиноэтил)-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 154-158 С; ИК-спектр (KBr, см-1): 2933, 1595, 1468, 1318, 1166, 1132, 858; масс-спектр (m/z): 357,1 (М+Н)+; 1 Н-ЯМР: 2,35 (6 Н, с), 2,68-2,72 (2 Н, м), 2,96-3,00 (2 Н, м), 7,1-7,13 (1 Н, м), 7,44-7,48 (1 Н, т), 7,58 (1 Н,с), 7,6-7,606 (1 Н, д, J=2,44 Гц), 7,7-7,72 (1 Н, д, J=7,84 Гц), 7,9-7,92 (1 Н, д, J=7,64 Гц), 8,14-8,16 (д, 1 Н,J=8,92 Гц). Пример 19. 3-(N,N-Диметиламиноэтил)-5-фтор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 186-187,5 С; ИК-спектр (KBr, см-1): 2946, 1597, 1411, 1327, 1168, 1126, 857, 501; масс-спектр (m/z): 375,3 (М+Н)+; 1-6 012750 Пример 20. 3-(N,N-Диметиламиноэтил)-5-фтор-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 152-153,4 С; ИК-спектр (KBr, см-1): 2948, 1333, 1175, 1132, 894, 627; масс-спектр (m/z): 379,1 (М+Н)+; 1 Н-ЯМР: 2,348 (6 Н, с), 2,66-2,7 (2 Н, м), 2,92-2,96 (2 Н, м), 7,42-7,45 (1 Н, дд), 7,616-7,659 (3 Н, м,J=8,48 Гц), 8,05-8,06 (д, 1 Н, J=1,96 Гц), 8,15-8,176 (1 Н, д, J=8,48 Гц). Пример 21. 3-(N,N-Диметиламиноэтил)-5-метил-8-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2921, 1327, 1176, 786, 762; масс-спектр (m/z): 359,4 (М+Н)+; 1H-ЯМР: 2,35 (6 Н, с), 2,68-2,72 (2 Н, м), 2,96-3,00 (2 Н, м), 7,1-7,13 (1 Н, м), 7,44-7,48 (1 Н, т), 7,58 (1 Н,с), 7,60-7,606 (1 Н, д, J=2,44 Гц), 7,7-7,72 (1 Н, д, J=7,84 Гц), 7,9-7,92 (1 Н, д, J=7,64 Гц), 8,14-8,16 (1 Н, д,J=8,92 Гц). Пример 22. 3-(N,N-Диметиламиноэтил)-5-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2919, 1338, 1175, 1127, 786, 763; масс-спектр (m/z): 341,4 (М+Н)+; 1 Н-ЯМР: 2,4 (6 Н, с), 2,6 (3 Н, с), 2,75-2,77 (2 Н, м), 2,99 (2 Н, м), 7,52 (1 Н, с), 7,53 (1 Н, с), 7,59-7,63(1 Н, м), 7,75-7,79 (2 Н, м), 8,16-8,18 (1 Н, д, J=7,88 Гц), 8,21-8,23 (1 Н, дд, J=9,08 Гц). Пример 23. 3-(N,N-Диметиламиноэтил)-5,8-диметил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2918, 1463, 1327, 1174, 1139, 807, 607, 527; масс-спектр (m/z): 355,5 (М+Н)+; 1 Н-ЯМР: 2,4 (6 Н, с), 2,56 (3 Н, с), 2,59 (3 Н, с), 2,73-2,77 (2 Н, м), 2,98-3,02 (2 Н, м), 7,4-7,42 (1 Н, м),7,51-7,52 (2 Н, м), 7,77 (1 Н, с), 7,96 (1 Н, с), 8,09-8,11 (д, 1 Н, J=8,16 Гц). Пример 24. 3-(N,N-Диметиламиноэтил)-5-метил-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2918, 1596, 1323, 1303, 1240, 1169, 811, 533; масс-спектр (m/z): 370,7 (М+Н)+; 1H-ЯМР: 2,41 (6 Н, с), 2,75-2,79 (2 Н, м), 2,98-3,29 (2 Н, м), 3,99 (3 Н, с), 7,09-7,12 (1 Н, дд, J=8,84 Гц,2,44 Гц), 7,51-7,52 (2 Н, м), 7,57-7,58 (1 Н, д, J=2,4 Гц), 7,72 (1 Н, с), 8,12-8,15 (1 Н, д, J=8,8 Гц). Пример 25. 3-(N,N-Диметиламиноэтил)-5,8-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 101-108 С; ИК-спектр (KBr, см-1): 2982, 2769, 1329, 1178, 1150, 851, 791, 619, 529; масс-спектр (m/z): 395, 397, 399 (М+Н)+; 1H-ЯМР: 2,35 (6 Н, с), 2,67-2,71 (2 Н, м), 2,93-2,97 (2 Н, м), 7,61-7,64 (2 Н, м), 7,72-7,727 (2 Н, д, J=1,64 Гц), 7,89-7,90 (1 Н, д, J=1,52 Гц), 8,09-8,10 (1 Н, д, J=1,56 Гц), 8,15-8,17 (1 Н, д, J=8,56 Гц). Пример 26. 3-(N,N-Диметиламиноэтил)-5-фтор-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 207-210 С; ИК-спектр (KBr, см-1): 2918, 1454, 1340, 1175, 1163, 838, 581; масс-спектр (m/z): 413,2, 415,2 (М+Н)+; 1H-ЯМР: 2,35 (6 Н, с), 2,66-2,70 (2 Н, м), 2,92-2,96 (2 Н, м), 7,41-7,44 (1 Н, дд, J=8,4 Гц, 2,12 Гц), 7,597,62 (1 Н, дд, J=9,98 Гц, 2,0 Гц), 7,68 (1 Н, с), 7,83-7,85 (1 Н, д, J=8,78 Гц), 7,97-7,99 (1 Н, д, J=8,78 Гц). Пример 27. 3-N,N-Диметиламиноэтил)-5,9,10-трихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 210,4-214,9 С; ИК-спектр (KBr, см-1): 2946, 1445, 1339, 1163, 838, 594, 568; масс-спектр (m/z): 429,1, 431,1, 432,9 (М+Н)+; Н-ЯМР: 2,35 (6 Н, с), 2,67-2,71 (2 Н, м), 2,93-2,97 (2 Н, м), 7,66 (1 Н, с), 7,70-7,71 (1 Н, д, J=1,48 Гц),7,83-7,86 (2 Н, м), 8,01-8,03 (1 Н, д, J=8,76 Гц). Пример 28. 3-(N,N-Диметиламиноэтил)-5-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 133-136,3 С; ИК-спектр (KBr, см-1): 2962, 1331, 1169, 1124, 826, 766, 749; масс-спектр (m/z): 361, 363 (М+Н)+; 1 Н-ЯМР: 2,35 (6 Н, с), 2,67-2,71 (2 Н, м), 2,93-2,97 (2 Н, м), 7,62-7,69 (3 Н, м), 7,78-7,80 (1 Н, м), 7,927,93 (1 Н, д, J=1,56 Гц), 8,12-8,14 (1 Н, д), 8,22-8,24 (1 Н, дд, J=8,0 Гц, 1,08 Гц). Пример 29. 3-(N,N-Диметиламиноэтил)-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 240 С; ИК-спектр (KBr, см-1): 2940, 1448, 1329, 1165, 793, 600; масс-спектр (m/z): 394,9, 397 (М+Н)+; 1 Н-ЯМР: 2,37 (6 Н, с), 2,71-2,75 (2 Н, м), 3,00-3,03 (2 Н, м), 7,45-7,49 (1 Н, т), 7,74-7,76 (1 Н, д, J=7,72 Гц), 7,81-7,83 (1 Н, д, J=8,76 Гц), 7,89-7,91 (1 Н, д, J=7,76 Гц), 8,08-8,10 (1 Н, д, J=8,72 Гц). Пример 30. 3-(N,N-Диметиламиноэтил)-5-хлор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 176,6-183 С; ИК-спектр (KBr, см-1): 2980, 1596, 1311, 1167, 850, 573, 534; масс-спектр (m/z): 391,1 (М+Н)+; 1 Н-ЯМР: 2,36 (6 Н, с), 2,67-2,71 (2 Н, м), 2,93-2,97 (2 Н, м), 4,0 (3 Н, с), 7,13-7,16 (1 Н, дд, J=8,84 Гц,2,36 Гц), 7,52-7,53 (1 Н, д, J=2,36 Гц), 7,61 (1H, с), 7,68-7,687 (1H, д, J=1,56 Гц), 7,86-7,87 (1H, д,J=1,56 Гц), 8,13-8,16 (1H, д, J=8,84 Гц). Пример 31. 3-(N,N-Диметиламиноэтил)-5-метил-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 86,5-93,5 С; ИК-спектр (KBr, см-1): 2957, 1599, 1458, 1322, 1174; масс-спектр (m/z): 383 (М+Н)+; 1(1 Н, септет), 7,46-7,48 (1 Н, дд, J=8,24 Гц, 1,32 Гц), 7,49 (1 Н, с), 7,53 (1 Н, с), 7,79 (1 Н, с), 7,98-7,99 (1 Н, д,J=1, 61 Гц), 8,12-8,14 (1 Н, д, J=8,28 Гц). Пример 32. 3-(N,N-Диметиламиноэтил)-5-фтор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 117-124 С; ИК-спектр (KBr, см-1): 2917, 1598, 1344, 1178, 1128, 796, 661; масс-спектр (m/z): 387 (М+Н)+; 1H-ЯМР: 1,35-1,37 (6 Н, д), 2,36 (6 Н, с), 2,68-2,72 (2 Н, м), 2,93-2,97 (2 Н, м), 3,1-3,13 (1 Н, септет),7,38-7,4 (1 Н, дд, J=8,56 Гц, 2,1 Гц), 7,51-7,53 (1 Н, дд, J=8,28 Гц, 1,56 Гц), 7,63 (1 Н, с), 7,68-7,71 (1 Н, дд,J=9,9 Гц, 2,08 Гц), 7,914-7,918 (1 Н, д, J=1,48 Гц), 8,14-8,16 (1 Н, д, J=8,28 Гц). Пример 33. 3-(N,N-Диметиламиноэтил)-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 155-160 С; ИК-спектр (KBr, см-1): 2963, 1612, 1331, 1261, 1173, 1111, 855, 797, 512; масс-спектр (m/z): 363,1 (М+Н)+; 1H-ЯМР: 2,41 (6 Н, с), 2,74-2,78 (2 Н, м), 3,02-3,06 (2 Н, м), 7,04-7,1 (1 Н, м), 7,47-7,53 (1 Н, т), 7,62 (1 Н,с), 7,67-7,71 (1 Н, м), 7,8-7,82 (1 Н, д, J=7,76 Гц), 7,87-7,89 (1 Н, д, J=7,72 Гц). Пример 34. 3-(N,N-Диметиламиноэтил)-5,8,10-трифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. Интервал плавления: 140-144 С (разл.); ИК-спектр (KBr, см-1): 2917, 1579, 1462, 1339, 1173, 1094, 857, 799, 529; масс-спектр (m/z): 380,7 (М+Н)+; Н-ЯМР: 2,38 (6 Н, с), 2,7-2,74 (2 Н, м), 2,95-2,99 (2 Н, м), 7,08-7,14 (1 Н, м), 7,47-7,5 (1 Н, дд, J=8,4 Гц,2,04 Гц), 7,58-7,61 (2 Н, дд, J=9,84 Гц), 7,67 (1 Н, с). Пример 35. 3-(N,N-Диметиламиноэтил)-5-метил-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2936, 1460, 1333, 1175, 1132, 816, 609, 594; масс-спектр (m/z): 409, 411 (М+Н)+; 1 Н-ЯМР: 2,37 (6 Н, с), 2,70-2,74 (2 Н, м), 2,96-3,00 (2 Н, м), 7,53 (1 Н, с), 7,58 (1 Н, с), 7,70 (1 Н, с), 7,797,81 (1 Н, д, J=8,8 Гц), 8,06-8,08 (1 Н, д, J=8,82 Гц). Пример 36. 3-(N,N-Диметиламиноэтил)-5-хлор-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2917, 1339, 1172, 1123, 757; масс-спектр (m/z): 397,1, 399 (М+Н)+; 1H-ЯМР: 2,42 (6 Н, с), 2,74-2,78 (2 Н, м), 2,99-3,03 (2 Н, м), 7,08-7,14 (1 Н, м), 7,63-7,66 (2 Н, м), 7,787,784 (1 Н, д, J=1,32 Гц), 7,85-7,854 (1 Н, д, J=1,32 Гц). Пример 37. 3-(N,N-Диметиламиноэтил)-5-метил-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2918, 2762, 1330, 1177, 1096, 790; масс-спектр (m/z): 375, 376,9 (М+Н)+; 1 Н-ЯМР: 2,37 (6 Н, с), 2,60 (3 Н, с), 2,69-2,73 (2 Н, м), 2,96-3,00 (2 Н, м), 7,53-7,58 (3 Н, м), 7,74 (1 Н, с),8,12-8,15 (2 Н, м). Пример 38. 3-(N,N-Диметиламиноэтил)-5-хлор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2963, 1457, 1406, 1336, 1178, 1126, 827; масс-спектр (m/z): 403,2, 405,2 (М+Н)+; 1 Н-ЯМР: 1,382-1,399 (6 Н, д, J=6,8 Гц), 2,37 (6 Н, с), 2,65-2,73 (2 Н, м), 2,94-2,98 (2 Н, м), 3,12-3,15 (1 Н,септет), 7,53-7,56 (1 Н, дд, J=8,28 Гц), 7,63 (1 Н, с), 7,694-7,699 (1 Н, д, J=1,68 Гц), 7,96-7,967 (2 Н, м), 8,158,17 (1 Н, д, J=8,24 Гц). Пример 39. 3-(N,N-Диметиламиноэтил)-5-метил-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2918, 2849, 1619, 1332, 1170, 853, 802; масс-спектр (m/z): 377,1 (М+Н)+; 1(4 Н, м). Пример 40. 3-(N,N-Диметиламиноэтил)-7-трифторметил-10-хлор-1,2-бензотиазино[2,3,4-ab]индолS,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2917, 1348, 1297, 1170, 1142, 753; масс-спектр (m/z): 429,1, 431 (М+Н)+; 1 Н-ЯМР: 2,37 (6 Н, с), 2,72-2,76 (2 Н, м), 2,99-3,04 (2 Н, м), 7,48-7,58 (2 Н, м), 7,72-7,82 (2 Н, м), 8,208,60 (2 Н, м). Пример 41. 3-(N,N-Диметиламиноэтил)-5-фтор-7-трифторметил-10-хлор-1,2-бензотиазино[2,3,4ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2943, 1435, 1349, 1298, 1170, 868; масс-спектр (m/z): 447,2, 449,2 (М+Н)+; 1-9 012750 Пример 42. 3-(N,N-Диметиламиноэтил)-5,10-дихлор-7-трифторметил-1,2-бензотиазино[2,3,4ab]индол-S,S-диоксид. Используя, по существу, такую же процедуру, как описано в примере 1, приготовили указанное выше производное. ИК-спектр (KBr, см-1): 2926, 1356, 1297, 1173, 1130, 795; масс-спектр (m/z): 463, 465 (М+Н)+; 1H-ЯМР: 2,45 (6 Н, с), 2,79-2,83 (2 Н, м), 3,03-3,10 (2 Н, м), 7,538-7,549 (1 Н, с), 7,76-7,78 (1 Н, Д, J=8,64 Гц), 7,80-7,804 (1 Н, д, J=1,4 Гц), 8,03 (1 Н, ушир.с), 8,05-8,07 (1 Н, д, J=8,60 Гц). Список литературы 1. Moritani, I., Fujiwara, Y.; Tetrahedron Lett.; 1967, 1119-1122. 2. Fujiwara, Y., Moritani, I., Mastuda, M.; Tetrahedron; 1968, 24, 4819-4824. 3. Heck, R.F.; J. Am. Chem. Soc.; 1968, 90, 5518-5526. 4. Heck, R.F.; J. Am. Chem. Soc.; 1969, 91, 6707-6714. 5. Braese, S., Gil, C., Knepper, K.; Bioorg. Med. Chem.; 2002, 10: 8, 2415-2438. 6. Amos, P.C., Whiting, D.A.; J. Chem. Soc. Chem. Commun.; 1987, 510-511. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения замещенных бензотиазиноиндолов общей формулы (I) где R1, R2 и R4 могут быть одинаковыми или различными и, каждый независимо, представляют водород, хлор, фтор, амино, нитро, циано, CHO, (C1-С 3)алкил, пергалоген(C1-С 3)алкил, (C1-С 3)алкокси,арил, аралкил, аралкокси, (С 5-С 7)гетероциклил, (С 5-С 7)гетероциклилалкил, (С 5-С 7)гетероциклилокси,ацил, ацетил, алкиламино, аминоалкил, амид, гидроксиалкил, группу карбоновой кислоты и ее производных;R3 представляет водород, (C1-С 3)алкил, арил и группу карбоновой кислоты и ее производных,включающий циклизацию соединений общей формулы II (т.е. замещенного 1-бензолсульфонил-7 бром-1 Н-индола) где R1, R2, R3 и R4 определены выше в присутствии подходящего палладиевого (0) или (II) каталитического комплекса, в присутствии подходящего основания и растворителя при температуре в интервале 0-200 С катализатора с получением соединения формулы (I), где R1, R2, R3 и R4 определены выше; причем основание выбирают из ацетата калия или триэтилацетата и подходящий растворитель выбирают из диметилформамида, диметилсульфоксида или диметилацетамида. 2. Способ по п.1, в котором указанное соединение формулы I выбрано из 8-метил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-фтор-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-изопропил-3-(4-метилпиперазин-1-илметил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксид-3-карбоксальдегида; 3-ацетил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-изопропил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-хлор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 8-фтор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида;- 10012750 5-фтор-8-метил-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 5-хлор-8-фтор-3-(N,N-диметиламиноэтил)-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-хлор-8-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5,8-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-8-фтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5,8-диметил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5,8-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5,9,10-трихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-хлор-8-метокси-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5,8,10-трифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-9,10-дихлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-хлор-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-8-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-хлор-8-изопропил-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-метил-8,10-дифтор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-7-трифторметил-10-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,S-диоксида; 3-(N,N-диметиламиноэтил)-5-фтор-7-трифтометил-10-хлор-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксида; 3-(N,N-диметиламиноэтил)-5,10-дихлор-7-трифторметил-1,2-бензотиазино[2,3,4-ab]индол-S,Sдиоксида. 3. Способ по п.1, в котором используемый катализатор представляет собой систему комплексного палладиевого (0) или (II) катализатора. 4. Способ по п.1, в котором подходящая система комплексного палладиевого (0) или (II) катализатора выбрана из одного или более: Pd(OAc)2, PdCl2, Pd (0)(PPh3)4, Pd(0)(P(o-CH3)Ph3)4, PdCl2(PPh3)2,Pd2(dba)3-CHC13, (3-аллил-PdCl)2 или Pd-на-угле без фосфиновых лигандов. 5. Способ по любому из указанных пунктов, где подходящие лиганды, используемые с палладиевым катализатором, выбраны из одного или более фосфинов, фосфитов, гетероциклических карбеновых лигандов или Li и более предпочтительно фосфинов. 6. Способ по любому из пп.3-5, в котором соотношение предпочтительного палладиевого катализатора и фосфинового катализатора может быть в интервале от 2 до 4, как, например, в PdCl2(PPh3)2 иPd(0)(PPh3)4. 7. Способ по любому из предыдущих пунктов, в котором молярное соотношение используемого палладиевого катализатора находится в интервале от 0,01 до 0,10 мольного эквивалента (от 1 до 10 мол.%) в расчете на соединение формулы (II). 8. Способ по п.7, в котором молярное соотношение используемого в реакции палладиевого катализатора предпочтительно находится в интервале от 0,03 до 0,05 мольного эквивалента (от 3 до 5 мол.%) в расчете на соединение формулы (II). 9. Способ по любому из предыдущих пунктов, в котором подходящее основание представляет собой или CH3COOK, или TEA. 10. Способ по п.9, в котором молярное соотношение используемого в реакции основания составляет примерно 0-5 мольных эквивалентов в расчете на соединение формулы (II). 11. Способ по п.9 или 10, в котором подходящее основание или растворено, или суспендировано в полярном апротонном растворителе, таком как диметилформамид, диметилсульфоксид, диметилацетамид. 12. Способ по любому из предыдущих пунктов, в котором используемый растворитель представляет собой диметилацетамид в соотношении 5-20 об./об. 13. Способ по п.1, в котором используемый в реакции растворитель представляет собой диметилформамид в соотношении 5-20 об./об. 14. Способ по п.1, в котором указанная циклизация проводится в температурном диапазоне от 0 до- 11012750 200 С в зависимости от растворителя. 15. Способ по п.14, в котором указанный температурный диапазон составляет от 90 до 180 С. 16. Способ по п.1, в котором указанная циклизация проводится в инертной атмосфере/дегазированных условиях с использованием инертных газов, таких как N2, Ar или Не.
МПК / Метки
МПК: C07D 513/06
Метки: замещенных, получения, способ, бензотиазиноиндолов
Код ссылки
<a href="https://eas.patents.su/13-12750-sposob-polucheniya-zameshhennyh-benzotiazinoindolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения замещенных бензотиазиноиндолов</a>

















